T.C.
SELÇUK ÜNĐVERSĐTESĐ SAĞLIK BĐLĐMLERĐ ENSTĐTÜSÜ
APROTĐNĐNĐN VE KADEMELĐ CO
2BASINÇ KOMBĐNE
UYGULAMASININ PNÖMOPERĐTONYUM SONRASI OLUŞAN
DOKU ĐSKEMĐ-REPERFÜZYON HASARINDA ÇEŞĐTLĐ
DOKULARA OLAN ETKĐLERĐ
Mehmet ÇINAR
YÜKSEK LĐSANS TEZĐ
BĐYOKĐMYA ANABĐLĐM DALI
Danışman
Prof. Dr. Sadık BÜYÜKBAŞ
T.C.
SELÇUK ÜNĐVERSĐTESĐ SAĞLIK BĐLĐMLERĐ ENSTĐTÜSÜ
APROTĐNĐNĐN VE KADEMELĐ CO
2BASINÇ KOMBĐNE
UYGULAMASININ PNÖMOPERĐTONYUM SONRASI OLUŞAN
DOKU ĐSKEMĐ-REPERFÜZYON HASARINDA ÇEŞĐTLĐ
DOKULARA OLAN ETKĐLERĐ
Mehmet ÇINAR
YÜKSEK LĐSANS TEZĐ
BĐYOKĐMYA ANABĐLĐM DALI
Danışman
Prof. Dr. Sadık BÜYÜKBAŞ
Bu araştırma Selçuk Üniversitesi Bilimsel Araştırma Projeleri Koordinatörlüğü tarafından 08202019 proje numarası ile desteklenmiştir.
i. ÖNSÖZ
Tezin hazırlanması esnasındaki yardım ve desteklerinden dolayı başta Anabilim Dalı Başkanımız Prof. Dr. Đdris MEHMETOĞLU’na, tez danışmanım Prof. Dr. Sadık BÜYÜKBAŞ’a, Yrd. Doç. Dr. Dursun Ali ŞAHĐN’e ayrıca tüm deneysel ve yazım çalışmalarında yardımını esirgemeyen Yrd. Doç. Dr. Kemal BAŞARALI’ya ve tüm biyokimya öğretim görevlisi ve çalışanlarına teşekkür ederim.
ii. ĐÇĐNDEKĐLER
i. ÖNSÖZ………...………..…….. i
ii. ĐÇĐNDEKĐLER………....ii
iii. ÇĐZELGE LĐSTESĐ………...………iv
iv. ŞEKĐLLER LĐSTESĐ………...……...……….…………...vi
vi. KISALTMALAR………...……….…………...vii
1. GĐRĐŞ………...1
2. GENEL BĐLGĐLER...………...……….3
2.1. Đskemi……….………...3
2.1.1. Đskemik Hipoksik Zedelenme………...3
2.1.2. Geri Dönüşlü (Reversible) Zedelenme………...………...3
2.1.3. Geri Dönüşsüz (Đrreversible) Zedelenme………...……….4
2.2. Reperfüzyon………...……….………6
2.3. Serbest Oksijen Radikallerinin Kimyası……….………..……….7
2.3.1. Serbest Radikaller ve Oluşum Mekanizmaları……….………...9
2.3.2. Serbest Radikallerin Kaynakları………...……...11
2.4. Malondialdehit (MDA) ……….…...………11
2.5. Nitrik Oksit (NO)……….……….………...12
2.6. Ksantin Oksidaz ( XO)………...……….……….13
2.7. Adenozin Deaminaz ( ADA)……….………...14
2.8. Antioksidanlar………...……….………..15
2.9. Süperoksit Dismutaz (SOD)……….………16
2.10. Ürik Asit (UA)………..………..17
2.11. Aprotinin……….………. …..18
2.12. Sitokinler……….………...19
2.13. Tümör nekroz faktör alfa (TNF-α)………..…………...20
3. GEREÇ VE YÖNTEM……….……….22
3.1. Gereç….………...22
3.1.1. Vakaların Oluşturulması ve Gruplama……….………..22
3.1.2. Numunelerin Alınması ve Doku Analizi Ön Đşlemleri………...23
3.1.3. Kullanılan Cihazlar………...23
3.1.4. Kullanılan Reaktif ve Çözeltiler……….……….…………...24
3.2. Yöntem.………...………...26
3.2.1. Dokuların Homojenizasyonu………....………..25
3.2.2. Protein Ölçümü………...27
3.2.3. Malondialdehit ( MDA) Ölçümü………27
3.2.4. Ksantin Oksidaz (XO) Ölçümü.………..…………...28
3.2.5. Speroksit Dismutaz (SOD) Ölçümü……….………..28
3.2.6. Antioksidan Aktivite (AOA) Ölçümü………...……….29
3.2.7. Nitrik Oksit (NO) Ölçümü……….……...30
3.2.8. Adenozin Deaminaz ( ADA) enziminin aktivite tayini….…….………31
3.2.9. Ürik Asit (UA) Analizi...……….………...32
3.2.10. Tümör Nekroz Faktör Alfa (TNF-α) Analizi...………...………….33
3.2.11. Đnterlökin 6 (IL-6) Analizi……….………...33
4. BULGULAR………...………...34 5. TARTIŞMA ve SONUÇ………..………...40 6. ÖZET………...………...46 7. SUMMARY………..………...47 8. KAYNAKLAR………...………...48 9. EKLER……....………..………..54
EK-A: Selçuk Üniversitesi Deneysel Tıp Araştırma ve Uygulama Merkezi Etik Kurul Kararı Onayı………...54
iii. ÇĐZELGE LĐSTESĐ
Çizelge 2.1. Serbest oksijen radikalleri………...8
Çizelge 2.2. Serbest radikallerin kaynakları……….………11
Çizelge 2.3. Antioksidan avunma sistemleri………..………..15
Çizelge 3.1. NO çalışma çizelgesi………..………..31
Çizelge 3.2. ADA ölçümünde işlem basamakları-I………...…………...31
Çizelge 3.2. ADA ölçümünde işlem basamakları-I (devamı)………..31
Çizelge 3.3. ADA ölçümünde işlem basamakları-II………...32
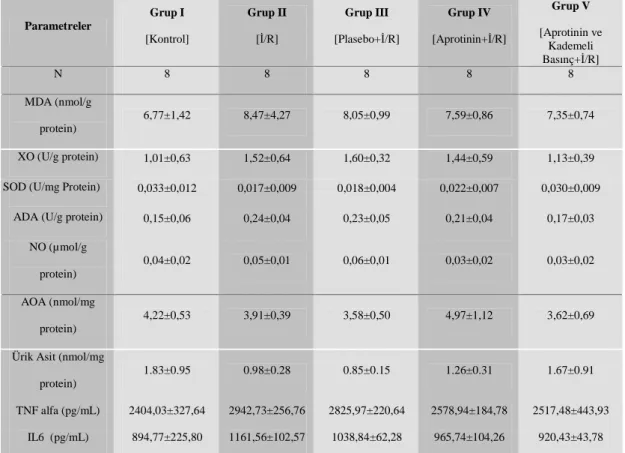
Çizelge 4.1. I. Grup (Kontrol), II. Grup (Đ/R), III. Grup (Plasebo+Đ/R), IV. Grup (Aprotinin+Đ/R) ve V. Grup (Aprotinin ve Kademeli Basınç+Đ/R) Ortalama±SD değerleri………...35
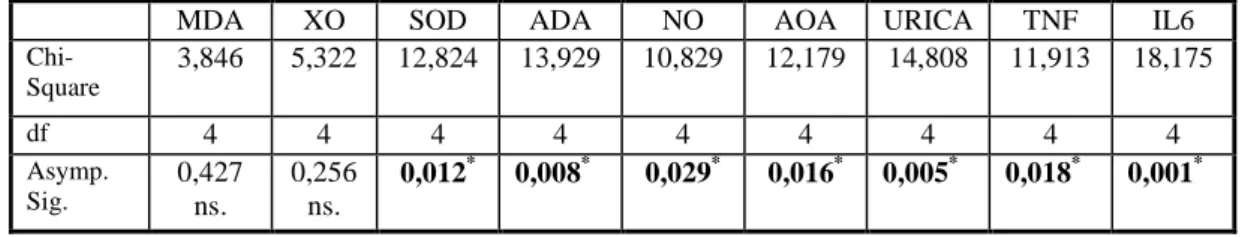
Çizelge 4.2. I. (Kontrol), II. (Đ/R), III. (Plasebo+Đ/R), IV. (Aprotinin+Đ/R) ve V. (Aprotinin ve Kademeli Basınç+Đ/R) grupların Đstatistiksel Karşılaştırılması (Kruskal-Wallis Test Sonuçları)……….36
Çizelge 4.3.1. I. (Kontrol) ve II. (Đ/R) grupların Mann-Whitney Testi Değerlendirilmesi………..……….36
Çizelge 4.3.2. I. (Kontrol) ve III. (Plasebo+Đ/R) grubun Mann-Whitney Testi Değerlendirilmesi………..………..36
Çizelge 4.3.3. I. (Kontrol) ve IV. (Aprotinin+Đ/R) grubun Mann-Whitney Testi Değerlendirilmesi………..………….36
Çizelge 4.3.4. I. (Kontrol) ve V. (Aprotinin ve Kademeli Basınç+Đ/R) grubun Mann-Whitney Testi Değerlendirilmesi………...……....37
Çizelge 4.3.5. II. (Đ/R) ve III. (Plasebo+Đ/R) grubun Mann-Whitney Testi Değerlendirilmesi……….……...37
Çizelge 4.3.6. II. (Đ/R) ve IV. (Aprotinin+Đ/R) grubun Mann-Whitney Testi Değerlendirilmesi……….37
Çizelge 4.3.7. II. (Đ/R) ve V. (Aprotinin ve Kademeli Basınç+Đ/R) grubun Mann-Whitney Testi Değerlendirilmesi………...………..37
Çizelge 4.3.8. III. (Plasebo+Đ/R) ve IV. (Aprotinin+Đ/R) grubun Mann-Whitney Testi
Değerlendirilmesi………..………..38
Çizelge 4.3.9. III. (Plasebo+Đ/R) ve V. (Aprotinin ve Kademeli Basınç+Đ/R) grubun
Mann-Whitney Testi Değerlendirilmesi………..38
Çizelge 4.3.10. IV. (Aprotinin+Đ/R) ve V. (Aprotinin ve Kademeli Basınç+Đ/R) grubun
Mann-Whitney Testi Değerlendirilmesi………..38
Çizelge 4.4. I. Grup (Kontrol), II. Grup (Đ/R), III. Grup (Plasebo+Đ/R), IV. Grup
(Aprotinin+Đ/R) ve V. Grup (Aprotinin ve Kademeli Basınç+Đ/R) Kruskal-Wallis ve Mann-Whitney Đstatistik Testleri Özet Sonuçları………39
Çizelge 4.4. I. Grup (Kontrol), II. Grup (Đ/R), III. Grup (Plasebo+Đ/R), IV. Grup
(Aprotinin+Đ/R) ve V. Grup (Aprotinin ve Kademeli Basınç+Đ/R) Kruskal-Wallis ve Mann-Whitney Đstatistik Testleri Özet Sonuçları (Devamı!)………..………39
iv. ŞEKĐLLER LĐSTESĐ
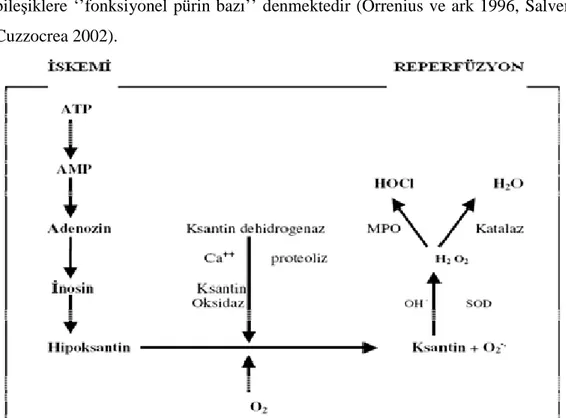
Şekil 2.1. Đskemi-Reperfüzyon sürecinde serbest radikallerinin oluşumu…...…...….7
Şekil 2.2. Adenozin deaminazın etki mekanizması………..…14
v. KISALTMALAR
ADA : Adenozin deaminaz SOD: Süperoksit dismutaz AMP : Adenozin monofosfat SOR : Serbest oksijen radikali AOA : Antioksidan aktivite TAS: Total antioksidant status ATP : Adenozin trifosfat TBARS : Tiyobarbitürik asit CABG : Koroner arter bypas cerrahisi TNF-α: Tümör nekroz faktör alfa CPB : Kardiopulmener bypass TAOx : Total antioksidant CCl4 : Karbon tetraklorür UA: Ürik Asit
CCl3 : Karbon triklorür VCAM : Vasküler hücre adezyon DNA : Deoksiribonükleik asit molekülü
Fe3+ : Ferrik demir XO: Ksantin oksidaz Fe2+ : Ferröz demir PMN : Polimorfonükleer GSSH : Okside glutatyon PUFA : Poliansatüre yağ asidi GSH : Đndirgenmis glutatyon RO· : Alkoksil radikali
H2O2 : Hidrojen peroksit radikali ROO · : Peroksil radikali
HOCl : Hipoklorik asit OONO- : Peroksinitrit radikali IAP : Đntraabdominal basınç
I/R : Đskemi/reperfüzyon IL-6: Đnterlökin 6 Ig : Đmmünglobulin KAT : Katalaz LDL : Düsük dansiteli lipoprotein LH : Yağ asidi
LOOH : Lipid peroksid radikali MDA : Malondialdehit
1
O2 : Singlet oksijen
NAD+ : Nikotinamid adenin dinükleotid
NADPH : Nikotinamid adenin dinükleotid fosfat hidrojen NO· : Nitrik oksit radikali
O2-· : Süperoksit anyonu radikali
1. GĐRĐŞ
Günümüzde hastaların yatış sürelerini kısaltmak ve süratle kişileri mobilize edebilmek gibi önemli nedenlerden dolayı günümüzde laporoskopik cerrahi uygulamalar giderek yaygınlaşmış ve açık cerrahi uygulamaların alternatifi olmuşlardır. Bu laporoskopik cerrahi uygulamalarda, operasyona uygun bir görüş alanı sağlamak amacıyla intraabdominal karbondioksit (CO2) insuflasyonu yaygın olarak kullanılagelmektedir (Polat ve ark 2003).
Đnsuflasyonun neden olduğu intraabdrominal basınç artışı; karın boşluğunda splanknik damarlarda basınca bağlı vasokonstriksiyon oluşturmaktadır. Vasokonstriksiyon nedeniyle inferior kaval, renal ve portal venöz kan akım hızlarında azalma olmakta (Baxter 1995) ve intraabdominal basınç artışı aynı zamanda intraabdominal arteriyel kan akımında da azalmaya neden olabilmektedir (Krahenbuhl ve Scafer 2001).
Đntraabdominal basınç artışından etkilenen splanknik doku ve organlar özellikle ince barsak, karaciğer ve böbrektir. Overler ise ikinci derecede etkilenebilmektedir. Splanknik iskeminin dokulara önemli olası etkilerinden birisi de oksidatif stres (reaktif oksijen ve nitrojen ürünleri) olarak yansımakta olup literatürde bu oksidatif stres değişik açılardan ele alınmaktadır.
Đskemi-reperfüzyon hasarı, iskemi ve onu izleyen reperfüzyon periyodu sonucunda oluşur. Đskemi, dokunun oksijen ve diğer metabolitlere olan gereksiniminin dolaşım tarafından sağlanamaması ve oluşan atık ürünlerin yine dolaşım tarafından uzaklaştırılamaması olarak tanımlanır. Đskemiye bağlı doku hasarında hücre enerji depolarının boşalması ve toksik metabolitlerin birikmesi hücre ölümüne sebep olmaktadır. Đskemik dokuda geri dönüşsüz hücre hasarını önlemek yani hem hücrenin rejenerasyonu, hemde toksik metabolitlerin temizlenmesi için, yeniden kan akımı gerekir. Ancak reperfüzyonun gerçekleştirilmesi, hücre içine moleküler oksijen sunulması ile birlikte reaktif radikal oksijen molekülleri hızla ortaya çıkmakta ve iskemik dokuda iskeminin oluşturduğu hasardan daha fazla bir hasara sebep olmaktadır (Granner ve Parks 1986).
Bu nedenle, rat iskemi-reperfüzyon sonrası böbrek ve plazmada antioksidan enzim, malondialdehit (MDA), ksantin oksidaz (XO), superoksit dismutaz (SOD), adenozin deaminaz (ADA), nitrik oksit (NO), antioksidan aktivite (AOA), ürik asit (ÜA), tümör nekroz faktör alfa (TNFα) ve interlökin 6 (IL6) düzeyleri ve bazı biyokimyasal parametreler ölçüldü.
Bu çalışmada Aprotinin ve kademeli basınç uygulamasının, pnömoperiton ile oluşan iskemi-reperfüzyon hasarını azaltıcı etkileri olup olmadığını araştırmak amacıyla bazı oksidan-antioksidan parametreler ve proinflamatuar sitokinlerin kan ve bazı doku düzeylerinin ölçümü gerçekleştirilmiştir. Selçuk Üniversitesi Bilimsel Araştırma Projeleri Koordinatörlüğü tarafından 08202019 proje numarası ile desteklenen çalışmada destek kapsamında temin edilen malzemeler ile kan ve böbrek dokusunda; malondialdehit (MDA), ksantin oksidaz (XO), superoksit dismutaz (SOD), adenozin deaminaz (ADA), nitrik oksit (NO), antioksidan aktivite (AOA), ürik asit (ÜA), tümör nekroz faktör alfa (TNFα) ve interlökin 6 (IL6) parametrelerinin analizleri gerçekleştirilmiştir.
2. GENEL BĐLGĐLER 2.1. Đskemi
Đskemi; dokunun oksijen (O2) ve diğer metabolitlere olan gereksiniminin dolaşım tarafından sağlanamaması ve bu süreçte oluşan atık ürünlerin yine dolaşım tarafından uzaklaştırılamaması olarak tanımlanır. Đskemi, kardiyak infarktüsde ve inmede olduğu gibi kronik olabilir. Đskemik hasarın derecesi hipoksinin derinliğine ve şiddetine bağlıdır. Sonuçta iskemiye bağlı doku hasarında hücresel enerji depolarının boşalması ve toksik metabolitlerin birikmesi hücre ölümüne yol açmaktadır (Donna ve ark 2000, Anaya ve ark 2002).
2.1.1. Đskemik Hipoksik Zedelenme
Đskemi, dokulara oksijen ve metabolik substrat temininde yeterli kan akımının olmayışı ile karakterizedir. Sonuçta oluşan hipoksi, aerobik oksidatif solunumu etkileyen, son derece önemli ve genel bir hücre zedelenme ve ölüm nedenidir (Kumar ve ark 1992).
Hipoksi sonucunda hücre, enerji kaynağı olan ATP üretimi için anaerobik glikoliz yolunu kullanır. Aerobik glikoliz ile elde edilen ATP' nin ancak % 7’si temin edilebilir.
Đskemide oluşan hücre hasarının potansiyel mekanizması; hücresel enerji depolarının tüketilmesi, hücre iskeleti ve hücre adezyon moleküllerinin ayrılması, plazma ve mikrozomal membran pompalarının fonksiyonlarının azalması (hücre elektrolit içeriğinde değişiklikler, hücre şişmesi, sitoplazmik serbest Ca+2 artışı, intrasellüler asidoz), enzim aktivasyonu (fosfolipaz, proteaz) ve reperfüzyon hasarı (dış medullanın persistan hipoksisi, reaktif oksijen türleri, intrasellüler asidoz, lökositlerin sebep olduğu hasar) olarak özetlenebilir.
2.1.2. Geri Dönüşlü (Reversible) Zedelenme
Hipoksi ilk olarak, mitokondrideki oksidatif fosforilasyonu engeller. ATP'nin azalması hücre zarında aktif sodyum pompasının yetersizliğine yol açarak hücre içi sodyum birikimi ve hücreden potasyumun dışarı atılmasına neden olur. Buna su birikimi eşlik ederek akut hücresel şişme meydana gelir. Hücre enerji kaynağı olan ATP üretimi
için anaerobik glikoliz yolunu kullanır. Aerobik glikoliz ile elde edilen ATP'nin ancak % 7’si temin edilir ve oluşan laktik asit ve diğer inorganik fosfatlar intrasellüler pH'yı düşürür. Ribozomlar, endoplazmik retikulumdan ayrılır. Zar geçirgenliği artar, mitokondri fonksiyonları azalır (Kumar ve ark 1992, Svenson ve Crawford 1997). Bütün bu olayların tümü oksijen verilince geri dönüşlüdür.
2.1.3. Geri Dönüşsüz (Đrreversible) Zedelenme
Burada yapısal olarak mitokondriyumda aşırı vakuolizasyon, plazma zarında aşırı zedelenme, lizozomlarda şişme meydana gelir. Đskemik alan yeniden beslenirse hücre içine yoğun kalsiyum girişi oluşur. Kalsiyum mitokondri matriksinde birikir. Asidoz normal enzim kinetiklerinin değişimine ve lizozomal membran hasarına yol açar (Hoshino ve ark 1988).
Lizozomal enzimler sitoplazmaya geçerek asit hidrolazların aktifleşmesiyle sitoplazma ve çekirdek yapılarını sindirir. Geri dönüşsüzlüğü karakterize eden iki olay vardır. Birinci olay; perfüzyon ve reoksijenizasyona rağmen mitokondri bozukluğunun düzeltilemeyişi iken ikincisi membran fonksiyonlarının çok ciddi bozukluğudur.
Đskemideki hasar birçok sebepten dolayı dramatik olarak artırılır. Bu sebeblerden bazıları serbest oksijen radikalleri, demir depolarının boşalması ve mikrovasküler hasar gibi etkenler neden olabilir. Geri dönüşsüz hücre zedelenmesinde hücre membran zedelenmesinin temel etken olduğuna dair yaygın görüş vardır. Burada dört ana mekanizma ileri sürülmüştür (Hoshino ve ark 1988).
1. Membran fosfolipitlerinin artan kaybı: Đskemide sitoplazmik kalsiyum konsantrasyonun uyarılmasıyla endojen fosfolipazların aktivasyonu sonucu fosfolipitlerin parçalanması artar. Fosfolipitlerin sürekli kaybı ATP bağımlı fosfolipitlerin yeniden yapımı veya dönüşümünün olmaması ile sonuçlanır.
2. Hücre iskelet anomalileri: Đskemide hücre iskeletinden hücre membranının ayrılması hücre şişmesinde de görülür ve gerilme ile rüptüre karşı membran duyarlılığını artırır. Hücre iskelet proteinlerinin parçalanması hücre içi proteazlarının sitoplazmik kalsiyum artışı ile aktivasyonuna bağlıdır.
3. Toksik oksijen radikalleri: Đskemik dokuda artan oksijen radikalleri kan akımı düzeldikten sonra reperfüzyon zedelenmesine neden olur. Toksik oksijen türevlerinin büyük ölçüde reperfüzyon sonrasında iskemi alanına infiltre olan polimorfonükleer lökositler tarafından yapıldığı düşünülmektedir. Reperfüzyon oluşmaz ise sonuçta; öldürücü iskemik zedelenme gelişir, fakat toksik oksijen türevleri oluşmaz (Mc Card ve Fridarich 1978).
4. Lipid yıkım ürünleri: Fosfolipid parçalanması sonucu iskemik hücrelerde biriken bu katabolik ürünler membranlar üzerinde deterjan etkisi yapar. Membran hasarının mekanizmaları ne olursa olsun sonuç Ca2+’un bol miktarda hücre içine girmesidir. Hücre içi Ca2+’un artması hücreye potansiyel zararlı etkilere sahip çok sayıda enzimi aktif hale getirir. Ca2+’un aktive ettiği enzimler fosfolipazlar (membran hasarına yol açar), proteazlar (membran ve sitoiskeletal proteinleri parçalar), ATP’azlar (ATP tüketilmesini hızlandırırlar) ve endonükleazlardır (kromatin parçalanması yapar) (Paschen 2000).
Hücrenin zedelenme mekanizmalarında 4 ana sistem etkilenir:
1- Hücre membran bütünlüğü, hücre ve organellerinin iyonik ve osmotik dengesi 2- Aerobik solunum, mitokondrial oksidatif fosforilasyon ve ATP oluşumu 3- Protein sentezi
4- Hücrenin genetik aparatı
Hücresel fonksiyonlar hücre ölümünden önce kaybolur. Hücre hasarının morfolojik değişiklikleri hücrede bazı kritik biyokimyasal sistemlerin bozulmasından sonra görünür hale gelir. Öldürücü hasarın morfolojik bulguları, geri dönüşümlü hasarın gelişmesinden daha çok zaman alır. Hücre şişmesi geri dönüşümlü bir hasardır ve dakikalar içinde görülebilir. Hücre ölümünün ışık mikroskobu bulguları miyokardda total iskemiden 10-12 saat sonrasına kadar görülmez, geri dönüşümsüz hasar ise 20-60 dakika içinde oluşabilmektedir. Đrreverzible zedelenme morfololojik olarak hücrelerde
şiddetli şişme, plazma membranında aşırı hasar ve lizozomda şişme ile karakterlidir. Mitokondrial matriksde büyük, kümelenmiş amorf dansiteler gelişir. Membranlardan protein, enzim, koenzim ve ribonükleik asitlerin kaybı vardır. ATP’nin oluşumu için gerekli metabolitler de sızdırılır, yüksek enerjili fosfatların kaybı oluşur. Bu dönemde
lizozomal membranlarda hasar gözlenir ve lizozomal enzimler sitoplazmaya geçer. Hücresel komponentler enzimatik sindirime uğrar. Ölümden sonra hücre komponentleri ilerleyici olarak parçalanır, diğer hücreler tarafından fagosite edilir veya yağ asitlerine parçalanır. Yağ asitlerinin kalsifikasyonu ile Ca++ sabunlarının oluşumu görülebilir (Orrenius ve ark 2003). Đki olay irreverzible zedelenmenin temelinde yatar; birincisi belirgin ATP azalmasının neden olduğu olayları geri döndürmede yetersizlik, ikincisi membran fonksiyonunda belirgin bozukluk gelişimidir (Anaya-Prado ve Toledo-Pereyra 2002).
2.2. Reperfüzyon
Reperfüzyon, kan akımının ve bununla birlikte O2’nin hipoksik dokuya tekrar geri sağlanmasıdır, yani dolaşımın restorasyonudur. Eğer hücre irreversible şekilde hasara uğramadıysa, bu sayede enerji depoları ve hücresel hemostazis geri kazanılmış olur. Đskemik organa tekrar kan sunumu yapılırken hücrelerin geri dönüşümsüz hasara uğramaları söz konusudur (Charles ve Simon 2001). Reperfüzyon iskeminin tek başına oluşturduğu hasardan çok daha fazla hasar oluşturabilir (Parks ve Granner 1986). Ksantin oksidoredüktaz, hipoksantin gibi pürinlerin iki aşamalı oksidasyonu ile ksantin üzerinden ürata dönüşmesini sağlayan bir enzimdir. Đn vivo olarak bu enzim, dehidrogenaz (D şekli) ve oksidaz (O şekli) olarak iki şekilde bulunabilir. Dehidrogenaz
şekli serbest oksijen radikali oluşumuna neden olmazken, oksidaz şekli elektron kabul edici olarak moleküler oksijeni kullanır ve süperoksit (O2-.) radikalinin ortaya çıkmasına neden olur. Ksantin oksidoredüktaz’ın normal dokularda dehidrogenaz şekli bulunurken iskemi, irreversible proteoliz ve yan grupların reversible oksidasyonu sonucunda oksidaz
şekline dönüşebilir (Mc Cord ve Franklin 1985, Li ve Jackson 2002).
Đskemi ile hücre içindeki ATP ve ADP gibi yüksek enerjili adenin bileşikleri AMP’ye indirgenir. Sonuçta hücre içi AMP konsantrasyonu artar. Artmış bulunan AMP’den adenozin ayrılır. Adenozin sırayla inozin ve hipoksantine dönüşür. ATP azalması nedeniyle membranların iyon gradiyentini koruyamaması nedeniyle hücre içine Ca++ girişi olur (Ichimiya ve ark 1998). Hücre içine giren Ca++, proteazları aktive ederek ksantin dehidrogenazdan ksantin oksidaz oluşmasını sağlar. Ksantin oksidaz
aracılığı ile de hipoksantinden ksantin, bundan da geri dönüşümsüz olarak ürik asit oluşur.
Reperfüzyon sırasında dokuya gelen bol miktarda O2 molekülünden, bu reaksiyonlar sırasında serbest oksijen radikalleri (SOR) süperoksit ve hidrojen peroksit (O2-., H2O2) oluşur. Bununla birlikte hipoksantin yıkılmaya başlamadan önce, yeterli oksijen akımı sağlanırsa, hipoksantin ve diğer bileşiklerden tekrar ATP oluşur. Bu bileşiklere ‘’fonksiyonel pürin bazı’’ denmektedir (Orrenius ve ark 1996, Salvemini ve Cuzzocrea 2002).
Şekil 2.1. Đskemi-Reperfüzyon sürecinde serbest radikallerinin oluşumu (Orrenius ve ark 1996, Salvemini ve Cuzzocrea 2002)
2.3. Serbest Oksijen Radikallerinin Kimyası
Oksijen; sekiz atom numaralı, doğada dioksijen (O2) olarak bulunan kararsız bir elementtir ve kararsız durumu enerji düzeylerinde bulunan elektronların yapısına bağlıdır. Oksijen molekülündeki aynı yönde dönen iki elektrona sahip son orbitali önemlidir. Bu orbitallerden herhangi birindeki elektron, bir orbitalden diğerine geçtiğinde veya farklı orbitallerde farklı yönlerde döndüğünde ‘singlet oksijen’ (ı O2) oluşur. Orbitalden birine ters dönüşlü bir elektron veya ikisine ters dönüşlü iki elektron gelirse ‘oksijen radikali’ elde edilir
Çizelge 2.1. Serbest Oksijen Radikalleri
1-Oksijen Merkezli Serbest Radikaller
Moleküler oksijen
Üçlü (triplet) durum 3O2 Tekli (singlet) durum 1O2 Süperoksit Radikali O2-. Hidroksil Radikali OH. Perhidroksi Radikali HO2.
Alkoksi Radikali RO. Peroksi Radikali ROO.
2-Oksijen Merkezli Olmayan Serbest Radikaller
Karbon Merkezli
Lipid Radikalleri L. Alkil Radikalleri R. Sülfür Merkezli
Sülfür Radikalleri R-S. Hidrojen Merkezli Merkezliler
Hidrojen Atomu H. Demir Merkezli
Perferil Radikalleri Fe3+-O2-Fe2+ Azot Merkezli
Nitrik Oksid NO. Nitrojen Dioksid NO2.
3-Radikal Olmayan Reaktifler Türler
Ozon O3 Hidrojen Peroksidler
Hidrojen Peroksid H2O2 Lipid peroksidleri LOOH Hipoklorik asit HOCl
Kloraminler R.RNCl
Oksijenin bir elektron alarak indirgenmesi ve süperoksit radikalinin oluşumu: O2 + e- ---> O2-. ( Süperoksit Radikali).
Oluşan radikal eşlenmemiş tek elektronu nedeniyle çok dengesiz olup hızla ortamdan uzaklaşır. Bu nedenle elektronlarını kolaylıkla başka bir moleküle verebilir (redüksiyon) veya bir elektron alarak, elektron çifti oluşturabilir (oksidasyon). Böylece radikal forma dönüşürler. Atom çekirdeği etrafında dönen elektronlar, birbirine zıt momentte bulunurlar. En dış yörüngede bulunan elektron çiftinin dengesi, yörüngeye eklenen veya yörüngeden ayrılan elektronlar tarafından belirlenir. Yörüngeye bir elektron girmesi veya çıkmasıyla bu denge bozulursa, momenti dengelenmemiş bir elektron atoma aktivasyon kazandırır. En dış yörüngesinde eşlenmemiş bir elektron taşıyan molekül ya da molekül gruplarına ‘radikal’ adı verilir. Molekülün bu özelliği, kimyasal simgesinin sağ üst kösesine konulan nokta ile belirtilir (Halliwell ve Gutteridge 1984, Hochstein ve Atallah 1988, Southorn 1988).
2.3.1. Serbest Radikaller ve Oluşum Mekanizmaları
Serbest radikaller organizmada hem metabolizma sırasında endojen olarak sürekli oluşurlar, hem de radyasyon, ilaçlar ve zararlı kimyasallar gibi etkenlere bağlı olarak ekzojen olarak ortaya çıkabilirler. Aerobik organizmalarda yaşamın sürdürülebilmesi için oksijene mutlak gereksinimi vardır. Solunan oksijenin % 95’inden fazlası mitokondrilerde ATP şeklinde enerji oluşumunda kullanılırken, yaklaşık % 5’i de toksik serbest radikallere dönüşmektedir. Oksijenin bir elektron ile indirgenmesiyle süperoksit radikali (O2-.), iki elektron alarak indirgenmesi ile hidrojen peroksid (H2O2) oluşur. Dördüncü elektron ilavesi ile de su oluşmaktadır. Serbest oksijen radikalleri stabil olmayan moleküllerdir ve organik/inorganik kimyasallarla hızlı reaksiyona girerler. Serbest oksijen radikalleri şu yollarla oluşmaktadır;
1- Radyan enerji absorbsiyonu (ultraviyole, X ışını)
2- Hücrenin normal metabolizması sırasında olaylar süresince gerçekleşen oksidasyon-redüksiyon reaksiyonları ( örneğin: solunum, ksantin oksidaz, fenton reaksiyonu). Özellikle demir ve bakır metabolizması hücre için büyük bir oksidatif hasardır.
3- Dış kaynaklı kimyasal maddelerin ve ilaçların enzimatik metabolizasyonu ( örneğin; karbon tetraklorürün karbon triklorüre dönüşmesi)
Kimyasal hasar iki yolla gerçekleşebilir; I- Doğrudan hücre organel hasarı:
Civa-klorid zehirlenmesinde; civa hücre membranını, diğer hücresel proteinleri (sülfidril grublarına bağlanarak) ve ATP-az bağımlı transportu inhibe eder. Pek çok antineoplastik ilaç da benzer şekilde hücre hasarına neden olmaktadır.
II- Đnaktif metabolit yoluyla hücre hasarı; Kimyasal maddelerin inaktif metabolitlere dönüşümü genellikle düz endoplazmik retikulumda bulunan sitokrom P-450 yardımıyla oluşur. Bu ürünler, serbest radikallerin oluşumu, membran hasarı ve karsinojenik moleküllerin gelişimine neden olabilir. Özellikle karaciğerde eksojen olarak alınan karbon tetraklorür (CCl4)’ün karbon triklorür (CCl3)’e dönüşümü buna iyi bir örnektir (Comporti 1989, Recknagel ve ark 1989).
Karbon tetraklorür yüksek oranda toksik bir serbest radikaldir. Sonuçta otokatalitik membran fosfolipid peroksidasyonuna yol açar. Dakikalar içinde hücrede protein sentezi durur, düz endoplazmik retikulum sişer ve ribozomlar granüllü endoplazmik retikulumdan ayrışır. Protein azaldığından karaciğerde sentezlenen lipidler hücreden atılamaz. Sonuç karaciğerde yağlı değişimdir yani steatoz’dur.
4- Nitrik oksid (NO), önemli bir kimyasal mediyatördür (endotel, makrofaj ve nöronlarda) ve serbest radikale dönüşebilir.
5- Đskemik hasarlı bölgenin reperfüzyonu ve oksijen tedavisi
6- Đnflamasyonda polimorf lökositler ve makrofajlar yolu ile oluşur.
Memelilerde serbest radikaller başlıca anaerobik metabolizma sırasında üretilir (Angel ve ark 1987, White ve Heckler 1990,). Fakat O2 kaynaklı serbest radikallerden farklı olarak karbon ve kükürt bazlı radikaller de oluşabilmektedir. Hücre içinde oksijenin varlığı, toksik oksijen türlerinin uygunsuz oluşumuna neden olabilir. Bunlardan en önemlileri; hidrojen peroksid (H2O2), süperoksit (O2-·) ve hidroksil (OH·) iyonlarıdır. Hücrenin birçok yerinde (örneğin: plazma membranı, mitokondri, sitozol, lizozom ve peroksizom) oksidatif enzim aktivitesi sonucu meydana gelebilirler (Kumar ve ark 2004).
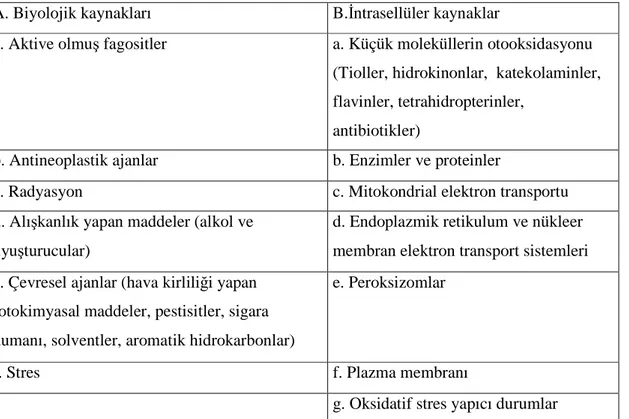
2.3.2. Serbest Radikallerin Kaynakları
Serbest radikallerin endojen ve eksojen kaynakları vardır. Hücresel kaynaklar; mitokondrial elektron transport zincirini, mikrozomal elektron transport zincirini, oksidan enzimleri (ksantin oksidaz, siklo oksijenaz), fagositleri, epinefrinin ve Fe+2' nin hücresel oto-oksidasyonunu kapsar.
Eksojen kaynaklar; oksitleyici ilaçları (karbontetraklorür (CCl4), asetominofen), sigara içmeyi, radyasyonu ve glutatyon oksitleyici maddeleri içerir (Freeman 1984). Normal hücresel metabolizma, serbest radikallerin üretimine öncülük edebilir. Enzimatik kataliz, mitokondrial elektron transport zinciri ve otooksidasyon; serbest radikal ara ürünlerini artırabilir (Hatefi 1985, Voet 1985).
Çizelge 2.2. Serbest radikallerin kaynakları
A. Biyolojik kaynakları B.Đntrasellüler kaynaklar
a. Aktive olmuş fagositler a. Küçük moleküllerin otooksidasyonu (Tioller, hidrokinonlar, katekolaminler, flavinler, tetrahidropterinler,
antibiotikler)
b. Antineoplastik ajanlar b. Enzimler ve proteinler
c. Radyasyon c. Mitokondrial elektron transportu
d. Alışkanlık yapan maddeler (alkol ve uyuşturucular)
d. Endoplazmik retikulum ve nükleer membran elektron transport sistemleri e. Çevresel ajanlar (hava kirliliği yapan
fotokimyasal maddeler, pestisitler, sigara dumanı, solventler, aromatik hidrokarbonlar)
e. Peroksizomlar
f. Stres f. Plazma membranı
g. Oksidatif stres yapıcı durumlar
2.4. Malondialdehit (MDA)
Lipid içeren hücre membranları ve organel membranları, hücre yapısı ve fonksiyonu için kritik bileşenlerdir. Çünkü bu membran yapılar lipid peroksidasyon
hasarına fazlasıyla hassastırlar (Southern ve Garth 1988). Yağ asidinin (LH) oksidasyonu metilen karbonundan hidrojen atomunun çıkarılması ile başlar ve yağ asidi radikali (L.) oluşur. Oluşan lipid karbon radikali bir konjuge dien oluşumuna yönlendirilebilir. Đlerleme aşamasında yağ asidi radikaline hızlı bir şekilde oksijen eklenerek peroksil radikalini (LOO.) oluşturur. Lipid peroksil radikalleri zincir reaksiyonlarının başlatıcılarıdır. Lipid radikal daha sonra zincirleme reaksiyonu tamamlamak için moleküler oksijenle tepkimeye girer. Peroksil radikalleri ayrıca siklik peroksitleri oluşturabilmektedir. Ortamda bulunan demir ve bakır tuzları lipid hidroperoksidlerinin yıkılımını hızlandırmakta olup oluşan peroksi ve alkoksi radikalleri lipid peroksidasyonunu uyarır.
Lipid peroksidasyon son ürünü MDA ve kısa zincirli alkenler gibi aldehitlerdir. Lipid peroksidasyonu membran lipid çift tabakasının yapısal bütünlüğünü bozarak membran permeabilite artışına neden olur. Membran geçişi artışına bağlı olarak iyon transportu bozulurken mitokondride ise oksidatif fosforilasyonda elektron transportu bozulur. Ayrıca lizozomal permeabilite artışı nedeniyle oluşan hidrolitik enzim salınımı, hücre hasarını artırır.
2.5. Nitrik Oksit (NO)
Aynı anda farklı hücre türlerinde sentezlenen, otokrin veya parakrin mediatör fonksiyonu gören NO, yağda çözünür ve biyolojik membranlardan kolaylıkla geçer. Radikal olarak reaktivitesi düşük olan NO, metal içeren merkezler ve radikaller ile büyük bir hızla tepkimeye girer. Özellikle lipid radikallerle tepkimeye girmesi NO’e antioksidan bir etki kazandırır. Süperoksit ile NO arasındaki tepkime ile oluşan peroksinitrit (ONOO–), hidroksil radikali benzeri aktiviteye sahip olup radikalik tepkimeleri başlatmaya ilave olarak biyomoleküllerin nitrasyonuna neden olur. Fizyolojik derişimde üretilen NO, esas olarak oksihemoglobin tarafından nitrata (NO3-) oksitlenerek aktivitesi sonlandırılır. Oksijen radikallerindeki durumun aksine, nitrik oksiti ortamdan temizleyen herhangi bir özel enzim yoktur. Aerobik ortamda NO stabil değildir, derişiminin artması ile oksidasyonu hızlanır. Bu nedenle ortamdaki derişimi ile kendi ömrü arasında ters bir orantı vardır. Özellikle indüklenebilir nitrik oksit sentaz
enziminin indüksiyonu sırasında NO derişiminin artması ile oksidasyonu da hızlanır ve çeşitli reaktif nitrojen oksit türleri oluşur. Bu reaktif türler NO’in dolaylı etkilerinden sorumlu olup; hücresel moleküllerin nitrozilasyonuna, nitrasyonuna, nitrozasyonuna yol açarak proteinlerin ve enzimlerin inaktivasyonuna neden olabilirler (Kılınç 2002).
2.6. Ksantin Oksidaz ( XO)
Sitoplazmik bir enzim olan ksantin oksidaz, pürin metabolizması esnasında O2 indirgenmesi yoluyla süperoksit radikal üretimine neden olabilir.
Hipoksantin + 2 O2 + H2O→ ksantin + 2O2 + 2H+
Ksantin oksidaz normal dokularda bulunan ksantin dehidrogenaz gibi sentezlenir. Ksantin dehidrogenaz hipoksantinin, ksantin ve ürik aside dönüşümü esnasında NAD’yi indirger. Ksantin dehidrogenaz saflaştırılması esnasında örneğin özel önlem olmaksızın doku homojenizasyonunda dehidrogenaz oksidaza dönüştürülür. Oksidaz, elektron alıcısı olarak NAD’nin yerine moleküler oksijeni kullanır. Ksantin dehidrogenazın dehidrogenaz oksidaza dönüşümü; sülfhidril grubu oksidasyonu veya Ca bağımlı sınırlı proteoliz yoluyla meydana gelir. Ksantin dehidrogenazın dehidrogenaz oksidaza dönüşümü, iskemi esnasında da meydana gelebilir (Boveris 1978).
Membran iyon gradyentinin bozulması sonucu Ca+2 iyon akımı meydana gelir. Bu iyon akımı sitozolik kalsiyum konsantrasyonunun artmasına yol açar ki, bu konsantrasyon artışı ksantin dehidrogenazı ksantin oksidaza dönüştürme yeteneği olan proteazları aktive eder (Malis ve Bonventre 1986).
Đskemik periyod esnasında eş zamanlı olarak ATP üretimi azaltılırken AMP konsantrasyonu artar. Buna ilaveten, AMP adenozin, inozin ve hipoksantine metabolize olur. Daha sonra reperfüzyon esnasında moleküler oksijen sağlanır ve birikmiş hipoksantin okside olur, bu oksitlenme O2- serbest radikallerini artırır. Plazma membranı siklooksijenaz ve lipoksijenaz gibi enzimleri de ihtiva eder. Araşidonik asit; prostaglandinler, tromboksanlar ve lökotrienlere dönüştürülen başlıca substrattır. Yağ asidi serbest radikal ara ürünleri; dönüşüm reaksiyonları esnasında meydana gelir. Araşidonik enzim sistemlerinin; plazma ve organel membranlarının birarada olması
nedeniyle, serbest radikal üretimi belirgin sitotoksik hasara neden olabilir (Freeman 1984).
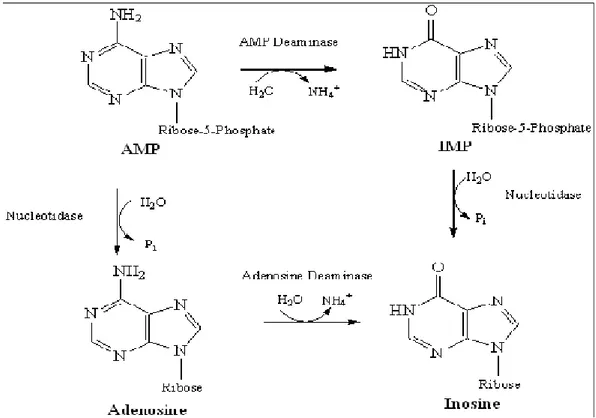
2.7. Adenozin Deaminaz ( ADA)
Adenozin deaminaz (ADA), pürin nükleotidlerinin katabolizmasında görev alan ve adenozinin inozine, deoksi adenozinin de deoksi inozine deaminasyonunu katalizleyen bir enzimdir (Baganha ve ark 1990).
Şekil 2.2. Adenozin deaminazın etki mekanizması (Baganha ve ark 1990).
ADA enzimi özellikle lenfosid hücrelerin yüksek oranda bulunduğu dokularda yaygın bir şekilde dağılmıştır. ADA enziminin özellikle T lenfosidlerin farklılaşması için gerekli olduğu düşünülmektedir. Ayrıca monosit ve makrofajların olgunlaşmasında rol aldığı için ADA hücre aracılı bağışıklığın bir komponenti olarak düşünülür. ADA’nın esas fizyolojik aktivitesi lenfosid çoğalma ve farklılaşma ile ilgilidir. Enzim aktivitesi lenfosidlerin mutajenik ve antijenik cevabı esnasında belirgin bir şeklide artar
ve buna karşılık lenfosid blastogenezi ADA inhibitörü ile inhibe edilir (Güngör ve ark 2000).
2.8. Antioksidanlar
Oksijen radikallerinin doku hasarı etkilerine karşı hücrelerin doğal olarak oksidatif hasarı önleme yetenekleri vardır. Hücre koruyucu bu mekanizmalar, oksijen radikallerini etkisiz hale getirmek ve temizlemek için düzenlenmiş birkaç enzim sistemini içermektedirler.
Antioksidanlar iki sınıfa ayrılırlar:
1. Koruyucu antioksidanlar, zincirleme reaksiyonun başlama hızını düşürürler 2. Zincir bozan antioksidanlar, zincir reaksiyonun ilerlemesini engeller.
Koruyucu antioksidanlar, ROOH ile reaksiyona giren katalaz ve perokisidazları ve dietilen triamin penta asetat (DTPA) ve etilendiamintetraasetat (EDTA) gibi metal iyonlarını şelatlayan bileşikleri içine alır. Zincir bozan antioksidanlar, fenoller ve aromatik aminlerdir.
2.9. Süperoksit Dismutaz (SOD)
Süperoksid dismutaz (SOD), bir metalloenzimdir. Oksijeni metabolize eden bütün hücrelerde bulunur. SOD, McCord ve Fridovich (McCord ve Fridovich 1969) tarafından bulunmustur ve süperoksidin hidrojen perokside dönüşümü reaksiyonunu katalizler.
Süperoksid Dismutaz Süperoksid radikalini dismutasyona uğratarak detoksifiye eder. Organizmada substrat olarak serbest radikal kullanan tek enzim SOD'dir. SOD'nin Cu-Zn ve Mn kapsayan iki ayrı izoenzimi bulunmaktadır. Cu ve Zn içeren tipi sitozolde, Mn içeren tipi ise mitokondride yerleşim gösterir. Oksijenin suya indirgenmesi sırasında radikal oluşumunu önler.
Hücre içinde mitokondride doğal olarak bulunan bir enzim olup bu enzimin aktivitesi yüksek oksijen kullanan dokularda fazladır ve doku pO2 (parsiyel oksijen basıncı) artışı ile artar. Enzimin fizyolojik fonksiyonu; oksijen kullanan hücreleri süperoksid serbest radikallerinin zararlı etkilerine karşı korumaktır. Bu etkisini süperoksid radikallerini daha az reaktif olan hidroksi peroksid formuna çevirerek gerçekleştirir. Böylece hücresel bölmelerdeki süperoksid düzeylerini kontrol ederek önemli bir savunma sağlar (Akkuş 1995, Gutteridge 1995).
SOD’nin, süperoksid anyonuna olan etkisi şu şekildedir. Süperoksid anyonu, SOD’nin yapısındaki Cu+2 ve bir arginin rezidüsünün guanido grubuna bağlanır. Bu bağlanma sonucunda süperoksidden bir elektron Cu+2’a transfer olurken Cu+1 ve moleküler oksijen meydana gelir. Đkinci bir süperoksid anyonu Cu+1’dan bir elektron, bağlanma ortağından ise iki proton alarak hidrojen peroksidi oluştururken, enzim tekrar Cu+2 formuna dönmüş olur (Akkuş 1995, Gürel ve ark 1997).
SOD-Cu+2 + O2-⋅ SOD-Cu+1 + O2 SOD-Cu+1+ O2-.+ 2H+ SOD-Cu+2+ H2O2
Süperoksid dismutazın katalizlediği reaksiyonun hızı spontan reaksiyonun yaklaşık 400 katıdır. Đnsanda iki tipi bulunmaktadır. Bunlar sitozolde bulunan dimer, Cu ve Zn ihtiva eden izomer (Cu-Zn SOD) ile mitokondride bulunan tetrametrik Mn ihtiva eden izomerlerdir (Mn SOD). Hücrede en bol izomer sitozolik Cu-Zn SOD’dir. Cu-Zn SOD 21 nolu kromozomda, Mn SOD 6 nolu kromozomda lokalizedir. Sitozolik Cu-Zn SOD
siyanidle inhibe edilirken, mitokondrial Mn SOD inhibe olmaz. Her iki SOD’nin katalizlediği reaksiyon aynıdır. Böylece peroksidasyonu inhibe eder. Normal metobolizma esnasında hücreler tarafından yüksek miktarda süperoksid üretimi olmasına rağmen SOD sayesinde intrasellüler süperoksid düzeyleri düşük tutulur (Akkuş 1995).
SOD aktivitesindeki genetik ya da sonradan meydana gelmiş değişikler ile hastalığa karşı hassasiyet ya da direncin birbiriyle ilişkili olabileceği kaydedilmiştir. Romatoid artritte, diabetik hipertrigliseridemik hastalıklarda ve Behçet hastalığında da süperoksid üretimi ile süperoksid toplayıcı aktivite arasında negatif bir korelasyon bulunmuştur. Cu-Zn SOD’nin spesifik aktivitesi Down sendromlu hastaların eritrositlerinde yüksek, prematürelerin ve yaşlıların eritrositlerinde düşük bulunmuştur (Akkuş 1995).
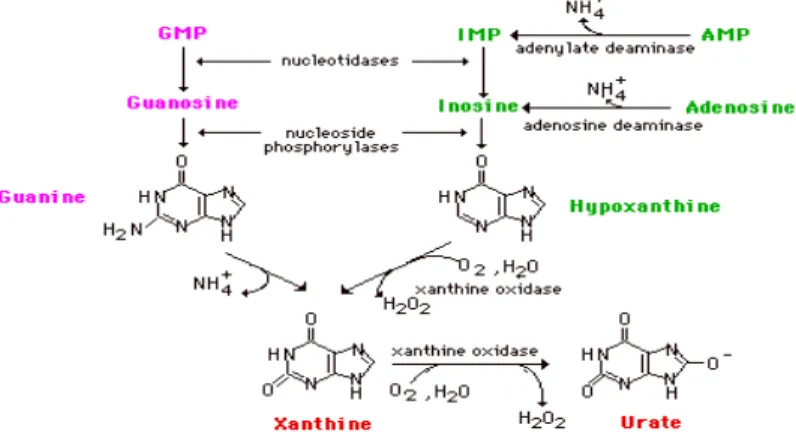
2.10. Ürik Asit (UA)
Ürik asit, nükleer materyalin katabolizması sonucu açığa çıkan adenozin ve guanozin bazlı pürinlerin metabolizmasının son ürünüdür. Vücuttaki ürik asit endojen ve eksojen kaynaklı olabilir (Dantzler 1996). Ürik asit zayıf asittir (pKa: 5,8) ve ekstrasellüler ortamda sodyum ürat şeklinde dağılmıştır. Pürin metabolizması günlük besinle olduğu kadar genetik faktörlerin hücre işlevini düzenlemesiyle de ilgilidir. Ürik asit sulu ortamda çok az çözünür ve sürekli yüksek serum düzeylerinde bulunması yumuşak dokularda ürat kristalleri şeklinde depolanmasına yol açar (Emmerson 1996).
Ürik asit sentezinde yer alan reaksiyonlar şematik olarak aşağıda gösterilmiştir.
Pürinlerin katabolizması ürik asit oluşmasına yol açan ortak bir arayoldan gerçekleşir. Nükleazlar, nükleotidleri nükleik asitlerden ayırır ve bunlar nükleotidazlar tarafından tekrar metabolize edilir. Adenin nükleotidlerinin metabolizması; inozin monofosfat ve adenozin üzerinden inozine çevrilmesini kapsar. Adenozinin inozine deaminasyonu adenozin deaminaz tarafından kontrol edilir. Hipoksantinin ksantine ve ksantinin ürik aside çevrilmesi her iki aşamada da ksantin oksidaz tarafından kontrol edilir (Beacker 1993).
Ürik asid, serbest radikalle reaksiyona giren ve radikal tutucu olarak görev yapan bir molekül scavenger olarak adlandırılır (Freeman 1982). Ürik asit aynı zamanda endotele granülosit yapışmasını ve peroksit ve süperoksit serbest radikallerinin serbestleşmesini uyarır. Bu yüzden lökosit aktivasyonu ile endotel üzerine zararlı etkileri olabilir, ilginç olarak yüksek serum ürik asit düzeyleri ile dolaşımdaki inflamatuar markırlar arasında yakın bir ilişki gözlemlenmiştir (Levya ve ark 1998).
Ürik asit peroksinitrit ile birleşerek NO oluşturur, bu da vasodilatasyonu ve peroksinitritin potansiyel fazla oksidatif hasarının azaltılmasını kontrol eder (Skinner ve ark 1998). Böylece ürik asidin oksidatif strese karşı koruyucu olması beklenir (Waring ve ark 2000).
2.11. Aprotinin
Doku hasarının azaltılmasında aprotinin adlı kimyasalın kullanıldığı bilinmektedir. Aprotinin, sığır akciğerinden elde edilen ve moleküler ağırlığı 6512 Dalton ağırlığında olan bir serin proteaz inhibitörüdür (Levy ve ark 1994). Aprotinin tek polipeptit zincirde birbirine 3 disülfid bağla bağlı 58 aminoasitten oluşmaktadır. Aprotinin kallikreinkinin sistemi aktivasyonunu inhibe etmektedir. Aprotinin genel olarak kardiyak cerrahide perioperatif kan kayıplarını engellemek amacıyla kullanılmaktadır. Bilindiği gibi iskemi reperfüzyon hasarında, polimorfonükleer (PMN) lökositlerin ürettiği serbest oksijen radikallerinin, kompleman aktivasyonunun ve sitokinlerin etkili olduğu ispatlanmıştır (Jordan ve ark 1999). Plazma lökosit seviyelerinin azaltılmasıyla iskemi reperfüzyon hasarının azaltılabileceği ve alt ekstremitede iskemi reperfüzyona yol açan patolojik durumlarda anti-inflamatuar
ajanların lökosit aktivasyonlarını azaltarak iskemi reperfüzyon hasarlarını belirgin seviyelerde düşürdüğü de bildirilmektedir (Okutan ve ark 2004, Ekingen ve ark 2005).
Aprotinin, açık kalp cerrahisi sırasında özellikle redo CABG, kapak operasyonları, kombine operasyonlar ve koagülopati durumlarında kanamayı azaltmak ve kan transfüzyon ihtiyacını en aza indirmek için kullanılan bir ilaçtır. Moleküler ağırlığı 6512 Dalton ağırlığında tek polipeptit zincirde birbirine 3 disülfid bağla bağlı 58 aminoasitten oluşan bir serin proteaz inhibitörüdür. 1930-39 yıllarda Kraut tarafından sığır akciğerinden izole edilen aprotininin moleküler eşdeğeri sığır pankreas tripsin inhibitörü 1936 yılında Kunitz ve Northrop tarafından tanımlanmıştır. Aprotinin ilk kez 1959 yılında preperat olarak kullanıma sunulmuştur (Anderer ve Hornle 1966, Ekingen ve ark 2005). Đlk defa sığır akciğerinden elde edilen aprotininin günümüzde rekombinant DNA teknolojisi ile üretimi ve kullanımı mevcuttur (Green ve ark 1995).
Aprotinin; tripsin, kimotripsin, plasmin ve kallikrein inhibitörüdür, bu enzimlerin aktif serin bölgeleri ile geriye dönüşümlü kompleksler oluşturarak aktivitelerini inhibe eder. Aprotinin sadece serbest enzim moleküllerine bağlanmakla kalmaz. Enzim bir üçüncü maddeyle bağlı olsa bile, aktif merkeze ulaşabildiği sürece aprotinin de enzime bağlanır. Bu şekilde aprotinin, hem serbest plazmini, hem de streptokinazla trombolitik tedavi sırasında oluşan plazmin-streptokinaz kompleksini inhibe eder.
Aprotinin reaktif bölümü lizin-15-alanin-16 parçasıdır. Oral olarak kullanımı yoktur, intravenöz olarak kullanılır. Glomerülerden atılımı olur, proksimal tübüllerden geri alınımı mevcuttur. Plazma yarı ömrü 150 dk ve terminal eliminasyon faz yarı ömrü 10 saattir. Aprotinin böbreklerde ve daha az oranda olmak üzere kıkırdak dokusunda birikir (Modugno 1981).
2.12. Sitokinler
Sitokinler hormonlara benzeyen, inflamatuar ve immün yanıtın gelişimi ve düzenlenmesinde hematopoietik hücrelere aracılık eden, peptid veya glikoprotein yapıda kimyasal ileti molekülleridir (Tokgöz 1997, Onat ve ark 2002). Birçok hücreden salgılanan ve molekül kütleleri 8-110 kDa arasında bulunan sitokinler başlıca T hücreleri ve makrofajlarda üretilmektedir. Salgılandıkları hücreden kan dolaşımı ile hedef
hücrelere taşınan sitokinlerin endokrin, parakrin, otokrin ve jukstakrin etkileri bulunmaktadır. Bazı dokularda birbirleriyle sinerjistik etkili olabilen sitokinler, başka dokularda antagonist etki de gösterebilmekte ve birbirlerini inhibe edebilmektedirler. Sitokinler, hücrelerin çevresel koşullarına göre farklı etkiler gösterebilmektedir. Bir sitokin değişik tip hücreler tarafından yapılabilir ve değişik tip hücreler üzerine etki gösterebilir, başka sitokinlerin sentezlenmesini uyarabilir ya da engelleyebilir (Hammouda ve ark 1995).
Sitokinler hücre yüzeyinde yer alan spesifik reseptörlere bağlanarak etki gösterirler (Kılıçturgay 2003). Organizmada immün yanıtın düzenlenmesi, inflamasyon, hematopoiez ve yara iyileşmesi gibi genel sistemik reaksiyonlarda işlev görmektedirler. Sitokinlerin embriyogenez ve organ gelişimlerinde, nöroimmünolojik, nöroendokrinolojik süreçlerde anahtar rolleri bulunmaktadır. Mitoz, farklılaşma, hücre göçleri, hücre yaşamı ve hücre ölümü olaylarında düzenleyicidirler (Onat ve ark 2002).
2.13. Tümör nekroz faktör alfa (TNF-α)
Tümörlerde hemorajik nekroz yaptığı için bu ad verilmiştir. TNF-α başlıca aktif makrofajlar tarafından yapılır. TNF-α’nın biyolojik fonksiyonları konsantrasyonuna bağlıdır. Düşük konsantrasyonlarda etkisi lokaldir. Lökositler ve endotel hücreleri üzerine otokrin ve parakrin etki yapar. TNF-α, damar endotelinde bazı adezyon moleküllerinin ortaya çıkmasına yol açar. Adezyon molekülleri endotelin önce nötrofiller daha sonra da mononükleer lökositler için yapışkan olmasını sağlar. Böylece inflamatuar reaksiyondan sorumlu hücreler infeksiyon sahasına toplanır. TNF-α, nötrofil, eozinofil ve mononükleer fagositlerin mikroorganizmaları öldürmesini aktive eder, mononükleer fagositler ve diğer bazı hücrelerin inflamatuar yanıtta önemli rolleri olan IL-1, IL-6, TNF-α ve kemokin gibi sitokinlerin üretimini uyarır (Tokgöz 1997).
2.14. Interlökin-6 (IL-6)
Đnterlökin–6; çesitli hücreler üzerinde çok sayıda biyolojik aktivitesi olan bir sitokindir. Aktive T ve B hücreleri, monositler, endotel hücreleri, epitel hücreleri,
fibroblastlar, keratinositler, hepatositler, nöroglial hücreler gibi çok değişik hücreler tarafından sentezlenir (Munoz ve ark 1991).
IL–6 reseptörleri, 80 kDa ağırlığında protein bağlayan bölge ve 130 kDa ağırlığında sinyal iletimini sağlayan alt birimlerden oluşur. Protein bağlayan bölge immünglobulin bölgesi içerir. IL–6 reseptörleri; ayrıca dış ortama salınırlar. Dolaşımda bulunan IL–6 reseptörleri diğer sitokin reseptörlerinden farklı olarak IL–6’nın etkilerini arttırırlar. IL-6’nın en önemli biyolojik etkinliği, B lenfosit matürasyonunu stimüle etmesidir. IL–6’nın etkisi ile B lenfositler immunglobulin sentezleyebilen olgun plazma hücrelerine farklılaşırlar. B hücrelerinde immünglobulin (Ig) sentezinde artış, T hücre aktivasyonu ve akut faz proteinlerinde artışa yol açması proinflamatuar, proinflamatuar sitokinleri baskılaması da antiinflamatuar özelliğidir. Hematopoezi ve trombopoezi uyarır. IL–6, nötrofil aktivatörüdür. Kemik iliği kök hücresinin matürasyonunda diger sitokinlerle sinerjistik etki gösterir (Oppenheim ve Taub 1994, Meisner 2005).
3. GEREÇ VE YÖNTEM 3.1. Gereç
3.1.1. Vakaların Oluşturulması ve Gruplama
Deneysel çalışmamızda, Sprague-Dawley, dişi, ortalama ağırlıkları 150-200 gr olan toplam 6-7 haftalık 48 adet rat kullanıldı. (Ratlar deney öncesi bir hafta süre ile tel kafeslerde 12 saat gece 12 saat gündüz sirkadiyan ritm de, ortam sıcaklığı 24-26 °C ve nem oranı %50-60 olacak şekilde tutuldu).
Tüm cerrahi prosedürler ratlara intraperitoneal ketaminhidroklorür (50mg/kg)+ksilazin HCL 5 mg/kg ile anestezi uygulandıktan sonra gerçekleştirildi. Sham operasyonu yapılan grup hariç tüm gruplarda anestezi altında No:16 branül ile batına girilip CO2 insuflasyonu gruplarda belirtildiğine göre uygun olarak uygulandı.
Gruplar sekizer (n=8) sayıda rattan oluşturularak aşağıda belirtilen şekilde düzenlendi.
• Grup 1 (kontrol). Aneztezi altında 60 dakika bekletildi.
• Grup 2 (Đ/R). Anestezi altında 60 dakika 15 mmHg CO2 insuflasyonu uygulanıp ve bu uygulamanın desüflasyon ile sonlandırılmasını takiben 20 dakikalık desüflasyon süresi takip edildi.
• Grup 3 (Plasebo-Serum fizyolojik+Đ/R). Anestezi altında 60 dakika 15 mmHg CO2 insuflasyonu uygulandı. Đnsüflasyonun başlangıcından 5 dakika sonra kuyruk veninden izotonik verildi. Đnsüflasyonun desüflasyon ile sonlandırılmasını takiben 20 dakikalık desüflasyon süresi takip edildi.
• Grup 4 (Aprotinin+Đ/R). Anestezi altında 60 dakika 15 mmHg CO2 insuflasyonu uyguladı. Đnsüflasyonun başlangıcından 5 dakika sonrasında Aprotinin 30,000 KIU/kg/0,7 mL dozunda kuyruk veninden uygulandı. Đnsüflasyonun desüflasyon ile sonlandırılmasını takiben 20 dakikalık desüflasyon süresi takip edildi
• Grup 5 (Aprotinin+Kademeli basınç Kombinasyonu+Đ/R). Anestesi altında önce 10 dakika 5 mmHg CO2 insuflasyonu, sonrasında 10 dakika 10 mmHg CO2 insuflasyonu, sonrasında 60 dakika 15 mmHg CO2 insuflasyonu uygulandı.
dozunda kuyruk veninden uygulandı. Đnsuflasyonun desüflasyon ile sonlandırılmasını takiben 20 dakikalık desüflasyon süresi takip edildi.
3.1.2. Numunelerin Alınması ve Doku Analizi Ön Đşlemleri
Grup 1 60 dakikalık anesteziyi takiben ve diğer gruplar (Grup 2-3-4-5) ise reperfüzyon bitiminde intrakardiyak kan alımı sonrası servikal dislokasyon ötenazisi uygulanarak süratle böbrek dokusu biyokimyasal analizler için alındı.
Đntrakardiyak olarak alınan kan süratle santrifuj edilip elde edilen plazma biyokimyasal analizlerle ilgili olarak plastik ependorf kapaklı tüplere transfer edildi. Servikal dislokasyonu takiben alınan dokular ise; serum fizyolojikle yıkanarak kan, pıhtı ve komşu doku artıklarından arındırıldıktan sonra histopatolojik ve biyokimyasal analizlere uygun saklama kaplarına (biyokimyasal analizler için plastik ependorf kapaklı tüplere ve patoloji analiz için formol içine) transfer edildi. Biyokimyasal analizlerle ilgili plazma ve doku numuneleri ependorf kapaklı plastik tüplerde -80 0C’ye derin dondurucuya aktarıldı.
Malonil dialdehit (MDA), ksantin oksidaz (XO), superoksit dismutaz (SOD), adenozin deaminaz (ADA), ürik asit, TNF-alfa ve IL-6 gibi Đ/R hasarı ile ilişkili biyokimyasal parametrelerin doku örnekleri analiz öncesinde soğuk zincire dikkat edilerek homojenize edildi. Homojenizasyonu takiben protein, MDA, XO, SOD ve AOA analizleri çalışıldı.
3.1.3. Kullanılan Cihazlar
a. Homojenizatör : Misonix XL 2007 Ultrasonic Cell Disruptor, USA b. Soğutmalı santrifüj : Hettich Universal 30 RF
c. Spektrofotometre : Shimadzu UV - 1601 d. Ayarlanabilir otomatik pipetler
e. Vorteks f. Benmari g. Hassas terazi
h. Manyetik karıştırıcı ve manyetik bar i. Damıtma cihazı
3.1.4. Kullanılan Reaktif ve Çözeltiler
Lowry Metodu reaktifleri
A reaktifi: 0,5 gr CuSO4.5H2O ve 1 gr Na3Sitrat (susuz) 100 ml distile suda çözülür.
B reaktifi: 20 gr Na2CO3 ve 4 gr NaOH, 1 L distile suda çözülür C reaktifi: 50 ml B çözeltisine 1 ml A çözeltisi ilave edilir D reaktifi: Phenol - Folin – Ciocalteu reaktifi
SOD (Süperoksit Dismutaz) reaktifleri Assay Reaktifleri;
a. 0,3 mmol / L Xanthine b. 0,6 mmol / L EDTA c. 150 µmol / L NBT d. 400 mmol / L Na2CO3
e. 1 g / L bovine serum albumin
Đlk 5 kimyasalın sırasıyla karıştırılması ile ASSAY reaktifi hazırlanır f. 0,8 mmol / L CuCl2
g. 2 M (NH4)2SO4
h. 167 U / L Ksantin Oksidaz i. 150 mM NaCN
XO (Ksantin Oksidaz) reaktifleri
a. Fosfat tamponu (50 mM, pH 7,5 – 0,5 mM Na2 EDTA’lı) b. 4 mM Ksantin
c. TCA (%100 w / v)
MDA ( Malondialdehit) reaktifleri a. % 0,675’lik TBA çözeltisi
b. %10’luk TCA
AOA (Antioksidan Aktivite) reaktifleri a. Fosfat tamponu (100 mM, pH 7,4) b. 10 mmol/l Sodyum Benzoat c. 50 mmol/l NaOH
d. 100 mM pH 7,4 fosfat tamponu ile hazırlanmış 2 mmol/l EDTA e. 2 mmol/l Fe(NH4)2(SO4)2
f. 10 mmol/l H2O2 g. % 20’lik asetik asit
h. 10 mmol/L Sodyum Benzoat ile hazırlanmış %0,8 lik TBA i. 5 mmol/l NaOH içinde hazırlanmış 1 mmol/l Ürik asit
NO (Nitrik Oksit) reaktifleri
Kadmiyum Granülleri
Glisin-NaOH Tamponu (Ph=9,7) Sülfanilamid
N-Naphthylethene daimine (NNDA) 5 mmol/L CuSO4
0,1 mol/L H2SO4 0,1 mol/L NaNO2 75 mmol/L ZnSO4 55 mmol/L NaOH
ADA (Adenozin Deaminaz) reaktifleri
Fosfat tamponu pH 6.5, 50 mM Adenozin tamponu pH=6.5, 20 mM
Amonyum Sülfat standart solusyonu (75 µM)
Alkali hipoklorid solüsyonu (11 mM NaOCl, 125 mM NaOH)
Fenol nitroprussid Solüsyonu (106 mM (P), 0,17 mM (Na-Nitroprussid)
3.2. Yöntem
3.2.1. Dokuların Homojenizasyonu
Analiz gününe kadar – 800 C de saklanan dokular, çalışma günü derin dondurucudan çıkarılıp kuru buz ortamında laboratuara getirildi ve analiz öncesinde çözüldü.
Cam tüpe aktarılan yaklaşık 0,30-0,50 gramlık doku üzerine 2 ml Tris – HCl tamponu eklendi. Buz doldurulmuş plastik kap içerisine yerleştirilen cam tüpteki doku tam bir homojenizasyon sağlanıncaya kadar yaklaşık olarak 2-5 dakika süreyle ultrasonik homojenizatörde homojenize edildi. Bu süre içerisinde son hacim doku ağırlığının 10 katı olacak şekilde tampon ilaveleri yapıldı. Homojenattan MDA çalışması için yeterli olacak kadar numune alındıktan sonra kalan homojenat +40 C de 30 dakika süre ile santrifüj edildi. Supernatandan XO, AOA ve protein analizleri için yeterli olacak kadar miktar alındıktan sonra kalan supernatanlar eşit hacimde 3/5 oranında hazırlanan Kloroform/Etanol karışımı ile vortexlenip cam tüpte 3220 rpm / 40 dakika +4 oC’de santrifüj edildi. Üstte oluşan etanol fazından protein ve SOD enzim aktivite tayini yapıldı.
3.2.2. Protein Ölçümü
Proteinlerin ölçümü Lowry ve ark (1951)’nın metoduna göre yapıldı. Alkali çözeltide bakır – protein kompleksi oluşmaktadır. Bu kompleks Folin – Ciocalteu – Phenol reaktifini redükler ve koyu mavi bir renk oluşturur. Buradaki renk koyuluğu ortamdaki protein konsantrasyonuyla doğru orantılıdır.
Protein ölçümü için değişik konsantrasyonlarda hazırlanmış olan protein standart solüsyonlarından faydalanılarak bir standart grafiği elde edildi. Çalışmalar için kör ve numune tüpleri hazırlandı. Numune tüpüne 10 µl numune ile 490 µl distile su ve kör tüpüne 500 µl distile su koyulduktan sonra üzerlerine 2,5 ml C reaktifi eklenip 10 dakika oda ısısında bekletildi. Tüplere 250’şer µl D reaktifi koyulup hızla vortekslendi. 30 dakika oda ısısında bekletildi. Bekleme süresinin sonunda 700 nm’de köre karşı absorbanları alındı. Sonuçlar standart grafiğinden hesaplandı.
3.2.3. MDA (Malondialdehit) Ölçümü
MDA seviyeleri Hammouda ve ark (1995)’nın metodu ile tiobarbitürik asit (TBA) reaktivitesi yöntemi kullanılarak ölçüldü. Yağ asidi peroksidasyonunun bir ürünü olan MDA, TBA ile reaksiyona girerek sıcak ve alkali ortamda, 532 nm’de maksimum absorbans veren renkli kompleks oluşturur. Oluşan kompleksin okunan absorbansından faydalanılarak MDA değerleri elde edilir.
Numune ve deney tüpleri hazırlandı. Tüplere 2,5 ml % 10’luk (w/v) TCA çözeltisi koyulduktan sonra kör tüpüne 0,5 ml distile su, numune tüpüne ise 0,5 ml numune koyularak vorteksle karıştırıldı. Tüplerin ağzı kapatıldıktan sonra 900 C’lik su banyosunda 15 dakika bekletildi. Tüpler soğutulduktan sonra 3000 x g de 10 dakika santrifüj edildi. Supernatanlardan 2 ml alınıp üzerine % 0,675’lik (w/v) TBA çözeltisinden 1 ml eklendi. Tekrar 90 0C’lik su banyosunda 15 dakika bekletildikten sonra tüpler soğutuldu. Her numunenin 532 nm de köre karşı absorbansları okutuldu.
1,1,3,3-tetramethoxypropane’nın değişik konsantrasyonları ile hazırlanan Standart grafiğinden faydalanılarak nmol/ml olarak hesaplanan MDA düzeyleri nmol / gr yaş doku cinsinden ifade edildi.
3.2.4. XO (Ksantin Oksidaz) Ölçümü
XO aktivitesi Prajda ve ark (1975)’nın metoduna göre çalışıldı. Bu metotta XO aktivitesi; numunede bulunduğu farz edilen XO’ın ortamdaki ksantinden ürik asit oluşturması esasına dayanır. Oluşan ürik asit miktarı % 100’lük TCA solüsyonunun eklenmesi ile sabitlenir.
Her bir numune için ayrı ayrı olacak şekilde numune ve kör tüpleri hazırlandı. Tüm tüplere EDTA’lı fosfat tamponundan 1680 µL ve Ksantin solüsyonundan 30 µL pipetlendi. Ardından numune tüplerine 30’ar µL numuneler pipetlendi. 37˚C'de 30 dakika inkübasyonun arkasından numune tüplerindeki reaksiyon 84 µL TCA ilavesi ile durduruldu. Kör tüplerine de önce 30’ar µL numune ve hemen beklenmeden 84 µL TCA pipetlenip vortekslendi. 4000 x g’de 20 dakika santrifüj sonu süpernatanların 293 nm dalga boyunda distile suya karşı absorbansları okundu. Böylece 30 dakika içerisinde üretilen ürik asit miktarı belirlendi ve sonuçlar ürik asitin değişik konsantrasyonları ile hazırlanan standart grafiğinden faydalanılarak aktivite U/gr protein cinsinden ifade edildi.
H2O + O2 Ksantin Oksidaz H2O2
Ksantin Ürik asit
3.2.5. SOD (Süperoksit Dismutaz) Ölçümü
Süperoksit dismutaz (SOD) aktivitesi; Sun ve ark (1988) ve Durak ve ark (1992)’nın tariflediği modifikasyona göre analiz edildi. Tayin metodu: ksantin / ksantin oksidaz sistemi ile üretilen süperoksitin nitro blue tetrazoliumu (NBT) indirgenmesi esasına dayanır. Oluşan süperoksit radikalleri ortamdaki NBT’yi indirgeyerek renkli formazon oluşturur. Bu kompleks 560 nm’de maksimum absorbans verir. Enzimin olmadığı ortamda bu indirgenme meydana gelip mavi – mor renk oluşmaktadır. Ortamda SOD olduğunda ise NBT indirgenmesi olmayıp mavi – mor renk meydana gelmemekte ve enzim miktar ve aktivitesine bağlı olarak açık renk oluşmaktadır.
Kör ve numune tüpleri hazırlandı. Tüm tüplere 1425 µL ASSAY reaktifinin ardından numune tüplerine 50 µL ekstrakt (Etanol fazı) ve kör tüpüne 50 µL distile su pipetlendi. Tüm tüplere 25’er µL XO enzimi ilavesi ile tüpler alt üst edilip 25º C'de 20 dakika inkübasyon sonu hemen tüm tüplere 500’er µL CuCl2 ilavesi ile reaksiyonlar durduruldu. Distile suya karşı körden başlanarak 560 nm de absorbansları okundu.
Enzim olmayan (kör) değer ile enzim bulunan numune absorbans değerleri hesaba katıldı. Hesaplama;
Enzimin % inhibisyonu = ( Abskör – Absnum) / (Abskör x 100)
Bir SOD ünitesi; NBT redüksiyonunu % 50 oranında inhibe eden enzim aktivitesidir. %50 inhibisyonu gerçekleştiren enzim aktivitesi U/L olarak hesaplandıktan sonra mg protein değerine bölünerek, U/mg protein değerine çevrilir.
3.2.6. AOA (Antioksidan Aktivite) Ölçümü
Bu parametre Koracevic ve ark (2002)’nın metoduna göre çalışıldı. Buna göre; Fe-EDTA komplexinden oluşan standart bir solüsyon Hidrojen peroksit ile Hidroksil radikallerinin oluşumuna neden olan fenton tipi bir reaksiyon verir. Bu reaktif oksijen türleri salınımı ile sonuçlanan TBARS (tiobarbiturik asit reaktif substansları) benzoatı azaltırlar. Eklenen homojenattaki antioksidanlar TBARS oluşumunu baskılarlar. Bu reaksiyon spektrofotometrik olarak ölçülür ve bu renk oluşumunun inhibisyonu AOA’ yı tanımlar.
Kör, standart ve numunelerin her biri için 1 ve 0 ile işaretli olmak üzere cam tüpler etiketlendi. Numune tüplerine numuneler standart tüplerine ürik asit standartı 10’ar µL pipetlendikten sonra aynı tüplere 490 µL distile su pipetlendi. Kör tüplerine ise 500’er µL distile su pipetlendi. Tüm tüplere 500’er µL sodyumbenzoat ilavesinin ardından 0 ile etiketli tüplere 1’er ml asetik asit eklendi. Ardından tüm tüplere 200’er µL Fe-EDTA ve 200’er µL H2O2 pipetlenip 60 dakika için 37 0C de bekletildi. Sürenin bitimini takiben bu kez 1 ile etiketli tüplere 1’er ml asetik asit ilavesinin ardından tüm tüplere 1’er ml TBA eklenip kaynar su banyosunda 10 dk bekletildi. Sürenin sonunda buzlu su ile soğutulup tüm tüplerin 532 nm de distile suya karşı absorbansları alındı.
Sonuçlar AOA (nmol/mg protein) = (CUA) x (K – A) / (K – UA) formülünden faydalanılarak mg protein başına antioksidan aktivite olarak hesaplandı.
CUA : Ürik asit standartının konsantrasyonu K : K1-K0
A : A1- A0 UA : UA1 – UA0
3.2.7. NO (Nitrik Oksit) Ölçümü
Nitrik oksit, üretildiği bölgede saniyeler içinde okside olarak önce nitrite (NO2-) daha sonra da nitrata (NO3-) dönüşmektedir. Bununla beraber proteinden zengin solüsyonlarda ve vücut sıvılarında spesifik olmayan reaksiyonlar meydana gelebileceğinden dolayı Griess reaksiyonu ile ölçümlerde bazı sıkıntılar yaşanabilmektedir. Bu nedenle nonspesifik reaksiyonların önüne geçebilmek amacıyla numuneler önce deproteinize edilip daha sonra total nitrit (nitrit ve nitrat) seviyeleri ölçüldü. NO analizi Griess reaksiyonu ile belirlendi (Cortas ve Wakid 1990).
15 ml’lik plastik tüplerin içine 2,5 gr kadmiyum ve 3ml H2SO4 hazırlanması çalışma öncesinde yapıldı. Daha sonra kadmiyumlar üç defa distile su yıkandı ve ardından plastik distile su kabının uç kısmı eğilerek tazyikli bir şekilde yıkama yapılarak kurulama işlemi süzgeç kağıdı ile yapıldı. Bu işlemde kadmiyumlarım iyice kurutulmasına ve zayi olmamasına özen gösterildi. Daha sonra 2 ml CuSO4 ilavesi yapıldı ve ardından vortekslendi. Süzülerek dökülüp tekrar kurulama işlemi yapıldı. 2 ml Glisin tamponu ilave edilip vortekslendi ve ardından dökülüp tekrar kurulandı. Daha sonra numune hazırlanmasına geçildi.
Đkinci aşama olarak diğer taraftan parmak tüpler hazırlandı 160 µL Homojenat + 640 µL ZnSO4, 800 µL NaOH sırayla eklendi ve ardından hemen vortekslenerek 3500 rpm de 10 dakika santrifuje edildi.
Üçüncü aşama olarak nitrat tayinine geçildi. Bu aşamada glisin tamponu ile yıkanmış aktif kadmiyum granüllü tüplerin üzerine 1 ml glisin tamponu ilave edildi.
Yine bu tüplerin üzerine 1 ml deproteinize numune ilave edilip ardından 2 ml distile su ilave edildi. Plastik tıpa ile kapatılıp karanlık bir ortama bırakıldı. Her 10 dakikada bir bu kadmiyumlu tüpler alt üst edildi. Bu işlem 90 dakika boyunca devam ettirildi.
Đnkubasyon sonunda nitrit çalışma çizelgesine göre uyularak sırasıyla numune ve reaktifler konuldu.
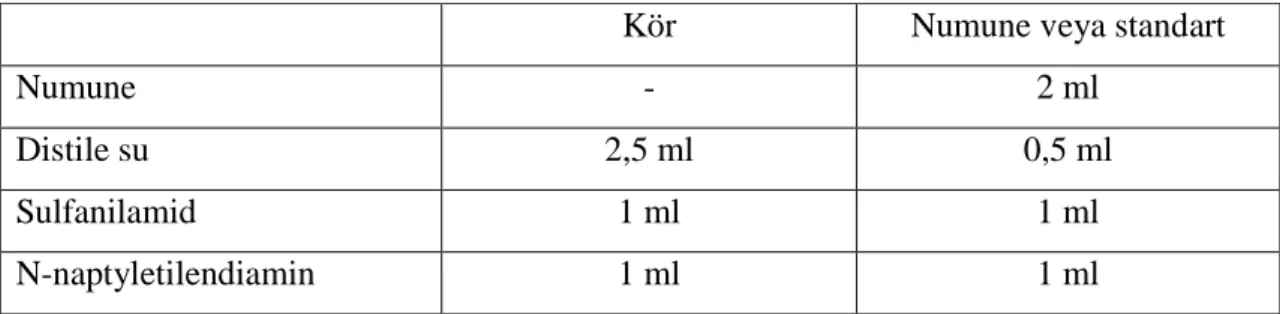
Çizelge 3.1. NO çalışma çizelgesi
Kör Numune veya standart
Numune - 2 ml
Distile su 2,5 ml 0,5 ml
Sulfanilamid 1 ml 1 ml
N-naptyletilendiamin 1 ml 1 ml
Bu işlemler tamamlandıktan sonra 50 dakika oda ısısında bekletildi. Total nitrit (nitrit + nitrat) konsantrasyonu modifiye kadmiyum redüksiyon metodu ile değerlendirilerek reaksiyon sonucu oluşan pembe rengin 545 nm dalga boyunda spektrofotometrede okunması ile sonuçlar mikromol/g protein olarak belirlenir.
3.2.8. Adenozin Deaminaz ( ADA) enziminin aktivite tayini
Numune substrat olan adenozin ile 37 0C’de bir saat inkube edilmiş ve oluşan
amonyak alkali ortamda sodyum hipoklorit ve fenol ile mavi indofenol oluşturmuştur. Amonyak konsantrasyonu direkt indofenolün absorbansıyla doğru orantılıdır (Giusti 1974). ADA ölçümüne ait işlem basamakları Çizelge 3.2 ve Çizelge 3.3’te gösterilmiştir.
Çizelge 3.2. ADA ölçümünde işlem basamakları-I
Hazırlanacak Deney Tüpleri Kullanılan
çözeltiler
Reaktif körü Standart Adenozin körü Numune körü Numune Fosfat tamponu 1 mL - - 1 mL - Adenozin - - 1 mL - 1 mL
Çizelge 3.2. ADA ölçümünde işlem basamakları-I (devamı)
Amonyum
Sülfat - 1 mL - - -
Numune - - 50 µL 50 µL
Distile Su 50 µL 50 µL 50 µL - -
Numune ve diğer tüpler Çizelge 3.2’de gösterildiği şekilde hazırlanarak pipetleme yapılmıştır. Deney tüpleri vortekslenerek 37 oC’da 1 saat su banyosunda bekletilmiş ve Çizelge 3.3’de gösterilen diğer işlemlere geçilmiştir.
Çizelge 3.3. ADA ölçümünde işlem basamakları-II
Hazırlanacak Deney Tüpleri Kullanılan
çözeltiler
Reaktif körü Standart Adenozin körü Numune körü Numune Fenol-nitroprussid 3 mL 3 mL 3 mL 3 mL 3 mL Alkali hipoklorit 3 mL 3 mL 3 mL 3 mL 3 mL
Pipetleme bittikten sonra her tüp, diğerine geçmeden muhakkak karıştırılmalı ve; 37 oC’ da 30 dakika su banyosunda bekletildikten sonra 625 nm’de distile suya karşı spektrofotometrede okunmuştur. Hesaplamada; numune, adenozin ve reaktif körlerinin absorbansları dikkate alınarak numunenin net absorbansı hesaplanmıştır. Standart konsantrasyonu ve dilüsyon faktörü de dikkate alınarak numunedeki enzim aktivitesi U/gr protein olarak hesaplanmıştır.
3.2.9. Ürik Asit (UA) analizi
Randox enzimatik kolorimetrik kiti ile (cat no: UA 233) ürik asit seviyeleri çalışıldı. Bu yöntemin çalışma prensibi olarak; Ürik asitin allontoin ve hidrojen perokside çevrilmesi esastır. Hidrojen peroksit, peroksidaz enzimin katalitik etkisi altında 3,5-Dikloro 2-hidroksibenzenosülfonik asit ve 4-aminophenazone kırmızı violet