Y
.
ÖZEL
Y
Ü
K
SEK
Lİ
SA
N
S TE
Z
İ
2
0
1
7
T.C.
BALIKESİR ÜNİVERSİTESİ
SAĞLIK BİLİMLERİ ENSTİTÜSÜ
TIBBİ MİKROBİYOLOJİ ANABİLİM DALI
CINNAMOMUM ZEYLANICUM UÇUCU YAĞI İLE BİLEŞENLERİNİN ANTİBAKTERİYEL AKTİVİTESİNİN VE TOPİKAL ANTİBİYOTİKLERLE SİNERJİSİNİN ARAŞTIRILMASI
YÜKSEK LİSANS TEZİ
Yener ÖZEL
Tez Danışmanı
Prof. Dr. Mehmet ÜNLÜ
T.C.
BALIKESİR ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ TIBBİ MİKROBİYOLOJİ ANABİLİM DALI
CINNAMOMUM ZEYLANICUM UÇUCU YAĞI İLE
BİLEŞENLERİNİN ANTİBAKTERİYEL AKTİVİTESİNİN VE
TOPİKAL ANTİBİYOTİKLERLE SİNERJİSİNİN ARAŞTIRILMASI
YÜKSEK LİSANS TEZİ
Yener ÖZEL
TEZ SINAV JÜRİSİ
Prof. Dr. Mehmet ÜNLÜ Balıkesir Üniversitesi - Başkan Prof. Dr. Gülhan VARDAR ÜNLÜ
Balıkesir Üniversitesi - Üye Prof. Dr. Ahmet ÖZBİLGİN Manisa Celal Bayar Üniversitesi - Üye
Tez Danışmanı
Prof. Dr. Mehmet ÜNLÜ
Bu araştırma; Balıkesir Üniversitesi Bilimsel Araştırma Projeleri Birimi tarafından 2015/218 nolu proje ile desteklenmiştir.
TEŞEKKÜR
Tezimin yürütülmesinde bana rehberlik eden ve her türlü desteğini esirgemeyen danışman hocam Sayın Prof. Dr. Mehmet ÜNLÜ’ye, tezimin yürütülmesinde bilimsel katkılarından dolayı Sayın Prof. Dr. Gülhan VARDAR ÜNLÜ’ye ve Prof. Dr. Mehmet Tevfik YAVUZ’a, bu araştırmaya sağladığı desteklerden dolayı Balıkesir Üniversitesi Bilimsel Araştırma Koordinatörlüğüne, tez dönemim boyunca bana destek olan çalışma arkadaşlarım Kaan DURAN, Nilsu AYDIN, Pelin DİLER ve Melike Sena BOZGÜL’e ve yine tez çalışmamda bana büyük katkıları olan merkezi sterilizasyon ünitesi sorumlusu Mehmet KÖSE ve ekibine, her zaman ve her koşulda yanımda olan, hiçbir yardımını ve desteğini esirgemeyen sevgili aileme ve canım eşim Seval ÖZEL’e teşekkürlerimi sunarım.
i
İÇİNDEKİLER
ÖZET ... v ABSTRACT ... vı SİMGELER VE KISALTMALAR DİZİNİ ... vıı ŞEKİLLER DİZİNİ ... vııı TABLOLAR DİZİNİ ... ıx 1. GİRİŞ ... 1 2. GENEL BİLGİLER ... 3 2.1. Cinnamomum zeylanicum ... 3 2.1.1. Tarihçe... 3 2.1.2. Kullanımı ... 42.2. Cinnamomum zeylanicum Uçucu Yağı ... 4
2.3. Cinnamomum zeylanicum Uçucu Yağ Bileşenleri ... 4
2.3.1. Biyolojik Etkileri ... 8 2.3.2. Antimikrobiyal Etkileri ... 8 2.4. Topikal Antibiyotikler ... 9 2.5. Antibiyotik Direnci ... 15 2.6. Bakteriler ... 17 2.6.1 Staphylococcus aureus ... 17
2.6.2. Enterococcus faecalis ve Enterococcus faecium... 18
2.6.3. Listeria monocytogenes ... 19
2.6.4. Escherichia coli ... 19
2.6.5. Klebsiella pneumoniae ... 20
ii
2.6.7. Salmonella Typhimurium ... 22
2.6.8. Stenotrophomonas maltophilia ... 23
2.6.9. Acinetobacter lwoffii ... 23
2.7. AntimikrobiyalAktivite ... 24
2.7.1. Disk Difüzyon Yöntemi ... 25
2.7.2. Mikrodilüsyon Yöntemi ... 25
2.7.3. Checkerboard Yöntemi ... 25
3. GEREÇ VE YÖNTEM ... 29
3.1. Cinnamomum zeylanicum ve Bileşenleri ... 29
3.2. Cinnamomum zeylanicum Uçucu Yağının Eldesi ... 29
3.3. Cinnamomum zeylanicum Uçucu Yağının GC-MS Analizi ... 30
3.4. Bakteri Kökenleri ... 31
3.5. Cinnamomum zeylanicum Uçucu Yağı ve Bileşenlerinin Antibakteriyel Aktivitesinin Belirlenmesi ... 31
3.5.1 Disk Difüzyon Yöntemi ... 31
3.5.2. Minimum İnhibisyon Konsantrasyon (MIK) ve Minimum Bakterisidal Konsantrasyon (MBK) Değerlerinin Belirlenmesi ... 32
3.6. Antibiyotiklerin Belirlenmesi... 33
3.6.1 Antibiyotiklerin Stok Çözeltilerinin Hazırlanması ... 33
3.6.2. Antibiyotiklerin Disk Difüzyon Sonuçlarının Belirlenmesi ... 33
3.6.3. Antibiyotiklerin MİK Değerlerinin Belirlenmesi... 34
iii
3.7.1. Cinnamomum zeylanicum Uçucu Yağı ve Topikal Antibiyotikler
Arasındaki Etkileşimlerin Belirlenmesi ... 34
3.7.2. Cinnamaldehyde ve Topikal Antibiyotikler Arasındaki Etkileşimlerin Belirlenmesi ... 37
3.7.3. Cinnamaldehyde ve Diğer Bileşenlerin Etkileşiminin Belirlenmesi ... 37
4. BULGULAR ... 38
4.1. Cinnamomum zeylanicum Uçucu Yağının GC-MS Analiz Sonuçları ... 38
4.2. Cinnamomum zeylanicum Uçucu Yağının Disk Difüzyon Sonuçları ... 38
4.3. Cinnamomum zeylanicum Uçucu Yağının MİK ve MBK Sonuçları ... 40
4.4. Cinnamomum zeylanicum Uçucu Yağ Bileşenlerinin Disk Difüzyon Sonuçları ... 40
4.5. Cinnamomum zeylanicum Uçucu Yağ Bileşenlerinin MİK ve MBK Sonuçları ... 40
4.6. Antibiyotiklerin Disk Difüzyon Sonuçları ... 43
4.7. Antibiyotiklerin MİK Sonuçları ... 44
4.8. Cinnamomum zeylanicum Uçucu Yağı-Antibiyotik Kombinasyon Sonuçları . 48 4.9. Cinnamaldehyde-Antibiyotik Kombinasyon Sonuçları ... 51
4.10. Cinnamaldehyde ve Cinnamomum zeylanicum Uçucu Yağında Bulunan Diğer Bileşenlerin Kombinasyon Sonuçları ... 55
5. TARTIŞMA ... 58
5.1. CZUY’nin GC-MS Analizi ... 58
5.2. CZUY’nin Antibakteriyel Etkinliği ... 60
5.3. Cinnamaldehyde’in Antibkteriyel Etkinliği ... 67
5.4. Cinnamyl Asetate’ın Antibakteriyel Etkinliği ... 70
iv
5.6. Isoborneol’ün Antibakteriyel Etkinliği ... 72
5.7. T-caryophyllene’in Antibakteriyel Etkinliği ... 73
5.8. A-terpinene’in Antibakteriyel Etkinliği ... 74
5.9. Eucalyptol’ün Antibakteriyel Etkinliği ... 74
5.10. D-limonene’in Antibakteriyel Etkinliği ... 75
5.11. Benzaldehyde’in Antibakteriyel Etkinliği... 77
5.12. CZUY/Cinnamaldehyde ve Antibiyotik Kombinasyonları ... 78
6. SONUÇ VE ÖNERİLER ... 86
KAYNAKLAR ... 88
v
ÖZET
Cinnamomum zeylanicum Uçucu Yağı ile Bileşenlerinin Antibakteriyel Aktivitesinin ve Topikal Antibiyotiklerle Sinerjisinin Araştırılması
Bu çalışma, Cinnamomum zeylanicum uçucu yağ bileşiminin belirlenmesi, antibakteriyel etkinliklerinin saptanması, uçucu yağ ve bileşenlerinin topikal antibiyotiklerle sinerjik etkileşim gösterip göstermeyeceğinin belirlenmesi amacıyla yapılmıştır.
Su distilasyonu ile elde edilen C. zeylanicum uçucu yağının bileşimi, GC-MS analizi ile tespit edilmiştir. Uçucu yağ ve bileşenlerinin antibakteriyel aktiviteleri, Kirby-Bauer disk difüzyon yöntemi ve sıvı mikrodilüsyon yöntemi ile belirlenirken, topikal antibiyotiklerle sinerji çalışmaları da checkerboard yöntemi ile yapılmıştır.
Bu çalışmada klinik örneklerden soyutlanan çoklu ilaç dirençli bakteriler (ÇİDB) ile standart bakteri kökenleri kullanılmıştır. Gram pozitif bakterileri temsilen Staphylococcus
aureus ÇİDB, Staphylococcus aureus ATCC 29213, Staphylococcus aureus ATCC 43300
(MRSA), Enterococcus faecalis ATCC 29212, Enterococcus faecium ATCC 6057 ve
Listeria monocytogenes F 1483 kökenleri, Gram negatif bakterileri temsilen Klebsiella pneumoniae ÇİDB, Escherichia coli ATCC 25922, Klebsiella pneumoniae ATCC 700603, Pseudomonas aeruginosa ATCC 27853, Salmonella Typhimurium ATCC 14028, Stenotrophomonas maltophilia ATCC 17666 ve Acinetobacter lwoffii ATCC 19002
kökenleri seçilmiştir.
C. zeylanicum uçucu yağı ve GC-MS analizi ile majör bileşen olduğu gösterilen cinnamaldehyde bileşeninin test edilen tüm bakteri kökenlerine karşı güçlü antibakteriyel aktiviteye sahip olduğu gösterildi. C. zeylanicum uçucu yağıtetrasiklin, neomisin ve -basitrasin kombinasyonları tüm kökenlere karşı sinerjik aktivite gösterirken, sadece cinnamaldehyde–neomisin kombinasyonu tüm bakteriler için aynı etkiyi gösterdi.
Sonuç olarak, C. zeylanicum uçucu yağı ve majör bileşeni olan cinnamaldehyde’in güçlü antibakteriyel özelliğe ve topikal antibiyotikler ile sinerjik etkileşime sahip olması, uçucu yağlar ve bileşenlerinin, her gün giderek büyüyen antibiyotik direnci sorununa çözüm arayışında, bize antibakteriyel yeni seçenekler sunabileceğini göstermektedir.
Anahtar kelimeler: Antibakteriyel Sinerji, Antibiyotikler, Cinnamaldehyde, C.
vi
ABSTRACT
Investigation of Antibacterial Activity and Synergy with Topical Antibiotics of Cinnamomum zeylanicum Essential Oil and Its Components
This study was conducted to determine the composition of Cinnamomum zeylanicum essential oil, to determine antibacterial activities, and to determine whether essential oil and its components exhibit synergistic interaction with topical antibiotics.
The composition of C. zeylanicum essential oil obtained by water distillation was determined by GC-MS analysis. The antibacterial activities of essential oil and its components were determined by Kirby-Bauer disc diffusion method and liquid microdilution method, while the checkerboard method was used to study synergy of the essential oil and its components with topical antibiotics chosen.
Multidrug resistant bacteria (MDR) isolated from clinical specimens and standard bacterial strains were used in this study. Staphylococcus aureus MDR, Staphylococcus
aureus ATCC 29213, Staphylococcus aureus ATCC 43300 (MRSA), Enterococcus faecalis
ATCC 29212, Enterococcus faecium ATCC 6057 and Listeria monocytogenes F 1483 strains representing Gram positive bacteria, Klebsiella pneumoniae MDR, Escherichia coli ATCC 25922, Klebsiella pneumoniae ATCC 700603, Pseudomonas aeruginosa ATCC 27853,
Salmonella typhimurium ATCC 14028, Stenotrophomonas maltophilia ATCC 17666 and Acinetobacter lwoffii ATCC 19002 strains, representing Gram negative bacteria, were
selected.
C. zeylanicum essential oil and the cinnamaldehyde component, indicated as the
major component by GC-MS analysis, were shown to have strong antibacterial activity against all bacterial strains tested. The combination of C. zeylanicum essential oil-tetracycline, -neomycin and –bacitracin showed synergistic activity against all strains, while only cinnamaldehyde-neomycin combination showed the same effect for all bacteria.
In conclusion, the strong antibacterial property of C. zeylanicum essential oil and its major component cinnamaldehyde, and their synergistic interactions with topical antibiotics, indicate that essential oils and their components may offer us new antibacterial options in search of a solution to antibiotic resistance problem that grows everyday.
Key words: Antibacterial Synergy, Antibiotics, Cinnamaldehyde, C. zeylanicum,
vii
SİMGELER VE KISALTMALAR DİZİNİ
ATCC : American Type Culture Collection
CDC : Centers for Disease Control and Prevention
CFU : Colony Forming Unit
CLSI : The Clinical and Laboratory Standarts Institute
CZUY : Cinnamomum zeylanicum Uçucu Yağı
ÇİDB : Çoklu İlaç Dirençli Bakteri
DMSO : Dimetilsülfoksit
ECDC : European Centre for Disease Prevention and Control
EMEA : European Medicines Agency
EUCAST : European Committee on Antimicrobial Susceptibility Testing
FİK : Fraksiyonel İnhibisyon Konsantrasyonu
FİKİ : Fraksiyonel İnhibisyon Konsantrasyon İndeksi
GAA : Glasiyel Asetik Asit
GC-MS : Gaz Kromatografisi Kütle Spektrometresi
GSBL : Geniş Spektrumlu Beta Laktamaz
HMEC-1 : Human Microvasculer Endothelial Cells
KKMHA : Koyun Kanlı Müeller-Hinton Agar
KAMHB : Katyon Ayarlı Müeller-Hinton Broth
MBK : Minimum Bakterisidal Konsantrasyonu
MCR-1 : The Mobilized Colistin Resistance Gene
MexAB-oprM : Pseudomonas Suşlarındaki Dışa Atım Pompa Sistemi
MHA : Müeller-Hinton Agar
MİK : Minimum İnhibisyon Konsantrasyonu
MRSA : Metisiline Dirençli Staphylococcus aureus
PBP : Penisilin Bağlayıcı Protein
T98G : Glioblastoma Cell Line
VRE : Vankomisin Dirençli Enterokok
viii
ŞEKİLLER DİZİNİ
Sayfa No
Şekil 2.1. FİKİ Değerlerinin Hesaplanacağı Kuyucuklar ... 27
Şekil 3.1. Clevenger Aparatı ... 29
Şekil 3.2. Shimadzu QP 2010 Plus GC – MS Analizörü ... 30
Şekil 3.3. Checkerboard İşleminde Birinci Mikroplakanın Hazırlık Şeması ... 35
Şekil 3.4. Checkerboard İşleminde İkinci Mikroplakanın Hazırlık Şeması ... 36 Şekil 3.5. Checkerboard Mikroplakasının İnkübasyon Sonrası Görünüm Şeması . 36
ix
TABLOLAR DİZİNİ
Sayfa NoTablo 2.1. Cinnamomum zeylanicum’un Taksonomisi. ... 3
Tablo 2.2.Cinnamomum zeylanicum’un Farklı Kısımlarının Kimyasal Bileşenleri 5 Tablo 2.3. FİKİ Değerlendirme Ölçütleri ... 27
Tablo 3.1. Antibiyotiklerin Hazırlanması İçin Gerekli Çözücü ve Sulandırıcılar ... 34
Tablo 4.1. CZUY’nin GC-MS Analiz Sonuçları ... 38
Tablo 4.2. CZUY’nin Disk Difüzyon Sonuçları ... 39
Tablo 4.3. CZUY’nin MİK ve MBK değerleri... 39
Tablo 4.4. CZUY Bileşenlerinin Disk Difüzyon Sonuçları ... 41
Tablo 4.5. CZUY Bileşenlerinin MİK ve MBK değerleri... 42
Tablo 4.6. Antibiyotiklerin Disk Difüzyon Sonuçları ... 46
Tablo 4.7. Antibiyotiklerin MİK Değerleri ... 47
Tablo 4.8. CZUY-Gentamisin Kombinasyon Sonuçları ... 48
Tablo 4.9. CZUY-Tetrasiklin Kombinasyon Sonuçları ... 49
Tablo 4.10. CZUY-Neomisin Kombinasyon Sonuçları ... 49
Tablo 4.11. CZUY-Fusidik asit Kombinasyon Sonuçları ... 50
Tablo 4.12. CZUY-Mupirosin Kombinasyon Sonuçları ... 50
Tablo 4.13. CZUY-Eritromisin Kombinasyon Sonuçları ... 50
Tablo 4.14. CZUY-Klindamisin Kombinasyon Sonuçları ... 51
Tablo 4.15. CZUY-Basitrasin Kombinasyon Sonuçları ... 51
Tablo 4.16. Cinnamaldehyde-Gentamisin Kombinasyon Sonuçları ... 52
Tablo 4.17. Cinnamaldehyde-Tetrasiklin Kombinasyon Sonuçları ... 52
Tablo 4.18. Cinnamaldehyde-Neomisin Kombinasyon Sonuçları ... 53
Tablo 4.19. Cinnamaldehyde-Fusidik asit Kombinasyon Sonuçları ... 53
Tablo 4.20. Cinnamaldehyde-Mupirosin Kombinasyon Sonuçları ... 53
Tablo 4.21. Cinnamaldehyde-Eritromisin Kombinasyon Sonuçları ... 54
Tablo 4.22. Cinnamaldehyde-Klindamisin Kombinasyon Sonuçları ... 54
Tablo 4.23. Cinnamaldehyde-Basitrasin Kombinasyon Sonuçları... 55
Tablo 4.24. Cinnamaldehyde-Benzaldehyde Kombinasyon Sonuçları ... 55
Tablo 4.25. Cinnamaldehyde-Eucalyptol Kombinasyon Sonuçları ... 56
Tablo 4.26. Cinnamaldehyde-α-terpinene Kombinasyon Sonuçları ... 57
1
1. GİRİŞ
1928’de penisilinin keşfedilmesi ile önceleri insan sağlığı için geliştirilen antibiyotikler ilerleyen zamanlarda hayvanların tedavisi, tarım ve endüstriyel uygulamalara kadar yayılmıştır (Fleming, 1929; Goldman, 2004; Sengeløv ve ark., 2003; WHO, 2017).
Antibiyotiklerin geniş kullanım alanı bulması; dirençli yeni bakteri türlerinin ortaya çıkması ile antibiyotiklerin etkinliğini azaltmış ve antibiyotik direnci küresel bir halk sağlığı sorunu haline gelmiştir. Enfeksiyonlara karşı birinci basamak ilaçlar etkisiz hale geldiğinde ise daha pahalı tedaviler kullanılmak zorunda olacaktır (ECDC/EMEA, 2009). Örneğin, antibiyotiklere karşı direnç gelişimi; Avrupa Birliği'nde yılda tahmini olarak 400,000 enfeksiyon vakasına, 25,000 kişinin ölümüne ve yaklaşık 1,5 milyar Euro daha fazla sağlık maliyetine neden olmaktadır (Bush ve ark., 2011; ECDC/EMEA, 2009).
Özellikle dünyanın bazı bölgelerinde tüm antibiyotiklere dirençli enfeksiyon etkenleri ortaya çıkmaya başlamıştır (Udwadia ve ark., 2012). Günümüzde yeni nesil antibiyotik araştırmaları için yapılan çalışmalar büyük ölçüde azalmış hatta neredeyse piyasada yeni nesil bir antibiyotik üretilmez duruma gelmiştir (Lewis, 2012). Bunun asıl nedeni finansal verimlilik adına; yeni nesil antibiyotiklerin geliştirilmesi üzerine odaklanmış araştırmaların mevcut antibiyotiklerin yapısında değişiklikler yapılması yönünde değişmesi olmuştur (ECDC/EMEA, 2009; Nordberg ve ark., 2005).
Önceleri önemli yan etkilerinin olduğu bilinen ilaçlar tekrar tekrar kullanılmaktaydı (Boucher ve ark., 2009). Ancak 2011 yılında, akademisyenler ve sanayi kuruluşları antibiyotik direnç gelişimindeki krizi çözmek için bir araya gelerek çözüm arayışına girmişlerdir. Önerilen olası stratejilerin başında antibiyotiklere karşı yeni alternatiflerin ve adjuvanların keşfi veya geliştirilmesi yer almıştır (Bush ve ark., 2011). Bununla birlikte, antibiyotik direnç gelişiminin önüne geçmek için birinci olasılık antibiyotiklerin diğer antibiyotik dışı ilaçlarla birlikte kombine edilerek kullanılması önerileri olmuştur (Ejim ve ark., 2011). Çünkü bazı
2
antipsikotik ve anti-inflamatuar ilaçlar in vitro antibiyotik etkinliğini artırmaktadır (Lehtinen ve Lilius, 2007; Mazumdar ve ark., 2009). Diğer bir olasılık ise antibiyotiklerin adjuvanlar ile ya da doğada rezervuar olarak bulunan aktif doğal bileşenler ile kombine edilerek uygulanması ve direnç gelişiminin engellenmesi önerisi olmuştur (Bush ve ark., 2011).
Fitokimyasallar antibiyotikler için umut verici adjuvanlar sunmakta, bu metabolitlerin antibiyotikler ile sinerjik etkileşimi araştırmacılarca değerlendirilmektedir (Hemaiswarya ve ark., 2008). Fitokimyasallar içinde özellikle bazı bitkilerden elde edilen yağlı aromatik sıvılar uçucu yağlar olarak tanımlanmakta ve güçlü antibakteriyel aktivite göstermektedir (Guenther ve ark., 1948).
Çalışmamızın çıkış noktası, sürekli artan ve ciddi boyutlara ulaşan antibiyotik direnci olmuştur. Yukarıda da bahsedildiği gibi antimikrobiyal etkinlik gösteren doğal kaynakların belirlenmesi ve antibiyotiklerle ilişkisinin araştırılması gelecekteki çalışmalara yön vermesi açısından oldukça önemlidir. Bu bağlamda, çalışmamızda Cinnamomum zeylanicum uçucu yağı (CZUY) doğal antimikrobiyal kaynak olarak seçilmiş, C. zeylanicum kabuklarından distilasyon yolu ile elde edilen uçucu yağın antibakteriyel aktivitesi; inhibisyon zonu, minimum inhibisyon konsantrasyonu (MİK) ve minimum bakterisidal konsantrasyonu (MBK) belirlenerek değerlendirilmiştir. Ayrıca elde edilen CZUY’nın GC-MS analizi yapılarak bileşenleri ve miktarları saptanmıştır.
Bu çalışmada, 5’i Gram pozitif ve 6’sı Gram negatif olmak üzere 11 standart bakteri kökeni ve 2 çoklu ilaç direnci gösteren klinik köken kullanılarak, CZUY ve içerdiği bileşenlerin antibakteriyel aktivitesi ve antibiyotiklerle ve bileşenlerin kendi arasındaki sinerjik etkileşimleri çalışılmıştır. Uçucu yağ ve bileşenlerinin antibiyotiklerle kombinasyonu checkerboard (dama tahtası) yöntemiyle araştırılmış, kombinasyon çalışmaları için topikal uygulanabilen antibiyotikler tercih edilmiştir. Uçucu yağ içeriğinde bulunan diğer bileşenlerin adjuvan özelliklerinin bulunup bulunmadığı belirlemek için de, bu maddelerle majör bileşen cinnamaldehyde arasında kombinasyon çalışması yapılmıştır.
3
2. GENEL BİLGİLER
2.1. Cinnamomum zeylanicum
Halk arasında “Darçın”, “Loğusa”, “Şerbet Kokusu” gibi adlarla bilinen tarçın, bazı Cinnamomum (Lauraceae) türlerinin kurutulmuş kabuğudur. Çin Tarçını (Cinnamomum cassiae) ve Seylan Tarçını (Cinnamomi zeylanicum) olmak üzere başlıca iki cins tarçın bulunmaktadır (Vangalapati ve ark., 2012). Cinnamon türleri Lauraceae ailesi içinde yer almaktadır ( Tablo 2.1).
Tablo 2.1. Cinnamomum zeylanicum’un taksonomisi (http://taxonomicon.taxonomy.nl/TaxonTree.aspx)
Takson Bilimsel Adı
Kingdom Plantae Subkingdom Tracheobionta Superdivision Spermatophyta Division Magnoliophyta Class Magnoliopsida Subclass Magnoliidae Order Laurales Family Lauraceae
Genus Cinnamomum Schaeff.
Species Cinnamomum zeylanicum
Dünyada bazı bölgelere dağılmış olarak yaklaşık 250 farklı Cinnamon türü tespit edilmiştir (Sangal, 2011; Vangalapati ve ark., 2012). En fazla üretimin yapıldığı bölgeler; Sri Lanka, Güneydoğu Hindistan, Endonezya, Güney Amerika ve Batı Hint Adalarıdır. Dünyadaki tarçın üretiminin %90’ı Sri Lanka’da yapılmaktadır (Vangalapati ve ark., 2012).
2.1.1. Tarihçe
Uçucu yağ içeren bitkilerin kullanımı çok eski zamanlara dayanmaktadır. Örneğin, Sümer tabletlerinde aromatik bitkilerden söz edilmektedir. Hipokrat, Galen,
4
İbn-i Sina gibi ünlü bilim insanları aromatik bitkiler ve bu bitkilerin uygulama yöntemleri ile ilgili çalışmalar yapmıştır. Yapılan bu çalışmalar bugün yapılanlara temel oluşturmuştur (Berk, 1953).
Aromatik kokulu cinnamon kabuğuna ait bilgilere eski Mezopotamya, Roma, Hint, Çin, Yunan ve Latin yazıtlarında sıklıkla rastlanmaktadır. Bu belgelerde rastlanan tarçın türünün M.Ö. 2700’den beri bilinen Çin tarçını (Cinnamomi cassiae) olduğu ve daha kalın kabuklu, daha az aromatik olan bir tür olduğu düşünülmektedir. 13. yüzyıla kadar Seylan’da tarçın yetiştiğine dair bir bulguya rastlanmamıştır. Seylan’da tarçın kültürü yapılması, Hollandalıların 1770’te Seylan’ı işgali ile başlamıştır (Gürson ve Özçelikay, 2015).
2.1.2. Kullanımı
C. zeylanicum baharat olarak tüketilmesinin yanı sıra ilaç, parfümeri, kozmetik ve gıda sektöründe de oldukça fazla miktarda kullanılmaktadır. Özellikle güçlü antimikrobiyal etkisinden dolayı çeşitli gıdalarda koruyucu katkı maddesi olarak tercih edilmektedir (Huang ve ark., 2007).
2.2. Cinnamomum zeylanicum Uçucu Yağı
Uçucu yağlar bitkilerin, çiçek, yaprak, gövde, kabuk, kök, meyve ve tohum gibi kısımlarından elde edilmektedir. Normal koşullarda sıvı, uçucu, kokulu ve yağımsı karışımlardır. Uçucu yağlar bilinen bitkisel yağlardan farklı olmakla birlikte, emici bir kâğıda damlatıldıklarında hiçbir iz bırakmadan uçmaları ile ayrılmaktadır. Genel olarak bitkilerin taşıdığı uçucu yağ oranı %10 ile %0,01 arasında değişmektedir (Toroğlu ve Çenet, 2006).
2.3. Cinnamomum zeylanicum Uçucu Yağ Bileşenleri
Bitkilerden elde edilen uçucu yağların bileşimi, coğrafi, mevsimsel, iklimsel, tür düzeyinde ve yağ çıkarma yöntemlerindeki farklılıklara göre değişiklik gösterme eğilimindedir (Santoyo ve ark, 2006). Bu durum uçucu yağların antibakteriyel etkinliğini değiştirebilir. Antimikrobiyal etkinliği yorumlamak için, uçucu yağ içinde
5
bulunan tüm bileşenlerin birbiri ile olan etkileşimleri de değerlendirilmelidir (Bassolé ve Juliani, 2012; Van Vuuren ve Viljoen, 2011). En iyi çalışılan uçucu yağlardan biri Cinnamomum zeylanicum uçucu yağıdır (CZUY) ve doğal bileşenleri olan cinnamaldehyde ve cinnamic acid güçlü antimikrobiyal aktivite göstermektedir (Woehrlin ve ark., 2010).
CZUY’de majör bileşen olarak cinnamaldehyde, daha düşük oranlarda ise benzaldehyde, cinnamyl asetate, limonene, eugenol, α-pinene, 1,8 cineole, linalool ve cinnamic acid gibi diğer bileşenlerin yer aldığı bildirilmiştir (Ünlü ve ark., 2010). Tablo 2.2.’de görüleceği üzere, uçucu yağ içerikleri bitkinin çeşitli bölgelerinde farklı oranlarda bulunabilmektedir (Vangalapati ve ark., 2012). Çalışmamızda kullandığımız CZUY’nin GC-MS analizi ile belirlenen kimyasal bileşenleri aşağıda verilmiştir.
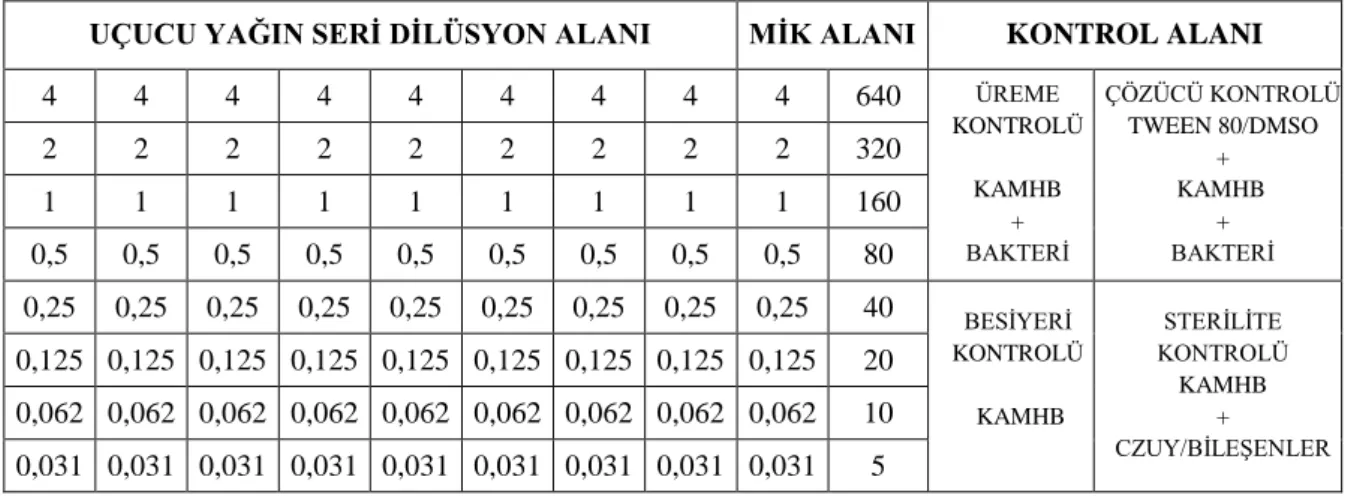
Tablo 2.2. C. zeylanicum farklı kısımlarının kimyasal bileşenleri
Bitkinin bölgeleri Bileşenleri
Yaprak Cinnamaldehyde: %1-5
Euganol: %70-95
Kabuk Cinnamaldehyde: %65-80
Euganol: %5-10
Kök kabuğu Camphor : %60
Meyve Trans - cinamyl asetate: %42-54
Caryophyllene: %9-14 C. zeylanicum tomurcukları Terpene Hidrocarbons: %78 α-Bergamotene: %27,38 α-Copaene: %23,05 Oxygeneted terpenoids: %9 C. zeylanicum çiçekleri (E)-cinamyl asetate: %41,98 Trans α-Bergamotene: %7,97 Caryphyllene oxide: %7,20
6
Cinnamaldehyde
Tarçına tadını ve kokusunu veren bir aldehit türevidir. Cinnamon bitkisinin kabuğundan elde edilen uçucu yağ içeriğinde majör olarak bulunmaktadır. Güçlü antimikrobiyal etkiye sahiptir (http://www.hmdb.ca/metabolites/HMDB03441).
Cinnamyl asetate
CZUY içeriğinde bulunmasının yanında diğer tarçın türlerinden ve fesleğen bitkisinden elde edilen uçucu yağda da bulunmaktadır. Ayrıca guava bitkisinin meyve ve kabuğunda, kavun ve çilekte de bulunmaktadır. Cinnamyl asetat tat verici bir katkı maddesidir ve fenilpropenler ailesine aittir.
(http://www.hmdb.ca/metabolites/HMDB29699)
Coumarin
Pek çok bitkide bulunan, özellikle tonka fasulyesi, tarçın, melilot (tatlı yonca), yeşil çay, nane, kereviz, yaban mersini, lavanta, kereviz gibi doğal bitkiler, doğal baharatlar ve gıdalarda bulunan bir bileşiktir. Tatlı bir kokusu olup, çeşitli antikoagülanların, özellikle de varfarinin öncüsü olarak klinik değeri vardır.
(http://www.hmdb.ca/metabolites/HMDB01218)
Isoborneol:
Bir aroma maddesidir ve bisiklik monoterpenler ailesine aittir. Bunlar, birbirlerine kaynaşmış iki halka içeren monoterpenlerdir. Borneol keskin camphor benzeri bir kokuya sahip ve beyaz renklidir. Kolayca yanar. Sudan biraz daha yoğun ve suda çözünmez. Parfüm yapmak için kullanılır.
(http://www.hmdb.ca/metabolites/HMDB35819)
Alfa-copaene
Alfa-copaene, seskiterpenoidler olarak bilinen organik bileşik sınıfına aittir. Bunlar üç ardışık izopren birimi olan terpenlerdir.
7 (http://www.hmdb.ca/metabolites/HMDB61851)
Trans-caryophyllene
Tüm baharatlarda bulunur. Baharatların dışında Jasminum, Origanum ve Pimpinella cinsi bitkilerde yaygın olarak bulunur.
(http://www.hmdb.ca/metabolites/HMDB36792)
Alfa-terpinene
Tüm baharatlarda bulunan -terpinene, narenciye, ökaliptüs, Juniperus türleri ve Litsea ceylanica gibi pek çok uçucu yağın bileşeni olup tatlandırıcı bir maddedir. Terpinenler, terpenler olarak sınıflandırılan üçlü izomerik hidrokarbonlar olup, her biri aynı molekül formülüne ve karbon iskeletine sahiptir, ancak karbon-karbon çift bağlarının konumlarında farklılık gösterir. -terpinene, kakule ve marjoram yağlarından ve diğer doğal kaynaklardan soyutlanmıştır.
(http://www.hmdb.ca/metabolites/HMDB36995)
Eucalyptol
Renksiz organik bir bileşik olan eucalyptol siklik bir eter ve monoterpendir. Eucalyptol, birçok aromatik bitkinin doğal bir bileşeni ve uçucu yağ fraksiyonudur. Eucalyptol ile ilgili toksikolojik veriler oldukça sınırlıdır. Beşten fazla sigara şirketi tarafından yayımlanan bir raporda, eucalyptol, sigaraya eklenen 599 katkı maddesinden biri olarak listelenmiştir.
(http://www.hmdb.ca/metabolites/HMDB04472)
D-limonene
Oda sıcaklığında berrak, renksiz, sıvı bir monoterpen olup, portakal yağı içindeki ana bileşendir. Limonene yaygın olarak lezzet ve koku artırıcı olarak kullanılmaktadır. Limonene, düşük toksik etkisi olan bir çözücüdür. Limonene maruz kalındığında hafif cilt tahrişi meydana gelebilir, limonene oksidasyon ürünleri dermal sensitizasyona neden olabilir, tahriş edici ve bronkokonstriktif hava yolu
8
etkilerine sahip olabilir; Limonene’in hiyalin damlacık nefropatisi olarak tanımlanan sıçan spesifik böbrek toksisitesine sahip olduğu gösterilmiştir. Limonene, kansere karşı koruyucu olduğu görünen, diyette kullanılan fitokimyasal maddelerin aktif bileşenlerinden biridir. (http://www.hmdb.ca/metabolites/HMDB04321)
Benzaldehyde
Kozmetikte denatüre edici, tatlandırıcı ve parfüm olarak kullanılan aromatik bir aldehittir. En yüksek kullanım konsantrasyonu parfümlerde % 0,5’dir. Benzaldehyde, ABD'nde genel olarak güvenli gıda katkı maddesi ve Avrupa Birliği'nde aroma maddesi olarak kabul edilmektedir. Benzaldehyde cilt yoluyla emilir ve akciğerler tarafından, iyi perfüze edilmiş tüm organlara dağıtılır, ancak belli bir dokuda birikmez. Benzoik aside metabolize edildikten sonra, glisin veya glukuronik asit ile konjuge olur ve idrarla atılır. Çeşitli çalışmalar ile benzaldehyde’in karsinostatik veya antitümör özelliklere sahip olabileceğini ileri sürülmüştür. Genel olarak, kozmetikte kullanılan konsantrasyonlarda, benzaldehyde insanlar için kanserojen bir risk oluşturmamaktadır.
(http://www.hmdb.ca/metabolites/HMDB06115)
2.3.1. Biyolojik Etkileri
CZUY birden fazla biyolojik aktivite göstermektedir. CZUY, antioksidan (Mancini ve ark., 1998; Shobana ve Akhilender Naidu, 2000; Mathew ve Abraham, 2006a; Mathew ve Abraham, 2006b; Kim ve ark., 1993), antidiabetik (Kim ve ark., 2006; Jia ve ark., 2009; Jarwill Taylor ve ark., 2001; Lu ve ark., 2011; Subash Babu ve ark., 2007; Onderoglu ve ark., 1999; Bandara ve ark., 2012), kolesterol düzenleyici (Amin ve El-Twab, 2009), kolon sağlığını düzenleyerek kolon kanseri riskini azaltıcı (Wondrak ve ark., 2010), pıhtılaştırıcı özelliği ile kanamayı önleyici (Hossein ve ark., 2013), uterustaki kan dolaşımını artırıcı ve doku rejenerasyonunu geliştirici, (Minich ve Msom, 2008), anti-inflamatuar (Chao ve ark., 2005; Tung ve ark., 2008; Tung ve ark., 2010), antinematodal (Park ve ark., 2005; Kong ve ark., 2007), sivrisinek larvasidal (Cheng ve ark., 2004), insektisit (Cheng ve ark., 2009) gibi geniş bir spektrumda etkilere sahiptir.
9 2.3.2. Antimikrobiyal etkileri
CZUY’nin sahip olduğu uçucu yağ ve içerdiği kimyasal bileşenlerin güçlü antimikrobiyal (Hili ve ark., 1997; Chang ve ark., 2001; Wang ve ark., 2005; (Prabuseenivasan ve ark., 2006; Matan ve ark., 2006; Gende ve ark., 2008; Ünlü ve ark., 2010) etkileri bulunmaktadır.
Uçucu yağ bileşenleri için önerilen spesifik hedeflerden birisi, antibiyotik direncinden sorumlu olduğu düşünülen ve hücre membranında bulunan efflux sisteminin inhibe edilmesidir (Johny ve ark., 2010; Shahverdi ve ark., 2007). Efflux sisteminin inhibe edilmesinde büyük alkoloidal ve lipofilik moleküllerin rol aldığı tahmin edilmekle birlikte membran hasarı ve metabolik yolların bozulmasının da etkili olduğu düşünülmektedir (Gibbons, 2008). Aynı zamanda çeşitli enzimlerin üretiminin inhibe edilmesi ya da aktivitelerinin azaltılmasında uçucu yağlar etkili görev almaktadır. Cinnamaldehyde’in bulundurduğu karbonil grubunun, bazı proteinleri bağlayarak bakterilerin aminoasit dekarboksilasyon fonksiyonlarını inhibe etmesi, uçucu yağların bu etkilerine örnek verilebilir (Wendakoon ve Sakaguchi, 1993; Wendakoon ve Sakaguchi, 1995).
2.4. Topikal Antibiyotikler
Birçok antibakteriyel madde, başta deri ve yumuşak dokuyu ilgilendiren çeşitli enfeksiyonların önlenmesi ve tedavisi için topikal olarak uygulanmaktadır. Topikal antibiyotiklerin ilk hedef organı deridir ve daha sonra değişen miktarlarda emilerek vücuda yayılmaktadır. Sistemik antibiyotiklerin tersine, ilacın konsantrasyonu deri yüzeyinden deri altına doğru azalmakta ve bu nedenle patolojik olay epidermis ya da papiller dermiste ise, topikal uygulama avantaj sağlamaktadır (O’Donnel ve Tunkel, 2005).
Gentamisin, tetrasiklin, basitrasin, neomisin, fusidik asit, mupirosin, klindamisin ve eritromisin, gibi antibiyotikler bu amaçla kullanılmaktadır (İşgör ve Sultan, 2007).
10
Gentamisin ve Neomisin
Gentamisin ve neomisin aminoglikozid grubunda yer alan antibiyotiklerdir. Gentamisin, ilk olarak 1963 yılında Micromonospora purpurea ve Micromonospora echinospora'dan, neomisin ise 1949 yılında Streptomyces fradiae’den elde edilmiştir. Her iki antibiyotik de Gram pozitif ve Gram negatif bakterileri kapsayan geniş bir spektrumda kullanılmaktadır (Waksman ve Lechevalier, 1949; Gilbert, 1995). Gentamisin oral, parenteral ve topikal olarak, neomisin ise, sistemik uygulandığında ciddi toksisite göstermesi nedeniyle sadece bağırsak sterilizasyonu için oral olarak kullanılmaktadır. Neomisin, bu nedenle genellikle topikal olarak uygulanmaktadır (Köksal, 2009).
Gentamisin ve neomisin, bakterilerde ribozomların 30S alt birimine bağlanarak mRNA’nın yanlış okunmasına ve bunun sonucunda bakterinin ölümüne yol açmaktadır. Gentamisinin klinik kullanım alanları, diğer antibiyotiklere dirençli Gram negatif bakterilerle oluşan enfeksiyonlar ve nötropenik hastalardaki hastane enfeksiyonları, komplike üriner sistem enfeksiyonları, sepsis, peritonit ve diğer intra-abdominal enfeksiyonlar, endokardit, neonatal sepsis ve deri ve yumuşak doku enfeksiyonları, oküler enfeksiyonlar, otitis eksterna gibi enfeksiyonları içerir (Pancoast, 1988; Montie ve Patamasucon, 1995). Neomisin ise deri enfeksiyonları, göz ve kulak yolu enfeksiyonlarında etkili olarak kullanılmaktadır. Bazı antidiyareiklerin içinde yer almaktadır. Genellikle cilt enfeksiyonlarında basitrasin ile kombine edilerek kullanılmaktadır (O’Donnel ve Tunkel, 2005). Tüm antibiyotiklerde olduğu gibi, aminoglikozidlere karşı direnç de giderek artmaktadır. Aminoglikozid antibiyotiklerin tekrarlayan tekli kullanımı, yeni direnç mekanizmalarının gelişmesine ve direnç insidansının artmasına neden olmaktadır (Garneau-Tsodikovaa ve Labby, 2016).
Tetrasiklin
Tetrasiklinler bugün bir grup antibiyotiğe verilen genel isim olup, tetrasiklin de bu antibiyotiklerden biridir. Tetrasiklin, Streptomyces rimosus’dan üretilen yarı sentetik bir antibiyotiktir. Birçok bakteriyel enfeksiyonlarda kullanılır. Tetrasiklin,
11
geniş spektrumlu antibiyotik olarak tanımlanmaktadır. Bakteriyostatiktir ancak yüksek konsantrasyonda bakterisid olabilirler. Gram pozitif ve Gram negatif patojenlere, mikoplazmalara, hücre içi klamidyalara, riketsiyalara ve protozoonlara kadar geniş bir yelpazede etkili olurlar (Chopra ve ark., 1992).
Tetrasiklin pasif difüzyon ve enerjiye bağlı aktif transport sistemi ile bakteriyel hücre duvarını aşmakta ve 30S ribozomal alt birimine bağlanarak etkili olmaktadır. Bu bağlanma, aminoaçil-tRNA’nın RNA-ribozom kompleksine bağlanmasını önleyerek protein sentezini bloke etmesine neden olmaktadır. Tetrasiklin ayrıca sitoplazmik membranı değiştirmekte ve nükleotidler ile diğer komponentlerin hücre dışına sızmasına yol açmaktadır (Schnappinger ve Hillen, 1996; Stein ve Craig, 2006). Genel olarak oral, parenteral ve topikal olarak kullanılan tetrasiklin, genellikle vücut sıvılarına ve dokulara orta derecede nüfuz etmekte ve idrarla atılmaktadır. Ayrıca topikal kullanımda yara ve yumuşak doku enfeksiyonları ile sebum içine nüfuz ederek ve terleme ile atılarak akne tedavisinde etkili olmaktadır (Chopra ve ark., 1992).
Bu antibiyotiğe direncin ortaya çıkması nedeniyle glisilsiklinler, daktilosiklin, tigesiklin gibi tetrasiklinlerin yeni türevleri geliştirilmeye devam edilmektedir (Mcmurry ve Levy, 2000). Ancak tetrasiklinin çok yaygın kullanılmasına bağlı olarak direnç gelişimi görülmektedir (Taşova, 2010).
Basitrasin
İlk olarak 1945 yılında Bacillus licheniformis bakterisinden elde edilmiş peptit bağlı aminoasitlerden oluşan peptid bir antibiyotiktir. Önceleri şiddetli stafilokokal enfeksiyonların tedavisinde önerilmesine karşın günümüzde sistemik toksisitesi nedeniyle topikal kullanımla kısıtlanmıştır (Köksal, 2009). Basitrasin, bakteriyel hücre duvarı sentezinin başlangıç basamağı olan C55-pirenol pirofosfat yapısına bağlanarak hücre duvar sentezini etkisiz kılmaktadır. Ayrıca bakteriyel sitoplazmik membranı bozmaktadır (Köksal,2009).
Basitrasin özelikle stafilokoklar ve A grubu beta hemolitik streptekoklar olmak üzere Gram pozitif bakterilere etkilidir. Buna karşın C ve G streptokoklara etkinliği azdır ve grup B streptekoklar dirençlidir. Neisseria türleri duyarlı iken Gram
12
negatif basiller dirençlidir (Finland ve ark., 1976). Basitrasin sıklıkla kremler, merhemler, antibiyotik spreyler pudralar, yara veya mesane irrigasyon solüsyonları gibi değişik topikal preparatlarda kullanılmaktadır. Topikal kullanıldığında önemli sistemik absorpsiyonu yoktur. Ancak seröz kavitelere yüksek doz irrigasyon yapıldığında sistemik toksisite gelişebilmektedir (Köksal, 2009). Basitrasin topikal olarak, neomisin, polimiksin B veya her ikisi ile kombine edilerek kullanılmaktadır. Oral olarak verildiğinde Clostridium difficile kolitinin tedavisinde etkili olmaktadır (Dudley ve ark., 1986). Basitrasin, stafilokokların nazal taşıyıcılığı ve impetigo için de kullanılmaktadır (O’Donnel ve Tunkel, 2005).
Fusidik asit
Fusidik asit, 1962 yılında Fusidium coccineum’dan elde edilen ve yaklaşık elli beş yıldır Staphylococcus aureus enfeksiyonlarının tedavisinde kullanılan dar spektrumlu bir antibiyotiktir (Verbist, 1990). Uzama faktörü G, protein sentezi sırasında peptit bağ oluşumundan sonra bakteriyel ribozom üzerinde translokasyon için gerekli olan bir bakteri proteinidir. Fusidik asit, bu proteine ve ribozoma bağlanarak bakterinin protein sentezini inhibe etmektedir. Fusidik asidin etkisi büyük oranda bakteriyostatiktir ancak yüksek konsantrasyonlarda kullanıldığında bakterisidal olabilmektedir (Verbist, 1990).
Fusidik asit, Corynebacterium, Nocardia, anaeroblar ve Neisseria türlerini içeren bir spektruma sahiptir, ancak genellikle antistafilokokal ajan olarak, MRSA enfeksiyonu ve kolonizasyonunun sistemik tedavisinde, deri ve yumuşak doku enfeksiyonlarının topikal tedavisi ile atopik dermatitin topikal tedavisinde kullanılmaktadır (Dobie ve Grey, 2004; Collignon ve Turnidge, 1999). Fusidik asit, sağlam ve zedelenmiş deriye penetre olabildiği için tedavide avantaj sağlamaktadır. Ayrıca piyodermi ve impetigo ile nazal taşıyıcılık eradikasyonunda da kullanılan önemli bir antibiyotiktir (O’Donnel ve Tunkel, 2005). Fusidik aside direnç oranlarında artış saptanmaktadır. Derin doku enfeksiyonları ve MRSA kontrolü gibi önemli endikasyonlarda fusidik asit etkisiz kalmaktadır. Ülkemizde yapılan birçok çalışmada fusidik asidin direnç oranları %10’nun altında bulunmuştur. Direnç gelişiminin azaltılması için bölgesel duyarlılık oranlarının yakından takip edilerek
13
fusidik asit kullanımının ayaktan hastalar için sınırlandırılması önerilmektedir (Dobie ve Grey, 2004; Yaman ve ark., 2010).
Mupirosin
Pseudomonas fluorescens’ten 1971 yılında üretilen mupirosin (pseudomonik asit A), Gram pozitif bakteriler ve özellikle Staphylococcus aureus’un neden olduğu yüzeyel enfeksiyonların tedavisinde topikal bir ajan olarak kullanılmaktadır. Mupirosin, izolözil-tRNA sentetaz inhibisyonu yoluyla bakteriyel protein sentezini önleyerek etki göstermektedir. Oral ve parenteral uygulandığında iyi absorbe olmakla birlikte metabolik yıkımının hızlı olması nedeniyle topikal kullanımı tercih edilmektedir (Hurdle ve ark., 2005).
Nazal taşıyıcılık kontrolü, yüzeyel stafilokok enfeksiyonları ve impetigo tedavisinde ilk tercih edilen antibiyotiklerden biridir. Klinik kullanıma 1985 yılında girmesinden iki yıl sonra ilk dirençli olgu bildirilmiştir. Türkiye’de ise 1991 yılında kullanıma girmiştir (Park ve ark, 2006; Gündüz ve ark. 2005). Tedavi veya profilaktik amaçla kullanılan mupirosine direnç gelişimini engellemek için antimikrobiyal duyarlılık testinin yapılması ve sonuçlar dikkate alınarak tedavi uygulanması gerekmektedir (Vardar-Ünlü ve ark., 2006).
Eritromisin
Makrolid grubu antibiyotiklerin ilk üyesidir. Eritromisin, Streptomyces erythraeus’tan üretilen doğal bir makroliddir. 1952 yılında kullanıma girmiş ve direnç gelişimi arttıkça yeni türevleri üretilmiştir (Haight ve Finland, 1952; Sivapalasingam ve Steigbigel, 2005). Eritromisin bakyeriyostatik olup, protein sentezini inhibe etmektedir. Duyarlı organizmaların 50S ribozomal alt birimindeki 23S rRNA’ya reversible bağlanarak polipeptid zincir elangasyonunun translokasyonunu bloke etmektedir. Eritromisin topikal, parenteral ve oral kullanılmaktadır. Oral kullanım sonrası eritromisin mide asidi ile hızla inaktif olabilmektedir. İntravenöz kullanımda daha yüksek konsantrasyonlara ulaşabilmektedir. Eritromisinin dokulara dağılımı mükemmeldir ve serum konsantrasyonun 10-100 katına ulaşabilmektedir (Köksal, 2009).
14
Eritromisin, Gram pozitif ve bazı Gram negatif bakteriler, anaeroplar, mikoplazmalar, treponemalar, ve riketsiyalara etkili olan nispeten geniş spektrumlu bir antibiyotiktir ve stafilokoklar ve Streptococcus pneumoniae’da dahil olmak üzere streptokoklara iyi etki göstermektedir. Sifiliz ve gonore tedavilerinde penisiline alerjisi olan hastalarda eritromisin kullanılmaktadır. Eritromisinin yan etki insidansı nispeten düşüktür. Ancak günümüzde eritromisinin yüksek oranda kullanılmasına bağlı olarak özellikle MRSA ve MSSA kökenleri için yüksek direnç oranları bildirilmektedir (Köksal, 2009; Yüksekkaya ve ark, 2017).
Klindamisin
Klindamisin, Streptomyces lincolnensis’ten elde edilen linkomisinin kimyasal modifikasyonu ile elde edilmiştir. Klindamisin oral, parenteral ve topikal olarak kullanılabilmektedir (McGehee ve ark., 1968). Bu antibiyotik 50S ribozomal alt birime bağlanarak peptid zincirinin uzamasını engellemekte ve protein sentezini baskılamaktadır. Klindamisin, ilaç konsantrasyonu, bakteri türü ve bakteri yoğunluğuna bağlı olarak bakteriyostatik veya bakterisidal olabilmektedir (Leclercq, 2002).
Oral kullanım dozunun yaklaşık %90’ı bağırsaklardan geri emilmekte ve gıdalardan etkilenmemektedir. Kemik, akciğer, plevral sıvı ve safraya iyi dağılmakta fakat menenjt olgularında BOS’a iyi penetre olamamaktadır (Leigh, 1981). Klindamisin en sık kullanılan topikal antibiyotiktir. Toplum kökenli MRSA enfeksiyonlarında, karbonkül ve fronkül, erizipel, selülit, nekrotizan fasit (kombine), klostriyal miyonekroz, piyomiyozit ve Acne vulgaris’te sıklıkla tercih edilmektedir (Tan, 2004). Penisilin alerjisi olanlarda penisiline alternatif olarak kullanılmaktadır (Stevens ve ark., 2005). Klindamisin, metisilin duyarlı stafilokoklar, Streptococcus pneumoniae, grup A ve viridans streptokoklara karşı etkilidir (Leigh, 1981). Enterokoklar ve tüm Enterobacteriaceae’ler klindamisine dirençlidir. Bacteriodes fragilis grup üyeleri ve Clostridium perfiringens dahil anaeroplara en etkili antibiyotiktir (Leigh, 1981). Sık tercih edilen bir antibiyotik olmasından dolayı direnç oranlarında artış görülmektedir. Özelikle MRSA kökenlerinde direnç oranı %50’nin üzerinde bulunmaktadır (Yaman ve ark., 2017).
15 2.5. Antibiyotik Direnci
Antibiyotik terimi genel olarak doğada bulunan ve bazı mikroorganizmaların üremesini durduran maddeler anlamına gelmektedir. Uzunca bir süredir insanlığa büyük faydaları olan bir ilaç grubudur. Antibiyotik terimi ilk kez Waksman ve Woodruff (1941) tarafından kullanılmıştır. Ancak antibiyotik çağının kapıları 1928 yılında Sir Alex Flemming’in Penicillium notatum küfünün bakterileri öldürdüğünü bulmasıyla açılmış, 1948 yılında penisilinin ilaç olarak kullanıma başlanmasıyla da antibiyotiklerin altın çağı başlamıştır (Llarrull ve ark., 2010). 1950-1970 yıllarında birçok antibiyotik keşfedilmiş ve kullanılmaya başlanmıştır. Ancak 1980’li yıların sonuna gelindiğinde geliştirilen yeni antimikrobiyal maddelerin sayısı oldukça azalmaya başlamıştır. Bu durumun meydana gelmesindeki en büyük etkenler, onaylanan her antibiyotiğin ilaç şirketleri için yüksek araştırma-geliştirme maliyeti getirmesi, enfeksiyonların kısa süreli tedavi gerektirmesine karşın, kronik hastalıkların tedavisinin yaşam boyu sürebilmesi, yeni ajanlara rakip olabilecek ve ruhsatlandırılmış durumda çok sayıda antibiyotik olması ve direnç gelişmesi kaygısıyla yeni geliştirilmiş geniş spektrumlu ajanların ilk seçenek olarak kullanılmalarının önlenmesi şeklinde sayılabilir (IOM, 2010).
Diğer taraftan en önemli sorun giderek artan antibiyotik direncidir ve bunun en büyük nedeninin aşırı ve gereksiz antibiyotik kullanımı olduğu düşünülmektedir. Doğada bile mantarlar ile bakteriler arasındaki ilişki incelendiğinde mantarların savunma mekanizması olarak kullandıkları antibiyotik özellikteki maddeleri düşük konsantrasyonlarda ürettikleri görülmektedir. Ancak içinde bulunduğumuz zaman diliminde antibiyotikler tıptaki kullanımından daha fazla miktarda tarımda ve hayvancılık sektöründe kullanılmaktadır (Davey ve ark., 2013; Hollis ve Ahmad, 2013). Örneğin ABD’de hayvancılık sektöründe kullanılan antibiyotik miktarı günlük 51 tondur. Bu şekilde hayvanların dışkıları ile çevreye yayılan dirençli Clostridium kökenlerinde artış görülmektedir (SAGACMPVU, 2009).
Tıp alanında da aşırı miktarda antibiyotik kullanımı direnç gelişimini artırmaktadır. Ortamda ne kadar fazla miktarda antibiyotik varsa, dirençli bakterilerin bakteri popülasyonunda egemen hale gelmesi de paralel şekilde artmaktadır. Bu nedenledir ki özellikle yoğun bakım ünitelerinde ve yanık ünitelerinde nazokomiyal enfeksiyonlara neden olan bakterilerde direnç oranı yüksek bulunmaktadır. Bakteriler
16
aşırı antibiyotik kullanımına bağlı olarak, PBP modifikasyonu, GSBL üretimi, efflux (dışa atım) pompaları gibi çeşitli savunma mekanizmaları geliştirmektedir. En son geliştirilen antibiyotikler arasında olan karbapenem grubuna karşı da bakteriler tarafından karbapenemaz enzimleri üretilmeye başlanmıştır (Gündem ve ark., 2013).
Tek bir antibiyotiğe karşı direnç gelişmesi tek bir antibiyotik sınıfının hatta bazen birden fazla antibiyotik sınıfının etkisiz kalmasına neden olmaktadır (ECDC/EMEA, 2009). Antibiyotik direnci intrensek (doğal) ya da sonradan kazanılmış olabilmektedir ve mekanizmalarına göre farklı kategorilere ayrılmaktadır.
Bakteriler antibiyotiklerin yapısını bozan ya da değiştiren enzimler üretmektedir. Örneğin, bakterilerin ürettiği beta laktamaz enzimlerinin penisilinleri ve diğer beta laktam antibiyotikleri parçalayarak etkisiz kılması gibi.
Antibiyotiğin hedef bölgesinde meydana gelen modifikasyon sonucu, ilgili antibiyotik etkisiz bir bölgeye bağlanabilmektedir. Örneğin, MRSA’da penisilin bağlayan protein hedef bölgesinin modifikasyonu gibi.
Az miktar bulunan bazı antibiyotikler hücreden çıkarılabilmekte ya da dışa pompalanabilmektedir. Örneğin, Pseudomonas spp. de olduğu gibi.
Antibiyotiğe karşı dirençli olan farklı bir hedef bölge bakteri tarafından üretilebilmektedir. Örneğin Trimetoprim dirençli E. coli’de hedef enzimin aşırı miktarda üretilmesi gibi (Huovinen, 2001; Sheldon, 2005).
Gram negatif bakterilerde hücrede oluşan toksinlerin dışarı atılmasını sağlayan dışa atım pompaları doğal bir direnç mekanizması olarak çeşitli deterjanlara ve antibiyotiklere karşı direnç gelişiminde önemli rol oynamaktadır (Lehtinen ve Lilius., 2007; Ma ve ark., 1994; Nikaido, 2001).
Bütün bu nedenlerden dolayı günümüzde tüm antibiyotiklere dirençli bakteriler ortaya çıkmaya başlamış, “super bug” olarak adlandırılan ve kolistin dahil tüm antibiyotiklere dirençli olan bakterilerde söz konusu dirençten sorumlu gen, MCR-1 olarak saptanmış ve ilk olarak Kasım 2015’te Çin’den bildirilmiştir. Bunun üzerine CDC, ABD’de MCR-1 geni taşıyan bakterileri araştırmaya başlamış, Çin’den
17
bildirilen vakadan altı ay sonra Amerika’nın Pensilvanya eyaletinde MCR-1 geni taşıyan ilk bakteri tespit edilmiştir (CDC, 2017).
2.6. Bakteriler
2.6.1. Staphylococcus aureus
Micrococcaceae familyasına ait olan ve doğada çok yaygın olarak bulunan bu bakteriler insan ve hayvanlar için patojen olabilir (Kilpper ve ark.,1980). Bu cinsin üyeleri 0,5-1,5µm çapında, düzensiz kümeler ve üzüm salkımı oluşturan Gram pozitif kok görünümündedir. Sporsuz, hareketsiz, genellikle kapsülsüz, katalaz pozitif ve fakültatif anaerobik bakterilerdir. Optimal üreme sıcaklığı 30-37o
C ve pH’sı 7,4 dür. Önemli bir patojen olan Staphylococcus aureus türü diğer stafilokoklardan koagülaz pozitifliği ile ayrılır. Krem rengi, sarı-portakal rengi pigment oluşturan, düzgün, hafif kabarık olan S. aureus kolonileri kanlı agarda geniş hemoliz oluşturur. Isıya ve kuruluğa oldukça dayanıklıdırlar (Gümral, 2009).
Normal insanların, hastane çalışanlarının ve tedavi altında olan hastaların burun mukozasında yerleşebilen S. aureus en önemli nazokomiyal etkenlerindendir. Stafilokoklar fronkül, selülit ve impetigo gibi cilt ve yumuşak doku enfeksiyonları, kemik, eklem, kalp kapağı, dalak ve karaciğer, akciğer ve üriner sistem enfeksiyonları gibi derin enfeksiyonlara neden olur. Toksine bağlı olarak besin zehirlenmesi, haşlanmış deri sendromu ve toksik şok sendromu görülebilir (Gümral, 2009).
Stafilokok enfeksiyonlarında tedavi, antibiyogram testi sonucuna göre uygun antibiyotik seçimi yapılarak yapılır. Metisiline dirençli Staphylococcus aureus (MRSA) kökenlerinin ortaya çıkması ile birlikte, çoklu antibiyotik direncine sahip bu bakteriler için vankomisin önerilmekteydi (CDC, 2004a). Günümüzde vankomisine dirençli kökenlerin de hızla artmasıyla tedavide yeni antibiyotiklerden daptomisin ve linezolid kullanılabilmektedir (Anstead ve Owens, 2004). Yüzeyel enfeksiyonların tedavisinde ve nazal taşınmanın önlenmesinde topikal bir ajan olarak kullanılan mupirosine karşı da dirençli kökenlerin artmakta olduğu bildirilmektedir.
18
2.6.2. Enterococcus faecalis ve Enterococcus faecium
Enterokoklar uzun yıllar Streptococcus cinsi içinde kabul edilmiş, ancak kimyasal ve fiziksel ajanlara dirençli olmaları ile Streptococcus cinsinden ayrılmış ve yeni cins olarak tanımlanmıştır. Gram pozitif tekli, ikili ya da kısa zincirli koklardan oluşan Enterococcus cinsi bakteriler, katalaz negatif, L-pirolidonil-β-naftilamid (PYR) pozitif, fakültatif anaerop, glikozdan laktik asit üretimi pozitif, gaz oluşturmayıp, optimal üreme sıcaklığı 10o
C ile 45oC arasındadır (Akan, 2009).
İnsan ve hayvanlarda gastrointestinal sistem (GİS) florasının üyesi olan enterokoklar, günümüzde daha çok altta yatan önemli bir hastalığı olan yaşlılarda, uzun süreli hastanede yatan, ya da tedavilerinde geniş spektrumlu antibiyotiklerin aşırı kullanıldığı immün zorluklu hastalarda önemli hastane enfeksiyonu etkeni olarak saptanmaktadır. Bu enfeksiyonların çoğundan Enterococcus faecalis ve Enterococcus faecium türleri sorumludur. Enterokoklar nozokomiyal, üriner sistem ve yara enfeksiyonları, bakteriyemi, endokardit, intraabdominal ve pelvik enfeksiyonları etkeni olarak soyutlanmaktadır (Başustaoğlu ve Aydoğan, 2002). Ayrıca, solunum yolları enfeksiyonu, otit, sinüzit, septik artrit ve endoftalmi de nadir olarak görülür (Hancock ve Gilmore, 2000).
Aminoglikozid antibiyotiklere intrensek dirence sahip olan Enterokoklar, plazmid ve transpozon aracılığı ile tetrasiklinlere, makrolidlere, kloramfenikole, aminoglikozidlere (yüksek düzeyde), glikopeptidlerden vankomisin ve teikoplanine direnç kazanabilir. İntrensek direnç yanında, kazanılmış direnç genlerinin de aynı bakteride bulunabilmesi, ciddi enfeksiyonların tedavisinde zorluklara neden olmaktadır. Aminoglikozid antibiyotikler, beta-laktam antibiyotik ya da vankomisin gibi hücre duvar sentezini engelleyen bir antibiyotikle kombine edilecek olursa, sinerjik etki gösterir. Penisilinler hücre duvar sentezini engeller ve hasarlanan hücre duvarından aminoglikozid antibiyotiklerin daha kolay geçmesine neden olur. Klinik olarak ilk kez 1988 yılında tanımlanan; ardından hızla dünyaya yayılan; ülkemizde ise ilk kez 1998 yılında bildirilen vankomisine dirençli enterokok (VRE) kökenleri, günümüzde tüm hastanelerin sorunu haline gelmiştir. Özellikle VRE'ler, diğer birçok antibiyotiğe de dirençli olmaları nedeniyle, hastane ortamında kolayca çoğalıp yayılarak yatan hastalarda ciddi morbidite ve mortalite nedeni olabilmektedir. Glikopeptid direnci, E. faecalis'e oranla E. faecium'da daha fazladır (Simonsen ve
19
ark, 2003). Vankomisine bağımlı (Tambyah ve ark., 2004) ve vankomisine heteroresistant (Alam ve ark., 2001) türlerin, klinik olarak önemli enfeksiyonlardan az da olsa soyutlanmaya başlanması, enterokok enfeksiyonlarının tedavi ve kontrolünde yeni zorluklar oluşturmaktadır.
2.6.3. Listeria monocytogenes
Listeria monocytogenes, Clostridium alt bölümünde ve Listeria cinsi içinde yer alan altı türden biridir. Listeria cinsi üyeleri sporsuz, dallanmayan, düzgün, kısa (0,5-2 ve 0,4-0,5µm), tek tek ya da zincirler halinde görülen Gram pozitif basillerdir. Bakteri 28oC’de hareketli iken, 37oC’de hareketi zayıflar. Optimal üreme sıcaklığı 30-37oC olmasına rağmen 4oC’de birkaç günde üreyebilir. Listeria türleri fakültatif anaeroptur. Voges-Proskauer ve metilen kırmızısı testleri pozitif iken, üre, jelatin hidrolizi, indol ve H2S oluşumu negatiftir (Gültekin, 2009).
Tüm dünyada yaygın olarak bulunan L. monocytogenes, yiyeceklere geçebilme ve 4o
C’de üreyebilmesi ile kolonize olduğu gıdaları soğutucuda uzun süre bekleterek tüketen insanlarda hastalığa neden olur (Rocourt ve Cossart, 1997). Gebe olmayan erişkinlerde özellikle menenjit, ensefalit ve septisemiye yol açarken, gebelerde plesantayı geçebildiği için plasentit ve fetüs enfeksiyonu ile abortus ve ölü doğum veya erken doğuma yol açabilir (Lecuit ve ark., 2004). Ayrıca Listeria monocytogenes nadirde olsa yara enfeksiyonlarından soyutlanabilir (Tilton ve Ebrom, 1982).
Listeryoz tedavisinde genellikle penisilin veya ampisilin ve/veya bir aminoglikozid önerilmektedir. Trimetoprim-sulfametakzasol ve aminoglikozidler L. monocytogenes’e karşı bakterisit etkilidir. Klinik örneklerden soyutlanan bazı L. monocytogenes kökenlerinde kloromfenikol, makrolidler, ve tetrasikline direnç plazmidlerinin bulunduğu bildirilmiştir (Hadorn ve ark., 1993; Evirgen, 2005).
2.6.4. Esherichia coli
Escherichia cinsi Enterobacteriaceae ailesinde yer alan hareketli ve hareketsiz bakterilerden oluşmaktadır. Cins içindeki tipik tür Esherichia coli’dir. E.
20
coli, EMB ve MacConkey agarda iyi üreyen Gram negatif bir basil olup, D-glikozu fermente ederek genellikle gaz üretir (Levent, 2009).
Sağlıklı bireylerin barsak florasında bulunmakla birlikte, E. coli’nin bazı patojenik kökenleri, immün düşkün bireylerde olduğu kadar sağlıklı bireylerde de idrar yolu enfeksiyonları, bakteriyemi, menenjit ve ishaller gibi barsak dışı ve barsak enfeksiyonlarına neden olabilmektedir (Kaper ve ark., 2004). Bunların yanında yara enfeksiyonlarından en sık soyutlanan Gram negatif bakterilerin başında gelmektedir (Doğan ve ark., 2010). Tanımlanmış beş diyarejenik E. coli kategorisi bulunmaktadır: i) Shiga-toksin üreten E. coli (STEC), aynı zamanda enterohemorajik E.coli (EHEC) olarak ta bilinir, ii) enterotoksijenik E. coli (ETEC), iii) enteropatojenik E. coli (EPEC), iv) enteroagregatif E. coli (EAEC) ve v) enteroinvaziv E. coli (EIEC) (Kaper ve ark., 2004).
Uygun antibiyotik seçimi, ETEC enfeksiyonunun süresini ve semptomlarını azaltır. Antimikrobiyal direnç özellikle tetrasiklin direnci ETEC kökenlerinde yaygındır (Dalton ve ark., 1999). Antibiyotik tedavisi EPEC’in neden olduğu ishallerde faydalı olabilir. Bazı EPEC kökenleri çoklu ilaç direncine sahiptir (Donenberg, 2002). EAEC kökenleri genelikle florokinolonlara duyarlı olduğu halde çoğu antibiyotiğe dirençlidir (Glandt ve ark., 1999). Üriner sistem enfeksiyonlarından sıklıkla soyutlanan E. coli kökenlerinde ise, son yıllarda düşük direnç oranı ile fosfomisin ilk tercih haline gelmiştir (Özel ve Vardar Ünlü, 2015).
2.6.5. Klebsiella pneumoniae
Klebsiella pneumoniae türü Enterobacteriaceae familyası içinde yer almakta ve genel özelliklerini taşımaktadır. K. pneumoniae, aerop ve fakültatif anaerop ortamlarda 37oC ve pH 7’de iyi üreyebilen, oksidaz negatif, hareketsiz, sporsuz, genelikle kapsüllü, Gram negatif bir basildir (Unat, 1986).
İnsanlarda üst solunum yolu ve dışkı florasında bulunabilen bu bakteriler fırsatçı patojen olarak hastane enfeksiyonlarına neden olabilir (Balıkçı ve Keskin, 2011). K. pneumoniae’nın neden olduğu lober pnömoni, alkoliklerde, diyabetiklerde, kronik obstrüktif akciğer hastalığı olanlarda genellikle üst solunum yollarına yerleşmiş bakterilerin aspirasyonu neticesinde meydana gelmektedir. K. pneumoniae
21
ile idrar yolu ve cerrahi yara enfeksiyonları ve bakteriyemi olguları, diğer Gram negatif bakterilerle oluşan enfeksiyonlardaki klinik belirtilere benzer seyreder. K. pneumoniae ile menenjit, safra kesesi enfeksiyonu, çeşitli organlarda abse oluşumu gibi enfeksiyonlar da meydana gelebilir (Töreci, 2002; Akalın, 2003).
β-laktam antibiyotiklere dirençten sorumlu genişlemiş spektrumlu β-laktamaz (GSBL), sefalosporinaz ve karbapenemaz üreten kökenlerin sayısı ve artan kinolon direnci Enterobacteriaceae üyeleri ile ilgili başlıca sorunlardır (ASCP, 1997). Özellikle son yıllarda görülen K. pneumoniae karbapenemaz enzimlerine bağlı olarak gelişen karbapenem direnci ciddi boyutlara ulaşmıştır (Quenaan ve Bush, 2007).
2.6.6. Pseudomonas aeruginosa
Pseudomonas cinsi, klinik ve çevresel açılardan dikkate alınması gereken pek çok tür içeren, büyük ve kompleks bir Gram negatif bakteri grubudur. İlk kez Migula (Migula, 1894) tarafından tanımlanan ve Proteobacteria’ ların gama alt sınıfında yer alan (De Vos ve De Ley, 1983) Pseudomonas türleri aerop, sporsuz, düz veya hafif kıvrımlı, 0,5-1,0 ve 1,5-5,0µm boyutlarında, katalaz pozitif, oksidaz pozitif, Gram negatif çomaklardır (Holt ve ark., 1994).
Pseudomonas aeruginosa hidrofilik olup lavabolar, sebzeler, nehir suları, hatta antiseptik solüsyonlar gibi nemli ortamlarda kolayca üreyebilir. Nötropenik kanser hastaları, kemik iliği transplantasyonu olan hastalar, sık yüzen çocukların dış kulak yolları, mekanik ventilasyon hastalarının entübasyon tüpleri ve kistik fibrosis hastalarının solunum yolları, P. aeruginosa açısından risk altındadır (Şener, 2009). P. aeruginosa kökenleri, deride oluşan yanıklarda ve yaralarda en sık soyutlanan bakterilerden biridir (Demir ve Erandaç, 2001). Dış kulak yolu enfeksiyonlarında, kontakt lens kullanımına bağlı konjunktivitte, diyabetik hastalarda, eksternal otitte, yeni doğan sepsis ve menenjitinde, endokardit ve osteomiyelitte, idrar yolu enfeksiyonlarında sıklıkla soyutlanır (Şener, 2009).
P. aeruginosa başlıca iki intrensek direnç mekanizmasına sahiptir. Biricisi, ampisilin, amoksisilin, amoksisilin-klavulanat, dar ve geniş spektrumlu seflosporinler, sefotaksim ve sefriaksona direnç sağlayan AmpC β-laktamazlar, ikincisi ise efflux pompa sistemleridir (Livermore, 2002). Ancak çeşitli antibiyotikler
22
intrensek direncin üstesinden gelebildiği için, P. aeruginosa enfeksiyonunda kullanılabilir. Bunlar; piperasilin, tikarsilin, seftazidim, sefepim, imipenem, meropenem, siprofloksasin, levofloksasin, gentamisin, tetrasiklin, amikasin ve kolistindir (Şener, 2009).
2.6.7. Salmonella Typhimurium
Salmonella cinsi, Enterobacteriaceae ailesi içinde yer alır ve Salmonella enterica ve Salmonella bongori olmak üzere iki türden oluşur. S. enterica da altı alt tür içerir ve Salmonella serotip Typhimurium gibi alt türlerin serotiplendirilmesi, bakterinin üç yüzey yapısının (O, H, Vi antijenleri) immünolojik karakterizasyonuna dayanmaktadır. Salmonella türleri, metilen kırmızısı pozitif, Voges-Proskauer negatif, üre negatif, büyük çoğunluğu H2S pozitif, hareketli, glikozdan asit üreten,
laktoz negatif, oksidaz negatif Gram negatif basillerdir (Aktepe, 2009).
Salmonella kökenleri, ilişkili oldukları hastalığa uygun olarak tifo ve tifo dışı olmak üzere ayrılmaktadır. Tifo dışı Salmonella kökenleri bir hafta veya daha uzun süren barsak enfeksiyonuna neden olur (Hohman, 2001). İmmün zorluklu bireylerde ise, daha az olarak bakteriyemi, üriner sistem enfeksiyonu veya osteomiyelite neden olur. Salmonelloz, hayvanlarla direk temas, hayvansal gıdalar ve sularla ilişkilidir. Tifo etkeni Salmonella serotip Typhi’ dir. Tüm dünyada yaygın olan, vücutta kan ve lenfatik yolla yayılan ciddi bir barsak enfeksiyonudur (Mead ve ark., 1999). Ancak son yıllarda bağırsak dışı (BOS, kan, idrar, serviks, yara ve abse) Salmonella enfeksiyonlarından artış görülmüştür (Abbott ve ark., 2012; Sfeir ve ark., 2013).
Tifoda tedavi edilmeyen vakaların mortalite oranı %10’nun üzerindedir. Çoklu ilaç direnci, tifo dışı Salmonella serotiplerinde dikkat çekmektedir (Levent, 2009). Salmonella serotip Typhimurium faj tip DT104 kökeni ampisilin, kloromfenikol, streptomisin, sülfonamid ve tetrasikline dirençlidir ve tüm dünyada tanınmaktadır. ABD’de soyutlanan Salmonella serotip Typhimurium kökenlerinin %21’i bu direnç profiline sahiptir (CDC, 2004b).
23 2.6.8. Stenotrophomonas maltophilia
Önceleri Pseudomonas maltophilia olarak bilinen ve çeşitli genotipik ve fenotipik özeliklerine göre Xanthomonas cinsine alınan ancak flagella sayısı, nitrat indirgeme özelikleri ve fibrinasyon tiplerinde bir çok farklılık sonucu yeni bir cins olan Stenotrophomonas içinde sınıflandırılan Stenotrophomonas maltophilia (Palleroni ve Bradbury, 1993), aerobik, spor oluşturmayan, düz, 0,7-1,8 ile 0,4-0,7µm boyutunda, hareketli, katalaz pozitif, oksidaz negatif, optimum üreme sıcaklığı 30-37o
C olan Gram negatif bir basildir (Holt ve ark., 1994).
S. maltophilia sık rastlanan fırsatçı bir patojendir. Tarımsal makineler gibi çeşitli araçlarla travma sonrası deride gelişen yara enfeksiyonlarından soyutlanan bir türdür. Yoğun bakım ünitelerinde solunum cihazına bağlı ve immün zorluklu hastalarda yüksek morbidite ve mortaliteye neden olan önemli bir nozokomiyal patojen olup, bakteriyemi, pnömoni, üriner sistem enfeksiyonu, oküler enfeksiyon, endokardit, menenjit, yumuşak doku ve yara enfeksiyonu, epididimit, kolanjit ve peritonit oluşturabilmektedir (Denton ve Kerr, 1998).
S. maltophilia birçok antibiyotiğe intrensek direnç gösterir. Enfeksiyon süresince de direnç gelişebilir. İki farklı laktamaz enzimine sahip olduklarından β-laktam antibiyotiklere dirençlidirler (Emektaş, 2009). Trimetoprim-sulfametoksazol genellikle en etkili ajandır. Bunun yanında tikarsilin klavulanat, minosiklin veya piperasilin tazobaktam ile kombine edilerek kullanılır. Siprofloksasin+piperasilin tazobaktam, siprofloksasin+tikarsilin klavulonat ve doksisiklin+tikarsilin klavulonat kombinasyonlarının tedavide etkili olduğu bildirilmiştir (San Gabriel ve ark., 2004).
2.6.9. Acinetobacter lwoffii
Bu cins, önceleri Neisseriaceae ailesinde iken günümüzde Moraxellaceae ailesinde yer almaktadır. Acinetobacter cinsi, zorunlu aerop, oksidaz negatif, hareketsiz, nitrat negatif, nonfermantatif, 1-1,5 ile 1,5-2,5µm boyutlarında, Gram negatif koko-basil görünümündedir (Zarakolu, 2009). Glikozu okside eden, hemolitik olmayan kökenlerin birçoğu Acinetobacter baumannii, glikozu okside etmeyen, hemolitik olmayan kökenler ise Acinetobacter lwoffii olarak tanımlanmıştır (Rossau ve ark., 1991).