T.C
SELÇUK ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ
İ
Ç ANADOLU BÖLGESİ İLLERİNDEN TOPLANAN MISIR
SİLAJI ÖRNEKLERİNDE AFLATOKSİN VE ZEARALENON
KİRLİLİKLERİNİN BELİRLENMESİ
Hasan AYDIN
DOKTORA TEZİ
FARMAKOLOJİ VE TOKSİKOLOJİ ANABİLİM DALI
Danışman Prof. Dr. Halis OĞUZ
T.C
SELÇUK ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ
İ
Ç ANADOLU BÖLGESİ İLLERİNDEN TOPLANAN MISIR
SİLAJI ÖRNEKLERİNDE AFLATOKSİN VE ZEARALENON
KİRLİLİKLERİNİN BELİRLENMESİ
Hasan AYDIN
DOKTORA TEZİ
FARMAKOLOJİ VE TOKSİKOLOJİ ANABİLİM DALI
Danışman Prof. Dr. Halis OĞUZ
Bu araştırma Selçuk Üniversitesi Bilimsel Araştırma Projeleri Koordinatörlüğü tarafından 08202004 proje numarası ile desteklenmiştir.
S.Ü. Sağlık Bilimleri Enstitüsü Müdürlüğü’ne
Hasan AYDIN tarafından savunulan bu çalışma, jürimiz tarafından Farmakoloji ve Toksikoloji Anabilim Dalında Doktora Tezi olarak oy birliği ile kabul edilmiştir.
Jüri Başkanı Prof. Dr. Bünyamin TRAŞ İmza
Selçuk Üniversitesi
Danışman Prof. Dr. Halis OĞUZ İmza
Selçuk Üniversitesi
Üye Prof. Dr. Muammer ELMAS İmza
Selçuk Üniversitesi
Üye Prof. Dr.Varol KURTOĞLU İmza
Selçuk Üniversitesi
Üye Prof. Dr. Ahmet ATEŞŞAHİN İmza
Fırat Üniversitesi ONAY:
Bu tez, Selçuk Üniversitesi Lisansüstü Eğitim-Öğretim Yönetmeliği’nin ilgili maddeleri uyarınca yukarıdaki jüri üyeleri tarafından uygun görülmüş ve Enstitü Yönetim Kurulunun ……….tarih ve ………..sayılı kararıyla kabul edilmiştir.
İmza
Prof. Dr. Orhan ÇETİN Enstitü Müdürü
ii. ÖNSÖZ
Son yıllarda Türkiye’de yaygın olarak kullanılan mısır silajı ruminant beslemesinde önemli bir yer tutmaktadır. Silaj yemler doğal yapılarının bir sonucu olarak silolama tekniklerine uyulmadığı zaman mantar üremesi ve mikotoksin oluşumu için uygun bir ortam oluşturur. Bu tür silajları tüketen hayvanlarda sebebi bilinmeyen verim düşüklükleri, hastalıklara karşı duyarlılık artışı, yavru atmalar ve ölümler görülebilir. Bu hayvanlardaki sağlık problemleri, sütlerindeki kalıntı düzeyleri ile silajlardaki mikotoksin kirliliği arasındaki ilişkiyi belirlemek, hayvan sağlığı, ekonomik işletmecilik ve halk sağlığı açısından da önemli görülmektedir.
Bu çalışma, hayvan varlığı açısından zengin olan Türkiye’nin İç Anadolu Bölgesi illerinde yapılan silajların Aflatoksin (AF B1) ve Zearalenon (ZON)
açısından incelenerek silo tipi, silajın genel görünümü, iklim şartları, katkı maddeleri, pH ve % kuru madde (KM) oranları gibi silaj özelliklerinin mikotoksin üremesine muhtemel etkilerinin belirlenmesi ve geçerliliği denenmiş bir yöntemin rutin analizlerde kullanılabilir hale getirilmesi amacıyla yapılmıştır.
Bu araştırmada İç Anadolu Bölgesi’nde yer alan Aksaray, Ankara, Çankırı, Eskişehir, Karaman, Kayseri, Kırıkkale, Kırşehir, Konya, Nevşehir, Niğde, Sivas ve Yozgat illerinden 1 Mart 2008 - 31 Mayıs 2008 tarihleri arasında toplanan mısır silajı örnekleri kullanılmıştır. Örnek alımı sırasında silaja, siloya, işletmeye ve bölgenin iklim özelliklerine ait anket bilgileri de alınmıştır.. Silajın % KM ve pH’sı ölçülerek AF B1 ve ZON kirlilikleri belirlenmiştir.
Bu çalışmanın yapılmasında yakın ilgi ve desteğini esirgemeyen Selçuk Üniversitesi Veteriner Fakültesi Farmakoloji ve Toksikoloji Anabilim Dalı Başkanı Prof. Dr. Bünyamin TRAŞ’a, Öğretim Üyeleri Prof. Dr. A.Levent BAŞ’a, Prof. Dr. Muammer ELMAS’a, Prof. Dr. Enver YAZAR’a, Araştırma Görevlileri Dr. Kamil ÜNEY’e ve Dr. Ayşe ER’e, Hayvan Besleme ve Hastalıkları Anabilim Dalı Üyesi Prof. Dr. Varol KURTOĞLU’na, Konya Veteriner Kontrol ve Araştırma Enstitüsü Müdürü Dr. Adnan ÖZTÜRK’e ve Enstitü Toksikoloji Laboratuvarındaki çalışma arkadaşlarıma, maddi yönden destekleyen Selçuk Üniversitesi Bilimsel Araştırma
Projeleri Koordinatörlüğü’ne ve manevi desteklerinden dolayı aileme teşekkür ederim.
iii. İÇİNDEKİLER Sayfa
1.GİRİŞ ... 1
1.1. Silaj ... 3
1.2. Silajın Tarihçesi ... 4
1.3. Silajın Yapılışı ... 4
1.4. Silolama Esnasında Meydana Gelen Değişiklikler ... 5
1.4.1. Aerobik Dönem ... 5
1.4.2. Fermentasyon Dönemi (Anaerob Dönem) ... 5
1.4.3. Sabit Dönem ... 6
1.4.4. Silonun Açılması ve Silajı Yedirme Dönemi ... 7
1.5. Silaj Kalitesini Etkileyen Faktörler ... 7
1.6. Silo Tipleri ... 8
1.7. Silaj Katkı Maddeleri ... 9
1.8. Mikotoksinler ... 9
1.8.1. Aflatoksin (AF) ... 13
1.8.2. Zearalenon (ZON) ... 17
1.9. Amaç ... 19
2. GEREÇ ve YÖNTEM ... 21
2.1. Etik Kurulu Onayı ... 21
2.2. Kullanılan Alet ve Malzemeler ... 21
2.3. Kimyasal Maddeler, Çözeltiler ve Standartlar ... 24
2.4. Silaj Materyali ... 24
2.5. Meteorolojik Veriler ... 25
2.6. Anket Formları ... 25
2.7. pH Ölçümleri ... 25
2.8. Kuru Madde Tayinleri ... 25
2.9. AF B1 Analizleri ... 26
2.9.1. AF B1 Ekstraksiyonu ... 26
2.9.2. AF B1 Kolon Kromatografisinde Temizleme İşlemi ... 26
2.9.3. AF B1 İnce Tabaka Kromatografisinde Plakaya Lekelerin Uygulanması .... 26
2.9.4. AF B1 Developman Sistemi ... 27
2.9.5. AF B1 Miktar Tayini ... 27
2.10. ZON Analizleri... 27
2.10.1. ZON Ekstraksiyonu ... 28
2.10.2. ZON Minikolon Kromatografisinde Temizleme İşlemi ... 28
2.10.3. ZON İnce Tabaka Kromatografisinde Plakaya Lekelerin Uygulanması .... 28
2.10.4. ZON Developman Sistemi ... 28
2.10.5. ZON Miktar Tayini ... 29
2.10.6. ZON Doğrulama Testi... 29
2.11. Metot Validasyonu ... 29
2.11.1. Özgünlük (Specificity) ... 29
2.11.2. Doğrusallık (Linearity) ... 30
2.11.3. Geri Kazanım (Recovery) ... 30
2.11.4. Duyarlılık (Sensitivity)... 31 2.11.5. Kesinlik (Precision) ... 31 3.BULGULAR ... 33 3.1. Metot Validasyonu ... 33 3.1.1. Özgünlük ... 33 3.1.2. Doğrusallık ... 35 3.1.3. Geri Kazanım ... 36 3.1.4. Duyarlılık ... 36 3.1.5. Kesinlik ... 37 3.2. Meteorolojik Veriler ... 38
3.3. pH ve Kuru Madde Ölçümleri... 39
3.4. Silajlara Ait Anket Formları... 39
3.5. AF B1 ve ZON Analiz Sonuçları ... 42
4.TARTIŞMA ... 43 5. SONUÇ ve ÖNERİLER ... 49 6. ÖZET ... 50 7. SUMMARY ... 51 8. KAYNAKLAR ... 52 9. EKLER ... 60
9.1. EK-A: Etik Kurulu Kararı ... 60
9.2. EK-B: Silaj Toplama Formu ... 61
9.3. EK-C: Silaj Gözlem Formu ... 63
iv. SİMGELER VE KISALTMALAR
AF : Aflatoksin CO2: Karbondioksit
CRM: Sertifikalı Referans Materyal dk: Dakika
EC: Avrupa Komisyonu g: Gram
İTK: İnce Tabaka Kromatografisi H2: Hidrojen
H2O: Su
HPLC: Yüksek Performanslı Sıvı Kromatografisi
HPLC-MS: Yüksek Performanslı Sıvı Kromatografisi-Kütle Spektrofotometrisi HPTLC: Yüksek Performanslı İnce Tabaka Kromatografisi
KM: Kuru Madde Kg: Kilogram
LAB: Laktik Asit Bakterileri LC: Likit Kromatografi
LC-MS: Likit Kromatografi-Kütle Spektrofotometri
LC-MS-MS: Likit Kromatografi-Kütle Spektrofotometri-Kütle Spektrofotometri LOD: Gözlenebilirlik Sınırı LOQ: Ölçülebilirlik Sınırı Mg: Miligram ml: Mililitre µg: Mikrogram µl: Mikrolitre nm: Nanometre ppb: Milyarda Bir ppm: Milyonda Bir RF: Yürüme Mesafesi r: Tekrarlanabilirlik SO2: Kükürtdioksit SS: Standart Sapma
TKB: Tarım ve Köyişleri Bakanlığı TUİK: Türkiye İstatistik Kurumu VK: Varyasyon Katsayısı
WHO: Dünya Sağlık Örgütü ZON: Zearalenon
1.GİRİŞ
Türkiye’de çeşitli nedenlere bağlı olarak hayvansal üretim istenilen düzeye çıkarılamamıştır. Hayvan başına alınan verimin düşük olmasının en önemli sebeplerinden biri de kaliteli kaba yem açığıdır (Koç 1998, Kurtoğlu 1998, Karaman 2006).
Yüksek düzeyde besin maddeleri içeren kaliteli kaba yemlerin kurutulması esnasında önemli miktarda besin maddesi kaybı olmaktadır. Ayrıca yağış tehlikesi nedeniyle biçim, kurutma, balyalama ve depolama işlemlerinde güçlüklerle karşılaşılmaktadır. Yem bitkilerinde oluşan bu tür olumsuzlukları azaltmanın en kolay yolu bu bitkilerin silajlarının yapılmasıdır (Kurtoğlu 1998, Reyes-Velazquez ve ark 2008). Kaliteli kaba yemlerin silajlarının yapılması halinde ıslanma, kızışma, küflenme ve kurutma kayıpları ortadan kalktığı gibi hayvanların iştahla ve seçmeden tüketebilecekleri besin değeri bakımından tabii haline yakın, kuru ota göre daha kaliteli bir kaba yem elde edilebilmektedir (Kurtoğlu 1998).
Silaj kullanımı ile hemen her mevsimde süt ineklerinin, besi sığırlarının ve koyunların yeşil kaba yem ihtiyaçları karşılanabilmektedir. Usulüne uygun olarak yapılan silajda besin maddeleri kaybı diğer saklama metotlarına göre çok daha azdır. Yem bitkileri arasında silajı en çok yapılan mısırdır (Kılıç 1986, Kurtoğlu 1998, Özdüven 2002, Kaya 2005, Karaman 2006, Şimşek 2006).
Hayvanlarda ve özellikle ruminantlarda kaliteli kaba yem kaynağı olarak mısır silajlarının kullanılmasıyla konsantre yem tüketiminin düşük düzeylere inmesine bağlı olarak maliyetlerde düşme, sindirim bozukluklarında azalma ve elde edilen hayvansal ürünlerde artış sağlanabilmektedir. Ayrıca iş gücü ve depolama kayıpları en aza indirilerek ekonomik bir hayvancılığın yapılmasına imkan sağlanmaktadır (Kurtoğlu 1998, Kaya 2005). Mısır silajı, kaliteli silaj elde ederek ekonomik bir hayvancılık sağlamak, iş gücü ve depolama kayıplarını azaltmak amacıyla yaygın olarak kullanılır (Koç 1998, Kurtoğlu 1998, Kaya 2005, Şimşek 2006).
Türkiye’de özellikle sığır ve koyun yetiştiriciliğinin yoğun olarak yapıldığı İç Anadolu Bölgesi’nde yüksek miktarda silajlık mısır üretilmekte ve mısır silajı yapılmaktadır. 2008 yılı İç Anadolu Bölgesi illerinde sığır ve koyun varlığı Çizelge 1.1.’de ve ekilen silajlık mısır alanları ve üretim miktarları Çizelge 1.2.’de verilmiştir.
Çizelge 1.1. 2008 yılı İç Anadolu Bölgesi illerinde sığır ve koyun varlığı
(TKB 2009). İl Sığır Koyun Konya 408 758 1 257 296 Sivas 273 150 349 250 Ankara 224 651 598 125 Kayseri 196 281 387 005 Yozgat 189 613 225 964 Eskişehir 100 896 473 960 Kırşehir 82 238 90 500 Çankırı 80 649 69 033 Aksaray 80 000 255 195 Niğde 59 446 311 249 Nevşehir 46 425 43 995 Karaman 32 094 339 161 Kırıkkale 30 150 81 700 Toplam 1 804 351 4 482 433
Çizelge 1.2. 2007 yılı İç Anadolu Bölgesi illerinde ekimi yapılan silajlık mısır alanları ve üretim miktarları (TUİK 2010).
İl Dekar Ton Konya 98 973 436 200 Aksaray 42 320 199 885 Kayseri 32 780 154 961 Eskişehir 27 653 126 996 Karaman 31 908 120 760 Ankara 22 750 108 840 Niğde 13 200 65 811 Yozgat 7 085 28 102 Sivas 6 698 27 293 Nevşehir 6 180 25 260 Kırşehir 3 458 16 732 Kırıkkale 3 059 10 273 Çankırı 2 137 8 641 Toplam 298 271 1 331 082 1.1. Silaj
Yeşil ya da yeterli ham su içeren yemlerin sıkıştırılarak değişik sürelerde fermentasyonu ile anaerobik şartlarda bekletilmesi sonucu elde edilen ürüne silaj denir. Yapılan işleme silolama ve yapıldığı yere ise silo adı verilir (Kılıç 1986, Koç 1998, Coşkun ve ark 2000). Silaj yapımının amacı mümkün olan en az besin maddesi kaybı ile yemleri saklamaktır (Kılıç 1986). Silajda pH’nın düşük olması istenir ve pH’nın düşmesi ancak laktik asit bakterilerinin (LAB) artması ile gerçekleşir (Kılıç 1986, Coşkun ve ark 2000, Karaman 2006). Anaerobik bakterilerin etkisiyle kolay eriyebilen ve kısmen kompleks karbonhidratlar, büyük oranda laktik asit, daha az oranlarda asetik asit, diğer asitler ve alkollere çevrilir. Proteinler kısmen amonyak, aminoasit, amin ve amidlere dönüşür, bol miktarda da CO2 meydana gelir (Coşkun
Bütün yeşil yem maddelerinin silajı yapılabilmektedir ancak kimyasal bileşimlerine bağlı olarak silolanabilme özellikleri farklılık göstermektedir. Mısır, kolay eriyebilir karbonhidrat içeriği, kuru madde oranının yüksek olmasına bağlı olarak kolay fermente olabilme ve kolay silolanabilme özelliğinden dolayı en iyi silajı yapılabilen yem maddeleri arasında değerlendirilmektedir (Kılıç 1986, Bolsen ve ark 1996, Kurtoğlu 1998, Coşkun ve ark 2000, Karaman 2006).
1.2. Silajın Tarihçesi
Silaj yapımının tarihi çok eski çağlara dayanmaktadır. Mısır’da bulunan duvar resimlerinden, M.Ö. 1500-1000 yıllarında eski Mısırlıların yeşil yemleri silaj yaparak sakladıkları saptanmıştır. O dönemlerde hem tahıl tanelerinin hem de yeşil bitkilerin silolandığı bilinmektedir. Kartaca’daki bulgular M.Ö. 1200’lü yıllarda Kartacalılar’ın da silaj yaptıklarını göstermektedir. Romalılardan kalan yazıtlarda Akdeniz ülkelerinde yeşil yemlerin kuyulara ve toprak üstü kulelere silolandığı görülmüştür. Amerika kıtasını keşfeden Kristof Kolomb Kızılderililerin çukurlara tahıl depoladıklarını bildirmiştir. Kapodakya ve Trakya’da tane mısır ‘siri’ adı verilen kuyularda depolanmıştır. İtalya’da 700 yıldır silaj yapıldığı bilinmektedir. Baltık ülkelerinde 18. yüzyılda, Kuzey Almanya’da ise 19. yüzyılın başlarında şeker pancarının baş ve yapraklarının silolandığı ifade edilmektedir. Türkiye’de ise ilk kez 1931 yılında Atatürk Orman Çiftliği’nde üretilen silaj, çok uzun yıllar kamuya ait tarım işletmelerinin dışına çıkamamıştır (Kaya 2005).
1.3.Silajın Yapılışı
Hasat edildikten sonra özel makinalarla küçük parçalara ayrılmış yeşil yemler taze ya da bir süre soldurulduktan sonra silolara doldurulur. Silo tipine göre sıkıştırma yöntemleri uygulanır. Türkiye için en uygun silo tipleri olan çukur ve düz siloya doldurulan materyalin üzerinde traktör ya da benzer araçlarla gezinilerek olabildiğince sıkıştırılır ve yem parçaları arasında hava kalmaması sağlanır. Üzeri naylon ile örtülür. Naylonun yıpranmaması için üzeri sap ve toprakla örtülerek kapatılır. Silaj materyaline göre değişmekle birlikte yaklaşık 1,5-2 aylık beklemeden sonra açılarak hayvanlara yedirilir (Kılıç 1986, Coşkun ve ark 2000).
1.4. Silolama Esnasında Meydana Gelen Değişiklikler
Silaj fermentasyonu belli başlı 4 dönemde gerçekleşir. Bunlar aerobik dönem, fermentasyon dönemi, sabit dönem ve silonun açılmasını takiben silajı yedirme dönemlerinden oluşmaktadır (Kılıç 1986, Bolsen ve ark 1996, Kurtoğlu 1998, Kaya 2005).
1.4.1. Aerobik Dönem
Yem materyali siloya doldurulduktan sonra siloda iki önemli olay meydana gelir. Bunlar solunum ve proteolizisdir. Solunum ve proteolizis olayları silo içinde aynı anda başlar ve devam eder. Solunum olayı sırasında, bitkide mevcut olan doğal mikroorganizma florası bitkideki kolay eriyebilir karbonhidratları, CO2 ve H2O’ya
kadar parçalar. Bunun sonucu olarak da silo içi sıcaklık artmaya başlar. Proteolizis olayı esnasında bitki bünyesinde bulunan proteazlar, proteinleri daha çok amino asitlere ve amonyağa daha az oranda da peptit ve aminlere parçalarlar (Kılıç 1986, Coşkun ve ark 2000, Kaya 2005). Proteolizis olayı pH’nın yeterli bir seviyeye düşmesine kadar devam eder (Kurtoğlu 2006). Silolama prensiplerine uyulmadığında bu dönemde ortamda kokuşma bakterileri, aerob maya ve mantarlar üreyebilir (Kılıç 1986, Coşkun ve ark 2000, Kaya 2005). Fermentasyonun bu dönemi yaklaşık birkaç gün sürer (Kılıç 1986, Bolsen ve ark 1996).
1.4.2. Fermentasyon Dönemi (Anaerob Dönem)
Silaj yapımı prensip olarak anaerobik şartlarda doğal fermentasyonu teşvik ederek LAB’nin üremesi ile düşük pH düzeyinde clostridial üremeyi engelleyerek muhafaza yöntemine dayanmaktadır (Richard ve ark 2007). Bu dönemde anaerobik şartlar sağlandığı takdirde silajı yapılan materyalde başlıca LAB ve proteolitik bakterilerin oranı artar. Aerob maya ve mantarların üremeleri sınırlanır. Anaerobik bakterilerin etkisiyle kolay eriyebilir karbonhidratlar büyük oranda laktik asit ve daha az oranlarda asetik ile diğer asitlere ve alkollere çevrilirler. Proteinler kısmen amonyak, amino asit, amin ve amidlere dönüşür (Kılıç 1986, Coşkun ve ark 2000, Kurtoğlu 2006).
Uygun nem oranına (% 55-75) sahip materyallerde fermentasyon yaklaşık 7-14 gün sürer (Kılıç 1986, Bolsen ve ark 1996). Ortamda fermente olabilecek besin maddelerinin kalmaması ve ortam pH’sının mikroorganizmaların faal olmayacağı noktaya geldiğinde fermentasyon durur (Bolsen ve ark 1996). LAB oksijensiz ortamda yaşayabilirler. Siloda açığa çıkan toplam fermentatif ürünler içinde laktik asitin % 75 oranında oluşması durumunda en uygun laktik asit fermentasyonunun meydana geldiği kabul edilmekte ve bu oranda bir laktik asit oluşumunda ideal bir silaj elde edildiği belirtilmektedir (Kurtoğlu 1998).
1.4.3 Sabit Dönem
LAB’nin aktif gelişimini takiben silaj materyali sabit döneme girer. Silo uygun şekilde kapatıldıktan kısa bir süre sonra oluşan asitlerin birikimi sonucu ortamın pH’sı tüm bakterilerin yaşayamayacağı nokta olan 4,0-4,2 civarına iner. Buna rağmen hemiselüloz, selüloz ve lignin kompenentlerinin oldukça yavaş gelişen kimyasal yıkımlanmaları sonucu bazı karbonhidratlar serbest kalabilir. Kolay eriyebilir karbonhidratların yetersizliği veya yokluğu durumlarında fermentasyon hızı yavaşlar veya fermentasyon durabilir (Bolsen ve ark 1996). Anaerob dönemi geçirmiş bir silajda silonun boşaltılacağı zamana kadar bakteri faaliyeti en düşük düzeydedir. Usulüne uygun hazırlanmış bir silaj yeminin yapısının bu şekilde 10-15 yıl değişmeden kalabildiği bildirilmektedir (Kılıç 1986, Coşkun ve ark 2000).
Silolama sırasında silolama tekniğine uygun çalışılmamış veya silo örtülerindeki delik ve silo duvarlarındaki çatlaklardan sabit dönem süresince siloya hava girişi olmuş ise aerobik mikroorganizmalar çoğalır. Bu durum çoğunlukla bütirik asit üreten bakteri, maya ve mantar sayısında artışa sebep olur. İstenen düşük pH şekillenemediği için silajın rengi kızışmalar nedeniyle koyulaşır ve silajın kendine has hoş kokusu kaybolarak yerine çok kötü bir koku oluşur. Besin maddeleri ile kuru madde kaybı artar ve silaj materyalinde ısı artışına sebep olur. Hayvanlar bu tip silajları tüketmek istemez (Kurtoğlu 1998, Coşkun ve ark 2000).
1.4.4. Silonun Açılması ve Silajı Yedirme Dönemi
Silo açıldığı zaman silaja oksijen girmeye başlar ve aerobik mikroorganizmalar tarafından laktik ve asetik asit gibi besin maddeleri tüketilerek kuru madde ve besin maddeleri kaybı meydana gelir (Bolsen ve ark 1996, Auerbach ve ark 1998, Kurtoğlu 1998, Elferink ve ark 1999). Bu çözülebilir kompenentlerin aerobik mikroorganizmalarca yıkımlanması sonucu ısı, CO2 ve H2O meydana gelir
(Bolsen ve ark 1996). Bu dönemde silajların aerobik yıkımlanmalarından başlıca Enterobacter, Bacillus türleri, maya ve mantarlar sorumludur. Kızışma ile önemli miktarda besin maddesi kaybı meydana gelmektedir (Kurtoğlu 1998).
1.5. Silaj Kalitesini Etkileyen Faktörler
Silaj kalitesini çok sayıda faktör etkilemekle birlikte bu faktörler içinde en önemlilerinin silaj materyalinin kuru madde (KM) miktarı (Bolsen ve ark 1996, Kurtoğlu 1998, Duman 2007), kolay eriyebilir karbonhidrat düzeyi (Bolsen ve ark 1996, Coşkun ve ark 2000), ihtiva ettiği doğal mikrooganizma sayısı (Bolsen ve ark 1996), oksijen (Coşkun ve ark 2000) ve çevre sıcaklığı (Bolsen ve ark 1996) olduğu ifade edilmektedir.
Kaliteli bir silaj elde edebilmek için silajlık materyalin KM düzeyinin % 25-45 arasında olması gerektiği ve silaj materyalinde en az % 2-3 düzeyinde kolay eriyebilir karbonhidrat bulunması gerektiği belirtilmektedir (Kurtoğlu 1998). Silaj yapımı esnasında faaliyet gösteren LAB gibi bazı mikroorganizmaların üremesi arzu edilirken bütirik asit, asetik asit, koliaerojen ve çeşitli kokuşma bakterileri ile maya ve mantarlar gibi diğer bazı mikroorganizmaların silajda üremeleri istenmez (Kılıç 1986, Coşkun ve ark 2000).
Silaj yapımında en önemli zararlı mikroorganizmalardan biri mantarlardır. Mantar üremesi olan silajlarda organoleptik bozulma da olduğu için hayvanlar tarafından isteyerek tüketilmez. Silajda mantarların bulunması silolama tekniğine uyulmadığının bir göstergesidir. Mantarlar havayla temas durumunda hızla ürerler. Özellikle silo iç ve orta kısımlarında mantar üremesinin bulunması silajın iyi bir şekilde sıkıştırılmadığını gösterir (Kılıç 1986).
Silajda en çok rastlanan mantarlar Penicillium türleridir. Aspergillus ve Mucor türlerine de sık rastlanır. Bunlar silajda öncelikle karbonhidratları daha sonra da proteinleri ve laktik asiti parçalayarak önemli kayıplara sebep olurlar. Sonuç olarak kötü koku ve tada sahip olan yıkımlanma ürünleri SO2, H2 ve protein
parçalama ürünleri açığa çıkar. Mantarlar, LAB’ne göre düşük pH’ya daha dayanıklıdırlar. Ancak hava bulunmayan bir ortamda yaşayamazlar (Kılıç 1986).
Yaz mevsiminde çevre ısısının yüksek olmasından dolayı kış mevsimine göre aerobik yıkımlanma olaylarının daha yüksek oranda meydana geldiği bildirilmektedir. Bitkinin doğal florasında var olan ya da kontaminasyonla bulaşan mikroorganizmalar tarafından oluşturulan sıcaklık çoğunlukla termofilik mikroorganizmaların üremesine imkan sağlayacak derecede olabilmektedir (Kurtoğlu 1998).
Yem bitkilerinin silajlarının yüzey kısımlarındaki bozulmalar, siyahımsı renk değişimi, sümüksü bir tabaka ve mantar üremesi ile kendini gösterir. Böyle silajlar hayvanlar tarafından istenerek tüketilmez. Bu yüzey kayıpları fermentasyon kayıpları olarak adlandırılır. Siloya hava girişi ile oluşan KM kayıplarının her ay % 2 düzeyinde arttığı bildirilmektedir (Kurtoğlu 1998).
1.6. Silo Tipleri
Silo tipleri 4 grupta incelenmektedir.
1. Yüksek silolar: Silindirik kule şeklindedir. Türkiye’de böyle silolar yaygın değildir.
2. Çukur silolar: Kuyu şeklinde silolardır.
3.Yatay silolar: Türkiye’de en yaygın silo tipleridir.
• Toprak üstü silolar: Toprak üzerinde bulunan ve plastikle (polietilen) örtülmüş silolardır.
• Yer üstü beton silolar: Zemini beton veya üç tarafı prefabrik beton veya taş örgülü silolardır.
4. Diğer silo tipleri
• Plastik kaplı rulo veya silindirik silolar (Balya Silolar): Bu tip silolar traktörün arkasına monte edilen özel bir ekipmanla önceden
biçilip soldurulmuş ve rulo yapılmış yeşil ot balyalarının polietilen (plastik) örtü ile sarılması yöntemi ile yapılır.
• Sucuk-sosis tipi silolar: Önceden tarladan biçilip parçalanarak getirilmiş silajlık yeşil yemlerin özel ekipmanlar yardımıyla tünel şeklinde büyük plastik torbalara doldurulup torbanın havasının alınıp ağzının kapatılması ile yapılır (Coşkun ve ark 2000) .
1.7. Silaj Katkı Maddeleri
Günümüzde birçok materyal daha kaliteli bir silaj elde edebilmek ve hayvansal verimleri yükseltebilmek amacıyla silaj katkı maddesi olarak kullanılabilmektir. Katkı maddeleri, silajı besin meddesi yönünden zenginleştirmek, fermentasyonu kolaylaştırmak, asit ortamı güçlendirmek ve silajı korumak için katılmaktadır (Coşkun ve ark 2000, Kurtoğlu ve ark 2001).
1.8. Mikotoksinler
Mikotoksinler, üretimi ve depolanması uygun şartlarda yapılamayan yem, yem hammaddeleri ve besinlerde kontaminasyona sebep olan mantarlar tarafından salgılanan sekonder toksik metabolitlerdir (Buckle 1983, Ranjan ve Sinha 1991, Topal ve ark 1999, Malir ve ark 2006, Murphy ve ark 2006, Krska ve ark 2008). Bunları içeren yem, yem hammaddeleri ve besinleri yiyen hayvan ve insanlarda çoğunlukla latent ve kronik tipte bazen de akut zehirlenmeler ve ölümler görülebilir (Candlish ve ark 1988, Munoz ve ark 1990, Nizamlıoğlu 1996, Kaya 1998, Karagözlü ve Karapınar 2000, Yarsan ve ark 2002, Bennett ve Klich 2003, Pereyra ve ark 2008). Ayrıca ekonomik kayıplara da neden olurlar (Topal ve ark 1999, Oğuz ve Kurtoğlu 2000, Jouany ve Diaz 2005, Fink-Gremmels 2008a, 2008b). Süt sığırı yemlerinde kullanılan tarımsal ürünlere de (mısır, buğday, soya fasulyesi) bulaşabilirler (Driehuis ve ark 2008, Krska ve ark 2008).
Mikotoksin oluşturan mantarlar dünyanın her tarafında bulunurlar. Gerek sahada ve gerekse de harmanlama, depolanma, taşınma ve hazırlanma safhalarında başta ısı ve rutubet olmak üzere şartlar mantarların gelişmesine uygun olduğu
takdirde yem ve besinler mantarların istilasına uğrayarak mikotoksinlerle kirlenebilirler (Oğuz ve Kurtoğlu 2000) .
Tarihi kaynaklarda insanlığın düzenli tarım üretimine başlamasından beri mikotoksikolojik vakaların meydana geldiği bildirilmektedir. Bazı kaynaklarda M.Ö. 5. yüzyılda Atina Krizine ve Etrüsk medeniyetinin çöküşünden T-2 toksin ve zearalenon (ZON) gibi fusariotoksinlerin sorumlu olabileceği bildirilmektedir (Yiannikouris ve Jouany 2002). Ortaçağ Avrupa’sında ‘holy fire’ veya ‘St. Antony fire’ olarak tanınan ‘ergotizm’ hastalığı bilinen ilk mikotoksikozis olayıdır. Hastalığın Claviceps purpurea ile kontamine olmuş hububatın tüketilmesi sonucu meydana geldiği bildirilmiştir. Japonyada görülen “sarı pirinç” hastalığı ve Rusya’da 2. Dünya Savaşı sırasında ortaya çıkan “Alimentary Toxic Aleukia”nın çok sayıda insanın ölümüne neden olduğu bildirilmektedir (TKB 2002).
Mikotoksin üreten mantarlar tüm dünyada yaygın bir problemdir (Oruç 2005, Pereyra ve ark 2008). Mantar üremesi silaj, yem ve gıdaların besin değerini azaltır (O’Brien ve ark 2006) ve yemin lezzetini bozar (Mansfield ve Kuldau 2007), besin değerini düşürür. Yemin renk, koku, kıvam ve tadında da bazı değişikliklerin oluşmasına neden olmaktadır (Nizamlıoğlu 1996). Günümüze kadar varlığı ortaya konmuş 300.000 den fazla mantar türünden 250 kadarının mikotoksin oluşturduğu ve bunların da 20-25 çeşidinin yem ve besinlerde bulunarak anılan yem ve besin maddelerini tüketme durumunda özellikle kanatlılar olmak üzere hayvan yetiştiriciliğinde verim kayıplarına yol açmasının yanında kanserojenik, mutajenik ve teratojenik maddeler olmaları nedeniyle zehirlenmelere sebep olabileceği ifade edilmektedir (Özkazanç ve ark 1992, Kaya 1998, Şanlı 2000, Ortatatlı ve Oğuz 2001, Karaman ve ark 2005, Karakaya 2006).
Mısır silajı sığır rasyonlarının önemli bir bölümünü oluşturmakla birlikte Aspergillus, Alterneria, Fusarium, Penicillium (Scudamore ve Livesey 1998, O’Brien ve ark 2006), Monascus, Mucor, Absidia, Scopualariopsis ve Trichoderma (Reyes-Velazquez ve ark 2008) mantarları tarafından üretilen mikotoksinlerle kontamine olabilmektedir. Kontamine silajların hayvanlar tarafından tüketilmesi sonucu ciddi sürü sağlığı problemleri ile karşılaşılabileceği bildirilmektedir (Scudamore ve Livesey 1998, O’Brien ve ark 2006).
Mantar üremesinin sıklığı ve derecesi çevre ısısı, rutubet, mekanik hasar, yemin kimyasal bileşimi, yağ ve karbonhidrat içeriği, pH durumu ve hazırlayıcı koşullara göre önemli oranda değişmektedir (Topal ve ark 1999, Garon ve ark 2006, Şanlı 2007). Genellikle ortamın rutubet içeriği ve sıcaklık durumu mantar çoğalması yönünden kritik koşullar niteliğindedir (Bacha ve ark 1988 Whitlow ve Hagler 2002). Mantarlar % 12-13’den daha fazla nem ihtiva eden yemlerde (Türker 1987, Whitlow ve Hagler 2002), oksijenli ortamda, 10 ile 40 ºC sıcaklıkta, pH 4 ila 8 arasında kolayca gelişebilirler (Whitlow ve Hagler 2002). Aspergillus flavus ve Aspergillus parasiticus mantarlarının aflatoksin (AF) oluşturması için besin ve diğer durumlar müsait ise 20-30 ºC’de 3-6 gün yeterlidir (Oğuz 1997).
Dünyanın birçok bölgesinde ruminant beslenmesinde önemli bir yeri olan silajlar başta mısır olmak üzere birçok farklı yem kaynaklarından yapılır. Silaj materyalinin kuru madde miktarı ve pH düzeyi mikotoksin oluşumunda önemli faktörlerden olup aynı zamanda bu faktörler silaj kalitesine de ayrı etki ederler (Kurtoğlu 1998, Auerbach 2003, Diaz 2006). Hayvan beslemede silaj yapımı her geçen gün yaygınlaşmaktadır. Bunun için silajın kaliteli olması hayvan sağlığı ve dolaylı olarak da insan sağlığı açısından ciddi bir önem arz etmektedir (Kurtoğlu ve Coşkun 2001, Garon ve ark 2006).
Silaj yapımında doğranmış yeşil yemin silo içinde tamamen sıkıştırılması gerekmektedir. İyi bir silajda oksijensiz bir ortam sağlanarak laktik asit bakterilerinin üremesi istenir. Laktik asit bakterilerinin üremesi ile devam eden fermentasyon sonucunda pH seviyesi düşer. Düşük pH ve oksijensiz ortam çoğu mantarların üremesi için uygun değildir. Mantarların gelişebilmesi ve mikotoksin üretebilmesi için oksijene ihtiyaçları vardır. Silaj gibi nem oranı yüksek yemlerde mantarlar ancak yeterli oksijen varlığında ve uygun pH düzeyinde gelişebilirler. Yemi yetersiz ya da aşırı soldurma, mantarla bulaşmış ürünün silolanması, ürünün siloya yavaş doldurulması, yem parçalarının iri olması, iyi sıkıştırılmaması, silajın uygunsuz kapatılması, silajın plastik örtüsünde yırtıkların oluşması, silaj hazırlama hataları, silajda bulunan suyun buğu yaparak yoğunlaşması, sıcaklık artışı, açılan silajı yedirmede gecikme, yağmur suyu sızıntısı, böcek enfestasyonu gibi durumlar da istenmeyen aerobik ve mikroaerofilik, aside dayanıklı mantarların üremesine sebep olabilir. Silajı mantar üremesinden ve mikotoksin oluşumundan korumak için
mümkün olduğunca oksijensiz ortamın sağlanması gerekmektedir (Diaz 2006, Garon ve ark 2006).
Silajlarda mikotoksin üreten mantarlardan en önemlileri Fusarium, Penicillium ve Aspergillus türleridir (El-Shanawany ve ark 2005, Diaz 2006, Murphy ve ark 2006). Bunlar AF’ler, deoksinivalenol, ZON, T-2 toksin, verrukolojen, nivalenol, sitrinin, PR toksin, fumonisin, okratoksin A, andastrin, mikofenolik asit, roquefortin A ve C, festuklavin, markfortin A’yı da içine alan mikotoksinleri üretebilirler (Vallone ve ark 1997, Yu ve ark 1999, O’Brien ve ark 2005, Diaz 2006, Garon ve ark 2006, O’Brien ve ark 2006, Ren ve ark 2007, Richard ve ark 2007). Silajda bulunan mantarların aynı anda birden fazla mikotoksin üretebildikleri belirtilmiştir. Silajlarda mantar üremesi buna bağlı multimikotoksin bulaşması sonucunda sinerjik ve potansiyel additif etkileri ile insan ve hayvanlarda ciddi sağlık riskleri oluşturur (Mansfield ve Kuldau 2007).
Mikotoksinlerin rumende mikrobiyel olarak yıkımlanması nedeniyle sığırların mikotoksinlere karşı daha dayanıklı olduğuna inanılmaktadır. Gerçekte in vitro çalışmalar mikrobiyel yıkımlanmanın birçok mikotoksin için oldukça düşük seviyede kaldığı ve yıkımlanma ürünlerinin ana bileşikten daha da toksik olabileceğini göstermiştir. Ayrıca rumende toksinlerin yıkımlanmasına etki eden başka faktörler de vardır. Protozoonlar, rumende mikotoksinlerin detoksifikasyonunda bakterilere göre daha aktif rol oynarlar. Yüksek düzeyde tane yem alımı ve düşük ruminal pH gibi durumlar rumende protozoonların gelişimini engeller ve böylece ruminal mikotoksin yıkımını sınırlandırır. Yine fazla yem alımı ve içeriğin hızlı geçişi gibi diğer faktörler de rumenin mikotoksin yıkım özelliğini azaltır. Stres durumu, enfeksiyöz ajanlar arasındaki etkileşim, yetersiz beslenme, genetik yatkınlık, farklı mikotoksinlerin bir arada bulunması gibi faktörler de sütçü sığırların mikotoksinlere duyarlılığında önemli rol oynarlar (Diaz 2006).
Sağmal hayvanlar tarafından mikotoksinli yemlerin tüketilmesi sonucunda sütlerine mikotoksinin kendisi veya metaboliti geçerek kalıntı oluşturabilmektedir (Kaya 1998, Karakaya 2006, Boudra ve ark 2007, Fink-Gremmels 2008c). Yemlerle alınan AF B1’in sığır ve koyunlarda yaklaşık %0,1-0,3’ü sütle AF M1 halinde
sağlığı yönünden sakıncalı olabilmektedir. Özellikle yemlerle alınan AF’ler sindirim kanalından kolayca emilir ve başlıca karaciğer ile yumuşak dokulara dağılarak metabolize olurlar (Karakaya 2006). AF M1’in de insanlarda karaciğer hastalıklarına
ve kansere neden olan etkilerinin bulunduğu bildirilmektedir. Amerika Birleşik Devletleri ile Danimarka’da AF M1 ile ilgili yapılan çalışmaların bazılarında AF M1
düzeyinin kabul edilebilir sınırları aştığı görülmektedir (Ukan 2003). Türkiye’de süt ürünlerinin AF M1 içerikleri ile ilgili bazı çalışmalarda Türk Gıda Kodeksi
Yönetmeliğinde belirtilen sınır değerinin (0,05 ppb AF M1) aşıldığı kaydedilmektedir
(Kırdar 2006).
Diğer mikotoksinlerden okratoksin A, siklopiazonik asit (Oruç 2005), sterigmatosistin, fumonisin B1, T-2 toksin, ZON ve deoksinivalenol gibi toksinlerin
süte geçtiği ve özellikle ZON’un insan vücudunda hormon düzeyini bozduğu bildirilmiştir (Ukan 2003).
Mikotoksinlerden beş veya altı tanesinin çok önemli olduğu bildirilmekte olup önem derecesine ve bölgelere göre farklılık göstermekle birlikte AF’ler, okratoksin A, fumonisinler, trikotesenler ve ZON’un birinci derecede önemli mikotoksinler olduğu belirtilmektedir (Oruç 2005).
1.8.1.Aflatoksin
Mikotoksinler içerisinde en önemlisi AF’dir (Nizamlıoğlu 1996, Richard ve ark 2007, Fink-Gremmels 2008c, Piermarini ve ark 2009). Çünkü diğerlerine oranla daha toksiktir ve daha kısa sürede oluşurlar (Salwa ve ark 2000). Tüm hayvan türleri ve insanlarda zehirlenmeye neden olurlar; her çeşit yem ile besin maddelerinde bulunabilirler ve karsinojenite riskleri diğer mikotoksinlere göre daha fazladır (Nizamlıoğlu 1996, Giray ve ark 2007).
AF’ler; Aspergillus [Aspergillus flavus (Candlish ve ark 1988, Ranjan ve Sinha 1991, Oğuz ve Kurtoğlu 2000, Kuldau 2001, Khanafari ve ark 2007),
Aspergillus parasiticus (Candlish ve ark 1988, Oğuz ve Kurtoğlu 2000, Kuldau
2001, Khanafari ve ark 2007)] ve bazı Penicillium ve Rhizopous türü mantarlar tarafından üretilen toksik metabolitlerdir (Candlish ve ark1988).
İlk defa 1960 yılı bahar ve yazında gizemli bir hastalık İngiltere’nin kuzey ve güney bölgesinde 100.000’den fazla hindinin ölmesine neden olmuştur. Ördek ve sülünleri de etkileyen bu hastalık ‘Turkey X’ hastalığı olarak adlandırılmıştır. Diyetin değiştirilmesinin morbidite ve mortalite oranını azaltmasıyla bu hastalığın besinsel kaynaklı olduğu fark edilmiştir. Etkilenen tüm hayvanların rasyonunun Aspergillus flavus ile bulaşık olduğu ve ‘aspergillus, flavus, toksin’ kelimelerinin kısaltmasıyla elde edilen ‘aflatoksin‘ adı verilen toksik maddeyi Brezilya yer fıstığının içerdiği saptanmıştır (Özpınar ve ark 1988, Girgin ve ark 2001). Ölen tüm hindilerde akut nekrotik karaciğer bozukluğuna (Robb ve Norval 1983, Badria 1996, Cespedes ve Diaz 1997) ve safra kesesi hiperplazisine rastlanmıştır. Türkiye’de AF sorunu ilk defa 1967 yılında gündeme gelmiş, Kanada’ya ihraç edilen 10 ton iç fındık AF içerdiği gerekçesi ile geri çevrilmiştir. 1971 yılında Amerika’ya ihraç edilen Antep fıstıklarında, 1972 yılında da Danimarka’ya ihraç edilen kuru incirlerde AF bulunmuştur. 1987’de kuru incir ve 1994 yılında kuru kırmızı pul biber ihracatında AF varlığıyla ilgi uyarılar zaman zaman Türkiye gündemine gelmiştir (Kabak ve Var 2006).
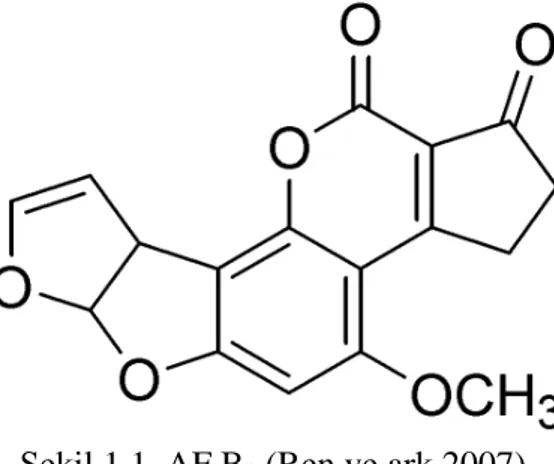
AF’ler kimyasal olarak difurokumarolakton (şekil 1.1) olarak sınıflandırılırlar (Richard ve ark 1993, Şahin 1994, Ren ve ark 2007).
Şekil 1.1. AF B1 (Ren ve ark 2007).
Aflatoksikosiz kanatlılar başta olmak üzere tüm çiftlik hayvanlarında önemli verim kayıpları ve çeşitli toksikasyon belirtileri ile karakterize bozukluklara neden olan önemli bir hastalıktır (Oğuz ve ark 2000, Oğuz ve Kurtoğlu 2000, Nizamlıoğlu ve Oğuz 2003, Oğuz ve ark 2003). Tüm dünya ülkelerinde tarımsal ürünlerde (Bryden ve ark 1980) yol açtığı ekonomik kaybın yanısıra teratojenik, mutajenik, kanserojenik, immunosüpresif etkili bir toksin olması sebebiyle gerek hayvan sağlığı
gerekse insan sağlığı açısından ciddi önem arz etmektedir (Candlish ve ark 1988, Ranjan ve Sinha 1991, Jones ve ark 1994, Ioannou-Kakourı ve ark 1999, Kalkan ve Filya 2005, Şanlı 2007, Bhatnagar ve ark 2008).
AF’lerin B1, B2, G1, G2 ve sütte bulunan M1, M2 formları ve P1, Q1,
aflatoksikol, B2a, G2a, D1, GM1, GM2a, B3 (Betina 1993, Kaya 1998) gibi yaklaşık 20
çeşidi belirlenmiştir. Yem ve besinlerde en sık bulunan ve en önemli mikotoksin AF B1’dir (Oruç ve ark 2007, Fink-Gremmels 2008c). Bunu G1, B2 ve G2 izler (Oruç ve
ark 2007). Sütçü sığırlarda süte geçmesi nedeniyle ülkeler sütte ve süt ürünlerinde bulunmasına müsaade edilen üst sınırlar belirlemişlerdir (Jones ve ark 1994, Kalkan ve Filya 2005, Şanlı 2007). Halk sağlığına etkisine bağlı olarak sütteki AF M1
kalıntısından dolayı en çok araştırılan mikotoksinler AF’lerdir (Fink-Gremmels 2008b).
AF’lerin zehirliliği hayvanların duyarlılık derecesine, türüne, cinsiyetine, ırkına, yaşına, alınan toksinin çeşidine, miktarına, alınma süresine ve yemde başka toksin veya maddelerin bulunup bulunmamasına göre değişir. AF’ler hayvanlarda akut, subakut ve kronik nitelikli zehirlenmelere sebep olabilirler (Nizamlıoğlu 1996). Sığırlarda genellikle canlı ağırlık kazancında (Whitlow ve Hagler 2002, 2005), süt üretiminde azalma (Dokuzlu 2000, Whitlow ve Hagler 2002, 2005), topallık, subklinik mastitis (Özsoy ve ark 2005), fertilite oranında düşüş (Candlish ve ark 1988, Whitlow ve Hagler 2002, 2005, Özsoy ve ark 2005), yem tüketiminde ve yemden yararlanmada azalma, yüksek düzeyde alındığında ölümler, karaciğer lezyonları, kanamalar ile ödemler, karaciğerde yağlanma, böbrek ile beyinde ödemler görülür (Candlish ve ark 1988, Whitlow ve Hagler 2002, 2005).
Toksik düzeyde AF alınmasını takiben 3-6 saat içerisinde karaciğerde hasar, yağ dejenerasyonu ve fonksiyon bozukluğu ortaya çıkar. Karaciğerin ileri derecede hasarına bağlı olarak kanın pıhtılaşma mekanizması bozulur, sarılık durumu gelişir ve karaciğer kaynaklı serum proteinlerinde ciddi azalmalar meydana gelir. Kanın pıhtılaşma yeteneğinin azalması ve kapillar damar çeperlerinin hasarına bağlı olarak mukoz zarlar ve vücut boşluklarında yaygın kanamalar meydana gelir (Oğuz ve Kurtoğlu 2000, Ortatatlı ve Oğuz 2001, Şanlı 2007).
Uzun bir süre içerisinde düşük düzeyde AF alınması sonucunda ortaya çıkan kronik zehirlenmeler subklinik seyrettiği için zehirlenme belirtileri gözden kaçar. Bu tip zehirlenmelerde özellikle bağışıklık sisteminin baskılanması ve kazanılmış direncin kırılması nedeniyle birçok hastalık ön plana çıkar. Hayvanlarda hastalanma ve ölüm oranları artar. Kronik olarak etkilenen hayvanlarda protein sentezi, vitamin ve minerallerin değerlendirilmesi de baskılandığından etkilenen genç hayvanlarda yemden yararlanma ve canlı ağırlık kazancı azalır, büyüme hızı yavaşlar (Candlish ve ark 1988, Nizamlıoğlu 1996, Kuldau 2001) ve ineklerde yavru atma görülür (Nizamlıoğlu 1996, Kaya 1998).
Yem ve besinlerle alınan AF’ler sindirim kanalından hızla emilirler. Vücuda giren toksinin % 85-90’ı ilk 24 saat içerisinde gaita (Nizamlıoğlu 1996), idrar ve sütle (Prior 1976) atılır. Ayrıca yemdeki düzeyin % 0,5 kadarı yumurtaya geçer. Bu durum damızlık işletmelerinde önemlidir, çünkü yumurta sarısında bulunan 0,9 ppb miktarındaki AF, % 50 oranında embiriyo ölümüne yol açabilir. AF’ler, bilinen en önemli karaciğer karsinojenidir (Nizamlıoğlu 1996).
Ülkemizde yemlerde bulunmasına izin verilen AF B1 düzeyleri Tarım ve
Köyişleri Bakanlığı’nın yayınlamış olduğu Yemlerde İstenmeyen Maddeler Hakkında Tebliğde Değişiklik Yapılmasına Dair 27653 sayılı tebliğde (Çizelge 1.5.) bildirilmiştir. Bu çizelgeye göre yem maddesi olan silajda AF B1’in silajda 20 ppb’ye
Çizelge 1.3. AF B1’in yemlerde bulunmasına izin verilen en çok miktarları (Resmi
Gazete 2010).
İstenmeyen madde Hayvan yemi olarak kullanılan ürünler Kabul edilebilir en çok miktarı mg/kg (ppm)
AF B1 Yem maddeleri 0,02
Sığır, koyun ve keçi tam yemleri; aşağıdakiler dışında:
0,02
Süt sığırları için tam yemler 0,005 Buzağı ve kuzular için tam yemler 0,01 Kanatlı ve domuz tam yemleri (genç
hayvanlar hariç)
0,02
Diğer Tam Yemler 0,01
Sığır, koyun ve keçi tamamlayıcı yemleri (süt hayvanları, buzağı ve kuzu yemleri hariç)
0,02
Kanatlı ve domuz tamamlayıcı yemleri (genç hayvanlar hariç)
0,02
Diğer Tamamlayıcı Yemler 0,005
1.8.2. Zearalenon
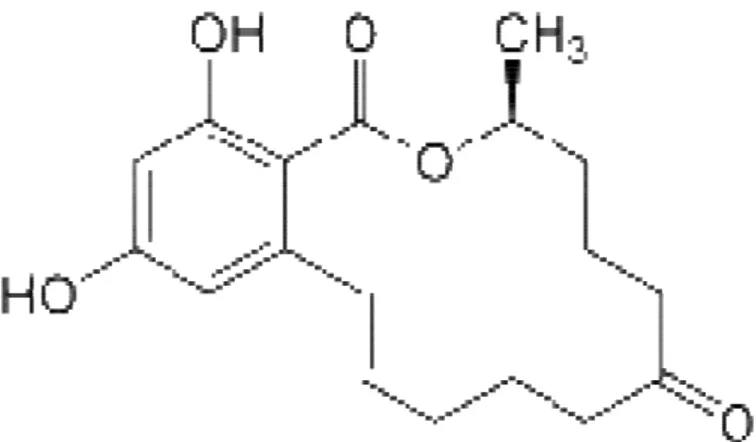
ZON (F-2 toksin), Fusarium cerealis, F. equiseti, F. semitectum (Ostry ve Skarkova 2003), F. roseum, F. graminearum (Richard ve ark 1993, Ren ve ark 2007, Minervini ve Dell’Aquila 2008), F. culmorum (Lepom ve ark 1988, Hadiani ve ark 2003), F. crookwellense (Lepom ve ark 1990) F. moniliforme (Ranjan ve Sinha 1991) F. verticillioides (Richard ve ark 2007) gibi Fusarium türleri tarafından üretilen fenolik rezorsilik asit türevi, büyük lakton yapılı (Şekil 1.2.) (Smith ve ark 2004, Minervini ve Dell’Aquila 2008) güçlü östrojenik bir mikotoksindir (Acet ve ark 1989b, Kaya 1998, Scudamore ve Patel 2000, Campbell ve Armstrong 2007, Whitlow ve Hagler 2007) .
Şekil 1.2. ZON (Minervini ve Dell’Aquila 2008).
Tahılların, yem ve yem hammaddelerinin 24-27 ºC’de yüksek rutubetli (%22) ortamlarda depolanması ZON sentezini teşvik eder. ZON üreten mantarlar 24-27 ºC’de en iyi üremeyi gösterir. Bunlar başta mısır, arpa, yulaf olmak üzere tüm tahıl ile otlarda gelişebilir ve mikotoksin oluşturabilir. ZON son derece dayanıklı bir mikotoksindir; ısıtma ve diğer işlemlerden pek etkilenmez (Kaya 1998). Soğuk ve nem oranının yüksek olduğu mevsimlerde yetiştirilen ve hasat edilen tarım ürünleri ile silajlarda rastlanılmıştır (Kalkan ve Filya 2005).
ZON vücuda girdikten sonra başta zearalenol olmak üzere bir çok metabolite çevrilir, glukuronik asitle birleşerek vücuttan atılır. ZON rumende kısmen metabolize olur. Bununla birlikte metabolitleri asıl toksinden az veya daha çok zehirli olabilir (Seeling ve ark 2005, Adesogan 2006). Süte geçişi azdır ve tüketiciler için ciddi risk oluşturmazlar. İneklere 5 ppm düzeyinde verildikten sonra sütle yaklaşık 76 saat süreyle ZON ve 108 saat süreyle de β-zearalenol halinde çıkarıldığı bildirilmektedir. İneklere yem ile birlikte 25 ppm miktarında verildiğinde sütle ana madde ve metabolitleri halinde 1,3 ppm’e kadar çıkarılır. Koyunlara 1,8 ppm miktarda verilen ZON süte 1-2 ppb miktarında geçebilir; bu düzeyde toksin içeren sütü emen yavrularda 10 gün içinde östrojenizm belirtilerinin ortaya çıkabileceği ifade edilmiştir (Kaya 1998).
ZON’a karşı hayvanların duyarlılığı önemli ölçüde değişir; en duyarlı hayvan domuz ve en dayanıklı olanlar da kanatlılardır (Kaya 1998). Sütçü ineklerde yemlerdeki oranlarına bağlı olarak gösterdikleri östrojenik etki ile siklus düzensizliklerine, kalıcı korpus luteum ile serum progesteron düzeylerinin yüksek olarak devam etmesine (Oruç 2005), infertile ve abort problemlerine neden olur
(Whitlow ve Hagler 2005 Adesogan 2006). Yem alımında azalma, süt üretiminde düşüş, vaginitis, vaginal sekresyonlar ile düvelerde meme bezlerinde ve genital bölgede ödem ve hipertrofiye neden olurlar (Jones ve ark 1994). Ayrıca genç erkeklerde, dişilik belirtileri ve infertilite problemleri bildirilmiştir (Sebater-Villar ve ark 2005).
Farelerin uzun süre ZON’a maruz kalmaları karsinojeniteye neden olabildiğinden Uluslararası Kanser Araştıma Merkezi, ZON’u karsinojen etkenler içinde 3. grupta sınıflandırmıştır (WHO 2000, 2010). Türkiye’de ZON’un silajlarda bulunabilmesine izin verilen düzeyleri hakkında herhangi bir veri yoktur.
1.9. Amaç
Uygun şartlarda yapılmayan silolanmış kaba yemlerde görülen mikotoksinler süt ineklerinde verim ve sağlığı doğrudan etkiler. Dolayısıyla silajların kalitelerinin değerlendirilmesinde rutin mikotoksin analizleri önemli bir kriterdir. İyi bir silaj hazırlama tekniği ve uygulama pratiği ile mantar ve mikotoksin üremesi için gerekli şartlar sınırlandırılabilir (Diaz 2006).
Mikotoksinli yem alan sağmal hayvanlar toksinleri sütle çıkararak insanlar için ciddi bir sağlık sorunu oluştururlar. İnsanlar bu toksinleri doğrudan gıdalarla (tarımsal ürünler ile) dolaylı olarak da mikotoksinli yem ile beslenen hayvanların sütleriyle alabilmektedirler. Yem kalitesi, hayvan sağlığı ve yetiştiriciliğini doğrudan etkilediğinden ülke ekonomisi için de oldukça önemli görülmektedir.
Silaj yapımı dünyada olduğu gibi ülkemizde de hayvan besleme alanında en sık kullanılan depolama yöntemlerinden birisidir. Silolama prensiplerine uyularak yapılan silaj yemlerinde arzu edilmeyen mikroorganizmaların üremesi büyük ölçüde engellenir. Ancak usulüne uygun olarak yapılmayan silajlar, mikotoksin üreten mantarlar için uygun bir üreme ortamı oluşturabilirler. Bu bakımdan silajların belli aralıklarla toksikolojik analizlerinin yapılması gerekmektedir. Mikotoksin zehirlenmeleri genellikle kronik seyirli olması nedeniyle klinik belirtiler oldukça geç ortaya çıkmakta ve yetiştiriciler tarafından kolaylıkla fark edilememektedir. Bu nedenle yetiştiriciler yem maddesinin rutin kontrolünü ihmal etmekte ve genellikle
sağlık problemleri çıktıktan sonra çözüm aramaktadırlar. Özellikle süt sığırı yetiştiriciliğinde görülen jinekolojik problemler bu konunun önemini daha da artırmaktadır.
Türkiye’de ve özellikle silajın yaygın olarak yapıldığı İç Anadolu Bölgesinde AF B1 ve ZON gibi mikotoksinlerin silajlardaki durumu ile ilgili ayrıntılı bir çalışma
bulunmamaktadır. Sunulan bu çalışma ile İç Anadolu Bölgesi illerinden (13 il) toplanan silaj örneklerinde;
• Silo tipi, silajın genel görünümü, iklim şartları, katkı maddeleri, pH ve % KM oranlarının tespiti,
• AF B1 ve ZON düzeylerinin tespiti,
• Silaj özelliklerinin mikotoksin üremesine muhtemel etkilerinin belirlenmesi,
• Geçerliliği denenmiş yöntemlerin rutin analizlerde kullanılabilir hale getirilmesi.
2. GEREÇ ve YÖNTEM
2.1. Etik Kurulu Onayı
Bu proje Selçuk Üniversitesi Veteriner Fakültesi Etik Kurulu’nun 08.10.2007 tarihli 2007/053 karar sayılı onayı (Bkz. EK-A) ile gerçekleştirilmiştir.
2.2. Kullanılan Alet ve Malzemeler
Derin Dondurucu (-20 °C, Arçelik, Türkiye)
pH metre (Orion Research Inc., Orion PerpHec T pH Meter, USA) Ultra Saf Su sistemi (Elga, Purelab Ultra, Germany)
Hassas Terazi (Mettler Toledo, PG203-S, Switzerland) Benmari (Memmert, Germany)
Vorteks (IKA, MS2 MinishakerUSA)
Fluorodansitometre (Camag, TLC Scanner 3, Basel, Switzerland) (Resim 2.1.) Linomat 5 (Camag, Basel, Switzerland) (Resim 2.2.)
AMD 2 (Camag, Basel, Switzerland) (Resim 2.3.)
Developman Tankı (23X20X8, Camag, Basel, Switzerland) Mikro Enjektör (100 µl, Camag, Basel, Switzerland)
Blendır (Arçelik, Türkiye) Öğütücü (Arçelik, Türkiye)
Çalkalayıcı (IKA, Vibrax-Vxr, USA)
Etüv (240ºC, Termal Laboratuar Aletleri, Türkiye) Seyyar Buzdolabı (+4ºC Evercool, Laurina, Hong Kong)
Vakum Pompası (W. Edwards & Company (London) Ltd., Speedivac, England) Vakumlu Paketleme Makinesi (Kramer&Grebe, Compack, Western Germany) Azotlu Uçurma Sistemi (Teknosem, TAB 40-WT Evaporater, Türkiye)
Polietilen Torbalar (1 kg)
Cam Şişeler (50 ml, 500 ml, 1000 ml) Cam Tüp (10x15)
Ayırma Hunisi (500 ml, İldam, Türkiye) Mezür (100 ml, İldam, Türkiye )
Yüksek Performanslı İnce Tabaka Kromatografi (HPTLC) Plakaları (20x20, silica gel 60, Merck, USA)
Filtre Kağıdı ( 40x40, Macherey-Nagel, Germany) Cam Pamuk (Merck)
Cam Kolon (18mm x 400mm) Enjektörler (2-10 ml, Hayat)
Resim 2.1. Fluorodansitometre (Camag, Basel, Switzerland).
Resim 2.2. Linomat 5 (Camag, Basel, Switzerland).
2.3. Kimyasal Maddeler, Çözeltiler ve Standartlar
Sodyum sülfat granül (Merck), florosil (Merck), silica jel 60 (Merck), susuz sodyum sülfat (Merck), alüminyum klorür (AlCl3. 6H2O, Merck), sodyum hidroksit
(Na OH) (Merck), kloroform (Merck), ultra saf su (18mΩ), toluen (Merck), metanol (Merck), aseton (Merck), n-hekzan (Merck), benzen (Merck), asetonitril (Merck), dietileter (Merck), orto-fosforik asit (Merck), sülfirik asit (Merck), AF B1 (34029,
%99 Sigma-Aldrich), ZON (Z2125 >%99, Aldrich-Sigma) kullanıldı.
AF B1 standart için stok solüsyon 20 µg/ml olacak şekilde benzen+asetonitril
(98+2)’de çözdürüldü. Çalışmada kullanılmak üzere 0,5; 1; 2; 2,5; 3; 5; 10; 15; 20 µg/ml’lik çalışma standartları hazırlandı ve çalışma süresince alimunyum folyaya sarılı olarak 0 °C’de tutuldu. ZON standart için benzende 1000 µg/ml çözdürülerek stok solüsyonu hazırlandı ve çalışma da kullanılmak üzere 2,5; 5; 7,5; 10; 15; 20; 25; 50; 75; 100 µ g/ml’lik standart çalışma solusyonları hazırlandı ve -20 ºC’de aliminyum folyoya sarılı olarak derin dondurucuda saklandı (Trucksess 2000).
Doğrulama test solusyonu olarak sülfirik asit çözeltisi (%25’lik alkolde) ve alüminyum klorür (20 g AlCl3. 6H2O, 100 ml alkol) çözeltileri hazırlandı (Trucksess
2000). ZON ekstraksiyonu için %4’lük NaOH solusyonu ve 0,7 Molar orto-fosforik asit solusyonu hazırlandı (Lepom 1988).
2.4. Silaj Materyali
Çalışmada kullanılan mısır silajı örnekleri İç Anadolu Bölgesi’nin tüm illerinden (Aksaray, Ankara, Çankırı, Eskişehir, Karaman, Kayseri, Kırıkkale, Kırşehir, Konya, Nevşehir, Niğde, Sivas, Yozgat) Eylül 2007 tarihinden sonra hazırlanmış silolardan 1 Mart-31 Mayıs 2008 tarihleri arasında toplandı. Bu illerin her birinden AF B1 ve ZON analizleri ile KM tayini ve pH ölçümleri için yaklaşık 1
kg’lık 20 farklı silodan silaj örneği alındı. Böylece 13 ilden toplam 260 örnek alındı. Siloların hayvan tüketimine sunulan kesit yüzeylerinin üst, orta ve alt bölümlerinin her birinin 10’ar farklı noktasından mısır silajı örnekleri alınarak homojenize edildi. +4 ºC’de taşınarak polietilen torbalarda vakumlandı ve analize kadar -20 °C’de derin dondurucuda saklandı (Driehuis ve ark 2008, Greenhill ve ark 2008).
2.5. Meteorolojik Veriler
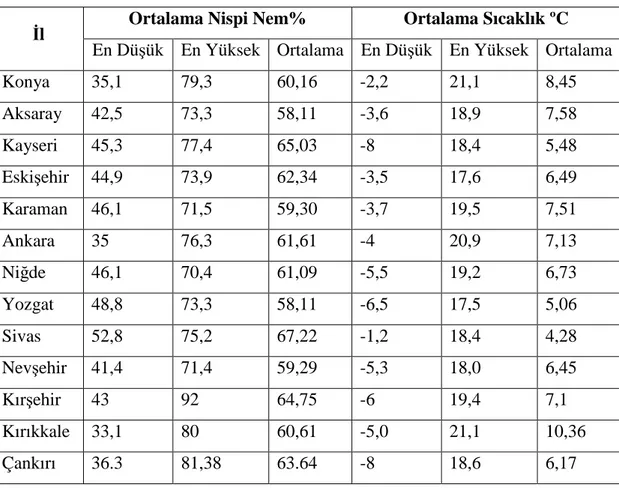
Konya Meteoroloji Bölge Müdürlüğü’nden İç Anadolu Bölgesi’ndeki 13 ile ait 2007 yılı Eylül ayından 2008 yılı Mayıs ayına kadar geçen süreye ait sıcaklık değerleri ve nispi nem oranları hakkında bilgiler alındı (Konya Meteoroloji Bölge Müdürlüğü 2009).
2.6. Anket Formları
Örnek alınırken Silaj Toplama Formu (EK-B) ve Silaj Gözlem Formu (EK-C) dolduruldu. Silo tipi, silajın yapıldığı işletme tipi, silajı yapılan bitkinin hasattan kaç gün sonra siloya doldurulduğu, silajın kapalı kalma süresi, genel görünümü, silajda katkı maddesi kullanılıp kullanılmadığı, silajın yapılış tekniği, rengi, kokusu, mantar üremesinin olup olmadığı ve sıkıştırılma durumu ile ilgili bilgiler kaydedildi.
2.7. pH Ölçümleri
20 g silaj numunesi 180 ml bidistile su ile 3-4 dakika blendırda karıştırıldıktan sonra 250 ml’lik şişelere alındı. pH metrenin probu tabanına temas etmeyecek şekilde şişeye daldırıldı. pH sabitlendikten sonra ölçümler yapıldı (Buck ve ark 2002).
2.8. Kuru Madde Tayinleri
Kuru madde tayinleri iki paralel örnekle çalışıldı. Sıcaklığa dayanıklı plastik kaplar etüvde 50 ºC’de ısıtılarak nemleri alındı. Plastik kapların sıcaklığı oda sıcaklığına ulaştığı zaman hassas terazide daraları alındı ve içine 50 g silaj numunesi ilave edilerek tartıldı. 36-48 saat süreyle 55-60 ºC’de etüvde bekletildi. 36. saatten itibaren silaj numunesi birer saat aralıklarla tartıldı. Her bir tartımda ağırlığın daha da azaldığı görüldü. Tekrarlanan bu tartım işlemi ağırlığın değişmeyip sabit kaldığı zamana kadar devam ettirildi. Bu aşamadan sonra plastik kabın darası çıkarılarak silajın ağırlığı tespit edildi.
2.9. AF B1 Analizleri
AF B1 analizleri Kamimura ve ark (1985)’nın belirtmiş oldukları yöntemler
modifiye edilerek gerçekleştirildi.
2.9.1. AF B1 Ekstraksiyonu
Etüvde kurutulmuş silaj örneklerinden 20 gram tartılıp öğütüldü. Cam kavanozlara konulan silaj örneği üzerine 100 ml kloroform ve 10 ml distile su ilave edildi. Ağzı kapatılarak 10 dakika süreyle çalkalayıcıda karıştırıldıktan sonra 10 g Na2SO4 konmuş süzgeç kağıdından süzüldü. Elde edilen ekstraktan 50 ml’si kolon
kromatografisi için ayrıldı.
2.9.2. AF B1 Kolon Kromatografisinde Temizleme İşlemi
Cam kolonun tabanına cam pamuğu yerleştirildi. Üzerine 5 ml kloroform aktarıldı. Önce 5 g susuz granüllü sodyum sülfat, sonra 0,7 g florosil ve tekrar 0,5 g susuz granüllü sodyum sülfat konularak kolon hazırlandı. Daha önce ayrılan 50 ml ekstraktın hepsi bu kolona döküldü. Sırasıyla 30 ml kloroform+n-hekzan (1+1) ve 20 ml kloroform+metanol (9+1) ile yıkama işlemi yapıldı. 30 ml aseton+bidistile su (9+1) ile AF B1 elüsyon örnekleri potaya alındı. Benmaride 50 ºC’de kuruyuncaya
kadar uçuruldu. İki kere 1’er ml asetonla çözülerek tüpe alınıp tekrar uçuruldu.
2.9.3. AF B1 İnce Tabaka Kromatografisinde Plakaya Lekelerin Uygulanması
Elde edilen AF B1 eluatı 200 µl benzen+asetonitril (98+2)’de çözdürüldü.
Spot uygulama düzeneği olan Linomat 5 (Resim 2.2.) ile HPTLC plakasının altından 11 cm uygulama noktası seçilerek 20 µl örnek plakaya uygulandı. Örnek uygulama yerinden 15 mm aralıkla 0,5 µg/ml’lik AF B1 çalışma standardından 20 µl (10 ng)
2.9.4. AF B1 Developman Sistemi
Kirliliklerden arındırmak için susuz dietileterde ters developman yapıldı. Plaka önce developman tankında dietileterde sonuna kadar yürütüldü. Tanktan çıkarılıp havada kurutuldu. Yürütme yönünün tersi istikametinden ve uygulama noktasının 1 cm altından plaka makasla kesildi. (Scott 1995, Nizamlıoğlu 1996). İkinci devolapman AMD 2’de (Resim 2.3.) kloroform+aseton+bidistile su (88+12+0,1) karışımında 90 mm yürütülerek gerçekleştirildi.
2.9.5. AF B1’in Miktar Tayini
AF B1’in kantitatif tayini HPTLC plaka kullanılarak fluorodansitometrede
(Resim 2.1.) gerçekleştirildi. Dalga boyu : 366 nm Lamba : HG Ölçüm tipi : Remission Ölçüm modu : Floresans Optik filtre : K400 Dedektör mod : Otomatik Rf (Yürüme mesafesi) yaklaşık : 0,61 mm
2.9.6. AF B1 Doğrulama Testi
Doğrulama testi için HPTLC plakalara % 25’lik sülfirik asit püskürtüldü. 366 nm dalga boyu ışık altında plakalardaki mavi-yeşil renkten sarıya dönen lekeler müspet kabul edildi (Şanlı ve ark 1982, Trucksess 2000).
2.10. ZON Analizleri
2.10.1. ZON Ekstraksiyonu
Etüvde kurutulmuş silaj örneklerinden 50 gram tartıldıktan sonra öğütülerek cam şişelere konuldu. Üzerine 20 ml bidistile su ve 200 ml kloroform+metanol (9+1) karışımı eklenerek 60 dk çalkalayıcıda karıştırıldıktan sonra süzgeç (filtre) kağıdından süzüldü. Elde edilen filtratın 50 ml’si ayırma hunisine alındı. Üzerine 50 ml % 4’lük NaOH eklenerek 1 dk süreyle karıştırıldı. Kloroform fazı atıldı. Alkali çözelti 25 ml kloroform ile yıkandı. Sulu faz alınarak 0,7 M fosforik asitle pH’sı 8 olacak şekilde tamponlandı. İki kez 50 ml kloroform ile ekstrakte edildi. Birleştirilen kloroform ekstraktları susuz NaSO4’dan süzüldü. Ekstraktın 80 ml’si alınarak
uçuruldu.
2.10.2. ZON Minikolon Kromatografisinde Temizleme İşlemi
Süzgeç kağıdı 2 ml’lik enjektörün tabanına yerleştirildikten sonra 1 g silika jel-60 enjektör içine doldurularak minikolon hazırlandı. Uçurulan ekstrakt 3x200 µl kloroform ile minikolona aktarıldı. Solüsyonun buharlaşmasından sonra 10 ml’lik enjektörle minikolon dk’da 5-7 ml akış hızında 5 ml toluen ile yıkandı. Minikolondan toluen+aseton (9+1) karışımından 15 ml akıtılarak eluat elde edildi. Eluat uçurularak kurutuldu.
2.10.3. ZON İnce Tabaka Kromatografisinde Plakaya Lekelerin Uygulanması
Eluat 0,5 ml kloroformla çözüldü. Uygulama düzeneği olan Linomat 5 ile HPTLC plakanın (10x20 cm’lik) alttan 1 cm uygulama noktası seçilerek 1 µl örnek plakaya uygulandı. Örnek uygulama yerinden 15 mm uzaklığa 5 µg/ml’lik ZON çalışma standardından 10 µl (50 ng) uygulandı.
2.10.4. ZON Developman Sistemi
HPTLC plaka AMD 2’de kloroform+metanol (97+3) karışımında 90 mm yürütüldü.
2.10.5. ZON Miktar Tayini
ZON’nun kantitatif tayini HPTLC plaka kullanılarak fluorodansitometrede gerçekleştirildi. Dalga boyu : 254 nm Lamba : HG Ölçüm tipi : Remission Ölçüm modu : Floresans Optik filtre : K320 Dedektör mod : Otomatik Rf (Yürüme mesafesi yaklaşık) :0,72
2.10.6. ZON Doğrulama Testi
Doğrulama testi için alüminyum klorür çözeltisi plaka üzerine püskürtülerek 130 ºC’de 5 dakika tutuldu. 254 nm dalga boyu ışık altında yeşil-mavi floresans renk verenler ve 366 nm dalga boyunda mavi floresans renk verenler müspet kabul edildi (Trucksess 2000).
2.11. Metot Validasyonu
Metot validasyonunun belirlenmesinde performans ölçütleri olarak özgünlük (specificity), doğrusallık (linearity) ve ölçüm aralığı (range); geri kazanım (recovery); duyarlılık (sensitivity-tespit sınırı ve ölçülebilirlik sınırı) ve kesinlik (precision) alındı (EC 2002, Üney 2007, Avcı 2010, Eurochem Guide 2010, Yılmaz 2010).
2.11.1. Özgünlük (Specificity)
Özgünlük, bulunması muhtemel diğer bileşenlerin (parçalanma ürünleri ortam bileşenleri vb.) varlığında istenilen analiti açık bir şekilde gözlemleyebilme yeteneğidir. Tayin edilecek maddelerin analiz sonuçları ortamda bulunan başka maddelerden etkilenmemelidir.
Aranan maddeleri içermeyen silaj örnekleri kullanılarak dansitogramda AF B1’in ve ZON’un yürüme mesafelerinde (RF) silaj ve diğer maddelerden
kaynaklanan piklerin girişim yapıp yapmadığı incelendi (EC 2002, Üney 2007, Avcı 2010).
2.11.2. Doğrusallık (Linearity)
Bir analitik prosedürün doğrusallığı (belirli sınırlar içerisinde) ölçülen analitin konsantrasyonu (miktarı) ile dedektör cevabının ne derece doğru orantılı olduğu ile belirlenir (EC 2002, Üney 2007, Avcı 2010).
Çalışma boyunca kullanılacak standartlar, AF B1 için 0,5, 1; 2; 2,5; 5; 7,5; 10;
15; 20 µg/ml’lik; ZON için 2,5; 5; 7,5; 10; 15; 25; 50; 75; 100 µg/ml’lik dilusyonlar şeklinde günlük olarak hazırlandı. Konsantrasyonların pik alanları tayin edildi. Konsantrasyonlar ve bu konsantrasyonlara gelen pik alan değerleri kullanılarak kalibrasyon eğrileri çizildi ve korelasyon katsayıları hesaplandı.
2.11.3. Geri kazanım (Recovery)
Bir analitin geri kazanım oranı, o analitten numune ortamına eklenen miktarın ortaya çıkardığı dedektör cevabın saf orijinal standardın cevabına oranıdır. Geri kazanım bir analitik metodun ekstraksiyon verimliliğini ölçerken belirli limitler içerisindeki sapmalar dikkate alınarak numune saflaştırma sırasında ortaya çıkan kayıpları da gösterir. % Geri kazanım: Ölçülen değer/teorik değer x 100 olarak ifade edilir.
Aradığımız maddeleri içermeyen silaj örneklerine AF B1 ve ZON içeren
standart solüsyonların farklı miktarları(final konsantrasyonları AF B1 için 10, 20, 30
ng/g; ZON için 50, 100, 200 ng/g) her bir düzey için 10’ar kez tekrarlı olarak eklendi. Geri kazanımlar, herhangi bir numune gibi değerlendirilen silaj örneklerinde tayin edilecek maddelerin pik alanlarının standartların pik alanları ile karşılaştırılmasıyla hesaplandı (EC 2002).
2.11.4. Duyarlılık (Sensitivity)
Duyarlılık bir analitik yöntemin saptayabildiği en küçük konsantrasyon değeri olup tespit sınırı [limit of detection (LOD)] ve ölçülebilirlik sınırı [Limit of quantification (LOQ)] olarak ifade edilir. LOD, analit sinyalin geri plan gürültüden ayrılabilmesi için gereken en az analit miktarıdır. LOQ, analitin güvenilir bir şekilde doğru ölçümünün yapılabilmesi için gerekli en düşük miktardır. Tespit sınırı olarak gün içi tekrar edilebilirlik çalışmasının en küçük değerinin standart sapmasının 3 katı olduğu konsantrasyon düzeyi baz alınırken, ölçülebilirlik sınırı olarak gün içi tekrar edilebilirlik çalışmasının en küçük değerinin standart sapmasının 10 katı olduğu konsantrasyon düzeyi baz alındı (Eurachem Guide 2010, Yılmaz 2010).
2.10.5. Kesinlik (Precision)
Bir analitik metodun kesinliği, önceden tanımlanmış şartlarda birden çok kez alt numuneleri alınan homojen bir numuneden yapılan ölçümlerin birbiriyle uyumudur (dağılım oranı). Kesinlik istatistiksel olarak yeterli sayıda (ör: ≥10) numuneden elde edilen ölçümlerin bağıl standart sapmalarının yüzdeleridir [(% Varyasyon Katsayısı (VK)].
Bir analitik metodun takip eden ölçümleri arasındaki yakınlık derecesinin ifadesidir. Kesinlik parametresi standart sapma ve/veya varyasyon katsayısıyla ifade edilir. Analitik yöntemin kesinliğinin belirlenmesi için istatiksel açıdan yeterli sayıda aynı konsantrasyona sahip örnekler kullanılarak ortalama, standart sapma ve varyasyon katsayıları tayin edilir.
Kesinlik için gün içi ve günler arası tekrar edilebilirlik (repeatability) ölçüt olarak kullanıldı. Tekrarlanabilirlik (r), kısa bir zaman aralığında aynı uygulama şartları altındaki kesinliği ifade eder. Bu nedenle; aynı analist, aynı ekipman, tekrarlı analizler arasında yakın zaman aralıkları, aynı kimyasallar, aynı laboratuvar vs. kullanılarak yapılan ölçümlerin kesinliğidir.
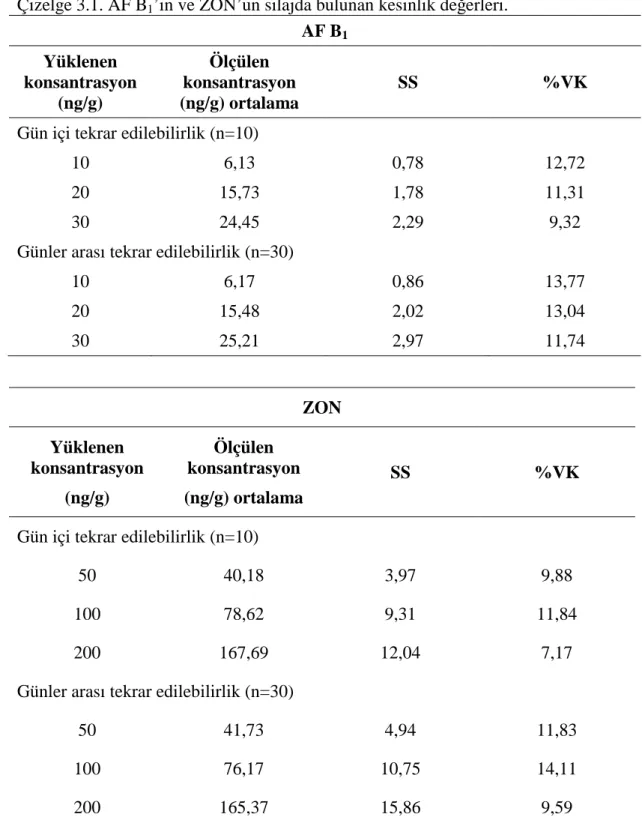
Gün içi ve günler arası farklılığın tespiti için standart solüsyonların ölçüm aralığında yer alan 3 farklı miktarı (AF B1 için 10, 20, 30 ng/g ve ZON için 50, 100,
200 ng/g) ana madde içermeyen silaj örneklerine eklendi. Her düzeyde 10 tekrarlı analiz yapıldı. Bu kademeler 3 farklı günde tekrarlandı. Tüm örneklerde konsantrasyon tayin edildi. Zenginleştirilmiş silaj örneklerindeki konsantrasyonlar üzerinden ortalama, standart sapma ve % VK hesaplandı. Tekrar edilebilirlik, pik alanlara karşılık gelen konsantrasyonların % varyasyon katsayılarının 15’den küçük olmasına göre değerlendirildi (EC 2002, Üney 2007, Avcı 2010).
3.BULGULAR
3.1. Metot Validasyonu
3.1.1. Özgünlük
AF B1 ve ZON içermeyen silaj örneklerinin HPTLC plakalarda
fluorodansitometrik ölçümleri sonrasında dansitogram üzerinde AF B1 ve ZON’un
plaka üzerinde yürüme mesafelerinde (RF) silaj kaynaklı pikler (Şekil 3.1.) gözlenmedi. A Rf B Rf AF B1
C
Rf
D
Rf
Şekil 3.1. AF B1 ve ZON’un dansitogramları: AF B1 için boş silaj örneği (A),
AF B1 silaj örneği (B), ZON için boş silaj örneği (C), ZON silaj örneği (D). ZON
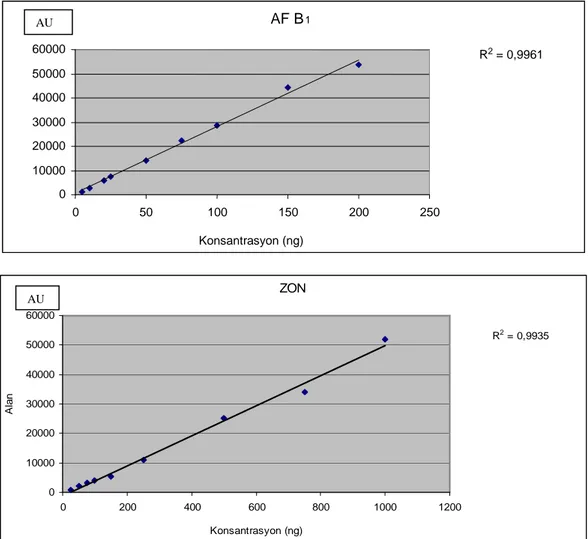
3.1.2. Doğrusallık
AF B1’in standart solüsyonları 5; 10; 20; 25; 50; 75; 100; 150; 200 ng ve
ZON’un standart solüsyonları 25; 50; 75; 100; 150; 250; 500; 750; 1000 ng olacak şekilde HPTLC plakalara 10 µl uygulandı. Konsantrasyonlar ve bu konsantrasyonlara karşılık gelen pik alan değerleri kullanılarak çizilen kalibrasyon eğrileri ve hesaplanan korelasyon katsayıları (AF B1 için r2= 0,9961, ZON için
r2=0,9935) (Şekil 3.2)’na dayanılarak metotların AF B1 için 5-200 ng ve ZON için
25-1000 ng aralıklarında doğrusal olduğu belirlendi.
ZON R2 = 0,9935 0 10000 20000 30000 40000 50000 60000 0 200 400 600 800 1000 1200 Konsantrasyon (ng) A la n
Şekil 3.2. AF B1’in (5-200 ng) ve ZON’un (25-1000 ng) farklı konsantrasyonlardaki
standart çözeltilerinin kalibrasyon doğruları ve korelasyon katsayıları.
AF B1 R2 = 0,9961 0 10000 20000 30000 40000 50000 60000 0 50 100 150 200 250 Konsantrasyon (ng) AU AU
3.1.3. Geri Kazanım
AF B1 ve ZON’u içermeyen silaj örneklerine AF B1 10, 20, 30 ng/g olması
için standart çalışma solüsyonundan ZON için 50, 100, 200 ng/g standart çalışma solüsyonlarından yükleme yapılarak hesaplanan ortalama geri kazanım değerleri AF B1 için % 73,82; ZON için % 80,94 olarak belirlendi. Resim 3.1.’de AF B1 ve
ZON’un HPTLC plakalarda vermiş oldukları floresans lekeler görülmektedir.
Resim 3.1. (A) AF B1’li silaj örneğinin 366 nm’de ve (B) ZON’lu
silaj örneğinin 254 nm’de geri kazanımda HPTLC plakada vermiş olduğu floresans lekeler.
3.1.4. Duyarlılık
LOD: Gün içi tekrar edilebilirlik çalışmasının en küçük değerinin standart
sapmasının 3 katı AF B1 için 2 ppb ve ZON için 12 ppb olarak belirlendi.
LOQ: Gün içi tekrar edilebilirlik çalışmasının en küçük değerinin standart
sapmasının 10 katı AF B1 için 8 ppb, ZON için 40 ppb olarak hesaplandı.
A