T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ DERMATOLOJİ ANABİLİM DALI
ALOPESİ AREATA HASTALARINDA TOTAL
OKSİDAN/ANTİOKSİDAN DÜZEYLERİ VE OKSİDATİF
STRES İNDEKSİ
Dr.VEYSEL MURAT İNAÇ TIPTA UZMANLIK TEZİ
T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ DERMATOLOJİ ANABİLİM DALI
ALOPESİ AREATA HASTALARINDA TOTAL
OKSİDAN/ANTİOKSİDAN DÜZEYLERİ VE OKSİDATİF
STRES İNDEKSİ
Dr. VEYSEL MURAT İNAÇ TIPTA UZMANLIK TEZİ
Prof. Dr. SEDAT AKDENİZ
TEŞEKKÜR
Dicle Üniversitesi Tıp Fakültesi Deri ve Zührevi Hastalıkları kliniğindeki uzmanlık eğitimim süresince yetişmemde büyük emeği geçen, her türlü konuda desteğini esirgemeyen, tecrübe ve deneyimlerinden çok şey kazandığım değerli hocalarım başta Prof. Dr. Sedat AKDENİZ olmak üzere, Prof. Dr. Mehmet HARMAN, Prof. Dr. Mustafa ARICA, Prof. Dr. Sema AYTEKİN, Yrd.Doç. Dr. Derya UÇMAK, Yrd. Doç. Dr. Zeynep Meltem AKKURT ve Yrd. Doç. Dr. Bilal SULA’ ya şükranlarımı sunarım.
Asistanlık eğitimim süresince klinikteki çalışmalarımda ve tezimde yardımlarını esirgemeyen Dr. Abdullah KIVRAK ile Dr. Gurbet ACAR’ a ve de fedakar değerli arkadaşlarım Deri ve Zührevi Hastalıklar kliniği asistanlarına, hemşirelerine ve personeline, laboratuar çalışmaları esnasında yardımlarından dolayı Biyokimya A.D. çalışanlarına, Dr. Murat AR ve Dr. Cemal POLAT’ a ayrıca teşekkür ederim.
Son olarak asistanlık eğitimim boyunca her türlü destek ve katkılarını esirgemeyen sevgili eşime, canım kızıma, anneme, babama ve ablalarıma sevgilerimi sunarım.
ÖZET
Bu çalışmadaki amacımız alopesi areata hastaları ile sağlıklı kontrollerin total oksidan/antioksidan kapasite düzeylerini karşılaştırmak, oksidatif stres indekslerini hesaplamak ve bu durumun alopesi areata hastalığının etiyopatogenezinde rolünün olup olmadığını araştırmaktı.
Çalışmamızda Temmuz 2012 ve Kasım 2012 tarihleri arasında Deri ve Zührevi hastalıklar polikliniğine başvuran 30 sağlıklı kontrol ve 30 alopesi areata hastasının total oksidan ve antioksidan kapasite düzeyleri ölçüldü. Çalışmaya son iki aydan beri immünsüpresif tedavi almayan, konjenital anomali, kronik sistemik hastalık, akut infeksiyon, septisemi ve akciğer hastalığı gibi hastalıkları bulunmayanlar dahil edildi. Çalışmada kullanılan kontrol grubu hasta grubun yaş ve cinsiyet özelliklerine göre seçildi. Total oksidan ve antioksidan kapasite düzeyleri Erel metodu ile Dicle Üniversitesi Tıp Fakültesi Biyokimya Laboratuarında çalışıldı.
Sonuçlarımızda yaş ve cinsiyet açısından hasta grup ile kontrol grubu arasında istatistiksel olarak anlamlı bir fark yoktu (p >0.05). Total antioksidan kapasite düzeyleri hasta grupta kontrol gruba kıyasla daha düşüktü ve bu istatistiksel olarak anlamlıydı (p <0.05). Total oksidan düzeyleri ve Oksidatif stres indeksi açısından hasta ve kontrol grupları arasında istatistiksel olarak anlamlı bir fark saptanmadı (p >0.05).
Biz bu sonuçlarla, azalmış total antioksidan kapasite düzeylerinin alopesi areata patogenezinde rol oynayabileceğini ancak oksidatif stresin hastalığın patogenezinde herhangi bir rolünün bulunmadığı düşüncesindeyiz.
ANAHTAR KELİMELER: Alopesi areata, oksidatif stres, total antioksidan
ABSTRACT
In this study our aim was to compare total oxidant/antioxidant capacity levels and to calculate oxidative stres index of alopecia areata patients and healthy controls, and to investigate whether this situation has a role in the etiopathogenesis of alopecia.
In our study, total antioxidant and oxidant capacity levels of 30 alopecia areata patients and 30 healthy controls who visited Dermatology and Venerology outpatient clinic between July 2012 and November 2012, were measured. Patients without history of acuta infection, septicemia , lung disease, congenital anomalies or chronic sistemic disease and those who had not received any immünsupressive therapy for at least two months were accepted for the study. The control group used in this study were selected according to age and gender characteristics of the patient group. Total oxidant and antioxidant capacity levels were evaluated by the Erel method at Dicle University Medical Faculty Biochemistry Laboratory.
In our results, there was no statistically significant difference between patient and control groups in terms of age and gender (p >0.05). Total antioxidant capacity levels were lower in the patient group compared to the control group and this was statistically significant (p <0.05). There was no statistically significant difference between patient and control groups in terms of total oxidant levels and oxidative stres indices (p>0.05).
İÇİNDEKİLER
Sayfalar
Teşekkür………...i
Özet……….ii
İngilizce Özet (Abstract)………...iii
Simgeler ve Kısaltmalar Dizini……….. v
1. Giriş ve Amaç……….1 2. Genel Bilgiler………..2 2.1. Alopesi Areata………..2 2.1.1. Tarihçe……….. 2 2.1.2. Epidemiyoloji………....2 2.1.3. Etiyopatogenez………..2 2.1.4. Genetik faktörler………...2 2.1.5. Atopi………. 3 2.1.6. Otoimmünite………. 3 2.1.7. Emosyonel stres……….... 4 2.1.8. Melanositler ve keratinositler………....5 2.1.9. Nöropeptidler………...5 2.1.10. İnfeksiyon………5 2.1.11. Laboratuar………5 2.1.12. Histopatoloji………....5 2.1.13. Klinik……….. 6 2.1.14. Tanı……….7 2.1.15. Ayırıcı tanı………..7 2.1.16. Prognoz………... 7 2.1.17. Tedavi………... 8 2.2. Serbest Radikaller………....19
2.2.1. Reaktif oksijen türleri………... 20
2.2.2. Serbest radikallerin vücuttaki etkileri………... 23
2.3. Antioksidan Savunma Sistemleri………...26
2.3.1. Enzimatik antioksidanlar………... 27
2.3.2. Enzimatik olmayan antioksidanlar………... 29
2.4. Total Antioksidan Seviye….………... 32
3. Bireyler ve Yöntem……….... 33
3.1. Örneklerin Hazırlanması………..33
3.2. Total Antioksidan Seviye………...34
3.2.1. Prensip……….. 34
3.3. Total Oksidan Seviye………...34
3.3.1. Prensip……….. 34
3.4. Oksidatif Stres İndeksi………...34
3.5. İstatistiksel Analiz………... 35 4. Bulgular……….. 36 5. Tartışma ve Sonuç……….. 41 6. Kaynaklar………....47 7. Ekler………....56
SİMGELER VE KISALTMALAR
AA: Alopesi Areata
ACTH: Adrenokortikotropik Hormon AT: Alopesi Totalis
AU: Alopesi Universalis CAT: Katalaz
CGRP: Kalsitonin Gen İlişkili Peptid DNBC: Dinitroklorobenzen DPCP: Difenilsiklopropenon GSH: Glutatyon GST: Glutatyon S Transferaz GSSGR: Redükte Glutatyon GPx: Glutatyon Peroksidaz HLA: Human Lökosit Antijen H2O2: Hidrojen Peroksit
ICAM: İntraselüler Adezyon Molekülü IL:İnterlökin
LOOH: Lipit Peroksit L·: Lipit Radikali
MDA: Malondialdehid
OLOO·: Epoksilik Peroksit Radikali
OSİ: Oksidatif Stres İndeksi O2ˉ : Süperoksit Radikali
SADBE: Skuarik Asit Dibütil Ester SALT: Alopesi Şiddet Ölçeği SOD: Superoksit Dismutaz
SLE: Sistemik Lupus Eritematozus SSRI: Serotonin Geri Alım İnhibitörleri TAS: Total Antioksidan Seviye
TBARS: Tiyobarbitürik Asit Reaktif Ürünleri TOS: Total Oksidan Seviye
VIP: Vazoaktif İntestinal Peptid XO: Ksantin Oksidaz
8 MOP: 8 Metoksipsoralen α-TOH:α-Tokoferol
1.GİRİŞ VE AMAÇ
Alopesi areata (AA); saçlı deri, yüz veya vücutta herhangi bir bölgede yama tarzında veya daha geniş alanlar şeklinde, skarsız kıl kaybı ile karakterize, otoimmün bir hastalıktır (1).
AA etiyolojisi halen tam olarak açıklığa kavuşmamıştır. Hastanın atopi eğilimi, genetik yapısı, emosyonel stres, otoimmünite, infeksiyonlar etiyopatogenezde başlıca suçlanan faktörlerdir. Günümüzde AA’nın kıl foliküllerine karşı olan organ spesifik otoimmüm bir hastalık olduğu görüşü yaygın kabul görmektedir (1,2,3,4,5).
Serbest radikaller; yörüngelerinde çiftlenmemiş elektrona sahip kimyasal ürünlerdir. Canlılarda en önemli serbest radikaller, oksijenin radikal türevleridir (6). Serbest oksijen radikallerinin yıkıcı etkilerine karşı organizmada antioksidanlar olarak bilinen çeşitli savunma sistemleri mevcuttur ve bunlar serbest radikallerin neden olduğu hücre hasarı ile sonuçlanan çeşitli reaksiyonları enzimatik veya non-enzimatik yollarla baskılamaktadırlar (6,7,8,9).
Serbest radikallerin üretimi artıp antioksidan sistemler arasındaki denge bozulursa, vücudun temel yapı elemanları olan proteinlerin, lipitlerin, nükleik asitlerin ve enzimlerin yapıları ve fonksiyonları bozulabilmektedir (10,11).
Çalışmamızın konusunu, AA hastalarında total oksidan/antioksidan düzeylerindeki değişiklikler olarak ifade edebiliriz.
Son yıllarda AA etiyopatogenezinde oksidatif stresin rolü üzerine yapılmış çeşitli çalışmalar mevcuttur. Çalışmalarda özellikle antioksidan sistemdeki azalma ve oksidatif stresteki artışın AA etiyopatogenezinde rolü olabileceği üzerinde durulmakta, bununla birlikte birbiriyle çelişen sonuçlar da bulunmaktadır.
2. GENEL BİLGİLER
2.1.Alopesi Areata
Alopesi Areata (AA) , saçlı deri veya gövdede skarsız kıl dökülmesi ile karakterize otoimmün ve inflamatuar bir hastalıktır. Saçlı derideki tüm saçların kaybı alopesi totalis (AT), tüm vücut kıllarının kaybı ise alopesi universalis (AU) olarak adlandırılır (1).
2.1.1.Tarihçe
Alopesi areata, çok eskiden beri bilinen dermatolojik hastalıklardan biridir. Hastalığın ilk tanımlamasını milattan sonra 30’lu yıllarda Cornelius Celsus yapmıştır. O dönemde bu hastalığa “area celci” adı verilmiştir, ayrıca milattan önce 2500 yılına ait papirüslerde de hastalıktan bahsedildiği görülmektedir. Günümüzde kullanılan AA terimini ise ilk kez 1708 yılında Sauvage kullanmıştır (12).
2.1.2.Epidemiyoloji
Hastalığın insidansı % 0.1- 0.2 olarak bildirilmiştir. Genel popülasyonda AA
gelişmesi için yaşam boyu risk % 1.7 olarak tahmin edilmektedir (1,13). Hastalık herhangi bir yaşta başlayabilirken çocukluk çağında ve 40’lı yaşlarda hastalığın insidansında artış görülmektedir (13). Kadınlarda ve erkeklerde görülme oranı eşittir (1). Hastaların % 60’ı ilk atağı 20 yaşın altında geçirir (14).
2.1.3.Etiyopatogenez
AA’nın etiyopatogenezi tam olarak bilinmemektedir. Birçok hipotez öne sürülmekle beraber; AA’nın genetik predispozisyon ve çevresel tetikleyicilerle meydana gelen, T lenfositlerin aracılık ettiği, kıl foliküllerine karşı oluşan, organ spesifik otoimmün bir hastalık olduğu görüşü ağırlık kazanmıştır (1).
2.1.4.Genetik faktörler
AA’lı hastalarda % 4.6 ile % 42 arasında pozitif aile öyküsü vardır (2). AA ile
human lökosit antijeni (HLA) arasındaki ilişkinin araştırıldığı çeşitli çalışmalar literatürde mevcuttur. Ülkemizde yapılan çalışmalarda, Kavak ve arkadaşlarının 88 hasta
ve 100 kontrol grubundan meydana gelen çalışmalarında A1, B62, HLA-DQ1 ve HLA-DQ3 sıklığını hasta grubunda daha yüksek tespit etmişlerdir (15). Akar ve arkadaşları ise HLA-DQB1*03’ün AA’da genel yatkınlıkla ve AA’nın şiddetli formları ile ilişkili olduğunu bildirmişlerdir (16).
Down sendromlu hastalarda AA görülme sıklığı % 8.8 oranındadır. Bu durum 21. kromozomdaki bir genin AA’ya yatkınlıkta etkili olduğunu düşündürmektedir (13). Ayrıca AA’nın şiddeti ile IL-1 reseptör antagonisti ve bunun homoloğu IL1F5’deki polimorfizmin ilişkili olduğu gösterilmiştir (17).
2.1.5.Atopi
Birçok çalışma AA’lı hastalarda atopi sıklığının arttığını bildirmektedir. Atopi
bulunan AA’lı olgularda hastalık daha şiddetli olabilmekte ve prognozu da kötü olmaktadır. Yapılan bir çalışmada AA’lı çocuklarda atopik dermatit insidansı % 18, AA’lı yetişkinlerde ise % 9 olarak bildirilmiştir (4).
2.1.6.Otoimmünite
AA organ spesifik otoimmün bir hastalık olarak kabul edilmektedir. AA’lı hastalar sistemik kortikosteroidlerin immünsüpresif dozlarına ve kontak duyarlandırıcılarla immünoterapiye cevap verir. AA birçok otoimmün hastalıkla birliktelik gösterir. Bunların başında tiroid hastalığı ve vitiligo gelmektedir (18). Yapılan bir çalışmada AA’lı hastalarda vitiligonun % 4.1, tiroid hastalığının % 2.3 oranında görüldüğü bildirilmiştir (19).
AA ile birlikteliği bildirilen diğer otoimmün hastalıklar; diabetes mellitus, pernisyöz anemi, liken planus, poliendokrinopati sendromu tip I, sistemik lupus eritematozus, çölyak hastalığı ve myastenia gravisdir (1,4).
Humoral immünite:
AA’da otoantikorların rolü hala tartışılmaktadır. AA biyopsilerinde foliküler yapılara karşı dolaşan otoantikorlar bildirilmiştir, ancak antikorlar tarafından hangi foliküler yapıların hedef alındığına dair kesin bir bulgu yoktur (20).
Tobin ve arkadaşları AA’lı hastaların % 100’ünün serumunda pigmente kıl foliküllerine karşı antikor tespit ederken aynı antikorları kontrol grubunda sadece % 44
olarak tespit etmişlerdir (21). Tobin ve arkadaşları tarafından yapılan başka bir çalışmada; AA’lı hastalarda birçok anagen kıl folikülü yapısına karşı yüksek seviyede otoantikor tespit etmişler, epidermal keratinosit ve melanositlerde gösterilemeyen, ancak kıl folikül keratinosit ve melanositlerinde eksprese edilen bazı antijen ve bu antijenlere karşı oluşan otoantikorları AA’lı hastalarda yüksek bulmuşlardır. AA’lı hastalarda kıl foliküllerine karşı antikor cevabı heterojen olarak bulunmuştur, çünkü farklı hastalar farklı kıl folikül yapılarına karşı farklı paternde antikor geliştirirler (22). En sık hedef yapılar; dış kök kılıfı, matriks, iç kök kılıfı ve kıl şaftıdır (5).
Hücresel immünite:
Saç folikülü melanositlerinin AA’da hedeflerden biri olduğu ve bu durumun T hücrelerle ilişkili olduğu öne sürülmektedir. Bu hipotezin temelini AA’nın pigmente saçları etkileyip beyaz saçları etkilememesi oluşturur. Nagasi ve arkadaşlarının fareler üzerinde yaptıkları bir çalışmada saç kaybının saç folikülü melanositlerine karşı gelişen CD 8+ T hücre aracılı bağışıklığa bağlı olabileceği ileri sürülmüştür (23).
Freidmann bir çalışmasında dolaşan T hücre sayısının azaldığını ve azalma düzeyinin hastalığın şiddeti ile ilişkili olduğunu öne sürmüştür (24). Otoimmünite ile ilgili en güçlü bulgu, anagen kıl foliküllerinin intrafoliküler ve peribulber bölgelerinde gözlenebilen Langerhans hücreleri, makrofajlar ve T lenfositlerdir (5).
2.1.7.Emosyonel stres
AA’lı hastalarda kişilik özellikleriyle ilgili çalışmalar arasında çeşitli farklılıklar mevcuttur. Bazı çalışmalarda AA hastalarının genel popülasyona göre psikopatolojik morbiditelere daha sık sahip olduğu bildirilmiştir. Bu morbiditeler; depresyon, anksiyete, sosyal fobi, paranoid bozukluk ve uyum bozukluklarını içerir. Bazı çalışmalar ise kontrollere göre anksiyete veya depresyonda herhangi bir fark bulunamadığını bildirmektedir. Tan’ın çalışmasında (19) saç dökülmesi öncesi stresli olayların 132 hastanın sadece % 9.8’ inde görüldüğü bildirilirken, Manolache ve arkadaşları 45 AA hastası üzerinde yaptıkları çalışmada stres ile AA arasındaki ilişkiyi doğrulamıştır (3).
2.1.8.Melanositler ve keratinositler
AA’da keratinositlerde intrensek bozukluklar olduğu ve bilinmeyen bir uyaranla kemotaktik ajanlar salgıladıkları, kıl bulbusuna gelen T lenfositlerin de olayları başlattıkları düşünülmektedir. AA lezyonlarında melanositlerin normal dağılımı ve yapısal özelliklerinde değişiklikler görülmüştür. Bazı çalışmalarda kıl bulbusundaki melanositlerin aktif olarak tutulduğu gösterilmiştir (25).
2.1.9.Nöropeptidler
Kalsitonin gen ilişkili peptit (CGRP), substans-P ve vazoaktif intestinal peptit (VIP) immünmodülatör nöropeptitlerdir. CGRP, mast hücre degranülasyonunu ve immünsüpresif TNF-α ve IL-10 salınımını uyarır, aynı zamanda kıl siklusunda önemli olabilecek kutane damar ağının kuvvetli vazodilatörüdür. AA lezyonlarında CGRP ve substans –P seviyeleri düşük bulunmuştur. Ayrıca AA’lı hastalarda kontrol grubuna göre serum CGRP seviyelerinde azalma tespit edilmiştir (20).
2.1.10.İnfeksiyon
Sitomegalovirüs infeksiyonunun AA etiyolojisindeki rolü hakkında hem olumlu hem de olumsuz sonuçlar bildirilmiştir (5).
2.1.11.Laboratuar
Birçok AA hastasında laboratuar inceleme gerekli değildir. Klinik şüphe halinde fungal kültür, deri biyopsisi, SLE ve sfiliz serolojisi ayırıcı tanılar açısından yapılabilir (26).
2.1.12.Histopatoloji
AA’nın histopatolojisinde anagen kıl bulbusu etrafında inflamatuar infiltrat mevcuttur. Bu infiltrat lenfositler, Langerhans hücreleri, eozinofil ve plazma hücrelerini içerir. İnflamasyon dermal papillada ödem, mikrovezikülasyon, apoptozis, nekroz ve yabancı cisim dev hücrelerinin oluşumuna neden olur. Bunun sonucunda anagen faz sonlanır veya inhibe olur. Anagen faz sonlanınca kıl büyümesi hızla durur, kıl gövdesinin alt kısmı incelir, otomatik olarak katagen döneme geçilir ve kılda trikoreksis nodoza benzeri kırık oluşur. Kıl, katagen evreden sonra telogen evreye geçer. Bu azalmış
anagen/katagen oranıyla sonuçlanan, artmış telogen ve katagen kıllar horizontal biyopsi kesitlerinde gözlenebilir. Telogen kıl şaftı, şişkin bölgedeki dinleneceği alana yükselince, nodüler kırık ile sonlanan kıl şaftının distal kısmı deri yüzeyine 3-4 mm çıkıntı yapar. Böylece AA için patognomonik olan tipik “ünlem işareti” saç oluşur. Telogen evreden birkaç ay sonra yeni bir kıl büyümeye başlar. İnflamasyon yoksa normal kıl gelişir, inflamasyon hala devam ediyorsa kıl minyatürize kalır. Minyatürize kıllar inflamasyon yatıştıktan sonra siklusa girer ve normal terminal kıl büyümesi olur (27).
Saçlı derinin elektron mikroskopik incelemesinde hem lezyonel hem de lezyona komşu normal deride dermal papillalarda ultrastriktürel anomaliler görülür. Bu durum yama tipi AA’nın bile lokalize bir olay olmadığını göstermektedir. AA örneklerinin immünhistokimyasal incelenmesinde dermal papillada, dış kök kılıf ve matriks keratinositlerinde ICAM-1’in bariz ekspresyonu gözlenmiştir (5).
Alopesi areatada kıl folikülü çevresinde bir inflamatuar hücre infiltratı olması ve bu infiltratın da kıl folikülüne hasar verdiği düşüncesiyle oksidatif stres enzimleri araştırılan AA’lı hastalarda lipit peroksidasyonunun göstergesi olan nitrik oksit seviyesi ile ksantin oksidaz aktivitelerinin artmış, süperoksit dismutaz aktivitelerinin azalmış olduğu bildirilmiştir (28).
AA histopatolojisinde önemli bir nokta da; hastalığın evresine bağlı olarak peribulber infiltratın her zaman görülmeyebileceğidir. AA hastalarının % 38’inde infiltrasyon bulunmamaktadır. Bu gibi durumlarda yararlı bir tanısal özellik az sayıda peribulbar eozinofil infiltrasyonu ve foliküler bantların varlığıdır (29).
2.1.13.Klinik
Alopesi areata sıklıkla lokalize alanlarda iyi sınırlı saç kaybı şeklinde tezahür eder. Lezyon genellikle tek ya da çok sayıda, yuvarlak veya oval alopesik peç şeklindedir (1). AA’nın en sık etkilediği alan saçlı deridir. Olguların % 60’ında ilk etkilenen bölge saçlı deridir (30). Etkilenen cilt makroskopik olarak normal görünür, herhangi bir kabuklanma veya foliküler anormallik yoktur. Ünlem işareti olarak bilinen karakteristik kıllar, alopesi alanları içinde veya çevresinde bulunabilir. Lezyon periferinden yapılan pozitif saç çekme testi (altı veya daha fazla kıl), hastalık aktivitesi
ile korele olabilmektedir. Birbirinden ayrı yamalar birleşerek büyük yamalar oluşturabilirler (1).
Yamalar genellikle semptomsuz olmalarına rağmen, hastaların bir kısmı dökülme öncesi karıncalanma ve kaşıntı tarifleyebilmektedir. AA % 10-22 oranında atopi ile birliktelik gösterebilir ki bu genel popülasyonun iki katıdır. Otoimmün hastalıklardan; tiroid hastalıkları ile % 8-28, vitiligo ile % 1-4 birliktelik gösterir (31). Yeni çıkan saçlar genellikle pigment eksikliğine bağlı sarı ya da beyaz renklidir. Tırnak tutulumu pitting şeklinde gözlenebilmekle birlikte, trakionişi, beau çizgileri, onikoreksis, punktat veya transvers lökonişi ve kırmızı benekli lunula da görülebilmektedir (1).
AA’da farklı klinik görünümler farklı isimlerle adlandırılmıştır. Oval veya dairesel dökülmelere yamasal AA, ağ biçiminde dökülmelere retiküler AA, pariyetal-temporal-oksipital bölge dökülmelerine ofiasis, pariyetal bölge dökülmelerine sisaifo, tüm saçlı deri, sakal, bıyık, kaş ve kirpik dökülmelerine alopesi totalis, bütün saç ve vücut kıllarındaki dökülmelere alopesi üniversalis denir (32).
2.1.14.Tanı
Tanı genellikle inspeksiyon ile konur. Korunmuş foliküler ostiumlar ile sınırlı saçsız yamalar veya büyük alopesik bölgelerin varlığı AA için tipiktir. Dermoskopide hastalığın şiddeti ile korele olan siyah noktalar, sarı noktalar ve kısa vellus kılları gözlenebilir. Öykü ve muayenede şüphe var ise biyopsi ile tanı doğrulanabilir (31).
2.1.15.Ayırıcı tanı
AA ayırıcı tanısına; trikotillomani, tinea capitis, erken skarlı alopesi, telojen effluvium, anajen effluvium, SLE ve sekonder sfiliz girer. Trikotillomanide saçlı deride çoğu zaman kırık saçlar bulunurken, tinea capitiste saçlı deride inflamasyon ve kepekler görülebilmektedir (26).
2.1.16.Prognoz
Pratikte hastalığın seyri öngörülememektedir. Yama tipi AA hastalarının % 50’sinde 1 yıl içinde spontan remisyon görülebilmektedir, bu oran 5 yıl içinde % 66’dır. Ancak rekürrens riski de % 85’dir. AT ve AU’ de tam iyileşme oranı % 10’dan azdır (31).
Yapılan çalışmalarda AA’lı hastalarda atopi sıklığının arttığı ve bunun prognozu olumsuz etkilediği bildirilmiştir (33). AA’da diğer kötü prognostik faktörler şunlardır; ciddi başlangıç, çocukluk çağında başlangıç, ilişkili otoimmün hastalık, pozitif aile hikayesi, tırnak değişiklikleri, 12 aydan uzun hastalık süresidir (31,34).
2.1.17.Tedavi
Alopesi areata; saçlı deride herhangi bir alanı etkileyen skarsız saç kaybı ile karakterize, yaygın görülen otoimmün bir hastalıktır (35). Alopesi areatada kıl folikülü harabiyeti olmadığından yeniden saç çıkma potansiyeli mevcuttur. Alopesi areatada birçok tedavi modeli ile yeniden saç çıkışı indüklenebilir, ancak hastalığın seyri değişmez (36). Günümüzde dermatologlar tarafından kullanılan birçok tedavi seçeneği var olmasına rağmen, hiçbiri tamamen iyileştirici ya da önleyici değildir (37).
Alopesi areata tedavisinde, tedavi yöntemlerini değerlendiren randomize kontrollü çalışmaların sayısı azdır. Bununla birlikte, tedaviye yanıtı ölçmede birçok rapor objektif parametreler bakımından eksiklik arz etmektedir. Ayrıca özellikle yama tipi AA yüksek spontan remisyon oranı tedavi etkinliğinin daha iyi değerlendirilmesini zorlaştırmaktadır (37). Yama tipi AA’da uygulanan tedaviler, alopesi totalis ve alopesi üniversalise uygulanan tedavilere kıyasla daha etkilidir. Alopesi areata tedavisi mevcut durumun ciddiyetine ve hastanın yaşına göre şekillendirilmelidir (35).
Topikal tedaviler
İntralezyonel kortikosteroid
Alopesi areatanın intralezyonel tedavisinde en yaygın kullanılan ajan triamsinolon asetoniddir (35,38). Triamsinolon asetonid saçlı deride 5-10 mg/ml (maksimum 3 ml/gün), kaş ve sakalda 2.5 mg/ml konsantrasyonunda 1 cm aralarla ince kanallı bir enjektör ile 0.1 ml miktarında intradermal olarak uygulanır (32,35,39). Enjeksiyonların 4-6 hafta aralarla tekrarlanması önerilir (32,35,36,39). İyileşme genellikle 4-8 haftada başlar (32). Tedaviye 6 ay sonunda hala yanıt alınamamışsa tedavi bırakılmalıdır (32,37,39).
İntralezyonel kortikosteroidlerin etkisini gösteren birçok çalışma mevcuttur. Abell ve Munro triamsinolon asetonid ile tedavi edilen subtotal AA hastalarında % 71 oranında yeniden saç çıkışı bildirmişlerdir (40).
İntralezyonel tedavinin yan etkileri; deri atrofisi, telenjiektazi ve depigmentasyondur. Bu yan etkiler düşük doz kullanımı ve yüzeyel uygulamalardan kaçınılarak minimalize edilebilir (35,36,37,38).
Topikal kortikosteroidler
AA için önerilen topikal kortikosteroidlerin krem, merhem, losyon, köpük ve jel gibi formları reçete edilmektedir (35). Orta ve güçlü topikal steroidler AA tedavisinde yaygın olarak kullanılmaktadır. Ancak bunların etkileri ile ilgili kanıtlar sınırlıdır (37).
AA’da etkili olduğuna dair bildiriler bulunan topikal kortikosteroidler şunlardır: Fluosinolon asetonid krem, fluosinolon saçlı deri jeli, betametazon valerat losyon, dezoksimetazon krem, halisinonid krem ve klobetazol dipropionat merhemdir (41). Özellikle çocuklar ve lezyonlu alanı az olan hastalarda betametazon dipropionat ve fluosinolon asetonid tercih edilmektedir. Bazı hastalarda tek başına faydalı olmadığı görülmekle birlikte, 3 ay süreyle aralıksız tedavi yapılan hastalarda başarılı sonuçlar alınabilmektedir (32).
Yapılan bir çalışmada % 0.1 betametazon valerat köpük kullanan hastaların % 61’inde % 75’den daha fazla yeni saç çıkışı görülürken, % 0.05 betametazon dipropionat kullanan grupta bu oran % 27 olarak bulunmuştur (35).
Topikal kortikosteroidlerin en sık yan etkileri folikülitlerdir (35,38). Daha nadir yan etkiler; telenjiektaziler ve atrofi gelişimidir. Topikal kortikosteroidler ile tedavide bildirilen relaps oranı % 37-% 63’tür (35).
Minoksidil
Malign hipertansiyon tedavisinde kullanılan, arteriolar dilatasyona yol açan bir ilaçtır. Etki mekanizması tam olarak bilinmemekle birlikte foliküler DNA sentezini stimüle ederek saç folikülü proliferasyonu ve diferansiyasyonu üzerinde etkili olduğu düşünülmektedir (42). Minoksidil bir sülfotransferaz enzimi tarafından cilt ve saç folikülünün dahil olduğu çeşitli organlarda aktif formu olan minoksidil sülfata
dönüştürülmektedir. Anlamlı klinik etkileri daha çok kadın ve erkeklerdeki androgenetik alopesi ile androjen bağımlı kıl folikülü minyatürizasyon bozukluklarında gösterilmiştir (43).
Minoksidilin %5’lik ve %1’lik formlarının karşılaştırıldığı bir çalışmada %5 minoksidil ile tekrardan saç çıkımının daha sık olduğu bildirilmiştir (44). Topikal minoksidil AT ve AU’te etkili değildir (26).
Topikal olarak % 5 konsantrasyonda günde 2 kez kullanılmasıyla % 20-45 arasında değişen başarı oranları bildirilmiştir. Tedaviden yaklaşık 12 hafta sonra saç çıkışı başlar. Minoksidilin tek başına kullanılması yerine topikal antralin veya kortikosteroidlerle kombine edilmesinin daha etkili olduğu öne sürülmüştür. Antralin minoksidilden 2 saat, topikal kortikosteroid ise yarım saat sonra uygulanabilir (43).
Minoksidil topikal kullanıldığında sistemik emilimi minimal olan bir ilaçtır ve yan etkileri az olmasına karşın lokal irritasyon, alerjik kontak dermatit, fasiyal kıllanma görülebilir. Gebelik ve emzirme dönemlerinde kullanılmamalıdır (32).
Antralin (Ditranol)
Antralin AA tedavisinde kullanılan irritan bir maddedir (42). Etki mekanizması kesin olarak bilinmeyen antralinin antiproliferatif ve immünsupresyon etkiye sahip olduğu ileri sürülmektedir. Kontakt dermatit oluşturarak Langerhans hücrelerinde ve T lenfositlerinde azalmaya neden olduğu gösterilmiştir (32). Tang ve arkadaşlarının fareler üzerinde yaptıkları bir çalışmada antralinin TNF-α/β üzerinde downregülasyonla etki gösterdiği belirtilmiştir (45). Özellikle çocuklar için önerilen antralinin % 0.25-1’lik kremleri mevcuttur ve geceleri kısa süreli kullanımları önerilmektedir. Etki için irritasyon şart değildir. Başlangıçta genellikle % 0.5’ lik kremle 20-30 dakika uygulanır, daha sonra yavaş yavaş ilaç konsantrasyonu ve deride kalma süresi artırılarak % 1’lik kremle 1 saat/gün ilaç uygulamasına ulaşılır. Etkili olan olgularda saç gelişimi genellikle 3 ayda ortaya çıkar, kozmetik olarak yeterli yanıt ise 6 ayda sağlanır (32).
Bir çalışmada ditranol ile hastaların % 18’inde kozmetik olarak kabul edilebilir olumlu sonuçlar bildirilmiştir (46). Ayrıca % 75’e kadar başarı oranı olabileceğini bildiren yayınlar da mevcuttur (32). % 0.5-1 ditranol ile tedavi edilen 68 hastalı geniş bir çalışmada % 25 oranında cevap alınmasına rağmen, kozmetik açıdan iyi sonuç oranı
%17.6 olarak belirlenmiştir. Ortalama kozmetik cevap süresi 2-3 hafta olarak bildirilmiştir (46).
Antralin uygulaması ile ciltte ve elbiselerde boyanma görülebilmektedir (35). Yan etkileri arasında; ciddi irritasyon, folikülit, bölgesel lenfadenopati görülebilmektedir (37).
Kriyoterapi
AA tedavisinde kriyoterapi için tam olarak yüz güldürücü olmasa da bazı umut verici sonuçlar bildirilmistir. Bu yöntemin etki mekanizması açık değildir. İmmünomodülatör etkisi, plasebo etkisi veya kıl folikulleri içindeki kan dolaşımını uyarıcı etkileri üzerinde durulmaktadır. Literatürdeki çeşitli çalışmalarda %60 ile %77.8 arasında, değişen oranlarda başarı bildirilmiştir. Aksakal ve arkadaşlarının yaptıkları bir çalışmada özellikle saçlı derinin %25'inden azını ilgilendiren AA tedavisinde ilk seçeneklerden biri olarak akla gelebileceği vurgulanmıştır (47).
Topikal immunoterapi
Kontakt immünoterapi; güçlü bir kontakt alerjenin ilk olarak indüksiyon amacıyla daha sonra da periyodik olarak alerjik kontakt dermatit oluşturması esasına dayanır. Topikal duyarlandırıcılar ilk olarak 1976’da dinitroklorobenzenin ciddi AA’da kullanılmasıyla tedavinin temel noktalarından birini oluşturmaktadırlar. Topikal duyarlandırıcıların mekanizması tam olarak anlaşılmış değildir. İmmünmodülasyonu destekleyen bir teoriye göre topikal duyarlandırıcılar ile tedavi edilen ciltte CD4/CD8 lenfosit oranı düşmektedir (36). Son zamanlarda ise antijenik yarışma ile kıl folikülüne karşı immün cevabı nonspesifik olarak inhibe ettiği ve dolayısıyla saç büyümesini sağladığı düşünülmektedir. Bununla beraber immünojenler foliküler keratinositlerce salınan proinflamatuar sitokinlerin üretimine de engel olmaktadırlar (32).
AA’da kullanılan kontakt duyarlandırıcılar; dinitroklorobenzen (DNCB), skuarik asit dibütilester (SADBE) ve difenilsiklopropenondur (DPCP) (42).
Dinitroklorobenzen; AA tedavisinde ilk kullanılan topikal immünmodülatör olup mutajenik etkileri nedeniyle kullanımı oldukça sınırlandırılmıştır. Aseton içinde % 0.001-0.1 konsantrasyonlarda saçlı deride dermatit oluşturacak şekilde uygulanır. Saç çıkışı 2-4 ay içinde başlar (32).
Difenilsiklopropenon en sık kullanılan ajan olup, tedavi öncesinde tam kan sayımı, eritrosit sedimantasyon hızı, karaciğer fonksiyon testleri istenmelidir. Verruka vulgaris ve melanoma tedavisinde de kullanılmaktadır (42). İlk olarak hastanın saçlı derisinde 4x4 cm’lik bir alana DPCP’ nin % 2’lik solüsyonu uygulanır. İki hafta sonra saçlı derinin aynı yarısına DPCP’ nin % 0.001’lik solüsyonu uygulanır. Her hafta saçlı deride hafif bir dermatit gözlenene kadar DPCP konsantrasyonu arttırılmalıdır. Solüsyon saçlı deride 48 saat kalmalı ve bu süre içinde güneşten korunulmalıdır. Tedavi edilen tarafta saç çıkımı elde edildiğinde her iki taraf tedavi edilir. Difenilsiklopropenon eğitimli bir hemşire tarafından haftalık olarak uygulanabilir. Tedaviden 6 ay sonra halen yanıt yoksa tedavi kesilebilir (35).
Cotelessa’ nın bir çalışmasında DPCP tedavisinden 6 ay sonra uygulanan hastaların % 48’inde terminal saç büyümesi elde edilmiş, 12 ay sonra % 6’lık bir bölüm daha bu orana katılmıştır (48). Weise ve arkadaşlarının bir çalışmasında ise başarı oranı % 40 olarak bildirilmiştir (49). Happle ve arkadaşları ise DPCP ile tedavi edilen hastaların % 67’sinde tatmin edici cevap almışlardır (50).
DPCP mutlaka hastane ortamında uygulanmalıdır. Teratojenitesi kanıtlanmamasına rağmen gebelerde ve 10 yaş altında kullanılmamalıdır (42). DPCP tedavisinde negatif prognostik faktörler; uzun süreli hastalık, AT, AU, tırnak değişiklikleri, atopi ve ailede AA öyküsüdür (35).
Skuarik asit dibütilester güçlü bir duyarlandırıcıdır. Doğal çevrede bulunmaz, dolayısıyla diğer kimyasallarla çapraz reaksiyona girmez ve mutajenik değildir. Bu nedenle ideal bir immünojen olarak kabul edilmektedir. Kullanım şekli, süresi ve konsantrasyonu DPCP gibidir. Asetondaki solüsyonu ancak 2 ay stabil kalabilir. Gebelikte, emzirme döneminde ve 12 yaşından küçüklerde kullanılmamalıdır (32). Yayınlanan topikal immünoterapi çalışmalarının kapsamlı incelemesinde DPCP ile SADBE arasında çok az fark bulunmuştur (38).
SADBE ile bildirilen yan etkiler; dermatit, bül oluşumu, lenfadenopati, uygulama sonrası yanma, otoekzematizasyon, generalize pruritus, lökoderma, kserozis, folikülit, uygulama sonrası geçici perioral yanma, ateş ve artralji gibi sistemik reaksiyonlardır. DPCP ile oluşabilen yan etkiler ise benzer şekilde büllü ya da bülsüz ekzematöz reaksiyonlar, diğer vücut alanlarında kontakt dermatit oluşması, kaşıntı ve sonucunda
uykusuzluk, ürtiker, saçlı deri göz kapağı veya yüzün diğer bölümlerinde ödem, lenfadenopati ve yüksek ateştir (51). Topikal duyarlandırıcılara bağlı nadiren vitiligo gözlenmektedir. Birçok vakada tedavinin kesilmesiyle 1 yıl içinde pigmenter değişiklikler düzelmektedir (52).
Takrolimus ve pimekrolimus
Takrolimus 1984 yılında keşfedilen potent bir makrolid immünsupresandır. Takrolimus hücre içinde FK-BP (FK-Binding Protein) proteinine bağlanır. Oluşan kompleks kalsinörine bağlanarak inhibe eder. Takrolimus/FK-BP kompleksi IL-2 üretimini de inhibe etmektedir (53).
Takrolimus merhem çeşitli hayvan deneylerinde anajen veya aktif saç büyümesini indüklemek için kullanılmıştır. Yamamoto ve arkadaşları sıçanlar üzerinde yaptıkları çalışmada takrolimusun 30 mg/kg dozunda oral uygulamasının saç çıkışını stimüle etmediğini, ancak topikal takrolimus uygulamasının yeni saç çıkışını stimüle ettiğini göstermişlerdir (54). Mc Elwec ve arkadaşlarının tüysüz fareler üzerinde yaptıkları bir çalışmada bir gruba % 25’lik takrolimus solüsyonu haftada 5 kez (8 hafta), ikinci gruba % 0.1’ lik solüsyonu haftada 5 kez (8 hafta), üçüncü gruba %0.1’lik solüsyonu haftada 2 kez (4 hafta) verilmiştir. Uygulanan tüm deneklerde 14-21 gün içinde kontrol grubuna göre anlamlı derecede saç çıkışı olduğu gözlenmiştir (55).
Pimekrolimusta takrolimusa benzer şekilde kombine antiinflamatuar ve immünmodülatuar aktivitesi bulunan bir kalsinörin inhibitörüdür (56). Saçar ve arkadaşları, çalışmalarında topikal pimekrolimus tedavisine olumlu yanıt veren AA’lı bir çocuk hasta bildirmişlerdir (57).
Latanoprost
Latanoprost glokom tedavisinde kullanılan bir prostoglandin F2 alfa analoğudur. Kirpik sayısı, kalınlığı ve pigmentasyonunda artış latanoprostun yan etkileri olarak bildirilmiş ve böylece kaş kirpik alopesisinde kullanılabileceği düşünülmüştür. Faghihi ve arkadaşlarının yaptığı bir çalışmada kaş ve kirpik tutulumu bulunan 26 hastaya topikal latanoprost uygulaması sonucu sadece 1 hastada kısmi kıl büyümesi bildirmiştir (58).
AA tedavisinde latonoprost kullanımı ile ilgili çok az bildiri mevcuttur (59). Mehta ve arkadaşları latanoprost ile günde 1 kez tedavi edilen 11 yaşında kız çocuğunda 8 hafta sonra yeni kirpik çıkışı bildirmişlerdir (60).
Sistemik tedaviler Sistemik steroidler
1950’den beri sistemik steroidler AA tedavisinde kullanılmaktadır. Sistemik steroid tedavisinin yeniden saç çıkışını sağladığı hususunda şüphe yoktur, ancak hastalığın daha şiddetli formlarının bulunduğu hastalarda tedavi kesildiğinde relaps yaygın olarak görülmektedir (36).
Saç dökülmesi % 50’den fazla olan, hızlı progresyon gösteren genç hastalarda steroidler sistemik olarak kullanılabilir. Prednizonun 40-60 mg dozda başlanıp haftada 5 mg azaltılarak 4-8 hafta kullanılması önerilmektedir. Özellikle çok odaklı, aktif dökülmesi olan, şiddetli AA olgularında intravenöz veya oral pulse steroid kullanımı tavsiye edilmektedir (32).
Pulse steroid tedavi rejimleri; 2 gr IV tek doz, günlük 0.5 gr 5 gün, IV 250 mg günde 2 kez 3 gün; ayda 300 mg en az 4 ay şeklinde uygulanabilmektedir. Pulse steroid tedavisi hastalar tarafından iyi tolere edilmektedir. Ancak günlük ya da gün aşırı oral rejimler ile akne, obezite, ACTH rezerv düşüklüğü, lentiküler opasite gibi beklenen yan etkiler gelişebilmektedir (36).
Al Abdulkareem ve arkadaşları yaygın AA’lı 18 hastaya günde 15-40 mg oral kortikosteroid verdikleri bir çalışmalarında 7 hastada belirgin düzeyde terminal saç çıkışı olurken, 2 hastada yanıt izlenmemiştir. Tedaviye yanıt veren tüm hastalarda kortikosteroid dozu düşülürken ya da kesildiğinde relaps görülmüştür (61). Friedli ve arkadaşlarının yaptıkları bir çalışmada 20 multifokal, 10 ofiazik, 9 AU ve 6 AT’li toplam 45 hastaya haftada 3 ardışık gün, günde 2 kez 250 mg IV metilprednizolon tedavisi hiçbir belirgin yan etki oluşmaksızın uygulanmıştır. 20 multifokal AA’lı hastanın hepsinde % 100 veya % 50-100 oranında saç çıkışı olduğu bildirilmekle birlikte; 1 hastada 3. 2 hastada 6. ve 4 hastada 12. ayda relaps izlenmiştir. AU ve AT’li 15 hastanın sadece 3’ünde % 50-90 oranında saç çıkışı saptandığından pulse steroid tedavisinin yalnız multifokal AA’lı hastalarda etkili olduğu sonucuna varılmıştır (62).
Karşılaştırmalı bir çalışmada ayda 1 kez 40 mg triamsinolon asetonid ile tedavi edilen hastalarda cevap oranının, günde 0.5 mg deksametazon ile tedavi edilen hastalardan daha iyi olduğu sonucuna varılmıştır (63). Pulse steroid ile tedavi edilen 139 hastalık bir çalışmada yeni başlangıçlı hastalarda ( 6 aydan kısa süreli) cevap oranı %59.4 bulunurken, 6 aydan uzun süreli hastalarda cevap oranı % 15.8 olarak bulunmuştur (64).
Myung ve arkadaşlarının bir çalışmasında ciddi düzeyde AA’lı 70 hasta 25 mg/kg/gün metilprednizolon ile 3 ardışık gün tedavi edilmiş, hastaların % 70’inde terminal saç çıkışı görülmüş, % 41.4’ ünde tam cevap alınmıştır. Hastaların % 30’unda geçici vellus kılları ortaya çıkmış ya da saç çıkışı olmamıştır. Bir hastada 4 ay içinde, 6 hastada 6-8 ayda ve bir diğer hastada 10 ay içinde relaps görülmüştür (65).
Fotokemoterapi
Fotokemoterapi tedavisi otoimmün kökenli birçok dermatolojik hastalıkta başarıyla kullanılmaktadır. PUVA’ nın T hücre fonksiyonunu etkilediği, antijen sunumu ve Langerhans hücrelerini azaltarak, kıl folikülüne karşı gelişmiş olan lokal immünolojik atağın inhibisyonu şeklinde immünmodülatör etki gösterdiği düşünülmektedir. UVA ile aktive olan 8-metoksipsoralen (8-MOP) DNA içinde primidine bağlanarak mitozu inhibe etmektedir (32).
AA’da PUVA tedavisine 20-80 seans sonrasında yanıt alınabilmektedir. Çalışmalar psoralenin oral veya topikal kullanımı arasında fark olmadığını göstermektedir. Topikal tedavide yanık oluşumu daha fazla, oküler komplikasyonlar ise daha azdır. PUVA tedavisinin dezavantajı uzun süreli olması ve kesildikten sonraki yüksek relaps oranıdır. Yan etkiler; bulantı, pigment değişiklikleri, deri kanseri riski ve kataraktır (42).
Topikal ve oral PUVA’ nın başarı oranı % 15 ile % 70 arasında değişmektedir. PUVA türban tedavisi seyreltik bir psoralen çözeltisinin bir pamuk havlu aracılığı ile türban şeklinde saçlı deriye uygulandığı ve daha sonra hastanın saçlı derisine UVA verildiği bir tedavi yöntemidir. Bu şekilde haftada 2-3 kez uygulanır. PUVA türban tedavisi sonrası 15 aylık takipte tedaviye cevap veren hastalarda rekürrens oranı % 26 olarak gözlenmiştir. PUVA türban tedavisi oral PUVA’ ya göre sistemik yan etkiler
bakımından daha avantajlıdır ve bu yüzden AA tedavisinde alternatif bir yöntem olarak değerlendirilir (35).
Sistemik PUVA ise yaygın AA olgularında kullanılan ve başarılı sonuçlar alındığı bildirilen tedavi yöntemlerinden birisidir. Oral olarak psoralen 0.6-0.8 mg/kg/gün alındıktan iki saat sonra UVA uygulanan hastalarda 16. seanstan sonra kıllar çıkmaya başlamakta, 50-75 seansta % 37-75 oranında kozmetik olarak yeterli sonuçlar alınmaktadır (32).
Mitchel ve arkadaşlarının 22 AA’lı hastada yaptıkları bir çalışmada UVA verilmesinden 45 dakika önce % 0.1 topikal 8-metoksipsoralen solüsyonu uygulanmış, haftada iki seans ile % 45’inde başarı sağlanmasına rağmen relaps oranı yüksek bulunmuştur (66). Behrens ve arkadaşlarının çalışmalarında şiddetli ve hızlı ilerleyen, tedaviye dirençli AA’sı olan 9 hastada uygulanan PUVA türban tedavisinde her seansta % 0.0001’lik 8-metoksipsoralen ile ıslatılmış bir havlu türban şeklinde hastanın başının etrafında dolanıp 20 dakika bekletilmiş ve ardından UVA verilmiştir. Haftada 3-4 kez 10 haftalık tedavi süresinin sonunda 9 hastanın 6’sında saç çıkışı meydana gelmiş, 2 hasta tedaviyi yarıda bırakmış, 1 hastada ise vellus tipi saç çıkışı olmuştur (67).
Whitmont ve arkadaşlarının AT ve AU’ li toplam 26 hastaya PUVA tedavisi uyguladıkları bir çalışmada 15 AT’ li hastanın 8’inde ve 11 AU’ li hastanın 6’sında % 90 oranında tedaviye cevap bildirilmiştir (68). Dirençli ve şiddetli AA olgularında PUVA ile antralin, sistemik steroid, siklosporin ve çinkonun ikili, üçlü, dörtlü kombinasyonları kullanılabilmekte ve bu kombinasyonlara cevap oranı % 45-79 arasında değişmektedir (32). Ito ve arkadaşları diğer tedavilere dirençli 6’sı AT, 3’ü AU tanılı 9 hastada oral PUVA ve sistemik steroid tedavisini kombine ettikleri çalışmada, hastalara günlük 20 mg kortikosteroid verilmiş ve 1 ay boyunca metoksalen aldıktan 2 saat sonra tüm vücut ışınlanmıştır. Tüm hastalarda 2 ay sonra saçlı deride terminal saç çıkışı olurken, 2 hastada tedavi kesildikten 3 ay sonra relaps görülmüştür (69).
UVB’nin ise, birçok neoplastik ve inflamatuar hastalıkta etkili olmasına rağmen AA’da etkili olduğuna dair çok az kanıt bulunmaktadır (70).
Siklosporin
Etki mekanizması net değildir, fakat İL-2 inhibisyonu ile birlikte immünsupresif etki yaparak CD4/CD8 oranını düşürdüğü ve yeni kıl gelişimini stimüle ettiği düşünülmektedir (32). Topikal siklosporin AA tedavisinde bir seçenek olarak düşünülmekle birlikte, penetrasyonu az olduğu için etkisiz bulunmuştur. Oral siklosporinin ise etkili olduğunu gösteren çalışmalar olmasına rağmen nüks oranı yüksek bulunmuştur (42).
Bir çalışmada serum IL-18’in yüksek, IL-2’nin düşük olduğu durumlarda oral siklosporine daha iyi yanıt alınabileceği bildirilmiştir (71). Oral siklosporinin ise başarı oranı % 25 ile %76.6 arasındadır (35). Sistemik siklosporin ile 1-6 mg/kg/gün dozunda başarılı sonuçlar alınmış, fakat ilaç kesildiğinde kısa sürede nüksler görülmüştür. Sistemik siklosporin, sistemik kortikosteroid veya PUVA ile kombine edildiğinde daha başarılı sonuçlar alınmıştır (32). Dadras ve arkadaşlarının 18 hasta üzerinde yaptıkları bir çalışmada, hastalara tedavi olarak pulse metilprednizolon ve oral siklosporin verilmiştir. Bu kombinasyon ile hastaların % 33’ünde yeterli yanıt elde edildiği bildirmiştir (72). Oral siklosporin tedavisi; nefrotoksisite, immünsupresyon, hipertansiyon gibi yan etki profili ve yüksek relaps oranı nedeniyle genellikle tercih edilmemektedir (35).
Sulfasalazin
Sulfasalazinin inflamatuar hücre kemotaksisi, sitokin ve antikor üretimi inhibisyonuna dayanan immünsupresif ve immünmodülatör etkileri mevcuttur. Sulfasalazin ile tedavi edilen ciddi AA’lı hastaların % 23’ünde kozmetik açıdan kabul edilebilir yeni saç çıkışı bildirilmiştir (73). En yaygın yan etkileri; bulantı, kusma, baş ağrısı, ateş ve döküntüdür. Hepatotoksisite ve hematolojik yan etkiler nadir, ancak daha ciddi durumlardır. Yan etki insidansı 4 g/gün üzerindeki dozlarda daha fazladır (74).
Biyolojik ajanlar
TNF-alfa’nın AA patogenezinde yeri olduğu bilinmesine rağmen, birçok çalışmada AA tedavisinde adalimumab, infliksimab ve etanersepti içeren TNF-alfa inhibitörleri ile başarısızlık bildirilmiştir. Strober ve arkadaşlarının 17 AA’lı hastayı içeren çalışmalarında etanersept etkili bulunmamıştır (75). Randomize kontrollü bir çalışmada 62 hastada efalizumab etkisiz bulunmuştur (36).
Vitamin D
Vitamin D3 türevlerinin biyolojik aktiviteleri; epidermal hücre çoğalması ve farklılaşması ile sitokin üretiminin modülasyonudur. Bu etkiler AA tedavisinde vitamin D3 türevlerinin etkinliklerini açıklayabilirler. Kim ve arkadaşlarının topikal kalsipotriol uyguladıkları 7 yaşında AA’lı bir hastada 3 ay sonra tedaviye tam yanıt alınmıştır (76).
Ustekinumab
IL-12 ve IL-23’ün p40 subünitine bağlanan monoklonal insan antikorudur. Psoriasiste etkinliği kanıtlanmış olup, uzun dönem etkinliği ve güvenliği üzerinde çalışmalar devam etmektedir. Gelecekte AA’lı hastaların tedavisinde kullanılabileceği düşünülmektedir (39).
Bahsedilen tedavilere ek olarak hastalara dermografi, lokal saç aksesuarları gibi non-farmakolojik yöntemler ile SSRI’ lardan oluşan psikoterapiler de uygulanabilir (32,42).
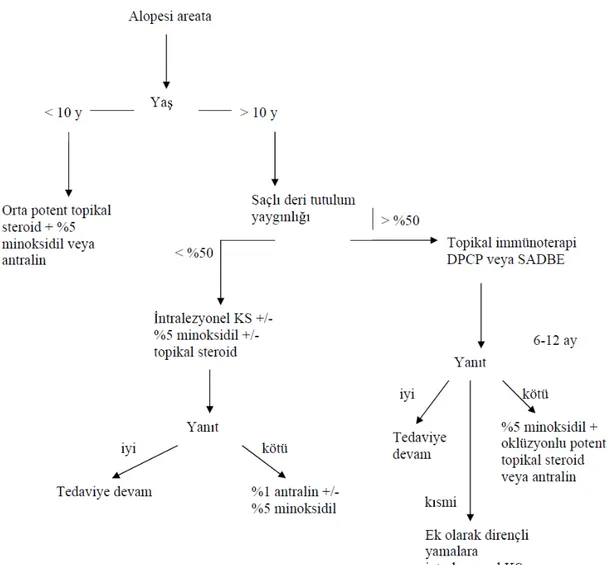
Şekil 1. Alopesi areatada hasta yaşı ve yaygınlığına göre tedavi algoritması
2.2.Serbest Radikaller
Serbest radikaller atomik ya da moleküler yörüngelerinde, bir veya daha fazla çiftlenmemiş elektron içeren molekül ya da molekül parçaları olarak tanımlanabilir. Bu çiftlenmemiş elektronlar serbest radikallere önemli derecede reaktivite kazandırırlar (6). En dış yörüngede eşlenmemiş bir elektronu bulunan molekül ya da molekül gruplarına radikal adı verilmektedir ve molekülün kimyasal simgesinin sağ üst köşesine konan nokta veya çizgiyle gösterilir (R·,R¯) (77). Oksijen kaynaklı radikaller canlı sistemlerde
oluşan radikal türlerinin en önemlileridir (6). Bu moleküller mikroorganizmalara da yüksek düzeyde toksiktirler (78).
2.2.1.Reaktif oksijen türleri
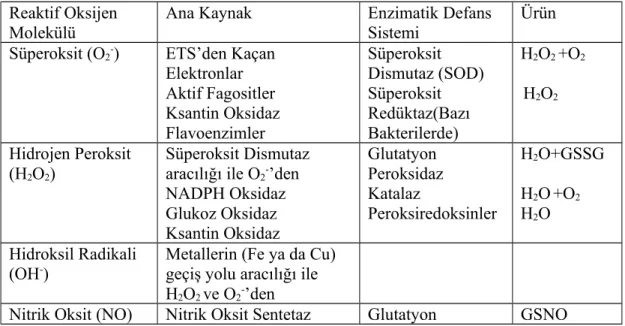
Oksijenden elde edilen, kimyasal açıdan reaktif moleküllerdir. Bu moleküllerin bazıları hidroksil radikali gibi son derece reaktif iken, süperoksit ve hidrojen peroksit gibi bazı türlerin reaktivitesi daha azdır. Serbest radikaller ve reaktif oksijen türleri serbest radikal oluşumunun zincir reaksiyonunu başlatacak şekilde birçok molekülle reaksiyona girebilir. Bu zincir reaksiyonunu durdurmak için eşlenmemiş elektronların elimine edilmesi adına, ya yeni oluşmuş radikal başka bir serbest radikal ile reaksiyona girmeli ya da bir zincir kırıcı veya bir antioksidan ile reaksiyona girmelidir. Tablo 1’de serbest oksijen türlerinin en yaygın hücre içi formları, üretimindeki hücre içi kaynaklar ve ortadan kaldırılmasında ilişkili antioksidan enzimler listelenmiştir (7).
Reaktif Oksijen
Molekülü Ana Kaynak Enzimatik Defans Sistemi Ürün Süperoksit (O2-) ETS’den Kaçan
Elektronlar Aktif Fagositler Ksantin Oksidaz Flavoenzimler Süperoksit Dismutaz (SOD) Süperoksit Redüktaz(Bazı Bakterilerde) H2O2 +O2 H2O2 Hidrojen Peroksit (H2O2) Süperoksit Dismutaz aracılığı ile O2-’den
NADPH Oksidaz Glukoz Oksidaz Ksantin Oksidaz Glutatyon Peroksidaz Katalaz Peroksiredoksinler H2O+GSSG H2O+O2 H2O Hidroksil Radikali (OH-)
Metallerin (Fe ya da Cu) geçiş yolu aracılığı ile H2O2 ve O2-’den
Nitrik Oksit (NO) Nitrik Oksit Sentetaz Glutatyon GSNO
Süperoksit radikali (O2ˉ)
Superoksit radikali moleküler oksijene bir elektron eklenmesiyle oluşur. Oluşumu iç mitokondriyal zar civarındaki elektron açısından zengin oksijenli ortamda spontan olarak meydana gelir. Bir serbest radikal olmasına rağmen yüksek derecede reaktif değildir. Süperoksit iskemi-reperfüzyonda aktive olan ksantin oksidaz gibi flavoenzimler tarafından endojen olarak da üretilebilir. Süperoksit üreten diğer enzimler; lipooksijenaz ve siklooksijenazdır (7).
O2 + eˉ→ O2ˉ (Süperoksit Radikali)
Süperoksit anahtar radikaldir. Çünkü sinyal yolaklarında mesajcı olarak fonksiyon görmesinin yanında, hidrojen peroksit, hidroksil radikali ve peroksinitrit gibi birçok reaktif oksijen türlerinin oluşumunda rol alır (79). Süperoksit ile perhidroksil radikalleri reaksiyona girdiklerinde biri okside olurken diğeri indirgenir. Süperoksit Dismutaz (SOD) enzimi tarafından kataliz edilen bu reaksiyon sonucunda oksijen ve hidrojen peroksit oluşurken reaksiyon, dismutasyon reaksiyonu olarak adlandırılır (7,80).
HOˉ + O2ˉ + H → H2O2 + O2
Hidrojen peroksit (H2O2)
Hidrojen peroksit; süperoksit (O2ˉ) hidroksil (HOˉ), peroksil (ROOˉ) ve alkoksil
(ROˉ) radikalleri ile birlikte reaktif oksijen türlerindendir. İnsan dokularında H2O2’nin
kaynakları; organeller (özellikle mitokondri), salgı hücreleri, mikroorganizmalar ve akciğerlerdir (81).
Hidrojen peroksit; oksijenin enzimatik olarak iki elektron alması ya da süperoksitin enzimatik/nonenzimatik dismutasyon tepkimeleri sonucu oluşur. Yapısında paylaşılmamış elektron bulundurmadığından serbest radikal özelliği göstermez, ancak biyolojik membranlara nüfuz kabiliyeti son derece önemlidir (7).
2 O2ˉ + 2H+ → H2O2 + O2ˉ
Hücrelerde hidrojen peroksitin primer eliminasyonunu katalaz, glutatyon peroksidaz (GSH-Px) ve süperoksit dismutaz (SOD) sağlar (7,81,82).
Hidroksil radikali (OHˉ)
Hidroksil radikali en zararlı reaktif oksijen türlerindendir. Yüksek reaktivitesi vardır. Protein, DNA gibi biyomolekülleri okside edebilir (83,84). Hidroksil radikali Fenton reaksiyonu veya Haber-Weiss reaksiyonu sonucu hidrojen peroksitten oluşmaktadır. Ayrıca suyun yüksek enerjili iyonize edici radyasyona maruz kalması sonucunda da oluşabilmektedir. (85).
H2O2 + O2ˉ → OH + OHˉ + O2
2H2O + enerji → H2O + + eˉ + H2O ˉ
Süperoksit hem H2O2’nin öncülü hem de metalleri indirgeyici bir tür olduğundan
biyolojik koşullarda süperoksit yapımının arttığı ortamda OHˉ üretimi kaçınılmazdır. Hidroksil radikali DNA üzerinde tamir edilemeyen hasarlara, proteinlerde oksidasyona ve zar lipitlerinde peroksidasyona neden olur (85).
Singlet oksijen (1 O 2)
Moleküler oksijen yaşamın tüm formları için potansiyel bir zehir olarak davranmasına rağmen yaşamsal süreçlerde de yer almaktadır. Birçok hücrede enerji absorbsiyonu veya elektron transferinin bir sonucu olarak reaktif türevler üretebilir (86).
Başlıca şu mekanizmalarla vücutta oluşabilir:
a)Pigmentlerin ( örneğin flavin içeren nükleotidler, bilirübin) oksijenli ortamda ışığı absorblamasıyla,
b)Hidrojen peroksitlerin metaller varlığındaki yıkım tepkimelerinde, c)Kendiliğinden dismutasyon tepkimeleri sırasında,
d)Bazı sitokrom p450 tepkimelerinde, prostoglandin endoperoksit sentaz, myelo/kloro/laktoperoksidaz enzimlerinin etkileri sırasında (85).
Singlet oksijen, DNA, RNA, proteinler, lipitler ve steroller gibi biyolojik hedefleri içeren geniş bir yelpaze ile reaksiyona girer (87). Singlet oksijen diğer moleküllerle etkileştiğinde ya içerdiği enerjiyi transfer eder ya da kovalent tepkimelere
girer. Özellikle karbon-karbon çift bağları singlet oksijenin tepkimeye girdiği bağlardır. Bu moleküllerin başında; tokoferoller, fenoller, bilirubin, DNA, karotenler, kolesterol, NADPH, triptofan, metionin, sistein ve histidin gibi bileşikler gelir. Doymamış yağ asitleri ile doğrudan tepkimeye girerek peroksi radikalini (ROOˉ) oluşturur ve HOˉ kadar etkin bir şekilde lipid peroksidasyonunu başlatabilir (85).
Nitrik Oksit (NOˉ)
Nitrik oksit yüksek yapılı canlılarda önemli biyolojik fonksiyonları yerine getirmek üzere üretilen nitrojen merkezli bir radikaldir (85). Nitrik oksit enzimatik olarak nitrik oksit sentaz enzimi tarafından L-arjininden sentezlenir (7).
L-arjinin + NADPH + O2 → L-sitrulin + NOˉ + NADP+
Fizyolojik derişimde üretilen NO esas olarak oksihemoglobin tarafından nitrata (N03ˉ) oksitlenerek aktivitesi sonlandırılır. Oksijen radikallerindeki durumun aksine,
nitrik oksiti ortamdan temizleyen herhangi bir özel enzim yoktur (85).
2.2.2.Serbest radikallerin vücuttaki etkileri
Normal metabolizma olayları sırasında çeşitli basamaklarda serbest oksijen radikalleri oluşabilir. Oluşan bu serbest radikal yapısına sahip maddelerin organizmaya zarar verme potansiyelleri bulunsa da, bazı metabolik olayların devamı için bunların oluşumu kaçınılmazdır (88).
Biyomoleküllerin oksidatif hasarı kanser ve ateroskleroz gibi major iki ölüm nedenini içeren birçok patolojiye yol açar. Araştırmaların çoğu oksidanların lipit ve DNA üzerine olan etkilerini ve bunların antioksidanlarla korunmasına yoğunlaşmışken proteinlerin oksidanlar ile hasarı ve antioksidan ile korunması üzerine bilinenler daha azdır (89).
Serbest radikaller hücrelerin lipit, protein, DNA, karbonhidrat ve enzimler gibi tüm önemli bileşiklerine etki ederler (10,11).
Serbest radikallerin proteinlere etkileri:
Protein oksidasyonunun insan hastalıklarında major rolü olduğu ve oksidanların da major hedefinin proteinler olduğuna dair kanıtlar mevcuttur (10).
Enzim aktivitelerinde azalma, reseptör ve membran taşıyıcılarının etkilenmesi nedeniyle proteinlere oksidatif hasarın in vivo özel bir önemi olabilir. Dahası oksidatif hasara uğramış proteinler kimyasal açıdan reaktif gruplar içerebilir ve bu durum diğer biyomoleküllerde sekonder hasara neden olabilir. Serbest radikal maruziyeti sonucunda aminoasit modifikasyonu, fragmantasyonu, agregasyonu gibi birçok değişiklik ortaya çıkabilir ve bunun sonucunda fonksiyon kaybı ya da proteolitik duyarlanma oluşabilir. Bütün bu değişiklikler serbest radikaller tarafından oluşturulan protein hasarının işaretleri olarak değerlendirilebilir (89).
En sık karşılaşılan değişiklik ise belirli aminoasit rezidülerine karbonil gruplarının eklenmesidir. Gerçektende doku homojenatlarında protein karbonillerinin miktarındaki artış yaşlanma sırasında görülen en önemli biyokimyasal değişikliktir (90).
Reaktif oksijen türlerinin proteinlere saldırısı sonucunda histidin, triptofan, sistein, prolin, tirozin, metionin, arjinin ve lizini içeren birçok aminoasit hasar görebilir (91).
Serbest radikallerin nükleik asitlere etkileri:
Serbest radikaller hücrelerde normal metabolizma ya da kanserojenler ve iyonize radyasyon gibi ekzojen kaynaklar tarafından üretilirler (92,93). Serbest radikaller içinde hidroksil radikali (OHˉ) DNA ve diğer biyolojik moleküllerde hasara neden olurlar. Bu tip bir hasar oksidatif DNA hasarı olarak adlandırılır ve mutagenez, karsinogenez ve yaşlanmada rol oynar. Oksidatif DNA hasarı hücresel tamir sistemleri ile onarılabilirler (92). Bu hasarların onarılması özellikle eksizyon tamiri ve zincir kırılma tamir enzimleri sayesinde gerçekleştirilmektedir (92,93). Bu tamir mekanizmaları lezyonların % 99’unu temizlemesine rağmen, % 1’i kalır ve bu da zamanla lezyonların birikimine yol açar. Sonuç olarak oksidatif DNA hasarı ve mutasyonları yaşla artar (88).
Hücrelerde spontan olarak indüklenen major iki DNA hasarı 8-oksoguanin ve timin glikoldür. Oksidatif metabolizmaya bağlı oluşan DNA hasarı genellikle tek lezyon olmasına rağmen sıralı birkaç lezyonda oluşabilir (93).
Serbest radikallerin karbonhidratlara etkileri:
Karbonhidratların radikaller tarafından oksidasyonu sonucunda α-hidroksialkil (C(OH)RRˉ) radikalleri elde etmek üzere C-H bağlarında hidrojen ayrılması şeklinde gerçekleşir (94). Fizyolojik pH ve sıcaklıkta glikoz gibi monosakkaritlerin otooksidayonu sonucunda hidrojen peroksit, peroksitler ve okzoaldehitler oluşur (88). Gözün vitröz sıvısında bol miktarda bulunan hiyalüronik asitin oksidatif hasarı sonucu katarakt gelişimi ile sinovyal sıvıdaki hiyalüronik asitin O2ˉ tarafından depolimerize
olarak vizkozitesinin azalması, serbest radikallerin karbonhidratlar üzerinde etkilerine verilebilecek örneklerdir (88,95).
Serbest radikallerin lipitlere etkileri:
Lipit peroksidasyonu, oksidatif stres koşulları altında enzimatik ve enzimatik olmayan iki süreç tarafından başlatılan, çoğunlukla çoklu doymamış yağ asitleri içeren bir serbest radikal zincir reaksiyonudur. Bu zincir reaksiyonunun ara ürünlerini; lipit hidroperoksit (LOOH), lipit radikali (L· ), epoksilik peroksit radikali (OLOO·) ve
peroksil radikali oluşturur (96).
Membran kolesterolleri ve yağ asitlerinin doymamış bağları serbest radikallerle reaksiyona girerek peroksidasyon oluştururlar (97). Serbest radikal etkisiyle yağ asidi zincirindeki metilen gruplarından bir H atomu uzaklaştırılması sonucu zincir radikal niteliği kazanmaktadır (97,98). Böylece oluşan lipit radikali dayanıksız bir bileşiktir (L· )
ve bir dizi değişikliğe uğramaktadır. Özellikle molekül içi çift bağ aktarılmasıyla dien konjugatları ve daha sonra lipit radikalinin moleküler oksijenle etkileşimi sonucu lipit peroksit radikali meydana gelir. Bu lipit peroksit radikalleri, zar yapısındaki diğer poliansatüre yağ asitlerini etkileyerek yeni lipit radikallerinin oluşumunu sağlamakta, kendileri de açığa çıkan hidrojen atomlarını alarak lipit peroksitlerine (LOOH) dönüşmektedir. Böylece olay kendi kendine katalizlenerek yürümektedir (97).
O2ˉ’in lipit hidroperoksitlerle (LOOH) reaksiyonu ile yeni radikal reaksiyonları
başlayabilir.
Bu reaksiyonla lipit peroksitler oluştukları yerden uzak bölgelerde hasara sebep olabilirler (99).
Lipit peroksidasyonu, lipit hidroperoksitlerin aldehid ve diğer karbonil bileşiklere dönüşmesiyle sona ermektedir. Bu bileşiklerden biri de malondialdehiddir (MDA) (97). Lipit peroksidasyonunun toksik etkilerini ortadan kaldırmak için canlıların sahip olduğu peroksiredoksinler denilen proteinler mevcuttur. Bu enzimler lipit peroksitleri alkole indirger (96).
Lipit peroksidasyonunun membran lipit yapısındaki değişiklikleri nedeni ile membran işlevinin bozulmasına, oluşan serbest radikallerin ise enzimler ve diğer hücre hasarlarına neden olduğu düşünülmektedir (97).
2.3.Antioksidan Savunma Sistemleri
Çeşitli kaynaklardan gelen serbest radikallere maruz kalma durumu organizmada bir dizi savunma mekanizmalarının gelişmesine yol açmıştır. Serbest radikallerin oluşturduğu oksidatif strese karşı savunma mekanizmaları; önleyici mekanizmalar, onarım mekanizmaları, fiziksel savunma ve antioksidan savunmadan oluşur (6). Bazı antioksidanlar proteinler ve enzimlerken, bazıları diğer küçük moleküllerdir (100).
Antioksidanlar enzimatik ve non-enzimatik antioksidanlar olmak üzere ikiye ayrılırlar.
Enzimatik Antioksidanlar: Süperoksit dismutaz (SOD), glutatyon peroksidaz (GPx), katalaz (CAT) bu gruba girer.
Non-enzimatik Antioksidanlar: Askorbik asit (Vitamin C), α-tokoferol (Vitamin E), glutatyon (GSH), karotenoidler, flavonoidler bu gruba girer (6,7,8,9,101,102,103).
Antioksidanlar önleyici, süpürücü, onarıcı ve de novo antioksidanlar olarak fonksiyonlarına göre de sınıflandırılabilirler. Önleyici antioksidan fonksiyonu reaktif oksijen türlerini baskılamada ilk basamak savunmadır. Buna örnek olarak hidrojen peroksit ve lipit hidroperoksitlerin su ve lipit hidroksitlere indirgenmesi yada demir ve bakır gibi metal iyonlarıyla kompleks yapılması verilebilir. Süpürücü antioksidanlar aktif türleri biyolojik moleküllere saldırmadan önce uzaklaştırırlar. Bu şekilde süperoksit dismutaz süperoksiti hidrojen peroksite dönüştürür. Birçok fenolik bileşik ve aromatik
amin bir serbest radikal süpürücü antioksidan olarak hareket eder. Bu süpürücü antioksidanlar ikinci basamak savunmayı oluştururlar. Birçok enzim zararların onarılması, atıkların temizlenmesi ve fonksiyon kaybının yeniden yapılandırılması açısından üçüncü savunma hattı olarak işlev görürler. Antioksidanların doğru konsantrasyonda, doğru zamanda, doğru transferi şeklinde adaptasyon mekanizması fonksiyonları ise dördüncü basamak savunmayı oluşturur. Ayrıca bazı antioksidanların diğer antioksidan düzeylerini düzenleyen hücresel sinyal mesajcısı olarak hareket ettiğine dair kanıtlar artmaktadır (100).
2.3.1.Enzimatik antioksidanlar
Süperoksit dismutaz (SOD)
Normal şartlar altında süperoksit anyon düzeyleri ilk kez 1969 yılında Mc Cord ve Fridovich tarafından keşfedilen endojen süperoksit dismütaz enzimi tarafından sıkı kontrol altında tutulur (104). Süperoksit dismutaz enziminin aktif merkezindeki metal ve aminoasit yapısına, subünit sayısına, kofaktörlere ve diğer özelliklere göre birçok izoformu vardır. SOD’ın üç formu vardır. Bunlar; sitozolik Cu,Zn-SOD, mitokondriyal Mn-SOD ve ekstraselüler SOD (EC-SOD)’ dır (104,105). Süperoksit dismutaz enzimi süperoksitin, hidrojen peroksit ve moleküler oksijene dönüşümünü sağlar (103). SOD enzimi süperoksitin kararlı durum konsantrasyonunu düşürmektedir (80).
2 O2ˉ + 2H+ → H2O2 + O2 (SOD ile katalizlenen reaksiyon)
SOD tarafından katalizlenen bu reaksiyon son derece verimlidir ve sadece difüzyon ile sınırlıdır (7). Bu dismutasyon reaksiyonunun ürünü olan H2O2 ise katalaz ve
glutatyon peroksidaz ile yıkılır (105).
2 H2O2 → O2 + 2 H2O (CAT ile katalizlenen reaksiyon)
H2O → 2 GSH → GSGG + 2 H2O (GPx ile katalizlenen reaksiyon)
Bu tür enzimler normal oksijen metabolizması sırasında oluşan toksik ara ürünleri ortadan kaldırmak için sekonder antioksidan olarak görev alırlar (105).
Glutatyon peroksidaz (GPx)
Glutatyon peroksidaz enziminin iki formu vardır. Bunlardan biri selenyum bağımsız (Glutatyon S-Transferaz, GST) glutatyon peroksidaz iken diğeri selenyum bağımlı glutatyon peroksidazdır (GPx). Bu iki enzimin alt ünitelerinin sayısı aktif merkezlerine bağlı selenyuma ve katalitik mekanizmalarına göre farklılık göstermektedir. Glutatyon mekanizması en önemli antioksidan savunma mekanizmalarından biridir. İnsanlarda dört farklı Se bağımlı glutatyon peroksidaz mevcuttur. Tüm GPx enzimlerinin peroksitleri indirgemek için iki elektron ekledikleri bilinmektedir. Bu enzimlerin antioksidan özellikleri, Fenton reaksiyonu için potansiyel substrat oluşturmak üzere peroksitleri elimine etmelerini sağlar (103).
Glutatyon peroksidazın katalizlediği reaksiyonun substratı H2O2 ya da organik bir
peroksit olan hidroperoksittir (ROOH). GPx peroksitleri suya ya da alkole parçalar (7,103).
2 GSH + H2O2 → GSSG + 2 H2O
2 GSH + ROOH → GSSG + ROH + H2O
Kırmızı kan hücreleri hemoglobin otooksidasyonunda ortaya çıkan yüksek oranda H2O2’ye sahip olmaları açısından ayrı bir öneme sahiptirler. Glutatyon peroksidaz
ise eritrositleri peroksitlere karşı korumaktadır (106).
Halen glutatyon peroksidaz izoenzimlerinin antioksidan defanstaki fonksiyonları tam olarak aydınlatılmamış olmakla birlikte, kinetik özelliği ve yaygın dağılımı ile oksidatif hasara karşı önemli katkı sağladığı bildirilmektedir (7).
Katalaz (CAT)
Katalaz; bitkiler, hayvanlar ve aerobik bakterilerin hücrelerinde bulunan hemoproteini içeren bir enzimdir (103). Eritrosit, karaciğer, kemik iliği gibi canlı dokularda, hücre içinde ise peroksizom adı verilen organelde bulunur (107). Katalaz enzimi verimli bir şekilde H2O2’in su ve oksijene dönüşümünü sağlar (7,103,107,108).
Katalaz Cu ve Fe iyonları tarafından katalizlenen fenton reaksiyonu yoluyla H2O2’den
hidroksil radikali oluşum riskini azaltır (7).
Katalaz tüm enzimler içinde en yüksek turnover oranına sahip olanlardan biridir. Her bir katalaz molekülü dakikada yaklaşık altı milyon hidrojen peroksit molekülünü su ve oksijene dönüştürebilir. Çeşitli tümörlerde H2O2’in detoksifikasyon kapasitesinin
önemli ölçüde azalması katalaz düzeylerindeki azalma ile bağlantılıdır (103). Glutatyon redüktaz
Glutatyon (GSH) ve glutatyon ilişkili enzimler reaktif oksijen türleri gibi karsinojenik ve sitotoksik bileşiklerin metabolizma ve detoksifikasyonuna katılırlar (109). Bazı radikallerin glutatyon peroksidaz ile reaksiyonu sonucu oluşan okside glutatyon (GSSG) NADP bağımlı glutatyon redüktaz ile indirgenir (7,110)
GSSG + NADPH + H+ → 2 GSH + NADP+
Bu enzim için gerekli NADPH pentoz fosfat yolundan sağlanır (110).
Glutatyon redüktaz; aerobik glikoliz sürecinde artmış redükte glutatyon (GSSGR) düzeylerinin eritrosit enzimleri, hemoglobin ve biyolojik hücre membranlarına vereceği oksidatif hasara karşı korunmada önemli rol üstlenir. Enzim eksikliği; bazı ilaçlar ya da kimyasallara maruziyet neticesinde hafif ya da orta şiddette hemolitik anemiyle sonuçlanabilir. Ancak kalıtımsal enzim eksikliği son derece nadirdir (106).
2.3.2.Enzimatik olmayan antioksidanlar
Askorbik Asit (Vitamin C)
Askorbik asit suda çözünen bir vitamindir. İnsan plazması ve hücre membranında önemli bir antioksidan olduğu çalışmalarda gösterilmiştir (7). Askorbik asitin antioksidan enzimler gibi çalışan primer partnerleri vitamin E ve karotenoidlerdir. Askorbik asit, E vitamininin rejenerasyonunda görev alarak α-tokoferol radikalinin, α-tokoferole indirgenmesini sağlar (103). Ayrıca superoksit, hidrojen peroksit, hidroksil radikali, singlet oksijen, hipoklorik asit ve peroksil radikallerini temizlediği gösterilmiştir (110).