TC
İNÖNÜ ÜNİVERSİTESİ
FEN BİLİMLERİ ENSTİTÜSÜ
KOLESTEROL BİYOSENSÖRÜ TASARIMINDA BAZI POLİMERİK
MATERYALLERİN ENZİM İMMOBİLİZASYON ORTAMI OLARAK
KULLANIMI
F. BİLGE EMRE
DOKTORA TEZİ KİMYA ANABİLİM DALI
MALATYA HAZİRAN 2007
Tezin Ba~hgl: Kolesterol Biyosensorii Tasanmmda Bazi Polimerik Materyallerin Enzim immobilizasyon Ortaml Olarak Kullamml
Tezi Hazlrlayan: F. Bilge EMRE
#
Smay Tarihi: 22.06.2007
Yukanda adl ge<;en tez jlirimizce degerlendirilerek Kimya Anabilim Dalmda Doktora T ezi olarak kabul edilmi~tir.
Sma" Jiirisi i)yeleri (ilk isim jliri ba~kanI. :1,'
Prof Dr. Serpil AKSOY
Prof Dr. Enmn EKINCi
Prof Dr, M, EnQ:in SENER
-:,.::--,.~~
Prof Dr. TurQ:aySECKi?\ ..., -~
Doc. Dr. Gamze ERDOGDU
-
Sh~~
',:---
,~
...lim'an ad soyadl
Tez ikinci DanI~manI (\'ar ise)
Onur Sözü
Doktora Tezi olarak sunduğum “Kolesterol Biyosensörü Tasarımında
Bazı Polimerik Materyallerin Enzim İmmobilizasyon Ortamı Olarak Kullanımı” başlıklı bu çalışmanın bilimsel ahlak ve geleneklere aykırı düşecek
bir yardıma başvurmaksızın tarafımdan yazıldığını ve yararlandığım bütün kaynakların, hem metin içinde hem de kaynakçada yöntemine uygun biçimde gösterilenlerden oluştuğunu belirtir, bunu onurumla doğrularım.
ÖZET
Doktora Tezi
KOLESTEROL BİYOSENSÖRÜ TASARIMINDA BAZI POLİMERİK MATERYALLERİN ENZİM İMMOBİLİZASYON ORTAMI OLARAK
KULLANIMI F. Bilge EMRE
İnönü Üniversitesi Fen Bilimleri Enstitüsü
Kimya Anabilim Dalı
118 + xi sayfa 2007
Danışman: Prof. Dr. Ergun EKİNCİ
Kan kolesterol derişimi; kardiyovasküler rahatsızlıklar, hipertansiyon ve arterosiklerozis gibi birçok klinik hastalığın teşhisi ve tedavisinde önemli bir parametredir. Kolesterol tayini için, kimyasal ve enzimatik metotlar kullanılmaktadır. Amperometri esaslı enzimatik metotta, kolesterol ile kolesterol oksidaz arasındaki enzimatik tepkimenin bir sonucu olarak oluşan hidrojen peroksit ölçülür.
Bu çalışmada, kolesterol oksidaz elektrokimyasal ya da kimyasal metotlarla hazırlanan, poliindolin, poli(o- toluidin), poli(m- toluidin), poli(o- fenilendiamin), poli(p- fenilendiamin), poli(4-asetamidofenol), poli(4-metoksifenol), poli(1,3,5-tri(aminofenil)hegzahidro-1,3,5-triazinpiromellitimit), poli(2,4,6-triaminopirimidin bifeniltetrakarboksiimid) ve poli(2,4,6-triaminopirimidinbenzofenondiimid) gibi farklı polimerik materyallerde immobilize edilmiştir. Dahası, enzim immobilizasyonunu etkileyen bazı parametreler incelenmiştir.
Sonuç olarak, anılan polimerlerin çoğunun kolesterol oksidaz için immobilizasyon ortamı olarak kullanılabileceği gösterilmiştir.
Anahtar Kelimeler: Enzim immobilizasyonu, kolesterol oksidaz, polimer matriks,
ABSTARCT
PhD. Thesis
USE OF THE SOME POLYMERIC MATERIALS AS ENZYME IMMOBOLIZATION MEDIUM IN CHOLESTROL BIOSENSOR DESIGN
F. Bilge EMRE İnönü University
Graduate School of Natural and Applied Science Department of Chemistry
118 + xi pages 2007
Supervisor: Prof. Dr. Ergun EKİNCİ
Blood cholestrol concentration is an important parameter to diagnosis and cure some clinical diseases such as cardio-vasciler ailment, hypertension and arteriosclerosis. For the determination of cholesterol, chemical and enzymatic methods have been used. In amperometry based enzymatic method, hydrogen peroxide formed as a result of the enzymatic reaction between cholesterol and cholesterol oxidase is measured.
In this work, cholesterol oxidase has been immobilized in different polymeric materials such as polyindoline, poly(o-toluidine), poly(m- toluidine), poly(4- acedamindophenol, poly(4-methoxyphenol), poly(o-phenylenediamine), poly( p- phenylenediamine), poly(1,3,5-(triaminophenyl)hexzahydro-1,3,5-triazinepyromellitimide), poly(2,4,6-triaminopyrimidine biphenyltetracarboxyimide) and poly(2,4,6-triaminopyrimidinebenzophenondiimide) prepared electrochemical or chemical methods. Moreover, the some parameters affecting enzyme immobilization have been examined.
As a result, it has been demostrated that the major of the mentioned polymers could be used as an immobilization media for cholesterol oxidase.
İÇİNDEKİLER ÖZET ………i ABSTRACT ………ii İÇİNDEKİLER ………...iii ŞEKİLLER DİZİNİ ………....v TABLOLAR DİZİNİ ………....x
SEMBOL VE KISALTMALAR ………xi
1. GİRİŞ VE AMAÇ ………1
2. KURAMSAL TEMELLER ………2
2.1. Voltametrik Teknikler ………2
2.1.1. Voltametri ………....2
2.1.1.1. Dönen elektrot voltametrisi ………2
2.1.1.2. Taramalı voltametri ………3
2.1.1.3. Dönüşümlü voltametri (CV) ………3
2.1.1.4. Kare dalga voltametrisi (SWV) ………4
2.1.2. Kronoamperometri (CA) ………5
2.1.3. Kronokulometri (CC) ………6
2.2. Elektroliz Teknikleri ………6
2.2.1. Elektroanalitik tekniklerin sınıflandırılması ……….6
2.2.2. Elektrokimyasal pil ………7
2.2.2.1. Elektrotlar ………8
2.2.2.1.1. Referans elektrotlar ………9
2.2.2.2 Elektrolitler ………..10
2.2.3. Pil potansiyeli ve Nersnt Eşitliği ………...10
2.2.4. Kütle aktarımı ………..11
2.2.5. Yük aktarımı ………..13
2.3. Elektrotların Kimyasal Modifıkasyonu ………...13
2.3.1. Elektrotların kimyasal modifikasyonunda polimerlerin kullanımı …...15
2.4. Biyosensörler ………..17
2.4.1. Biyosensörlerin yapısı ve fonksiyonu ………...18
2.4.1.1. Biyokomponentler ………..18
2.4.1.2. İletici ………..20
2.4.2. Reseptör immobilizasyonu ………...………...20
2.4.3. Biyosensörlerde yararlanılan iletim ve ölçüm sistemleri …………...21
2.4.3.1. Fizikokimyasal biyosensörler ………..22
2.4.3.1.1. Elektrokimyasal biyosensörler ………..22
2.4.3.1.2. Optik esaslı biyosensörler ………..24
2.4.3.1.3. Kalorimetri esaslı biyosensörler ………..24
2.4.3.1.4. Piezoelektrik esaslı biyosensörler ………..24
2.4.4. Kimyasal Biyosensörler ………..25
2.5. Biyosensörlerin Avantaj ve Dezavantajlarını Belirleyen Temel Özellikler ………..25
2.6. Biyosensörlerin Uygulama Alanları ………...26
2.7. Enzim Sensörleri ………..27
2.7.1. Enzim sensörlerin genel çalışma ilkesi ………...28
2.7.2. Enzim sensörlerinin sınıflandırılması ………...29
2.8. Elektrokimyasal Sensörler ………..29
2.8.1. Enzim immobilizasyonu ………..30
2.8.1.2. Entrapment ………..31
2.8.1.3. Adsorpsiyon ………..31
2.8.1.4. Çapraz bağlanma ………..31
2.8.1.5. Transduser yüzeyinin kaplanması/ Biyolojik bağlanma …………...31
2.9. Elektropolimerizasyon Parametrelerinin Seçimi ………...32
2.9.1. Monomer seçimi ………..32
2.9.2. Akım yoğunluğu ………..33
2.9.3. Polimerizasyon sıcaklığı ………..33
2.9.4. Biyoajan seçimi ………..33
2.9.5. Çözücü ve destek elektrolit seçimi ………...33
2.10. Enzim Sensörlerin Performans Faktörleri ………...34
2.10.1. Kararlılık ………..34 2.10.2. Duyarlılık ………..35 2.10.3. Seçicilik ………..35 2.10.4. Yanıt süresi ………..35 2.10.5. Tekrarlanırlık ………..36 2.11. Kolesterol ………..36 2.11.1 Fizyolojisi ve özellikleri ………..37
2.11.2. Kolesterol biyosentezi ve hücre içine alımı ………...38
2.11.3. Vücuttan atılımı ………..40
2.11.4. Kolesterol oksidaz ………..41
2.12. Polimerler ………..41
2.12.1. Poliimitler ………..42
3. MATERYAL VE METOD ………..45
3.1. Deneysel Araç ve Gereçler ………..45
3.1.1. Elektrotlar ………..47
3.1.1.1. Elektrotların temizliği ………..47
3.1.2. Ölçüm çözeltileri ………..47
3.1.3. Kolesterol oksidaz immobilizasyonu ….………..48
3.2. Kimyasal Maddeler ………..48
4. ARAŞTIRMA VE BULGULAR ………..49
4.1. Kolesterol Çözeltisi ………..49
4.2. Poliindolin – COx Elektrodu ………..55
4.3. Poli (o-toluidin) – COx Elektrodu ………..61
4.4. Poli(m-toluidin) – COx Elektrodu ………..70
4.5. Poli (o-fenilendiamin) – COx Elektrodu ………..73
4.6. Poli (p-fenilendiamin) – COx Elektrodu ………..76
4.7. Poli (4-asetamidofenol) – COx Elektrodu ………..81
4.8. Poli (4-metoksifenol) – COx Elektrodu ………..87
4.9. Poliimit Esaslı Enzim Elektrotlar ………..96
4.9.1. Poli[1,3,5-tri(aminofenil)hegzahidro-1,3,5-triazin piromellitimit]–COx Elektrodu ………..97 4.9.2. Poli[2,4,6-triaminopirimidin bifeniltetrakarboksiimid]- COx Elektrodu ………103 4.9.3. Poli[2,4,6-triaminopirimidin benzofenondiimid] – COx Elektrodu ………106 5. SONUÇ VE TARTIŞMA ………111 6. KAYNAKLAR ………113 7. ÖZGEÇMİŞ ………118
ŞEKİLLER DİZİNİ
Şekil 2.1. Dönüşümlü voltametride potansiyel taraması ve akım potansiyel eğrisi. A) dönüşümlü potansiyel taraması,
B) tarama sonucunda elde edilen voltamogram ………4
Şekil 2.2. Osteryoung kare dalga voltametrisi (OSWV) için potansiyel-zaman dalga şekli ve akım ölçümü ……….4
Şekil 2.3. Kronoamperometride çalışma elektroduna uygulanan potansiyelin zamanla değişimi ……….5
Şekil 2.4. Elektroanalitik tekniklerin sınıflandırılması ……….7
Şekil 2.5. Elektrokimyasal pil tipleri ………8
Şekil 2.6. Biyosensörlerin yapısı ve çalışma prensibi ………...18
Şekil 2.7. Biyoaffinite ve biyokatalitik sensörler ………...19
Şekil 2.8. Tutuklama yöntemleri ………..20
Şekil 2.9. Biyosensör teknolojisinde kullanılan biyoaktif materyal hiyerarşisinde enzimlerin yeri ………...27
Şekil 2.10. Enzim sensörün genel şematik gösterimi ………...28
Şekil 2.11. Enzim immobilizasyon yöntemleri ………...30
Şekil 2.12. Kolesterolden d vitamini ve bazı steroidlerin üretim şeması …...…...37
Şekil 2.13. Kolesterolün vücutta taşınması ….………..38
Şekil 2.14. Melovonat yolu ile kolesterol sentez şeması ………...40
Şekil 2.15. Genel imit yapıları ………..44
Şekil 3.1. BAS 100W elektrokimyasal analizörü ………...45
Şekil 3.2. Mikro hücre ve montajı ………..46
Şekil 4.1. Çıplak Pt elektrot üzerine PBS enjeksiyonunu ………..49
Şekil 4.2. Çıplak Pt elektrot üzerine 0,1 M PBS + %1 Triton X-100 enjeksiyonları ………...….………..50
Şekil 4.3. Çıplak Pt elektrot üzerine 0,1 M PBS + % 15 Triton X-100 enjeksiyonları ………..50
Şekil 4.4. Çıplak Pt elektrot üzerine Triton X-100 enjeksiyonu …………...51
Şekil 4.5. Çıplak Pt üzerine çözücü enjeksiyonları ………...51
Şekil 4.6. Çıplak Pt elektrot üzerine 2-propanol enjeksiyonu ………...52
Şekil 4.7. Çıplak Pt elektrot üzerine hegzan enjeksiyonu ………...53
Şekil 4.8. Çıplak Pt üzerine hegzan + kolesterol çözeltisi enjeksiyonu ...53
Şekil 4.9. Çıplak Pt elektrot üzerine farklı çözücülerin enjeksiyonu ………...54
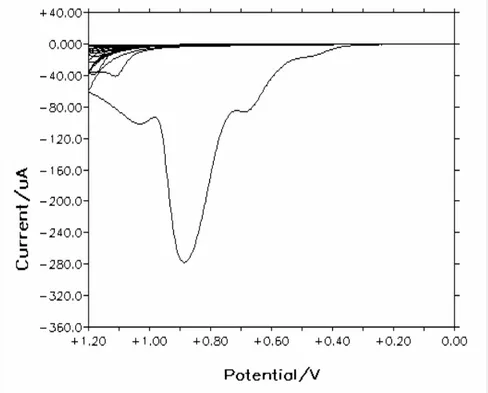
Şekil 4.10. İndolin’in CV’si ………..55
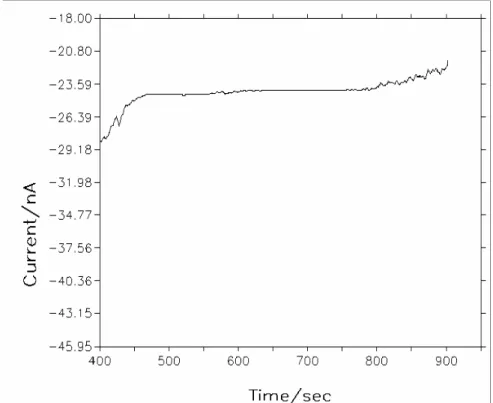
Şekil 4.11. Poliindolin-COx elektrot üzerine kolesterol enjeksiyonu …...…...56
Şekil 4.12. Poliindolin-COx elektrodun kolesterol enjeksiyonlarına yanıtları (750 mV) ………..57
Şekil 4.13. Poliindolin-COx elektrodun kolesterol enjeksiyonlarına yanıtları (550 mV) ………..57
Şekil 4.14. Poliindolin-COx elektrodun kolesterol enjeksiyonlarına yanıtları (650 mV) ………..58
Şekil 4.15. Poliindolin-COx elektrodun kolesterol enjeksiyonlarına yanıtları (850 mV) ………..58
Şekil 4.16. Poliindolin-COx elektrodun kolesterol enjeksiyonlarına yanıtları (pH=5) ………..59
Şekil 4.17. Poliindolin-COx elektrodun kolesterol enjeksiyonlarına yanıtları (pH=7) ………..59
Şekil 4.18. Poliindolin-COx elektrodun kolesterol enjeksiyonlarına
yanıtları (pH=9) ………..60
Şekil 4.19. Poliindolin-COx elektrodun kolesterol enjeksiyonlarına
yanıtları (pH=11) ………..60
Şekil 4.20. o-toluidin’in CV’si ………..61
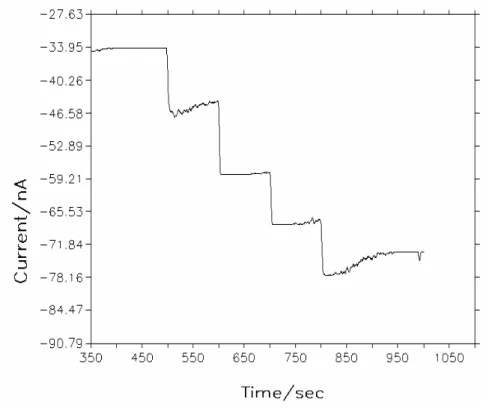
Şekil 4.21. Poli(o-toluidin)’in 24 çevrimlik filminin kolesterol
enjeksiyonlarına yanıtı ………..62
Şekil 4.22. 3,0 mC’luk poli(o-toluidin) elektrodun kolesterol
enjeksiyonlarına yanıtı ………..62
Şekil 4.23. 3,0 mC’luk poli(o-toluidin)-COx elektrodun kolesterol
enjeksiyonlarına yanıtı ………..63
Şekil 4.24. 3,5 mC’luk poli(o-toluidin)-COx elektrodun kolesterol
enjeksiyonlarına yanıtı ………..63
Şekil 4.25. 5,0 mC’luk poli(o-toluidin)-COx elektrodun kolesterol
enjeksiyonlarına yanıtı ………..64
Şekil 4.26. 7,0 mC’luk poli(o-toluidin)-COx elektrodun kolesterol
enjeksiyonlarına yanıtı ………..64
Şekil 4.27. 7,0 mC’luk poli(o-toluidin)’in bulk elektrolizi (BE) ………...65 Şekil 4.28. Poli(o-toluidin)-COx elektrodun kolesterol
enjeksiyonlarına yanıtı (750 mV) ………..65
Şekil 4.29. 550 mV’da poli(o-toluidin)-COx elektrodun kolesterol
enjeksiyonlarına yanıtı ………..66
Şekil 4.30. 650 mV’da poli(o-toluidin)-COx elektrodun kolesterol
enjeksiyonlarına yanıtı ………..66
Şekil 4.31. 750 mV’da poli(o-toluidin)-COx elektrodun kolesterol
enjeksiyonlarına yanıtı ………..67
Şekil 4.32. 850 mV’da poli(o-toluidin)-COx elektrodun kolesterol
enjeksiyonlarına yanıtı ………..67
Şekil 4.33. pH=5’de poli(o-toluidin)-COx elektrodun kolesterol
enjeksiyonlarına yanıtı ………..68
Şekil 4.34. pH=7’de poli(o-toluidin)-COx elektrodun kolesterol
enjeksiyonlarına yanıtı ………..68
Şekil 4.35. pH=9’da poli(o-toluidin)-COx elektrodun kolesterol
enjeksiyonlarına yanıtı ………..69
Şekil 4.36. pH=11’de poli(o-toluidin)-COx elektrodun kolesterol
enjeksiyonlarına yanıtı ………..69
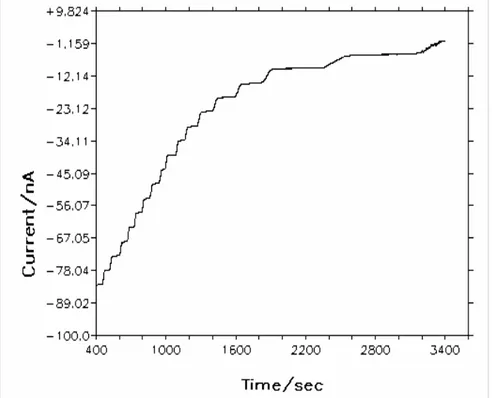
Şekil 4.37. Poli(o-toluidin)-COx enzim elektrodu için artan kolesterol
derişiminine karşı yanıtlar ………..70
Şekil 4.38. 4,0 mC’luk poli(m-toluidin) için bulk elektroliz (BE) …………...71
Şekil 4.39. 4,0 mC’luk poli(m-toluidin) elektrodun kolesterol
enjeksiyonlarına yanıtı ………..71
Şekil 4.40. 4,0 mC’luk poli(m-toluidin)- COx elektrot üzerine
kolesterol enjeksiyonlarının yanıtı ……….………...72
Şekil 4.41. 8,0 mC’luk poli(m-toluidin)-COx elektrot üzerine
kolesterol enjeksiyonlarının yanıtı ….………..72
Şekil 4.42. 4,0 mC'luk poli(m-toluidin)-COx elektrodun kolesterol
enjeksiyonlarına yanıtı ………..73
Şekil 4.43. o-fenilendiamin’in CV’si ……...………...74
Şekil 4.44. Poli(o-fenilendiamin) filmin kolesterol
Şekil 4.45. 1 μL COx damlatılarak hazırlanan poli(o-fenilendiamin)-COx
elektrodun kolesterol enjeksiyonlarına yanıtları …………...75
Şekil 4.46. 2 μL COx damlatılarak hazırlanan poli(o-fenilendiamin)-COx
elektrodun kolesterol enjeksiyonlarına yanıtları ………...75
Şekil 4.47. p-fenilendiamin’in 4 çevrimlik CV’si ……….…..76
Şekil 4.48. p-fenilendiamin’in 18 çevrimlik CV’si ……….…..77
Şekil 4.49. 18 çevrimlik poli(p-fenilendiamin) filmin kolesterol
enjeksiyonlarına yanıtları ………...…...77
Şekil 4.50. 18 çevrimle poli(p-fenilendiamin)-COx elektrot
hazırlanmasına ait CV ………..78
Şekil 4.51. 18 çevrimlik poli(p-fenilendiamin)-COx elektrodun
kolesterol enjeksiyonlarına yanıtı ………..78
Şekil 4.52. 5,0 mC’luk poli(p-fenilendiamin)’in 600 mV’daki BE’si …………..79 Şekil 4.53.
5,0 mC’luk poli(p-fenilendiamin)’in kolesterol
enjeksiyonlarına yanıtı ………..79
Şekil 4.54. 5,0 mC’luk poli(p-fenilendiamin)-COx elektrodun BE’si .…………..80 Şekil 4.55. 5,0 mC’luk [poli(p-fenilendiamin) - 2 μl COx)]
elektrodun kolesterol enjeksiyonlarına yanıtı ………...80
Şekil 4.56. Poli(p- fenilendiamin)-2 μL COx elektrodun
kolesterol enjeksiyonlarına yanıtı ………...81
Şekil 4.57. 4-asetamidofenol’ün CV’si ……...………...82 Şekil 4.58. Poli[4-asetamidofenol]’ün 24 çevrimlik filmi ………...82
Şekil 4.59. Poli(4-asetamidofenol) elektrodun kolesterol
enjeksiyonlarına yanıtı ………..83
Şekil 4.60. 24 çevrimle poli(4-asetamidofenol)-COx elektrot
hazırlanmasına ait CV ………..83
Şekil 4.61. 24 çevrimlik poli(4-asetamidofenol)-COx
elektrodun kolesterol enjeksiyonlarına yanıtı ………...84
Şekil 4.62. 7,0 mC’luk poli(4-asetamidofenol)’ün BE’si ………...84
Şekil 4.63. 7,0 mC’luk poli(4-asetamidofenol) elektrodun
kolesterol yanıtları ………..85
Şekil 4.64. 7,0 mC’luk poli(4-asetamidofenol) - 1 µL COx
elektrodun kolesterol yanıtları ………...85
Şekil 4.65. 6,0 mC’luk poli(4-asetamidofenol) - 2 µL COx
elektrodun BE’si ………..86
Şekil 4.66. 6,0 mC’luk poli(4-asetamidofenol)-2 µL COx elektrodun
kolesterol enjeksiyonlarına yanıtı ………...86
Şekil 4.67. (A) [ 3.0 mC poli(4-metoksifenol) + 10 µL COx ] elektrot,
(B) [ 3,0 mC poli(4 -metoksifenol)] elektrot için
kolesterol enjeksiyonları (PBS) ………...87
Şekil 4.68. [3,0 mC poli(4-metoksifenol)] polimer ve
[3,0 mC poli(4-metoksifenol) + 10 μL COx] enzim
elektrotların kolesterol enjeksiyonlarına yanıtları ………...88
Şekil 4.69. [3,75 mC poli(4-metoksifenol) + 10 μL COx] elektrodu için; A: hegzanda hazırlanmış olan kolesterol
çözeltisinin yanıtları, B: sadece hegzan çözücüsünün yanıtları …...89
Şekil 4.70. 550 mV’da poli(4-metoksifenol)- 2 μL COx
Şekil 4.71. 650 mV’da poli(4-metoksifenol)- 2 μL COx
elektrodun kolesterol enjeksiyonlarına yanıtları ………...90
Şekil 4.72. 750 mV’da poli(4-metoksifenol)- 2 μL COx
elektrodun kolesterol enjeksiyonlarına yanıtları ………...91
Şekil 4.73. 850 mV’da poli(4-metoksifenol)- 2 μL COx
elektrodun kolesterol enjeksiyonlarına yanıtları ………...91
Şekil 4.74. 950 mV’da poli(4-metoksifenol)- 2 μL COx
elektrodun kolesterol enjeksiyonlarına yanıtları ………...92
Şekil 4.75. Poli(4-metoksifenol)- 2 μL COx elektrodun
kolesterol enjeksiyonlarına yanıtları (pH=5) ………...92
Şekil 4.76. Poli(4-metoksifenol)- 2 μL COx elektrodun
kolesterol enjeksiyonlarına yanıtları (pH=7) ………...93
Şekil 4.77. Poli(4-metoksifenol)- 2 μL COx elektrodun
kolesterol enjeksiyonlarına yanıtları (pH=9) ………...93
Şekil 4.78. Poli(4-metoksifenol)- 2 μL COx elektrodun
kolesterol enjeksiyonlarına yanıtları (pH=11) ………...94
Şekil 4.79. Poli(4-metoksifenol) elektrodu üzerine damlatılan enzim
miktarının fonksiyonu olarak kolesterol yanıtları (1 µL COx) …...94
Şekil 4.80. Poli(4-metoksifenol) elektrodu üzerine damlatılan enzim miktarının
fonksiyonu olarak kolesterol yanıtları (2 µL COx) …...95
Şekil 4.81. Poli(4-metoksifenol) elektrodu üzerine damlatılan enzim miktarının
fonksiyonu olarak kolesterol yanıtları (3 µL COx) …...95
Şekil 4.82. Poli(4-metoksifenol) elektrodu üzerine damlatılan enzim miktarının
fonksiyonu olarak kolesterol yanıtlar (4 µL COx) …...96
Şekil 4.83. 5 μL’lik poli[1,3,5-tri(aminofenil)hegzahidro-1,3,5-triazinpiromellitimit] elektrodun kolesterol enjeksiyonlarına yanıtı ………...97
Şekil 4.84. 5 μL poli[1,3,5-tri(aminofenil)hegzahidro-1,3,5-triazinpiromellitimit] + 2 μL COx’den oluşan elektrodun kolesterol
enjeksiyonlarına yanıtı ………..98
Şekil 4.85. 5 μL poli[1,3,5-tri(aminofenil)hegzahidro-1,3,5-triazinpiromellitimit] + 10 μL COx’den oluşan elektrodun kolesterol
enjeksiyonlarına yanıtı ………..98
Şekil 4.86. 30 μL poli[1,3,5-tri(aminofenil)hegzahidro-1,3,5-triazinpiromellitimit]
elektrodun kolesterol enjeksiyonlarına yanıtı ………...99
Şekil 4.87. 30 μL poli[1,3,5-tri(aminofenil)hegzahidro-1,3,5-triazinpiromellitimit] + 10 μL COx’den oluşan enzim elektrodun kolesterol
enjeksiyonlarına yanıtı ………..99
Şekil 4.88. SiO2 camın SEM görüntüsü ………100
Şekil 4.89. Poli[1,3,5-tri(aminofenil)hegzahidro-1,3,5-triazinpiromellitimit]
elektrodu için SEM ………101
Şekil 4.90. Poli[1,3,5-tri(aminofenil)hegzahidro-1,3,5-triazinpiromellitimit]
–COx elektrodu için SEM ………101
Şekil 4.91. SiO2 + poli[1,3,5-tri(aminofenil)hegzahidro-1,3,5-triazinpiromellitimit]
elektrodu için SEM ………102
Şekil 4.92. SiO2 + poli[1,3,5-tri(aminofenil)hegzahidro-1,3,5-triazinpiromellitimit]+
poli[1,3,5-tri(aminofenil)hegzahidro-1,3,5-triazinpiromellitimit]-COx elektrodu için SEM ………102
Şekil 4.93. 2 μL’lik poli[2,4,6-triaminopirimidinbifeniltetrakarboksiimid]
Şekil 4.94. 2 μL poli[2,4,6-triaminopirimidinbifeniltetrakarboksiimid] + 2 μL COx’den oluşan elektrodun kolesterol
enjeksiyonlarına yanıtı (1.kullanım) ……….104
Şekil 4.95. 2 μL poli[2,4,6-triaminopirimidinbifeniltetrakarboksiimid] + 2 μL COx’den oluşan elektrodun kolesterol
enjeksiyonlarına yanıtı (4.kullanım) ……….104
Şekil 4.96. Poli[2,4,6-triaminopirimidin bifeniltetrakarboksiimid]
elektrodu için SEM ………105
Şekil 4.97. Poli[2,4,6-triaminopirimidin bifeniltetrakarboksiimid]-COx
elektrodu için SEM ………105 Şekil 4.98. SiO2+poli[2,4,6-triaminopirimidin bifeniltetrakarboksiimid]+
poli[2,4,6-triaminopirimidin bifeniltetrakarboksiimid]-COx
için SEM ………106
Şekil 4.99. 2 μL’lik poli[2,4,6-triaminopirimidin benzofenondiimit] elektrodun CV’si ………107
Şekil 4.100. 2 μL’lık poli[2,4,6-triaminopirimidin benzofenondiimit] + 2 μL
COx’den oluşan elektrodun CV’si ……….107
Şekil 4.101. 1 μL poli[2,4,6-triaminopirimidin benzofenondiimit]’in kolesterol
enjeksiyonlarına yanıtı ………108
Şekil 4.102. 1 μL poli[2,4,6-triaminopirimidin benzofenondiimit] + 2 μL COx’den oluşan elektrodun kolesterol
enjeksiyonlarına yanıtı ………...…….108
Şekil 4.103. Poli[2,4,6-triaminopirimidinbenzofenondiimit] için SEM………...….109 Şekil 4.104. Poli[2,4,6-triaminopirimidinbenzofenondiimit]-COx için SEM ..……109 Şekil 4.105. SiO2 +poli[2,4,6-triaminopirimidinbenzofenondiimit] +
TABLOLAR DİZİNİ
Tablo 2.1. Elektrot modifikasyon şeması …...………..14
Tablo 2.2. İletim ve ölçüm sistemleri ………..21
Tablo 2.3. Biyosensör grupları ve kapsadıkları analiz alanları ……..…………...26
SEMBOL VE KISALTMALAR a aktiflik A akım BE kitle elektrolizi C derişim CE kolesterol esteraz
COx kolesterol oksidaz
CV çevrimli/çevrimsel voltametri
D difüzyon katsayısı E elektrot potansiyeli Epil pil potansiyeli
f frekans F faraday sabiti
ΔG serbest enerji değişimi
HDL yüksek yoğunluklu lipoprotein
IDL orta yoğunluklu lipoprotein
I akım şiddeti
J akım yoğunluğu
LDL düşük yoğunluklu lipoprotein
m kütle aktarım katsayısı M molar derişim
n elektron sayısı N Avagadro sayısı
PBS fosfat tampon tuzu
R ideal gaz sabiti t zaman (s)
T sıcaklık (Kelvin)
TB zaman esaslı
U ünite
ν potansiyel tarama hızı
VLDL çok düşük yoğunluklu lipoprotein
ρ kinematik viskozite
ω açısal dönme hızı
Q yük
1. GİRİŞ VE AMAÇ
Kandaki kolesterol derişimi, kardiovasküler rahatsızlıklar, hipertansiyon, arterosiklerosis gibi birçok klinik hastalığın teşhisi ve tedavisinde önemli bir parametredir [1]. Kolesterol tayini için farklı analitik prosedürler önerilmektedir. Bunlar; kimyasal ve enzimatik metotlardır. Spektrofotometrik ve kimyasal reaksiyonların; analizlerdeki interferantlar sebebiyle duyarlılık ve seçiciliğin az olması, kararsız ve korrozif reaktiflerin kullanılması, karışık prosedürler ve her deney için ayrı enzim gereksinimi gibi dezavantajları söz konusudur [2-5]. Bununla birlikte, enzimatik yöntemin; seçicilik, yanıt süresi, küçük elektrotların kullanılabilir olması, düşük maliyeti ve tekrarlanabilirliği gibi avantajları vardır. Amperometrik yöntemle kolesterol tayini genelde iki temel prensibe dayanmaktadır:
1. kolesterol ile kolesterol oksidazın (COx) enzimatik reaksiyonundan oluşan hidrojen peroksitin ölçümü [6].
2- kolesterol ile kolesterol oksidazın (COx) enzimatik reaksiyonunda tüketilen oksijenin ölçümü [7].
Hidrojen peroksit ölçümüne dayalı yöntemde; kolesterol, oksijen varlığında kolesterol oksidaz enzimi ile koleston ve elektroaktif bir tür olan hidrojen peroksite parçalanmakta ve oluşan hidrojen peroksitin uygun bir potansiyelde yükseltgenmesi sonucunda oluşan akımın ölçülmesiyle kolesterol derişimi ölçülebilmektedir.
Kolesterol + O2 koleston + H2O2
H2O2 -⎯→ O2 + 2H++ 2e
Enzimatik esaslı amperometrik biyosensör tasarımında; ilgili enzim bir matriks (genellikle polimer) içerisinde immobilize edilmektedir [8-10]. Zira, enzimler son derece pahalı maddeler olduklarından, immobilizasyon öncelikle bir zorunluluktur. Laboratuarımızda şu ana kadar yapılan çalışmalarda, glikoz biyosensörü hazırlamak amacıyla, glukoz oksidaz enzimi değişik polimerik materyaller içerisinde başarılı bir şekilde immobilize edilebilmiştir [11-13].
Bu çalışmanın temel amacı; genel olarak elektrokimyasal polimerizasyon yöntemi kullanılmak suretiyle, kolesterol oksidaz enziminin, bazı polimerik matrikslerdeki immobilizasyonu amaçlanmaktadır. Ayrıca, kimyasal yöntemle hazırlanan bazı poliimitler de immobilizasyon materyali olarak denenmiştir.
2. KURAMSAL TEMELLER
2.1. VOLTAMETRİK TEKNİKLER
2.1.1. Voltametri
Voltametri, elektrot potansiyelinin değiştirilmesi ile elektrolitik hücreden geçen akımın ölçümüne dayalı elektroanalitik metotların genel adıdır. Voltametrik yöntemde akım-gerilim eğrileri yardımıyla çözeltideki türlerin nitel ve nicel analizlerinin yapılabilmesi mümkündür [14]. Voltametride, çalışma elektrodu ile referans elektrot arasına uygulanan ve değeri zamanla değiştirilen potansiyel farkına karşı, çalışma elektrodu ile yardımcı elektrot arasındaki akım ölçülür Potansiyeli değişen elektrot, indikatör veya çalışma elektrodu olup, değişik tür ve şekilde kullanılır. Bunlar civa, platin, altın, camsı karbon vb. elektrotlardır.
2.1.1.1. Dönen elektrot voltametrisi
Disk şeklindeki bir mikro elektrot belli bir hızda döndürülür. Bu dönme sayesinde elektroda madde aktarımı konveksiyon ve difüzyonla gerçekleşmiş olur. Kütle aktarım katsayısı,
m = 0.62D2/3ρ-1/6ω1/2 2.1
ile ifade edilir. ρ: kinematik viskozite (cm2/s), D: difüzyon katsayısı, ω: açısal dönme
hızı (rad/san). Elektrodun 1/s türünden dönme frekansı f ile verilirse,
ω = 2πf olur. 2.2
Dönen disk voltamogramının sınır akımı Levich eşitliği ile bulunur:
is=0.62nFAD2/3ρ-1/6 Cω1/2 2.3
2.1.1.2. Taramalı voltametri
Elektroaktif madde içeren durgun bir çözeltide bir mikroelektrot ile yardımcı elektrot arasına doğrusal olarak artan bir potansiyel uygulandığında oluşan akımın ölçülmesine taramalı voltametri denir. Buradan elde edilen pikin maksimum değeri, ip,
Randles-Sevcik eşitliği ile verilir.
ip=2.69.105n3/2AD1/2Cυ1/2 2.4
Sabit tarama hızında, ip derişim ile doğru orantılıdır. Tarama hızının arttırılması
ile faraday türü akım tarama hızının karekökü ile artar, buna karşın yükleme akımı ise tarama hızına doğrudan bağlıdır [15-17].
2.1.1.3 Dönüşümlü voltametri (CV)
Akımın, potansiyelin veya zamanın bir fonksiyonu olarak ölçüldüğü bir sistemdir. Durgun bir elektrodun potansiyeli doğrusal olarak değiştirilmek suretiyle akım-gerilim ilişkisinin incelenmesi sonucunda, elektrot tepkimelerinin aydınlatılmasında başvurulan en önemli yöntemlerden biridir. Belli bir potansiyelde taramanın yapılarak daha sonra tersi yönde (anodik ve katodik) taramanın yapıldığı bir teknik olup, konveksiyonu ortadan kaldırmak için durgun çözeltide yapılır [18,19]
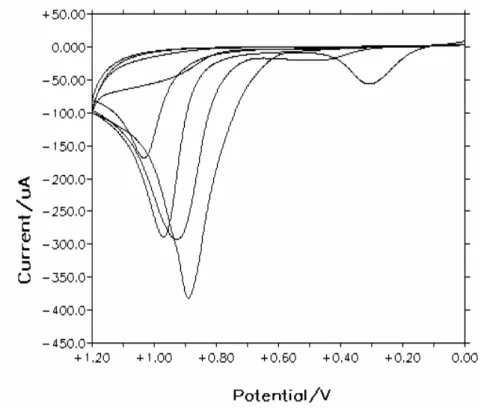
CV’de akım, potansiyele karşı grafiğe geçirilir (Şekil 2.1). Tarama hızı pratikte 10 mV/s’den birkaç yüz V/s’ye kadar değiştirilebilir. Çift tabaka yüklenmesi ve IR düşmesi gibi problemler çok yüksek tarama hızlarında (birkaç bin V/s) ortaya çıkar ve mikroelektrotların kullanımı ile minumuma indirilir. Bir voltamogramın temel davranışı, elektrot tepkimesinin yer aldığı potansiyelde bir akım pikinin görülmesidir. Pikin şekli ve konumu, elektrot materyali, çözelti bileşimi, reaktant derişimi ve tarama hızına bağlıdır [19]. Pik yüksekliklerinin tarama hızı ile değişmesinden adsorpsiyon, difüzyon ve elektron aktarım reaksiyonuna eşlik eden kimyasal reaksiyonların çeşitliliği belirlenebilir. Ayrıca reaksiyon mekanizması hakkında bilgi edinmek için ileri ve geri tarama pikleri incelenebilir. Bir sistemin hangi gerilimlerde kaç basamaklı olarak indirgenip yükseltgendiği, tersinir olup olmadığı, elektrot tepkimesinde oluşan ürünlerin karalı olup olmadığı ve yüzeye tutunup tutunmadıkları rahatlıkla anlaşılabilir [15,16].
Şekil 2.1. Dönüşümlü voltametride potansiyel taraması ve akım potansiyel eğrisi.
a) dönüşümlü potansiyel taraması b) tarama sonucunda elde edilen voltamogram
2.1.1.4. Kare dalga voltametrisi (SWV)
1930’da Kemula tarafından adsorpsiyon olaylarının incelenmesi için düşünülmüş, ancak 1952’de Fujinaga ve arkadaşları tarafından analitik kullanımı fark edilmiştir. 1952’de ise Barker, gelişimine büyük katkı sağlamıştır. Sabit elektrotlarda teorik ve uygulama bakımından gelişimi 1985 yılında Osteryoung tarafından gerçekleştirilmiştir.
Şekil 2.2. Osteryoung kare dalga voltametrisi (OSWV) için potansiyel-zaman dalga
Son derece hızlı ve duyarlı olma üstünlüğü olan bir tekniktir [21]. Şekilden görüldüğü gibi dalga-şekli, simetrik kare dalgalardan oluşan merdiven görünümündedir. Damlayan civa elektrodu ile tarama, bir damla ömrünün son birkaç saniyesi içinde, yükleme akımı hemen hemen sabitken gerçekleştirilir [21].
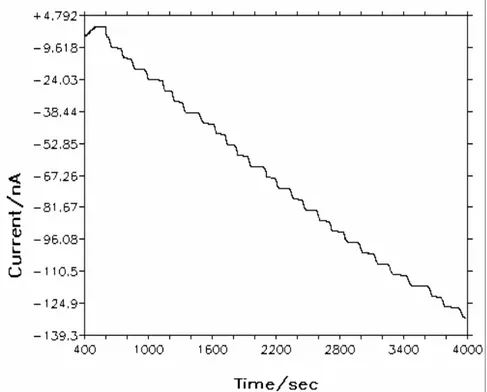
2.1.2. Kronoamperometri (CA)
Bir potansiyel basamak tekniği olan kronoamperometride çalışma elektrodunun
potansiyeli ani olarak değiştirilir ve durgun ortamda akım-zaman ilişkisi gözlenir.
Şekil 2.3. Kronoamperometride çalışma elektroduna uygulanan potansiyelin zamanla
değişimi. Ei potansiyelinde reaksiyon olmaz, Es potansiyelinde ise akım difüzyon kontrollüdür.
Bir elektrot yüzeyinde, Ei ve Es potansiyeli seçilirken önce maddenin DC
polarogramı veya CV’si alınır. Akımın henüz gözlenmediği artık akım bölgesindeki potansiyel başlangıç potansiyeli (Ei) olarak seçilir. Normal polarogramın plato bölgesinde veya CV’nin pik potansiyelinin daha ötesinde bir potansiyel de Es
potansiyeli olarak alınır. Potansiyel E2 değerinde belirli bir süre sabit tutulur. Bu
potansiyelde oluşan akımın zamanla değişimi aşağıdaki Cottrell eşitliğinde verildiği gibidir.
Ι = nFCoD1/2 / π1/2t1/2 2.5
Akım, t1/2 ile ters orantılıdır. Cottrell eşitliğine göre akım-t-1/2 grafiği orijinden geçen bir doğru verir. Bu sonuç, bir elektrot reaksiyonunun difüzyon kontrollü olup olmadığını ve elektroaktif maddenin difüzyon katsayısı ile aktarılan elektron sayısının bulunmasına yarar [15,22,23].
2.1.3. Kronokulometri (CC)
Kronoamperometri gibi bir potansiyel basamak tekniğidir. Çalışma elektroduna uygulanan potansiyel-zaman grafiği kronoamperometride olduğu gibidir. Reaksiyon süresince oluşan akımın zamana karşı grafiğe geçirilip bu grafiğin elektronik olarak integralinin alınmasıyla toplam yük bulunur [22].
2.2. Elektroliz Teknikleri
Farklı potansiyellerde farklı tepkimelerin meydana gelme olasılığı varsa sabit potansiyelli (potansiyel kontrollü) elektroliz ile sadece istenen ürünün elde edilmesi mümkündür. Time-Base (TB) tekniğinde akım, zamanın bir fonksiyonu olarak ölçülür yani kronoamperometrik bir yöntemdir [14].
Bulk Elektrolizi (kitle elektrolizi, BE) ise, başlangıç ortamında yükseltgenen bir tür varsa bu türün hızlı bir şekilde indirgenebilmesi için yeterli negatif potansiyelin uygulanmasına dayanır. Bulk elektrolizde geçen toplam yük Faraday yasası ile belirlenebilir.
Q= nFN 2.6
Çalışma ve yardımcı elektrodunun yüzey alanı elektroliz hızını etkilemektedir. Karıştırma hızı da elektroliz hızını arttıran bir diğer etkendir. Bu, çalışma elektoduna taşınan kütle artışını sağlar. BE deneylerinde ilk olarak çalışma potansiyeline karar verilir. Bu potansiyel, elektroliz hızını da kontrol edebilmek için redoks potansiyelinden 200 mV daha düşük bir değerdir. Akım, başlangıç değerinin %90’nına düşünceye kadar deneye devam edilir [14].
2.2.1. Elektroanalitik tekniklerin sınıflandırılması
Elektrot-çözelti sistemine bir elektriksel etki yapılarak sistemin verdiği yanıtın ölçülmesi elektrokimyasal tekniklerle yapılır. Alınan yanıt elektrokimyasal tekniğin özellikleri hakkında bilgi verir. Sistemin verdiği yanıtın türü tam olarak tekniğin adından anlaşılmayabilir. Potansiyel, akım ve zaman parametreleri hemen hemen bütün elektrokimyasal tekniklerde bulunur ve bu parametreler tekniğin adında yer alır.
Örneğin, voltametride potansiyel ile akımın, kronoamperometride zaman ile akımın ilişkisi incelenir.
Elektroanalitik metotların en yaygın sınıflandırılması Şekil 2.4’de gösterildiği gibidir. Elektroanalitik metotlar genelde net akımın sıfır olduğu denge durumundaki statik metotlar ve denge durumundan uzakta net akımın gözlendiği dinamik metotlar olmak üzere ikiye ayrılır. Dinamik metotlar çoğunlukla ya potansiyel kontrollü ya da akım kontrollüdür. Potansiyel veya akımın kontrol edildiği tekniklerde bu parametreler
büyük genlikli veya küçük genlikli olarak uygulanır. Büyük genlikli teknikler diğerlerine
göre daha yaygın olarak kullanılır.
Şekil 2.4. Elektroanalitik Tekniklerin Sınıflandırılması
2.2.2. Elektrokimyasal pil
Elektriksel olarak bağlanmış iki elektrottan oluşan sistemlerin genel adı olup, kendiliğinden akım üreterek kimyasal enerjiyi elektrik enerjisine dönüştürebilen hücrelerdir. Her türlü pilde biri indirgenme diğeri yükseltgenme olmak üzere iki
tepkime gerçekleşir. Bu nedenle herhangi bir pilde oluşan tepkimeleri doğrudan incelemek yerine iki yarı pil tepkimesinin incelenmesi daha doğru olur. Pilin toplamında meydana gelen değişimler, elektrotlarda oluşan tepkimelerin toplamıdır [22].
Şekil 2.5. Elektrokimyasal Pil Tipleri
2.2.2.1. Elektrotlar
Elektrokimyasal tepkimeler, elektronik ve elektrolitik fazların ara yüzlerinde (yükseltgenme – indirgenme) gerçekleşir. Elektrotlar, fazlarına göre 4 grupta incelenir:
* tek fazlı elektrotlar * iki fazlı elektrotlar
* üç fazlı elektrotlar * dört fazlı elektrotlar.
Elektrokimyasal hücreler iki ya da üç elektrotlu olmak üzere ikiye ayrılırlar. Son yıllarda yaygın olarak kullanılan hücre tipi ise üç elektrotlu olanıdır.
Bu elektrotlardan ilki çalışma (working) elektrodudur. İncelenen elektrokimyasal reaksiyon, çalışma elektrodunda gerçekleşir. Çalışma elektrodu çalışma prensibinden dolayı diğer iki elektrotla birleştirilemez.
İkinci elektrot, karşılaştırma elektrodudur. Polarizlenmeyen elektrot olarak da bilinir. İyi bir referans elektrot, sabit potansiyelde tersinmez elektrotdur.
Üçüncü ve sonuncu elektrot yardımcı elektrot olup, bunun görevi ise elektronlar için havuz oluşturmaktır. Yardımcı elektrot yapımında, inert maddeler daha çok kullanılır.
Üç elektrotlu sistemle ölçümün en önemli avantajı uygulanan potansiyelden etkilenmeyen referans elektrodun direncidir. Referans elektrodun direcinin değeri 104 -106 Ω aralığında olmalıdır ve voltmetre için 1012 Ω giriş direnci ile kombine edilmelidir, bu ölçülen potansiyelin 1μV veya daha az hatanın ortaya çıkmasını sağlar [24]. Çalışma elektrodundaki potansiyel değişimi, pratik olarak üstünden akım geçmeyen bir referans elektroda karşı ölçülür. Bu yolla karşıt ve çalışma elektrodunu içeren bir devrede akan/oluşan polarizlenme akımının, referans ve çalışma elektodundan oluşan, gerçekte akımın sıfır olduğu farklı bir devre içindeki potansiyel değişimleri ölçülür [24]. Referans elektrot üstünde akım olmadığından, karşıt elektrottan geçen akıma bakılmaksızın potansiyelin sabit olduğu düşünülebilir.
2.2.2.1.1. Referans elektrotlar
İyi bir referans elektrot tersinir olup, Nernst eşitliğine uyar. Ayrıca, sabit bir potansiyeli vardır, kolay tekrarlanabilir ve sıcaklık değişimine bağlı olarak küçük bir histerisiz gösterir [21,24]. Potansiyeli zamanla değişmeyen yarı hücreler kullanılır. Yaygın olarak kullanılan üç referans elektrot vardır. Bunlar;
* Standart Hidrojen Elektrot (SHE) : H+ iyonları aktivitesi 1 olan çözelti içine daldırılmış bir platin çubuk üzerinden 1 atm basınçta hidrojen gazının geçirilmesiyle yapılır ve 25 oC’deki potansiyeli sıfır olarak kabul edilir.
2H+ + 2e- ↔ H2(g) E = 0 V (2.7)
* Kalomel Elektrotlar: Kalomel referans elektrotlar, doygun civa (I) klorür ile temasta olan civadan oluşur. Derişimi belli KCl içerir. Doygun kalomel elektrot (DKE), sıcaklık sabitinin önemli ölçüde büyük olduğu metalik civa ve civa (I) klorür (Hg2Cl2)
çökeltisinden oluşan katı ve doygun KCl çözeltisi temasından oluşur. 25 oC’deki potansiyeli + 0,244 V’dur [21, 24,25].
* Gümüş- Gümüş Klorür Elektrot: Gümüş klorür tabakasıyla kaplı bir gümüş telin 0.1 M KCl çözeltisine daldırılmasıyla oluşur. 25 oC’deki potansiyeli + 0,288 V’dur [21, 24,25].
AgCl (k) + e- ↔ Ag (k) + Cl-(suda) E = + 0,288 V (2.9)
2.2.2.2. Elektrolitler
Çözündükleri veya eridikleri zaman iletken bir ortam oluşturan yani elektrik akımını ileten maddelere “elektrolit maddeler” denir. Gerçek ve potansiyel elektrolitler olmak üzere ikiye ayrılırlar.
İyonik kristallere gerçek elektrolitler veya iyonoforlar denir. Gerçek elektrolit olmayıp bazı koşullarda elektrolit olma yeteneği gösteren maddelere ise potansiyel elektrolit ya da iyon oluşturan anlamında iyonojen denir.
2.2.3. Pil potansiyeli ve Nernst eşitliği
Bir pilden elde edilen enerji, pilin elektrotlarında meydana gelen kimyasal reaksiyonların serbest enerjisindeki azalmaya eşittir.
ΔG = -nFE (2.10)
ΔG, serbest entalpi değişimini,
n, alınan ya da verilen elektron sayısını, F, faraday sabitini (96500 C),
E, pil potansiyelini göstermektedir. Kendiliğinden gerçekleşen reaksiyonlarda ΔG değeri negatiftir. Serbest entalpi değişimi ise;
ΔG = ΔG0+ RTlnQa (2.11)
şeklinde verilir. 2.10 ile 2.11 eşitliklerinden,
-nFE = -nFE0 + RTlnQa
Bu denklem 250C için düzenlenecek olursa;
E= E0 – [0,059/n] log (aürünler / agirenler) Nernst eşitliği elde edilir. (2.13)
2.2.4. Kütle aktarımı
Bir elektrot sadece elektrot yüzeyindeki çok ince bir çözelti tabakasında etkili olabildiğinden, faradayik akım, ana çözeltiden elektrot yüzeyinde reaksiyona giren türlerin devamlı kütle aktarımını gerektirir [21]. Eğer arayüzeyde elektron transferi ve elektrot boyunca elektron iletiminin mekanizmalarının ikisi de hızlıysa, elektroaktif türlerin hareketi yük akış hızını sınırlar.
Elektrokimyasal hücrenin çalışması sırasında maddenin elektrot yüzeyine aktarımına kütle aktarımı, başka bir deyişle derişim/derişim polarizasyonu denir ve elektrot-çözelti ara fazında bir molekülün elektrokimyasal indirgenmesi veya yükseltgenmesiyle gerçekleşir. Kütle transferi, migrasyon (göç), konveksiyon ve difüzyon olmak üzere üç ayrı mekanizma ile incelenir.
Derişim polarizasyonu bir galvanik hücrenin potansiyelinin, termodinamik potansiyel ve IR düşüşüne bağlı olarak tahmin edilenden daha küçük olmasına sebep olur [21].
Birçok elektroanalitik yöntemde derişim polarizasyonu önemlidir. Bazı durumlarda giderilmeye çalışılırken bazı uygulamalarda ise derişim polarizasyonu önemli olup, arttırmak için her yola başvurulur. Derişim polarizasyonunun derecesini etkileyen bazı parametreler vardır:
- Düşük reaktif derişiminde polarizasyon oluşma olasılığı daha yüksektir. - Yüksek elektrolit derişimi polarizasyonu arttırabilir.
- Homojen karıştırma polarizasyonu azaltır.
- Yüzey alanı büyüdükçe polarizasyonun etkisi azalır[26].
Kütle transferinin tüm türleri bir elektrot için elektroaktif türlerin, ji, değişkeni
olarak adlandırılabilir.
migrasyon sonucu oluşan bileşen ji = fonksiyonu difüzyon sonucu oluşan bileşen
Konveksiyon; kütle transferinde en etkili olandır ve çözelti bileşimi sabit tutularak elimine edilebilir. Elektrot yüzeyine yakın çözelti hareketinden oluşur ve elektrot yüzeyindeki difüzyon tabakasının kalınlığının azalmasına sebep olan iki ekstra durum vardır:
- sabit çözeltide elektroda doğru hareket
- kararlı haldeki elektroda çözeltiden hareket [27].
Difüzyon; hem migrasyon hem de konveksiyonun olmadığı durumlarda bile ortaya çıkar. Çözelti karıştırılsa bir difüzyon meydana gelir. Difüzyon, iki bölgesi arasında derişim farkı var ise ortaya çıkar ve derişim farkı olmayıncaya kadar devam eder. Difüzyon hızı derişim farkıyla doğru orantılı olup, difüzyon hızı;
dc /dt = k (c-co) (2.14)
eşitliği ile verilir. Reaktif derişimi c, elektrot yüzeyindeki denge derişimi co ve orantı
sabiti k’dır. co, Nernst eşitliğinden hesaplanır.
Ekatot = E0- (0.0592 / 2) log (1/ co) (2.15)
Elektroda yüksek potansiyel uygulandıkça co küçülür ve difüzyon hızı da
zamanla daha büyük olur. co, c’ye kıyasla ihmal edilebilir hale geldiğinde yani sonsuz
seyreltik oldukça, hız sabitlenir. co → 0 olduğunda,
dc/dt = kc olur. (2.16)
Bu durumda elektrot ideal polarizlenmiş bir elektrot olarak kullanılır [26, 27]. Göç (Migrasyon); bir elektrik alanında, yüklü türlerin hareketidir. Çözelti içindeki yüklü türler iyon olarak adlandırılır. Migrasyon hızı iyonların yüküne, çapına ve iyonla alan arasındaki çekim gücüne bağlıdır.
Elektrodun çevresinde çok negatif veya çok pozitif yükten dolayı kuvvetli bir alan, yani büyük bir potansiyel alan oluşur. Bu tanım Coulomb yasasının kısa bir özetidir. Eğer, elektrotda bir potansiyel yok ise migrasyon da olmaz. Çözelti ortamına
reaktif olmayan iyonik tuzlar elektrolit olarak ilave edilirse migrasyon minimize edilebilir.
2.2.5. Yük aktarımı
Kütle ve yük transferi ardışık iki prosestir. Uygulanan potansiyel düşükse, yük transferi de yavaştır ve kütle transfer sınırlamaları ihmal edilebilir [27]. Kinetik polarizasyonda akımın büyüklüğü, elektrot reaksiyonlarının birinin veya her ikisinin hızı ile yani reaktifler ve elektrotlar arasındaki elektron aktarım hızı ile sınırlıdır. Kinetik polarizasyonu bastırmak için, yarı-reaksiyon enerji engelini yenmesi amacıyla, ilave bir potansiyel veya aşırı gerilim uygulamak gerekir [21]. Belirlenen potansiyel arttırılırsa yük transferi de artar, fakat bu kütle transferi ile sınırlanan tüm reaksiyon hızını etkilemez [27]. Yük aktarım polarizasyonu ile ortaya çıkan aşırı gerilim aşağıdaki özelliklere sahiptir.
1. Elektrot yüzeyinin cm2 si başına amper olarak tanımlanan akım yoğunluğu arttıkça aşırı gerilim de artar.
2. Sıcaklık arttıkça aşırı gerilim azalır.
3. Kalay, kurşun, çinko ve özellikle civa gibi daha yumuşak metallerin kullanılması durumunda aşırı gerilim daha büyük olur. Yani, elektrodun kimyasal bileşiminden etkilenir.
4. Hidrojen veya oksijen gibi gaz ürünlerin oluştuğu elektrot işlemleri için çok önemli olan aşırı gerilim; metalin biriktiği veya bir iyonun yükseltgenme basamağının değiştiği durumlarda genellikle ihmal edilir.
5. Aşırı gerilimlerin büyüklüğü bir dizi kontrol edilemeyen değişkene bağlı olarak belirlendiğinden önceden kesin olarak tahmin edilemez [21,26].
2.3. Elektrotların Kimyasal Modifikasyonu
Elektroaktif polimer ve çok moleküllü katman filmler kimyasal modifikasyonda yaygın olarak kullanılmaktadır [14]. En önemli avantajları ise kovalent bağlı tek katmanlara kıyasla, elektrot yüzeylerine daha kolay uygulanmalarıdır. Polimer filmler, 105 tek moleküler katmana eşdeğerde elektroaktif merkeze sahip olduklarından elektrokimyasal özellikleri çok daha kolay incelenir. Elektrot yüzeyine reaktiflerin bağlanmasıyla, kullanılan reaktifin kimyasal özelliklerinin elektroda kazandırılacağı
düşüncesi, kimyasal olarak modifiye edilmiş elektrot kavramını ortaya çıkarmıştır. Özel reaktifler seçilirse elektrokimyasal tepkimelerde seçicilik ve hız kontrolü yapılabilir. Kimyasal modifiye elektrotlar; elektrokataliz, membran engeli (permselektivite), deriştirme (ön biriktirme), bazı maddelerin elektrot yüzeyinden kontrollü salınımı ve mikroelektrotlar olmak üzere beş değişik amaçla kullanılır.
Kimyasal ajanların elektrot yüzeyine immobilizasyonu Tablo 2.1’de gösterilmiştir.
Tablo 2.1. Elektrot Modifikasyon Şeması
Monomoleküler Tabakalar Ajanın Kemisorpsiyonu, Platin yüzeyine, Karbon yüzeyine, Civa yüzeyine, Altın yüzeyine.
Elektrot-elektroaktif ajan arasında kovalent bağ oluşumu Metal oksit yüzeylerde,
Karbon yüzeylerde, Yarıiletken yüzeylerde, Elektroinaktif kiral maddelerde.
Elektrot üzerine polimer film kaplanmış multimoleküler tabakalar Redoks polimerleri,
Elektrostatik olarak kurulmuş tuzaklarda iyon değişimi, Elektronik iletken polimerler,
İyonik iletken polimerler,
Taç eter veya kompleksleşme ajanı, Elektroinaktif kiral polimerler Heterojen multimoleküler tabakalar
Karbon pastası ile karıştırılmış modifiye ajanlar, Modifiye edilmiş kil,
Modifiye edilmiş zeolit,
Elektrot tepkimelerinin katalizlenmesi, modifiye edilmiş elektrot yüzeylerinin en önemli uygulama alanlarından biridir. Çıplak elektrot yüzeyinde elektrot kinetiğinin yavaş olması durumunda yüzeyde tutuklanmış bir aracı katalizör yardımıyla aşırı gerilimin düşürülerek istenen elektrot tepkimesi hızlandırılabilir. Aracı katalizör tarafından yükseltgenmiş tür, yüzeyde çok hızlı bir şekilde indirgenir ve oluşan indirgenmiş tür çözeltide bulunan türler ile hızlı redoks tepkimesine girebilir. Böylece elektrokataliz olayında tepkime hızları istendiği şekilde arttırılabilir. İyi katalizlenmiş bir elektrokimyasal tepkime ile çıplak elektrottaki indirgenme gerilimi daha negatif veya yükseltgenme gerilimi de daha pozitif değerlere kaydırılabilir.
Membran engelli polimerik filmler, çözeltideki türlerin bir kısmının elektrot ile temasını engelleyerek kuvvetli adsorpsiyon yapan elektroaktif türlerin elektrot yüzeyine ulaşmasını engeller. Modifiye elektrotda önderiştirme / önbiriktirme ve membran engeli özellikleri, analizi istenen ve istenmeyen türler için kullanılır. Farklı gözenek yapısına sahip polimer filmler oluşturmak için elektropolimerizasyon sırasında geçirilen yük miktarı ve polimerizasyon parametreleri ile oynanabilir.
2.3.1. Elektrotların kimyasal modifikasyonunda polimerlerin kullanımı
Polimer film ile kaplanmış elektrot yapımında ya kimyasal polimerizasyon ya da monomerin doğrudan elektrot yüzeyinde polimerleştirilmesiyle elde edilen polimerlerle elektrot yüzeyi kaplanır.
Kimyasal polimerizasyon ile polimerlerin elektrot yüzeyine kaplanmasında; elektrot yüzeyine elektrokimyasal çöktürme, daldırıp kurutma, damlatma, döndürerek-buharlaştırma yöntemleri kullanılabilir.
Doğrudan film oluşturmada ise kullanılan üç yöntem vardır; plazma polimerizasyonu, organosilan kondenzasyonu ve elektrokimyasal polimerizasyondur.
Elektroaktif veya elektroaktif olmayan polimerik fılmler oluşturmak için elektrokimyasal yolla radikal oluşturulan tepkimelerde yüzeyde başlatılan polimerizasyon sonucu elde edilen bileşiğin elektrot yüzeyinde çöktürülmesi ya da adsorpsiyonu yapılabilir.
Elektrokimyasal çöktürme yönteminde ise;
- polimer çözeltisine daldırılan elektroda uygun bir gerilim uygulanarak kaplama yapılır.
- elektrot, polimer çözeltisine daldırılır ve bir süre bekletildikten sonra kurutulur. - damlatma-döndürerek buharlaştırma yönteminde ise elektrot yüzeyine polimer çözeltisi damlatılıp elektrodun döndürülmesi yoluyla çözücü buharlaştırılır.
Elektroaktif polimerik filmler üç sınıfta ele alınır. Bu tür filmler hem iyonik hem de elektronik iletkenlik gösterirler [14].
Redoks polimerleri; indirgenmiş ve yükseltgenmiş redoks merkezlerinde elektron hopping (sıçrama) ile elektriği ileten polimerler olarak bilinir. En yaygın olarak bilinenleri polivinilpiridin [28] ve ferrosen esaslı polimerlerdir [28, 29].
1. İyon değiştirme polimerleri; istenen yanıt karakteristiklerini sağlayabilen bileşenlerden oluşan polimerlerdir. Nafyon ve Eastman-AQ en çok kullanılan iyonik polimerlerdir [28]. Katyonik gruplar içeren polimerler ile anyona duyarlı elektrotlar yapılmıştır.
2. İletken polimerler; elektrik akımını ileten polimerleredir. Genellikle anot yüzeyinde yükseltgenme sonucunda büyümeyle başlar. Çözelti içerisinde de belirli oranda polimer oluşturulabilir. Yükseltgenen monomer genellikle radikal katyon oluşturur ve bu şekilde yüzeyde artı yüklü polimer zincirleri oluşur [26,30].
Polimerik filmlerle kaplanmış elektrotların hazırlanması ve bu elektrotların elektrokimyasal davranışlarının belirlenmesi çeşitli gruplar tarafından incelenmiştir. Polimerik filmin çalışılan ortamda çözünmemesi ve kararlı olması önemlidir. Bu filmler yüzeye kemisorpsiyon kuvvetleri ile tutunurlar. Genel olarak, polimer filmlerin kararlılığı mono katmanlardan çok daha iyi olup, bu sebeple elektroanalitik kimya uygulamalarında ve özellikle de sensör tasarımında oldukça önemlidirler.
2.4. Biyosensörler
Biyosensörlerin tarihi, 1962’de L.C. Clark’ın Cincinnati Hastanesi’nde (Ohio, ABD) ameliyat sırasında kanın O2 miktarını bir elektrot ile izlemesiyle başlar. Clark ve
Lysons enzim içeren membranlar kullanarak, üre ve glikozu, pH veya O2 elektrot ile
tayin edilebilen bir ürüne dönüştürerek, glikoz oksidaz (GOx) enzimini O2 elektrodu ile
kombine etmek suretiyle, kanın glikoz düzeyini ölçmeyi başarmışlardır. 1967’de Updike ve Hicks, O2 elektrot üzerine glikoz oksidaz içeren polimerik bir jel kaplayarak
enzim elektrot hazırladılar. Burada kullanılan elektrot, elektrolit ortamında bulunan O2’yi kullanarak glikozu glikonik aside yükseltger [31, 32].
Biyosensör, işlenmemiş örneklerdeki kimyasal türlerin derişimindeki değişimi doğrudan, tersinir, sürekli, hızlı ve doğru bir biçimde ölçmek için kullanılan analitik bir alettir [28,33]. Biyosensörler, kimyasal veya biyokimyasal reaksiyonun meydana geldiği duyarlı bir mikro alana optik, elektrik, termal veya kütle transferini sağlayan bir parçanın entegre edilmesinden oluşur [28,34]. Biyosensörler, biyoloji, fizik, kimya, biyokimya, mühendislik gibi pek çok bilim alanının bilgi birikiminden multidisipliner bir anlayış çerçevesinde yararlanılarak ve biyolojik moleküllerin veya sistemlerin seçimlilik özellikleri ile modern elektronik tekniklerin işlem yeteneğinin birleştirilmesi sonucunda geliştirilen biyoanalitik cihazlar olarak tanımlanabilirler [35]. Biyosensörlerde, bir taraftan biyolojik sistemin (enzim) yüksek spesifisikliği, diğer taraftan da fiziksel sistemin (elektrot) tayin duyarlılığı birleştirilerek geniş spektrumlu bir uygulama alanı ortaya çıkarılmıştır.
Biyosensörlerin yüksek spesifikliği yanında, renkli ve bulanık çözeltilerde geniş bir derişim aralığında doğrudan ölçüme olanak sağlaması gibi üstünlükleri vardır. Fakat reseptör olarak adlandırılan biyokomponentlerin pH, sıcaklık ve iyon şiddeti gibi ortam koşullarından etkilenerek biyosensörün kullanım ömrünü kısaltması ise bir dezavantajdır [26].
2.4.1. Biyosensörlerin Yapısı ve Fonksiyonu
Biyosensörler; "biyomolekül / biyoajan" olarak da adlandırılan biyokomponentler (reseptör), fiziksel komponentler (transduser) ve fizikokimyasal sinyalleri elektronik sinyallere dönüştürebilen bir " çevirici / elektronik " sistemden oluşur. Yani analizlenecek madde ile seçimli bir şekilde etkileşime giren biyoaktif bir bileşenin, ortaya çıkan sinyalini ileten bir iletici sistemle birleştirilip bunların bir ölçüm sistemi ile kombinasyonundan oluşur [1,35,38]. Biyokomponent örnek ile doğrudan temas halinde olup, biyosensörün en hassas bileşenini oluşturur. Şekil 2.6’da biyosensörlerin yapısı ve çalışma prensibi gösterilmiştir.
Şekil 2.6. Biyosensörlerin Yapısı ve Çalışma Prensibi
2.4.1.1. Biyokomponentler
Biyosensörlerin yapısında görev alan biyokomponentler çoğu kez biyoreseptör olarak adlandırılırlar. Bunların içinde en yaygın kullanılanlar enzimler, dokular, mayalar, antibadi/antijenler ve antikorlardır [1,34]. Enzim –substrat ve antikor – antigen arasındaki etkileşimin ilk adımı analitlerin protein moleküllerine bağlanmasıdır.
İncelenen maddenin varlığında, biyoalıcı bir iletici vasıtasıyla saptanabilen fizikokimyasal bir etkiye sahip olmalıdır. Aslında biyosensörleri çalışma prensiplerine göre Şekil 2.7’de gösterildiği gibi biyoaffinite ve biyokatalitik sensörler olmak üzere iki grupta incelemek mümkündür.
BİYOAFFİNİTE SENSÖRLER BİYOKATALİTİK SENSÖRLER
BİYOALICI (RESEPTÖR) ANALİT BİYOALICI (RESEPTÖR) ANALİT
Enzim Substrat, İnhibitör Enzim Substrat Apoenzim Prostetik Grup Mikroorganizma Kofaktör
Antikor Antijen Organel Aktivatör
Reseptör Hormon Doku Kesiti İnhibitör
Lektin Glikoproteinler Enzim
Sakkaritler
Protein
İLETİCİLER
Amperometrik ve Potansiyometrik Elektrotlar Yarı İletken Elektrotlar
Termistörler Transistörler
Optoelektronik Dedektörler
Şekil 2.7. Biyoaffinite ve Biyokatalitik Sensörler
*Biyoaffinite Esaslı Biyosensörler; boyalar, lektinler, antikorlar veya hormon
reseptörleri, matrikse bağlı olarak enzimler, glikoproteinler, antigenler ve hormonların moleküler tanımlamaları için kullanılırlar. Diğer yandan enzimler (saf enzimler,
organeller, doku kesitleri veya mikroorganizmalar) tarafından gerçekleştirilen
moleküler değişimlere analitlerin kimyasal dönüşümü eşlik eder. Yüksek spesifikliklerinden dolayı enzimler en yaygın kullanılan biyoreseptörlerdir.
*Biyokatalitik Esaslı Biyosensörler; iletici sistem üzerinde enzim immobilizasyonuyla
substratın, inhibitörün, aktivatörün veya koenzimin tayini,
*İmmobilize Hücre Esaslı Biyosensörler; hücrelerin iletici sistem üzerine
immobilizasyonu ile o hücreler tarafından metabolize edilen çeşitli maddelerin tayini.
*Transmembran Esaslı Biyosensörler; spesifik reseptör veya farklı membran
proteinlerini içeren hücre membranlarının iletici sistem üzerinde immobilizasyonuyla aranan moleküllerin seçimli tayinleridir.
Teorik olarak reseptör ve transduserlerin birçok kombinasyonunu olmasına rağmen bu kombinasyonlar bir elektrik sinyali oluşturamazlarsa biyosensör aktivite gösteremez. Örneğin; transduser olarak bir termistörün kullanılması durumunda substratın dönüşüm reaksiyonu sonucu entalpide bir değişim olmaz ise biyosensör çalışmaz [26].
2.4.1.2. İletici
Transduserler yani ileticiler, biyoalıcı vasıtasıyla reseptörlerin biyolojik reaksiyonunu ölçülebilir fiziksel bir sinyale dönüştüren [36] yani bir enerjinin diğerine dönüşümün sağlayan cihazlardır. Biyokimyasal modifikasyona göre ileticiler seçilir. Amperometrik ve potensiyometrik ölçümlerde transduser olarak elektrotlar kullanılır ve burada hedef, maddedir (O2 elektrodunda çözünmüş O2, pH elektrodunda H+ iyonu
gibi). Optik sensörlerde hedef, ışıktır. Kristalin salınım rezonansının kütle yüklenimi sebebiyle değişmesi ise piezoelektrik sensörlerin hedefidir [32,35,37].
2.4.2. Reseptör immobilizasyonu
Biyokomponentlerin iletici üzerine immobilizasyonu fiziksel (adsorpsiyon, polimer matrikste tutuklama vb.) veya kimyasal (kovalent bağlama, bi veya multi fonksiyonel reaktifler ile çapraz bağlama) yöntemler ile gerçekleştirilir. Doku kültürleri, organeller ve mikroorganizmaların immobilizasyonunda daha çok polimer jellerde tutuklama yöntemi kullanılır [26]. Şekil 2.8’de tutuklama yöntemleri gösterilmiştir.
2.4.3. Biyosensörlerde yararlanılan iletim ve ölçüm sistemleri
Biyosensörlerde, biyoaktif bileşenin tayin edilecek madde ile etkileşiminde meydana gelen sinyalin iletim ve ölçümü için genel olarak Tablo 2.2’de gösterildiği gibi, elektrokimyasal, optik, kalorimetrik ve piezoelektrik yöntemler kullanılır.
Tablo 2.2. İletim ve Ölçüm Sistemleri
1- Fizikokimyasal Biyosensörler
Elektrokimyasal Yöntemler
Potansiyometrik Yöntemler
Amperometrik Yöntemler
Yarı İletken Esaslı
Optik ( Fotometrik) Esaslı Yöntemler
Fotometri Esaslı
Fluorometri Esaslı
Biyolüminesans Esaslı
Kalorimetrik (Termometrik / Termistörler) Esaslı Yöntemler Piezoelektrik (Piezoelektrik Kristaller) Yöntemler
2- Kimyasal Biyosensörler
Transformasyon Reaksiyonları
2.4.3.1. Fizikokimyasal biyosensörler
2.4.3.1.1. Elektrokimyasal biyosensörler Amperometrik Biyosensörler:
Amperometri; potansiyel uygulanmış elektrokimyasal bir hücreden geçen akım yoğunluğunun saptanmasıdır. Bu akım yoğunluğu elektrokimyasal olarak aktif taneciklerin (çalışma elektrodunda yükseltgenen ya da indirgenen türlerin) derişiminin bir fonksiyonu olarak tanımlanır. Çalışma elektrodunda indirgenen veya yükseltgenen madde katyon, anyon veya yüksüz bir tanecik olabilir. İkinci elektrot referans elektrot olarak iş görür. Bir elektrot tepkimesinin hızı;
i çözeltiden elektrot yüzeyine doğru akan kütle transfer (difüzyon) hızına
ii tepkimeye girecek olan maddenin bir kimyasal tepkime ile oluştuğu durumlarda çözelti tepkimesinin hızına
iii adsorplanan türler olması durumunda, yüzeye tutunma ve yüzeyden koparak çözeltiye geçme hızına
iv elektrot yüzeyindeki madde ile elektrot arasındaki yük aktarımı yani elektron aktarım hızına bağlıdır. Bu ise tepkimeye giren madde türüne, derişimine, elektrot malzemesinin türüne ve uygulanan gerilime bağlıdır.
İletici sistem olarak bir amperometrik biyosensörün kullanılması durumunda potansiyometrik biyosensörlerde olduğu gibi enzim, elektrot sistemini saran bir membran içinde tutuklanmıştır ve bu ikisi arasındaki en büyük fark, ürünlerden sinyal oluşturan türün elektrot yüzeyinde tüketilmesidir [32,38-41].
Amperometrik esaslı ve biyoaktif bileşen olarak enzimlerin kullanıldığı bazı biyosensörlere ilişkin örnekler aşağıda verilmiştir;
- Potansiyometri Esaslı Biyosensörler;
Potansiyometri; karşılaştırma elektrodu ile uygun bir çalışma elektrodu arasında oluşturulan bir elektrokimyasal hücrede, ölçülen gerilim değerleri yardımı ile hücre çözeltisindeki türlerin nicel analizidir. Potansiyometrik biyosensörlerde kullanılan temel sensörler pH ya da tek değerlikli iyonlara duyarlı cam elektrotlar, anyonlara ve / veya katyonlara duyarlı iyon seçimli elektrotlar ve karbondioksit veya amonyağa yönelik gaz duyarlı elektrotlardır [32,38-41].
Potansiyometri esaslı ve biyoaktif bileşen olarak enzimlerin kullanıldığı bazı biyosensörlere ilişkin örnekler aşağıda verilmiştir:
- Yarı İletkenleri Esas Alan Biyosensörler
Genel olarak, metal oksit yarı iletken alan etkili transistorleri (MOSFET) ya da
iyon duyar alan etkili transistörlerini (ISFET) esas alan bu tür enzim sensörleri, enzim ile alan etkili transistorlerin (FET) birlikte kullanımından oluşur (ENFET). pH ve iyonların derişimlerinin bir referans elektrot varlığında, akıma karşı ölçümü esastır [32,38].
2.4.3.1.2. Optik esaslı biyosensörler
Optik fiberlerde biyosensörlerin yapımında kullanılır. Örnek ve dedektör kaynağı arasındaki ışık, biyosensörün iletici sistemi olarak kullanılan optik lifler üzerine uygun bir yöntemle iletilir [36]. Önce reaktif madde bir optik fiber üzerine sabitleştirilir. Daha sonra absorpsiyon fluoresansı veya lüminesansı nedeni ile ışık yoğunluğundaki değişim kaydedilir. Etkileşim sonucu meydana gelen kimyasal ya da fizikokimyasal bir değişimin ölçümünü esas alır [36-38].
2.4.3.1.3. Kalorimetri esaslı biyosensörler
Termal enzim sensörleri, enzim termistörleri ya da entalpimetrik enzim sensörleri kalorimetri esaslı enzim sensörleri olarak adlandırılır. Basit termokaplar, enzimatik reaksiyonların entalpilerindeki değişimlerden yararlanarak substrat derişimini belirlemekte yeteri kadar hassas değildir. Termistör ve termofiller, sıcaklıktaki küçük değişimleri bile saptayabilirler [36-38].
2.4.3.1.4. Piezoelektrik esaslı biyosensörler
Piezoelektrik sensörler; en genel anlamda karakteristik rezonans frekansındaki farklanmayı belirleyerek bir piezoelektrik kristal yüzeyinde toplanan örneğin kütlesinin ölçülmesi esasına göre çalışan gravimetrik aygıtlardır. Bir elektriksel polarizasyonun varlığını veya mevcut bir polarizasyondaki değişikliği kullanır. Sensör seçimliliği, kristal yüzeyindeki madde ile spesifik bir etkileşime sahip analitin birikimiyle ilişkilidir. Bir piezoelektrik sensörün üzerinde enzim immobilizasyonuyla gerçekleştirilen piezoelektrik enzim sensörlerinde, enzim moleküllerine substratların bağlanmasından dolayı meydana gelen kütle değişimlerinin, piezoelektrik kuartz diskin vibrasyonunda sebep oldukları farklanmadan yararlanılarak madde miktarına ulaşılır. Kütledeki küçük değişimlerin saptanması için rezonans frekanslarını kullanan aletler kullanılır. Piezoelektrik biyosensörler virüslerin tayininde de kullanılırlar [36-38].
2.4.4. Kimyasal biyosensörler
*Transformasyon Reaksiyonları; enzimlerde spesifik olarak özel bir bileşeni tanırlar ve
onu bir iletici ile ölçülebilir bir ürüne dönüştürürler. Enzimatik bir reaksiyonun esas bileşeni onun türevlerinden birinin tüketimiyle izlenebilir. Birçok enzimatik reaksiyon kofaktör kullanır. Kofaktör substrat derişimini ölçmek için kullanılır. Dolayısıyla esas bileşen yerine enzim inhibitörleri de saptanır. Çünkü inhibitörler reaksiyon hızını dolayısıyla elde edilen sinyalin yoğunluğunu etkiler [32].
*Bağlanma (Coupling) Reaksiyonları; elektriksel yükte, kütle ve optik özelliklerde değişimlere neden olurlar. Yükteki değişimler antibadiyi bir iyonofor ile kombine ederek güçlendirebilir ve yükleri bağlanma reaksiyonları ile modifiye edilebilir [32].
2.5. Biyosensörlerin Avantaj ve Dezavantajlarını Belirleyen Temel Özellikler
Biyosensörlerin kullanımını belirleyen bazı avantaj ve dezavantajları vardır. Bunlar;
*Biyoaktif bileşen spesifik ve kararlı olmalıdır.
*Temel reaksiyon fiziksel parametrelerden olabildiğince az etkilenmelidir.
*Elde edilen yanıtlar doğru, duyarlı ve tekrarlanabilir olmalıdır.
*Biyoajanın küçük ve genel olarak biyouyumlu olması beklenir.
*Ölçüm ünitesinin ucuz, taşınabilir ve farklı alanlarda kullanılabilir olması istenir.
2.6. Biyosensörlerin Uygulama Alanları
Biyosensörler, tıbbi analizlerden çevresel analizlere, proses izlenmesinden ilaç analizlerine ve savunma faaliyetlerine kadar pek çok alanda kullanılmaktadır. Bunların dışında biyosensörler için olası uygulama alanları şunlardır:
Klinik diyagnostik, ilaç analizi, biyomedikal sektör, Biyoreaktör kontrol ve analitiği, gıda üretim ve analizi,
Endüstriyel atık su kontrolü, çevre koruma ve kirlilik kontrolü, Tarla tarımı, bağ– bahçe tarımı ve veterinerlik,
Bakteriyel ve viral diyagnostik,
Maden işletmelerinde toksik gaz analizleri, Askeri uygulamalar ve savunma sanayi
Biyosensörler; gıda maddeleri, metabolitler, vitaminler, antibiyotikler, ilaçlar gibi organik maddeler ve bu organik bileşiklerin yanında enzimler, virüsler ve mikroorganizmaların tayininde kullanılırlar. Bunların dışında biyolojik oksijen istemi (BOD), toksisite ve mutajenite testlerinde de başarı ile uygulanmaktadırlar. Biyosensör grupları ve kapsadıkları analiz alanları aşağıdaki Tablo 2.3’de gösterilmektedir [37,42].
Tablo 2.3. Biyosensör Grupları ve Kapsadıkları Analiz Alanları [39]
BİYOSENSÖR GRUBU KAPSADIĞI ANALİZ ALANI
Enzim Sensörleri
Küçük moleküllü organik ve anorganik maddeler (metabolitler, ilaçlar, gıda maddeleri, vitaminler, antibiyotikler, pesdisitler vb.)
Mikrobiyal Sensörler Enzim sensörlerin kapsadığı alanlar + BOD, Toksisite, Mutajenite
DNA Sensörleri Virüsler, patojen mikroorganizmalar