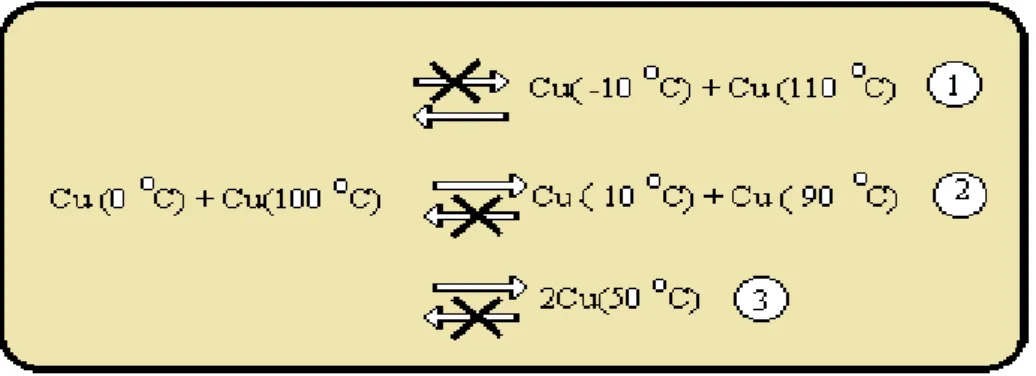T.C
GAZİ ÜNİVERSİTESİ EĞİTİM BİLİMLERİ ENSTİTÜSÜ
ORTAÖĞRETİM FEN VE MATEMATİK ALANLAR EĞİTİMİ ANABİLİM DALI KİMYA ÖĞRETMENLİĞİ BİLİM DALI
ENTROPİ VE TERSİNİRLİK KAVRAMLARININ TARTIŞILMASI
YÜKSEK LİSANS TEZİ
Hazırlayan Sevcan AKMAN
Tez Danışmanı
Prof. Dr. Mehmet Levent AKSU
T.C
GAZİ ÜNİVERSİTESİ EĞİTİM BİLİMLERİ ENSTİTÜSÜ
ORTAÖĞRETİM FEN VE MATEMATİK ALANLAR EĞİTİMİ ANABİLİM DALI KİMYA ÖĞRETMENLİĞİ BİLİM DALI
ENTROPİ VE TERSİNİRLİK KAVRAMLARININ TARTIŞILMASI
YÜKSEK LİSANS TEZİ
Hazırlayan Sevcan AKMAN
Tez Danışmanı
Prof. Dr. Mehmet Levent AKSU
CANIM KARDEŞİM
ŞEHİT KD. KARA PİLOT ÜSTEĞMEN YAKUP ÇINAR’IN AZİZ ANISINA
i JÜRİ ONAY SAYFASI
Enstitünüze bağlı Ortaöğretim Fen ve Matematik Alanları Eğitimi Bölümü Yüksek Lisans programında kayıtlı olan 118143117 numaralı Sevcan AKMAN’nın hazırladığı’’Entropi ve Tersinirlik Kavramlarının Tartışılması” adlı çalışma jürimiz tarafından Kimya Eğitimi Anabilim Dalında YÜKSEK LİSANS TEZİ olarak kabul edilmiştir.
ii ÖN SÖZ
Çalışmalarım süresince bilgisi, tecrübesi, güler yüzüyle destek olan ve bana ışık veren çok sevgili hocam ve danışmanım Prof. Dr. Mehmet Levent AKSU’ ya sonsuz şükranlarımı sunmayı bir borç bilirim.
Lisans öğrenimimden itibaren her zaman yanımda olan ve desteğini hiç esirgemeyen can dostum Özlem TÜRK YAVUZ’ a teşekkür ederim.
Ayrıca her ne kadar bu tezden haberleri olmasa da desteklerini her an arkamda hissettiğim ve ne yapsam haklarını ödeyemeyeceğim annem ve babama büyük minnet duymaktayım.
Acılarımın ve Rüzgar Masal ile yaşayacağımız güzel günlerin ortağı kız kardeşim Serpil ÇINAR’a hayatıma kattığı her şey için teşekkür ederim.
En son olarak ta benden habersiz kaydımı yaptıran ve bu tez için bana motivasyon veren, maddi ve manevi hiçbir fedakarlıktan kaçınmayan eşim Ahmet Şahin AKMAN’a teşekkür ederim.
Hakkı olan vaktinin büyük bir bölümünü çaldığım canım kızım Ebrar Naz ile daha fazla ilgilenebileceğimden dolayı çok mutluyum.
iii ÖZET
Bu araştırma termodinamiğin en karmaşık konusu olan entropi kavramıyla tersinirlik ve tersinmezlik(kendiğinden olma) konusuna yeni bir anlayış getirmek için yapılmıştır. Bu amaçla bu konular dünyanın çeşitli fizikokimya kitaplarından taranmış ve herkese öğretildiği şekilde entropinin artışının hem olayların kendiliğinden olması yani tersinmezliği ve hem de entropinin bir hal fonksiyonu olduğu hakkındaki belirsizlik giderilmeye çalışılmıştır. Bu çalışma birçok açıdan klasik eğitim tezlerinden farklıdır. Burada ne bir ön test metodu alınmış nede bir istatistiksel bir çözümlemeye gidilmemiştir. Ancak yapılan çalışma bu son derece karmaşık konulara ışık tutacak niteliktedir.
iv ABSTRACT
This study was carried out to enlighten the most complicated concepts of thermodynamics entropy and reversibility. For this purpose the subject was thoroughly investigated from the physical chemistry text books and the subject of entropy as the parameter of which determines the instantaneous events and the state function property was thoroughly discussed. This study is different than most of the conventional education thesis in many respects. There is no pretest post test pattern was employed and there was no attempt to bring any statistical explanation. This study is expected to enlighten these complicated and mostly misunderstood concepts.
v İÇİNDEKİLER
Sayfa
JÜRİ ÜYELERİNİN İMZA SAYFASI ...i
ÖN SÖZ ... ii
ÖZET ... iii
ABSTRACT ...iv
İÇİNDEKİLER ... v
ŞEKİLLERİN LİSTESİ ... vii
1.GİRİŞ 1.1Problem Durumu ... 1 1.2 Araştırmanın Amacı ... 1 1.3 Araştırmanın Önemi ... 1 1.4 Araştırmanın Sınırlılıkları ... 1 1.5 Varsayımlar ... 2 1.6 Tanımlar ... 2 1.6.1.Sistem ... 2 1.6.2. İş ... 6 1.6.3. Enerji ... 6 2.KAVRAMSAL ÇERÇEVE ... 8
2.1 Tersinirlik ve Tersinmezlik Kavramları ... 8
2.2 Termodinamiğin I. Kanunu ... 9
2.3 Termodinamiğin II. Kanunu ... 9
2.3.1 Maksimum İşin Elde Edilmesi ... 10
2.3.2 Carnot Çevrimi ve Isı Makinaları ... 12
2.4 Entropi Kavramı ... 16
2.4.1 Entropinin Fiziksel Anlamı ... 21
2.4.2 Entropinin Bir Hal Fonksiyonu Olması ... 25
2.4.3Entropinin Bir Hal Fonksiyonu Olduğunun İspatlanması ... 26
2.5 Clausius Eşitsizliği ... 28
2.6 Minumum Enerji Prensibi ... 29
vi
2.7.1 Entropi ve Düzensizlik ... 30
3.YÖNTEM ... 34
3.1 Araştırma Modeli ... 34
3.2 Evren ve Örneklem ... 34
3.3 Veri Toplama Teknikleri ... 34
3.4 Verilerin Analizi ... 34
4.BULGULAR ve YORUM ... 35
4.1 Entropiye Moleküler Yaklaşım ve İstatistiksel Termodinamik ... 35
5.SONUÇ ve ÖNERİLER ... 42
vii
ŞEKİLLERİN LİSTESİ
Şekil 1.1 Sistem ve sistemin tipleri ... 2
Şekil 1.2 Hal Fonksiyonu Olma Şartı ... 4
Şekil 1.3 Denge ve Şekilleri ... 5
Şekil 1.4 İşin Gösterimi ... 6
Şekil 2.1Tersinir ve Tersinmez Olaylara Bir Örnek ... 8
Şekil 2.2 Tek Basamakta Yapılan Tersinmez Genleşme ... 10
Şekil 2.3 Tek Basamakta Tersinmez Süreçlerde Elde Edilen İşin minimum Olması 11 Şekil 2.4 İki Basmakta Elde edilen İşin Daha Yüksek Olması ... 11
Şekil 2.5 Sonsuz Basmaklı (Tersinir)Genleşmede Elde Edilen Maksimum İş ... 12
Şekil 2.6 Carnot Çevrimi ... 12
Şekil 2.7 Carnot Makinesinin Şematik Gösterimi ... 15
Şekil 2.8 Termodinamikte Göz Önüne Alınan Sistem ... 16
Şekil 2.9 Termodinamiğin 1. ve 2. Kanununa Göre Olan Olasılıklar ... 17
Şekil 2.10 Kentliğinden Olmayan Tersinir Bir Prosesi Dış Bir Katkı ile Tersine Çevirmek ... 18
Şekil 2.11 Entropinin Grafiksel Olarak Bulunması ... 24
Şekil 2.12 Carnot Çevriminde P-V ve T-S Değişimleri ... 25
Şekil 2.13 Entropinin Hal Fonksiyon Olduğunun İspatı ... 26
Şekil 2.14 Entropinin Hal Fonksiyonu Göstermede Alternatif Yöntem ... 27
Şekil 2.15 Minimum Enerji Prensibi ... 29
Şekil 5.1 Entropinin Negatif Çıkması Durumunda Bile Olayın Kendiliğinden Olması ... 42
GİRİŞ
Bu bölümde, araştırmanın problem durumu, amacı ve önemi, problem cümlesi, alt problemler, sayıltılar, sınırlılıklar, tanımlar ve kısaltmalara yer verilmiştir. Problem durumunda, termodinamik, termodinamiğin ikinci yasası ve entropi tanıtılmış, önemleri vurgulanmış termodinamiğin bu çok önemli ve karmaşık fonksiyonu açıklanmaya çalışılmıştır.
1.1.Problem Durumu
Burada üç tane problem cümlesinin cevabı aranmıştır Bunlar: 1. Entropinin hal fonksiyonu mudur?
2. Kendiliğinden olan her olayda entropi artar mı? 3. Kendiliğinden olan her olayda düzensizlik artar mı?
1.2. Araştırmanın Amacı
Termodinamik konusunda anlaşılması en güç olan kavramlar tersinirlik ve tersinmezlik kavramalarıyla entropi fonksiyonudur. Bu araştırma bu konulara açıklık getirmek amacıyla yapılmıştır.
1.3.Araştırmanın Önemi
Belki de dünyadaki en karmaşık ve çelişkili kavramlardan biri entropidir. Ayrıca bu kavramın yine aynı derece anlaşılması güç olan kendiliğinden olmama veya tersinirlik ve kendiliğinden olma veya tersinmezlik hususlarına uygulanması ve aynı zamanda entropinin hal fonksiyonu olarak kabulü ve düzensizlikle eşdeğer olarak tanımlanmasında da sorunlar mevcuttur. İşte bu araştırma tüm bu hususlara açıklık getirmek için yapılmıştır.
1.4.Araştırmanın Sınırlılıkları
Araştırmadaki en büyük sınırlılık entropinin genelde kapalı ve hatta izole sistemler için tanımlanmış olmasına rağmen tüm sistemlere aitmiş gibi gösterilmesi ve enerjinin arttıkça entropinin artması gerektiği gibi yanlış kavramaların mevcudiyetidir. Tüm kitaplarda entropinin hal fonksiyonu olması hususu daima Carnot çevrimine göre anlatılmış ve buna karşılık Clausius kavramına göre entropinin tersinmez olaylarda
artması ve tersinir olaylarda değişmemesi hususu göz ardı edilmektedir. Ayrıca entropi ister tersinir ister tersinmez olsun tüm olaylarda öğrencinin kafasını allak bullak edecek şekilde daima tersinir bir yol üzerinden hesaplanmaktadır. Entropi hal fonksiyonu olarak kabul edilmesine rağmen (hal fonksiyonları daima bir fark olarak bulunmakta mutlak değerleri belirlenememektedir) üçüncü kanuna göre mutlak değerleri hesaplanmaktadır.
1.5.Varsayımlar
Burada yapılan bir varsayım yoktur. Tezin amacı da zaten entropi konusunda yapılan varsayımlara açıklık getirmektir.
1.6. Tanımlar
Burada konumuzla ilgili birkaç önemli termodinamik kavramı tanımlamakta fayda vardır.
1.6.1. Sistem
Belli sınırlar arasında tanımlanmış olan uzay parçasına “sistem” adı verilir. Sistem katı, sıvı veya gaz halinde olabilir. Sistemin dışında “ortam” bulunur. Sistem ve ortamı da evren kaplar. Sistemi kabaca üçe ayırmak mümkündür. Sistem sınırları içine ne ısı ne de madde akışına izin vermiyorsa “izole(adyabatik)”, ısı akışına izin verip madde akışına izin vermiyorsa “kapalı” her ikisine de izin veriyorsa “açık” olarak nitelenir.
Şekil 1.1 Sistem ve sistemin tipleri
Termodinamik sistemin mutlak değeri ölçülebilen ve hal değişkeni olarak tanımladığımız, kütle (m), hacım (v) , sıcaklık (t) ve derişim (c) gibi özellikleri ile
ilgilenir. Bu özellikler bir eşitlik ile birbirine bağlanıyorlarsa bağımlı bağlanamıyorlarsa bağımsız değişken olarak adlandırılır. Bu özellikle madde miktarı ile değişmiyorsa veya bir başka deyişle sistemi parçalara ayırdığımızda bir farklılık göstermiyorsa (T,P) bunlara “intensif ” veya “şiddet”, farklılık gösteriyorsa “ekstensif ” veya “kapasite” (m,v) özellikleri adı verilir. Kapasite özellikleri toplanabilir. İki tane kapasite özelliğinin oranı bir şiddet özelliğidir (=m/v). Bir sistemi tanımlamak için vermemiz gereken minimum şiddet özelliği sayısına o sistemin serbestlik derecesi adı verilir .
Sistem sabit tutulan hal değişkenine göre de çeşitli isimler alır . Örneğin sıcaklığın sabit tutulduğu sistemler izotermal, hacmin sabit tutulduğu sistemler izokorik, basınç sabit tutulduğu sistemlere izobarik, ısı akışına izin verilmediği sistemlere adyabatik ve herhangi bir sınırlama olmayan sistemlere de politropik sistemler adı verilir.
Ayrıca sistemin özellikleri gidilen yola bağımlı ise hal fonksiyonu ve tam differensiyel yola bağımlı ise yol fonksiyonu olarak bilinir .
U=U(x,y,z) şeklinde bir fonksiyon ise bunun türevi
(1.1)
Eğer U=U(x,y) şeklinde ise (ki, termodinamik fonksiyonlar genelde bu formattadır ) yukarıdaki ifade ;
(1.2)
şeklini alır.
Buda dU=Mdx +Ndy şeklinde yazılabilir.
dz z U dy y U dx x U dU y x z x z y, , , dy y U dx x U dU x y
(1.3)
şeklinde verilen bir diferansiyelin, tam diferansiyel olma veya U fonksiyonunun hal fonksiyonu olma şartı
veya veya şeklinde verilir
U bir hal fonksiyonu ise
Şekil 1.2 Hal Fonksiyonu Olma Şartı
Eğer U1=U2= U3 =U ise U bir hal fonksiyonudur.
Başka bir deyişle bir hal fonksiyonunun değişimi gidilen yola bağımlı değildir. Hal fonksiyonunun türevsel haline de tam diferansiyel denir ve d ile gösterilir. Bunun aksine hal fonksiyonu olmayan fonksiyonlar gidilen yola bağımlıdır. Bunlara da yol fonksiyonu denir. Bunların türevsel halleri de bundan sonra ile gösterilecektir.
(1.4)
şeklindedir.
Eğer tam diferansiyel değilse çevrim integrali sıfır olmaz
(1.5) ve N y U ve M x U x y
(1.6) Ayrıca bir tam diferansiyelin integrali daima bir fark iken ,tam olmayan diferansiyel kendine eşittir.
(1.7)
(1.8)
ve
(1.9)
Sistemin özellikleri zaman ile değişmiyorsa sistem dengede demektir. Bunu bir örnek üzerinde açıklayalım:
Şekil 1.3 Denge şekilleri :(A) yarı-kararlı denge, (B) kararsız denge ve (C) kararlı denge denge şartı 0 = dr dU (1.10) şeklinde verilir.
Ancak dengenin şeklini bulmak için ikinci türeve bakılmalıdır.
Buna göre:
)
kararsız
(
0
<
dr
U
d
)
kararlı
(
0
dr
U
d
2 2 2 2≥
(1.11)1.6.2. İş
Eğer bir kuvvetin uygulandığı nokta yer değiştiriyorsa bu durumda bir iş yapılıyor demektir. Bunu da aşağıdaki şekil ile açıklayabiliriz:
Şekil 1.4 İşin gösterimi
Eğer hareket yönü ile uygulanan kuvvet arasında bir açısı var ise dr cos F = w θ δ (1.12)
bir kuvvetin Kartezyen koordinatları cinsinden olan bileşenleri Fx, Fy ve Fz şeklinde ise
dz F + dy F + dx F = w x y z δ (1.13)
olur. Eğer uygulanan kuvvet alınan mesafe boyunca sabit ise
∫
1 -0 r r Fdr = F(r1 r0) = w (1.14) şeklini alır .1kg’lık kütleyi 1 m kaldırmak için yapılması gereken iş w=mgr1=1kg×9,80655ms-2×1m = 9,80655 kgm2s-2(veya Nm) olarak bulunur.
1.6.3.Enerji
Enerjinin bugünkü şekilde tanımlanması uzun süre almıştır. 1789’da Thomas Young enerjiyi “görünür” ve “potansiyel” olmak üzere ikiye ayırmış, daha sonra Thompson görünür enerjiye” kinetik enerji” adını vermiştir. Bir r0 durumundaki taneciğe bir f(r ) kuvveti uygulayalım ve bu taneciği r0’dan r1’e getirelim.
2 0 2 1 t t t t t t v v r r t t mv 2 1 mv 2 1 vdv m vdt dt dv m mavdt F(r)vdt dt dt dr F(r) F(r)dr w
∫
∫
∫
1∫
∫
∫
0 1 0 1 0 1 0 1 0 1 0 (1.15) şeklinde verilir . v0= 0 ise ve v1 = v dersek 2 K mv 2 1 E (1.16) Bulunur.Kuvvet yalnızca mesafenin fonksiyonu olduğunda potansiyel enerji cinsinden
K0 K1 1 0 r r F(r)dr=U(r) U(r)=E E dU(r) = F(r)dr 1 0 ⇒
∫
(1.17) bulunur.Buradan da görüldüğü üzere potansiyel enerji artarken kinetik enerji azalır. Buda enerjinin korunumu ilkesinin matematiksel bir ifadesidir. Durağan bir cismin kinetik enerjisi sıfırdır . Ancak potansiyel enerjinin sıfır olduğu noktayı tanımlamak mümkün değildir . Yalnızca potansiyel enerjinin farkı tanımlanabilir.
2 .KAVRAMSAL ÇERÇEVE 2.1 Tersinirlik ve Tersinmezlik Kavramları
Bu kavramlar en iyi bir örnek üzerinde gösterilebilir
Şekil2.1Tersinir ve tersinmez olaylara bir örnek
Burada görüldüğü üzere eğer sistem tek bir basamakta ve ani olarak değişime tabi tutulursa sistemdeki denge alt üst olmaktadır. Örneğin sistem birden bire bir sıkıştırmaya tabi tutulursa pistonun yakınındaki moleküller çok daha hızlı bir şekilde sıkışıp ısınacağından sistemde bir sıcaklık farkı meydana gelecektir. Bir sistemde sıcaklık farkı varsa sistemde dengeden bahsedilemez. Termodinamik bu tip denge dışı olayları açıklayamaz.
Ancak bu değişimi sonsuz tane basamakta örneğin bir kum tanesi eklemek suretiyle yaparsak sistemdeki sıcaklık farkıda sonsuz küçük olacağından sistem esas olarak dengede farz edilebilir. İşte bu duruma tersinir süreç denir.
Termal denge gazın belli bir anda belli bir hacime, sıcaklığa ve basınca sahip olması demektir. Buna kararlı hal de denmektedir. Termal dengenin olması için en azından basınç ve sıcaklığın değişmemesi gerekir. Ancak bu durumun meydana gelmesi
için sistemin her anlamda sabit olup hareket etmemesi gerekir. Çünkü sistemin bir halden başka bir hale geçmesi için dengenin bozulması gerekir. İşte bu denge bozulma miktarı ne kadar uzun ise sistem o kadar tersinmez demektir. Tabiatta kendiliğinden olan süreçlerin hepsi belli bir hızda ve tersinmez olarak cereyan eder. Termodinamik süreçlerin hiçbiri sürekli devam etmez ve sistem dengeye geldiği anda sonlanır. Sistemin eninde sonunda dengeye gelmesi gerektiğiden buna termal kıyamet adı verilir. Tersinir süreç ise yarı kararlı süreç olarak bilinir ve biribiri ardından gelen sonsuz sayıdaki basmaklardan oluşur. Değişim çok ufak olduğundan sistem esas olarak dengede kabul edilir.
2.2 Termodinamiğin I. Kanunu
Termodinamiğin en önemi kurallarında biri olan I.Kanun enerjinin korunumu ilkesine dayanır. Buna göre bir cisme q ısısı verir ve ona bir w iş yaparsak iç enerjideki değişim du= δq+δw veya u = q + w şeklinde tanımlanır. IUPAC kurallarına göre sisteme verilen ısı ve iş (+), alınanlar ise (-) olarak kabul edilir. Bilindiği gibi iç enerji bir hal ve iş ve ısı ise bir yol fonksiyonudur. Buna göre du gidilen yola bağlı olmayıp sadece sistemin başlangıç ve son hallerine bağlıdır. Eğer bu bir hal fonksiyonu olmasaydı bu durmada farklı yollardan gitmek ve dönmek suretiyle yoktan enerji yaratılabilir ve termodinamiğin I. Kanunu ihlal edilebilirdi. Başka bir deyişle enerjinin hal fonksiyonu olması dışardan herhangi bir katkı olmaksızın çalışılabilecek olan birinci derece devri daim makinasının önündeki tüm yolları kapatmaktadır.
2.3 Termodinamiğin II Kanunun
Bu kanun iki açıdan önemlidir. Bunlardan birincisi dünyada bazı olaylar kendiliğinden cereyan eder. Örneğin bir gaz mevcut olan tüm hacımı kaplayacak şekilde kendiliğinden yayılır, sıcak bir cisim ortamın sıcaklığını alacak şekilde kendiliğinden soğur, kimyasal bir süreç belli bir yönde cereyan eder, iki gaz birbiri ile kendiliğinden karışır. Ancak bunların aksinin oluştuğu hiç görülmez ve bunu yapmak için mutlaka bir katkı yapmak gerekir. İşte hangi olayların kendiliğinden olup hangilerini kendiliğinden olmayacağını tanımlamak II. Kanunun konusudur.
Dünyadaki enerji büyük oranda yakıtların içinde olan iç enerji şeklinde bulunmaktadır. En temel enerji şekli ısıdır . Enerjiyi ısı formunda hiçbir kayıp olmadan evlerimizi ısıtmakta veya mutfakta yemeklerimizi pişirmekte kullanabiliriz. Ancak bu ısının tümünü bir tekerleği döndürmek, veya arabamızı çalıştırmak için kullanmak mümkün değildir. Çünkü bu durumda ısı mekanik enerjiye dönüştürülmelidir. İşte bu işlemi tam olarak yapmak mümkün değildir. Çünkü işe dönüştürülen ısının büyük bir kısmını tabiata vergi olarak vermek gerekir. Çekilen ısının işe dönüştürülen veya vergi kesildikten sonra elimize geçen kesrine makinenin verimi denir. Makineden ne kadar verim elde edilebileceği işlemin ne oranda tersinir olarak yapılabileceğine bağlıdır.
2.3.1 Maksimum İşin Elde Edilmesi
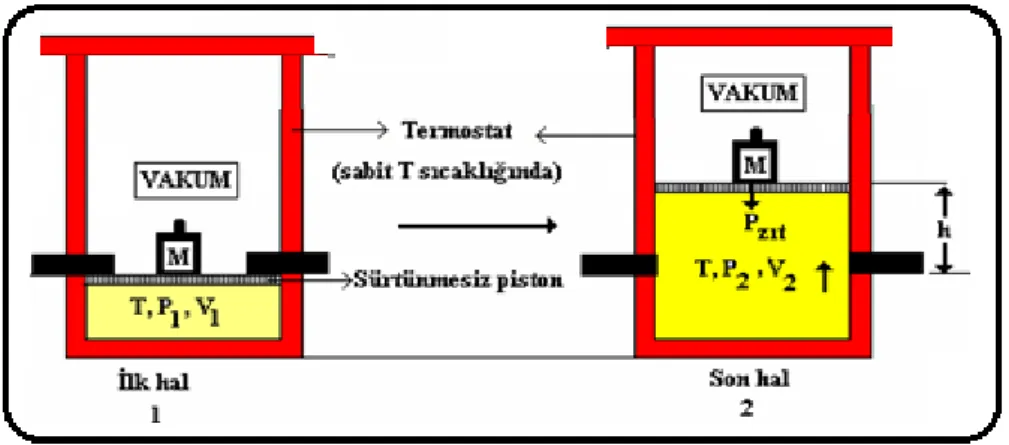
Aşağıdaki gibi bir sistem düşünelim ve sistem tek bir safhada v1 hacminden v2 hacmine genleşsin ;
Şekil 2.2 Tek basamakta yapılan tersinmez genleşme
(1) (2) genleşmesi ile yapılan iş
w= -mgh (iş ortama yapılıyor) (2.1)
eğer pistonun alanı a ise pzıt pistonun hareketine mani olan basınçtır ve en yüksek değeri p2 olabilir
mg=-p2 aw=-p2 a h (2.2)
ah=v w = -p2v=-p2(v2-v1) (2.3)
Şekil 2.3 Tek basamakta tersinmez süreçlerde elde edilen işin minimum olması Şimdi de bu işin iki basamakta yapıldığını düşünelim
Şekil 2.4 İki basmakta elde edilen işin daha yüksek olması
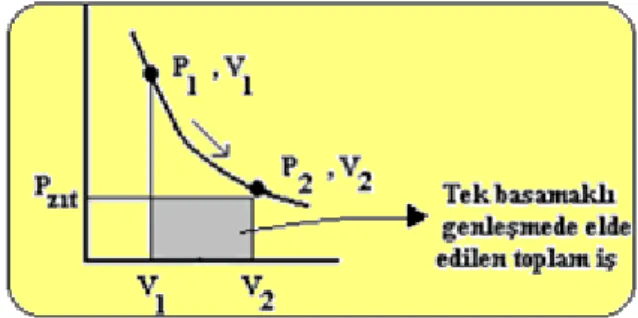
Görüldüğü gibi iki basamaklı genleşmede elde edilen toplam iş tek basamaklı genleşmede elde edilen toplam işten daha büyüktür. Çok basamaklı genleşmede elde edilen toplam iş her basamakta elde edilen toplam işlerin toplamıdır.
Tek basamakta elde edilen toplam iş
(2.4)
İş bir hal fonksiyonu olmadığından
(2.5)
Dolayısıyla iki basamaklı genleşmedeki toplam iş
w= wilk basamak +wikinci basamak = -{p’zıt(v’-v1) + p’’zıt(v2-v’)} (2.6) Eğer bu genleşme işini sonsuz tane basamakta tersinir olarak yaparsak ( örneğin içi kum dolu bir torba almak ve her defasında bundan tek bir kum tanesi almak sureti ile) genleşme sonunda elde edilebilecek olan maksimum iş elde edilir. Bunu grafikte gösterirsek ; dV P δw zıı
2 1 2 1 V V PzııdV w w Şekil 2.5 Sonsuz basamaklı (tersinir)genleşmede elde edilen maksimum iş
Burada görüldüğü üzere tam tersinirlik asla mümkün olmadığından asla maksimum iş elde etmek mümkün değildir. Yani teorik veya termodinamik verimle gerçek verim asla aynı olmayacaktır.
2.3.2 Carnot Çevrimi ve Isı Makinaları
Enerjinin direkt olarak ısıya döndürmesinde bir sorun yoktur. Bu şekilde elde edilen enerji ısıl işlemlerde örneğin meskenlerin ısıtılmasında, pişirmede yahut başka kimyasal veya fiziksel işlemler için kullanılabilir. Fakat bir makinayı çalıştırmak yahut bir vasıtayı yürütmek veya bir mermiyi fırlatmak için ısı mekanik enerjiye dönüştürüldüğünde sorunlar başlamaktadır.
Bu hususu ilk inceleyen Fransız bilim adamı adı Carnot'tur. Carnot bunun için aşağıdaki tersinir çevrimi önermiştir .
Proses (I): izotermal tersinir genleşme
Gaz yüksek bir T2 sıcaklığında v1 haciminden v2 hacimine izotermal ve tersinir bir şekilde genleşmektedir. Bu sırada sistem tarafından bir q2 ısısı soğurulmaktadır. 1 mol ideal gaz aldığımızda genleşen gazın ortama yaptığı iş:
(2.7)
(2.8)
(2.9)
Proses (II) –adiyabatik tersinir genleşme
Gazın sıcaklığı soğuk kaynağının sıcaklığı olan T1 değerine düşene dek v2 hacminden v3 hacmına genleşir.
(2.10)
Proses (III): İzotermal tersinir sıkıştırma
Gaz T1 sıcaklığında V3 haciminden V2 hacimine izotermal ve tersinir bir şekilde sıkıştırılır. Bu sırada sistem soğuk ısı deposuna q1 ısısı aktarır.1 mol ideal gaz tarafından gaz üzerinde yapılan sıkıştırma işi:
(2.11)
yapılan işlem izotermal olduğuna göre
(2.12)
2 1 V V 1 2 2 2 I V V ln RT V dV RT dV P w q w 0 ΔUI I I 1 2 2 I 2 I V V ln RT w q q 0 ΔUIII 3 2 1 III 1 III V V ln RT w q q
2 3 V V 3 2 1 1 III V V ln RT V dV RT dV P w 0 qII w C (T T ) ΔUII II V 1 2Proses (IV): Adyabatik tersinir sıkıştırma
Gazın sıcaklığı sıcak kaynağının sıcaklığı olan T2 değerine çıkana dek V2 haciminden V1 hacimine sıkıştırılır.
(2.13)
Burada görüldüğü üzere bu çevrim sonunda T2 sıcaklığındaki sıcak bir ısı deposundan q2 ısısı alınmış ve t1 sıcaklığındaki soğuk ısı deposuna q1 ısısı aktarılmıştır. aradaki fark alınan ısının işe çevrilen kısmıdır.
w = q2 - q1
(2.14)
ii ve iv prosesleri işleri birbirini götüreceğinden,
(2.15)
adyabatik proseslerde
(2.16)
yazılabilir. bu iki ifadeyi birbirlerine bölersek
buradan (2.17) 0 qIV w C (T T) ΔUIV IV V 2 1 2 1 2 1 2 q q 1 q q q ısı Verilen iş edilen Elde η Verim I III net w w w = + 3 2 1 1 2 2 V V ln RT V V ln RT 1 2 2 R C 1 1 R C 2 3 2 3 R C 1 2 R C 2
V
V
V
T
V
T
V
V
V
T
V
T
V V V V
2 3 1 2 V V V V 1 2 1 1 2 2 3 2 1 1 2 2 net V V ln RT V V ln RT V V ln RT V V ln RT w 1 2 1 2 net V V )ln T R(T w Gaz tarafından soğurulan toplam ısı
olduğundan
(2.18)
Önce böyle bir makinayı şematik olarak gösterelim :
Şekil 2.7 Carnot makinasının şematik gösterimi
Bu tip makinanın en önemli özelliği onun verimidir.
1 2 net net w q q q 3 2 1 1 2 2 3 2 1 1 2 2 net net V V ln RT V V ln RT V V ln RT V V ln RT w q 2 3 1 2 V V V V 1 2 1 1 2 2 3 2 1 1 2 2 net net V V ln RT V V ln RT V V ln RT V V ln RT w q 1 2 1 2 net net V V )ln T R(T w q 2 1 2 1 2 1 2 2 1 2 1 2 2 net T T 1 T T T V V ln RT V V )ln T R(T q w η 2 q w η
(2.19)
Buradan da görüldüğü gibi sıcak ısı deposundan alınan bir q2 ısısının tamamını işe döndürecek bir makine yapılamaz. Bunu yapmanın imkânsızlığı, bize
termodinamiğin ikinci kanunu olarak bilinen tabiatın temel kanunlarından birini getirir.
2.4. Entropi Kavramı
Dünyada bazı olaylar kendiliğinden cereyan eder. Örneğin bir gaz mevcut olan tüm hacımı kaplayacak şekilde kendiliğinden yayılır, sıcak bir cisim ortamın sıcaklığını alacak şekilde kendiliğinden soğur, kimyasal bir süreç belli bir yönde cereyan eder ki gaz birbiri ile kendiliğinden karışır. Ancak bunların aksinin oluştuğu hiç görülmez ve bunu yapmak için mutlaka bir katkı yapmak gerekir. Dolayısıyla kendiliğinden olan olayları tanımlayacak bir özellik olmalıdır.
Önce bu tip bir olayın cereyan ettiği aşağıdaki gibi bir sistem düşünelim
Şekil 2.8 Termodinamikte göz önüne alınan sistem
Peki, olayların kendiliğinden cereyan etmesini ne belirler? Bu izole sistemin enerjisi olamaz çünkü I. kanuna göre enerji korunur ve izole bir sistemin enerjisi sabit olur.
Belki de bu incelenen sistemin enerjisidir. Ancak bunun da olamayacağını gösteren bir kanıt vardır. İdeal bir gaz kendiliğinden vakuma dolar ve bu sırada sistemin iç enerjisi değişmez.
2 1 2 1 2 T T 1 q q 1 q w η 1 2 q q w w
Zıplayan bir top alalım. Bunun kinetik enerjisi sürtünme yolu ile ısı enerjisine dönüşür ve yerde durağan bir hale gelir. Oluşan ısı enerjisi de sonsuz büyüklükteki yer alanının moleküllerinin termal enerjisini artırmakta kullanılır.
Ancak sıcak bir yüzey üzerindeki bir topun kendiliğinden zıplamaya başlaması asla görülmez. Bunun için son derece özel şartların yerine getirilmesi gerekir. Birincisi yüzeydeki termal hareket topta yoğunlaşmalıdır. Ayrıca topu yukarı doğru hareket ettirmek için tüm moleküller yukarı doğru hareket etmelidir. Ancak bilindiği gibi termal hareket gelişigüzel bir harekettir ve yukarda bahsedilen şartların oluşma olasılığı hemen hemen sıfırdır.
Termodinamiğin II. Kanunu fizik, kimya ve mühendislik açısından son derece önemlidir. Kimyacı açısından en önemli yanı kimyasal reaksiyonların olup olmayacağını ve ne ölçüde olacağını göstermesidir. dolayısıyla kendiliğinden meydana gelen olayları kavramak büyük önem taşımaktadır.
Kendiliğinden olan olaylara birçok örnek verilebilir. Örneğin bir ucu ısıtılan bir çubukta ısı kendiliğinden çubuk boyunca yayılır. Ancak bunun aksi asla söz konusu değildir. Yani sıcaklığı her tarafta aynı olan bir metal çubuğun bir ucu kendiliğinden ısınırken diğer ucu da kendiliğinden soğumaz. Bunu yapmak için ısının çubuğun bir ucundan bir ısı makinası ile alınıp eşdeğer işe çevrildikten sonra diğer ucuna verilmesi gerekir.
Bu olayı bir örnek ile açalım: Kütleleri aynı olan biri 00C diğeri de 1000C’de olan iki bakır blok alalım. Bunları adyabatik olarak yalıtılmış bir ortamda birbiri ile temasa getirelim termodinamiğin I.Kanununa göre üç tane olasılık vardır:
Deneyimler (1) prosesinin asla kendi başına mümkün olmadığını göstermektedir. Yani soğuk bir cisim kendiliğinden daha da soğurken sıcak bir cisim daha ısınmaz. (2) prosesi ise bloklar termal dengeye erişmeden evvel birbirlerinden ayrılmaları durumudur. (3) prosesi de blokların uzun bir süre temasta tutulmaları sonunda termal dengeye gelmeleri durumudur.
Şimdide bu proseslerin terslerini göz önüne alalım. (1) prosesinin tersi kendiliğinden olurken (2) ve (3) proseslerinin tersleri asla kendiliğinden olmaz.
Acaba bir dış katkı vasıtası ile örneğin (3) prosesini tersine döndürmek mümkün müdür? Bildiğimiz 500
C sıcaklıkta bulunan kütleleri aynı olan iki metal bloğun termal olarak yalıtılmış olan bir ortamda temasa getirilmesi durumunda birinin sıcaklığı 600C’ye çıkarken diğerinin sıcaklığı 400C’ ye inmez. Acaba bir dış katkı ile bu proses gerçekleştirilemez mi?
Bunun için 500C sıcaklıkta bulunan kütleleri aynı adyabatik olarak izole edilmiş silindirlerde bulunan iki ideal gaz ile yine aynı şekilde izole edilmiş olan kütleleri aynı olan iki tane bakır blok alalım ve aşağıdaki prosesi gerçekleştirelim.
Şekil 2.10 Kentliğinden olmayan tersinir bir prosesi dış bir katkı ile tersine çevirmek
Buradan görüldüğü üzere bloklardan birinin sıcaklığı 600C’ye çıkarken diğerininki 400
C’ye inmiştir. Gazları tekrar eski haline döndürmek için bir iş yapmak gerekir ki bu da bize Clausius prensibini getirir.
Bu prensibe göre “soğuk bir depodan sıcak bir depoya ısı aktarımı dışında başka
Görüldüğü üzere ısının kendiliğinden yayılma prensibinin tersine döndürülmesinde termodinamiğin I. kanunu açısından bir sakınca yoktur. Ancak buradaki tüm sorun sistemin bazı kısımlarında ve çevresinde bir değişiklik yapmaksızın ısının eşdeğer miktarda işe döndürülememesidir.
II. Kanunu ilk olarak Lord Kelvin tanımlamıştır. Buna göre “sıcak bir ısı
deposundan ısı alıp onun bir kısmını soğuk bir ısı deposuna aktarmadan tamamını eşdeğer işe döndürmek mümkün değildir” alınan ısının işe döndürülen bu kısmına
makinanın verimi adı verilir. bu tanıma göre verimi %100 olan bir makina yapılamaz. Kısacası tabiatta kendiliğinden cereyan eden olaylar tersinmez bir şekilde olur. Zaten I.Kanundan bildiğimiz üzere tersinir olaylar sonsuz uzun bir süreç alır. Tüm bu yukarıda söylediklerimizden şu sonuç çıkmaktadır: “Kendiliğinden yürüyen olayları
herhangi bir dış katkı olmaksızın tersine döndürmek mümkün değildir". Buda
termodinamiğin II. Kanununun bir başka şekilde ifade edilmesidir.
Kendiliğinden yürüyen olayların (örneğin yukarıdaki a b proseslerinin) termodinamik açıdan tersinmez olduklarını belirledikten sonra sıra bu kendiliğinden olma prensibini açıklayan bir fonksiyonun tanımlanmasına geldi bu fonksiyona entropi adı verilir ve S ile simgelenir. Entropi tanım olarak
(2.20)
şeklinde verilir.
Önce ortamın entropi değişimi dS’yi tanımlayalım. Ortamı t sıcaklığında büyük bir ısı deposu olarak tanımlayalım. Bu depoya ısıyı işe çeviren bir makina ve bu makinaya da bir ağırlık bağlayalım ağırlık düşünce depoya bir q ısısı aktarılır. Depoya ne kadar fazla ısı aktarılırsa depo içinde olan termal harekette o kadar fazla olur. Bu durumda yaratılan entropi de o denli yüksektir. Bunun yanında ısıyı sıcak bir ısı deposu yerine daha soğuk bir depoya aktarırsak (yani soğuk depodan daha soğuk bir depoya ) yaratılan entropi de o kadar düşük olur. Buradan;
(2.21) şeklinde verilir. Adyabatik olaylarda T q dS ter T q S T q dS' ' ' ter
q = 0 ve S=0 (2.22) İzobarik olaylarda
(2.23)
İzotermal olaylarda
(2.24)
İlgilenilen değişim olduğu zaman sistem entropisindeki değişim dS olsun (bizde bunu belirlemek istiyoruz). Bu iki hali birbirine bağlayan bir yol bulalım. Örneğin sistemi izotermal tersinir olarak genleştirdikten sonra yine izotermal ve tersinir olarak sıkıştıralım. S bir hal fonksiyonu olduğundan (ki bunu tüm tartışma da buradan çıkmakladır) dS her iki yolda da aynıdır. Sistemin tersinir olarak sıkıştırılmasındaki entropi değişimi -dS verilmesi gereken ısıda -qter olur. Bu enerji çevreden gelme zorunda olduğundan -q′=qter ve ds′=qter/t olur. Sistem tersinir bir çevrime tabi tutulduğundan;
(2.25)
şeklinde bulunur.
Şimdide tersinmez bir sistem alalım. Sistem ile ortamın termal dengede olmasını sağlayalım (bunların mekanik dengede olmaları şart değildir). Örneğin bir gaz çevresinden daha yüksek basınca sahip olabilir bu durumda herhangi bir değişim sistemin entropisinde ds, ortamın entropisinde de ds′ değişimine sebep olur sistem tersinmez bir değişime tabi tutulursa toplam entropide değişimi sıfırdan daha büyük olur. ds+ds′ 0 veya ds -ds′ olur .
(2.26) idi T H S T U S T q dS 0 T q dS ter ter T q dS ter
qter= sisteme verilen ısı buradan
(2.27)
bulunur. Bu ifade Clausius Eşitsizliği olarak bilinir.
Buradan iki sonuç çıkar:
Tersinir olaylarda toplam entropi sıfır olup tersinmez olaylarda ise toplam
entropi>0 olur. Peki, hani entropi hal fonksiyonuydu ve gidilen yola bağlı değildi!
2.4.1Entropinin Fiziksel Anlamı
Kendiliğinden olan bütün olaylarda sistemin düzensizliği artar. Örneğin bir gazın başka bir gaz içine difüzlenmesi, gazın boşlukta genleşmesi gibi kendiliğinden olan olayların hepsinde düzensizlikte büyük bir artış görülür. Bu olayların hepsinde entropide arttığına göre entropi sistemde meydana gelen düzensizlik artışının bir ölçütü olarak düşünülmelidir. Kısaca istemli veya kendiliğinden olan bir hareket daha fazla düzensizlik oluşturacak şekilde cereyan eder. Ancak entropinin düzensizliğe bağlanmasında da büyük sorunlar vardır.
Faz değişimlerinde düzensizlik dolayısıyla entropi katı sıvı gaz şeklinde değişir. katılarda düzenli bir örgü yapısı varken sıvılarda bu yapı bozulur. Buharlaşma ise düzensizliğin en yüksek seviyeye çıktığı haldir. Dolayısıyla sıcaklık ile entropi arasında doğrusal bir ilişki vardır. Mutlak sıcaklıkta daha sonra göreceğimiz gibi entropi sıfıra yaklaşır. Düzensiz hal olasılığı düzenli hal olasılığından çok daha yüksektir. İlk olarak 1896 yılında Boltzmann mutlak entropiyi,
(2.28)
şeklinde tanımlamıştır. Burada k Boltzmann sabitini w ise termodinamik olasılığı göstermektedir. Daha sonra Planck bu sabit terimin sıfıra eşit olduğunu kanıtlamıştır. Düzenli halde w=1 ve S=0 olur.
T q dS sabit w k S ln
Şimdide kendiliğinden olan bazı olaylarda olan entropi değişimlerine bakalım
(İ) Tersinmez adyabatik genleşme
q=0 (2.29)
dssis + dsort (Clausius eşitsizliği ) (2.30)
(2.31)
olursa
dssis>0 olur . (2.32)
(ii)Tersinmez izotermal genleşme
ideal gazlarda
(2.33)
(2.34)
Eğer gaz izotermal olarak vakuma karşı genleşiyorsa (p=0) ortama ne ısı yayılır nede bir iş yapılır. ( q=0 ve w=0 ) dolayısıyla ortamın entropisi değişmez.
Ancak sistem v1v2 genleşmesi yaptığından sistemde
(2.35)
kadarlık bir entropi değişimi olur. Dolayısıyla dssis > 0 olur .
Şimdide ortamın entropisine bakalım: Her iki durumda da (yani adyabatik tersinmez genleşme ve vakuma karşı izotermal genleşme) q=0 olduğundan dsort=0 olur.
dstop = dssis + dsort dstop = dssis (2.36)
veya dstop > 0 (2.37) 0 T q dS ter ort 0 V T U w q w q dU 0 1 2 V V nRln ΔS
kısaca tersinmez olaylarda toplam entropi artar.
Şimdide genleşme işini sonsuz küçük basamaklar halinde yani tersinir olarak yapalım. Bu durumda sistem ortamdan q kadar ısı çeker ve entropi artışı q/t olur. Ortamdan çekilen ısı –q olduğuna göre entropide azalma –q/t olur. Dolayısıyla tersinir proseslerde
(2.38)
demek ki tersinir olaylarda toplam entropi değişimi sıfırdır. Kısaca olayın kendiliğinden olması için sistemin entropisi dolayısıyla toplam entropinin artması gerekir dssis > 0 olur.
İdeal gazlarda
dolayısıyla;
buradan
(2.39)
dolayısıyla ideal gazlarda entropi değişimi sıcaklık ve hacımın fonksiyonundur.
olduğundan; (2.40) 0 T q T q Stop V dV nRT dT nC PdV dT nC q PdV q dT nC w q dU V V ter V V dV nR T dT nC T q dS V ter 1 2 1 2 V 1 2 V V ln nR T T ln nC S S S 2 1 1 2 1 2 P T P T V V 1 2 1 2 1 2 V P P ln nR T T ln nR T T ln nC S
1 2 1 2 V P P nRln T T ln R C n ΔS 1 2 1 2 P P P nRln T T ln nC ΔS izotermal olaylarda T1=T2 (2.41) izobarik olaylarda p1= p2 (2.42) izokorik olaylarda V1= V (2.43)
dolayısıyla sabit basınç altındaki entropi değişimi grafiksel olarak kolaylıkla bulunabilir.
v
Şekil 2.11 Entropinin grafiksel olarak bulunması
Bu yöntem özellikle katı ve sıvılar için uygundur. Çünkü bunlarda Cp genellikle sıcaklığın karmaşık bir fonksiyonudur.
1 2 1 2 T V V nRln P P nRln ΔS T dH = T δq = dS T ΔH = T q = T T ln nC = ΔS P P P 1 2 P P T dU T δq dS T ΔU T q T T ln nC ΔS V V V 1 2 V V
2.4.2 Entropinin Bir Hal Fonksiyonu Olması
Bilindiği gibi hal fonksiyonlarında çevrim integrali sıfır idi. Carnot çevrimindeki entropi değişimini hesaplayalım.
I.İzotermal tersinir genleşme
(2.44)
II. Adyabatik tersinir genleşme
(2.45)
III. İzotermal tersinir sıkıştırma
(2.46)
IV. Adyabatik tersinir sıkıştırma
(2.47)
Buradan toplam entropi sıfır olur.
Bunların P-V ve T-S eğrilerine bakarsak;
Şekil 2.12 Carnot çevriminde P-V ve T-S değişimleri 1 2 2 V V Rln T q ΔS I I 0 ΔSII 3 2 1 1 1 III III V V Rln T q T q ΔS 0 ΔSIII
Entropinin hal fonksiyonu olduğu genelde yukardaki gibi Carnot çevrimine dayandırılmaktadır.
2.4.3 Entropinin bir hal fonksiyonu olduğunun ispatı
Aşağıdaki gibi bir çevrim alalım
(2.48)
Bunu biraz daha açalım. Birçok ufak Carnot çevriminden oluşan bir toplam proses alalım;
Şekil 2.13 Entropinin hal fonksiyon olduğunun ispatı
Bu prosesleri hepsini yapınca toplam proses de yapılmış olur.
2 b a 1 b a cevrim ΔS ΔS ΔS çevrim 2 b a 1 b a S S S 2 1 2 2 T T T q w 1 2 q q w
2 1
2
2 1
2 2 1 2 2 1 2 T T q q q T T T T q q q Bunu açarsak;
(2.49)
Bu da entropinin bir hal fonksiyonu olduğunu gösterir.
Tüm çevrimler için
(2.50)
Alternatif Yöntem
Şekil 2.14 Entropinin hal fonksiyonu göstermede alternatif yöntem Burada bc ile da birbirlerine ne kadar yaklaştırılırsa abcda alanı
afghe alanı da birbirlerine o kadar yaklaşır. ab boyunca yapılan iş w
ef boyunca yapılan iş w
limit durumda abef olacağından
w w (2.51)
ab prosesi izotermal bir proses olduğundan uab =0
w = q2 (2.51) ifadesine göre ; -w= -w = q2 = q2 (2.52) S 0 T q T q T q T q T q T q 1 1 2 2 2 2 1 1 1 2 2 1 0 T qter
Aynı şekilde net çevrimin alt kısmı için
q1= q1
Limit durumunda toplam proses bir seri çevrim ile gösterilebilir.
(2.53)
Bu da entropinin bir hal fonksiyonu olduğunu gösterir. Tabi bu birçok açıdan doğrudur ortada bir çevrim vardır ve bunun sonunda da entropi sıfır çıkmaktadır.
Ancak hal fonksiyonu olmanın bir başka şarttı da gidilen yola bağlı olmamaktır ki Clausius eşitsizliği bununla büyük bir çelişki içindedir. Bir fonksiyon tersinir ve tersinmez yollarda fark ederse nasıl hal fonksiyonu sayılabilir? İşte bu noktada işler içinden çıkılmaz hal almaktadır.
2.5 Clausius Eşitsizliği
Clausius tersinmez sistemlerde
(2.54) ve tersinir sistemlerde de (2.55) olduğunu bulmuştur. Bu prensibi (2.56) şeklinde açıklamıştır.
Buna göre tersinmez sistemlerde sistemin dolayısıyla evrenin entropisi artar iken tersinir sistemlerde değişmez.
0 T q T qter ter
T q dS ter Sis T q S ter Sis T q S ter Sis 2.6 Minimum enerji prensibi
Adyabatik olarak yalıtılmış bir ortamda bulunan mükemmel bir jeneratörün ucuna sürtünmesiz bir ipe asılmış olan bir ağırlık bağlayalım. Ağırlık yere doğru indikçe jeneratörü döndürür ve elektrik enerjisi elde edilir.
Şekil 2.15 Minimum enerji prensibi
Burada görüldüğü üzere mekanik enerji elektrik enerjisine döndürülmektedir. sürtünmesiz ve adyabatik bir sistem göz önüne aldığımıza göre;
qter =0 Ssis= 0, Sort= 0 ve Stop= 0
Burada bir çelişki varmış gibi görülmektedir. Olay kendiliğinden cereyan etmesine rağmen entropi değişimi sıfır olarak bulunmaktadır. Ancak bu kriter sabit enerjili sistemler için geçerlidir. Buradan şu sonuç çıkar: enerji sabit iken entropi
maksimuma giderken, entropi sabit iken enerji minimuma gider.
2.7 Entropinin Artması (Korunumsuzluğu) Prensibi
Bütün doğal süreçlerde veya termodinamik olarak tersinmez süreçlerde (örneğin yüksek sıcaklıktaki bir ısı deposunda düşük sıcaklıktaki ısı deposunu ısının kendiliğinden akması gibi) entropi artar. Doğal olamayan tersinir süreçlerde ise dışarıdan mutlaka katkı yapılması gerekmektedir. Bu husus yukarda detaylı bir şekilde anlatılmıştır. Bir başka hususta ısının daha farklı kullanılabilir bir enerjiye dönüştürülmesi durumunda tamamının bu dönüşüme iştirak etmemsin veya heba edilmesidir. Başka bir şekilde tabiat mümkün olan en kısa yolu kullanır ki bu yüzden entropi enerji gibi korunumlu değildir.
2.7.1 Entropi ve “Düzensizlik”
Entropi, en genel şekilde sistemin “düzensizliği” şeklinde kabul edilir. Ancak bu tanım entropi ile ilgili büyük bir kavram kargaşası yaratmaktadır. Bunlardan bazılarını listelersek
i)Entropik düzensizlik ve görsel düzensizlik: Entropik düzensizlik bazen
görsel düzensizlik sonucu çıkarılmaktadır. Bir oda kendi başına bırakılırsa doğanın gereği düzensiz olur. Ancak odanın bir başka canlı tarafından düzenlenmesi entropi ile açıklanamaz.
ii)Entropik Düzensizlik ve Kaos: Entropik düzensizlik bazen de“karmaşa, kargaşa, belirsizlik” anlamındaki kaos ile karıştırılmaktadır. Hâlbuki kendiliğinden olan
olaylar kaostan düzene göre gider.
iii)Fiziksel Anlamda Entropik Düzensizlik: Fiziksel anlamdaki düzensizlik,
yâni entropik düzensizlik, kısaca, birbirini bütünleyen şu iki şekilde tanımlanabilir: a: Belirli bir sistemin toplam enerjisinin mevcut tanecikler arasındaki dağılımı;
b: Bir termal işlemde, bir sisteme giren enerjinin tamamının faydalı mekanik işe dönüştürülememesi sonucunda, sistemin kendiliğinden eski hâline geri dönememesi.
Düzensizlikten kasıt sistemin bu şekilde kendiliğinden geriye dönememesi, geriye dönebilmek için bir dış müdahalenin şart olması ve sistemin bir önceki haline göre kendini toparlamasının çok daha zor olmasıdır. Bu olay zamanın geri döndürülmesi ile de yakından ilişkilidir. Bunu açıklamak için zaman oku kavramı geliştirilmiştir. Zaman oku, zamanın tek yönde ve sabit bir hızda ilerleyen bir karaktere sahip olduğu fikrine dayanmaktadır. Buna göre zaman, sâdece bir istikamette ilerler ve hızı da sabittir. Diğer yandan zaman, süreçlerin bir ifadesi olduğuna göre, hiçbir fiziksel süreç geriye döndürülemez.
iv)Kozmolojik zaman oku, kâinatın sürekli olarak genişleyeceğini ileri
sürmektedir; buna göre, durmadan genişleyen kâinat da çok uzun zamanlar sonunda parçaçıklar arasındaki mesafe o kadar büyüyecektir ki sonuçta hiçbir fiziksel süreç gerçekleşemeyecektir.
v)Termodinamik zaman oku ise, farklı ısı kaynakları arasındaki ısı transferinin
ancak ve yalnız daha yüksek sıcaklıktaki ortamdan (sıcak depo) daha alçak sıcaklıktaki ortama yapılabileceği gerçeğinden hareketle, bunun geriye döndürülemezliğini ifade etmektedir.
Termodinamiğin her iki yasası kısa bir cümlede özetlenebilir: Evrenin toplam enerjisi sabit olmasına rağmen entropi sürekli artar. Enerjinin yaratılması veya yok edilmesi mümkün olmamasına rağmen bir formdan bir başka forma dönüştürmek mümkündür. Ancak eldeki enerjiyi tamamen kullanılabilir bir işe dönüştürmek mümkün değildir. Tabi I.Kanuna göre bu işi yapmakta bir sıkıntı yoktur ama II. Kanun tabiatın vergi memuru gibi yakamıza yapışır ve bunun vergisini tahsil eder ve aldığı vergide bayağı yüksek bir orandır. İşte bunu açıklayan terim entropidir.
Entropi terimi ilk olarak Boltzmann tarafından kullanılmıştır. Ona göre evrene
“başlangıçta” belirli bir miktar enerji ve madde verilmiş ve bunların bir şekle döndürülmesine izin verilmiş (tabi yasalar çerçevesinde), fakat yok edilmelerine de yeniden yaratılmalarına da izin verilmemiştir”.
Boltzmann kaos kavramını bilim dünyasında kullanan ilk kişidir. Boltzmann matematik çözümlemesi sonunda daha önceden Makswell tarafından hiçbir kuralın olmadığı her şeyin mutlak rasgeleli içinde yürüdüğü bir sistemde elde edilen dağılım eğrisini bulmuştur. Maxwell dağılımı kargaşanın mutlak anlamda egemen olduğu ortamların düzenidir.
vı)Fiziksel anlamda Kaos: Kaos kelimesinin fiziksel anlamı, sözlük
anlamından ve geleneksel anlamından hayli farklıdır. başlangıç olarak, kaosu “sürekli kararsızlık” ve/veya “belirlenemezlik” olarak tarif edebiliriz.
vıı)Heisenberg’in belirsizlik ilkesi: Modern fiziğin en önemli kavramlarından
biri olan belirsizlik ilkesi, kısaca hareket halinde bulunan bir cismin momentum ve konumunun aynı anda ve aynı kesinlikle tespit edilemeyeceği esasına dayanır ve matematiksel olarak δx.δp ≥ h bağıntısı ile ifade edilir. Burada δx “konum’un belirlenmesindeki hata”, δp “momentum’un belirlenmesindeki hata” ve h ise, bilinen
“Planck katsayısı”dır (6.63x10-34
J.s) hata teorisi’ne göre, momentum [p=m.v] ve konum [x] ölçümünde bir hata yapmak kaçınılmazdır; bu husus, evren’in kanunlarından birisidir. Buna göre cismin konum ve momentumunun (dolayısıyla da hız ve kütlesinin) ölçümündeki hatalardan birisi küçültüldüğü takdirde diğeri büyüyecektir; meselâ momentum’un ölçüm hatası azaltılarak sıfıra, yâni “tam belirlenebilme” sınırına yaklaştıkça konum’un ölçüm hatası da sonsuza, yâni “hiç belirlenememe ” sınırına doğru yaklaşır ve limit hâlde δx = 0 için δp = ∞ olur ki bu, şu demektir:
Eğer cismin momentumunu, yâni hızını ve kütlesini “tam olarak”, yâni sıfır hatâ ile ölçmüş isek, konumunu, yâni, nerede olduğunu asla bilemeyiz. Ölçümünü“burada” yaptığımız cisim, evren’in herhangi bir yerinde bulunuyor olabilir. Buradaki belirsizliğin minimuma indirmek içi ölçümün sonsuz sayıda basamakta yapılması gerekir ki bu da mümkün değilimdir. İşte kaos olaraktan tanımlanabilen bu belirsizlik durumu sistemin başlangıç haline son derece bağımlı olduğundan “dinamik kararsızlık” durumuna karşılık gelir.
vııı) Serbest Genleşmede Entropi Değişimi: İzole bir sistemde bulunan bir
gazın vakuma doğru genleşmesi durumunda ilk ve son hacımlar Vi ve Vs ise genleşme sonunda Vs> Vi olur. Genleşen gaz tekrar kendiliğinden eski, haline dönemeyeceği için işlem ‘tersinmezdir. Ayrıca, gazın bu genleşmesi bir “ani genleşme” olduğu için yarı kararlı da değildir. Gaz tarafından boşluğa karşı yapılan iş sıfırdır (w=0)ve sistem izole edilmiş olduğu için ısı transferi yoktur (q=0); yâni işlem bir adyabatik bir işlemdir. q=0 olduğundan δS=0 olacağı düşünülebilir ise de bu doğru değildir çünkü sistemin düzensizliği artmaktadır. δs ’in hesaplanabilmesi için ilk ve son durumlar birbirine bir tersinir yol ile bağlanırlar. Bu yol bir izotermal genleşmedir. İzotermal genleşme, serbest genleşme ’den farklı olmasına rağmen aralarında çok mühim bir ortak nokta vardır: Her ikisinin ilk ve son durumları sabit sıcaklıkta oluşan birer denge durumudur. (izotermal genleşmede ara sıcaklıklar bilindiği halde serbest genleşmede bilinemez; ancak bu vaziyet, ilk ve son denge durumları bakımından benzer olmalarını engellemez.)
Bu hususta en önemli çalışmayı Carnot yapmıştır. Carnot ideal verimi sadece sıcak ve soğuk depoların ısısına bağlı olduğunu belirlemiştir.
Termodinamik kanunlarına göre her cisim hareket etmek ve bunun içinde belli bir enerji kullanmak zorundadır. Ancak daha öncede söylenildiği her hareket sonlanmak zorundadır çünkü termodinamiğin I.Kanunun devri daim hareketinin mümkün olmadığında dolayı belli bir sure sonra durmak zorundadır.
Fakat termodinamik kanunlarının keşfedilmesinin çok öncelerinden başlayarak günümüze gelinceye dek, birçok hayalperest bu kanunlardan habersiz olarak veya onlara meydan okuyarak, sürekli bir enerji girdisi olmaksızın çalışarak daimî hareket (Lat. perpetuum mobile, ing. perpetual motion) ilelebet faydalı iş üretecek makinalar tasavvur etmişlerdir ve etmeye de devam etmektedirler. Ancak bu kanunların çiğnenemeyeceği artık herkes tarafından kabul edilmektedir.
3. YÖNTEM 3.1 Araştırma Modeli
Bu araştırma bir literatür taraması (survey) niteliğindedir. Entropi ile ilgili tüm literatür taranmış termodinamik ve fizikokimya kitaplarındaki tanımlar birbirleri ile karşılaştırmalı olarak incelenmiştir.
3.2 Evren ve Örneklem
Araştırmanın evrenini dünyada bu konu ile ilgili yazılmış tüm termodinamik, fizikokimya kitapları ve entropi ile ilgili yazılmış makaleler teşkil etmektedir. Örneklem ise bu konu ile ilgili yazılmış olan fizikokimya kitaplarıdır.
3.3 Veri Toplama Teknikleri
Tüm dünyada bu konuda yapılmış yayınlar araştırılmış ve daha sonrada çeşitli kitaplar taranmış ve entropi ile ilgili kavramlar karşılaştırmalı olarak incelenmiştir.
3.4 Verilerin analizi
Konu çok karmaşık olduğu için ön test son test modellemesine gidilmemiş ve elde edilen veriler çerçevesinde yani savlar önerilmiştir.Entropinin hal fonksiyonu olup olmaması, tersinirlik ve tersinmezlik kavramları detaylı bir şekilde tartışılmıştır.
4.BULGULAR VE YORUMLAR
Entropi kavramının temel teşkil ettiği termodinamiğin ikinci kanunu hangi tür proseslerin kendiliğinden gerçekleşeceğini belirlemeye çalışır
(Lechner, 1999). İkinci kanun entropiye dayalı olarak, kendiliğinden yüreyen
bir değişim sırasında izole bir sistemin entropisi artar şeklinde açıklanır (Atkins, 1998). Bu konudaki önemli yanılgılar, sistemin şartlarının göz ardı edilmesiyle ve genel olarak toplam entropinin (çevre ve sistemin toplam entropi) yerine sistemin entropisinin dikkate alınmasıyla ortaya çıkar. Entropinin mikro düzeyde tartışılmasından ziyade düzensizliğin bir ölçütü olarak gösterilmesi ve sistemlerin maksimum düzensizlik eğiliminde olduğunun söylenilmesi öğrencilerde büyük kavram yanılgılarına sebep olmaktadır. Bunlardan bazıları :
Entropi sistemdeki düzensizliğin sebebidir (Söz bilir, 2001), Entropi sistemin düzensizliğine eşittir (Sözbilir, 2001), Entropi arttığı zaman sıcaklıkta artar (Sözbilir, 2001),
İkinci kanuna göre kendiliğinden gerçekleşen olaylarda sistemin entropisi artmalıdır (Thomasve Schwenz, 1998),
Entropi sistem özerine iş yapıldığını gösterir (Selepe ve Bradley, 1997),
Mikro hal küçük bir haldir. Entropiyle ilişkili değildir (Sözbilir, 2001),
Evrenin entropisi değişmez ya da azalır (Sözbilir, 2001),
Bir sistem her zaman maksimum entropili hale gider (Sözbilir, 2001), Bir reaksiyonun entropi değişimi her zaman pozitiftir (Sözbilir, 2001).
4.1Entropiye moleküler yaklaşım ve istatistiksel termodinamik
Öncede anlattığımız üzere Boltzmann dağılımı dikkate alınarak mikro hallerin sayısı ve istatistiksel yorumlan dayalı olarak açıklanabilir. Boltzmann formülü;
S=kblnW,
S=kbln(W2/W1)
Denklemdeki W “termodinamik olasılığı” ifade eder. Termodinamik olasılık sıcaklık, basınç, hacim, her bir bileşenin mol sayısıyla belirlenmiş termodinamik bir hal olan özel bir makro hale karşılık gelen mikro hallerin sayıdır (Maes and Redig, 2000).
Mikro hal ifadesiyle; özel bir sistemdeki her bir taneciğin(atom ya da molekül) konum ve momentumlarını belirterek açıklayan - hal kastedilmektedir. Mikro hallere bağlı olarak makro durum ve olaylardan bahsedilebilir. Bu bahis aynı zamanda makro durumun gözlenebilmesini, destekleyen mikro hallerin sayısına bağlı olarak genişletilebilir. Bu nedenle bir olayı ya da durumu sağlayan mikro hallerin sayısı ne kadar fazla ise o durumun gerçekleşme ihtimali o kadar fazladır denilebilir
(www.entropysite.com).
Moore(1972) entropinin hal fonksiyonu olma durumunu Carnot çevrimine dayandırmıştır. Ayrıca entropinin her durmada tersinir bir yol üzerinden hesaplandığını söylemiş ve entropinin sadece iki denge durum arasındaki fark için tanımladığını söylemiştir.
Levine (1988)’de kapalı bir sistemin Carnot çevrimini vermesi durumunda dq ter/T değerinin sıfır olduğunu söyler. Levine'e göre sonsuz küçük Carnot çevrimine bölünebilecek genel çevrim vermiş ve bu çevrimine dayanmakta S=qter/T = 0 olarak kabul etmiştir. Dolayısıyla entropi fonksiyonu kapalı sistemler için tanımlanmıştır.
Buna göre entropi sadece bulunan hallere bağlı olduğundan hal fonksiyonu olarak tanımlanmıştır. Entropinin hesabı için;
1-Başlangıç bitiş halleri için olan 1 ve 2 hali tanımlanmalı
2-Bunun için tersinir bir yol belirlenmelidir.
Bu ister tersinir ister tersinmez olsun takip edilmesi gereken yoldur.
Chakrabarty (2001)’ye göre gazların kinetik teorisine göre yüksek ısı, taneciklerin çok daha fazla gelişi güzel hareket yapmasına sebep olmaktadır. Buna göre, yüksek entropiye sahip bir sistem daha fazla ısıya sahiptir. Entropi artan bu ısı miktar mıdır acaba? Eğer böyleyse ısı miktarı yola bağlı olup hal fonksiyonu değildir. Dolayısıyla entropide sonsuz küçük bir değişim teoride tam diferansiyel almayacaktır. Ancak yine ona göre entropinin in bir hal fonksiyonu olarak tanımlanması çok büyük kolaylık sağlamaktadır.
Glasstone ve Lewis(1978)‘in dediğine göre sistemin gerçek entropisi kolaylıkla tanımlanamaz bunun yerine entropideki artışın tanımlanması çok daha pratiktir. Dolayısıyla entropideki ΔS artışın tanımlanması çok daha pratiktir. Dolayısıyla entropideki ΔS artışı tersinir bir prosesteki dq ter/T eşittir. Δ q ter değeri tam bir diferansiyel olmamasına rağmen bunun tersinir ve izotermal bir değişiminin net bir değer olduğundan yukarıda tanımlanan ΔS’inde tam diferansiyel olduğu söylenebilir. Buna göre sistemin entropisi olan S değeri sadece hal ve durumuna bağlıdır ve aradaki yola bağlı değildir. Dolayısıyla ΔS değeri (S2-S1) sadece başlangıç ve bitiş hallerine bağlı olup aradaki yolun tersinir veya tersinir olmasına bağlanamaz. Ancak ΔS değerinin gerçek değerini bulmak için ısının tersinir bir biçimde soğrulması gerekir. dq ter eğer ısı tersinmez olarak soğrulduysa belirsiz bir değer olup entropi hesabında kullanılmaz.
Barrow(1979), Carnot çevrimine dayanarak entropi direk olarak bir hal fonksiyonu olarak kabul etmiş ve aynı şekilde entropinin sistemin başlangıç ve bitiş hallerine bağlı olduğundan oraya nasıl geldiğinin önemli olmadığını vurgulamıştır. Yani direkt olarak entropinin hal fonksiyonu olduğunu kabule etmiştir. Ancak burada da Clausius eşitliğine bir açıklama getirmemektedir.
Voltehc vd. (1977) entropinin hal fonksiyonu olmasını her dq ter/T’ nin bir hal fonksiyonu olması gerektiğini söylemiştir. Entropinin kendiliğinden olan olayların önemli bir fonksiyon olduğunu belirlemiştir. Entropinin hal fonksiyonu olduğunu herkes gibi Carnot çevrimine dayandırmış ve dq ter/T’ nin tam diferansiyel olduğunu söylemiş.
Bery vd.(1986) entropinin S=KB ln Ώ (E,V,N) şeklinde kuantum kimyasal tanımını yapmıştır. Ancak entropinin sadece makroskopik değerlere bağımlı tanımı da kolaylıkla yapılabilir.
Termodinamiğinin II. Kanunu yazılı olarak 3 şekilde ifade edilebilir.
Birincisi, Clausius ifadesi: Buna göre, sıcak bir ısı deposundan soğuk bir ısı deposuna ısı aktarmak dışında herhangi bir etki yapmadan çalışan çevrimsel bir makine yapılamaz.
İkincisi, Kelvin tanımı: Buna göre, çevresinde sıcak ısı deposundan ısı alıp tamamını işe döndürecek bir makine yapmak mümkün değildir.
Üçüncüsü ise Caratheodory: Buna göre her denge halindeki bir halin çevresinde herhangi bir adyabatik bir yol ile 1. Halden başlamak suretiyle erişilmeyecek haller vardır. Görüldüğü gibi I.Kanundan aksine burada erişilmesi imkansız haller vardır. Buna göre iki tane tersinir adyabat veya izotermin kesişmesi mümkün değildir .
Arada hiçbir adyabatik tersinir bir yol yoksa bu durumda sistemin entropisi
sadece ΔS=S1-S2′ yazılır. ΔS değeri S1-S2+S2′ olup S1-S=0’dır. Dolayısıyla S2-S2′=q2′/T>0 dolayısıyla ΔS>0 olup 2 ile 1 arasındaki her türlü tersinmez prosesler
için geçerlidir. Dolayısıyla dS ≥ dq/T olup entropinin hal fonksiyonu olmasına tamamen ters bir durum arz etmektedir. Kısaca, Clausius eşitsizliği entropinin hal fonksiyonu olma şartına ters düşmektedir.
Adamsan (1979) burada sadece izotermal bir çevrim ile ısıyı işe çevirmek mümkün olmadığı ve kapalı sistemlerde entropinin kendiliğinden olan prosesler de artacağını ve qter/T’nin de hal fonksiyonu olduğunu söylemektedir. Kısaca, entropi kapalı sistemler için söz konusu olan bir kavramdır.
Burada en net açıklamayı Glasstone (1975) getirmiştir. Glasstone‘e göre dS=dq/T olup dq’nun tersinir ve izotermal bir proses tam diferansiyel olmamasına rağmen dS′ değerinin tam diferansiyel olduğunu göstermiştir.1 ve 2 halleri arasında integral alındığında ΔS= S2-S1. Buna göre S1 başlangıç hali, S2 de son halindeki entropi olup yukarıdaki açıklamaya göre sadece bu hallere bağlı olup aradaki yola bağlı değildir. Bu yolun tersinir olup olmadığına bağlı olmaksızın S2-S1 değeri aynıdır. Ancak ΔS değeri yukarıdaki denklemde bulunması durumunda da değerinin de sabit T’de
tersinir bir değişim olması gerekir. Eğer değişim tersinmez ise soğrulan ısı belirsiz olup entropi artışını belirlemede kullanılamaz. Adyabatik bir proseste sistemi herhangi bir ısı girmediğinden dq=0 olup entropide bir değişim söz konusu değildir bu yüzden bu tip değişimlere izentropik(sabit entropi) değişim denir.
Castellan (1983) entropiyi II. Kanuna göre tanımlamış. Entropinin Carnot çevrimindeki değerin sıfır olmasından dolaylıda buna hal fonksiyonu olduğunu belirtmiş. Ancak Clausius eşitsizliği ile gösterilen tersinir ve tersinmez haldeki entropi değişiminin farklı olması olayına farklı bir açıklama getirmemiştir.
Kriev (1978) II. Kanunun önemini açıkladığı 7. Bölümümde doğal olayları 3’e ayırmıştır.
1. Sisteme meydana gelen değişime direk olarak orantılı olan bir işin yapılması gerektiği olaylar
2. Sisteme bir işin yapılmasını gerektirmeyen ve dış kuvvetlere karşıda herhangi bir iş elde edilmeyen olaylar
3. Kendiliğinden gelişen olaylardaki sistem üzerine herhangi bir iş yapılmasını gerektirmeyen meydana gelen değişim ile orantılı olan bir işin elde edildiği olaylardır.
1. tip olaylara bir cismi yükseğe kaldırmak veya suyun bir elektrik akımı etkisi ile bulunması örnek verilebilir.
2. tip olaylara ise bir topun tamamen yatay bir düzlemde hareket etmesi veya sürtünmesiz bir sarkacın titreşimleri örnektir.
3. tip olaylara ise genel olaylar olup ağırlığın aşağı düşmesi, kuvvetli bir asitin kuvvetli baz tarafından nötralize edilmesi yakıtın yanması, maddelerin camsı halden kristal hale geçmesi örnek verilebilir. Bu gruptaki olayların hepsi pozitif olaylar olarak bilinir.1. gruptaki olaylar ise negatiftir.
Buna göre I. Kanun sistemin oluşumu karakteri hakkındaki herhangi bir şey söylemezken II. Kanun verilen P, T ve konsantrasyonda olayın kendiliğinden oluşup oluşmayacağı hakkında bilgi verir.
Buna göre enerji bir şiddet faktörü ile kapasite faktörünün bir çarpımıdır. Şiddet faktörü madde miktarından bağımsız olup kapasite faktörü madde miktarı ile değişir.
Bir olayın olabilirliği şiddet faktörü ile arasındaki ilişkiye bağlıdır. Örneğin, biri sıcak , biri soğuk iki cisim birbiri ile temasa getirilirse sıcak cismin sıcaklığı azalırken soğuk cismin sıcaklığı artar. Bu olay denge haline kadar devam eder. Bu tip denge olaylara çok fazla örnek mevcuttur. Dolayısıyla kendiliğinden oluşan bu olayların yönünü ve sınırlarını belirleyen bir kriter alınmalıdır. Buna göre; farklı kısımlarında meydana gelen olayları belirleyen faktör sistemi denge durumuna götürecek yönde hareket etmelidir.
Bu olay sadece ve sadece homojen sistemlere uygulanabilir. Buna göre Termodinamik II. Kanunu verilen şartlar altında her termodinamik sistem için bunun yönünü olabilirliğini, sınırı tanımlayan genel bir kıstas olduğunu söyler.
Örneğin izole sistemlerde bu parametreye entropi denir. Diğer şartlar için daha farklı termodinamik parametrelerin kullanılması daha uygundur.
II. Kanuna göre izole sistemler sistemin entropisinin artması ve maksimum değere ulaşması durumunda kendiliğinden cereyan eder.
Ayrıca entropinin istatistik termodinamik yanı da vardır. Buna göre izole bir sistemde ısı, sıcak cisimden soğuk bir cisme akarken sistemin entropisi artar dolayısıyla tersinmez sistemlerde mutlaka bir entropi artışı söz konusudur. Buna göre ∫dq/ T< 0 olmalıdır. Entropi hal fonksiyonu olduğuna göre prosesin gittiği yoldan bağımsız olup özellikle sistemin tersinirliği üzerinde hiçbir etkisi yoktur. Eğer sistem orijinal haline dönerse bu çevriminin şartıdır. Entropide daima ilk değerini alır. Dolayısıyla entropi değişimi sıfırdır. Ancak prosesin ısısı yola bağlı olduğundan yukarıdaki eşitsizlik denge durumuna uygulanmaz .İstatistiktik termodinamiğe göre entropi taneciklerin farklı hareket türleri ile ilgili termodinamiğin toplamıdır. Tüm bu yukarıdakilerin anlatımına göre dS ≥ dq/T buna göre izole bir sistemde ( sadece adyabatik olayların cereyan edebildiği) sistemin entropisi ancak tersinir bir proses meydana gelebiliyorsa sabit olup tersinmez bir sistemde mutlaka artar .Başka bir deyişle izole bir sistemde kendiliğinden meydana gelen her olay sonunda entropi artar.
Mortimer (1993)’’e göre tersinir bir sistemde entropi başlangıç ve bitiş hallerine bağlı olduğunda gidilen yola bağımlı değildir dolayısı ile hal fonksiyonudur. Tersinmez durumda ise sistem bir seri denge halinde geçerek son hale gelir. Başlangıç ve bitiş halleri denge değildir. Dolayısı ile bu durumda entropi bir hal fonksiyonunu olmaz.