SAĞLIK BİLİMLERİ ENSTİTÜSÜ
PEDİATRİK DİYABETİK HASTALARDA ANJİYOTENSİN KONVERTİNG ENZİM (ACE)
GEN POLİMORFİZMİ ANALİZİ
YÜKSEK LİSANS TEZİ ARŞ. GÖR. MAHİR BİNİCİ
TEZ DANIŞMANI
YRD. DOÇ. DR. SELAHADDİN TEKEŞ
DİYARBAKIR 2016 T.C.
T.C
DİCLE ÜNİVERSİTESİ
SAĞLIK BİLİMLERİ ENSTİTÜSÜ MÜDÜRLÜĞÜ
“Pediatrik Diyabetik Hastalarda Anjiyotensin Konverting Enzim (ACE) Gen Polimorfizmi Analizi” Başlıklı Yüksek Lisans tezi…… tarihinde tarafımızdan değerlendirilerek başarılı bulunmuştur.
Tez Danışmanı : Yrd. Doç. Dr. Selahaddin TEKEŞ Tezi Teslim Eden : Arş Gör. Mahir BİNİCİ
Jüri Üyesinin Ünvanı Adı Soyadı Üniversitesi
Başkan : Prof. Dr. Mehmet ELBİSTAN Ondokuz Mayıs Üniversitesi
Üye : Doç. Dr. Hilmi İSİ Dicle Üniversitesi
Üye : Yrd. Doç. Dr. Selahaddin TEKEŞ Dicle Üniversitesi
:
Yukarıdaki imzalar tasdik olunur.
…../…../………
Doç. Dr. Sevgi KALKANLI TAŞ Dicle Üniversitesi
TEŞEKKÜR
Başta eğitim sürecim boyunca gerek bilgi ve birikimi gerekse öngörüleri ile bana yardımcı olan ve tez seçimim konusunda fikirlerini esirgemeyen değerli danışmanım Yrd. Doç. Dr. Selahaddin TEKEŞ’e;
Çalışmalarım esnasında fikirleri, tecrübeleri ve verdikleri dersler ile aynı zamanda eğitimime katkı sunan başta bölüm başkanım Doç Dr. Hilmi İSİ olmak üzere Doç. Dr. Mahmut Balkan, Doç. Dr. Selda ŞİMŞEK, Yrd. Doç. Dr. Diclehan ORAL, şuan Muğla Üniversitesi öğretim üyesi Yrd. Doç. Dr. Ayşegül TÜRKYILMAZ ve aramızdan ayrılan rahmetli Yrd. Doç. Dr. Nail ALP hocama;
Biyoistatistik analiz çalışmalarında yardımlarıyla tezime katkı sunan Farmakoloji AB dalı öğretim üyesi Doç. Dr. Hasan AKKOÇ’a;
Çalışmalarımda her türlü katkıyı esirgemeyen anabilim dalımızdaki bütün sağlık ve idari personele;
Araştırmam sırasında katkılarını sunan Dr. Pınar Emür’e;
Çalışmalarımda desteklerini esirgemeyen arkadaşlarım İlyas YÜCEL, A. Serhat BAYAR ve Turan ERİŞEN’e;
Beni bugünlere getiren eğitim yaşamım boyunca her türlü maddi manevi katkılarını sunan değerli babam Necat BİNİCİ, annem Halime BİNİCİ ve kardeşlerim Berivan ve Baran’a;
Ve özverisinden dolayı biricik eşim Serap’a; Teşekkürlerimi bir borç bilirim.
İÇİNDEKİLER TEŞEKKÜR...I İÇİNDEKİLER...II ÖZET...IV SUMMARY...V KISALTMALAR...VI TABLOLAR DİZİNİ...IX ŞEKİLLER DİZİNİ...X 1. GİRİŞ VE AMAÇ...1 2. GENEL BİLGİLER...2
2.1. Diyabetes Mellitus'un Tarihçesi...2
2.2. Diyabetes Mellitus'un Tanımı...2
2.3. Epidemiyoloji...3
2.4. Tanı ve Sınıflama...4
2.5. Diyabet ve Genetik...7
2.5.1. Mody (Gençlerde Görülen Erişkin Tip Diyabet)...8
2.6. Anjiyotensin Konverting Enzim (ACE)...8
2.6.1. Tarihçe...9
2.6.2. ACE yapısı ve fonksiyonu...9
2.6.3. Renin – Anjiyotensin Sistemi (RAS)...11
2.6.4. ACE Geni...13
2.6.5. ACE Polimorfizmi...14 2.6.6 Anjiyotensin II tip 1 reseptör (AT1R) Geni ve Polimorfizmi. .15
3. MATERYAL VE METOD...19
3.1. Materyal...19
3.1.1. Hasta ve Kontrol Grupları...19
3.1.2. Kan Örnekleri...19
3.1.3. Kullanılan Solusyonlar ve Tamponlar...19
3.1.4. 1X TBE tampon hazırlanışı...21
3.1.5. Agaroz Jel Hazırlanışı...21
3.2. Metod...21
3.2.1. Periferik Kandan DNA İzolasyon Yöntemi...21
3.2.2. Polimeraz Zincir Reaksiyonu (PCR) İle Örneklerin Çoğalması22 3.2.2.1. ACE I/D polimorfizmi PCR Aşaması...22
3.2.2.2. ACE geni DD genotiplerinin doğruluk kontrolü...23
3.2.2.2. Anjiyotensin II tip 1 reseptör (AT1R) 1166C Polimorfizmi PCR Aşaması ………...24
3.2.3. PCR Ürünlerinin Restriksiyon Enzimleri İle Kesimi...24
3.2.4. Agaroz Jel Elektroforezi...25
3.2.5. İstatistiksel Analiz...26
4. BULGULAR...27
5. TARTIŞMA...34
6. SONUÇLAR...38
7. KAYNAKLAR...40
8. Etik Kurul Raporu...47
9. Aydınlatılmış Onam Formu...48
10. Özgeçmiş...49
ÖZET
PEDİATRİK DİYABETİK HASTALARDA ANJİYOTENSİN KONVERTİNG ENZİM (ACE) GEN POLİMORFİZMİ ANALİZİ
Anjiyotensin dönüştürücü enzim (Angiotensin-converting enzyme, ACE), çinko metalopeptidaz enzim ailesinden olup, anjiyotensin I’in anjiyotensin II’ye dönüştürülmesinde rol oynar. ACE geni, 17. kromozomun p kolu üzerinde 21 kb boyutunda 26 eksonlu bir gen olup, intron 16’da 287 baz çiftlik bir tekrar dizisinin olup olmaması ile insersiyon/delesyon şeklinde polimorfizm gösterir.
Çalışmamızda 3-15 yaş aralığındaki Diabetes Mellitus (DM) tanısına sahip 75 kişilik hasta grubu ve başka herhangi bir hastalığı olmayan 50 kişilik kontrol grubunda Anjiyotensin Dönüştürücü Enzim (ACE) ve Anjiyotensin II tip-1 Reseptör (AT1R) gen polimorfizmlerinin DM ile ilişkisinin olup olmadığını ve bunların hastalardaki biyokimyasal değerlerle karşılaştırılması hedeflenmiştir.
Her iki gruptan alınan kan örneklerinden DNA izolasyonunu takiben PCR ve PCR-RFLP ile bireylerin genotipleri belirlenmiştir. Her iki grubun biyokimyasal testleri için kan örnekleri alınmış olup; HDL kolesterol, LDL kolesterol, total kolesterol, glikoz ve sadece hasta grubu olmak üzere HbA1c düzeyleri karşılaştırılmıştır. İstatiksel analizler SPSS 21.0 (IBM SPSS Statistics 21 CLIENT) kullanılarak yapıldı. Verilerin analizinde Hardy-Weinberg, Chi-kare, Student t-testi gibi testler kullanıldı.
Hasta ve kontrol grupları arasında ACE ve AT1R polimorfizmleri bakımından yapılan analizler sonucu istatiksel olarak anlamlı bir fark gözlenmedi (p>0.05). Bu polimorfizmler ile glukoz, total kolesterol ve HDL arasında bir ilişki saptanmadı (p>0.05). Hasta grubunda HbA1c düzeyi ile polimorfizmler arasında bir ilişki saptanmadı (p>0.05).
Her ne kadar Diyabetes mellitus ile ACE ve AT1R gen polimorfizmi arasında istatiksel olarak anlamlı bir ilişki saptanmamış ise de mevcut literatür bilgilerimize göre ülkemizde çocuk yaş grubunda yapılan ilk çalışma olması bakımından önemlidir.
Anahtar Kelimeler: Diabetes Mellitus; ACE geni; AT1R geni; Genetik
SUMMARY
ANGIOTENSIN CONVERTİNG ENZYME (ACE) GENE POLYMORPHISM ANALYSIS IN PEDIATRIC PATIENTS WITH DIABETES MELLITUS
Angiotensin Converting Enzyme (ACE) is member of zinc metallopeptidas family and responsible for converting angiotensin I to Angiotensin II. ACE gene which is 21 kb has 26 exon located on 17’th chromosomes’ long arm. Polymorphism occurs with presence of the 287 base pair fragment which is described by insertion/deletion in intron 16.
In this study we aimed to compare ACE and Angiotensin II type 1 receptor (AT1R) gene polymorphism and their biochemical values in 75 Diabetes Mellitus (DM) patients with 50 healthy control groups with mean age 3-15.
After DNA extraction we detected the genotypes of the two groups by PCR and PCR-RFLP methods. The blood samples were taken for biochemical tests from both groups; HDL cholesterol, LDL cholesterol, total cholesterol, glucose and only in the patient group HbA1c levels were compared. Statistical analysis was performed by SPSS 21.0 (IBM SPSS Statistics 21 CLIENT). Hardy-Weinberg, chi-square test and student-t-test was used for the analysis of data.
There is no statistically significant a difference observed between patients and healthy control groups for polymorphisms ACE and AT1R (p>0.05) in our study. There is no a correlation between levels of HDL cholesterol, total cholesterol and glucose with this polymorphisms (p>0.05). There was no significant correlation between ACE and AT1R polymorphism and HbA1c level in patients (p>0.05).
Although there is no statistically significant association between the ACE and AT1R gene polymorphisms and diabetes mellitus was found in our study. According to our knowledge this study is the one of first study in children in our country.
Keywords: Diabetes Mellitus; ACE gene; AT1R gene; Genetic
KISALTMALAR
ABCC8 : ATP binding cassette, subfamily C, member 8 ACE : Angiotensin Converting Enzyme
ADA : American Diabetes Association (Amerikan Diyabet Birliği) APG : Açlık Plazma Glukozu
AT1R : Angiotensin II Type 1 Receptor (Anjiyotensin II tip 1 reseptör) bç : Baz Çifti
CAPN10 : Calpain 10
CTLA-4 : Cytotoxic T lymphocyte-associated 4
DIDMOAD : Diyabetes Insipitus, Diyabetes Mellitus, Optik Atrofi, Sağırlık (Deafness)
DM : Diyabetes Mellitus DNA : Deoksiribonukleik Asit
EASD : Avrupa Diyabet Çalışma Birliği EDTA : Etilendiamintetraasetik Asit EtBr : Etidiyum Bromür
gACE : Germinal ACE
GDM : Gestasyonel Diyabetes Mellitus GCK : Glucokinase
HbA1c : Glikozillenmiş Hemoglobin A1 HDL : High Density Lipoprotein
HLA : Human Leucoyte Antigene (İnsan Lökosit Antijeni)
HNF4A : Hepatocyte nucleara factor 4-α HNF1A : Hepatocyte nucleara factor 1-α U HNF1B : Hepatocyte nucleara factor 1-β IDDM1 : HLA class II genleri
IDF : International Diabetes Federation (Uluslararası Diyabet Federasyonu) IFG : Impaired Glucose Tolerance
(Bozulmuş Açlık Glukozu)
IFCC : International Federation of Clinical Chemistry IGT : Impaired Fasting Glucose
(Bozulmuş Glukoz Toleransı) INS : İnsülin Geni
IPF1 : İnsulin promoter factor-1
KCNJ11U : Potassium channel, inwardly rectifying subfamily J, member 11 LDL : Düşük Yoğunluklu Protein
MgCl2 : Magnezyum klorür
MODY : Gençlerde Görülen Erişkin Tip Diyabet (Maturity Onset Diabetes Of The Young) NDDG : National Diabetes Data Group
(Amerikan Ulusal Diyabet Veri Toplama Grubu) OGTT : Oral Glucose Tolerance Test
PCR : Polymerase Chain Reaction (Polimeraz Zincir Reaksiyonu)
PPARγ : peroxisome proliferator-activated receptor-γ sACE : Somatik ACE
TBE : Tris-Borik Asit-EDTA TRİS-HCl : Tris Hidroklorür
TURDEP : Türkiye Diyabet, Hipertansiyon, Obezite ve Endokrinolojik Hastalıklar Prevalans Çalışması
UNEUROD1 : Neurogenic differentiation factor 1
WHO : World Health Organization (Dünya Sağlık Örgütü)
TABLOLAR DİZİNİ
Tablo 1. Diabetes Mellitus ve glukoz metabolizmasının diğer bozukluklarında tanı kriterleri
5
Tablo 2. Diabetes mellitus’ un etiyolojik sınıflandırılması 6
Tablo 3. MODY genleri 8
Tablo 4. ACE Geninin organizasyonu 13
Tablo 5. AT1R Geninin organizasyonu 17
Tablo 6. Kontrol ve hasta gruplarının yaşa göre dağılımı 27
Tablo 7. Kontrol ve hasta gruplarının cinsiyete göre dağılımı 27
Tablo 8. ACE polimorfizmi Genotip ve allel frekansı 28
Tablo 9. AT1R polimorfizmi Genotip ve allel frekansı 28
Tablo 10. Kontrol ve hasta gruplarının glukoz, HDL, LDL, total kolesterol düzeyleri
29
Tablo 11. ACE ve AT1R gen polimorfizmleri ile glukoz değerleri arasındaki ilişki
30
Tablo 12. ACE ve AT1R gen polimorfizmleri ile HDL düzeyleri arasındaki ilişki
31
Tablo 13. ACE ve AT1R gen polimorfizmleri ile total kolesterol düzeyleri
arasındaki ilişki
32
Tablo 14. ACE ve AT1R gen polimorfizmleri ile HbA1c düzeyleri arasındaki ilişki
33
ŞEKİLLER DİZİNİ
Şekil 1. Anjiyotensin konverting enzim yapısı 10
Şekil 2. Anjiyotensin konverting enziminin 3 boyutlu yapısı 10
Şekil 5. ACE geninin lokasyonu 13
Şekil 6. ACE polimorfizmleri 14
Şekil 3. Alu repeat sekansının yerleşimi 14
Şekil 8. Alu repeat bölgesinin yapısı 15
Şekil 9. AT1R reseptör yapısı 16
Şekil 10. AT1R gen lokasyonu 17
Şekil 11. İnsan AT1R gen yapısı 18
Şekil 12. ACE bant bölgeleri 23
Şekil 13. ACE geni DD genotiplerinin doğruluk kontrolü bant bölgeleri 24
1. GİRİŞ VE AMAÇ
Diabetes mellitus (DM) insülin salgılanması veya hareketinden ya da her ikisinden kaynaklanan hiperglisemi ile karakterize olmuş bir metabolik hastalık grubudur. Diyabetin kronik hiperglisemisi; özellikle göz, böbrek, sinir, kalp ve kan damarları gibi çeşitli organlarda fonksiyon bozukluğuna, yetmezliğine ve uzun vadede hasar vermeye yol açar (1).
Diyabetin bütün formlarının sağlığa ciddi zararları vardır. Bu hastalıkla ilişkili anormal glikoz metabolizmasının sonuçlarına ( hiperlipidemi, proteinlerin glikozilasyonu gibi) ek olarak çok sayıda uzun vadeli komplikasyonları da söz konusudur. Bunlar genç yetişkinlerde morbidite, sakatlık ve prematüre ölüme sebep veren kardiyovasküler, periferal vasküler, ocular, nörolojik ve renal anormalliklerdir. Üstelik üreme komplikasyonları ile ilişkili hastalık anne ve çocuğunda problemlere sebep olurlar. Her ne kadar gelişmiş glisemik kontrol bu komplikasyonların gelişim riskini azaltabilse de diyabet, dünya popülasyonunda sosyal, psikolojik ve finansal yükü artırmaktadır (2).
Diabetus mellitus genetik ve çevresel risk faktörlerinin kombinasyonundan kaynaklanır. Ancak direkt olarak kalıtılan Diyabetin nadir formlarıda vardır. Bunlar MODY ve mitokondriyal DNA daki mutasyondan kaynaklı diyabetleri içerir (2).
ACE genotiplerinin olası etkilerinin genel değerlendirilmesi, yapılan çalışmalarda ortaya konmaya çalışılmıştır. Bu bağlamda yapılan çalışmalarda Anjiyotensin dönüştürücü enzim (ACE) aktivitesi delesyon tipi polimorfizm için homozigot olan bireylerde (D/D) en yüksek, insersiyon tipi polimorfizm için homozigot (I/I) ve heterozigot (I/D) olan bireylerde en düşük olduğu bilinmektedir. Bu nedenle ACE düzeyi daha yüksek olan kişiler yani D aleli için homozigot bireyler anjiyotensin II’ye bağlı risklere I alleli taşıyan homozigot ve heterozigot bireylere göre daha fazla maruz kalırlar (24). Son yıllarda ACE gen polimorfizminin hastalıklarla ilişkisi olup olmadığı çok sayıda araştırmanın konusu olmuştur. ACE geni DD polimorfizmi ile diyabetik nefropati, fokal segmental glomerülosklerozis ve Immunglobulin A nefropatisi gibi hastalıklarını kapsayan çok sayıda böbrek hastalıkları arasında pozitif bir ilişki gösterilmiştir (4,5).
Bu çalışmanın amacı; diyabetik çocuk hastalarda ACE ve AT1R gen polimorfizmlerinin hastalığın kliniği, prognozu ve klinik bulgularıyla bir ilişkinin
olup olmadığının araştırılması olmuştur. Çocuk yaş gruplarında bu konu ile ilgili olarak fazla çalışma yapılmamış olmasından dolayı, bu yaş grubundan elde edilecek sonuçların bu konudaki bilgileri ortaya çıkarmaya ve literatüre yeni katkılar yapmaya yönelik olacağı düşünülmektedir.
2. GENEL BİLGİLER
2.1. Diabetes Mellitus’un Tarihçesi
Diyabet ile ilgili ilk kayıtlar MÖ 1550’li yıllarda Mısır’da yazılmış bir el yazmasında bulunmuştur. El yazmasında şeker hastalığına benzer, çok idrara çıkma ile seyreden bir durumdan bahsedilmiştir. Hindular da böcek, sinek ve karıncaların bazı insanların idrarının yapıldığı yere toplandığını kaydetmiştir. Günümüzde tıp kaynaklarında kullanılan, “Diabetes” ve “Mellitus” kelimeleri Yunanca akıp gitmek anlamına gelen dia-betes ve bal kadar tatlı anlamına gelen mellitus kelimelerinden türetilmiştir. Diabetes kelimesi ilk kez Anadolu topraklarında, Kapadokya’da MS 2. yüzyılda Arateus tarafından kullanılmıştır. Arateus şeker hastalığını idrar miktarında artma, aşırı susama ve kilo kaybının olduğu bir hastalık olarak tanımlamıştır (3).
2.2. Diabetes Mellitus’un Tanımı
Diyabet, insülin eksikliği ya da insülin etkisindeki düzensizlikler nedeniyle organizmanın karbonhidrat, yağ ve proteinlerden yeterince yararlanamadığı, sürekli tıbbi bakım gerektiren, kronik bir metabolizma hastalığı olduğu kabul edilmektedir (6).
Diabetes mellitus karakteristik olarak susuzluk, aşırı idrara çıkma, iştahsızlık, ağırlık kaybı, görüş bozukluğu gibi klasik belirtiler ve hastalığa spesifik retinopati, nöropati, nefropati gibi komplikasyonlar ile tespit edilebilir (7,8). Aynı zamanda çok ciddi durumlarda etkili tedaviden yoksun olan ketoasidoz ve non ketotik hiperglisemide koma ve ölüme sebep olabilir (7).
Her ne kadar DM için birçok spesifik neden tespit edilmişse de yaygın olarak bilinen tiplerin etiyolojisi ve patogenezi daha az anlaşılmıştır. Diyabet vakalarının çokluğundan dolayı tip 1 ve tip 2 olmak üzere iki ana etiyopatogenetik kategoriye ayrılmıştır(7).
Çocukluk yaş grubunda sık görülen Tip 1 DM; T-hücrelerinin aracılığıyla insülin üretiminde görev alan pankreasın beta hücrelerinin süregelen otoimmün veya otoimmün dışı nedenlerle zedelenmesi sonucu gelişen insülin eksikliği ile karakterize diyabet türüdür (9,10,11).
Tip 2 DM pankreas beta hücre fonksiyonlarının ileri düzeyde zarar görmesi sonucu kas, yağ ve karaciğer gibi organlarda insülinin etkilerine direnç gösterilmesi ile karakterize bir bozukluktur (12).
2.3. Epidemiyoloji
Diabetes mellitus dünya populasyonunun yaklaşık %7-11,4 ünü etkileyen en yaygın bir endokrin hastalıktır (13,14).
Diyabet 21. Yüzyılın en büyük global sağlık problemlerinden biridir. Her yıl daha fazla insan hayat standartlarını değiştiren komplikasyonlarla sonuçlanan bu durumu yaşamaktadır. Şu anda 415 milyon yetişkinin diyabet hastası olduğu tahmin edilmektedir. Gelecekte hastalık gelişimi riski yüksek olan, glukoz tolerans bozukluğuna sahip 300-320 milyon yetişkin vardır. 2040 da 642 milyon diyabet hastası olacağı tahmin edilmektedir (14).
Tip 1 diyabet daha az yaygındır. Özellikle çocuklar arasında her yıl %3 civarında artış yaşanmaktadır. Her yıl yaklaşık 86,000 çocukta tip 1 diyabet görülmektedir. Dünyada 542,000 çocuğun tip 1 diyabet olduğu tahmin edilmektedir (14).
Tip 1 ve tip 2 diyabetin her ikisininde patogenezinde çevresel faktörler etkin rol oynamaktadır (13). Tip 1 diyabet prevalansında etnik ve coğrafik farklılıkların etkisi rapor edilmiştir (17). Rapor edilen en yüksek tip 1 diyabet oranı İskandinav ülkelerindedir. Finlandiya 0-14 yaş aralığındaki çocuk popülasyonuyla en yüksek orana sahipken, Asya, Afrika ve Latin Amerika da en düşük oran söz konusudur (18). Bu farklar genetik varyasyon ve çevresel faktörlerden kaynaklı olduğu düşünülmektedir (19,20).
International Diabetes Federation (IDF) 2015 verilerine göre Türkiye de ulusal diyabet prevalansı %12.5 olup; 9500 çocuğun tip 1 diyabet hastası olduğu tahmin edilmektedir.
Türkiye’ de diyabet epidemiyolojisi için yapılan en kapsamlı çalışma 1997-1998 yılları arsında TURDEP-I ve 2010 yılında TURDEP-II çalışması yapılmıştır. TURDEP-I e göre yetişkinlerde diyabet prevalansı %7,2 tespit edilmiştir (15). TURDEP-II de yapılan çalışmada diyabet prevalansının %13,7 ye ulaştığı görülmüştür. TURDEP-II çalışması sonucu ülkemizde 12 yılda diyabet sıklığının %90 arttığı gözlemlenmiştir. (16).
2.4. Tanı ve Sınıflandırma
DM’un tanı ve sınıflandırılması için kriterler 1979 ve 1980 de Dünya Sağlık Örgütü (WHO) ve Amerikan Ulusal Veri Grubu (NDDG) tarafından ortaya konmuştur. 1985 te WHO tarafından küçük değişiklikler yapılmıştır (21).
Diyabet ve glukoz metabolizmasının diğer bozukluklarının tanımlanması ve sınıflandırılmasında günümüze kadar birçok değişiklik yapılmıştır. Bunlardan ilki 1997 yılındaki Amerikan Diyabet Birliği (ADA) tarafından yapılan yeni tanı ve sınıflandırma kriterleridir. Bunun ardından Dünya Sağlık Örgütü (WHO) tarafından 1999 yılında bu kriterlerde küçük değişiklikler yapılarak kabul etmiştir. Daha sonra IDF ve WHO tarafından 1999 kriterlerinin korunması gerektiği 2006 yılı sonlarında yayınlanan rapora göre benimsenmiştir. En son 2007 yılında ADA ve Avrupa
Diyabet Çalışma Birliği (EASD) tarafından yayınlanan raporlara göre 2003 yılındaki düzenlemenin değişmemesi gerektiği kararlaştırılmıştır (6).
Diyabet ve glukoz metabolizmasının diğer bozukluklarının tanımlanması için kullanılan 2003 ve 2010 yıllarına ait değişiklikleri de içeren tanı belirteçleri Tablo 1’de görülmektedir (6).
Tablo 1. DM ve glukoz metabolizmasının diğer bozukluklarında tanı kriterleri (6).
Aşikar DM İzole
IFG(**) İzole IGT IFG + IGT DM RiskiYüksek
APG (≥8 st açlıkta) ≥126 mg/dl 100-125mg/dl <100 mg/dl 100-125mg/dl -OGTT 2.stPG (75 g glukoz) ≥200 mg/dl <140 mg/dl 140-199 mg/dl 140-199 mg/dl -Rastgele PG ≥200 mg/dl + Diyabet semptomları - - - -A1C(***) ≥%6.5 (≥48 mmol/mol) - - - %5.7-6.4 (39-46 mmol/mol)
ADA’ ya göre Diyabetes mellitus’ un en kolay tanısı açlık durumunda venöz plazma glukoz düzeyinin birbirini izleyen en az 2 ölçümde 126 mg/dl veya daha yüksek olması ile konulabilir. Yine günün herhangi bir saatinde açlık ve tokluk durumuna bakılmaksızın randomize venöz plazma glukozunun 200 mg/dl’ nin üzerinde olması ve susuzluk, aşırı idrara çıkma, iştahsızlık, ağırlık kaybı gibi belirtilerin varlığı ve ikinci bir ölçüm ile doğrulama kaydıyla tanı konulabilir. Açlık plazma glukoz düzeyi 100 mg/dl üstünde olan ve diyabet açısından yüksek risk grubundaki bireylerde oral glukoz tolerans testi (OGTT) yapılarak bozulmuş glukoz toleransı veya diyabet araştırılmalıdır (8).
ADA, IDF, EASD (Avrupa Diyabet Çalışma Birliği) ve Uluslararası Klinik Kimyacılar Federasyonu (IFCC) temsilcilerinden oluşturulan Uluslararası Diyabet Uzmanlar Komitesi 2008 yılında yaptıkları bir dizi değerlendirme sonucunda, diyabet tanısı için uluslararası standardizasyon kurallarına uyulması koşulu ile HbA1c kesim noktasını %6,5 (48 mmol/mol) olarak belirlenmiştir (61).
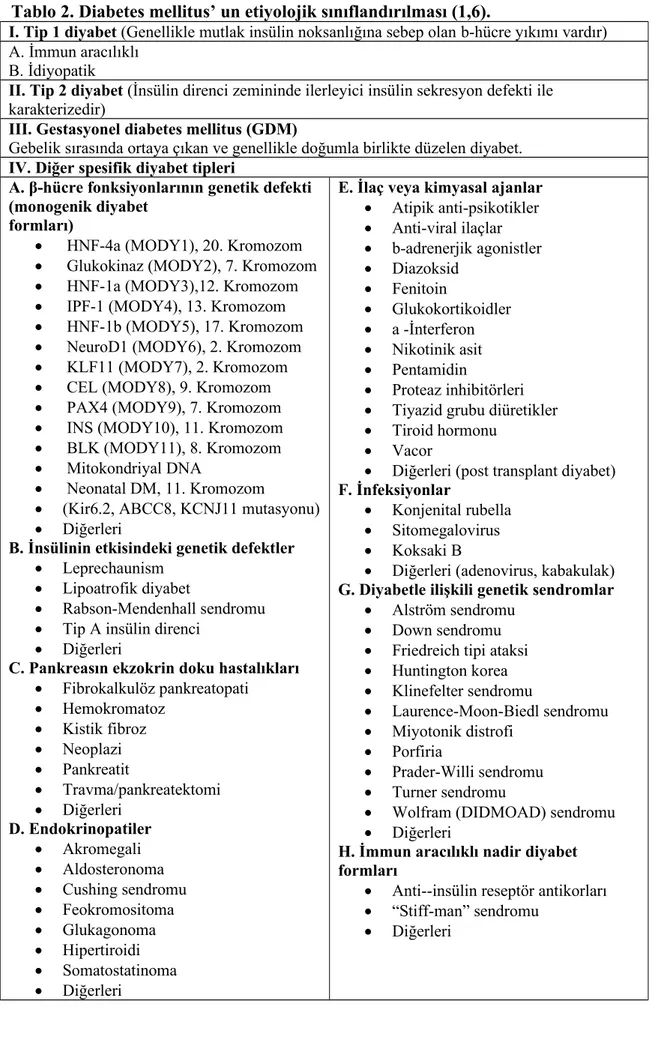
Tablo 2. Diabetes mellitus’ un etiyolojik sınıflandırılması (1,6).
I. Tip 1 diyabet (Genellikle mutlak insülin noksanlığına sebep olan b-hücre yıkımı vardır) A. İmmun aracılıklı
B. İdiyopatik
II. Tip 2 diyabet (İnsülin direnci zemininde ilerleyici insülin sekresyon defekti ile karakterizedir)
III. Gestasyonel diabetes mellitus (GDM)
Gebelik sırasında ortaya çıkan ve genellikle doğumla birlikte düzelen diyabet. IV. Diğer spesifik diyabet tipleri
A. β-hücre fonksiyonlarının genetik defekti (monogenik diyabet
formları)
HNF-4a (MODY1), 20. Kromozom Glukokinaz (MODY2), 7. Kromozom HNF-1a (MODY3),12. Kromozom IPF-1 (MODY4), 13. Kromozom HNF-1b (MODY5), 17. Kromozom NeuroD1 (MODY6), 2. Kromozom KLF11 (MODY7), 2. Kromozom CEL (MODY8), 9. Kromozom PAX4 (MODY9), 7. Kromozom INS (MODY10), 11. Kromozom BLK (MODY11), 8. Kromozom Mitokondriyal DNA
Neonatal DM, 11. Kromozom
(Kir6.2, ABCC8, KCNJ11 mutasyonu) Diğerleri
B. İnsülinin etkisindeki genetik defektler Leprechaunism
Lipoatrofik diyabet
Rabson-Mendenhall sendromu Tip A insülin direnci
Diğerleri
C. Pankreasın ekzokrin doku hastalıkları Fibrokalkulöz pankreatopati Hemokromatoz Kistik fibroz Neoplazi Pankreatit Travma/pankreatektomi Diğerleri D. Endokrinopatiler Akromegali Aldosteronoma Cushing sendromu Feokromositoma Glukagonoma Hipertiroidi Somatostatinoma Diğerleri
E. İlaç veya kimyasal ajanlar Atipik anti-psikotikler Anti-viral ilaçlar b-adrenerjik agonistler Diazoksid Fenitoin Glukokortikoidler a -İnterferon Nikotinik asit Pentamidin Proteaz inhibitörleri Tiyazid grubu diüretikler Tiroid hormonu
Vacor
Diğerleri (post transplant diyabet) F. İnfeksiyonlar
Konjenital rubella Sitomegalovirus Koksaki B
Diğerleri (adenovirus, kabakulak) G. Diyabetle ilişkili genetik sendromlar
Alström sendromu Down sendromu Friedreich tipi ataksi Huntington korea Klinefelter sendromu Laurence-Moon-Biedl sendromu Miyotonik distrofi Porfiria Prader-Willi sendromu Turner sendromu
Wolfram (DIDMOAD) sendromu Diğerleri
H. İmmun aracılıklı nadir diyabet formları
Anti--insülin reseptör antikorları “Stiff-man” sendromu
2.5. Diyabet ve genetik
Birinci derece akrabalar arasında genel popülasyonun ilişkisiz bireylerine göre tip 1 diyabet gelişimi daha yüksektir (yaklaşık olarak sırasıyla %6 ve %1) (30). Bu veriler hastalık gelişiminde genetik faktörlerin etkisi olduğunu düşündürmektedir. Mevcut olarak tip 1 diyabetin genetik yatkınlığı ile ilişkili olduğu düşünülen genomun 20 den fazla bölgesi vardır. Ancak hiçbiri 6. Kromozomun HLA bölgesindeki genlerden doğan tip 1 diyabet üzerindeki etkiyi göstermemektedir. Bu bölge immün cevaptan sorumlu olduğu bilinen birkaç yüz gen içerir. Bunlardan hastalıkla ilişkisi çok kuvvetli olan HLA class II genleridir.
Tip 1 diyabetle alakalı bazı genler şunlardır: IDDM1 (HLA class II genleri) INS (İnsülin geni)
CTLA-4 (cytotoxic T lymphocyte-associated 4)
Tip 2 diyabetin kalıtsal olduğu uzun zamandır bilinmektedir. Aile çalışmaları; birinci derece akraba olan bireylerde, ailede pozitif hastalık öyküsü olmayanlara göre 3 kat daha fazla hastalık gelişimi olduğunu göstermiştir (31,32,33). Aynı zamanda monozigot ikizlerde %60-90 arasındaki uyumluluk (konkordans) oranı dizigot ikizlerden önemli ölçüde yüksektir. Bu yüzden tip 2 diyabetin önemli genetik bileşenlere sahip olduğu açıktır.
Tip 2 diyabetle alakalı bazı genler şunlardır: PPARγ
ABCC8 CAPN10 KCNJ11U
Hastalığın genetik yatkınlığını belirlemek için kullanılan bir diğer yaklaşımda aday genlerin belirlenmesine dayanmaktadır (34,35). Aday genler, pankreatin β hücre fonksiyonu, insülin etkisi/glukoz metabolizması ya da diğer metabolik şartlar (enerji alış-verişi, lipid metabolizması vb.) gibi Tip 2 diyabet riskini artırdıkları düşünülen genler arasından seçilmektedir. Günümüze kadar dünya çapında Tip 2 diyabet için 50 den fazla gen çalışılmıştır.
2.5.1. MODY (Gençlerde Görülen Erişkin Tip Diyabet )
Genelde 25 yaş altında ortaya çıkan Tip 2 diyabetin yaygın olmayan bir türüde MODY (Gençlerde Görülen Erişkin Tip Diyabet ) dir. MODY obezite, ketozis ve beta hücre otoimünitesi bulgularından yoksun ve semptonların yavaş başlangıçlı olmasıyla karakterizedir. Sıklıkla dışarıdan insülin alımına ihtiyaç duyulmadan yönetilmektedir. MODY otozomal dominant kalıtım gösterir (36). Moleküler genetikteki gelişmeler sayesinde MODY nin en az altı formu olduğu bilinmektedir. Bunların herbiri beta hücre fonksiyonuyla direkt olarak ilişkili farklı genlerde meydana gelen bir mutasyon sonucu oluşmaktadır (37). Tablo 3 te günümüze kadar tanımlanan MODY genlerinin listesi verilmiştir. MODY hastalarının % 15 inin bu genlerden herhangi birinde mutasyon taşımamalarından dolayı yakın gelecekte MODY e sebep olan diğer genler keşfedileceği düşünülmektedir (38,39,40).
Tablo 3. MODY genleri (60)
MODY1 HNF4A MODY2 GCK MODY3 HNF1A MODY4 IPF1 MODY5 HNF1B MODY6 UNEUROD1
Önümüzdeki on yıl içerisinde diyabetin bütün formlarının gelişim riskini artıran genler büyük olasılıkla bilinecektir. Bu nedenle bilim adamları, sağlık profesyonelleri ve popülasyon üyeleri diyabet için tahmini genetik testin avantajlarını maksimize, dezavantajlarını minimize edeceklerini düşünecekler.
2.6. Anjiyotensin Konverting Enzim (ACE)
Anjiyotensin konverting enzim (kinaz II; peptidil dipeptidaz; EC3.4.15.1) iki fonksiyona sahiptir: anjiyotensin I’ i anjiyotensin II’ ye dönüştürür ve bradikinini inaktive eder. Akciğer, böbrek, hint domuzu plazması ve testisler enzimin en zengin kaynakları arasındadır. Vasküler endotelyal hücreler ve böbrek proksimal tübüler hücrelerin fırça kenarları yüksek enzim konsantrasyonu içerir. Sentetik peptid inhibitörlerin mevcudiyeti normal ve patolojik şartlarda enzimin fonksiyonunun oluşturulmasında birçok yardımı olur (22).
2.6.1. Tarihçe
ACE, 1950 lerin ortalarında Renin Anjiyotensin Sisteminin (RAS) geleneksel bileşenlerinden sonuncusu olarak tanımlanarak bulunmuştur. Aslında ACE, fizyolojist Robert Tigerstedt tarafından reninin tanınmasından 50 yıl sonra bulunmuştur (23).
ACE, 1950 lerin ortalarında anjiyotensini saflaştırma ve tanımlamak için Cleveland ve London kliniklerindeki araştırma gruplarıyla yarışan Leonard T. Skeggs, Jr. Skeggs ve meslektaşları Joseph Kahn ve Norman Shumway tarafından keşfedilmiştir.
ACE, 1966 yılında Erdös ve Yang tarafından bradikinin indirgeyici enzim olarak ikinci kez keşfedilmiştir.
1971 de rat hücrelerindeki ACE enzim aktivitesini gösteren bir çalışmada çalışılan bütün hücrelerden epididimis ve testislerin en yüksek spesifik aktiviteye sahip olduğu saptanmıştır.
ACE, Corvol ve arkadaşları tarafından 1988 de insan endotelyel hücrelerinden ilk defa klonlanmıştır. 1989 da Bernstein ve arkadaşları tarafından fare böbrek hücrelerinden klonlanmıştır.
2.6.2. ACE yapısı ve fonksiyonu
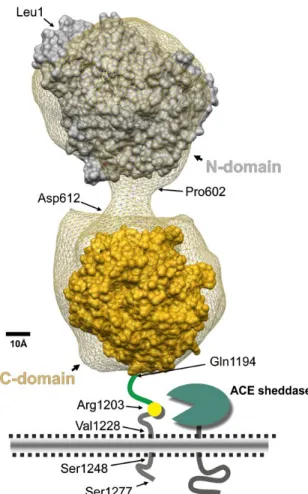
Memelilerde ACE’ nin iki izoformu mevcuttur. Bunlardan biri somatik dokularda (sACE, 1306 rezidü) diğeri erkek testislerinde germinal hücrelerde (gACE, 732 rezidü) eksprese edilir. Bu iki form; gACE tek bir aktif bölge içerirken sACE iki aktif bölge içermesiyle birbirinden ayrılır. Somatik protein tandem duplikasyon ile transle olur. Bu duplike yapı N-domain ve C-domain olmak üzere iki domainli bir protein oluşturur. Her iki protein formuda C- domain tarafından kodlanan hidrofobik transmembran bağ ile bağlı tip 1 c-terminal membran bağlantılı ektoenzimdir. Her iki form aynı zamanda N-terminalde, endoplazmik retikulumdan geçmek için gereken sinyal peptide sahiptir (25).
Molekülün karbonhidrat içeriğine bağlı olarak Endotelyal anjiyotensin konverting enzimin moleküler ağırlığı 140-160 kd iken, testiküler form ise 90-100 kd arasındadır (26).
Şekil 4. Anjiyotensin konverting enzim yapısı
Şe kil 5. Anjiyotensin konverting enziminin 3 boyutlu yapısı yapısı (28)
ACE anjiyotensin I’ in Anjiyotensin II’ ye dönüştürülmesi ya da Bradikinin indirgenmesinde olduğu gibi C-terminalden dipeptidin uzaklaştırlmasıyla pepditleri hidroliz eder. Aynı zamanda amidleşmiş C-terminal peptidlerin ayrılmasında görüldüğü gibi bir endopeptidaz gibi davranabilir (25).
ACE’ nin mevcut olarak iki önemli aktivitesi vardır. Bunlar substratının carboksil-terminalinden(C-terminal) dipeptidi ayıran pepdidil dipeptidaz olması ve amidlenmiş c-terminal substratlar üzerine endopeptidaz olarak aktivite göstermesidir. ACE fonksiyonunun en önemli göstergesi katalitik ayrılma sonucu Anjiyontensin I den vazokonstriktür peptid olan Anjiyotensin II’ ye dönüşümünde anahtar enzim olmasıdır (45,53,54). ACE aynı zamanda inaktif anjiyotensin(1-9) peptidini vazodilatör metobolit olan anjiyotensin(1-7) peptidine hidroliz eder (55) ve ek olarak vazodilatör olan bradikinin ve kallidinin inaktive olmasını sağladığı düşünülmektedir (55,56). Ayrıca multifonksiyonel P ve kolesistokinin üzerine endopeptidaz etki gösterir ve lüteinleştirici hormon salınımını yapan hormonu düşürebilir (45,57).
2.6.3. Renin – Anjiyotensin Sistemi (RAS)
Renin-Anjiyotensin sistemi; kan basıncı, akışkanlığı ve elektrolit homeostasizini düzenleyen önemli regülatörlerden biridir. Bu sistemin birincil elemanları anjiyotensinojen, renin, anjiyotensin konverting enzim, anjiyotensin II ve anjiyotensin II reseptörlerinden oluşur (26).
Anjiyotensinojen, geniş globular protein olup renin için substrat görevi görür. Renin, anjiyotensinojenin protelitik dönüşümünü gerçekleştirerek Anjiyotensin I’ in oluşumunu sağlayan bir enzimdir. Anjiyotensin konverting enzim Anjiyotensin I’ i oktapeptid olan Anjiyotensin II’ ye dönüştürür. Anjiyotensin II’ nin kendisi ve reseptörleri Anjiyotensin II’ nin hücresel etkilerini iletmekten sorumludurlar. Bu enzimatik kaskadın son ürününün reseptörlerine bağlanmasıyla vazokonstriksiyona, aldesteron ve katekolamin salınımına, prolaktin ve adrenokortikotropik hormonun salgılanmasına ve glikojenolize aracılık eder (26).
Şekil 3. Renin-anjiyotensin-aldesteron sistemi (29)
Ang I’ in kan basıncına etkisi varsa çok azdır ama ACE tarafından potansiyel vasopressör olan Ang II’ ye dönüştürülür. Ang II, G protein bağımlı iki reserptör olan AT1 ve AT2 aracılığıyla etkisini gösterir (45).
2.6.4. ACE Geni
Şekil 5. ACE geninin lokasyonu (42)
Peptidaz M2 ailesine ait olan (43) ACE geni insanlarda 17. Kromozomun uzun kolunda lokalize olmuştur (şekil 5). ACE geninin klonlanmasıyla; intron 16 da ACE serum seviyelerini etkilediği görünen 287 bç lik bir insersiyon/delesyon polimorfizminin tanımlanmasına olanak sağlanmıştır (4).
Bu gen 21 kb uzunluğunda ve yaklaşık 88 bç ile 481 bç içeren 26 ekzon ve 25 intron içerir. ACE geninden iki tip mRNA transkribe olur. Uzun endotelyal ACE mRNA (4.3 kb uzunluğunda) ekzon 13 hariç 1 den 26 ya kadar olan ekzonlardan transkribe olur. 3 kb uzunluğundaki testiküler ACE mRNA ekzon 13 ten 26 ya kadar olan ekzonlardan transkribe olur (25,41).
sACE 1-12 ve 14-26 ekson bölgerinden transkript edilirken daha kısa form olan gACE 13-26 ekson bölgesinden kodlanır. sACE’nin promotoru genin 5’ ucunun ilk eksonuna, germinal formun promotoru ise 12. intronuna yerleşmiştir (41).
ACE geninin organizasyonu Tablo 4 te gösterilmiştir. Tablo 4. ACE Geninin organizasyonu
Sitogenetik lokasyonu 17q23.3
Moleküler lokasyonu 63,477,061 ile 63,498,380 baz çifti arasında (Homo sapiens Annotation Release 107, GRCh38.p2)
Gen uzunluğu (kb) 21
Ekzon sayısı 26 (88-481 bç uzunluklarında) İntron sayısı 25 (150 bç-2 kb uzunluklarında) mRNA uzunluğu (kb) sACE 4.3 kb gACE 3 kb
başlangıç kodonu
sACE Promotörü Başlangıç kodonundan 22 baz yukarıda pürin nükleotidi (G)
TATA kutusu TATA transkripsiyon başlangıç noktasından 37 baz yukarıda lokalize olmuştur
2.6.5. ACE Polimorfizmi
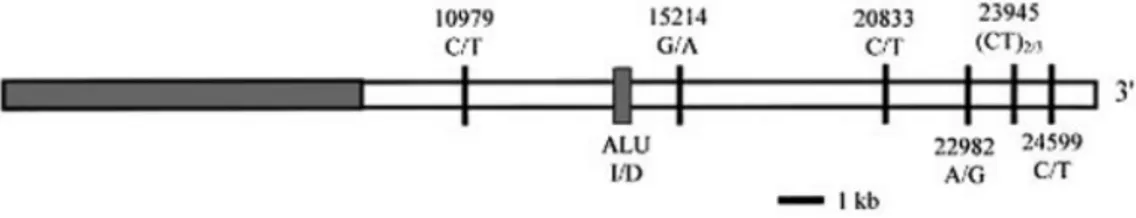
ACE geni üzerinde konuşlanmış 10 adet biallelik polimorfik bölge bilinmektedir. Bu bölgelerin listesi şekil 6 de gösterilmiştir.
Şekil 6. ACE polimorfizmleri (44)
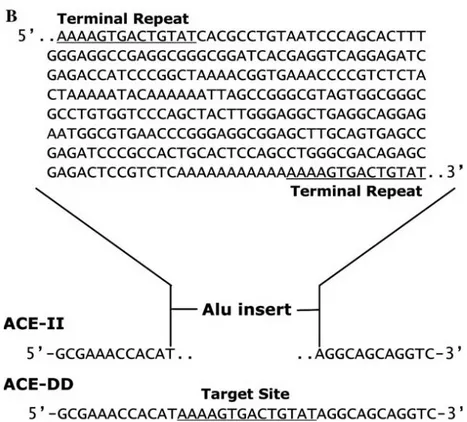
ACE geni intron 16 da 287 baz çiftlik Alu repeat sekansının varlığı (insersiyon) ya da yokluğu (delesyon) sonucunda ortaya çıkan İnsersiyon/Delesyon polimorfizmi ile karakterizedir. Bu polimorfizmde 3 farklı genotip ortaya çıkmaktadır. Bunlar homozigot DD, Heterozigot ID ve homozigot II genotipleridir (46,51).
Şekil 6. Alu repeat sekansının yerleşimi (44)
I ve D genotipleri serum ACE konsantrasyonuyla ilişkilendirilmiştir. DD genotipli bireyler ortalama en yüsek serum ACE seviyesine (ortalama 494.1 ± 88.3 µg/l) sahipken, II genotipli bireyler en düşük ortalamaya (299.3 ± 49 µg/l) sahiptir ve heterozigot bireyler (ID) ise ara bir değere (392.6 ± 66.8 µg/l) sahiptir (23).
Şekil 8. Alu repeat bölgesinin yapısı
ACE genindeki delesyon polimorfizminin miyokardiyal infarktüs riskini artırdığı ileri sürülmüştür. Bundan dolayı yapılan bazı çalışmalarda da DD genotipinin dezavantaj olduğu gösterilmiştir ve farklı klinik alanlarda ve hastalıklarda modifiye klinik sonuçlar verdiği de gözlenmiştir (46).
2.6.6. Anjiyotensin II tip 1 reseptör (AT1R) Geni ve Polimorfizmi
İnsanlarda Anjiyotensin bağlayıcı reseptörlerin (AT1 ve AT2) en az iki alt tipi bilinmektedir. Bu alt tipler belirli ligandları bağlama yeteneklerine göre tanımlanmışlardır. Her ikiside yedi sarmallı bölgesi ile transmembran reseptör grubundadır ve G-proteinine bağlıdırlar. AT1 hipertrofi, vazokonstriksiyon ve sempatik sinir uçlarından katekolaminlerin serbestleşmesini içeren Ang II’ nin fizyolojik aksiyonlarına aracılık eder (46).
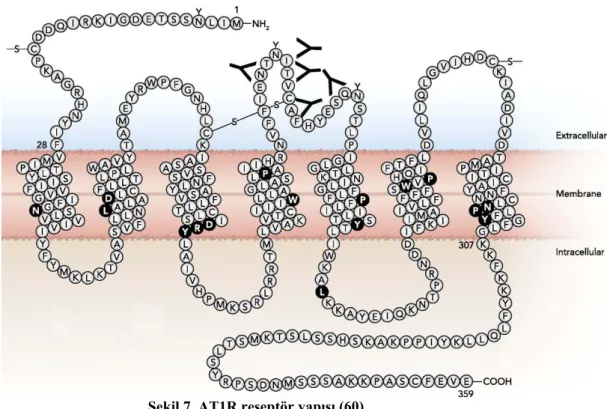
Şekil 7. AT1R reseptör yapısı (60)
Ang II’ nin olumsuz etkileri (vazokontriksiyon, kardiyak ve vasküler hipertrofi) AT1 reseptörü aracılığı ile iletilmektedir. Buna karşılık AT2 reseptörü genellikle tam tersi bir etkiye sahiptir (45).
Ang II fizyolojik etkilerini dokuların plazma membranlarında yerleşmiş bulunan spesifik reseptörlerine bağlanarak gösterir. Reseptörün peptit tarafından tanınmasında peptiti oluşturan aminoasitlerin sırası önemlidir. Ang II’ nin Anjiyotensin Reseptör 1 (AT1) ve Anjiyotensin Reseptör 2 (AT2)olmak üzere iki farklı reseptörü vardır. Her iki alt tip reseptörün bir çok farklı dokuda (beyin, böbreküstü, böbrek, kalp) bulunduğu bildirilmiştir. Bu alt tip reseptörlerin dağılış oranları da dokudan dokuya farklılık gösterir. Reseptörlerin dokulardaki heterojen dağılımı, dokunun Ang II’ ye yanıtını önemli ölçüde etkilemektedir. (47)
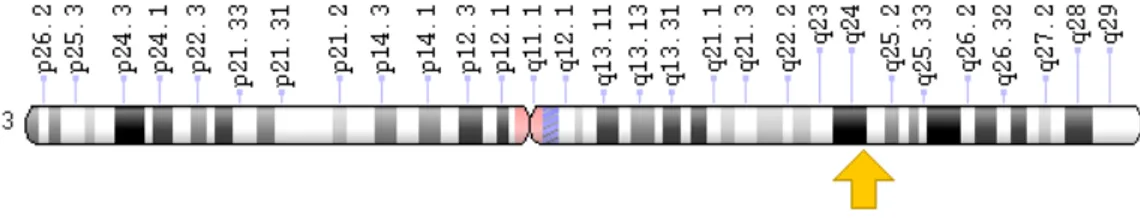
AT1R geni 3. kromozomun q kolunda lokalize olan bir gendir (şekil 9). AT1R gen polimorfizmi ekson 5 bölgesinde 1166. pozisyonunda adenine/cytosine (A/C) yer değiştirmesiyle karakterizedir (48).
Şekil 10. AT1R gen lokasyonu(52)
AT1R geninin organizasyonu tablo 5 te gösterilmiştir. Tablo 5. AT1R geninin lokasyonu
Sitogenetik lokasyonu
3. Kromozomun q kolunun 24 bölgesinde (3q24) Moleküler
lokasyonu
3. Kromozom üzerinde148,697,871 bç 148,743,003 baz çiftine kadar (Homo sapiens Annotation Release 107, GRCh38.p2) Gen uzunluğu (kb) 445.123 Ekzon sayısı 5 İntron sayısı 4
Renin-anjiyotensin mekanizmasının bir diğer polimorfizmi de Anjiyotensin II tip 1 reseptörünün A116C polimorfizmidir. Anjiyotensin II bu reseptör üzerinden çoklu fizyolojik etkinin yanı sıra, kan basıncının düzenlenmesini AT1R üzerinden yapmaktadır. Genellikle AT1R gen polimorfizmi kardiyovasküler fenotiplerle ilişkilidir (50).
Ang II tip 1 reseptör (AT1R) A1166C polimorfizmi genin 1166 pozisyonundaki Adeninin (A) sitozine (C) transversiyonu sonucu oluşur ve genin 39. kodlanmayan bölgesinin sonunda lokalize olmuştur. AT1R-C allel frekansının hipertansiyon hastalarında yükseldiği görülmüştür (46) ve aynı zamanda hipertansif hastalarda aortik sertliği artırmasıylada ilişkilendirilmiştir (47).
3. MATERYAL VE METOD 3.1. Materyal
3.1.1. Hasta ve kontrol grupları
Dicle Üniversitesi Hastanesi Çocuk Sağlığı ve Hastalıkları Anabilim Dalı Endokrinoloji bölümüne başvurmuş ve diyabet tanısı almış 3-15 yaş aralığında kız ve erkeklerden oluşan 75 hasta (1.grup) ve diyabeti olmayan, metabolik sendrom kriterleri bulunmayan, koroner arter hastalığı olmayan, tiroid, böbrek ve karaciğer hastalığı olmayan 3-15 yaş aralığında kız ve erkeklerden oluşan 50 sağlıklı kişiden (2.grup) bilgilendirilip izinleri alınmak suretiyle kan örnekleri alınmıştır.
3.1.2. Kan örnekleri
Çalışma grubundaki bireylerden 12 saat açlık sonrası etilendiamintetraasetik asit (EDTA) li tüplere alınan 5-10 ml kan örnekleri DNA ekstraksiyonu yapılmak üzere -20 C’de saklandı. Hemoliz olan serum örnekleri çalışmaya dahil edilmedi. HDL, LDL, total kolesterol, glukoz düzeyleri için ise 12 saat açlık sonrası antikoagulan jelli biyokimya tüplerine alınan kan örnekleri santrifüj edildikten sonra çalışılarak sonuçlar elde edildi.
3.1.3. Kullanılan solusyonlar ve tamponlar 1. Lysis Buffer (Reaktif A) pH 8.0
10 mM TRİS hidroklorür (TRİS-HCL) 320 mM Sucrose
5 mM magnezyum klorür
Otoklav edilir ve % 1 Triton-X100 eklenir.
2. Reaktif B pH 8.0
400 mM TRİS-HCL 60 mM EDTA 150 mM NaCl
3. Sodyum Perklorate
5 M Sodium Perklorate
4. Taq DNA polimeraz Tamponu (10X )
100 mM Tris-HCl 10 mM Magnezyum klorür 500 mM potasyum klorür % 1 Triton X-100 5. dNTP karışımı (pH 7.4) 2 mM dATP 2 mM dTTP 2 mM dCTP 2 mM dGTP
6. 10 X Tris-Borik asit-EDTA (TBE) Elektroforez Tamponu
90 mM Tris-borik asit
10mM Sodium-EDTA pH 8.3
7. 10 X Agaroze Jel Elektroforezi Yükleme Karışımı
10% Glycerol
2.5% (w/v) Ficoll (type 400) 1mM EDTA
3.1.4. 1X TBE tamponu hazırlanışı
Elektroforez tankı ve agaroz jel için kullanılan daha önceden hazırlanmış 10 X TBE çözeltisinden 1 X TBE tampon çözeltisi hazırlandı. 1 X TBE tamponu hazırlamak için 900 ml distile suya 100 ml 10X TBE tamponu eklenmiştir (9).
3.1.5. Agaroz jel hazırlanışı
%2’lik agaroz jel hazırlamak için 2 gram agaroz hassas terazide tartılıp, mezürde ölçülen 100 ml 1 X TBE çözeltisine ilave edilerek mikrodalgada ısıtılmıştır. Agarozun erimesi ile homojen bir karışım elde edildikten sonra, mikrodalgadan çıkarılan beherin sıcaklığı ortalama 60°C’ye indirildikten sonra içerisine 1 μL Etidium bromür (EtBr) ilave edilerek elektroforez tankına döküldü.
3.2. Metod
3.2.1. Periferik kandan DNA izolasyon yöntemi
Sodium EDTA’lı tüplere 5-10 ml kan alınır. Santrifüj 4C için ön soğutmaya hazırlanır. 5-10 ml kan 50 ml’lik polypropylene santrifüj tüplerine aktarılır ve üzerine 35-40 ml lysis buffer eklenir (Reaktif A). Elle hafifçe 2 dakikalık bir süre için karıştırılır. 4C de 10 dakika süre ile 3000 rpm de santrifüj edilir. Pelletteki hücrelere zarar vermeksizin süpernatant dökülür.
Tüplere 2 ml Reaktif B eklenir ve hafifçe karıştırarak hücre çökeltilerin çözülmeleri sağlanır. Bu süspansiyon daha sonra 15 ml’lik kapaklı polypropylene tüplerine aktarılır.
Her bir tüpe 5M’lık Sodium Perklorat’tan 500 l eklenir ve tüpler kan döndürme (rotary mix) cihazına konur, oda ısısında 15 dakika süre ile karışması sağlanır. Tüpler 30-35 dakika 65C’lik sıcak blokta inkübe edilir.
Her bir tüpe daha önceden -20C’de bırakılan kloroform’dan 2 ml eklenir. 10 dakikalık süre için oda sıcaklığında rotary mix'e konur. Bunun ardında 10 dakika 1400 rpm de santrifüj edilir.
DNA içeren faz (üstteki berrak tabaka) plastik pastör pipetleri kullanılarak 15 ml’lik yeni bir santrifüj tüpüne aktarılır. DNA içeren volümün 2 katı kadar soğuk etanol (daha önceden -20C’de bırakılmış, yaklaşık 2 ml) ilave edilir. Hafifçe karıştırarak DNA’nın presipite olması sağlanır. Plastik öze ile presipite olan DNA alınır ve 3-5 dakika dışarda bekletilerek kuruması sağlanır. Daha sonra 1.5 ml’lik ependorf tüplerine 200 l TE buffer konur. Üzerinde DNA’nın kuruması sağlanan plastik öze kesilir ve içinde TE buffer bulunan tüpe konur.
3.2.2. Polimeraz zincir reaksiyonu (PCR) ile örneklerin çoğalması
ACE geni I/D polimorfizmi ve AT1R geni A1166-C poimorfizmi için eksonların PCR ile çoğaltılması için 50 l’lik hacimde PCR karışımı hazırlandı. Her bir örnek için 32.5 l H2O, 0.5 ünite Taq Polimerase enzimi (Vivantis) (0.5 l), Taq
Polimeraz enziminin çalışması için gereksinim duyduğu 5 l 10X PCR buffer (50 mM KCL, 100 mM Tris-HCl Ph 9.0 25C de), 25 mM 3 l MgCl2, 2 mM 5 l
dNTP’s, 200 ng 2 l primer (1 l primer forward ve 1 l primer reverse) ile karışım elde edildi. Kişilere ait hedef DNA 100-150 ng olacak şekilde 2 l PCR karışımına eklendi. Buharlaşmanın engellenmesi için karışımın üzerine 30 l mineral yağ damlatılarak örneklerin Techne PHC3 thermal cyclerda amplifikasyon işlemleri gerçekleştirildi.
3.2.2.1. ACE I/D polimorfizmi PCR aşaması
ACE I/D polimorfizmi için; 2 μl genomik DNA (100 ng), her bir primerden (Forward ve Reverse) 1 μl (10 pmol/μl) (0.2 μM), 5 μl Taq Buffer (10 X), 3 μl MgCl2 (25 mM), 5 μl dNTP (2.5 mM), ve 0.5 μl Taq DNA Polimeraz enzimi (5
u/μl) PCR grade suyla toplam hacim 50 μl olacak şekilde tamamlanarak PCR gerçekleştirilmiştir. ACE geni I/D polimorfik bölgesinin amplifikasyonu için 5’F-CTG GAG ACCACT CCC ATC CTT TCT- 3’ ve 5’R-GAT GTG GCC ATC ACA TTC GTC AGA T-3’ primerleri kullanılmıştır. ACE I/D polimorfizminin, uygun primerlerle yapılan PCR’ının thermocycler programı; 95°C’de 3 dk. başlangıç denatürasyonunu takiben 94°C’de 1 dk. denatürasyon, 55 °C’de 1 dk. Primer bağlanması, 72 °C’de 1 dk. uzama (35 döngü) ve son olarak 72 °C’de 10 dk. final uzaması şeklinde referans alınan kaynaktan modifiye edilerek gerçekleştirildi (62).
10 μl amplifiye PCR ürünü ile 2 μl loading dye ile karıştırılarak %2’ lik agaroz jele yüklenerek 100 V’da 45 dk. kadar yürütüldü. 190 ve 490 baz çifti (bç) uzunluğundaki bantların varlığı kontrol edilmiştir. Bu polimorfizm sonucu üç bant gözlenir. Bunlar DD genotipi 190 bç, II genotipi 490 bç ve ID genotipi 190-490 bç olmak üzere iki banttır. (şekil 11)
Şekil 11. ACE bant bölgeleri
3.2.2.2. ACE geni DD genotiplerinin doğruluk kontrolü
ACE geni DD genotiplerinin doğruluk kontrolü için ; 2 μl genomik DNA (100 ng), her bir primerden (F ve R) 1 μl (10 pmol/μl) (0.2 μM), 5 μl Taq Buffer (10 X), 3 μl MgCl2 (25 mM), 5 μl dNTP (2.5 mM), ve 0.5 μl Taq DNA Polimeraz enzimi
(5 u/μl) PCR grade suyla toplam hacim 50 μl olacak şekilde tamamlanarak PCR gerçekleştirilmiştir. 5-TGG GAC CAC AGC GCC CGCCAC TAC–3 ve 5 -TCG CCA GCC CTC CCA TGC CCA TAA–3) primerleri kullanılmıştır. ACE I/D polimorfizminin, uygun primerlerle yapılan PCR’ının thermocycler programı; 95°C’de 10 dk. başlangıç denatürasyonunu takiben 94°C’de 30 sn. denatürasyon, 67 °C’de 30 sn. hibridizasyon, 72 °C’de 30 sn. uzama (30 döngü) ve son olarak 72 °C’de 5 dk. final uzaması şeklinde referans alınan kaynaktan modifiye edilerek gerçekleştirildi (63). 10 μl amplifiye PCR ürünü ile 2 μl loading dye ile karıştırılarak %2’ lik agaroz jele yüklenerek 100 V’da 45 dk. kadar yürütüldü. 335 baz çifti (bç) uzunluğundaki D bantların varlığı kontrol edilmiştir. Tespit edilen 355 bç uzunluğundaki bantın mevcudiyeti I (insersiyon) allelinin doğruluğunu tespit
etmemizde yardımcı olmuştur. Bantın yokluğu DD genotipini doğrulamaktadır. (şekil 12)
Şekil 12. ACE geni DD genotiplerinin doğruluk kontrolü bant bölgeleri
3.2.2.3. Anjiotensin II tip I reseptör (ATR1R) A1166C polimorfizmi PCR aşaması
AT1R geni A1166-C polimorfizmi için; 2 μl genomik DNA (100 ng), her bir primerden (F ve R) 1 μl (10 pmol/μl) (0.2 μM), 5 μl Taq Buffer (10 X), 3 μl MgCl2
(25 mM), 5 μl dNTP (2.5 mM), ve 0.5 μl Taq DNA Polimeraz enzimi (5 u/μl) PCR grade suyla toplam hacim 50 μl olacak şekilde tamamlanarak PCR gerçekleştirilmiştir. 5’-GCT TTG TCT TGT TGC AAA AGG–3’ ve 5’-CCC ACT CAA ACC TTT CAA–3’ primerleri kullanılmıştır. AT1R A1166-C polimorfizminin, uygun primerlerle yapılan PCR’ının thermocycler programı; 95°C’de 3 dk. başlangıç denatürasyonunu takiben 94°C’de 1 dk. denatürasyon, 55 °C’de 1 dk. hibridizasyon, 72 °C’de 1 dk. uzama (35 döngü) ve son olarak 72 °C’de 10 dk. final uzaması şeklinde referans alınan kaynaktan modifiye edilerek gerçekleştirildi (63). 10 μl amplifiye PCR ürünü ile 2 μl loading dye ile karıştırılarak %2’ lik agaroz jele yüklenerek 100 V’da 45 dk. kadar yürütülerek PCR ürününün amplifikasyonunun varlığı kontrol edilmiştir.
3.2.3. PCR ürünlerinin restriksiyon enzimleri ile kesimi
AT1R geni A1166-C polimorfizmi için elde edilen PCR ürünleri retriksiyon enzimleriyle kesilerek polimorfizmin varlığı tespit edilmiştir. 15 μl’lik amplifiye PCR ürünü, 0.5 μl Ddel (sigma) restriksiyon enzimi (10 u/μl) ve 5 mg bovine serum
albumin ile son hacim 25 μl’ye tamamlanacak şekilde bidistile su ilave edilerek; 37 °C’de gece boyunca inkübasyona bırakılarak kesim sağlandı (64). Enzim kesim ürününden 10 μl alınarak üzerine 2 μl 6X yükleme tamponu karışımı ilave edilerek, % 2’lik agaroz jelde 100 bp DNA moleküler marker (Fermentas) ile 100 V’da 1 saat yürütülüp, ultraviyole transilluminatur ile değerlendirildi. Kesim ürünleri, CC genotipi 143-, 106- ve 47- bç, AA genotipi 249-, 47- bç’lik ve AC genotipi bantları vermiştir. (şekil 13)
Şekil 13. AT1R gen polimorfizmine ait bant bölgeleri
3.2.4. Agaroz jel elektroforezi
PCR sonrası spesifik amplifikasyonun ve PCR artefaktlarının olup olmadığının kontrol edilmesi için agaroz jel kullanıldı. Amplifikasyonun incelenmesi için % 2’lik ve % 1’ lik agaroz jeli hazırlandı ve örnekler agaroz jel işlemine tabii tutuldu. 2 ve 1 gram agaroz tartılıp, beher içinde 1 X TBE tamponu ile 100 ml’ye tamamlandı. Manyetik karıştırıcılı ısıtıcıda kaynatıldı. Yaklaşık 50-55C'ye kadar soğutulduktan sonra üzerine konsantrasyonu 1 mg/l olacak şekilde etidyum bromid eklenip karıştırıldı. Jel soğuduktan sonra jel tabağına döküldü. Elektroforeze başlamadan önce tank, taraklar ve jel yatağı temizlendi. Tankın benç üzerindeki dengesi ayarlandı. Jel donduktan sonra elektroforez tankına yerleştirildi. Üzerine 1 X TBE elektroforez tamponu döküldü. 8 l PCR ürünü 2 l yükleme tamponu ile karıştırılarak jeldeki kuyucuklara yüklendi. Ayrıca her jelin bir kuyucuğuna 100 bç'lik size marker yüklendi. Yükleme işlemi bittikten sonra elektrodlar yerleştirilerek örnekler 30-45 dakika 80-100 V’ta yürütüldü. Yürütme işlemi tamamlandıktan sonra jel ultraviyole transilluminatör altında incelenerek amplifikasyonun başarılı olup olmadığı kontrol edildikten sonra jelin fotoğrafı çekildi.
3.2.5. İstatistiksel Analiz
Çalışmada elde edilen kategorik veriler yüzde ve frekans olarak, numerik veriler aritmetik ortalama ± standart sapma olarak ifade edildi. İstatistiksel analizler SPSS 21.0 programı (IBM SPSS Statistics 21 CLIENT) kullanılarak yapıldı. Kategorik verilerin analizinde Chi-kare testi, numerik verilerin analizinde t-testi kullanıldı. Anlamlılık düzeyi p<0.05 olarak kabul edildi.
ACE gen polimorfizm analiz sonuçları , alel frekansları ve genotiplendirme grupları Chi-kare ve Hardy-Weinberg istatistik yöntemleriyle değerlendirildi. Biyokimyasal parametrelerin verileri ACE gen polimorfizmi ile ilişkisi Student t-testi ile değerlendirildi.
4. BULGULAR
Çalışmamızdaki Diyabetes Mellitus’ lu hasta grubu ile sağlıklı kontrol grubuna ait yaşların ortalamaları ve standart sapma değerleri Tablo 6’da gösterilmiştir.
Tablo 6. Kontrol ve hasta gruplarının yaşa göre dağılımı
Kontrol (N=50)
Ort±SS Hasta (N=75)Ort±SS p
Yaş 9.0±3.2 10.2±3.5 0.065
Hasta grubunun yaş ortalaması 10.2±3.5, kontrol grubunun yaş ortalaması 9.0±3.2 bulunmuştur. Hasta ve kontrol grupları arasında yaş ortalamaları açısından istatistiksel olarak anlamlı bir fark saptanmamıştır (p>0.05).
Hasta grubu ile sağlıklı kontrol grubuna ait cinsiyetlerin yüzde olarak değerleri Tablo 7’de gösterilmiştir.
Tablo 7. Kontrol ve hasta gruplarının cinsiyete göre dağılımı Kontrol (N=50) n (%) Hasta (N=75) n (%) p X2 Cinsiyet Kız Erkek 25 (50.0)25 (50.0) 38 (50.7)37 (49.3) 0.942 0.005 Kontrol grubu 25’i kız (%50.0), 25’i erkek (%50.0) olmak üzere toplam 50 hastadan; hasta grubu ise 38’i kız (%50.7), 37’si erkek (%49.3) olmak üzere toplam 75 sağlıklı bireyden oluşmaktadır. Hasta ve kontrol grupları arasında cinsiyet açısından istatiksel olarak anlamlı bir fark saptanmamıştır.
Hasta ve kontrol grubunda yapılan çalışmada saptanan ACE ve AT1R gen polimorfizmlerine ait genotip ve allel frekansları Tablo 8 ve Tablo 9’da gösterilmiştir.
Tablo 8. ACE polimorfizmi Genotip ve allel frekansı I/D POL
Genotipi Kontrol N=50 N (%) Hasta N= 75 N (%) p X
2 DD 19 (38.0) 21 (28.0) 0.328 0.441 1.000 0.957 0.594 0 ID 25 (50.0) 44 (58.7) II 6 (12.0) 10 (13.3) Alleles D 63 (0.63) 86 (0.57) 0.371 0.371 0.8000.800 I 37 (0.37) 64 (0.43)
Çalışmamızda kontrol grubundaki 50 sağlıklı bireyden 19’unda (%38.0) ACE genotipi açısından DD genotipi, hasta grubunda 75 hastadan 21’inde (%28.0) DD genotipi tespit edildi. İki grup arasında istatiksel olarak anlamlı bir fark saptanmamıştır (p>0.05, X2=0.957). Kontrol grubunda 25 birey (%50.0), hasta
grubunda 44 bireyin (%58.7) ID genotipine sahip olduğu saptandı. İki grup arasında istatiksel olarak anlamlı bir fark saptanmadı (p>0.05, X2=0.594). Kontrol grubunda 6
birey (%12.0), hasta grubunda 10 (%13.3) birey II saptanmıştır. İki grup arasında istatiksel olarak anlamlı bir fark saptanmadı (p>0.05, X2=0).
Allel frekansları açısından bakıldığında kontrol grubundaki 50 hastada D alleli frekansı 63 (0.63) iken, hasta grubunda bu sayı 86 (0.57) idi. İki grup arasında istatistiksel olarak anlamlı fark saptanmadı (p>0.05, X2=0.800). Kontrol grubunda I
alleli frekansı 37 (0.37), hasta grubunda I alleli frekansı ise 64 (0.43) idi. İki grup arasında istatisitiksel olarak anlamlı fark saptanmadı (p>0.05, X2=0.800).
Tablo 9. AT1R polimorfizmi Genotip ve allel frekansı AT1R POL Genotipi Kontrol N=50 N (%) Hasta N= 75 N (%) p X2 AA 28 (56.0) 50 (66.7) 0.309 0.787 0.156 1.036 0.073 AC 18 (36.0) 24 (32.0) CC 6 (8.0) 1 (1.3) Alleles A 74 (0.74) 124 (0.83) 0.098 0.098 2.736 2.736 C 26 (0.26) 26 (0.17)
Çalışmamızda kontrol grubundaki 50 sağlıklı bireyden 28’inin (%56.0) AT1R genotipi AA, hasta grubunda ise 75 hastanın 50’sinin (%66.7) AA şeklinde olduğu saptandı. İki grup arasında istatiksel olarak anlamlı bir fark saptanmadı (p>0.05, X2=1.036). Kontrol grubunda 18 birey (%36.0), hasta grubunda 24 birey (%32.0) AC
genotipli olarak saptandı. İki grup arasında istatiksel olarak anlamlı bir fark saptanmadı (p>0.05, X2=0.073). Kontrol grubunda 6 bireyde (%8.0), hasta grubunda
1 bireyde (%1.3) CC genotipi saptandı. İki grup arasında istatiksel olarak anlamlı bir fark saptanmadı (p>0.05).
Allel frekansları açısından bakıldığında kontrol grubundaki 50 hastada A alleli frekansı 74 (0.74) iken, hasta grubunda bu sayı 124 (0.83) idi. İki grup arasında istatistiksel olarak anlamlı fark saptanmadı (p>0.05, X2=2.736). Kontrol grubunda C
alleli sayısı 26 (0.26), hasta grubunda C alleli sayısı ise 26 (0.17) idi. İki grup arasında istatisitiksel olarak anlamlı fark saptanmadı (p>0.05, X2=2.736).
Hasta ve kontrol gruplarında saptanan glukoz, HDL, LDL, total kolesterol düzeylerinin ortalama ve standart sapma değerleri Tablo 10’da gösterilmiştir.
Tablo 10. Kontrol ve hasta gruplarının glukoz, HDL, LDL, total kolesterol düzeyleri Kontrol (N=54) Ort±SS Hasta (N=75) Ort±SS p Glukoz (mg/dl) 88.1±8.9 306.1±139.8 0 Kolesterol (mg/dl) 178.1±36.5 170±36.1 0.227 HDL 39±11.4 49.1±13.5 0 LDL 82.3±18.8 93.3±26.5 0.008 HbA1c 10.5±2.9
Kontrol grubundaki 50 hastada bakılan glukoz değeri ortalaması 88.1±8.9, hasta grubunda 75 hastada bakılan glukoz değeri ortalaması ise 306.1±139.8 idi. Hasta grubunun glukoz değerleri ortalaması kontrol grubuna göre istatistiksel olarak anlamlı ölçüde yüksek saptandı (p=0).
Kontrol grubunun total kolesterol düzeyleri ortalaması 178.1±36.5 iken, hasta grubunda 178.1±36.5 olarak saptandı. İki grup arasında istatisitiksel olarak anlamlı bir fark saptanmadı (p>0.05).
Kontrol grubunda ölçülen HDL düzeyleri ortalaması 39±11.4, hasta grubunda ölçülen HDL düzeyleri ortalaması ise 49.1±13.5 idi. Bu iki grup arasında istatiksel olarak anlamlı bir fark saptandı (p=0).
Kontrol grubunun LDL ortalaması 82.3±18.8 iken, hasta grubunun ortalaması 93.3±26.5 olarak saptandı. İki grup arasında istatisitiksel olarak anlamlı bir fark saptandı (p<0.01).
Çalışmamızdaki kontrol ve hasta grupları dahil toplam 125 hastada bakılan ACE ve AT1R gen polimorfizmleri ile glukoz değerleri arasındaki ilişki tablo 11’de gösterilmiştir.
Tablo 11. ACE ve AT1R gen polimorfizmleri ile glukoz değerleri arasındaki ilişki
Glukoz 108 ve altı (N=49) n (%) Glukoz 109 ve üstü (N=76) n (%) p X2 I/D POL DD ID II 19 (38.8) 24 (49) 6 (12.2) 21 (27.6) 45 (59.2) 10 (13.2) 0.419 1.714 AT1R POL AA AC CC 27 (55.1) 18 (36.7) 4 (8.2) 51 (67.1) 24 (31.6) 1 (1.3) 0.110 4.416
Hasta ve kontrol gruplarının tamamında yapılan analize göre glukoz değeri 108 ve altı saptanan 49 bireyden 19’u (%38.8) ACE genotipi olarak DD, 24’ü (%49.0) ID, 6’sı (%13.6) II iken, glukoz değeri 109 ve üzeri saptanan 76 bireyin 21’i ( %27.6) DD, 45’i (%59.2) ID, 10’u (%13.2) II saptanmıştır. Glukoz değerleri farklı iki grup arasında ACE gen polimorfizmi açısından istatistiksel olarak anlamlı bir fark saptanmadı (p>0.05, X2=1.714).
Hasta ve kontrol gruplarının tamamında yapılan analize göre glukoz değeri 108 ve altı saptanan 49 bireyden 27’si (%55.1) AT1R genotipi olarak AA, 18’i (%36.7) AC, 4’ü (%8.2) CC iken, glukoz değeri 109 ve üzeri saptanan 76 bireyin 51’i ( %67.1) AA, 24’ü (%31.6) AC, 1’i (%1.3) CC saptandı. Glukoz değerleri farklı iki grup arasında ACE gen polimorfizmi açısından istatistiksel olarak anlamlı bir fark saptanmadı (p>0.05, X2=4.416).
Çalışmamızdaki kontrol ve hasta grupları dahil toplam 125 hastada bakılan ACE ve AT1R gen polimorfizmleri ile HDL değerleri arasındaki ilişki tablo 12’de gösterilmiştir.
Tablo 12. ACE ve AT1R gen polimorfizmleri ile HDL düzeyleri arasındaki ilişki
(N=21) n (%) (N=104) n (%) I/D POL DD ID II 8 (38.1) 11 (52.4) 2 (9.5) 32 (30.8) 58 (55.8) 14 (13.4) 0.763 0.541 AT1R POL AA AC CC 17 (80.9) 3 (14.3) 1 (4.8) 61 (58.7) 39 (37.5) 4 (3.8) 0.121 4.231
Hasta ve kontrol gruplarının tamamında yapılan analize göre HDL düzeyi 37 ve altı saptanan 21 bireyden 8’i (%38.1) ACE genotipi olarak DD, 11’i (%52.4) ID, 2’si (%9.5) II iken, HDL düzeyi 38 ve üzeri saptanan 104 bireyin 32’si (%30.8) DD, 58’i (%55.8) ID, 14’ü (%13.4) II idi. HDL düzeyleri farklı iki grup arasında ACE gen polimorfizmi açısından istatistiksel olarak anlamlı bir fark saptanmadı (p>0.05, X2=0.541).
Hasta ve kontrol gruplarının tamamında yapılan analize göre HDL düzeyi 37 ve altı saptanan 21 bireyden 17’si (%80.9) AT1R genotipi olarak AA, 3’ü (%14.3) AC, 1’i (%4.8) CC iken, HDL düzeyi 38 ve üzeri saptanan 104 bireyin 61’i (%58.7) AA, 39’u (%37.5) AC, 4’ü (%3.8) CC idi. HDL düzeyleri farklı iki grup arasında ACE gen polimorfizmi açısından istatistiksel olarak anlamlı bir fark saptanmadı (p>0.05, X2=4.231).
Çalışmamızdaki kontrol ve hasta grupları dahil toplam 125 hastada bakılan ACE ve AT1R gen polimorfizmleri ile total kolesterol değerleri arasındaki ilişki tablo 13’de gösterilmiştir.
Tablo 13. ACE ve AT1R gen polimorfizmleri ile total kolesterol düzeyleri arasındaki ilişki Kolesterol 199 ve altı
(N=106) Kolesterol 200 ve üstü(N=19) p X
I/D POL DD ID II 35 (33.0) 58 (54.7) 13 (12.3) 5 (26.3) 11 (57.9) 3 (15.8) 0.814 0.412 AT1R POL AA AC CC 67 (63.2) 35 (33.0) 4 (3.8) 11 (57.9) 7 (36.8) 1 (5.3) 0.890 0.232
Hasta ve kontrol gruplarının tamamında yapılan analize göre total kolesterol düzeyi 199 ve altı saptanan 106 bireyden 35’i (%33.0) ACE genotipi olarak DD, 58’i (%54.7) ID, 13’ü (%12.3) II iken, total kolesterol düzeyi 200 ve üzeri saptanan 19 bireyin 5’i (%26.3) DD, 11’i (%57.9) ID, 3’ü (%15.8) II idi. Total kolesterol düzeyleri farklı iki grup arasında ACE gen polimorfizmi açısından istatistiksel olarak anlamlı bir fark saptanmadı (p>0.05, X2=0.412).
Hasta ve kontrol gruplarının tamamında yapılan analize göre total kolesterol düzeyi 199 ve altı saptanan 106 bireyden 67’si (%63.2) AT1R genotipi olarak AA, 35’i (%33.0) AC, 4’ü (%3.8) CC iken, total kolesterol düzeyi 200 ve üzeri saptanan 19 bireyin 11’i (%57.9) AA, 7’si (%36.8) AC, 1’i (%5.3) CC idi. Total kolesterol düzeyleri farklı iki grup arasında AT1R gen polimorfizmi açısından istatistiksel olarak anlamlı bir fark saptanmadı (p>0.05, X2=0.232).
Çalışmamızdaki hasta grubundaki 75 bireyde bakılan ACE ve AT1R gen polimorfizmleri ile HbA1c değerleri arasındaki ilişki tablo 14’de gösterilmiştir.
Tablo 14. ACE ve AT1R gen polimorfizmleri ile HbA1c düzeyleri arasındaki ilişki
HbA1c %6.5 ve altı (N=5)
HbA1c %6.6 ve üstü (N=70)
n (%) n (%) I/D POL DD ID II 1 (20.0) 3 (60.0) 1 (20.0) 20 (28.6) 41 (58.6) 9 (12.8) 0.860 0.303 AT1R POL AA AC CC 3 (60.0) 2 (40.0) 0 (0) 47 (67.1) 22 (31.4) 1 (1.5) 0.898 0.214
Yalnız hasta grubunda yapılan analize göre HbA1c düzeyi %6.5 ve altı saptanan 5 hastadan 1’i (%20.0) ACE genotipi olarak DD, 3’ü (%60.0) ID, 1’i (%20.0) II iken, HbA1c düzeyi %6.6 ve üzeri saptanan 70 hastanın 20’si (%28.6) DD, 41’i (%58.6) ID, 9’u (%12.8) II idi. HbA1c düzeyleri farklı iki grup arasında ACE gen polimorfizmi açısından istatistiksel olarak anlamlı bir fark saptanmadı (p>0.05, X2=0.303).
Hasta grubunda yapılan analize göre HbA1c düzeyi %6.5 ve altı saptanan 5 hastadan 3’ü (%60.0) AT1R genotipi olarak AA, 2’si (%40.0) AC olup CC birey saptanmazken, HbA1c düzeyi %6.6 ve üzeri saptanan 70 hastanın 47’si (%67.1) AA, 22’si (%31.4) AC, 1’i (%1.5) CC idi. HbA1c düzeyleri farklı iki grup arasında ACE gen polimorfizmi açısından istatistiksel olarak anlamlı bir fark saptanmadı (p>0.05, X2=0.214).
5. TARTIŞMA
Bu çalışmada Diyabetes Mellitus’lu hasta ve kontrol gruplarında ACE ve AT1R gen polimorfizmlerinin Diyabetes Mellitus ile ilişkisinin olup olmadığı ve farklı
genotip gruplarında açlık glukozu, HbA1c, kolesterol ve HDL ile korelasyonu araştırılmıştır.
Bu çalışma 3-15 yaş aralığındaki kız ve erkek çocuklarından oluşan 75 hasta ve diyabeti olmayan 50 sağlıklı kişi ile yapılmıştır.
Hasta grubundaki 75 hastadan %50.7’si kız, %49.3’ü erkek; kontrol grubundaki 50 bireyin %50’si kız, %50’si erkeklerden oluşmaktadır.
Çalışmamızdaki hasta grubundaki 75 hastadan 21’inde (%28.0) ACE gen polimorfizmi açısından DD genotopi saptanırken, kontrol grubundaki 50 bireyden 19’unda (%38.0) DD genotipi saptandı. Her iki grup arsasında istatiksel anlamda bir fark saptanmadı (p>0.05). Hasta grubunda 44 birey (%58.7), kontrol grubunda 25 bireyde (%50.0) ID genotipi saptandı. İstatistiksel olarak anlamlı bir fark saptanmadı (p>0.05) . Hasta grubunda 10 birey (%13.3), kontrol grubundan 6 bireyde (%12.0) II genotipi saptandı. İstatistiksel olarak anlamlı bir fark saptanmadı (p>0.05) . Alsaeid ve arkadaşlarının 2004 yılında Kuveytli çocuklarda yaptıkları çalışmada hasta ve kontrol grupları arasında DD, ID ve II genotipleri açısından, araştırmamızda gözlendiği gibi istatiksel anlamda bir fark saptanmadığı gözlenmiştir. Hibberd ve arkadaşlarıda 1997’ de geniş yaş aralıklarında yaptıkları çalışmada anlamlı bir fark saptamamışlardır. Barkai ve arkadaşlarıda 2004 te yaptıkları çalışmada da istatiksel anlamda bir fark saptamamışlardır. Yapılan bu çalışmaların sonuçları çalışmamızın sonuçları ile uyumluluk göstermektedir. Zhou ve arkadaşlarının 2013 te yaptıkları çalışma yetişkin hipertansif diyabetik hastalarda DD genotipli hastalarda farklı sonuç elde etmişlerdir.
ACE geni allel frekanslarına baktığımızda hasta ve kontrol grupları arasında istatiksel anlamda bir fark saptanmadı (p>0.05) .
Çalışmamızdaki hasta grubundaki 75 hastadan 50’sinde (%66.7) AT1R gen polimorfizmi açısından AA genotopi saptanırken, kontrol grubundaki 50 bireyden 28’i (%56.0) AA genotipi saptandı. Her iki grup arsasında istatiksel anlamda bir fark saptanmadı (p>0.05). Hasta grubunda 24 birey (%32.0), kontrol grubunda 18 bireyde (%36.0) AC genotipi saptandı. İstatistiksel olarak anlamlı bir fark saptanmadı (p>0.05) . Hasta grubunda 1 birey (%1.3), kontrol grubundan 4 bireyde (%8.0) CC genotipi saptandı. İstatistiksel olarak anlamlı bir fark saptanmadı (p>0.05) . Yapılan bu çalışmamızda CC genotipi açısında istatiksel anlamda olmasada bir farklılık
saptandı (p=0.156) . İstatistiksel olarak anlamlı bir farkın çıkmaması hasta ve kontrol gruplarındaki birey sayılarının sınırlı olmasından kaynaklı olabileceğini düşündürmektedir. Mevcut literatürde bu alanda çocuk yaş grubu ve tip 1 diyabet üzerine yapılan bir çalışma bulunmadığından verilerimizi literatür temelinde tartışmanın imkanı olmamıştır.
AT1R geni allel frekanslarına baktığımızda hasta ve kontrol grupları arasında istatiksel anlamda bir fark saptanmadı (p>0.05) .
Çalışmamızda hasta grubunda bakılan açlık glukoz değerleri kontrol grubuna göre istatistiksel olarak anlamlı ölçüde yüksek bulundu (p=0). Total kolesterol düzeylerine bakıldığında kontrol grubu hasta grubuna göre istatiksel olarak anlamlı bir fark bulunmadı (p>0.05). HDL kolesterol açısından bakıldığında hasta grubu kontrol grubuna göre istatistiksel olarak anlamlı ölçüde yüksek bulundu (p=0). Yine LDL kolesterol açısından bakıldığında hasta grubu kontrol grubuna göre istatistiksel olarak anlamlı ölçüde yüksek bulundu (p<0.01). Alsaeid ve arkadaşlarının 2004 yılında yaptığı çalışmada da erişkin diyabetik hasta grubunda bakılan total kolesterol, HDL, LDL,düzeylerinin kontrol grubuna göre istatististiksel olarak anlamlı ölçüde farklı çıkması çalışmamızın sonuçlarını desteklemektedir. Bu sonuçlar, diyabetes mellitusun lipid profilinde olumsuz etkiler gösterdiğini orataya koymaktadır.
Çalışmamızdaki hasta ve kontrol gruplarında açlık glukoz düzeyleri ile ACE gen polimorfizmi arasındaki ilişki incelenmiştir. İstatiksel analiz sonucu glukoz düzeyi 109 ve üzeri olan bireyler ile 108 ve altı olan bireyler arasında ACE gen polimorfizmi açısından anlamlı bir fark saptanmadı (p>0.05).
Açlık glukoz düzeyleri ve AT1R gen polimorfizmi arasında istatiksel olarak anlamlı bir fark saptanmadı (p>0.05). Mevcut literatürde bu alanda çocuk yaş grubu ve tip 1 diyabet üzerine yapılan bir çalışma bulunmadığından sonuçlarımız tartışılamadı.
Çalışmamızdaki hasta ve kontrol gruplarında HDL kolesterol düzeyleri ile ACE gen polimorfizmi arasındaki ilişki incelenmiştir. İstatiksel analiz sonucu HDL kolesterol düzeyi 38 ve üzeri olan bireyler ile 37 ve altı olan bireyler arasında ACE gen polimorfizmi açısından anlamlı bir fark saptanmadı (p>0.05). Alsaeid ve arkadaşlarının yaptıkları çalışmada DD genotipine sahip bireylerin ID ve II genotipli bireylere göre farklılık gösterdiği ileri sürülmüştür. Çalışmamızda istatistiksel olarak