T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ ÇOCUK SAĞLIĞI VE HASTALIKLARI
ANABİLİM DALI Prof.Dr.SAVAŞ KANSOY
PREMATÜRE RETİNOPATİSİ MUAYENESİ SIRASINDA
SEREBRAL VE MEZENTER KAN AKIMLARININ
DEĞERLENDİRİLMESİ
UZMANLIK TEZİ
Dr. BURÇE EMİNE YAŞAR
Tez Danışmanı
Prof. Dr. NİLGÜN KÜLTÜRSAY
ii ÖNSÖZ
Uzmanlık eğitimim boyunca bilgi ve deneyimleri ile eğitimime katkıda bulunan, başta kliniğimiz Anabilim Dalı Başkanı Sayın Prof. Dr. Savaş Kansoy olmak üzere tüm hocalarıma ve uzmanlarıma,
Tanıştığım andan itibaren güleryüzünü ve sevgisini benden hiç esirgemeyen; başarılı bir tezim olması için görüşleri ile beni bilgilendiren ve yönlendiren; tezimin her aşamasında bilgisinden ve deneyiminden faydalandığım tez danışmanım ve hocam Sayın Prof. Dr. Nilgün Kültürsay’a,
Yenidoğan eğitimimde ve tezimle ilgili her konuda sonsuz yardımı ve desteği olan Sayın Prof. Dr. Mehmet Yalaz ve Doç. Dr. Özge Altun Köroğlu’na,
Yenidoğan eğitimimde bilimsel destekleri için tüm Neonatoloji Bilim Dalı Öğretim Üyeleri hocalarıma ve Neonatoloji Bilim Dalı uzmanlarına,
Tezimin başından sonuna kadar her aşamasında, hiçbir yardım isteğimi geri çevirmeyen, bana yol gösteren Uzm Dr. Fırat Ergin’e,
Tezimin istatistiklerini yapmamda yardımcı olan Biyoistatistik A.B.D. Başkanı Prof Dr. Mehmet Orman’a ve Araştırma Görevlisi Semiha Özgül’e
Birlikte çalışmaktan zevk aldığım ve zorlu eğitim sürecini daha yaşanılabilir kılan tüm asistan arkadaşlarıma,
Veri toplamamda yardımları olan tüm Yenidoğan Hemşirelerine,
Tez yazma sürecimde motivasyonu ile bana destek olan Mert Dörtkardeşler’e,
Tüm hayatım boyunca varlıkları ile güç aldığım, her durumda yanımda olan ve her konuda sonsuz destek veren sevgili annem ve babam, Hümeyra-Muzaffer Yaşar’a,
Kendimi bildiğim günden beri, tüm zor anlarımda sığındığım en büyük liman olan, yalnız yürüdüğümü düşündüğüm yollarda bile arkamda sessizce desteğini hep sürdüren, daimi mutluluk kaynağım, canım ablam Tuğçe Yaşar Dündar’a
Sonsuz teşekkür ederim…
DR. BURÇE EMİNE YAŞAR 2016- İZMİR
iii ÖZET
Giriş ve Amaç
Prematüre retinopatisi (PR), preterm bebeklerde görme kaybına da neden olabilen ciddi bir klinik tablodur ve çocuklardaki görme problemlerinin %50’sine neden olmaktadır. Son yıllarda PR insidansında belirgin bir artış gözlenmiştir. Bu durum yenidoğan yoğun bakım ünitelerindeki gelişmeler sayesinde daha küçük gestasyonel haftalarda doğan bebeklerin yaşam şanslarının artmasına bağlanmaktadır. Bu nedenle preterm bebek izleminde, PR taramaları erken tanı ve tedavi açısından önem kazanmaktadır. PR muayenesi midriyatik damlalar ile pupil dilatasyonu sağlandıktan sonra indirek oftalmoskop ile yapılmaktadır. Pupil dilatasyonun sağlamak için kullanılan midriyatik damlaların sistemik emilimi ile yan etkiler görülebilmektedir. Apne, bradikardi, beslenme intoleransı en sık görülen yan etkiler arasındadır. Bu yan etkilerin; kullanılan ilaçlara veya muayenenin kendisine bağlı olarak serebral ve mezenter kan akımlarının bozulması nedeniyle geliştiği düşünülebilir. Bu çalışmada; prematüre bebeklerde düşük dozda kullanılan midriyatik damlaların ve PR muayenesinin serebral ve mezenter oksijenasyona etkisinin, tüm bu süreçte yapılacak NIRS (Near Infrared Spectroscopy) ölçümleri ile saptanması ve ayrıca gelişebilecek komplikasyonlar ile NIRS ölçüm değerleri arasındaki ilişkinin değerlendirilmesi amaçlanmıştır.
Gereç ve Yöntem
Eylül 2015-Temmuz 2016 tarihleri arasında 32.gestasyonel hafta ve altında doğan veya doğum ağırlığı 1500 gr ve altında olan ve PR muayenesi uygulanacak preterm bebekler çalışmaya alındı. Pupil dilatasyonu için 5 dakika ara ile iki kür olacak şekilde, her iki göze 1’er damla %0.625’lik fenilefrin ve %0.25’lik tropikamid damlatıldı. PR muayenesi öncesinden başlanarak, 48 saat sonrasına kadar sağ-sol serebral ve mezenter olmak üzere üç ayrı bölgeden simultane NIRS ölçümleri alındı. Ölçümler
iv medikasyonlardan 15 dakika önce ilk ölçüm olacak şekilde başlatıldı. Sonrasında iki kür medikasyon arasında, ikinci medikasyondan 15 dakika sonra, PR muayenesinden 15 dakika sonra ve medikasyonun 3./6./12./24./36./48. saatlerinde olacak şekilde toplamda her hastadan 10 ölçüm alındı. Ölçümler; “Premed”, “Med”, “Postmed”, “Postbakı”, “3.sa”, “6.sa”, “12.sa”, “24.sa”, “36.sa” ve “48.sa” olarak isimlendirildi. Yapılan serebral ve mezenter NIRS ölçümleri kullanılarak her bir zaman periyodu için SCOR (Splanknik-serebral oksijenasyon oranı) değerleri hesaplandı. Olgularda PR muayenesi sonrası gelişen komplikasyonlar kaydedildi ve NIRS ölçümleri ile arasındaki ilişki değerlendirildi. İstatistiksel analiz için SPSS 22.0 paket programı kullanıldı. Normal dağılım gösteren verilerin analizi için tekrarlayan ölçümlerde varyans analizi, normal dağılım göstermeyen değerler için ise non-parametrik test olan Brunner-Langer modeli kullanıldı. Anlamlı çıkan sonuçlarda Bonferroni düzeltmesi yapıldı. Kategorize verilerde de Pearson ki-kare ve Fisher tam olasılık testi kullanılarak analizler yapıldı.
Bulgular
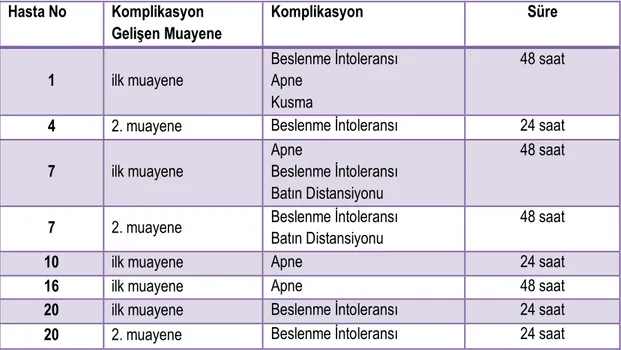
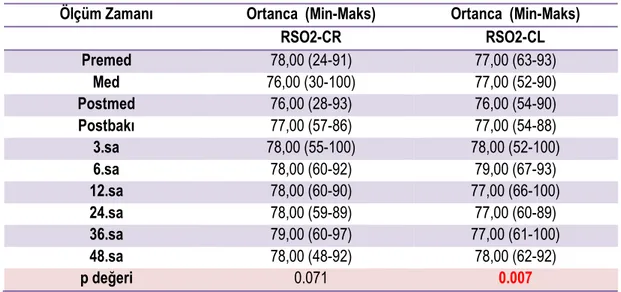
Çalışmaya 30 hastaya ait 61 PR muayenesi dahil edildi. Çalışmaya alınan olguların ortalama DA 1346,23(±496,00)gr, ortalama gestasyonel yaşı 29,40(±2,52) hafta idi. Düşük doz midriyatikle yeterli pupil dilatasyonu sağlandı. Yapılan 61 PR muayenesinin %9.8’sinde beslenme intoleransı görülürken, %6.5’inde apne komplikasyon olarak görüldü. Komplikasyonlar istatistiksel anlamlılık göstermemekle birlikte daha sıklıkla ilk muayene ertesinde oldu ve tümü 48 saat içinde sonlandı. Komplikasyon görülen grubun ortalama gestasyonel yaşı komplikasyon gelişmeyen gruba göre daha düşüktü(p:0.037). Kullanılan düşük doz midriyatikle açıklanabilecek şekilde literatüre göre daha düşük gestasyonel haftalarda ve daha düşük oranda komplikasyon izlendi. Tüm muayenelerdeki ölçümlerin ve vital bulguların zamansal değişimi değerlendirildiğinde, sadece RSO2-CL (Sol Serebral) ölçümünde postmed-3.saat ve postmed-6.saat ölçümleri arasında artış lehine anlamlı bir fark saptandı(p:0.007). Tüm grup için ilk ve tekrarlayan
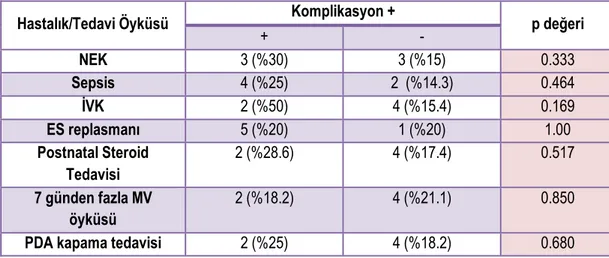
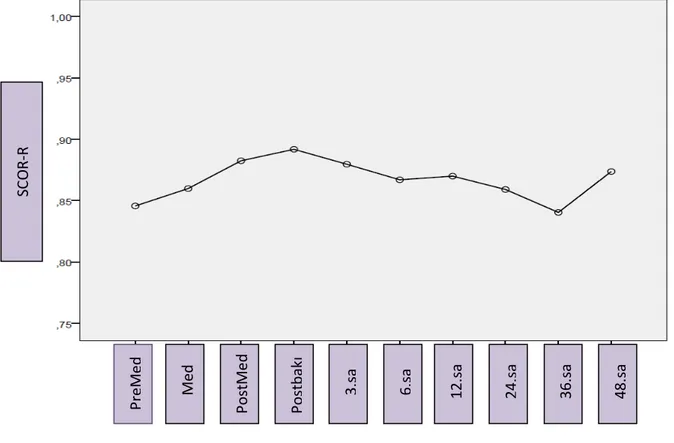
v muayenelerde ölçülen NIRS değerleri arasında anlamlı farklılık yoktu. Komplikasyon gelişen 6 olgunun ilk ve ikinci muayeneleri ayrıca değerlendirildiğinde ise; daha yüksek oranda komplikasyon görülen ilk muayenedeki RSO2-M (Mezenter) ölçümleri ve SCOR-R değerleri, ikinci muayene ölçüm ve değerlerine göre daha düşük saptandı(p değerleri sırasıyla; 0.043, 0.044). Düşüşün özellikle 6.saat sonrası belirginleştiği ve 24-36.saat sonrası düzeldiği görüldü; ancak zamansal değişimde istatistiksel fark saptanmadı (p değerleri sırasıyla: 0.338, 0.398).
Tartışma ve Yorum
Çalışmamız; PR muayenesi sonrası komplikasyonların NIRS ölçümleri ile değerlendirildiği ilk çalışmadır. Çalışmamızda PR muayenesinde pupil dilatasyonunu sağlayacak en düşük konsantrasyondaki midriyatik kullanmamızla açıklanabilecek şekilde literatüre göre daha düşük oranda sistemik yan etki izlenmiştir. Komplikasyonlar daha küçük bebeklerde ve istatistiksel anlama ulaşmasa da özellikle bebeklerin hafta olarak daha küçük olduğu ilk ölçümlerde daha sık izlenmiştir. Komplikasyon görülen bebeklerin özellikle ilk muayene ertesi NIRS ölçümlerinde mezenter RSO2 değerlerinde daha belirgin bir düşme izlenmiştir. Serebral NIRS değerlerinde tüm grupta özellikle sol kraniyal ölçümlerde anlamlılık kazanacak şekilde ilk saatlerdeki hafif düşmeyi izleyen ve 3-6. saatler içinde anlamlılık gösteren yükselme sempatomimetik göz damlalarının etkisine bağlanmış ve daha yüksek doz sempatomimetiklerin serebral etkilerinin daha belirgin olabileceğini düşündürmüştür.
Sonuç olarak prematüre bebeklerde ROP muayenesi öncesinde kullandığımız düşük doz sempatomimetikler etkin ve güvenilir bulunmuştur ve önerilebilir. Ancak PR muayenesinin 6. saatinde yapılacak NIRS incelemeleri ile, mezenter RSO2 değeri %70’in altında ve SCOR değeri 0.75’in altında olan bebeklerde muayene ertesinde beslenmeye yeniden başlanırken beslenme intoleransı ve apne açısından daha dikkatli olunması önerilebilir.
vi ABSTRACT
Introduction
Retinopathy of prematurity (ROP) is a serious clinical issue that may cause loss of vision in preterm infants and causes 50% of all vision problems in children. A significant increase in ROP incidence has been observed in recent years. This significant increase is thought to be due to recent advances in neonatal intensive care units and the increased survival of infants born at younger gestational age. Therefore, ROP screening is gaining importance for early diagnosis and treatment in the follow-up of preterm babies. Examination of the ROP is done by indirect ophthalmoscope after obtaining pupil dilation with mydriatic eye drops. Side effects of the mydriatic eye drops may be seen because of the systemic absorption. Apnea, bradycardia, feeding intolerance are some of the most common side effects. It is believed that these side effects occur due to the impaired cerebral and mesenteric blood flow caused by the drugs or examination itself. In this study, it is aimed to determine the effects of low dose mydriatic drops, used in ROP examination on the cerebral and mesenteric oxygenation of prematüre infants by using Near Infrared Spectroscopy (NIRS). It is also aimed to evaluate the relationship between complications and NIRS measurement results.
Materials and Methods
The infants born between September 2015-July 2016 and at 32 or earlier gestational weeks, with a birth weight of 1500 grams or less, and underwent ROP examination were included in the study. Two cycles -one drop in both eyes in a cycle- with an interval of five minutes of 0.625% phenylephrine and 0.25% tropicamide were applied for the dilation of the pupil. NIRS measurements were obtained on right and left cerebral regions and mesentery, started before the ROP examination and stand for post 48 hours. First NIRS measurements were obtained 15 minutes before the medications. NIRS measurements were then repeated at the time between
vii two cycles of medication, 15 minutes after the second medication, 15 minutes after ROP examination, and 3, 6, 12, 24, 36 and 48th hours of the medication. A total of 10 NIRS measurements were performed simultaneously at three different body region for every infant. The measurements were named as “Premed”, “Med”, “Postmed”, “Postexam”, “3rd h”, “6th h”, “12th h”, “24th h”, “36th h” and “48th h”. Splanchnic-cerebral oxygenation rate (SCOR) values were calculated for every time points by using cerebral and mesenteric NIRS measurements. Complications after the ROP examination were recorded and their relationship with the NIRS measurement results was investigated. In the statistical analysis, SPSS 22.0 software was used. In the analysis of the data showing a normal distribution, analysis of variance (ANOVA) was used. For the data not showing a normal distribution, Brunner-Langer model, which is a non-parametric test was used. Bonferroni correction was applied to the significant results. For the analysis of categorical data, Pearson chi-square and Fisher's exact test were used.
Results
Sixty one ROP examinations from 30 infants were included in the analysis. The infants had a mean birth weight of 1346.23 (±496.00) grams and gestational age of 29.40 (±2.52) weeks. Adequate pupil dilation was provided in all examinations with low dose mydriatics. After 61 ROP examination, rates of feeding intolerance and apnea were 9.8% and 6.5%, respectively. Complications were often seen following the first examination, but the difference was not statistically significant. All of the complications resolved in 48 hours. The mean gestational age of the infants who had complications were statistically significantly lower than the infants who had not (p=0.037). Complications were seen at a lower rate and gestational weeks in our group compared to the data from literature which may be explained with the low dose mydriatic usage. Temporal changes of measurements and vital signs were analyzed and there was statistically significant increase only for RSO2-CL (Regional Oxygen Saturation-left cerebral) values between 3rd h and 6th h measurements (p=0.007). There
viii was no statistically significant difference between NIRS results at first and repeated examinations for the whole group. However for the 6 infants who had complications, RSO2-M (Regional Oxygen Saturation-mesenteric) measurements and SCOR-R(Splanchnic-cerebral oxygenation rate-Right) values were statistically significantly lower at the time of first examination than the second one (p=0.043 and p=0.044, respectively). Reduction in these parameters was more pronounced after the 6th hour and recovered after 24-36th hour, but the temporal changes were not statistically significant (p=0.338 and p=0.398, respectively).
Discussion and comments
Our study is the first study that evaluates the complications of ROP examination with NIRS measurements. In present study, systemic complication rate was lower than the literature data and this may be explained with usage of the lowest dose of mydriatic that is sufficient to provide the pupil dilation. Complications were shown in the smallest infants and though not significantly in the first ROP examinations at which infants were in the lower postmenstrual ages. The mesenteric rSO2 measurements were sigificantly lowered in the first examinations of the 6 infants with complications compared to second examinations. Cerebral NIRS measurements were rapidly but insignificantly lowered in the whole group and recovered between 3-6 hours which reached a statistical significance in whole group in only the left cranial measurements. This effect was thought to be related to the sistemic effect of sympatomimetic eye drops used.The higher concentrations might have caused a more prominent effect on serebral oxygenation.
As a result low dose sympatomimetics we used, have been found effective and relatively safe in ROP examination of prematüre infants and is recommended. In the infants who have mesenteric RSO2 values lower than 70% and SCOR values lower than 0.75 at the 6 th hour of ROP examination, it may be recommended to be more careful at initiation of nutrition in terms of feeding intolerance and apnea.
ix İÇİNDEKİLER ÖNSÖZ ... ii ÖZET ... iii ABSTRACT ... vi KISALTMALAR DİZİNİ ... xi TABLOLAR DİZİNİ ... xiii ŞEKİLLER DİZİNİ ... xv 1. GİRİŞ ve AMAÇ ... 1 2. GENEL BİLGİLER ... 4 2.1. Prematüre Retinopatisi ... 4 2.1.1. Tanım ... 4 2.1.2. Epidemiyoloji... 4 2.1.3. Patogenez... 6 2.1.3.1. Faz-1 ... 7 2.1.3.2. Faz-2 ... 8 2.1.4. Risk Faktörleri ... 9 2.1.5. Sınıflandırma ... 11 2.1.5.1 Zon... 12
2.1.5.2. Yayılım Derecesi (Saat Kadranı)... 12
2.1.5.3. Vasküler Proliferasyon Derecesi (Evre) ... 13
2.1.5.4. “Plus Hastalık” Varlığı ... 14
2.1.6. Tedavi ... 15 2.1.6.1. Profilaktik Tedaviler ... 15 2.1.6.2. Önleyici Tedaviler ... 17 2.1.6.3.Düzeltici Tedaviler... 18 2.1.7. Prognoz ... 19 2.1.8. Tarama ... 20
2.1.8.1. Tarama Grubu ve Zamanlaması ... 20
2.1.8.2. İzlem Sıklığı ... 22
2.1.8.3. İzlemden Çıkarma ... 23
x
2.1.10.Pupil Dilatasyonu ... 25
2.2. NIRS (Near Infrared Sprectroscopy) ... 29
2.2.1. NIRS Kullanım Alanları ... 30
2.2.2. NEK ve NIRS ... 31
2.3. Splanknik-Serebral Oksijenasyon Oranı (Splanchnic-Cerebral Oxygenation Ratio / SCOR) ... 33
3. GEREÇ VE YÖNTEM ... 35 3.1. Çalışmanın Tasarımı ... 35 3.2. Pupil Dilatasyonu ... 36 3.3. PR Muayenesi ... 36 3.4. NIRS Ölçümleri ... 37 3.5. SCOR Hesaplamaları ... 38 3.6. Vital Bulgular ... 38 3.7. Komplikasyonlar ... 38 3.8. İstatistiksel Değerlendirme ... 40 4. BULGULAR ... 41 5. TARTIŞMA ... 66 6. SONUÇLAR ... 76 KAYNAKLAR ... 78 EKLER ... 97
Ek 1: Etik Kurul Onayı ... 97
Ek 2: Olgu Formu ... 100
Ek 3: Olgu Formu ... 102
xi KISALTMALAR
AACO : Amerikan Ortoptist Cemiyeti AAO : Amerikan Oftalmoloji Akademisi AAP : Amerikan Pediatri Akademisi
AAPOS : Amerikan Oftalmoloji ve Strabismus Cemiyeti
AGA : Appropriate for Gestational Age (Gestasyon Haftasına Göre Uygun Doğum Ağırlığı)
APROP : Agresif Posterior PR
BEAT-ROP : Bevacizumab Eliminates the Angiogenic Threat of Retinopathy of Prematurity
BPD : Bronkopulmoner Displazi C/S : Sezeryan Doğum
CL : Cerebral Left (Sol Serebral)
CR : Cerebral Right (Sağ Serebral)
CRYO-ROP : Cryotherapy for Retinopathy of Prematurity
ÇDDA : Çok Düşük Doğum Ağırlığı
DA : Doğum Ağırlığı
DDA : Düşük Doğum Ağırlığı
DİK : Dissemine İntravasküler Koagülasyon (Yaygın Damar İçi Pıhtılaşması)
DSÖ : Dünya Sağlık Örgütü ES : Eritrosit Süspansiyonu
ET-ROP : Early Treatment- Retinopathy of Prematurity GH : Gestasyonel Hafta
GMK : Germinal Martriks Kanaması
GY : Gestasyonel Yaş
ICROP : International Classification of Retinopathy of Prematurity IGF-1 : Insuline like Growth Factor-1 (İnsülin Benzeri Büyüme
Faktörü-1)
IGF-2 : Insuline like Growth Factor-2 (İnsülin Benzeri Büyüme Faktörü-2)
IGFBP3 : Insulin like Growth Faktor Binding Protein 3 (İnsülin Benzeri Büyüme Faktörü Bağlayıcı Protein-3)
xii İVK : İntraventriküler Kanama
KB : Kan basıncı
KN : Kardiyak Nabız
LGA : Large for Gestational Age (Gestasyon Haftasına Göre Yüksek Doğum Ağırlığı)
M : Mezenter
MAP : Mean Arterial Pressure (Ortalama Arter Basıncı) MV : MekanikVentilasyon
NEK : Nekrotizan Enterokolit NIRS : Near Infrared Spectroscopy
NSVD : Normal Spontan Vajinal Doğum
TND : Türk Neonatoloji Derneği TPN : Total Parenteral Nutrisyon PDA : Patent Duktus Arteriozus
Pİ : Perfüzyon İndeksi
PM : Postmenstruel
PR : Prematüre Retinopatisi RSO2 : Regional Oxygen Saturation RSO2-CR :Sağ Serebral NIRS ölçümü RSO2-CL :Sol Serebral NIRS ölçümü RSO2-M :Mezenter NIRS ölçümü
SCOR : Splanchnic - Cerebral Oxygenation Ratio (Splanknik-Serebral Oksijenasyon Oranı)
SCOR-R :Sağ SCOR SCOR-L :Sol SCOR
SGA : Small for Gestational Age (Gestasyon Haftasına Göre Düşük Doğum Ağırlığı)
SMA : Superior Mezenter Arter SO2 : Oksijen Saturasyonu
VEGF : Vasculer Endotelial Growth Factor (Vasküler Endotelyal Büyüme Faktörü)
xiii TABLOLAR DİZİNİ
Tablo 2.1. PR Risk Faktörleri ... 11
Tablo 2.2. Eşik Öncesi Hastalık Sınıflaması ... 14
Tablo 2.3. PR gelişimini engellemek amacıyla önerilen önlemler ... 16
Tablo 2.4. PR Tarama Zamanlaması ... 22
Tablo 2.5. NEK evrelemesi ... 32
Tablo 4.1. Çalışmaya alınan olguların demografik özellikleri ... 41
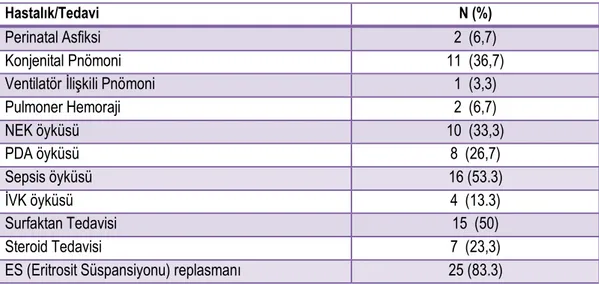
Tablo 4.2. Çalışmaya alınan olguların hastalık ve tedavi öyküleri ... 42
Tablo 4.3. Olguların PR muayenesi ertesinde gelişen komplikasyonları ve komplikasyonlar sonlanıncaya kadar geçen süreler ... 43
Tablo 4.4. Komplikasyon gelişen olguların demografik özellikleri ... 43
Tablo 4.5. Komplikasyon olan ve olmayan grupların DA ve GY karşılaştırması... 44
Tablo 4.6. İlk ve tekrarlayan muayenelerdeki komplikasyon oranları ... 44
Tablo 4.7. Olguların hastalık ve önceden gördüğü tedavi öykülerine göre komplikasyon görülme oranları ... 45
Tablo 4.8. RSO2-CR ve RSO2-CL ölçümlerinin ortanca ve minimum-maksimum değerleri ... 46
Tablo 4.9. RSO2-M ölçümlerinin ölçüm zamanlarına göre ortalamaları ... 48
Tablo 4.10. SCOR-R ve SCOR-L değerlerinin ölçüm zamanlarına göre ortalamaları ... 49
Tablo 4.11. KN değerlerinin ölçüm zamanlarına göre ortalamaları ... 51
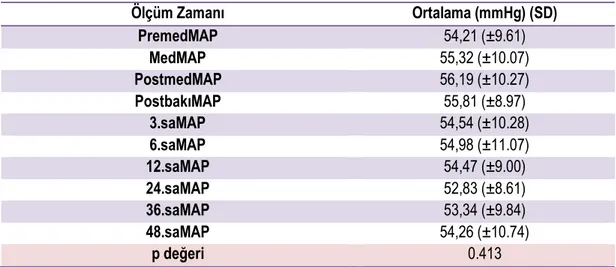
Tablo 4.12. MAP değerlerinin ölçüm zamanlarına göre ortalamaları ... 52
Tablo 4.13. Pİ değerlerinin ortanca ve minimum-maksimum değerleri ... 53
Tablo 4.14. SO2 değerlerinin ortanca ve minimum-maksimum değerleri ... 54
Tablo 4.15. Komplikasyon gelişen ve gelişmeyen gruplar arası fark, zamansal değişim ve interaksiyon p değerleri ... 55
xiv Tablo 4.16. Komplikasyon olan ve olmayan gruplarda KN ortanca
değerleri ... 56 Tablo 4.17. NEK öyküsü olan ve olmayan gruplarda; gruplar arası
fark, zamansal değişim ve interaksiyon p değerleri ... 59 Tablo 4.18. İlk muayene ve tekrarlayan muayeneler için; gruplar
arası fark, zamansal değişim ve interaksiyon p değerleri ... 60 Tablo 4.19. İlk muayene ve tekrarlayan muayenelerdeki Pİ ortanca
ve min-maks değerleri ... 61 Tablo 4.20. Komplikasyon görülen 6 hastada ilk muayenedeki
(grup1) ve 2. muayenedeki (grup2) NIRS ve vital bulguların farkı, zamansal değişim ve interaksiyon p
değerleri ... 62 Tablo 4.21. Komplikasyon görülen olguların 1. ve 2.
muayenelerindeki RSO2-M ölçümlerinin ortalama ve
standart sapma değerleri ... 63 Tablo 4.22. Komplikasyon görülen olguların 1. ve 2.
muayenelerindeki SCOR-R ölçümlerinin ortalama ve
standart sapma değerleri ... 64 Tablo 4.23. Komplikasyon görülen olguların 1. ve 2.
muayenelerindeki SCOR-L ölçümlerinin ortalama ve
xv ŞEKİLLER DİZİNİ
Şekil 2.1. PR de IGF-1 ve VEGF nin rolü... 9
Şekil 2.2. Retinal zonların şematik gösterilmesi ... 12
Şekil 2.3. PR Evrelemesinin Şematik Gösterilmesi ... 13
Şekil 3.1. NIRS ölçüm zamanlarının şematik gösterilmesi ... 37
Şekil 4.1. RSO2-CR değerlerinin zamansal değişim eğrisi ... 47
Şekil 4.2. RSO2-CL değerlerinin zamansal değişim eğrisi... 47
Şekil 4.3. RSO2-M değerlerinin zamansal değişim eğrisi ... 48
Şekil 4.4. SCOR-R değerlerinin zamansal değişim eğrisi ... 50
Şekil 4.5. SCOR-L değerlerinin zamansal değişim eğrisi... 50
Şekil 4.6. KN değerlerinin zamansal değişim eğrisi ... 51
Şekil 4.7. MAP değerlerinin zamansal değişim eğrisi ... 52
Şekil 4.8. Pİ değerlerinin zamansal değişim eğrisi ... 53
Şekil 4.9. SO2 değerlerinin zamansal değişim eğrisi... 54
Şekil 4.10. Komplikasyon olan ve olmayan gruplarda KN zamansal değişim eğrisi ... 56
Şekil 4.11. RSO2-CL ölçümleri için komplikasyon olan ve olmayan gruplardaki zamansal değişim eğrileri ... 57
Şekil 4.12. RSO2-CR ölçümleri için komplikasyon olan ve olmayan gruplardaki zamansal değişim eğrileri ... 58
Şekil 4.13. RSO2-M ölçümleri için komplikasyon olan ve olmayan gruplardaki zamansal değişim eğrileri ... 58
Şekil 4.14. RSO2-CL ölçümleri için NEK öyküsü olan ve olmayan gruplarda zamansal değişim eğrileri ... 59
Şekil 4.15. İlk muayene ve tekrarlayan muayenelerdeki RSO2-CL ölçümlerinin zamansal değişim eğrisi ... 60
Şekil 4.16. İlk muayene ve tekrarlayan muayenelerdeki Pİ değerlerinin zamansal değişim eğrisi ... 61
Şekil 4.17. Komplikasyon görülen olguların 1. ve 2. muayenelerindeki RSO2-M ölçümlerinin zamansal değişim eğrileri ... 63
xvi Şekil 4.18. Komplikasyon görülen olguların 1. ve 2.
muayenelerindeki SCOR-R ölçümlerinin zamansal
değişim eğrileri ... 64 Şekil 4.19. Komplikasyon görülen olguların 1. ve 2.
muayenelerindeki SCOR-L ölçümlerinin zamansal
1 1.GİRİŞ ve AMAÇ
Prematüre retinopatisi (PR); prematüre bebeklerde patogenezi tam açıklanamayan ratinal damarların anormal proliferasyonu ile giden klinik bir tablodur. Bu klinik tablo, oluşan yeni damarlarda fibrovasküler yapının daha yoğun olması nedeni ile ilerleyen evrelerde retina dekolmanına ve körlüğe neden olabilmektedir. Son dönemlerde başarılı tedavi yöntemlerinin artmasına ragmen, PR özellikle gelişmekte olan ülkelerde çocuklardaki görme kaybının major nedenleri arasındadır. Hastalığın insidansı ise; yenidoğan yoğun bakım ünitelerinin gelişmişlik düzeylerine göre değişmektedir. Ancak önceki yıllara göre PR insidansında belirgin artış gözlenmektedir. Bu durum yenidoğan ünitelerinin teknik özelliklerinin gelişmesi ve daha küçük gestasyonel haftalarda doğan prematüre bebeklerin yaşam şanslarının artmasına bağlanmaktadır.
Hastalığın patogenezinde 2 faz tanımlanmıştır. Faz 1’de tabloya hiperoksi hakimken, Faz 2’de hipoksi hakimdir. En çok suçlanan mediatörler ise VEGF (Vasküler Endotelyal Büyüme Faktörü) ve IGF-1’dir (İnsülin Benzeri Büyüme Faktörü-1). Multifaktöriyel bir hastalık olan PR için en önemli risk faktörleri düşük gestasyonel hafta ve düşük doğum ağırlığı olarak belirlenmiştir. Yüksek konsantrasyonda uzun süreli oksijen maruziyeti, 7 günden uzun süren mekanik ventilatör tedavisi, sepsis, sistemik mantar enfeksiyonları, intraventriküler kanama öyküsü, kan transfüzyonu öyküsü, hemodinamik anlamlı kardiyovasküler hastalıklar, bronkopulmoner displazi, hiperglisemi ve insulin kullanım öyküsü, postnatal yavaş kilo alımı, düşük kalori desteği ve düşük IGF düzeyleri de diğer önemli risk faktörleridir.
PR sınıflaması en son revizyonu 2005 yılında yapılan ICROP’a (International Classification of Retinopathy of Prematurity) göre yapılmaktadır. Sınıflandırmada; zon, evre, yayılım derecesi ve plus hastalık durumu belirtilmektedir. Tedavisi ise eşik hastalık tanımına göre yapılmaktadır. Yapılan çalışmalar, olguların %80-90’ında PR nin gerilediğini ve en önemli prognoz faktörünün ise olguların erken gestasyonel haftalarda ileri evre PR tanısı alması olduğunu göstermektedir. Bu nedenle olguların PR
2 taramalarının uygun zamanda yapılması ve PR evrelerine göre önerilen aralıklarla izlenmesi prognoz açısından önem taşımaktadır. PR tarama grubu ve zamanlaması; en son 2013 yılında revize edilen Amerikan Pediatri Akademisi (AAP), Amerikan Oftalmoloji Akademisi (AAO), Amerikan Oftalmoloji ve Strabismus Cemiyeti(AAPOS), Amerikan Ortoptist Cemiyeti(AACO) ortak görüşleri ile oluşturulan tarama-izlem önerilerine göre belirlenmektedir.
PR muayenesinin; pupil dilatasyonu için kullanılan medikasyon ve PR muayenesinin yan etkileri nedeni ile yenidoğan yoğun bakım ünitelerinde ve monitorize izlem eşliğinde yapılması önerilmektedir. PR muayenesinde uygun pupil dilatasyonu sağlanması tanı güvenilirliği açısından önemlidir. Yapılan çalışmalarda sempatomimetik olan fenilefrin ve parasempatolitik olan tropikamid veya siklopentolatın kombine kullanılması önerilmektedir. Ancak lokal olarak kullanılan bu damlalar konjonktiva ve nazolakrimal mukoza tarafından emilmekte ve sistemik yan etki oluşturmaktadır. Beslenme intoleransı, gastrik boşalmada gecikme, geçici paralitik ileus, kusma, apne, hipertansiyon ve nörolojik değişiklikler midriyatik damlaların sistemik yan etkileri arasında sayılabilir. Bazı olgularda PR muayenesi sonrasında NEK (Nekrotizan Enterokolit) kliniği geliştiği de bildirilmiş ve bu olgulardan bazıları kaybedilmiştir. Bu nedenle olgulara yeterli pupil dilatasyonu sağlayacak en az konsantrasyonda ve en az miktarda medikasyon uygulanması, olguların yan etkiler açısından yakın takip edilmesi ve özellikle NEK kliniğinin erken tanınması gerekmektedir. Bu amaca yönelik yapılan pek çok çalışma mevcuttur ve yapılan çalışmalar; daha düşük konsantrasyonlardaki veya miktarlardaki medikasyon ile daha az yan etki görüldüğünü destekler niteliktedir.
NEK patogenezinde, öncelikli olarak mezenter kanlanmada azalmaya bağlı barsak iskemisi olduğu savunulmaktadır. Burdan yola çıkılarak yapılan çalışmalarda; son dönemlerde sıklıkla kullanılan ve bölgesel doku oksijenasyonunu gösteren non-invaziv bir yöntem olan NIRS (Near Infrared Spectroscopy) kullanılarak, NEK tanısı alan olgularda mezenter kanlanmanın azaldığı gösterilmiştir. Bu nedenle mezenter NIRS ölçümlerinin takibi ile NEK
3 kliniğinin erken evrelerde tanınabileceği düşünülmektedir. Pupil dilatasyonunu sağlamak için kullanılan medikasyonların, serebral ve mezenter kanlanmayı bozduğu ve buna bağlı komplikasyonlara neden olduğu düşünülürse, NIRS ölçümlerinin benzer şekilde PR komplikasyonlarını da erken evrede tanıyabileceği söylenebilir. Ancak bu ilişkiyi araştıran bir çalışma yoktur.
Çalışmamız, prospektif bir çalışma olarak tasarlandı. Kliniğimizde izlenmekte olan, 32.gestasyonel haftanın altında veya 1500 gr altında doğum öyküsü olan prematüre yenidoğanlarda PR muayenesi öncesi ve sonrası, serebral ve mezenter NIRS ölçümlerinin alınması ve olguların komplikasyonlar açısından izlenmesi planlandı. Çalışmamızda; birincil olarak PR muayenesinde pupil dilatasyonu amacı ile kullanılan sempatomimetik ve parasempatolitik tedavilerin ve PR muayenesinin, serebral ve mezenter oksijenasyona etkisinin gösterilmesi amaçlanmıştır. İkincil amaç ise komplikasyonlar ile NIRS ölçüm değerleri arasındaki ilişkinin değerlendirilmesidir.
4 2. GENEL BİLGİLER
2.1. Prematüre Retinopatisi
2.1.1. Tanım
Prematüre retinopatisi (PR); prematüre doğan bebeklerde, retinal damarlanmanın anormal proliferasyonu sonucu oluşan, patogenezi tam açıklanamayan fizyopatolojik bir durumdur[1]–[3].
PR ilk olarak, retrolental fibroplazi adıyla, 1940’lı yıllarda bu klinik tablo ile prematürite arasında bağlantı kuran Terry tarafından tanımlanmıştır.[4] Daha sonra patogenezinde vasoproliferasyon olduğunun anlaşılması ile PR adını almıştır. O dönemde PR tedavisi için uygun bir yaklaşım bulunmamaktadır. PR tedavisi olarak 1980-1990 yılları arasında gündeme gelen kriyoterapi ve lazer fotokoagülasyon, PR tanılı hastalarda görme kaybını belirgin bir şekilde azaltmıştır. Ancak etkin tedavi yöntemlerine rağmen, PR hala gelişmiş ve gelişmekte olan ülkelerde çocuklardaki görme kaybının majör nedenleri arasındadır ve çocukluk çağı görme bozukluklarının %50’sinden sorumludur. [5], [6]
2.1.2. Epidemiyoloji
Prematüre retinopatisi için üç epidemi tanımlanmıştır. İlk epidemi 1940-1950 yılları arasında Amerika başta olmak üzere gelişmiş ülkelerde görülmüştür. PR yeni tanımlandığı yıllarda klinik daha çok görme kaybı şeklindedir. Bu dönemdeki epidemi kontrolsüz ve monitörize edilmeden verilen yüksek konsantrasyondaki oksijene bağlanmıştır[7], [8]. Bunun anlaşılmasıyla birlikte oksijen kullanımı sınırlandırılmış ve PR insidansında belirgin bir azalma görülmüştür[9].
İkinci epidemi ise, yine gelişmiş ülkelerde 1970’li yıllarda görülmüştür. Teknolojinin ve buna bağlı yoğun bakım imkanlarının gelişmesi ile daha düşük doğum ağırlıklı bebeklerin yaşatılması ve daha büyük bebeklerin
5 sekelsiz iyileşmesi bu epideminin sebebi olarak görülmektedir[7]. İlk epidemide görme kaybı yaşayan bebeklerin ortalama doğum ağırlıkları; Amerika’da ve İngiltere’de, sırasıyla 1354 gr ve 1370 gr iken, ikinci epidemide tedavi gereksinimi olan PR tanısı almış bebeklerin ortalama doğum ağırlıkları 763 gr ve 737 gr olarak belirtilmiştir[10], [11]. Prematüre retinopatisi tarama programlarının planlanması ile ikinci epidemi de sonlanmış ve erken tanı ile tedavi gerektiren PR insidansında azalma olmuştur. İlk iki epidemide gelişmekte olan ülkelere ait net bilgilere ulaşılamamıştır.
1990’lı yıllarda gelişmekte olan ülkelerde görülen epidemi ise üçüncü epidemi olarak tanımlanmıştır[8], [12], [13]. Yenidoğan bakımlarda gelişmekte olan ülkelerde de ilerleme sağlanmasına ve düşük doğum ağırlığı ve düşük gestasyonel yaştaki bebek ölümlerinin azalmasına rağmen, yaşayan prematüre bebeklerde PR takip, tanı ve tedavi imkanındaki yetersizlikler önemli nedenidir. Üçüncü epidemide dikkati çeken önemli nokta daha matür bebeklerin PR insidansında da artış olmasıdır.
Epidemilerin seyrinde de görüldüğü gibi PR sıklığı, ülkelerin ve yoğun bakım ünitelerinin gelişmişlik düzeylerine göre değişmektedir[14]. Gelişmiş ülkelerde %13 oranında PR görülürken, gelişmekte olan ülkelerde bu oran %15-35 arasında değişmektedir. Gelişmiş ülkelerde 28 haftanın altında PR sıklığı artarken, gelişmekte olan ülkelerde 34.haftaya kadar PR sorun oluşturmaktadır[2]. Ancak PR sıklığı ve evrelerinin ağırlığı, gestasyonel yaş(GY) ve doğum ağırlığının (DA) düşüklüğü ile her zaman korelasyon göstermektedir.[15]–[17]
CRYO-ROP(Cryotherapy for Retinopathy of Prematurity) çalışmasının ilk sonuçlarına göre, DA 1250 gr altında olan prematüre bebeklerde PR insidansı %64.8 olarak belirtilmiştir[18]. 2000-2002 yılları arasında Amerika’da yapılan ET-ROP (Early Treatment- Retinopathy of Prematurity) çalışma grubunun sonuçlarına göre de; DA 1250 gr altında olan prematüure bebeklerde PR insidansı %68, ileri evre PR insidansı %36 olarak saptanmıştır. Bu hastalar arasında insidans, 32 hafta ve üstünde %8, 27-31. haftalar arasında %9, 27 hafta ve altında %43 olarak bulunmuştur.[19] 1989 ve 1997 yılları arasında 37 hafta ve altında doğan 951 prematüre bebekle
6 yapılan bir çalışmada da 32 hafta ve üstünde PR saptanmazken, 28 hafta ve üzerindeki bebeklerde tedavi ihtiyacı olmayan erken evre PR saptanmıştır. [16]
2015 yılında İngiltere’de yapılan bir diğer çalışma da; PR insidansında yıllar içinde bir artış olduğunu göstermektedir. 1990 yılında DA 1500 gr ve altında olan prematüre bebeklerde binde 12.8 PR saptanırken, 2011 yılında bu oran binde 125.5 olarak artmıştır.[20] Bu durum yenidoğan yoğun bakım ünitelerinin teknik özelliklerinin gelişmesi ve buna bağlı olarak daha küçük gestasyonel haftalarda doğan prematüre bebeklerin yaşam şanslarının artmasına bağlanabilir.
Akman ve arkadaşlarının 2010 yılında Türkiye’de yaptıkları bir çalışmada 32.GH (Gestasyonel Hafta) altında doğan bebeklerde PR sıklığı %50.9 iken, 32-34.GH arasında %25, 34.GH’nın üstünde %9.1 bulunmuştur[21]. Türk Neonatoloji Derneği (TND) tarafından 2014 yılında yapılan çok merkezli bir çalışmaya göre de çok düşük doğum ağırlıklı (ÇDDA: DA<1500gr) doğan preterm bebeklerin %42 sinde PR saptanırken, %8.2 sinde ileri evre PR saptanmıştır[22]. Bu oranlar GH için değerlendirildiğinde; 28.GH ve altında doğan bebeklerde %52.8/%5.1 iken, 29-32.GH arasında %27.6/%2.6, 32.GH’nın üstünde %13.3/%0.4 olarak bulunmuştur. Aynı çalışmada hastaların %18’inde lazer fotokoagülasyon tedavisi ihtiyacı mevcut olup, bu hastaların 20 tanesi(%0.5) de GH 32 hafta ve üzeridir. Bu çalışmanın en önemli mesajlarından biri; Türkiye’de daha matür bebeklerde ileri evre PR ve tedavi ihtiyacı insidansının gelişmiş ülkelerde verilen rakamlardan daha yüksek olmasıdır.
2.1.3. Patogenez
Retinal damarlanma 15-18. gestasyonel haftalarda başlar. Bu dönemden önce retinanın beslenmesi, optik sinirden orijin alan ve vitreus boyunca uzanan hyaloid arter tarafından sağlanmaktadır. Retinal damarlar optik diskten çıkar ve perifere doğru gelişim göstererek ora serrataya kadar uzanır. Nasal retinada damarlanma 36. haftada tamamlanırken, temporal
7 retinanın damarlanması 40. haftada tamamlanır. Bu nedenle prematüre doğan bebeklerde retinal damarlanma tam olmayıp, periferde, ora serrataya uzanan avasküler bir zon bulunmaktadır. Prematüre doğan bebeklerde damarlanmanın tamamlanması 48-52. haftaya kadar uzayabilmektedir[23]– [26].
Prematüre retinopatisi iki fazı bulunan bir hastalıktır. Faz 1’de; hiperoksiye bağlı retinal damarlanmanın durması ve vazooklüzyon söz konusudur. Faz 2’de ise; hipoksiye bağlı neovaskülarizasyon ön plandadır. PR oluşumunda birçok mediatör suçlanırken, VEGF ve IGF-1 her iki faz için de en çok rolü olduğu düşünülen mediatörlerdir. Endotelyal mitojen olan VEGF, retinal anjiogeneziste anahtar rol oynamaktadır[27]–[29]. Şekil 2.1.’de IGF-1 ve VEGF’nin PR deki rolü şematik olarak gösterilmiştir.
2.1.3.1.Faz-1
Faz 1’de kliniğe hiperoksi hakimdir. İntrauterin dönemde parsiyel oksijen basıncı 35-40 mmHg civarında iken, doğum sonrası bu değerler 60-80 mmHg’ya kadar yükselir. Bu durum preterm bebekte göreceli bir hiperoksi ortamı yaratır. Sadece doğumun getirdiği bu hiperoksi durumu bile prematüre bebekler için zararlıdır. İmmatür akciğere sahip olan prematüre bebekler için yenidoğan yoğun bakım ünitelerinde uygulanan oksijen destek tedavileri ise diğer bir hiperoksi nedenidir. Oluşan hiperoksik ortamda VEGF salınımı baskılanır. Endotelyal hücreler için mitojen olan VEGF’nin azalması ile retinal damarların gelişimi duraklar[24], [30], [31]. Ayrıca hiperoksiye bağlı oluşan oksijen radikallerinin etkisi ile endotelyal hücre hasarlanması ve VEGF düşüklüğünün etkisi ile endotelyal hücrelerde apopitoz olması nedeniyle vazooklüzyon da görülmektedir[5].
Normal retinal damarlanmada IGF-1’in de önemli bir rolü olduğu bilinmektedir[32]. IGF-1 ve IGF-2, intrauterin dönemdeki fetal büyüme üzerine etkisi olan mediatörlerdir. Özellikle IGF-1’in gestasyonel yaş ilerledikçe arttığı ve 3. trimesterda en yüksek seviyelere ulaştığı gösterilmiştir[33], [34]. Bu nedenle erken gestasyonel haftalarda doğan
8 prematüre bebeklerin serum IGF-1 düzeylerinin de düşük olduğu, buna bağlı olarak da retinal damarlanmanın yavaşladığı düşünülmektedir. Bir çok çalışma düşük IGF-1 düzeyleri ile ileri evre PR arasında ilişki olduğunu göstermiştir[35], [36]. Ayrıca IGF-1; VEGF tarafından indüklenen ve endotelyal hücrelerin mitojen fonksiyonunda görev alan protein kinaz B aktivasyonunu sağlamaktadır. Düşük IGF-1 düzeylerinde ise protein kinaz B aktivasyonu engellenmekte ve buna bağlı retinal damar gelişiminde duraksama olmaktadır[32], [37].
2.1.3.2. Faz-2
Faz 2’de ise mevcut tablo hipoksi hakimiyetinde oluşmaktadır. Gestasyonel yaş arttıkça, retinadaki nöronal yapı gelişmeye devam etmektedir. Gelişmekte olan nöronal yapıya karşın, Faz 1’de meydana gelen retinal damar gelişiminin duraksaması ve vazooklüzyon oluşması; retinada göreceli bir hipoksinin oluşmasına neden olmaktadır. Tekrarlayan apneler, bronkopulmoner displazi ve anemi ise prematüre bebekteki hipoksiyi arttıran diğer nedenlerdir. Tüm bu nedenlerle oluşan hipoksinin etkisi ile VEGF ekspresyonunun artması, neovaskülarizasyon sürecini başlatmaktadır[38]. Neovaskülarizasyon sıklıkla anormal, nadiren normal bir seyir izlemektedir. Neovaskülarizasyon ile gelişen damarlar; permeabilitesi yüksek ve anormal fibrovasküler yapı içeren damarlardır. Retinadan vitreusa doğru uzanım gösteren bu damarlardaki fibrovasküler yapının aşırı artması sonucu ileri evre PR de retina dekolmanı görülebilmektedir[29], [30].
Faz 1’de düşük seviyelerde seyreden IGF-1’in, 32-34. gestasyonel haftalarda organ ve sistem maturasyonu nedeni ile arttığı tespit edilmiştir. Düşük seviyelerde damar gelişiminde duraksamaya neden olan IGF-1’in artışı, neovaskülarizasyon gelişimine neden olmaktadır[37]. 1999 yılında yapılan bir hayvan çalışmasında; IGF-1 reseptör antagonisti kullanılarak Faz 2’deki retinal neovaskülarizasyonun önüne geçilebildiği gösterilmiştir. Bu ve buna benzer çalışmalar[39] ile; IGF-1’in Faz 2’de VEGF’den bağımsız olarak neovaskülarizasyon gelişmesinde rolü olduğu savunulmaktadır. Faz 2’deki neovaskülarizasyonda; VEGF oksijen bağımlı bir faktörken, IGF-1 oksijenden
9 bağımsız bir faktör olarak rol oynamaktadır. Ancak VEGF’nin damar üzerindeki etkinliği de IGF-1 ile kontrol edilmektedir. Bu nedenle Faz 2’de gestasyonel yaşla birlikte yükselen IGF-1 düzeyleri, zaten artmış olan VEGF’nin damar üzerindeki etkinliğini daha da arttırmakta ve buna bağlı neovaskülarizasyonun şiddetini arttırmaktadır[5].
Şekil 2.1. PR de IGF-1 ve VEGF’nin rolü. [5]
2.1.4. Risk Faktörleri
PR multifaktöryel bir hastalıktır. PR risk faktörleri Tablo 2.1.’de görülmektedir. PR gelişimi için pek çok neden suçlanmakla birlikte düşük DA ve düşük GY major risk faktörü olarak görülmektedir[2], [5]. Daha önce de bahsedildiği gibi yapılan pek çok çalışma göstermiştir ki; GY ve DA küçüldükçe PR ve ileri evre PR insidansında artış mevcuttur [15]–[17], [19], [22], [40], [41]. 2006 yılında Türkiye’de yapılan bir çalışmaya göre; GY 28 haftanın altında veya DA 1000 gr altında olan prematüre bebeklerde ileri evre PR görülme riski artmıştır[42].
Diğer bir önemli risk faktörü ise, klinik izlemler ve hayvan çalışmları ile gösterilen yüksek konsantrasyonda oksijen maruziyetidir[5], [43]–[47]. 2011 yılında yapılan br çalışmaya göre, 28 gün üstündeki oksijen maruziyeti PR riskini 1,7 kat arttırmaktadır[40]. Aynı çalışmada; oksijen maruziyetinin özellikle GY 23-25 hafta olan bebeklerde belirgin bir risk faktörü olduğu bildirilmiştir.
2000 yılında Almanya’da yapılan bir çalışmada multivaryant analiz sonucu 10 faktör PR ile bağımlı bulunmuştur. Düşük DA, düşük GY, 7 günden uzun süren mekanik ventilasyon, yüksek volümlü eritrosit
Intrauterin normal damar
gelişimi Damar gelişimi duraklar Prematüre doğum Reine maturasyonu Rölatif hipoksi neovaskülarizasyon Retinal
Normal retinal damar gelişimim VEGF düşer
PR düzelir
VEGF artar Proliferatif Retinopati
10 süspansiyonu replasmanı ve surfaktan tedavisi ile PR sıklığı bağlantılı iken; nekrotizan enterokolit(NEK) öyküsü, annede preeklampsi öyküsü, anneye gebelikte betametazon uygulanması, E vitamini desteği ve fototerapi öyküsü olanlarda PR daha düşük oranlarda görülmüştür[48]. Solunumsal destek ihtiyacı, fetal kanamalar ve intraventriküler kanama(İVK)[49], bronkopulmoner displazi (BPD)[50], hiperkarbi[51], çoğul gebelik[52], hiperglisemi ve insülin tedavisi[53], [54], postnatal yavaş kilo alımı[55], düşük kalori alımı[56] ve annede koryoamnionit öyküsü[57] PR sıklığını arttıran diğer risk faktörleri arasındadır. Daha önceden risk faktörü olduğu savunulan ışığa maruziyetin ise PR sıklığı ile bağlantılı olmadığı gösterilmiştir[58]. 2016 yılında yapılan bir meta analizde ise, preeklampsi ve gestasyonel hipertansiyon ile PR arasında istatistiksel analmlı bir ilişki olmadığı gösterilmiştir[59].
2003 yılında yapılan bir çalışmada prematüre bebeklerde serum IGF-1 düzeyi düşüklüğünün PR sıklığını arttırdığı gösterilmiştir[35]. Aynı ekip tarafından 2006 yılında yapılan bir diğer çalışmada da postnatal kilo alımı, serum IGF-1 ve IGFBP3 (Insulin like Growth Faktor Binding Protein 3) düzeylerine bakılarak PR riski saptanmaya çalışılmış ve tedavi gerektirecek PR gelişen 6 prematüre bebeğin tamamı 5 hafta öncesinde bu algoritma kullanılarak saptanmıştır[3].
Yapılan pek çok çalışmada sepsisin de PR için risk faktörü olduğu gösterilmiştir[40], [53], [60]. Brezilya’da yapılan bir çalışmada sepsisin PR’yi 1.9 kat arttırdığı saptanmıştır[61]. 2006 yılında İtalya’da yapılan başka bir çalışma; özellikle ÇDDA’lı ve eşik hastalığı olan bebeklerde fungal sepsisin ve candida albicans dışı candida kolonizasyonlarının risk faktörü olduğunu göstermektedir[62]
Ünitemizde 2003 yılında yapılan, risk faktörlerinin ve koruyucu önlemlerin araştırıldığı bir çalışmada da düşük doğum ağırılığı, küçük gestasyonel haftalarda doğum, 1. dakika Apgar skorunun düşüklüğü, BPD varlığı, uzamış oksijen tedavisi, sepsis ve hastanede kalış süresinin uzunluğu risk faktörü olarak saptanmıştır. Aynı çalışmada PR gelişmeyen grupta, PR gelişen gruba kıyasla daha fazla oranda anne sütü alımı olduğu ve anne sütü alımının PR için koruyucu faktör olduğu gösterilmiştir[41].
11
Tablo 2.1. PR Risk Faktörleri [35], [40], [41], [46], [48], [49], [52], [54], [57], [63] Düşük gestasyonel yaş
Düşük doğum ağırlığı
Yüksek konsantrasyonda ve uzun süreli oksijen maruziyeti 7 günden uzun mekanik ventilatör tedavisi
Sepsis, sistemik enfeksiyon ve inflamasyonlar
Sistemik mantar enfeksiyonları (özellikle Candida enfeksiyonları) Düşük Apgar Skoru
İntraventriküler kanama (İVK) Kan transfüzyon öyküsü
Hemodinamik anlamlı kardiyovasküler hastalıklar Bronkopulmoner displazi
Hipoksi/Hiperoksi
Hiperglisemi/İnsülin kullanımı Postnatal yavaş kilo alımı Düşük kalori desteği Düşük IGF düzeyi Çoğul gebelik Hipotansiyon Hiperkapni
Annede koryoamnionit öyküsü
2.1.5.Sınıflandırma
PR sınıflaması en son 2005 yılında düzeltilmiş şekli yayınlanmış olan ICROP’a (International Classification of Retinopathy of Prematurity) göre yapılmaktadır[64]. ICROP ilk defa 1984 yılında kabul edilmiş olup, 1987 yılında ilk kez genişletilerek revize edilmiştir. Son olarak 2005 yılında, 6 ülkeden 15 oftalmolog tarafından oluşturulan bir komite tarafından oluşturulmuş olan ICROP’a göre sınıflandırmada 4 klinik parametre kullanılır:
1) Retinopatinin yerleşim durumu (Zon)
2) Retinopatinin yayılım derecesi (Saat kadranı) 3) Vasküler proliferasyonun derecesi (Stage-Evre) 4) ”Plus hastalık” varlığı
12 2.1.5.1 Zon
Retina, hastalığın yerleşim bölgesini tanımlamak için kullanılan, optik diskin merkez olduğu 3 bölgeye (zon) ayrılmıştır. Optik diskin merkez olarak seçilmesinin nedeni damarlanmanın buradan başlaması ve ora serrataya doğru gelişmesidir. Üç zon şematik olarak Şekil 2.2.’de gösterilmiştir.
Şekil 2.2. Retinal zonların şematik gösterilmesi[1]
Zon 1: Merkezi optik disk olan, optik disk-makula arasındaki mesafenin 2 katı kadar yarıçapa sahip dairesel alandır. Vizüel olarak en aktif bölgedir.
Zon 2: Yarıçapı optik disk-nasal ora serrata arasındaki mesafe kadar olan, zon 1 in dışında kalan dairesel alandır.
Zon 3: Temporal bölgede ora serratada sonlanan yarımay şeklinde alandır.
2.1.5.2. Yayılım Derecesi (Saat Kadranı)
Retinanın yüzeyi saat kadranına benzer 30 derecelik sektörlere bölünür ve yayılım derecesi hastalığın kaç saat kadranı boyunca oluştuğuna göre belirlenir. Yayılım, kesintili veya devamlı olabilir. Yayılımı belirlemek, “plus hastalık”, “eşik hastalık” tanımlamaları için önemlidir.
Sağ göz Sol göz
Saat Kadranı
13 2.1.5.3. Vasküler Proliferasyon Derecesi (Evre)
Retinanın vasküler proliferasyon derecesine göre 5 evreye ayrılır. PR evrelemesi şematik olarak Şekil 2.3.’de gösterilmiştir.
Evre 1 (Demarkasyon Hattı): Avasküler retinal bölge ile vasküler retinal bölgeyi birbirinden ayıran ince, beyaz bir çizgi oluşur.
Evre 2 (Ridge-Sırt): Demarkasyon hattı genişleyip, hacim kazanarak yüzeyden kabarık bir hal alır ve ridge (sırt) denilen yapıyı oluşturur.
Evre 3 (Ekstraretinal Fibrovasküler Proliferasyon): Sırta (Ridge) tutunan fibrovasküler yapıların vitreus içine doğru ilerlemesi ile karakterizedir. Fibrovasküler yapıların yoğunluğuna göre hafif-orta-ağır olarak 3 gruba ayrılır.
Evre 4 (Parsiyel Retina Dekolmanı): Retina dekolmanının görüldüğü evredir. Retina dekolmanı; oluşan yeni damarların geçirgenliğinin fazla olmasına bağlı oluşan retinal ödem ve effüzyon nedeni ile ya da fibrovasküler dokunun traksiyonu nedeni ile oluşabilmektedir. Dekolman; periferik yerleşimli, makulayı içine almayan bir bölgede ise Evre 4a, posteriorda ve makulayı içeren bölgede ise Evre 4b olarak isimlendirilir.
Evre 5 (Total Retina Dekolmanı): Huni şeklinde total retinal dekolmanın görüldüğü evredir. Ön ve arka kısmının açık veya kapalı olmasına göre 4 alt gruba ayrılır.
Şekil 2.3. PR Evrelemesinin Şematik Gösterilmesi[65] Evre‐4
Evre‐2 Evre‐1
Evre‐5
14 2.1.5.4. “Plus Hastalık” Varlığı
Plus Hastalık: Retinanın posteriorunda; en az 2 kadrandaki arteriollerde kıvrımlanmanın artması ve venüllerde dilatasyon olması olarak tanımlanır. Vitreal bulanıklaşma, iris damarlarında beirginleşme ve pupil dilatasyonunda azalma da eşlik edebilmektedir.
Preplus Hastalık: Plus hastalık kriterlerinin tam karşılanmadığı; ancak normale göre arteriolerdeki kıvrımlanmanın ve venüllerdeki dilatasyonun daha fazla olduğu hastalıktır. Plus hastalık ve preplus hastalık varlığında, hastalığın progresyonun hızlı ve kötü olacağı düşünülmelidir.
Eşik Hastalık (Threshold): Ardarda 5 kadranda ya da ardışık olmayan 8 kadranda yayılım olacak şekilde; Zon 1 veya Zon 2’de Evre 3 ve plus hastalık olması durumudur.
Eşik Öncesi Hastalık (Prethreshold): Zon 1’de herhangi bir evrede PR, Zon 2’de evre 2 PR ve plus hastalık varlığı ya da Zon 2’de eşik hastalık yayılım kriterlerini karşılamayan evre 3 PR ve plus hastalık varlığı olarak tanımlanır. Tip 1 (yüksek riskli hastalık) ve Tip 2 (düşük riskli hastalık) olarak 2 gruba ayrılır. Tip1 ve Tip 2 hastalık grupları Tablo 2.2.’de gösterilmiştir.
Eşik hastalık ve eşik öncesi hastalık tanımları tedavi endikasyonunun ve tedaviye yanıtın değerlendirilmesinde kullanılmakta olup; ET-ROP ve CYRP-ROP çalışmalarında tanımlanmışlardır[18], [66].
Tablo 2.2. Eşik Öncesi Hastalık Sınıflaması[18], [66] Tip 1 (Yüksek Riskli Hastalık):
Zon 1’de; plus hastalık bulunmaksızın evre 3 PR ya da plus hastalık eşliğinde herhangi bir evre
Zon 2’de;plus hastalık eşliğinde evre 2 veya evre 3 PR Tip 2 (Düşük Riskli Hastalık):
Zon 1’de; plus hastalık bulunmaksızın evre 1 veya evre 2 Zon 2’de; plus hastalık bulunmaksızın evre 3 PR
15 Agresif Posterior PR (APROP): Hızlı ilerleyen şiddetli bir PR formudur. Plus hastalığın 4 kadranda belirgin olması ve periferdeki hastalıkla orantısız olması durumudur. Hastalık zon 1 veya posterior zon 2’de olmakla birlikte sınırları net ayırt edilemeyebilir. Tedavisiz kalması durumunda hızla evre 5’e ilerleyebilmektedir.
2.1.6. Tedavi
PR tedavisi, PR gelişmesini önlemek amaçlı yapılan profilaktik tedaviler, PR gelişen olgularda ileri evreye gidişi önlemek amaçlı yapılan önleyici tedaviler ve ileri evre PR gelişen olgularda yapılan düzeltici tedaviler olarak 3 başlıkta toplanabilir.
2.1.6.1. Profilaktik Tedaviler
Profilaktik tedaviler; risk faktörleri ve PR patogenezinde rol oynayan faktörler düşünülerek PR gelişimini önlemek amacıyla alınan koruyucu önlemleri kapsamaktadır ve tedavideki en önemli kısmı oluşturmaktadır. PR için koruyucu önlemler Tablo 2.3.’te özetlenmiştir.
En önemli risk faktörünün düşük gestasyonel yaş ve düşük doğum ağırlığı olduğu düşünülürse ilk olarak erken doğumların önlenmesi ve planlı gebeliklerin sağlanması PR için koruyucu olan en öncelikli yaklaşımdır. Diğer risk faktörlerinden olan koryoamnionitin[57] önlenmesi ve antenal steroid uygulaması[67] da PR gelişimi için koruyucu niteliktedir.
PR hiperoksi ve hipoksinin farklı dönemlerde hakim olduğu bir hastalıktır. Özellikle 23-25. GH’da doğan prematüre bebekler için postnatal ilk 28 gün olan oksijen maruziyetinin önemli bir risk faktörü olduğu gösterilmiştir[40]. 2010 yılında yayınlanan bir metaanalizde ise; erken dönemde düşük saturasyonun, özellikle postmensturel (PM) 32.haftadan sonra ise yüksek saturasyonun ileri evre PR riskini azalttığı gösterilmiştir[68]. Bu nedenle özellikle ilk haftalarda yüksek oksijen maruziyetinin mümkün
16 olduğunca önlenmesi, Faz 2’nin başladığı kabul edilen PM 32-33. haftalarda ise hipoksinin önlenmesi PR gelişimini önlemede önemli bir yere sahiptir.
Düşük omega 3 seviyesinin de PR patogenezinde, her iki fazda da önemli bir rolü olduğu, bu nedenle erken başlanan uygun TPN (Total Parenteral Nutrisyon) desteğinin PR için koruyucu olduğu gösterilmiştir[65], [69]. Postnatal yeterli kalori desteği ve kilo alımının sağlanması ve hipogliseminin önlenmesi de PR gelişimini önlemede önemli bir yere sahiptir[3]. Beslenmenin ise öncelikle anne sütü ile sağlanması diğer bir önemli koruyucu faktör olarak belirtilmiştir[41]. E vitamini tedavisinin PR için koruyucu olduğunu savunan çalışmalar da mevcuttur[70]. Ancak net bir konsensus bulunmamaktadır.
Reynolds ve arkadaşları tarafından yapılan light-ROP çalışmasında ise ışık maruziyetinin PR insidansı üzerine etkisi araştırılmış; ancak çalışma grubu ve kontrol grubu arasında anlamlı bir fark bulunmamıştır[71]. Yine de erken dönemde, özellikle 31 hafta altındaki preterm bebeklerde fotopik adaptasyon sağlanması amacıyla karanlık ortam yaratılması önerilmektedir.
Tablo 2.3. PR gelişimini engellemek amacıyla önerilen önlemler [40], [41], [57], [65], [67]–[71]
PreFaz Faz 1 Faz 2
Planlı gebelik Doğum odası önlemleri
(erken CPAP, hiperoksiden kaçınılması, hipoterminin önlenmesi, geç kord klemplenmesi)
Hipoksinin önlenmesi
Antenatal steroid Oksijen kullanımındaki fluktuasyonun önlenmesi (Hedef saturasyon %90-95) Apnenin önlenmesi İntrauterin enfeksiyon ve inflamasyonun önlenmesi Erken anne sütü Uygun TPN Aneminin önlenmesi
Prematüreliğin önlenmesi Hipogliseminin önlenmesi Yeterli kalori alımının sağlanması
Fotopik adaptasyon Yeterli kilo alımının sağlanması
17 2.1.6.2. Önleyici Tedaviler
Önleyici tedaviler; periferik avasküler retinanın ablasyonunun sağlanmasıdır. İskemik retinadan VEGF ve diğer anjiogenik mediatörlerin salınımını baskılayarak neovaskülarizasyonun durudurulması amaçlanmaktadır. Böylece periferik görmenin bozulması uğruna santral görmenin korunması sağlanmaktadır.
Kryoterapi; avasküler retinanın göz polünün dış yüzeyinin soğuk problar kullanılarak koterize edilmesi işlemidir. Koterizasyon işlemi ridge(sırt) öncesinden başlayarak 360 derece olacak şekilde kesintisiz uygulanmalıdır[30]. 1988 yılında başlatılan CRYO-ROP grubu tarafından yapılan çalışmaya göre; eşik PR saptanan olguların ilk 72 saat içinde tedavi edilmesi gerekmektedir[18]. Göz kapaklarında şişlik, vitreus hemorajisi, makular skar oluşumu, konjonktiva altında ödem kriyoterapinin yan etkileridir. CRYO-ROP çalışmasının 3.ay, 1.yıl, 5.yıl ve 10.yıl sonuçları incelendiğinde; 3.ayda tedavi grubunun %31, kontrol grubunun %51’inde sonuçlar başarısız iken, 1.yılda bu oranlar %21.3 ve %43 olarak bulunmuştur. Onuncu yıl sonuçlarına göre tedavi grubunda görme kaybının kontrol grubuna göre daha az olduğu ve eşik PR olan olgularda vizüel aktivitenin korunduğu gösterilmiştir[18], [72]–[74].
Lazer fotokoagülasyon, 1990’lı yıllarda argon ya da diod lazer kullanılarak yapılan bir tedavi yöntemi olup, yıllar içinde kriyoterapiden daha fazla kullanım alanı bulmuştur. Direkt olarak retinal dokuya uygulanan lazer fotokoagülasyon yönteminde yan etki riski ve analjezik kullanım oranları da daha azdır[30]. Lazer fotokoagülasyon ve kriyoterapinin karşılaştırıldığı çalışmalarda; fotokoagülasyonun kriyoterapi kadar görme kaybını önlemede etkin olduğunu gösterilmiştir. On yıllık izlem sonuçlarına göre ise; lazer tedavisi uygulanan olgularda; kriyoterapi tedavisi uygulanan olgulara kıyasla; görme keskinliğinin daha fazla düzeldiği, retina dekolmanının daha az görüldüğü, myopi ve komplikasyonların daha az olduğu bildirilmiştir.[75], [76]. Lazer fotokoagülasyonun ön segment komplikasyonlarından olan; hifema,
18 glokom, band keratopatisi genellikle yıllar içinde kaybolur. Ancak geç komplikasyon olarak katarakt ve göz kaybı gelişebilir.
ET-ROP çalışmaları, erken ve etkin tedavi ile geleneksel tedaviyi karşılaştıran çok merkezli bir çalışmadır[77]. Çalışmanın 9 aylık sonuçlarına göre erken tedavi grubunda görme keskinliğinin daha iyi olduğu ve striktür gelişiminin daha az olduğu gösterilmiştir. On yıllık çalışma sonuçlarına göre ise tedavi endikasyonları yeniden belirlenmiştir. ET-ROP çalışmasına göre eşik hastalık ve eşik öncesi Tip 1 hastalık en geç 72 saat içinde uygun retinal ablasyon yöntemi ile tedavi edilmelidir. Tip 2 hastalık için tedavisiz izlem önerilmekle birlikte, eşik hastalık ya da Tip 1 hastalığa ilerleyiş açısından yakın takip gerekmektedir[78].
2.1.6.3. Düzeltici Tedaviler
Erken dönemde etkin tedavi yaklaşımları uygulanmasına rağmen, tüm PR olgularının %15-20’sinde retinal dekolman görüldüğü bildirilmiştir. Evre 4, Evre 5’e ilerlemiş olgularda retinal dekolman cerrahisi uygulanmaktadır. Vitreoretinal cerrahi, acil bir girişimdir ve göz çok küçük bir organ olduğundan teknik olarak zordur. Bu nedenle deneyim ve pediatrik anestezi gerektirir.
Skleral çökertme, geçmiş dönemlerde lensin korunması nedeni ile vitrektomiye üstünlük sağlarken, günümüzde lens koruyucu vitrektomi yöntemlerinin olması nedeni ile tercih edilmemektedir. Skleral çökertme, episklera üzerinden gözün 360 derece silikon bir bantla sarılması işlemidir. Bu yöntem; komplikasyonlarının ciddi olması ve gözün büyümesinin engellenmesi nedeni ile 18 yaşın altında önerilmemektedir. Ayrıca anatomik başarı sağlanmasına rağmen, fonksiyonel başarının yetersiz olduğu görülmüştür[79].
Vitrektomi; günümüzde retina dekolmanı cerrahisinde daha sıklıkla tercih edilen bir yöntemdir. Amaç traksiyon şiddetini azaltmak amaçlı mekanik serbestleştirme yapılmasıdır. Prolifere olan dokular kesilir, böylece retraksiyonlar gevşetilir. Lens koruyucu vitrektomi ve vitrektomi-lensektomi yaklaşımları mevcuttur. Lens koruyucu cerrahi, özellikle makulanın
19 korunduğu Evre 4a PR olguları için etkin bir yöntemdir. Bu nedenle olgular özenle seçilmelidir. Preoperatif vizüel aktivitenin değerlendirilmesi ve dekolman tipinin belirlenmesi, prognozu öngörmede önemli bir yere sahiptir. Seçilecek olan yaklaşım buna göre belirlenmelidir. Yapılan çalışmalarda vitrektomi sonrası görme keskinliğinin %15 daha fazla olduğu gösterilmekle birlikte, en iyi görme keskinliği 20/200 ve 20/600 olarak belirtilmiştir[80].
Anti VEGF ajan uygulamaları (Bevacizumab, Ranibizumab, Aflibercept) da; PR retinopatisi alternatif tedavileri arasındadır. Faz 2’de hipoksiye sekonder artan VEGF’nin neovaskülarizasyona neden olduğu bilinmekte, VEGF baskılanması ile neovaskülarizasyonun önlenmesi amaçlanmaktadır[81], [82]. Faz 1’de ise VEGF azlığına bağlı retinal damarlanmanın durduğu düşünülürse, bu tedavinin Faz 1’de uygulanması kalıcı distrofiye neden olmaktadır. Bu nedenle anti VEGF tedavinin zamanlaması önem kazanmaktadır. 2011 yılında yapılan BEAT-ROP (Bevacizumab Eliminates the Angiogenic Threat of Retinopathy of Prematurity) çalışmasına göre Bevacizumab tedavisi uygulanan olgularda rekkürrensin kontrol grubuna göre belirgin azalmış olduğu gösterilmiştir (oranlar sırasıyla %4 / %22 - p:0.002). Özellikle zon 1’deki PR tedavisinde etkin olduğu, ancak aynı oranda zon 2’de etkin olmadığı belirtilmiştir[83].
2.1.7. Prognoz
CRYO-ROP grubunun 1994 yılındaki çalışma sonuçlarına göre prognoz açısından pek çok bilgiye ulaşılmıştır. Çok merkezli bu çalışmada; DA 1250 gr altında olan prematüre bebeklerin PR insidansı, tedavi ihtiyaçları ve düzelme oranları değerlendirlmiştir[84]. Bu çalışma sonuçlarına göre hastaların %80’inde PR’nin gerilediği, %90’ında PM 44. haftada düzeldiği gözlenmiştir. Aynı çalışmaya göre hastaların %6’sında eşik hastalık geliştiği ve önleyici tedavi gereksinimi olduğu belirtilmiştir. Eşik öncesi hastalık geliştirenlerin 3.5-4.5 yaşları arasında görme keskinliğinde azalma olabildiği, buna karşın daha düşük evredeki olgularda görme keskinliğinde azalma olmadığı gösterilmiştir. Eşik hastalık gelişen olguların ise çok az bir kısmında
20 görme keskinliğinin korunabildiği belirtilmektedir. Ancak tam görme kaybı sıklığı tam olarak bilinmemektedir.
CRYO-ROP grubunun 1993 yılında 4099 bebekle yaptığı bir diğer çalışmada, eşik öncesi hastalığa ilerleyiş istenmeyen sonuç olarak tanımlanmış ve zon 1’deki PR’de plus hastalık varlığında, ileri evre PR’de ve geniş saat kadranı tutulumunda istenmeyen sonuç oranlarının arttığı gösterilmiştir. Aynı çalışmada erken PM haftalarda PR tanısı alan olgularda eşik öncesi ve eşik hastalığa ilerleyiş oranları yüksek bulunmuştur. PM 33-34. haftada evre 3 PR ve plus hastalık tanısı alan olguların %77’sinde eşik hastalık gelişirken, tanısı PM 41-42.haftalarda konan olgularda eşik hastalığa ilerleme oranı %14 olarak verilmiştir. Buna bağlı olarak erken PM haftalarda ileri evre PR tanısının prognozu gösteren en önemli faktör olduğu vurgulanmıştır[85].
Prematüre bebeklerde görülen diğer problemler ise; strabismus, ambliyopi, anizometri, myopidir. Daha ileri evre PR gelişen olgularda vizüel problem sıklığında artış olmaktadır[86]. Özellikle evre 5 PR gelişen olgularda ise geç çocukluk çağında retinal skar, glokom, retina dekolmanı ve nistagmus sıklığında artış mevcuttur[24]. 2009 yılında Çek Cumhuriyeti’nde, DA 1500 gr ve altında doğan ve prematüre retinopatisi gelişen bebeklerde yapılan bir diğer çalışmada da uzun dönem izlemde; %2 körlük geliştiği, %40 myopi, %36 anizometri, %30 stabismus ve %4 glokom geliştiği gösterilmiştir[87]. Bu nedenle vaskülarizasyonu tamamlanmış olguların da, ileri dönemde belirli aralıklarla oftalmolojik muayenelerinin devam etmesi gerekmektedir.
2.1.8. Tarama
2.1.8.1. Tarama Grubu ve Zamanlaması
Prematüre retinopatisi, çocuklarda önlenebilir körlük nedenlerinden biridir. Yıllar geçtikçe yenidoğan yoğun bakım ünitelerindeki şartların iyileşmesi ve deneyimli kadronun artması ile daha küçük GH’da doğan prematüre bebekler yaşatılabilmektedir. Bu da PR görülme sıklığını
21 arttırmaktadır. Ancak PR’nin erken evrede yakalanması, yakın takibi ve erken tedavisi ile görme keskinliğinin korunması mümkün olabilmektedir[66]. Bu nedenle yenidoğan yoğun bakım ünitelerinde izlenmekte olan bebeklerin uygun zamanlarda PR açısından taranması önem kazanmaktadır.
Tarama için ideal zamanlamanın belirlenmesi için pek çok çalışma yapılmıştır. Bu çalışmaların çoğunda 31. PM haftadan önce veya 44-47. PM haftadan sonra evre 3 ve üstü PR görülmemiş veya herhangi bir tedavi ihtiyacı doğmamıştır[88]–[90]. Ayrıca tarama zamanlaması için PM yaşın (GY + Kronolojik yaş) kullanılması önerilmektedir[1], [91]. Çünkü ileri evre PR başlangıç zamanının postmensturel yaş ile gestasyonel yaşa oranla daha korele olduğu gösterilmiştir[88].
Bütün bu çalışmalar doğrultusunda; Amerikan Pediatri Akademisi (AAP), Amerikan Oftalmoloji Akademisi (AAO), Amerikan Oftalmoloji ve Strabismus Cemiyeti(AAPOS), Amerikan Ortoptist Cemiyeti(AACO) ortak görüşleri ile oluşturulan ve tarama-izlem önerilerini içeren ilk makale 1997 yılında yayınlanmıştır. 2006 ve 2013 yıllarında revize edilen öneriler, pek çok merkez tarafından tarama şeması olarak kullanılmaktadır[1], [91].
2013 önerilerine göre; GH≤30.hafta ve/veya DA≤1500 gr olan tüm prematüre bebekler ve ayrıca GH>30.hafta ve/veya DA 1500-2000 gr olan ancak kardiyopulmoner destek ihtiyacı olan, klinik olarak risk faktörü taşıyan veya takip eden hekim tarafından PR açısından riskli görülen tüm prematüre bebekler PR için taranmalıdır. Bunun yanında TND tarafından oluşturulan Prematüre Retinopatisi Rehberi’nde ulusal çalışmalar ışığında Türkiye’de taramaların 2006 önerilerine göre; GH sınırının 32. hafta kabul edilerek yapılması önerilmektedir[2].
Tarama zamanı olarak 2006 yılında yayınlanan tarama ve izlem önerilerine göre; 27.GH ve öncesinde doğan bebeklerin PM 31.haftada, 27. GH sonrasında doğan bebeklerin postnatal 4.haftalarında tarama yapılması uygundur. 32. GH ve sonrası doğan ancak risk faktörü taşıması nedeni ile PR taraması planlanan olguların yine postnatal 4.haftada taranması önerilmektedir. 25. GH ve öncesinde doğan bebekler içinse izleyen hekim
22 gerekli görürse, PM 31.haftanın beklenmemesi, postnatal 6.haftada taramanın yapılması önerilmektedir. PR taraması için ilk muayene zamanları Tablo 2.4.’te gösterilmiştir.
Tablo 2.4. PR Tarama Zamanlaması[1] Gestasyonel Yaş
(Hafta)
PR Tarama Zamanı
PM Yaş (Hafta) Kronolojik Yaş (Hafta)
22 31 9 23 31 8 24 31 7 25 31 6 26 31 5 27 31 4 28 32 4 29 33 4 30 34 4 31 35 4 32 36 4 2.1.8.2. İzlem Sıklığı
Amerikan Pediatri Akademisi 2013 izlem önerilerine göre izlem sıklıkları aşağıda belirtilmiştir[91].
1 hafta veya daha erken süreçte izlem gereken hastalar:
İmmatür damarlanması zon 1’de olan, ancak PR olmayan olgular İmmatür damarlanması, zon 1 sınırına yakın, ancak zon 2’ye uzanım
gösteren olgular Zon 1’de Evre 1-2 PR Zon 2’de Evre 3 PR
![Tablo 2.3. PR gelişimini engellemek amacıyla önerilen önlemler [40], [41], [57], [65], [67]–[71]](https://thumb-eu.123doks.com/thumbv2/9libnet/3033401.2531/32.892.170.786.689.1036/tablo-pr-gelisimini-engellemek-amaciyla-onerilen-onlemler.webp)