DİCLE ÜNİVERİSTESİ FEN BİLİMLERİ ENSTİTÜSÜ
TUNCELİ SARIMSAĞININ( Allium tuncelianum (KOLLMAN),
N.ÖZHATAY, D. MATTHEW, Ş. ŞİRANECİ) IN VITRO
MİKROÇOĞALTIMI
Deniz Yusuf İÇGİL
YÜKSEK LİSANS TEZİ
TARLA BİTKİLERİ ANA BİLİMDALI
DİYARBAKIR ŞUBAT 2012
FEN BĠLĠMLERĠ ENSTĠTÜSÜ MÜDÜRLÜĞÜ DĠYARBAKIR
Deniz Yusuf ĠÇGĠL tarafından yapılan “TUNCELĠ SARIMSAĞININ (Allium
tuncelianum (KOLLMAN), N.ÖZHATAY, D. MATTHEW, ġ. ġĠRANECĠ) IN VITRO
MĠKROÇOĞALTIMI” konulu bu çalıĢma, jürimiz tarafından Tarla Bitkileri Anabilim Dalında YÜKSEK LĠSANS tezi olarak kabul edilmiĢtir.
Jüri Üyesinin Ünvanı Adı Soyadı
BaĢkan: Prof. Dr. Doğan ġAKAR
Üye : Doç. Dr. Süleyman KIZIL (DanıĢman)
Üye : Yrd. Doç. Dr. Sevil SAĞLAM
Tez Savunma Sınavı Tarihi: 28/02/2012
Yukarıdaki bilgilerin doğruluğunu onaylarım. .../.../2012
Prof. Dr. Hamdi TEMEL ENSTĠTÜ MÜDÜRÜ
BU TEZ, TÜBİTAK (110 O 703 NOLU PROJE) VE DİCLE ÜNİVERSİTESİ BİLİMSEL ARAŞTIRMA PROJELERİ KOORDİNATÖRLÜĞÜ (DÜBAP-07-02-36 NOLU PROJE)
I
Yüksek Lisans tez konumun belirlenmesi, laboratuvar olanaklarının sağlanması, çalıĢma materyalinin temini, çalıĢmanın yürütülmesi ve yazılması aĢamasında her türlü katkılarını esirgemeyen danıĢman hocam Sayın Doç. Dr. Süleyman KIZIL’A teĢekkürlerimi sunmayı bir borç bilirim.
Tez çalıĢmamın her aĢamasında desteklerini gördüğümAnkara Üniversitesi Ziraat Fakültesi Tarla Bitkileri Bölümü öğretim üyelerinden hocam Sayın Prof. Dr. Khalid Mahmood KHAWAR’ sonsuz teĢekkür ederim.
Hayatımın ve eğitimimin her aĢamasında sevgi ve desteklerini benden esirgemeyen canım aileme tüm yüreğimle teĢekkür ederim. Ayrıca, yüksek lisansım boyunca bana moral ve destek veren sevgili dostlarıma ve canım yeğenim Ronay DĠKAN’a en içten teĢekkürlerimi sunarım. Yüksek Lisans çalıĢmam boyunca bana destek olan Denizli ili Kale Ġlçe Gıda, Tarım ve Hayvancılık Müdürlüğünde görevli tüm iĢ arkadaĢlarıma teĢekkür ederim. Ayrıca Dicle Üniversitesi Ziraat Fakültesinde eğitim gördüğüm süre içinde üzerimde emeği geçen bütün hocalarım ve fakülte personeline teĢekkür ederim.
Deniz Yusuf ĠÇGĠL ġUBAT 2012
II Sayfa TEŞEKKÜR………... I İÇİNDEKİLER………... II ÖZET………... IV ABSTRACT………... V ÇİZELGE LİSTESİ………... VI
ŞEKİL LİSTESİ………... VIII
KISALTMA VE SİMGELER………... IX 1. GİRİŞ………... 1 2. KAYNAK ÖZETLERİ…... 13 3. MATERYAL ve METOT………... 19 3.1. Materyal………... 19 3.2. Metot………... 19
3.2.1. Eksplantların Ön Hazırlığı ve Sterilizasyonu………. 19
3.2.2. Bitki Büyüme Düzenleyicileri ve Ortamları ………... 21
3.2.3. Kültür KoĢulları………. 22 3.2.4. In Vitro ÇalıĢmalar………. 23 3.2.4.1 Soğan Rejenerasyonu……… 23 3.3. Ġstatistiksel Değerlendirmeler……… 23 4. BULGULAR ve TARTIŞMA………... 25 4.1 Bulgular………. 25
4.1.1 Allium tuncelianum Soğanlarında %100 ÇamaĢır Suyu ile Farklı Süredeki Uygulamaların BulaĢıklık Üzerine Etkisi……….. 25
4.1.2. Allium tuncelianum’un Yaprak Ucu Eksplantlarının BAP ve NAA içeren MS Besin Ortamında Rejenerasyonu………. 26
4.1.3. Allium tuncelianum’un Yaprak Sapı Eksplantlarının BAP ve NAA içeren MS Besin Ortamında Rejenerasyonu………. 26
4.1.4. Allium tuncelianum’un Dikey Olarak Yarım KesilmiĢ Soğan Eksplantlarının 2-4,D Ġçeren MS Besin Ortamında Rejenerasyonu………. 27
4.1.5. Allium tuncelianum’un Dikey Olarak Çeyrek KesilmiĢ Soğan Eksplantlarının 2-4,D Ġçeren MS Besin Ortamında Rejenerasyonu………. 29
III
Eksplantlarının BAP-NAA Ġçeren MS Besin Ortamında Rejenerasyonu……… 32
4.1.8. Allium tuncelianum’un Dikey Olarak Yarım KesilmiĢ Soğan Eksplantlarının BAP-NAA Ġçeren MS Besin Ortamında Rejenerasyonu……… 33
4.1.9. Allium tuncelianum’un Kök Eksplantlarının BAP ve NAA Ġçeren MS Besin Ortamında Rejenerasyonu………. 35
4.2. TartıĢma………. 38
4.2.1. Allium tuncelianum’un Soğanlarında %100 ÇamaĢır Suyu Ġle Farklı Sürelerdeki Uygulamaların BulaĢıklık Üzerine Etkisi……….. 38
4.2.2. Allium tuncelianum’un Dikey Olarak Çeyrek ve Yarım KesilmiĢ Soğan Eksplantlarının BAP-NAA ve 2,4-D, Ġçeren MS Besin Ortamında Rejenerasyonu…. 39 4.2.3. Allium tuncelianum’un Yaprak Ucu ve Yaprak Sapı Eksplantlarının BAP ve NAA Ġçeren MS Besin Ortamında Rejenerasyonu……… 40
4.2.4. Allium tuncelianum’un Kök Eksplantlarının BAP ve NAA Ġçeren MS Besin Ortamında Rejenerasyonu………. 40 5. SONUÇLAR ve ÖNERİLER……….. 43 5.1. SONUÇLAR………. 43 5.2 ÖNERİLER……….. 43 6. KAYNAKLAR……… 45 ÖZGEÇMİŞ………... 49
IV
MATTHEW, ġ. ġĠRANECĠ) IN VITRO MĠKROÇOĞALTIMI YÜKSEK LĠSANS TEZĠ
Deniz Yusuf ĠÇGĠL DICLE ÜNIVERSITESI FEN BILIMLERI ENSTITÜSÜ TARLA BITKILERI ANABILIM DALI
2012
Türkiye, Avrupa-Sibirya, Akdeniz ve Ġran-Turan fitocoğrafik bölgelerinin üzerinde olması nedeniyle zengin bir bitki çeĢitliliğine sahiptir. Türkiye florasında bulunan toplam 12054 tohumlu bitki türünden 3925 kadarı (% 32.56) Türkiye’ye endemiktir. Bu endemik türler arasında Allium cinsine bağlı türler önemli bir yer kaplar. Türkiye’de Allium cinsine ait 159 takson olup bunların 53 tanesi endemiktir. Bu tez kapsamda çalıĢılmıĢ Allium tuncelianum bitkisi bu endemikler içinde yer almakla beraber Türkiye’nin Bitkileri Kırmızı Kitapta VU- Vulnerable - gruplarına konmakla birlikte doğada orta vadeli gelecekte yüksek tehdit altında olan taksonlar grubuna girmektedir. Daha önce yapılan çalıĢmalarda Allium tuncelianum bitkisinin mikro çoğaltım veya doku kültürü ile adventif soğan oluĢumu ile çok baĢarılı sonuç alınamamıĢtır Tunceli sarımsağının kültüre alınması ve korunması çok önemlidir Bu tez kapsamında in vitro hızlı çoğaltım teknikleriyle dikey olarak çeyrek, ve yarım kesilmiĢ soğan eksplantları ve kök eksplantları farklı oranlarda sitokinin ve oksin içeren ortamlarda kültüre alınmıĢtır. Elde edilen sonuçlarına göre çeyrek ve yarım soğanlardan sadece yaprak oluĢum gözlenirken kök eksplantlarından soğan oluĢum gözlenmiĢtir. Elde edilen sonuçlara göre en iyi soğan oluĢumu 5 mg/I BAP ve 0.5mg/l NAA içeren MS ortamından elde edilmiĢtir. GeliĢtirilmiĢ yöntemin gelecekte Tunceli sarımsağının üretim ve ıslah çalıĢmalarında baĢarıyla kullanılabileceği düĢünülmektedir.
V
IN VITRO MICROPROPAGATION OF TUNCELI GARLIC (Allium tuncelianum
(KOLLMAN), N.ÖZHATAY, D.MATEV, ġ.ġĠRANECĠ)
MASTER THESIS
Deniz Yusuf ĠÇGĠL
DEPARTMENT OF FIELD CROPS
INSTITUTE OF NATURAL AND APPLIED SCIENCES UNIVERSITY OF DICLE
2012
Turkey is very rich in plant species due to it location on Euro-Siberian, Mediterranean and Iran –Turan phytogeographic regions. It has 12054 plant species, out of which about 32.56% species are endemic to Turkey. The plants belonging to Allium species have special place among these. Turkey has 159 Allium species out of which 53 are endemic to Turkey.
Allium tuncelianum studied in this thesis is placed among vulnerable plant species in the Red
Book of Turkish Plants. Previous studies show un-successful results from micro propagation, tissue culture or adventitious bulb regeneration from this plant. It is very important to conserve this important plant species. Complete bulb sterilisation was achieve during 100% commercial bleach for 30 minutes. A comparison of the effects of different concentrations of BAP-NAA, 2,4-D on longitudinally sectioned ½ and ¼ bulb explants showed leaf regeneration on adaksial side of the explants. No regeneration was recorded on leaf tip and petiole explant. Root explants showed bulb regeneration on root tips on MS medium containing various concentrations of BAP-NAA. The best bulb regeneration was achieved on MS mediumcontaining5 mg/l BAP-0.5mg/l NAA. This methodology test is the prospects of Tunceli garlic production in future for production and breeding purposes.
VI
Çizelge No Sayfa
Çizelge 1.1. Türkiye’nin endemik Allium türleri 4
Çizelge 1.2 Allium tuncelianum bitkisinin bilimsel künyesi 8
Çizelge 1.3. Tunceli sarımsağına ait gıda analiz sonucu. 11
Çizelge 3.1. MS (Murashige ve Skoog 1962) ortamında bulunan maddeler ve
konsantrasyonları 22
Çizelge 3.2. Kullanılan bitki büyüme düzenleyicileri ve stok çözelti
konsantrasyonları 22
Çizelge 3.3. Tunceli sarımsağının rejenerasyonu için kullanılan MS ortamında
BAP ve NAA konsantrasyonları 23
Çizelge 3.4. Tunceli sarımsağının rejenerasyonu için kullanılan MS ortamında
2,4-D konsantrasyonları 23
Çizelge 4.1. ÇamaĢır suyu ile farklı muamele sürelerinde yapılan yüzey
sterilizasyonuna ait varyans analizi 25
Çizelge 4.2. ÇamaĢır suyu ile farklı muamele sürelerinde yapılan yüzey
sterilizasyonuna ait Duncan test sonuçları 25
Çizelge 4.3. Allium tuncelianum’un yaprak sapı eksplantlarının BAP ve NAA
içeren MS besin ortamında rejenerasyonu ile ilgili varyans analizi
sonuçları 27
Çizelge 4.4. Allium tuncelianum’un yaprak sapı eksplantlarının BAP ve NAA
içeren MS besin ortamında rejenerasyonu ile ilgili Duncan testi
sonuçları 27
Çizelge 4.5. Allium tuncelianum’un dikey olarak yarım kesilmiĢ soğan
eksplantlarının 2,4-D içeren MS besin ortamında rejenerasyon ile
ilgili varyans analizi sonuçları 28
Çizelge 4.6. Allium tuncelianum’un dikey olarak yarım kesilmiĢ soğan
eksplantlarının 2,4-D içeren MS besin ortamında rejenerasyon ile
ilgili Duncan testi sonuçları 29
Çizelge 4.7. Allium tuncelianum’un dikey olarak çeyrek kesilmiĢ soğan
eksplantlarının 2,4-D içeren MS besin ortamında rejenerasyon ile
ilgili varyans analizi sonuçları 30
Çizelge 4.8. Allium tuncelianum’un dikey olarak çeyrek kesilmiĢ soğan
eksplantlarının 2,4-D içeren MS besin ortamında rejenerasyon ile
ilgili Duncan testi sonuçları 30
Çizelge 4.9. Allium tuncelianum’un dikey olarak çeyrek kesilmiĢ soğan
eksplantlarının BAP-NAA içeren MS besin ortamında rejenerasyon
ile ilgili varyans analizi sonuçları 32
Çizelge 4.10. Allium tuncelianum’un dikey olarak çeyrek kesilmiĢ soğan
eksplantlarının BAP-NAA içeren MS besin ortamında
rejenerasyonu ile ilgili Duncan testi sonuçları 32
Çizelge 4.11. Allium tuncelianum’un dikey olarak yarım kesilmiĢ soğan
eksplantlarının BAP-NAA içeren MS besin ortamında
VII
Çizelge 4.13. Allium tuncelianum’un kök eksplantlarının BAP ve NAA içeren MS
besin ortamında rejenerasyonu ile ilgili varyans analizi sonuçları 35
Çizelge 4.14. Allium tuncelianum’un kök eksplantlarının BAP ve NAA içeren MS
VIII
ŞEKİL LİSTESİ
Şekil No Sayfa
Şekil 1.1. Allium tuncelianum bitkisinin Tunceli il sınırları içindeki yayılıĢ alanları 6
Şekil 1.2. Munzur dağ eteklerinde tarla koĢullarında Tunceli sarımsağının üretiminde
çalıĢan iĢçiler 7
Şekil 1.3. Munzur dağı yamaçlarında meĢe ormanlık alanlarında yayılıĢ gösteren
Allium tuncelianum’un çiçeklenme döneminden görünümü 7 Şekil 1.4. Allium tuncelianum bitkisi (a) Dicle Üniversitesi Ziraat Fakültesi Tarla
Bitkileri Bölümü Soğanlı Bitkiler Koleksiyon Bahçesinden; Allium
tuncelianum bitkisinin toprak üstü, (b) çiçek (floresans) aksamı, (c)
tohumları ve (d) soğanlarının görüntüleri 10
Şekil 3.1. Yüzey sterilizasyondan önce kabukları ayıklanmıĢ Allium tuncelianum
soğanlarının görünümü 19
Şekil 3.2. Steril kabin içerisinde yüzey sterilizasyon çalıĢmalarından bir görünüm 20
Şekil 3.3. Yüzey sterilizasyondan sonra soğanlar steril kabin içinde, steril bisturi ve
pens ile yatay (a) ve dikey (b) Ģekilde kesilmesi 21
Şekil 4.1. Yüzey sterilizasyon (a) 15 dk ve 30 dk muamele sonucunda soğanlarda hiç
bulaĢıklık yokken (b) 10 dk çamaĢır suyu muamelesiyle çıkan bulaĢıklıktan
bir görünüm 26
Şekil 4.2. Allium tuncelianum’un dikey olarak çeyrek kesilmiĢ soğan
eksplantlarından sürgün rejenerasyonu 29
Şekil 4.3. Allium tuncelianum’un dikey olarak çeyrek kesilmiĢ soğan eksplantların 1
mg/l 2, 4-D içeren MS ortamda sürgün rejenerasyonu 31
Şekil 4.4. Allium tuncelianum’un üst (a ve b) ve alt (c ve d) kısımlarından alınan
eksplantların sürgün rejenerasyonu 33
Şekil 4.5. Allium tuncelianum’un dikey olarak yarım kesilmiĢ soğan eksplantından 2
mg/l BAP-0.5 mg/l NAA içeren MS ortamda sürgün rejenerasyonu 34
Şekil 4.6. Allium tuncelianum’un kök eksplantlarından 5 mg/l BAP-0.5 mg/l NAA
içeren MS ortamında kök eksplantı üzerinde (a) 2-3 gün, (b) 4-5 gün, (c)
14-15 gün (d) ve 20-21 gün sonra soğancık oluĢumu görüntüleri 36
Şekil 4.7. Allium tuncelianum’un kök eksplantlarından 5 mg/l BAP-0.5 mg/l NAA
IX 2,4-D : 2,4-Diklorofenoksi asetik asit
BAP : 6-Benzilaminopurin
NAA : α-Naftalen asetik asit
ABA : Absizik Asit
IAA : Ġndolasetik Asit
IBA : Ġndolbütirik Asit
2ĠP : 6-dimetilaminopürin
LS ORTAMI : Linsmaier and Skoog Ortamı BDS ORTAMI : Basel Dunstan and Short
B5 : Gamborg et al Ortamı
MS ORTAMI : Murashige and Skoog Ortamı
cm : Santimetre
g/l : Gram/litre
mm : Milimetre
mg/l : miligram/litre
o
C : Santigrat derece (Celcius)
µl : Mikrolitre
1 1. GİRİŞ
Türkiye, kuzeyde Orta Avrupa’nın soğuk ve yağışlı iklimi, batıda Akdeniz iklimi, doğuda Orta Asya’nın kara iklimi ve güneyde ise sıcak ve kurak bir çöl ikliminin etkisi altında kalan çok özel bir kuşaktadır. Türkiye’deki bitki örtüsünün zenginliği; jeolojik çağlar boyunca geçirdiği değişiklikler ve yüzey şekillerinden kaynaklanmaktadır. Türkiye florası 12 054 adet bitki türü içermektedir (Güner ve ark. 2000, Özhatay ve ark. 1994, 1999, 2006, 2009, Özel 2008). Buna karşın, Avrupa Kıtası'nda yaklaşık olarak 12 000 bitki türü bulunmakta ve söz konusu tür zenginliği Avrupa’nın hiçbir ülkesinde bulunmamaktadır. Böylece Türkiye bitki çeşitliliği açısından bir kıta özelliği göstermektedir. Aynı zamanda sahip olduğu türlerin % 32.56’sı (3925) endemik olup Avrupa’da Endemik bitki bakımından en zengin ülke olan Yunanistan'da bile bu değer 800-1 000 arasındadır (Ekim ve ark. 2000). Endemizm oranının bu derece yüksek olması Türkiye’yi çiçekli bitkiler açısından ilginç kılmakta ve bir cazibe merkezi olma özelliği katmaktadır.
Türkiye florasında 800’den fazla geofit bitki bulunmaktadır (Davis 1988, Güner ve ark. 2000). Bu bitkiler daha ziyade Akdeniz, Ege, Doğu Karadeniz ile Doğu ve Güney Doğu Anadolu Bölgelerinde yayılış göstermektedir. Türkiye geofitlerinin yaklaşık 500 adedi soğanlı bitki olup, Nergisgiller (Amaryllidaceae), Süsengiller (Iridaceae) ve Zambakgiller (Liliaceae) familyaları tür zenginliği ve endemizm oranı bakımından en zengin familyalardır (Davis 1988).
Önceleri, Allium cinsi, Liliaceae familyasına bağlı bir cins olarak tanımlanmış, (Jones ve Mann 1963, Bayraktar 1970, Ekinci 1972, Günay 1983, Kütevin ve Türkeş 1987, Başer ve ark. 1993) ancak son 50 yılda bu konuda farklı yaklaşımlar ortaya çıkmıştır. Başlangıçta Allium cinsi Amaryllidaceae familyası altında incelenmiş olmakla birlikte, sonradan taksonomistler arasında ortaya çıkan genel yaklaşım, bu cinsin
Alliaceae familyası altında yer alması olmuştur (Rabinowich ve Browster 1990,
Brewster 1994). Yapılan bu yeni sınıflandırmaya göre Allium sativum L.;
Monocotyledones sınıfı, Liliiflorae üst takımı, Asparagales takımı, Alliaceae familyası
ve Allium cinsine bağlı bir tür olarak kabul edilmiştir.
Allium cinsi çok yıllık otsu bir bitkidir. Kuzey yarımkürede yayılan 750’den
2
olan Allium sativum Mısır ve Hindistan kültürlerinde 5000 yıl, Babilliler zamanında 4500 yıl ve Çinliler tarafından da 4000 yıl önce kullanıldığı bilinmektedir (Simon 2001). Bu konudaki ilk kayıtlar eski Mezopotamya (Dicle-Fırat arasındaki bölge – dolayısıyla Doğu ve Güney doğu Anadolu) da Sümerlere (M.Ö. 2600-2100) aittir. Sümerler, sarımsağı bir kültür bitkisi olarak yetiştirip baharat ve ilaç olarak kullanmışlardır. Bilinen en eski eczacılık kitabı olan Mezopotamya Farmakopesinde 250 kadar bitkisel ilaç arasında sarımsağın da bulunduğu belirtilmektedir (Erdemir ve Elçioğlu 1999). Sarımsak, Eski Yunanlılar ve Romalılar tarafından güç verdiği ve hastalıklardan koruduğu için askerlere yedirilmiştir. Özellikle eski Mısır, Roma, Çin, Japon, Hint ve İbrani toplumlarında sarımsağın ilaç olarak kullanıldığını bildiren yazıtlar bulunmaktadır. Bu yazıtlarda, sarımsağın tıbbi bitki olarak hastalık tedavisinde kullanımının çok eski tarihlere dayandığı bildirilmektedir (Jones ve Mann 1963, Bayraktar 1970, Ayyıldız 1996, Taşkın ve ark. 1997, Hahn 1996).
Türkiye, sarımsağın ikinci gen merkezi olarak tanımlanan Akdeniz havzasından Kafkaslara kadar olan bölgenin içinde yer alması nedeni ile büyük bir tür çeşitliliğine sahiptir (Etoh ve Simon 2002, Türkeş 1978). Türkiye’de Allium cinsine ait 159 takson olup (Seçmen ve ark. 1995), bunların 53 adeti endemiktir. Çizelge 1.1’ de Türkiye’nin endemik Allium türleri verilmiştir (Özhatay ve ark. 2009, Tubives 2012).
Türkiye’de bulunan endemik bitkilerin tamamı ile endemik olmayıp (non-endemik) nesli tehdit altında olan türler ilk kez 1980’li yıllarda kabul edilen uluslararası IUCN tehlike kategorilerine göre sınıflandırılmış ve 1989 yılında “Türkiye’nin Tehlike Altındaki Nadir Ve Endemik Bitkileri” (List of Rare, Threatened and Endemic Plants in Turkey) isimli kitap olarak yayınlanmıştır. Söz konusu kitap 2000 yılında revize edilerek tekrar yayınlanmıştır. Bu sınıflandırmada; aşağıdaki kategoriler belirlenmiştir.
EX- Extinct- Tükenmiş: Şayet taksonun son ferdin öldüğü konusunda hiçbir şüphe yoksa EX kategorisindedir.
EW- Extinct in the wild - Doğada tükenmiş: Takson bulunabileceği ortamlarda ve yılın farklı zamanlarında yapılan ayrıntılı araştırmalarda bulunamamış, yani doğada kaybolmuş fakat kültüre alınmış bir şekilde yaşamaya devam ediyorsa bu grupta yer alır.
3
EN- Endangered - Tehlikede: Bir takson oldukça yüksek risk altında ve yakın gelecekte yok olma tehlikesiyle karşı karşıya, ancak henüz CR grubunda değilse EN grubuna konulur.
VU- Vulnerable - Zarar görebilir: CR ve EN gruplarına konamamakla birlikte doğada orta vadeli gelecekte yüksek tehdit altında olan taksonlar bu gruba girer.
LR- Lower risk - Tehdit altında: Populasyonları iyi ve en az 5 lokaliteden bilinenler bu kategoriye konulmuştur. Gelecekteki durumlarına göre 3 alt kategorisi vardır.
a- (cd) Conservation dependent - Koruma önlemi gerektiren: 5 yıl içinde yukarıdaki kategorilerden birisine girebilecek taksonlar. Hem tür, hem de habitat açısından özel bir koruma statüsü gerektirenler.
b- (nt) Near threatened - Tehdit altına girebilir: Bir evvelki kategoriye konamayan ancak VU kategorisine konmaya yakın adaylar.
c- (lc) Least deficient - En az endişe verici: Herhangi bir koruma gerektirmeyen ve tehdit altında olmayanlar.
DD- Data deficient - Veri yetersiz: Bir taksonun dağılım ve bolluğu hakkındaki bilgi yetersiz ise, takson bu gruba konur.
CR- Critically endangered - Çok tehlikede: Bir takson çok yakın gelecekte yok olma riski altında ise bu gruba konur.
NE- Not evaluated – Değerlendirilemeyen: Yukarıda ki herhangi bir kriter ile değerlendirilemeyenler bu gruba konur.
4 Çizelge 1.1. Türkiye’nin endemik Allium türleri
No Takson İsmi Bulunduğu
Yükseklik (metre)
Türkiye Dağılımı Kırmızı Kitaptaki Sınıflandırılması
1 Allium czelghauricum BORDZ. D. Anadolu DD
2 Allium koenigianum GROSSH. D. Anadolu DD
3 Allium gayi BOISS. 0-1800 G. Anadolu LR(nt)
4 Allium isauricum HUB.-MOR. ET WENDELBO 1900-2020 G. Anadolu VU
5 Allium incisum FOMIN 1650-1700 D. Anadolu VU
6 Allium peroninianum AZNAV. 250-1600 D. Anadolu LR(nt)
7 Allium microspathum EKBERG 0-2800 D. Anadolu LR(cd)
8 Allium alpinari N. ÖZHATAY ET KOLLMANN 0-2300 G. Anadolu VU 9 Allium balansae BOISS. 2440-2775 K. ve D. Anadolu LR(cd) 10 Allium tchihatschewii BOISS. 1000-2000 D. Anadolu LR(lc)
11 Allium wendelboanum KOLLMANN GD. Anadolu VU
12 Allium sieheanum (HAUSSKN. EX) KOLLMANN 900-1200 O. Anadolu LR(lc) 13 Allium sivasicum N. ÖZHATAY ET KOLLMANN 900-1800 O. Anadolu LR(lc) 14 Allium djimilense BOISS. EX REGEL 1700-3000 D. Anadolu LR(lc) 15 Allium sibthorpianum SCHULTES ET
SCHULTES FIL.
700-2500 K. ve O. Anadolu LR (lc) 16 Allium tauricola BOISS. 1200-2900 K., D., O. ve G.
Anadolu
LR(lc) 17 Allium brevicaule BOISS. ET BAL. 600-2500 G. ve O. Anadolu LR (lc) 18 Allium kurtzianum (ASCHERSON & SINT. EX)
KOLLMANN
KB. Anadolu(B.) EN 19 Allium flavum L. SUBSP. flavum Lm. VAR. minus
BOISS.
1600-2500 K. Anadolu VU
20 Allium flavum L. SUBSP. tauricum (BESSER EX
REICHB.) STEARN VAR. pilosum KOLLMANN ET KOYUNCU
0-800 G. Anadolu VU
21 Allium phrygium BOISS. 900-1850 O. Anadolu LR(lc)
22 Allium deciduum N. ÖZATAY ET KOLLMANN
SUBSP. deciduum N. ÖZHATAY
550-2000 GB. Anadolu LR(cd)
23 Allium deciduum N. ÖZHATAY ET KOLLMANN
SUBSP. retrorsum N. ÖZHATAY ET KOLLMANN
550-2000 ? VU
24 Allium olympicum BOISS. 1300-2800 K. Anadolu LR(lc)
25 Allium kastambulense KOLLMANN 40-1250 K. Anadolu LR(nt) 26 Allium armenum BOISS. ET KOTSCHY 900-2440 D. Anadolu LR(lc) 27 Allium huber-morathii KOLLMANN, N.
ÖZHATAY ET KOYUNCU 1000-2000 O. Anadolu LR(lc)
28 Allium pictistamineum O. SCHWARZ VAR. humile REGEL
200-980 B. Anadolu LR(cd)
29 Allium variegatum BOISS. 0-1100 D. Anadolu VU
30 Allium sandrasicum KOLLMANN, N. ÖZHATAY
ET BOTHMER
10-300 GB. Anadolu LR(cd)
31 Allium oltense GROSSH 0-1350 KD. Anadolu VU
32 Allium cappadocicum BOISS. 900-1400 O. Anadolu LR(lc)
33 Allium macrochaetum BOISS. ET HAUSSKN.
SUBSP. tuncelianum KOLLMANN
1100-2100 D. ve O. Anadolu VU
34 Allium stearnianum KOYUNCU, N. ÖZHATAY
ET KOLLMANN SUBSP. stearnianum KOYUNCU, N. ÖZHATAY ET KOLLMANN
1600-1750 O. Anadolu LR(cd)
35 Allium stearnianum KOYUNCU, N. ÖZHATAY
ET KOLLMANN SUBSP. vanense KOLLMANN ET KOYUNCU
2500-3000 D. Anadolu LR(nt)
36 Allium proponticum STEARN ET N. ÖZHATAY
VAR. proponticum STEARN ET N. ÖZHATAY
0-600 B. Anadolu LR(lc)
37 Allium proponticum STEARN ET N. ÖZHATAY
VAR. parviflorum KOLLMANN
800-900 G. Anadolu VU
38 Allium stylosum O. SCHWARZ 100-1800 B., GB. ve O. Anadolu
LR(lc) 39 Allium reuterianum BOISS. 1800-2100 B., GB. Anadolu LR(lc) 40 Allium phanerantherum BOISS. ET HAUSSKN.
SUBSP. deciduum KOLLMANN ET KOYUNCU
200-1800 G. Anadolu LR(nt)
41 Allium nevsehirense KOYUNCU ET KOLLMANN 800-1900 O. Anadolu LR(lc) 42 Allium gorumsense BOISS. 0-1280 G. Anadolu (Adana) EN
5
44 Allium junceum SM. SUBSP. tridentatum
KOLLMANN, N. ÖZHATAY ET KOYUNCU 5-10 G. Anadolu LR(cd)
45 Allium scabriflorum BOISS. 700-1700 O. ve G. Anadolu LR(lc)
46 Allium armerioides BOISS. GD. Anadolu DD
47 Allium baytopiorum KOLLMANN ET N.
ÖZHATAY
0-1200 D. Anadolu EN
48 Allium robertianum KOLLMANN 0-1550 G. Anadolu LR(nt)
49 Allium sosnowskyanum MISCZ. 1270-1650 KD. Anadolu LR(lc) 50 Allium stenopetalum BOISS. ET KOTSCHY 1280 G. Anadolu EN 51 Allium karamanoglui KOYUNCU & KOLLMANN 0-800 G. Anadolu EN 52 Allium shatakiense RECH. FIL. 1800-2750 D. Anadolu LR(nt)
53 Allium rhetoreanum NAB. 0-2100 GD. Anadolu VU
Tubives.gov.tr, (erişim tarihi: 03.02. 2012) ve Ekim ve ark. 2000 (değiştirilerek)
Bu tezin çalışma konusu olan Allium tuncelianum, Allium cinsinin Türkiye’ye özgü endemik bir türü olup, dünyada sadece Tunceli iline bağlı Ovacık, Hozat ve Pülümür İlçeleri (Şekil 1.1) ile Munzur dağı yamaçları (Şekil 1.2) ve Tunceli ili ile Erzincan ile Sivas sınırları arasındaki meşe ormanı alanlarında yayılış göstermektedir.
Türkiye Bitkiler Kırmızı Kitap (Eğrelti ve Tohumlu Bitkiler - Ekim ve ark. 2000)’ta Allium tuncelianum bitkisi VU- Vulnerable - Zarar görebilir: CR ve EN gruplarına konmamakla birlikte doğada orta vadeli gelecekte yüksek tehdit altında olan taksonlar grubuna girmektedir.
6
7
Şekil 1.2. Munzur dağı eteklerinde tarla koşullarında Tunceli sarımsağının üretiminde çalışan işçiler (www.tuncelitarim.gov.tr (erişim tarihi: 03.02. 2012)
Şekil 1.3. Munzur dağı yamaçlarında meşe ormanlık alanlarında yayılış gösteren Allium tuncelianum’un çiçeklenme döneminden görünümü
Tunceli sarımsağı ilk kez Allium macrochaetum’un bir alt türü olarak tanımlanmıştır (Kollman 1983). Ancak daha sonra yapılan çalışmalarda bunun farklı bir
8
tür oldugu anlaşılmış ve tür düzeyine yükseltilerek Allium tuncelianum adı verilmiştir (Özhatay ve Mathew 1995). Tunceli sarımsağı (Allium tuncelianum) Monocotyledonea (tek çenekliler) sınıfının, Liliflore takımında ve Liliaceae familyasının Allium cinsi içerisinde yer almaktadır (Çizelge 1.2-Hanelt 1990). Kromozom sayısı ise 2n=16’dır (Özhatay 2002).
Çizelge 1.2. Allium tuncelianum bitkisinin bilimsel künyesi
Familya Alliaceae
Cins Allium
Tür Allium tuncelianum (Kollmann) Özhatay, B.Mathew & Şiraneci, Kew Bull. 50: 723 (1995)
Sinonimi A.macrochaetum Boiss. & Hausskn. subsp. tuncelianum Kollmann, Notes R.B.G. Edinb. 41:262, f. 6 (1983).
Tip Örneği Türkiye: B7 Tunceli: Munzur Da., Aksu Dere above Ovacik, 1800 m, 21 vii 1957, Davis 31498 (holo. E )
Yetişme Ortamı/habitat Kuru, kayalık, çakıl akıntılı ve erozyonlu yamaçlar
Yükseklik 1000- 2500 m’ler arası
Fitocoğrafik Bölgesi İran-Turan elementi
Tehlike Kategorisi Türkiye Bitkileri Kırmızı kitabına göre VU (Vulnerable)- Duyarlı, Zarar
görebilir
Ülkemizde Yayılışı Yukarı Kızılırmak ve Yukarı Fırat Bölümleri: B6 Sivas, B7 Tunceli, Erzincan çevreleri.
Dünyada ki Yayılışı Türkiye (Endemik)
(TİM 2012a) (www.tuncelitarim.gov.tr-erişim tarihi: 03.02. 2012)
Alper (2005), Tunceli sarımsağının çiçek sapı uzunluğunun 80-110 cm, çiçek sapı, kapçık rengi ve taç yaprak renginin; beyaz, açık mor ve mor arasında değişim gösterdiğini, çiçeklerde 6 adet erkek organ ve 1 adet dişi organ bulunduğunu ve bir meyvede 4-6 adet tohum alınabileceğini belirlemiştir. Ayrıca, tohumların siyah renkli 1-2 mm çapında, 3 köşeli ve üzerlerinin buruşuk olduğu ve 1000 tohum ağırlığının 3,1-2 g olduğunu saptamıştır (Yanmaz ve Ermiş 2005).
Tunceli sarımsağı ile ilgili yapılan kimyasal analizlerde (Çizelge 1.3.); protein ve karbonhidrat oranlarının sırası ile % 2.38 ve % 28.1; E, B1, B2, B6 ve Niasin vitaminleri yanında yağ asitleri içeriği bakımından % 5.31 stearik, % 13.07 oleik, % 13.07 linolenik ve % 24.87 oranında palmitik asit, bitki mineral içeriği bakımından da oldukça zengin olup % 19.58 P, % 42.23 Ca, % 208.6 mg K ve % 13.12 Na içermektedir (TİM 2012c).
Tunceli sarımsağı, kültürü yapılan sarımsak (Allium sativum) türünün aksine tek dişli olup, genellikle yetiştiği bölgede Yöre halkı tarafından “Dağ Sarımsağı, Yabani
9
Sarımsak, Kaya Sarımsağı” adları ile tanınmakta ve doğadan toplanarak yaygın olarak tüketilmektedir. Toplamanın yoğun olduğu yıllarda sarımsak çevre iller ve özellikle İstanbul’da pazarlanmaktadır. Bitki, doğada sürekli ve bilinçsiz toplamalardan dolayı baskı altına alınmakta, tahribat görmekte ve yayılış alan gün geçtikçe daralmaktadır.
Tunceli sarımsağının son yıllarda ekonomik önemine paralel olarak tüketim miktarı da artmıştır. Özellikle her sene temmuz ayının son haftası Tunceli ilinde yapılan Munzur Festivali nedeniyle dışarıdan gelen insanlar Tunceli sarımsağının varlığı ve gıda olarak tüketimi hakkında bilgi sahibi olmakta ve satın almaktadırlar. Bu yüzden yıldan yıla tüketimi ve buna bağlı olarak doğadan sökümü ciddi şekilde artmaktadır. VU kategorisinden görülmesinden bugüne uzun zaman geçmiş olup (yaklaşık olarak 11 yıl) her geçen gün doğadan bilinçsizce toplanma miktarı artmış ve doğal yayılış alanında hızlı bir şekilde tahribata uğramıştır.
Tunceli sarımsağı ile ilgili olarak Ulaşılabilir Yaşam Derneği tarafından yürütülen bir proje kapsamında bitkinin doğal ortamda nasıl çoğaldığı ve kültüre alınmasına yönelik çalışmalar yapılmıştır. Bu çalışmalarda Tunceli, Ankara ve Yalova koşullarında bitkinin yavru soğancıklarından ve tohumdan üretme çalışmaları ile birlikte
in vitro çoğaltma çalışmaları gerçekleştirilmiştir (GEF 2003). Ayrıca, Dicle
Üniversitesi, Ziraat Fakültesi, Tarla Bitkileri Bölümünde de Tunceli sarımsağı ile ilgili çalışmalar yürütülmekte ve olumlu sonuçlar alınmaktadır (Şekil 1.4).
10
Şekil 1.4. Allium tuncelianum bitkisi (a) Dicle Üniversitesi Ziraat Fakültesi Tarla Bitkileri Bölümü
Soğanlı Bitkiler Koleksiyon Bahçesinden; Allium tuncelianum bitkisinin toprak üstü, (b) çiçek (floresans) aksamı, (c) tohumları ve (d) soğanlarının görüntüleri
T.C Tunceli Valiliği İl Gıda Tarım ve Hayvancılık Müdürlüğü 2011 yılında Tunceli sarımsağının yerinde korunması ve çiftçi şartlarında kültüre alınması için hazırladığı “Tarlanda Üret Sofranda Tüket” projesi için Fırat Kalkınma Ajansından Doğrudan Faaliyet Desteği hibe programından destek almıştır.
Söz konusu proje ile kısa vadede Tunceli Sarımsağı üretim planın hazırlanması, yetiştirme tekniklerinin geliştirilmesi, verim ve kalitenin artırılması ve üreticilerin teknik kapasitesinin yükseltilmesi, Tunceli sarımsağının analizlerinin yapılarak tıbbi değerinin ortaya konması (Çizelge 1.3), Tunceli sarımsağının, coğrafik işaretleme ve marka tescilini almak ve oluşturmak başta olmak üzere, yerel/ ulusal pazarlama ve tanıtım stratejileri belirleyerek pazarlanma koşullarının sağlanması, Tunceli Sarımsağının (Allium tuncelianum) korunması, toplayıcıların bilinçlendirilmesi ve onların üretici ailelere dönüştürülmesi, kültüre alınması ve tarla şartlarında üretiminin yapılması, girişimci ve yenilikçi yaklaşımlarla bu kaynağın etkin, çevreye duyarlı bir şekilde kullanılması, istihdamın geliştirilmesi ve ilin ekonomik potansiyelinin harekete
11
geçirilmesi amaçlanmıştır. Projenin planlama ve uygulanması için konu ile ilgili Ziraat Mühendislerinden 4 kişilik bir proje ekibi kurulmuştur. Ayrıca konu uzmanı akademisyenlerden bilim danışma kurulu kurulmuştur. Projenin yürütücülüğünü Tunceli Gıda, Tarım ve Hayvancılık İl Müdürlüğü yapmaktadır. Proje bünyesinde www.tuncelisarimsaği.net (erişim tarihi: 03.02.2012) adresli bir web sayfası hazırlanarak hizmete sunulmuştur (TİM. 2012 b) (www.tuncelitarim.gov.tr-erişim tarihi: 03.02.2012).
Çizelge 1.3. Tunceli sarımsağına ait gıda analiz sonucu
Analiz Sonuç Analiz Sonuç
Enerji 124 kcal/100 g Palmitoleik Asit 0.78 %
Nem 63.14 g/100 g Stearik Asit 5.31 %
Kül 0.91 g/100 g Oleik Asit 13.07 %
Protein 2.38 g/100 g Linolenik Asit 13.07 %
Karbonhidrat 28.10 g/100g g-Linolenik Asit 5.43 %
Toplam Şeker 25.0 g/100 g Palmitik Asit 24.87 %
Diyet Lif 5.24 g/100 g Kaproik Asit 0.59 %
Yağ 0.23 g/100 g Kaprilik Asit 0.80 %
E vitamini 0.54 g/100 g Kaprik Asit 0.90 %
B1 vitamini 0.083 mg/100 g Laurik Asit 1.24 %
B2 vitamini 0.05 mg/100 g Miristik Asit 5.14 %
B6 vitamini 0.18 mg/100 g Cu (Bakır) 0.011 mg/100 g
Zn (Çinko) 5.55 mg/100 g
Folik Asit 66.70 µg/100 g Fe (Demir) 7.98 mg/100 g
Niasin 1.03 mg/100 g P (Fosfor) 19.58 mg/100 g
B12 vitamini 0.132 µg/100 g Ca (Kalsiyum) 42.23 mg/100 g
K1 vitamin 12.44 µg/100 g Mg (Magnezyum) 21.73 mg/100 g
C vitamini 7.22 mg/100 g Mn (Mangan) 0.18 mg/100 g
Kuru madde % 37.94 K (Potasyum) 208.6 mg/100 g
Kolesterol TED Na (Sodyum) 13.12 mg/100g
pH 6.56 Se (Selenyum) 0.0013 mg/100 g
(TİM. 2012c) (www.tuncelitarim.gov.tr-erişim tarihi: 03.02. 2012)
Daha önce yapılan çalışmalarda Allium tuncelianum bitkisinin mikro çoğaltım veya doku kültürü ile adventif soğan oluşumu ile çok başarılı sonuç alınamamıştır (Yazar 2006).
Tohumla çoğaltma çalışmaları sırasında yapılan ön denemelerde, tohumların çimlenme oranının çok düşük olduğu belirlenmiştir. Yapılan çalışmada tohumlardan 2 aylık bir süreçte ancak %2’lik bir çimlenme oranı elde edilmiştir (Yanmaz ve Ermiş 2005).
Bu tez çalışması kapsamında; Allium tuncelianum bitkisinde in vitro hızlı çoğaltım teknikleri geliştirerek, bitkinin üretimi için etkili, hızlı ve güvenli bir yol bulunması hedeflenmektedir.
13 2. KAYNAK ÖZETLERİ
Türkiye üç kıtanın birleştiği ve üç tarafı denizlerle çevrili, farklı yükseltilere (deniz seviyesinden 5000 metre yüksekliğe kadar) sahip bir kara parçasında olduğu için zengin iklim çeşitliliğine ve dolayısıyla çok sayıda bitki türüne sahiptir. Türkiye florasında 12 054 tohumlu bitki türü bulunmaktadır ve her dört türden birinin endemik olması Türkiye florasının önemini daha da arttırmaktadır. Türkiye florasında 800’den fazla geofit bulunmaktadır. Bu geofitlerin yaklaşık 500 kadarı soğanlı bitki olup,
Allium cinsine bağlı 159 taksondan 53 tanesi endemiktir. Bu tez kapsamında çalışılan Allium tuncelianum bitkisi Türkiye’ye özgü endemik bir tür olup, Yukarı Kızılırmak ve
Yukarı Fırat Bölümleri: B6 Sivas, B7 Tunceli ve Erzincan çevrelerinde bulunmaktadır. Dünya’da ve Türkiye’de fazla bilinen bir tür olmaması nedeniyle Allium tuncelianum üzerine çok az sayıda çalışma bulunmaktadır. Bu çalışmaların birçoğu tarla denemeleri ve sitogenetik çalışmalar vb şekildedir. Allium tuncelianum ve Allium cinsine ait bazı türler üzerine yapılan önemli doku kültürü ve mikro çoğaltım çalışmalar aşağıda verilmiştir.
Nil (1977), sarımsakta (Allium sativum) kallus kültürü kullanarak organogenesis ve embriyogenesis yoluyla bitki elde etmek için etkili büyüme düzenleyici konsantrasyonlarını belirlemek amacıyla yaptıkları araştırmada, gövde, yaprak diskleri ve sürgün ucu parçalarını kullanmıştır. Çalışma sonucunda, AZ ortamına kallus oluşumu için konulan her üç eksplantından yüksek oksin ve düşük sitokinin konsantrasyonlarında (10 µ M (2 mg/l) p-CPA (p-klorofenoksiasetik asit) + 2 µ M (0.4mg/l) 2,4-D + 0.5 µ M (0.1 mg/l) kinetin) %55, % 83 ve % 10 oranında kallus oluşumu görülmüştür. Meydana gelen kalluslar değiştirilmiş AZ ortamında (18 µ M (3.6 mg/l)Amonyum azotu ve 40 µ M (8 mg/l) Nitrat azotu ) 10 µ M (2 mg/l) kinetin ile 10 µ M (2mg/l) IAA bulunan ortamda sürgün oluşturmuşlardır. Kinetin dozundaki artış ve uzun süreli (1 aylık) kültür koşullarında (20 µ M (4 mg/l) kinetin + 10 µ M (2 mg/l) IAA) sürgünlerde farklılaşma ve embriyoid oluşumu meydana gelmiştir.
Bhojwani (1980), sarımsakta (Allium sativum) virüsten arındırılmış bitki elde etmek amacıyla 5-8 mm sürgün uçlarını B5 ortamında 2iP (6dimetilaminopurin) ve NAA’in çeşitli konsantrasyonlarının bulunduğu ortamlara kültüre almıştır. Kültüre aldıktan 14 gün sonra sürgün uçlarında kardeşler görülmeye başlamıştır. Maksimum
14
kardeş sayısı (6 adet/bitki) 6. haftada 0.5 mg/l 2iP + 0.1 mg/l NAA bulunan ortamlarda belirlenmiştir. Alt kültür sayısı arttıkça bitkilerde baş oluşumunda çoğalma ve kardeşlenme sayısında azalma görülmüştür. Kardeş sayısının artmasında, sitokinin-oksin kombinasyonlarının birlikte kullanılmasının daha etkili olduğu belirlenmiştir. En düşük kardeş sayısı sadece oksin bulunan (NAA) ortamlarda görülmüştür. En iyi köklenme ortamının B5 + 0.2 mg/l NAA + 0.01 mg/l 2iP olduğunun belirlendiği araştırmada, NAA dozundaki artış (0.5 mg/l) köklenme oluşumunu azaltmıştır (% 56.5). Deneme sonucunda % 70 oranında sağlıklı bitki elde edilmiştir.
Matsuda ve Adachi (1996), A. tuberosum‘da dört farklı çeşitte somatik embriyogenesis yoluyla bitki elde etmek amacıyla yaptıkları çalışmada embriyo oluşumunun çeşitlere göre değiştiğini belirterek Green-Belt ve Giant-Belt çeşitlerinde somatik embriyo oluşumu görülmezken, Super-Green Belt ve Wild-Green çeşitlerinde % 54.7 ve % 30.1oranında somatik embriyo oluşumu gözlenmiştir. Aynı çalışmada çeşit yanında farklı konsantrasyonlardaki 2,4-D’nin kallus oluşumuna etkisi araştırılmış ve çalışma sonucunda 5.0 mg/l 2,4-D bulunan ortamda embriyonik kallus oluşumu görülmemiştir.
Haque ve ark. (1997), sarımsakta (Allium sativum) büyümeyi düzenleyici tipi ve dozu, temel besin ortamı ve köklerin alındığı bitki yaşının kök ucu kültürü yoluyla sürgün elde etmedeki etkisini ortaya koymak amacıyla yürüttükleri çalışmada, en uygun büyümeyi düzenleyici kombinasyonunu 1 µ M (0.2 mg/l) NAA (Naftalenasetik asit) + 10 µ M (2 mg/l) BA (Benziladenin) olarak belirlemişlerdir. Bu kombinasyonda kök uçlarının % 75’i sürgün oluşturmuştur. Sarımsak başlarının dikiminden 15-18 gün sonra alınan kök uçlarından daha hızlı sürgün oluşmuştur. MS ortamında kök başına 10 sürgün elde edilirken, B5 ortamında eksplant başına sürgün sayısı daha fazla olmasına karşılık, daha cılız sürgünler elde edilmiştir. Hormonsuz besin ortamlarında köklenme meydana gelmiş, köklenen bitkiler dış koşullara başarılı bir şekilde alıştırılmış ve dış görünüş yönünden bitkiler arasında önemli farklılıklar görülmemiştir. Geliştirilen yöntemin sarımsak üretiminde başarıyla kullanılabileceği belirtilmiştir.
Ayabe ve Sumi (1998), sarımsak (Allium sativum) dişlerinden ayrılan gövde disklerinin de sarımsağın mikro çoğaltımında önemli olduğunu belirterek, hormonsuz LS (Linsmaierve Skoog) ortamında ve 0.1 mg/l NAA ve 0.1 mg/l BA’li ortamlarda
15
kültüre alınan gövde disklerinden 2 hafta sonunda çok sayıda sürgün ucu gelişebildiğini kaydetmişlerdir. Sürgünlerin % 90’ın dan fazlasının soğan oluşturduğu ve rejenerasyon dan önce sarımsak başlarının yaklaşık 8 hafta 4˚C’de ön muamele yapılmasının hem sürgün oluşumunu hem de soğan oluşumunu artırdığını bildirmişlerdir.
Myers ve Simon (1999), sarımsakta (Allium sativum) Kök kültürü ile yaptıkları çalışmada ise kallus yaşının (4, 6, 9, 12 aylık ) artmasına paralel olarak sürgün rejenerasyonunda ve bitki parçası başına düşen sürgün sayısında azalma meydana geldiği ve sürgün rejenerasyonu yönünden en iyi sonuçların 6 ve 6 aydan daha az yaşlı kalluslardan elde edildiğini belirlemişlerdir.
Garcia ve Vargas (2000), 4 farklı sarımsak (Allium sativum) çeşidinde, meristem dokularından sürgün çoğaltmak amacıyla yaptıkları araştırmada, MS ortamına katılan NAA+BA ve NAA+2iP kombinasyonlarının etkisini araştırmışlardır. Araştırma sonucunda kardeş sayısı çeşitlere göre 1.83 ile 3.85 adet arasında değişim göstermiş, en iyi sonuçlar 0.5 mg/l 2 iP ve 0.2 mg/l NAA kombinasyonundan elde edilmiştir.
Sata ve ark. (2001), sarımsağın (Allium sativum) mikro çoğaltımında daha pratik ve fazlasayıda bitki elde etmek için İn vitro teknikler geliştirmek amacıyla yaptıkları çalışmada sarımsak dişlerin dip kısımlarından aldıkları dokulardan somatik embriyo oluşumu için, farklı büyüme düzenleyicilerin (0.0, 0.5, 1.0, 1.5, 2.0, 2.5 mg/l kinetin ile 0,0 0.5, 1.0,1.5, 2.0, 2.5 mg/l 2,4-D), temel besin ortamının (White’s) ve bitkicik tipinin etkisini araştırmışlardır. En iyi büyümeyi düzenleyici kombinasyonu olarak % 60 somatik embriyo oluşumu sağlayan 1.0 mg/l 2,4-D ve 0.5 mg/l kinetin kombinasyonu belirlenmiştir
Roksana ve ark. (2002), sarımsakta (Allium sativum) sürgün ucu kültüründen soğan elde edilmesi amacıyla yaptıkları çalışmada 0.2-0.3 mm uzunluğundaki sürgün uçlarını MS ortamında 2iP, BA, kinetin (0.01, 0.05, 0.1, 0.5, 1.0, 1.5, 2.0, 3.0, 4.0, 5.0 mg/l) ile NAA ve IAA (0.05, 0.1, 0.2, 0.25, 0.5 mg/l) kombinasyonlarının bulunduğu sıvı ve yarı sıvı ortamlarda kültüre almışlardır. En yüksek kardeşlenme oranı dikimden 3 hafta sonra 0.5 mg/l 2iP + 0.25 mg/l NAA (9.8 ± 1.2) bulunan ortamdan elde edilmiştir. Bunu 7.9±0.9 ile 1.5 mg/l BA + 0.5 mg/l NAA bulunan ortam izlemiştir. Bu sonuca göre düşük orandaki 2iP+NAA, yüksek kardeşlenme oranında daha etkili olmuştur. Hormonsuz ortamda kardeşlenme meydana gelmemiştir. Çalışma sonuçlarına
16
göre erken kardeşlenme açısından sitokininlerin tek kullanılması yerine olduğu sitokinin-oksin kombinasyonlarının daha etkili ve sıvı ortamlarda 9 kardeşlenmenin daha erken başladığı görülmüştür.
Fereol ve ark. (2002), sarımsakta (Allium sativum) somatik embriyo oluşturma ve bitki çoğaltma konusunda protokol geliştirmek amacıyla yürüttükleri araştırmada, genç yaprak ve kök kısımlarından in vitro koşullarda kallus elde etmeyi denemişlerdir. Yaprak parçalarından daha az miktarda kallus elde edilmesine rağmen, embriyonik kapasitenin daha yüksek olduğu belirlenmiştir. B5 ortamında 2 ay sonunda 0.1 mg/l 2,4-D (2,4-2,4-Diklorofenoksiasetik asit) + 0.5 mg/l kinetin kombinasyonunda % 75 oranında globular aşamada embriyo elde edilmiştir. Daha sonra elde edilen somatik embriyolardan % 30‘u bitkiye dönüştürülmüş ve serada dış koşullara adapte edilmiştir.
Kim ve ark. (2003), sarımsak (Allium sativum) kalluslarından sürgün elde etmek ve in vitro ortamda diş oluşumunu sağlamak amacıyla yürüttükleri araştırmada, yaprak parçalarını kullanmışlar ve farklı büyümeyi düzenleyici konsantrasyonları ve şeker dozlarının etkisini incelemişlerdir. Araştırma sonucunda, en fazla kallus MS ortamında 1.0 mg/l 2,4-D, 30 g/l sakkaroz ve 8 g/l agar katılmış ortamlardan alınmıştır. 3.0 mg/l kinetin+3.0 mg/l NAA ve 30 g/l sakkaroz kombinasyonunda kalluslardan daha fazla sürgün elde edilmiştir. Jasmonik asit dozunun 0.5 mg/l’den 2.0 mg/l’ye çıkarılmasıyla 10 diş oluşumu artmış, buna karşılık JA diş oluşumunu engellemiştir. En yüksek diş oluşturma oranı (% 96), 25 0C sıcaklıkta 2 ay sonunda 2.0 mg/l jasmonik asit ve 120
mg/l sakkaroz, katılmış ortamdan elde edilmiştir. Aynı araştırmada sürgün verimi ve soğan oluşumu sıvı kültür koşullarında incelenmiştir. 9 hafta sonunda ölçülen en fazla çoğalma oranı 135 soğancık/bitki parçası ile 5.1 mg/lNAA + % 11 (w/v) sakkaroz + 10 µ M (2 mg/l) JA katılan ortamlardan alınmıştır. Büyüme engelleyicilerden CCC (Kloroklorin klorid), B-9 (Daminozid), ABA (Absizikasit) da soğancıkların büyümesinde uyarıcı rol oynamıştır. Ayrıca karanlık ortam soğancık oluşumunda uyarıcı etkisi görülmüştür. Soğancıklarda dinlemenin kırılmasında 4 C’de 8 hafta soğuk uygulaması etkili olmuştur.
Haque ve ark. (2003), sarımsakta (Allium sativum) 2,4- D (0, 0.5, 1.0, 1.5, 2.0 mg/l) ile BA (0,0.5, 1.0 mg/l) kombinasyonlarının in vitro koşullarda çoğalmaya etkisini inceledikleri çalışmalarında bitki eksplant olarak kök ucu, gövde ve yaprak eksplant
17
kullanmışlardır. Çalışma sonucuna göre, en fazla kallus gelişimi yaprak eksplantları ile yüksek oranda 2,4 –D ve BA bulunan (2.0 mg/l 2,4- D + 1.0 mg/l BA) ortamlardan alınmıştır (% 80). Gövde eksplantından ve kök ucundan aynı ortamda % 75 ile % 70 oranında kallus oluşumu görülmüştür. Bitkiler dış koşullara başarıyla aktarılmış ve % 40-60 oranında sağlıklı bitki elde edilmiştir.
Humberto ve ark. (2004), sarımsakta (Allium sativum) 5 çeşitle yapılan sürgün ucu kültürü çalışmasında NAA, IAA, IBA (0.05, 0.1 mg/l) ile kinetin (0.1 mg/l) kombinasyonlarını denemişlerdir. Çalışma sonucuna göre, en yüksek kardeşlenme oranı % 89 ile NAA (0.1mg/l) + kinetin (0.1 mg/l) bulunan ortamda meydana gelmiştir.
Martin ve ark. (2004), tarafından sarımsakta (Allium sativum) gerçekleştirilen kök kültürü çalışmasında sürgün çoğalma oranına besi ortamı ve ışığın etkisi incelenmiş ve çalışmada kök uçları, üç farklı ortamda (A3: B5+0.03 mg/l 2,4-D+2 mg/l NAA+3 mg/lBA, B4: B5+2 mg/l NAA+3 mg/l BA, H: MS + 0.2 mg/l NAA+2.2 mg/l BA) 16/8 saat (ışık/karanlık) ve karanlık koşullarda kültüre alınmıştır. Çalışma sonucunda, kök uçlarında en fazla kallus oluşumu B4 ortamında meydana gelmiştir (% 64). Bunu % 41 ile A3 ve % 37 ile H ortamı izlemiştir. Kardeşlenme açısından ortamlar karşılaştırıldığında H ortamında kardeş oluşumu görülmezken en fazla kardeşlenme A3 ortamında (% 50) ve kallusların ışık altında tutulduğu uygulamalardan elde edilmiştir. Ayrıca köklerdeki rejenerasyonun ışıklı ortamda karanlık ortamda bekletilen köklere göre daha iyi olmuştur.
Mukhopadhyay ve ark. (2005), soğan (Allium cepa var. rosette) ve sarımsakta (Allium sativum var. rosette) genç yaprak parçalarını kullanarak yaptıkları kallus kültürü çalışmasında, yaprak parçalarını kallus oluşumu için 9.05 µ M (1.81 mg/l) 2,4-D ve 0.93 µ M (0.19mg/l) kinetin bulunan ortama kültüre aldıktan 4 hafta sonra hepsinde kallus oluşumu görüldüğünü belirtmişlerdir. Oluşan kalluslar, rejenerasyon amacıyla farklı dozlarda NAA (5.37 µ M (1.07 mg/l), 10.74 µ M (2.15 mg/l)) ve kinetin (0.93, 4.65, 9.29 µ M(0.19, 0.93, 1,90 mg/l)) bulunan sıvı MS besin ortamında kültüre alınmış ve 2hafta sonra kalluslarda rejenerasyon başladığı görülmüştür. Her iki türde de 5.37 µ M(1.07 mg/l) NAA+4.65 µ M (0.93 mg/l) kinetin bulunan ortamlarda fazla sayıda sürgün (13 adet) ve kök (10 adet) meydana gelmiştir. Elde edilen bitkiler başarıyla adapte edilmiştir.
18
Baktır (2005) Tunceli sarımsağında in vitro üretim çalışmalarında, BA’nın 0.05-2.5 ppm ve IBA’nın 0.005-0.05-2.5 ppm arasında değişen dozlarını kullanmış ve bitkilerin boylanma, kardeşlenme ve köklenme durumlarını gözlemlemiştir. Başlangıçta yüksek BA dozlarında hızlı büyüme tespit edilmiş, ilerleyen günlerde büyüme miktarının azaldığı belirtilmektedir. Hızlı büyüme esnasında vitrifikasyon görüldüğü ve hızlı büyümenin doku kültürü ortamında istenmeyen bir durum olduğu belirtilmektedir. Araştırıcı, 0.005 ppm IBA ve 0.05 ppm BA içeren ortamlarda hiçbir büyüme gözlenmediğini, bütün MS ortamlarında ortalama 0.077g ağırlığındaki yavru soğanların yüksek hormon konsantrasyonuna olumlu tepki verdiklerini bildirmiştir. Araştırıcı, 0.005 ppm IBA gibi düşük dozlarda % 11.5 oranında kök oluşumunun gözlendiği, kök sayısının 2. aydan sonra 3’e kadar çıktığını, kökler uzun süre orijinal beyaz rengini muhafaza etmiş ancak iki aydan sonra krem renge dönüşmüş, kardeşlenme oranının en yüksek 1.7 olduğu ve bunun da ekonomik olmaktan uzak olduğunu bildirmektedir.
Yazar (2006), Allium tuncelianum bitkisinde kök ucu kültürü çalışmalarında köklerde kallus oluşumu sağlanamamıştır. 0.1 mg/l BA ile 1.0 mg/l NAA bulunan ortamda hafif kallus başlangıcı görülse de daha sonra hiçbir gelişme görülmemiştir. Kök ucu kültürü çalışmasında beklenen başarıya ulaşılamamıştır. Sürgün ucu kültürü çalışmasında sürgün uçlarının dikiminden yaklaşık 1 ay sonra kardeş oluşumu başlamıştır. 4 alt kültür sonunda kardeş sayısı bakımından IAA bulunan ortamların NAA bulunduran ortamlardan daha başarılı sonuçlar verdiği belirlenmiştir. Büyümeyi düzenleyiciler kardeşlenme oranı açısından karşılaştırıldığında ise en yüksek kardeşlenme oranı % 76 ile 0.05 mg/l BA+0.1 mg/l IAA bulunan ortamdan alınmıştır. Bunu % 67 ile 0.1 mg/l BA, 0.1 mg/l BA+0.1 mg/l NAA ve % 65 ile 0.05 mg/l BA+0.5 mg/l IAA, % 56 ile 0.05 mg/l BA bulunan ortamlar izlemiştir. Bu türün çoğalma katsayısının düşük olduğu ve sürgün başına yaklaşık 1 adet kardeş elde edildiği belirlenmiştir. Baş oluşumunda 0.1 mg/l NAA’in IAA’e göre daha etkili olduğu ve alt kültür sayısı artıkça sürgünlerde baş oluşumunun da arttığı ortaya konulmuştur.
19
3. MATERYAL ve METOT
Araştırma 2011-2012 yılları arasında Dicle Üniversitesi Ziraat Fakültesi Tarla Bitkileri Bölümü, Biyoteknoloji Laboratuarında yürütülmüştür.
3.1. Materyal
Araştırmada materyal olarak kullanılan Tunceli sarımsağı soğanları (Şekil 3.1), Dicle Üniversitesi, Ziraat Fakültesi, Tarla Bitkileri Bölümü, Soğanlı Bitkiler Koleksiyon Bahçesi’nden temin edilmiştir.
Şekil 3.1. Yüzey sterilizasyonundan önce kabukları ayıklanmış Allium tuncelianum
soğanlarının görünümü 3.2. Metot
3.2.1 Eksplantların Ön Hazırlığı ve Sterilizasyonu
Tarladan hasat edilen Tunceli sarımsağı soğanları içinden orta boy (2-3 cm) hastalıksız ve üzerinde herhangi bir yara izi olmayan soğanlar seçilmiştir. Daha sonra seçilen bu soğanların kabukları yaralamalara yol açmadan dikkatli bir şekilde
20
soyulmuştur. Kabuğu soyulan sarımsaklar buzdolabında 4o
C sıcaklıkta muhafaza edilmiştir.
Buzdolabında 4 oC’de 1 ay muhafaza edilen materyalin yüzey sterilizasyonları için % 100 çamaşır suyu (%5 NaOCl) ile 10, 15, 20, 25 ve 30 dakika olmak üzere 5 farklı sterilizasyon süresi uygulaması yapılmıştır. Yüzey sterilizasyon çalışmaları steril kabin (Şekil 3.2) içerisinde yapılmıştır. Yüzey sterilizasyondan sonra soğanlar steril kabin içinde, steril bistüri ve pens ile yatay (Şekil 3.3a) ve dikey (Şekil 3.3b) şekilde kesilerek 24 ± 1 0C’de 16 saat ışık ve 8 saat karanlık foto periyodunda, içerisinde % 3 sukroz ve % 0,62 agar (Duchefa) ile katılaştırılan MS besi ortamında steril petri kaplarında bir hafta süreyle bekletilmiştir. Daha sonra eksplantlar farklı oranlarda oksin ve sitokinin içeren rejenerasyon ortamlarında kültüre.alınmıştır.
21
Şekil 3.3. Yüzey sterilizasyonundan sonra soğanların steril kabin içinde steril bisturi ve
pens ile yatay (a) ve dikey (b) şekilde kesilmesi 3.2.2 Bitki Büyüme Düzenleyicileri ve Ortamları
Denemelerde, MS mineral tuz ve vitaminleri (Murashige ve Skoog 1962), %3 oranında sukroz ile katılaştırma amacıyla agar (Duchefa) içeren besi ortamları kullanılmıştır. Ortam hazırlığında çift distile su kullanılmış olup, besin ortamına, farklı kombinasyonlarda sitokinin ve oksin ilave edilmiştir.
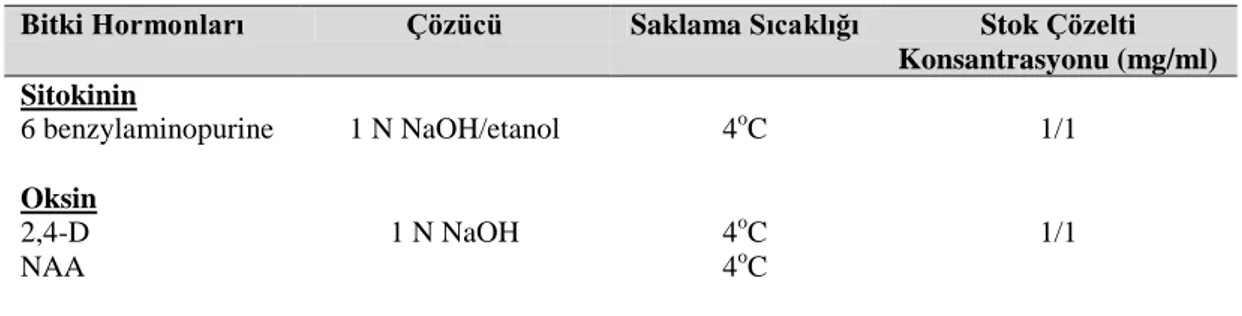
Çalışmada kullanılan kimyasal maddeler, Sigma Aldrich Chemical Co.’dan temin edilmiştir. Bitki büyüme düzenleyicileri uygun çözücülerde Çizelge 3.2’de verildiği gibi çözüldükten sonra istenilen miktarda ve oranda stok solusyonları hazırlanmıştır. Isı muamelesi ile bozulmayan bitki büyüme düzenleyicileri otoklavlanmadan önce besin ortamına ilave edilmiştir. Hazırlanan bitki büyüme düzenleyicileri stok solusyonları iki ay süreyle +4 oC’de muhafaza edilmiştir.
22
Çizelge 3.1. MS (Murashige ve Skoog 1962) ortamında bulunan maddeler ve konsantrasyonları
Ortamda bulunan maddeler Konsantrasyonu (mg/l)
Makro besin elementleri
NH4NO3 KNO3 CaCl2.2H2O MgSO4.7H2O KH2PO4 1650 1900 440 370 170
Mikro besin elementleri
KI H3BO3 MnSO4.4H2O ZnSO4.7H2O Na2MoO4.2H2O CuSO4.5H2O CoCl2.6H2O FeSO4.7H2O Na2EDTA.2H2O 0.83 6.2 22.3 8.6 0.25 0.025 0.025 27.8 37.3 Vitaminler Inisitol Nicotinic Acid Pyridoxine-HCl Thiamine-HCl Glycine 100 0.5 0.5 0.1 2
Çizelge 3.2. Kullanılan bitki büyüme düzenleyicileri ve stok çözelti konsantrasyonları
Bitki Hormonları Çözücü Saklama Sıcaklığı Stok Çözelti Konsantrasyonu (mg/ml) Sitokinin 6 benzylaminopurine 1 N NaOH/etanol 4oC 1/1 Oksin 2,4-D NAA 1 N NaOH 4oC 1/1 4oC 3.2.3.Kültür Koşulları
Besin ortamının pH’sı 1 N NaOH ya da HCl kullanılarak 5,6-5,8’e ayarlandıktan sonra otoklavda 1,2 kg/cm2 basınç altında 121oC’de 20 dk. sterilizasyon sağlanmıştır. Tüm kültürler iklim dolaplarında (Fitotron Almanya) beyaz floresans ışığı altında 16 saat ışık 8 saat karanlık periyodunda 24 oC bekletilmiştir (Babaoğlu ve ark. 2001).
23
3.2.4. In vitro Çalışmalar
3.2.4.1. Soğan Rejenerasyonu
Soğan rejenerasyonu için, tüm eksplantlar Çizelge 3.3 ve Çizelge 3.4’de verilen bitki büyüme düzenleyicileri ve belirtilen dozları kullanılarak, petri ya da magentalarda 4’er eksplant ve 3’er tekerrür olacak şekilde kültüre alınmıştır.
Çizelge 3.3. Tunceli sarımsağının rejenerasyonu için kullanılan MS ortamında BAP ve NAA
konsantrasyonları BAP mg/l NAA mg/l 1 0,5 2 0,5 3 0,5 4 0,5 5 0,5
Çizelge 3.4. Tunceli sarımsağının rejenerasyonu için kullanılan MS ortamında 2,4-D konsantrasyonları
2,4 D (mg/l) 1 2 3 4 5 3.3 İstatistiksel Değerlendirmeler
Denemeler, tek faktörlü, tesadüf parselleri deneme desenine göre kurulmuş ve 3 tekerrürlüdür. Her tekerrür içinde 4 adet eksplantın bulunduğu 100 x 10 mm’lik petri kutusu veya magenta kutusundan oluşmuştur. Elde edilen veriler “IBM SPSS 20 for Windows’’ paket programında tek yönlü varyans analizine tabi tutulmuş, muamele ortamlarını karşılaştırmak amacıyla Duncan ve LSD testleri uygulanmıştır. Yüzde değerler, istatistik analizinden önce arcsin değerlerine çevrilmiştir (Snedecor ve Cochran 1956).
25
4. BULGULAR ve TARTIŞMA
4.1. Bulgular
4.1.1. Allium tuncelianum Soğanlarında %100 Çamaşır Suyu ile Farklı Sürelerdeki Uygulamaların Bulaşıklık Üzerine Etkisi
In vitro denemelerde Allium tuncelianum soğanlarının (4 adet eksplant x 3
tekerrür) kabukları ayıklandıktan sonra % 100 ticari çamaşır suyunda 10, 15, 20, 25 ve 30 dk. süresince yüzey sterilizasyonuna tabi tutulmuştur. Daha sonra yüzey sterilizasyonu yapılmış soğanlar üçer defa üçer dk steril saf su ile durulanmıştır. Yüzey sterilizasyonu sonucunda elde edilen veriler varyans analizine tabi tutulmuş ve sonuçlar Çizelge 4.1’de verilmiştir
Çizelge 4.1. Çamaşır suyu ile farklı muamele sürelerinde yapılan yüzey sterilizasyonuna ait varyans
analizi
VK sd K.O F
Çamaşır suyu ile muamele süreleri
4 3583,33 3,58*
Hata 10 1000,00
Genel toplam 14
*0.05 düzeyinde önemli
Çamaşır suyu ile farklı muamele sürelerinin eksplantların yüzey sterilizasyonu üzerindeki etkisi Çizelge 4.1’de görüldüğü gibi varyans analizi sonucunda 0,05 düzeyinde farklılık göstermiştir. Bu farklılıkların önem düzeyini belirlemek amacıyla yapılan Duncan testi sonuçları Çizelge 4.2’de verilmiştir.
Çizelge 4.2. Çamaşır suyu ile farklı muamele sürelerinde yapılan yüzey sterilizasyonuna ait Duncan test
sonuçları
Çamaşır suyu ile muamele süreleri (dk) Bulaşıklık oranı (%)
10 83,33 a
15 0,00 b
20 16,67 b
25 33,33 ab
30 0,00 b
Aynı sütunda farklı harflerle gösterilen ortalamalar arasındaki fark 0.01 düzeyinde önemlidir.
Çizelge 4.2’de görüldüğü gibi yapılan Duncan testi sonuçlarına göre % 100 çamaşır suyu ve farklı süre uygulamalarından %0 ile % 83.33 arasında değişen bulaşıklıklar görülmüştür. 15 dk ve 30 dk muamele sonucunda soğanlarda hiç bulaşıklık görülmezken (Şekil 4.1a) 10, 20 ve 25 dk çamaşır suyu ile muamelede sırasıyla % 83.33
26
(Şekil 4.1b), % 16.67 ve % 33.33 oranda bulaşıklık görülmüştür. Sonraki denemelerde yüzey sterilizasyon için çamaşır suyu ile 30 dk muamele süresi tercih edilmiştir.
Şekil 4.1. Yüzey sterilizasyonunda (a) 15 dk ve 30 dk muamele sonucunda soğanlarda hiç bulaşıklık
görülmezken (b)10 dk çamaşır suyu muamelesiyle çıkan bulaşıklıktan bir görünüm
4.1.2. Allium tuncelianum’un Yaprak Ucu Eksplantlarının BAP ve NAA İçeren MS Besi Ortamında Rejenerasyonu
In vitro koşullarda Allium tuncelianum soğanları steril edilmiş ve daha sonra MS
ortamında kültüre alınarak gelişmesi için iklim dolabına bırakılmıştır. Yaklaşık 3 hafta sonra soğanlar üzerinde belirgin bir şekilde, 4-5 cm uzunlukta soğan yaprakları gelişmişlerdir. Elde edilen yapraklardan alınan yaprak ucu eksplantları farklı konsantrasyonlarda BAP ve NAA içeren ortamlara kültüre alınmıştır. Ancak, 8 hafta sonunda eksplantlar üzerinde herhangi kallus veya sürgün oluşumu gözlenmemiş olup herhangi bir gelişme de kaydedilmemiştir.
4.1.3. Allium tuncelianum’un Yaprak Sapı Eksplantlarının BAP ve NAA İçeren MS Besi Ortamında Rejenerasyonu
In vitro koşullarda steril edilen Allium tuncelianum soğanları MS besi ortamında
kültüre alınarak iklim dolabında gelişmeye bırakılmıştır. Yaklaşık 3 hafta sonra soğanlar üzerinde 4-5 cm uzunlukta soğan yaprakları gelişmişlerdir. Elde edilen yapraklardan yaprak sapı eksplantları farklı kombinasyonlarda BAP ve NAA içeren MS besi ortamında kültüre alınmıştır. Yaprak sapı eksplantları üzerinde 28 gün sonra meydana gelen sürgün oluşum oranı (%) ve eksplant başına sürgün sayısı (adet) ile ilgili varyans analizi sonuçları Çizelge 4.3 de verilmiştir. Varyans analizi sonuçlarına göre
27
sürgün oluşum oranı (%) ve eksplant başına sürgün sayısı (adet) bakımından ortamlar arasında istatistiksel olarak farklılık görülmemiştir. Sürgün oluşum oranı (%) ve eksplant başına sürgün sayısı (adet) bakımından ortaya çıkan gruplar Çizelge 4.4’de verilmiştir.
Çizelge 4.3. Allium tuncelianum’un yaprak sapı eksplantlarının BAP ve NAA içeren MS besi ortamında
rejenerasyonu ile ilgili varyans analizi sonuçları
VK Sd Sürgün oluşum oranı (%) Eksplant başına sürgün sayısı (adet) KO F KO F Ortamlar 4 93,33 0,58 0,767 0,52 Hata 10 160,00 1,467 Genel Toplam 14
Çizelge 4.4’ de görüldüğü gibi 1 ve 5 mg/l BAP – 0,5 mg/l NAA içeren ortamlarda sürgün oluşumu görülmemiştir. En fazla sürgün oluşumu % 13.33 2 mg/l BAP 0,5 mg/l NAA içeren ortamda tespit edilmiştir. 3 ve 4 mg/l BAP-NAA içeren MS ortamlarının eksplantlarda durdurucu etki yaptığı görülmüş ve her iki ortamda sürgün oluşum oranı % 6,67 olarak kaydedilmiştir. Eksplant başına sürgün sayısı 0 ile 1 adet arasında değişmiştir (Şekil 4.2).
Çizelge 4.4. Allium tuncelianum’un yaprak sapı eksplantlarının BAP ve NAA içeren MS besi ortamında
rejenerasyonu ile ilgili Duncan testi sonuçları
Ortamlar Sürgün oluşum oranı (%)
Eksplant başına sürgün sayısı (adet ) BAP (mg/l) NAA (mg/l) 1 0.5 0.00 0.00 2 0.5 13.33 1.00 3 0.5 6.67 1.00 4 0.5 6.67 0.67 5 0.5 0.00 0.00
28
4.1.4. Allium tuncelianum’un Dikey Olarak Yarım Kesilmiş Soğan Eksplantlarının 2,4-D İçeren MS Besi Ortamında Rejenerasyonu
Farklı kombinasyonlarda 2,4-D içeren MS besi ortamında dikey olarak yarım kesilmiş eksplantın adaksial (merkeze yakın) taraftan 4-5 gün sonra yaprak oluşumu ve gelişimi başlamış ve 28 gün sonra eksplantlar üzerinde belirgin bir şekilde sürgün ve kök oluşumu görülmeye başlanmıştır. Eksplantlar üzerinde sürgün oluşum oranı (%) ve eksplant başına sürgün sayısı (adet) ile ilgili verilerin varyans analizi sonuçları Çizelge 4.5’de verilmiştir. Elde edilen sonuçlarına göre istatistiksel olarak sürgün oluşum oranı (%) bakımından ortamlar arasında her hangi farklılık bulunmazken eksplant başına sürgün sayısı (adet) bakımından ortamlar arasında farklılık 0.05 düzeyinde önemli görülmüştür. Bu farklılıkların önem düzeyini belirlemek amacıyla yapılan Duncan testi sonuçları Çizelge 4.6’da verilmiştir.
Çizelge 4.5. Allium tuncelianum’un dikey olarak yarım kesilmiş soğan eksplantlarının 2,4-D içeren MS
besi ortamında rejenerasyonu ile ilgili varyans analizi sonuçları
VK Sd Sürgün oluşum oranı
(%)
Eksplant başına sürgün sayısı (adet)
KO F KO F
Ortamlar 4 3604,17 3,46 1,81 3,52*
Hata 10 1041,67 0,51
Genel Toplam 14 *0.05 düzeyinde önemli
Çizelge 4.6’da görüldüğü gibi sürgün oluşum oranı % 0 ile % 83,33 arasında değişmiştir. 2 mg/l 2,4-D içeren MS ortamda % 83,33 sürgün oluşum oranı görülürken 1 mg/l 2,4-D içeren MS ortamda sürgün oluşumu görülmemiştir. Eksplant başına en fazla 2 adet sürgün 2 mg/l 2,4-D içeren MS ortamından elde edilmiş (Şekil 4.3) olup, 1 mg/l 2,4-D içeren MS ortamından sürgün oluşumu görülmemiştir. Bunun dışındaki ortamlarda eksplant başına sürgün sayısı 0,33 ile 1 adet arasında değişmiştir.
29
Çizelge 4.6. Allium tuncelianum’un dikey olarak yarım kesilmiş soğan eksplantlarının 2,4-D içeren MS
besi ortamında rejenerasyonu ile ilgili Duncan testi sonuçları
2,4 D (mg/l) Sürgün oluşum oranı (%) Eksplant başına sürgün sayısı (adet)
1 0.00 0.00 b
2 83.33 2.00 a
3 8.33 0.33 b
4 41.67 0.50b
5 58.33 1.00 ab
Aynı sütunda farklı harflerle gösterilen ortalamalar arasındaki fark 0.05 düzeyinde önemlidir.
Şekil 4.2. Allium tuncelianum’un dikey olarak yarım kesilmiş soğan Eksplant ların 2 mg/l 2, 4-D içeren MS ortamda sürgün rejenerasyonu
4.1.5. Allium tuncelianum’un Dikey Olarak Çeyrek Kesilmiş Soğan Eksplantlarının 2,4-D İçeren MS Besi Ortamında Rejenerasyonu
Farklı kombinasyonlarda 2-4,D içeren MS besi ortamında dikey olarak çeyrek kesilmiş soğan eksplantlarının adaksial taraftan 9-10 gün sonra yaprak oluşum ve gelişimi başlamış olup 28 gün sonra eksplantlar üzerinde belirgin beyazlaşma, sertleşme ve irileşme ile kıvrılmış sürgün oluşumu görülmüştür. Elde edilen sürgün oluşum oranı (%) ve eksplant başına sürgün sayısı (adet) ile ilgili verilerin varyans analizi sonuçları Çizelge 4.7 de verilmiştir. Varyans analizi sonuçlarına göre sürgün oluşum oranı (%) bakımından ortamlar arasında farklılık 0.05 düzeyinde önemli görülürken eksplant başına sürgün sayısı (adet) bakımından ortamlar arasında istatisksel olarak farklılık görülmemiştir. Sürgün oluşum oranı (%) bakımından farklılıkların önem düzeyini
30
belirlemek amacıyla yapılan Duncan testi sonuçları ve eksplant başına sürgün sayısı bakımından ortamlar arasındaki ortaya çıkan gruplar Çizelge 4.8’de verilmiştir.
Çizelge 4.7. Allium tuncelianum’un dikey olarak çeyrek kesilmiş soğan eksplantlarının 2,4-D içeren MS
besi ortamında rejenerasyonu ile ilgili varyans analizi sonuçları
VK sd Sürgün oluşum oranı
(%)
Eksplant başına sürgün sayısı (adet) KO F KO F Ortamlar 4 1500,00 3,27* 0.57 1.21 Hata 10 458,33 0.47 Genel Toplam 14 *0.05 düzeyinde önemli
Çizelge 4.8’de görüldüğü gibi sürgün oluşumu oranı % 16.66 ile % 66.66 arasında değişmiştir. En fazla sürgün oluşum oranı 1, 2, 3 mg/l 2,4-D içeren ortamdan ve en az sürgün oluşum oranı 5 mg/l 2,4-D içeren ortamda gözlenmiştir. Eksplant başına sürgün sayısı (adet) ise 0.66 ile 1.66 arasında değişmiştir (Şekil 4.4).
Çizelge 4.8. Allium tuncelianum’un dikey olarak çeyrek kesilmiş soğan eksplantlarının 2,4-D içeren MS
besi ortamında rejenerasyonu ile ilgili Duncan testi sonuçları
2,4 D (mg/l) Sürgün oluşum oranı (%) Eksplant başına sürgün sayısı (adet)
1 66.66a 1.66
2 66.66a 1.33
3 66.66a 1.66
4 41.67ab 1.00
5 16.66a 0.66