T.C.
SİİRT ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
ELEKTRİKSEL PLAZMA YÖNTEMİYLE SUYUN ELEKTROLİZİ
YÜKSEK LİSANS TEZİ Emre ALP
(173111001)
Elektrik-Elektronik Mühendisliği Anabilim Dalı
Tez Danışmanı: Doç. Dr. Fevzi HANSU
Ağustos-2019 SİİRT
İÇİNDEKİLER
Sayfa TEZ KABUL ve ONAYI ... Hata! Yer işareti tanımlanmamış. ÖN SÖZ ... Hata! Yer işareti tanımlanmamış.
İÇİNDEKİLER ... ii
TABLOLAR LİSTESİ ... v
ŞEKİLLER LİSTESİ ... vi
KISALTMALAR ve SİMGELER LİSTESİ ... vii
ÖZET ... ix
ABSTRACT ... x
1. GİRİŞ ... 1
1.1. Hidrojen ... 1
1.1.1. Hidrojenin Genel Özellikleri ... 2
1.1.2. Hidrojenin Fiziksel ve Kimyasal Özellikleri ... 3
1.2. Elektriksel Plazma... 4 1.3. Elektroliz ... 5 1.3.1. Elektroliz Yasaları ... 6 1.3.2. Suyun Elektrolizi ... 6 2. LİTERATÜR ARAŞTIRMASI ... 9 3. MATERYAL ve YÖNTEM ... 19 3.1. Materyal ... 19 3.2. Yöntem ... 24 4. BULGULAR ... 25 5. SONUÇLAR ve ÖNERİLER ... 33 5.1. Sonuçlar ... 33 5.2. Öneriler ... 34 6. KAYNAKLAR ... 35 ÖZGEÇMİŞ ... 38
TABLOLAR LİSTESİ
Sayfa Tablo 1.1. Hidrojenin Özellikleri ... 3
ŞEKİLLER LİSTESİ
Sayfa
Şekil 1.1. Bir elektrolitik hücre modeli ... 5
Şekil 1.2. pH potansiyeli değişim oranları ... 7
Şekil 1.3. Suyun elektrolizi için ideal çalışma koşulları (MCAULIFFE, 1980) ... 8
Şekil 3.1. Dâhili tip gerilim trafosu görüntüsü ... 20
Şekil 3.2. Ayarlanabilir gerilim kaynağı görüntüsü ... 20
Şekil 3.3. Soğuk buhar makinesi görüntüsü ... 21
Şekil 3.4. Deney sisteminin kumanda ve ölçüm elemanları ... 21
Şekil 3.5. Deney sisteminin genel görüntüsü ... 22
Şekil 3.6. MRU OPTİMA 7 Portatif multifonksiyon baca gazı analiz cihazı görüntüsü ... 22
Şekil 3.7. Deneysel çalışmalarda kullanılan reaktörün teknik çizimi ve kapalı şeması ... 23
Şekil 4.1. Oluşturulan plazmanın çeşitli frekans değerlerine ait V-I karakteristikleri ... 25
Şekil 4.2. f=50 Hz frekansında alınan Gerilim-Gaz miktarı karakteristiği ... 26
Şekil 4.3. f=100 Hz frekansında alınan Gerilim-Gaz miktarı karakteristiği ... 27
Şekil 4.4. f=200 Hz frekansında alınan Gerilim-Gaz miktarı karakteristiği ... 27
Şekil 4.5. f=350 Hz frekansında alınan Gerilim-Gaz miktarı karakteristiği ... 28
Şekil 4.6. f=500 Hz frekansında alınan Gerilim-Gaz miktarı karakteristiği ... 28
Şekil 4.7. U=3 kV sabit gerilimde alınan karşılaştırmalı Frekans-Gaz miktarı karakteristiği ... 29
Şekil 4.8. Çeşitli frekans değerlerine ait Zaman-Güç karakteristiği ... 29
Şekil 4.9. Plazmanın Townsend Modu’ndaki Giriş/Çıkış akım osilasyonları görüntüsü ... 30
Şekil 4.10. Plazmanın Townsend Modundan hemen sonraki aşamasına ait Giriş/Çıkış akım osilasyonları görüntüsü ... 31
Şekil 4.11. Plazmanın gelişimi sırasındaki Giriş/Çıkış akımlarına ait osilasyon görüntüleri ... 31
Şekil 4.12. Plazmanın Ark Modu öncesine ait Giriş/Çıkış akımlarının osilasyon görüntüleri ... 32
KISALTMALAR ve SİMGELER LİSTESİ Kısaltma Açıklama
A.K.B : Atomik Kütle Birimi KOH : Potasyum Hidroksit NaOH : Sodyum Hidroksit
H2O : Su
OH- : Hidroksit
HCHO : Formaldehit
GPDE : Parıltılı Boşalma Plazma Elektrolizi PEM : Polimer Elektroliz Membran
SOEC : Katı Oksit Elektrolizör Hücresi HTSE : Yüksek Sıcaklıktaki Buhar Elektrolizi SOFC : Katı Oksit Yakıt Hücreleri
CAWE : Karbon Destekli Su Elektrolizi
AC : Alternatif Akım
PPM : Milyonda Bir
Simge Açıklama
n : Metalin Değerliği
m : Elektrolizde Toplanan Madde Miktarı
t : Süre (saniye)
I : Akım Şiddeti (Amper)
A : Metalin Ağırlığı
H : Hidrojen
O : Oksijen
M : Elektrolizde Toplanan Madde Miktarı
U : Gerilim P : Basınç (atm) CO2 : Karbondioksit W : Güç (watt) MWh : Megawattsaat kg : Kilogram m3 : Metreküp MJ : Megajoule K : Kelvin cm2 : Santimetrekare s : Saniye kJ : Kilojoule o C : Santigrat cm3 : Santimetreküp Ni : Nikel Cr : Krom Fe : Demir C : Karbon S : Sülfür N : Azot cm3 : Santimetreküp e- : Elektron
mmol : Milimol
Uθ : Teorik Ayrışma Voltajı
hZ : Hertz cm : Santimetre mm : Milimetre ml : Mililitre M : Molar µA : Mikroamper mA : Miliamper kV : Kilovolt
ÖZET
YÜKSEK LİSANS TEZİ
ELEKTRİKSEL PLAZMA YÖNTEMİYLE SUYUN ELEKTROLİZİ Emre ALP
Siirt Üniversitesi Fen Bilimleri Enstitüsü Elektrik-Elektronik Mühendisliği Anabilim Dalı
Danışman : Doç. Dr. Fevzi Hansu
2019, 38+x Sayfa
Günümüzde enerji kaynaklarına duyulan ihtiyacın sürekli artmasıyla birlikte alternatif bir enerji olan hidrojen enerjisine olan ihtiyaç da her geçen gün daha da artmaktadır. Hidrojen gazı üretiminde en çok kullanılan yöntemlerin başında suyun elektrolizi gelmektedir. Mevcut elektroliz yönteminde P=U*I bağıntısına göre gerilim değeri düşük; akım değeri ise yüksektir ve bu işlem suyun sıvı fazı ile gerçekleştirilmektedir. Bu durumda elektriksel kayıplar da artmaktadır. Bu tez çalışmasında, mevcut yöntemden farklı olarak; P=U*I bağıntısına göre, gerilim değeri yüksek; akım değeri ise düşük olan elektriksel plazma yöntemi önerilmiştir. Önerilen yöntemde, elektroliz işleminin etkin bir şekilde yapılabilmesi için mevcut uygulamalardan farklı olarak suyun sıvı fazı yerine buhar fazı kullanılarak uygulamalar gerçekleştirilmiştir. Önerilen bu yöntem sayesinde elektriksel kayıpların azaltılması için mevcut yöntemlerdeki akımla bağ kırma yöntemi yerine, kuvvetli elektrik alanının dövme veya bombardıman etkisiyle su buharı moleküllerine ait bağları kırmaya yönelik uygulamalar yapılmıştır. Omik kayıplar akımın karesi ile doğru orantılı olduğundan dolayı ve plazma akımlarının mikroamperler veya miliamperler düzeyinde olması nedeniyle oluşacak kayıp miktarları da oldukça düşük seviyelere gerilemiştir. Deneysel uygulamalarda çeşitli frekans değerlerindeki yarı doğru akım ve farklı gerilim değerlerinde oluşturulan elektriksel plazmanın kullanılmasıyla üretilen gaz miktarları ölçülmüş ve elde edilen sonuçlar yorumlanmıştır.
ABSTRACT MSc. THESIS
WATER ELECTROLYSIS BY USING ELECTRICAL PLASMA METHOD Emre ALP
The Graduate School of Natural and Applied Science of Siirt University The Degree of Master of Science
In Electrical-Electronics Engineering
Supervisor : Assoc. Prof. Dr. Fevzi HANSU
2019, 38+x Pages
Today, with the increasing of need of energy sources, the necessity of hydrogen energy is increasing day by day. The main method of hydrogen gas production is water electrolysis. In present electrolysis method, according to P=U*I relation, the voltage ratings are low and the current values are high; and also this process occurs with the liquid phase of water. In this circumstance, the electrical losses increase. In this dissertation study, in discordance with the current method, according to P=U*I relation, an electrical plasma method with the high voltage ratings and low current values, was suggested. In suggested method, instead of liquid phases of water, vapor phase of water method practiced in order to do electrolysis process effectively thanks to the suggested method, in order to decrease electrical losses, instead of current bond breaking method in present methods, bond breaking of water vapor molecules with the bombardment and hammering effect of powerful electrical field technics was used. As the electrical losses have direct proportion with square of the current, the electrical losses decreased to very low levels because of the plasma currents being at microamperes and milliamperes levels. In experimental applications, the quantity of gas, which produced by the usage of electrical plasma obtained at half continuous current and various frequency values conditions, was calculated and the results were interpreted.
1. GİRİŞ 1.1. Hidrojen
Enerji kaynaklarından biri olan fosil yakıtlar, sanayinin ekonomik açıdan büyümesinde önemli bir rol oynamaktadırlar (Bora, 2000). Ancak günümüzde dünyadaki enerji kaynaklarının temelini oluşturan fosil yakıtlarının her geçen gün azalması, fiyat bakımından çok yüksek oluşu (Kardaş ve ark., 2007), atmosferdeki sera etkisinin her geçen gün artması ve küresel ısınma nedeniyle dünyadaki ortalama sıcaklığın gün geçtikçe artmasıyla (Öztürk ve ark.,2007) alternatif enerji kaynaklarının bulanabilmesi için araştırmacılar yoğun çalışmalar yapmaktadırlar.
Bilim insanları, enerji tüketiminin artması nedeniyle alternatif enerji kaynaklarının kullanımını yaygınlaştırmak için çalışmalar yapmıştırlar. Bu enerji kaynaklarının çevreye olan etkinin de ne kadar önemli bir yere sahip olduğunu araştırmıştırlar (Mert, 2005). Araştırmalar sonucunda, yenilebilir enerji kaynaklarından olan güneş, rüzgâr ve biokütle önemli ölçüde çözüm olmuştur. Fakat bulunan kaynakların çevre üzerindeki olumsuz etkileri, kullanım sürelerinin aralıklı olmaları, teknolojik ilerlemede istenilen seviyeye ulaşılamamış olmaları yüzünden fosil kaynaklara göre karşılaştırma yapıldığında toplam enerji üretimine olan katkıları diğer enerjilere göre daha az olmaktadır. Bu bağlamda bilim insanları hidrojen enerji sistemini tüm alanlarda kullanarak sorunun çözüme kavuşacağı konusunda aynı fikirdedirler (Aslan, 2007).
Hidrojen gazının elde edilmesi, birincil enerji kaynaklarından olduğu için enerji taşıyıcısı olarak isimlendirilmektedir (Mert ve ark., 2008). Doğal gazın buhar reformasyonu tepkimelerinin temelini hidrojen oluşturmaktadır (Kotari ve ark., 2008). Ancak bu tepkimeler sonucunda çevre için zararlı olacak gazlar da oluşmaktadır. Gelecekte hidrojen, fosil yakıtların yerine alternatif enerji olarak kullanılacaksa; çevre dostu ve yenilebilir enerji özelliğinde olacak şekilde kullanılmalıdır (Koku ve ark., 2002).
Hidrojenin enerji taşıyıcı olarak kullanılabilmesi için en önemli avantajı korozyona etkisinin olmaması ve hidrojenin toksik olmayan bir element olmasıdır. Bu yüzden hidrojenin kullanılması minimum önlemlerle bile tehlikesiz ve çok basittir.
Çevre dostu olan hidrojen, geri çevrim reaksiyon tepkimelerinde su üretmesi sayesinde doğal çevrim tepkimelerine girebilmektedirler (Toprak, 2006).
Hidrojenin diğer yakıtların kullanımına göre daha pahalı olmasına karşın gelecek dönemdeki teknolojik gelişmelerle birlikte enerji kullanımında önemli bir rol oynaması düşünülmektedir. Pazar ihtiyacına göre kg başı maliyeti 2,35-7 $ arasındadır. Fakat bu maliyetin araştırmacılar tarafından göreceli olması nedeniyle, gelecek dönemlerde hidrojenin maliyetinde hızlı düşüş oranları beklenmektedir (Mert, 2005).
1.1.1. Hidrojenin Genel Özellikleri
Hidrojen, periyodik cetvelde atom numarası en küçük olan elementtir. Hidrojenin çekirdeğinde bir proton ve yörüngesinde bir elektron bulunmaktadır. Hidrojen, evrende en fazla bulunan elementlerden biridir ve çevre dostu olan bir elementtir (Sarıtaş, 2004). Ayrıca insan vücudunun % 66’sını ve evrende bulunan atomların da % 90’ını oluşturmaktadır. Bununla birlikte, kil ve minerallerin içyapısında oksijenle birleşmiş halde yüksek miktarda hidrojen bulunmaktadır. Ayrıca kömür ve ham petrolün de büyük bir çoğunluğunu da karbonla birleşmiş bir yapıda bulunmaktadır. Hidrojen, kütle başına düşen enerji miktarı bakımından da en yüksek olan maddedir. Yüksek sıcaklık değerlerinde ise 141,9 MJ/kg ile benzinin enerji yoğunluğundan 3 kat daha fazla enerjiye sahip olduğu kanıtlanmıştır. Hidrojenin bazı özellikleri ise Tablo 1’de gösterilmiştir (Sarıtaş, 2004).
Tablo 1.1. Hidrojenin Özellikleri
Özellikler Birim Miktar
Atom numarası 2,016
Molekül Ağırlığı a.k.b 0,0838
Yoğunluk kg/m3 141,90
Yüksek sıcaklık değeri MJ/kg 119,90
Havadaki stokiyometrik karışımı (Hacim. %) 29,53
Kaynama sıcaklığı K 20,3
Sıvı halde yoğunluğu kg/m3 70,8
Yükseltgenme derecesi +1
Havadaki alev sıcaklığı K 2318
Difüzyon katsayısı cm2/s 0,61
Öz-tutuşma sıcaklığı K 858
Havadaki tutuşma sınırı (Hacim. %) 4-75
Sıcaklık K 32,94 Basınç Bar 12,84 Düşük sıcaklık değerleri MJ/kg 10,05 Özgül sıcaklığı (cp) kJ/(kg.K) 14,89 Yoğunluk Kg/m3 31,40 İzotopları 1, 2 ve 3
1.1.2. Hidrojenin Fiziksel ve Kimyasal Özellikleri
Hidrojen, doğada saf haliyle renk ve kokuya sahip değildir. Havaya göre yoğunluğu ise çok düşüktür ve bu yönüyle de doğada bulunan elementler arasında en hafif olan elementtir. Hidrojen helyum gazından sonra saf halde bulunan elementler arasında sıvılaştırılması en zor olan elementtir. Maddenin halleri olarak da -240 o
C dan büyük değerlerde katı halde, -240 ile -253 oC arasında sıvı halde ve -253 o
C den küçük değerlerde ise doğada gaz halinde bulunmaktadırlar.
Hidrojen, değerli bir element olması nedeniyle alkali ve toprak alkali metaller de olduğu gibi ametallerin birçoğuyla da doğrudan tepkimeye girebilmektedir.
Halojenlerin ise dördüyle reaksiyon oluşturmaktadır ve tepkime sonucunda ise hidrasitleri meydana getirmektedir. Periyodik cetvelde yukarıdan aşağıya inildiği zaman ise tepkime hızında ve açığa çıkan ısı miktarında azalma görülmektedir. Oksijenli bileşiklerinde su oluşturmaktadır. Azotla tepkimelerde ise yüksek basınç durumunda katalizör yardımıyla amonyak elde edilmektedir (Toprak, 2006).
1.2. Elektriksel Plazma
Elektriksel plazma yöntemi ilk kez Siemens tarafından 1850’li yıllarda ozon üretimi amacıyla kullanılmış olup günümüze kadar bu alanda çok sayıda ve çok çeşitli alanlarda kullanımı söz konusudur. Özellikle son yıllarda endüstriyel alanlarda yaygın olarak kullanılmaktadır. Uygulama alanları her geçen gün daha da artarak çeşitlilik kazanmaktadır.
Normal koşullarda yalıtkan bir gaz ortamına iki iletken elektrotun yerleştirilmesi ve bu elektrotlara belirli adımlarla arttırılmakta olan bir gerilimin uygulanmasıyla birlikte bu gaz ortamı, gerilimin herhangi bir anında elektriksel bir delinmeye uğrayarak aniden iletken hale geçmektedir. Bu durumda gaz ortamı süper iletken bir hale geçerek devreden darbe şekilli ve non-lineer bir akım akmaktadır. Tamamen iletken hale geçen elektrot aralığının (plazma ortamının) birim hacimdeki toplam yük miktarı sıfırdır; başka bir deyişle nötrdür. Literatürde yapılan çalışmalarda, plazma ortamının birim hacmindeki elektron-iyon yoğunluğu 1013-1014 iyon-elektron/cm3 olduğu ifade edilmiştir.
Uygulamalarda plazmaların çok sayıda çeşitleri mevcuttur. Ancak genel anlamda plazmalar, sıcak plazmalar (Ark plazmalar) ve Soğuk plazmalar (Bariyer, Korona, kıvılcım vs. plazmalar) olmak üzere iki ana gruba ayrılırlar. Sıcak plazmaların ısısal değerleri ortalama 10000-11000 oK dolaylarındadır. Soğuk plazmalar ise
genellikle oda sıcaklığında veya buna yakın değerlerdedir. Bu durum, uygulama açısından önemli avantajlar sağlamaktadır. Sıcak plazmaların kullanım alanları sınırlı iken; soğuk plazmaların kullanılma alanları çok yaygın ve çok çeşitlidir. Çünkü kullanıldığı alanlarda herhangi bir kimyasal tahribat veya kalıntı bırakmamaktadırlar. Bu avantajları yönüyle kullanım alanları her geçen gün daha da artmaktadır.
Soğuk plazmalar günümüzde kimya endüstrisinde yaygın olarak kullanılmaktadırlar. Normal koşullarda gerçekleşemeyen birçok kimyasal reaksiyon,
soğuk plazma ortamında kolaylıkla gerçekleşebilmektedir. Diğer bir açıdan, soğuk plazmaların kimyasal bileşikler üzerindeki negatif etkileri yok denecek kadar azdır. Bu durum, kullanım yaygınlığına önemli bir etki etmektedir. Bu tez çalışmasında, elektriksel plazmanın elektro-kimyasal işlemlerden biri olan elektroliz olayı üzerindeki etkisi incelenmiştir. Bu çalışmada mevcut uygulamalardan farklı olarak, soğuk plazmanın yüksek verimliliği avantajının suyun elektrolizi işlemine uygulanması hedeflenmiştir.
1.3. Elektroliz
Bir elektrolit çözeltisinin içine iki elektrot daldırılıp, bu elektrotlara dışardan bir akım uygulanmasıyla reaksiyon meydana gelmesi sonucu, çözeltinin bileşenlerine ayrılması olayına elektroliz denir. Elektroliz olayı, çözeltiye anot ve katot akımlarının toplamından daha büyük bir dış akım uygulanmasıyla gerçekleşmektedir. Katot ve anotta indirgenme ve yükseltgenme reaksiyonları için elektrona ihtiyaç duyulmaktadır. Bu elektronlar ise dışardan uygulanan akımla sağlanmaktadır. Asit, baz ve tuzların sulu çözeltileri de elektrik akımını iletmektedirler. Elektrotlar arasındaki elektron akışı katottan anoda doğrudur. Bir elektroliz hücresi ile kimyasal pil arasında elektrokimyasal olaylar açısından genel anlamda pek bir farklılık yoktur. Elektroliz çözeltisinde reaksiyon oluşabilmesi için potansiyelin çok yüksek değerlere çıkararak reaksiyonun zorla oluşması sağlanmaktadır. Meydana gelen reaksiyon sonucunda oluşan bu çözeltilere elektrolit çözeltisi denir. Çözeltideki elektrolit maddelerden elektrik akımı geçirerek de bir reaksiyon gerçekleştirilebilir. Bu tepkimelerin en önemli noktası olarak katyonların indirgenerek katot elektrotuna toplanması ve anyonların yükseltgenerek anot elektrotunda birikmesidir. Bu çözeltide birden farklı cins anyon veya katyon olması durumunda ise indirgenme veya yükseltgenme potansiyeli en düşük olandan en yüksek olana doğru tepkime sırasıyla gerçekleşir.
1.3.1. Elektroliz yasaları
Faraday, 1834 yılında bir elektrot çözeltisinden elektrik akımı geçirildiği zaman elektrotlardan açığa çıkan madde miktarı ile elektrolitten geçen akım miktarı arasında bağlantı olduğunu kanıtlamıştır (Berkem, 1993). Çözeltiden 1 mol elektron geçirildiği zaman anot ve katotta 1’er gram madde toplanmaktadır. Elektrolizde anot ve katotta toplanan madde miktarını bulabilmek için Denklem 1.1 kullanılmıştır.
96500
n
A
t
I
m
(1.1) n: Metalin değerliğim: Elektrolizde toplanan madde miktarı (gram) t: Süre (saniye)
I: Akım şiddeti (Amper)
A: Metalin ağırlığı
1.3.2. Suyun elektrolizi
Günümüzde elektrolitik olarak kullanılan hidrojenin elde edilmesinde kullanılan doğal gazlar, naftanın yeniden düzenlenmesi ile elde edilen hidrojen miktarından oldukça fazladır. Bu yöntemle üretilen hidrojenin yüksek saflığında olan işlerde naftanın yeniden düzenlenmesi tercih edilmektedir. Örnek olarak besin maddelerin elde edilmesinde ve yarı iletken malzemelerin yapım aşamasında kullanılabilmektedir. Hidrojene olan ihtiyacımız gün geçtikçe artmaktadır ve arz isteğinin artmasıyla hidrojenin maliyetinin incelenmesi gerektiğini doğurmuştur. Araştırmacılar ise elektrolit hidrojenin maliyetiyle ilgili olarak su elektroliz sistemlerinin hızlı ve verimli olabilmesi için çalışmalar yapıp, hidrojen üretimi için mevcut yöntemlerden daha düşük maliyetli hücreler bulmaya çalışmaktadırlar.
Genel olarak elektrolitik hidrojen hücreleri, KOH veya NaOH sulu çözeltilerinin elektrolizi sonucu üretilmektedir. Alkali sulu çözeltilerin elektrolizi sırasında anotta oksijen ve katotta hidrojen gazı elde edilir ve oluşan elektrokimyasal tepkime ise Denklem 1.2 ve 1.3’te gösterilmiştir.
e O H O OH Anot g 2 4 4 : 2 2 ) ( EA 0,4010,0592pOH (PO2 (1,0atm) (1.2)
) ( 2 2 4 4 2 4 : g H OH e O H
Katot Ek 0,8280,0592pOH (PH2(1,0atm)
Toplam tepkime; ) ( ) ( 2 2 2 4 2 2 g g H O O H Etr 1,23V (1.3) Eşitsizliklerden teorik olarak Ea - Ek değeri oda sıcaklığında (25 oC) suyun
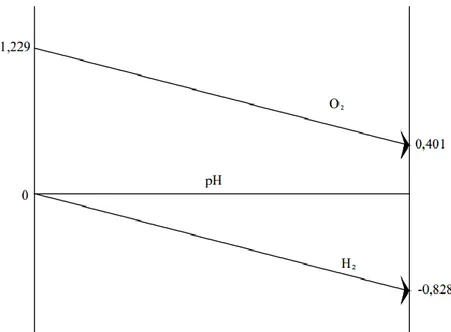
ayrışabilmesi için gereken en düşük gerilim değeri 1,229 V olarak hesaplanmıştır. Ea ve Ek değerlerinin pH’a bağlı değişimleri Şekil 1.2’de gösterilmiştir.
Şekil 1.2. pH potansiyeli değişim oranları
Su izotermal olarak elektroliz olmaktadır. Suyun elektrolizi için gerekli potansiyel (1,481) termodinamik yasasına göre de hesaplanan potansiyelden (1,229) daha büyüktür.
2. LİTERATÜR ARAŞTIRMASI
Enerji ihtiyacının günden güne artmasıyla hidrojen üretimi için çalışmalar her geçen dün daha da önem kazanmaktadır. Araştırmacılar hidrojen üretmek için farklı yöntemler denemektedirler. Kullanılan yöntemlerin başında ise suyun elektrolizi yöntemi gelmektedir. Mevcut araştırmalarda suyun elektrolizi yönteminde kayıplar çok yüksek olduğundan istenilen düzeyde hidrojen üretimi yapılamamaktadır. Bu kayıpları azaltmak için literatürde çok farklı çalışmalar yapılmıştır. Ancak kayıpları sıfıra yakın değerlere indirmek hâlâ mümkün olamamıştır. Suyun elektroliziyle hidrojen üretimi ve plazma destekli hidrojen üretimi ile ilgili literatürde daha önce yapılmış bazı çalışmalar aşağıda verilmiştir:
Plazma destekli elektroliz; endüstriyel hidrojen üretimi, klor-alkali üretimi ve atık su arıtımında büyük potansiyele sahiptir. Plazma destekli elektroliz, hidrokarbon veya Faraday elektrolizinden daha az enerji tüketimi ile daha fazla hidrojen üretmektedir. Saksono ve arkadaşlarının yaptıkları çalışmada 80 o
C ve 1 atm'de KOH-etanol çözeltisinin plazma destekli elektrolizle hidrojen üretimini araştırmıştırlar.
Gerilim, KOH çözeltisi, etanol ilavesi ve katodun derin plazma destekli elektroliz performansı üzerine etkileri incelenmişlerdir. Hidrojen üretimi, kabarcık akış ölçer ve hidrojen analizörü kullanılarak analiz etmişlerdir. Elektrik enerjisi tüketimini bir dijital multimetre ile ölçmüşlerdir. Plazma destekli elektrolizin hidrojen üretimi açısından etkinliği, Faraday Elektrolizi ile karşılaştırılarak değerlendirilmiştir. Sonuçlar, plazma tarafından üretilen hidrojenin elektrolizi, Faraday elektrolizi tarafından üretilen hidrojenden 149 kat daha yüksek olduğu görülmüştür. Optimum hidrojen üretimi, 50,31
mmol / dak, 700 V de 0,03 M KOH, % 10 hacim etanol ve 6,6 cm katot derinliğinde elde
edilip ve enerji tüketimi 1,49 kJ / mmol olmuştur. Sonuç olarak plazma destekli elektroliz yöntemiyle yapılmış reaktörü kullanarak hidrojen üretimi için umut verici bir yol olduğunu göstermişlerdir (Saksono, N. ve ark., 2016).
Yan ve arkadaşları yaptıkları çalışmada, hidrojen üretimi için metanol çözeltilerinin parıltılı boşalma plazma elektrolizini (GDPE) araştırmışlardır. H2 ve HCHO’nun GSYİH sırasında metanolün ayrışmasının baskın ürünleri olduğu
bilinmektedir. Deneysel sonuçlar, yüksek enerjili elektronların metanolün ayrışmasını başlatan en önemli tür olduğunu göstermektedir. Benzer şekilde boşaltılmış polaritenin,
boşaltılmış gerilimin ve etanol konsantrasyonunun hidrojen verimi, enerji tüketimi, hidrojen konsantrasyonu ve hidrojenin formaldehit çıktısı üzerinde önemli etkileri olduğu gösterilmiştir. Katodik GDPE'nin hidrojen veriminin, (anodik GDPE'den (AGDPE) daha yüksek olduğu bulunmuştur. Ek olarak, uygulanan gerilim 750 V'tan yüksek olduğunda, HCHO ayrılmasından sonra CGDPE'den serbest gaz içindeki hidrojen konsantrasyonu % 88'in üzerinde kalmıştır. CGDPE'nin enerji tüketimi (Wr) AGDPE'den önemli ölçüde düşük olduğu görülmüştür. Ayrıca, Wr boşalma
gerilimindeki artışla azalırken, G (H2) metanol konsantrasyonuyla birlikte artmıştır.
Deneysel sonuçlar metanol çözeltilerinin GSYİH'sinin eşzamanlı hidrojen ve formaldehit üretimi için umut verici bir teknik olduğunu göstermiştir (Yan ve ark., 2008).
Chaffin ve arkadaşları tarafından 2006 yılında yapılan çalışmada, kontrollü deneylerden elde edilen ön veriler, plazma destekli elektrolizde metal elektrotların geleneksel elektrolizde olduğu gibi hidrojen ve oksijen üretmek için suya daldırılması gerekmediğini göstermişlerdir. Bunun yerine elektrotlar, elektrot uçları ve su yüzeyi arasında bulunan atmosferik basınç plazmalarından su ile etkileşime girebilmektedirler. Plazmalar tarafından yayılan ışığın deneyleri ve spektral analizi ile negatif elektrot yakınındaki bir bölgeden gelen gazların kütle spektroskopik testleri, negatif elektrotla bağlantılı plazmanın sudan hidrojen geliştirdiğini açıkça göstermektedirler. Geleneksel yöntemde, bir daldırılmış metal elektrotla birlikte tek bir plazma elektrotu kullanıldığında, daldırılmış elektrotta kuvvetli kabarcıklanma gözlenmiştir. Çok geniş olan temel terimlerde, bu yöntemin avantajı, gaz fazı plazma sınırlayıcı bölgelerden geçen yüksek bir hızda hidrojen taşınmasının, yani plazma kılıflarının, hali hazırda geleneksel elektrolizde kullanılan sıvı fazda düşük hızlı difüzyonun yerini alabilmesi olarak ifade edilmiştir. Bu işlemin, dağıtılmış elektrik üretimi için küçük ölçekli güç sistemlerinin güçlendirilmesi için yakıt hücresi sistemlerine ve modüler ünitelere entegrasyon potansiyeli yüksek olan mevcut elektroliz yöntemlerine göre hidrojen üretim ve hidrojen toplama oranını arttırması mümkün görünmüştür (Chaffin ve ark. 2006).
Yan ve arkadaşları tarafından 2005 yılında yapılmış olan çalışmada aşağıdaki ifadeler ileri sürülmüştür: Hidrojen son zamanlarda çevre ve enerji sorunlarına olası bir çözüm olarak dikkat çekmektedir. Hidrojen doğal bir kaynaktan ziyade bir enerji
depolama ortamı olarak kabul edilmektedir. Bununla birlikte, dünyada serbest hidrojen yoktur. Hidrojen elde etmek için birçok teknik önerilmiştir. Geleneksel hidrokarbon yakıtlardan formüle edilebilmektedir. Nükleer reaktör gibi bir ısı kaynağıyla doğrudan elektroliz veya yüksek sıcaklıktaki piroliz yoluyla da sudan elde edilebilmektedir. Ancak, bu yöntemlerin verimliliği düşüktür. Suyun, ısınma için yeterince yüksek sıcaklıklara doğrudan ısıtılması piroliz yöntemi için çok zordur. Piroliz olayı, sıcaklık 4000 °C'yi aştığında meydana gelmektedir. Bu nedenle plazma elektrolizi daha iyi bir alternatif olabilir, aynı zamanda dolaylı kanıt olan Faraday yasaları tarafından öngörüldüğü gibi sıradan elektrolizden daha fazla hidrojen ürettiği görülmektedir. Ayrıca, katotta üretilen ve elektrolitik ayrışma yerine doğrudan ayrışmanın bir kanıtı olan büyük miktarda serbest oksijen gözlemlenmiştir. Faraday verimliliğini aşan verimlerle sürekli hidrojen oluşumunu sağlamak için elektrotun yüzey koşullarını, plazma elektroliz sıcaklığını, akım yoğunluğunu ve giriş gerilimini kontrol etmek gerekmektedir. Plazma durumunu tetiklemek için gereken minimum giriş gerilimi, çözeltinin yoğunluğuna ve sıcaklığına bağlıdır ve bu çalışmada 120 V olarak tahmin edilmektedir. Plazmanın oluştuğu en düşük elektrolit sıcaklığı 75 °C'dir. Plazma elektrolizinin ürettiği sıcaklıktan 300 V' taki geleneksel elektrolizden 80 kat daha fazla hidrojen gözlemlenmiştir (Yan ve ark., 2005).
Mizuno ve arkadaşlarına göre, normal koşullarda suyun doğrudan ayrışması çok zordur. Hidrojen gazı genellikle 3700 °C üzerinde yüksek sıcaklıklarda elektroliz ve piroliz reaksiyonu ile elde edilebilmektedir. Bununla birlikte, daha önce bildirildiği gibi, plazma destekli elektroliz sırasında anormal bir ısı oluşması için eş zamanlı olarak yüksek sıcaklık ve elektroliz koşulları altında elde etmek nispeten daha kolaydır. Yapılan çalışmada, plazma destekli elektroliz sırasında oluşan anormal hidrojen ve oksijen gazı tartışılmıştır. Faraday yasasını aşan miktarlarda hidrojen üretimi, sıcaklık, akım yoğunluğu, giriş gerilimi ve elektrot yüzeyi gibi koşullar uygun olduğunda sürekli olarak gözlenmektedir. Faradik olmayan hidrojen gazı üretimi, bazen normal elektroliz gazından 80 kat daha yüksektir. Hidrojenin fazla olması, diğer laboratuvarlar tarafından çoğaltılmasının zor olduğunu kanıtlamıştır, ancak düzenli olarak çoğaltılabilmektedir (Mizuno ve ark., 2006).
Chi ve Yu (2018) yaptıkları çalışmada, bir enerji depolama ortamı olarak hidrojen, son 10 yılda araştırma kurumlarının ve endüstrinin dikkatini çekmiş, kısmen
kullanılmayan artı rüzgâr ve fotovoltaik güce yol açan yenilenebilir enerjideki gelişmelerden etkilenmiştir. Suyun elektrolizinden hidrojen üretimi, fazla yenilenebilir enerjiden tam olarak yararlanmak için iyi bir seçenek olduğu görülmüştür. Hidrojen üretmek için kullanılan çeşitli teknolojiler arasında, yenilenebilir güç kaynaklarından elde edilen elektriği kullanan suyun elektrolizi büyük umut vaat etmektedir. Hidrojen üretimi için suyun elektrolizinin potansiyellerini araştırmak yerine bu derlemede farklı su elektroliz işlemleri, alkalin su elektrolizi, proton değişim membranı su elektrolizi, katı oksit su elektrolizi ve alkalin anyon değişim membranı su elektrolizi karşılaştırılmıştır. İyon transfer mekanizmaları, çalışma özellikleri, enerji tüketimi ve farklı su elektroliz aparatlarının endüstriyel ürünleri bu derlemede tanıtılmıştır. Yeni su elektroliz teknolojileri için beklentiler tartışılmıştır.
Suyun elektrolizi, yaklaşık iki yüzyıl önce başlayan, hidrojen üretimi için umut vaat eden bir teknoloji olarak kanıtlanmıştır. Rashid ve arkadaşları tarafından yapılan çalışmada, farklı su elektroliz tekniklerinin gelişimini, krizini ve önemini, geçmişini, bugününü ve geleceğini gözden geçirmişlerdir. Çalışmalarında, termodinamik, enerji gereksinimi ve elektroliz işlemlerinin verimliliği incelenmiştir. Alkali su elektrolizi, polimer elektroliz zarı (PEM) ve yüksek sıcaklık elektrolizi incelenip karşılaştırılmıştır. Hidrojen üretimi için su elektrolizinin düşük payı, maliyetin etkin olmaması, yüksek bakım, düşük dayanıklılık, stabilite ve diğer mevcut teknolojilere kıyasla düşük verimlilikten kaynaklanmaktadır. Su elektrolizinin güncel teknolojisi ve bilgisi, hidrojen üretimi için gereken modifikasyon ve geliştirmeler için incelenmiştir. Bu derlemede enerji ihtiyacını, pratik hücre gerilimini, işlemin verimliliğini, hidrojen üretiminin potansiyel kinetiği üzerindeki sıcaklık ve basınç etkilerini ve elektrot malzemelerinin alkalin elektrolizi, PEM elektrolizi ve yüksek sıcaklık elektrolizi için konvansiyonel su elektrolizi üzerindeki etkisi analiz edilmiştir (Rashid ve ark., 2015).
Hidrojen, temel olarak düşük ham madde maliyeti ile oldukça verimli bir işlem olan doğal gaz reformu ile üretilmektedir. Ancak, temiz teknolojilere duyulan ilginin artması, hidrojene olan talebi artırıp diğer kaynakların da keşfedilmesine yardımcı olmak gerekmektedir. Kömür şu anda ana enerji üretim kaynağı olmasına rağmen, yenilenebilir enerji kaynaklarından üretilen elektriğin artması ve dünya çapında düşük emisyonlu enerji üretimi arayışı nedeniyle talebi azalmaktadır. Dünya çapında kömür rezervleri çoktur, ancak bu hammaddeden hidrojen üretmek için yeni teknolojilere
ihtiyaç duyulmaktadır. Kömür gazlaştırma bu amaç için iyi bilinen bir teknolojidir, fakat verimsiz ve yüksek CO2 emisyonları üretmektedir. Son birkaç on yılda araştırılan
alternatif bir teknoloji, karbon destekli suyun elektrolizidir. Kömürün kimyasal enerjisinin sağladığı elektroliz için gerekli enerjinin bir kısmı ile birlikte temel işlemin, su / buhar elektrolizi olduğu görülmüştür (Ju ve ark., 2018).
Zeng ve Zhang (2010) tarafından yapılan çalışmada, alkali metallerin sulu elektrolizi, basitlik avantajı sunan ve hidrojen üretimi için en kolay yöntemlerden biri olduğu kanıtlanmıştır. Suyun elektrolizinin yaygın kullanımı için enerji tüketimini, maliyeti ve bakımı azaltıp, güvenilirliği, dayanıklılığı ve güvenliği arttırmak amaçlanmıştır. Bu literatür taraması, suyun elektrolizi yoluyla hidrojen üretiminin mevcut bilgi ve teknolojisini inceleyip, bu teknolojiyi geliştirmek için Ar-Ge çabalarının gerekli olduğu alanları belirlemek için yardımcı olmuştur. Alkali su elektrolizinin temellerine genel bir bakış sonrasında, elektroliz sistemindeki dirençlerin bir elektriksel analojisi tanıtılmıştır. Dirençler, elektriksel dirençler, reaksiyon dirençleri ve nakliye dirençleri olmak üzere üç kategoride sınıflandırılmıştır. Bunu daha yüksek bir alkali su elektroliz verimliliği elde etmek amacıyla direnci en aza indirmeye yönelik bilimsel bir rehberlik sağlamak üzere her bir rezistansın, termodinamik ve kinetik yoluyla ayrıntılı bir analizi izlenmiştir. Termodinamik analiz, sırasıyla teorik enerji girişi ve hücre gerilimine bağlı olarak çeşitli elektroliz verimlerini tanımlamaktadır. Bu verimlilikler daha sonra farklı elektroliz hücre tasarımlarını karşılaştırmak ve verimlilik gelişimini sağlamak için yapılmıştır. Kilit dirençlerin üstesinden gelmek için de aynı araçlar kullanılmıştır. Kinetik analiz, reaksiyon dirençlerinin alkali konsantrasyonuna, iyon transferine ve elektrot yüzeyindeki reaksiyon bölgelerine bağımlılığını ortaya çıkarmıştır ve elektrot malzemeleri tarafından belirlenmiştir. Tüm dirençleri birbirine bağlayan, reaksiyon dirençlerinin ve kabarcık dirençlerinin önemini ortaya koyan hücre gerilimi bileşenleri ile akım yoğunluğu arasında nicel bir ilişki kurulmuştur. Elektrot yüzeyinde oluşan gaz kabarcıklarının önemli etkisi ve iyon taşıma direncini en aza indirme ihtiyacı vurgulanmıştır. Alkali su elektroliz teknolojisindeki tarihsel ve sürekli gelişme incelenip bununla birlikte farklı su elektroliz teknolojileri, termodinamik ve kinetik analizlerden elde edilen bir dizi pratik parametre kullanılarak sistematik olarak karşılaştırılmıştır. Verimlilik iyileştirmelerine ek olarak, ekipman ve bakım maliyetlerinde azalma, güvenilirlik ve dayanıklılıkta iyileştirme ihtiyaçları da
belirlenmiştir. Gelecekteki araştırma ihtiyaçları, elektrot malzemelerinin, elektrolit katkı maddelerinin ve kabarcık yönetiminin yönlerinden de tartışılmaktadır ve suyun elektroliz teknolojisinin sürekli gelişimi için kapsamlı bir rehber niteliğindedir.
Güneş enerjisinin sıfır karbondioksit emisyonuyla doğrudan dönüştürülmesi yoluyla elektrik üretimi, enerji arz güvenliği ve çevre koruma açısından önemlidir. Bu nedenle, bu çalışmada 960 Wp güneş enerjisi santrali kullanan su elektroliziyle hidrojen
üretimi için bir sistem sunulmuştur. Sabit, tek eksenli ve dualaxis solar izleyici üzerine çiftler halinde monte edilmiş fotovoltaik modüllerin izlenmesinden elde edilen sonuçlar, bir elektrolizör ile çiftlenebilme ihtimalinin olup olmadığını belirlemek için incelenmiştir. Her fotovoltaik sistemin enerji performansı bir yıllık bir süre boyunca kaydedilmiş ve analiz edilmiş, veriler çevrimiçi bir yazılım servisinde izlenmiştir. Aylık güneş ışınımı, güneş enerjisi üretimi, optimum açı, aylık ortam sıcaklığı ve kapasite faktörü gibi tahmini parametreler gözlemlenen verilerle karşılaştırılmıştır. Enerji verimliliğini mümkün olduğunca arttırmak için, bipolar tasarımının yeni bir alkali elektroliz cihazı yapılmıştır. Tasarımı ve çalışma U-I karakteristiği açıklanmıştır. Fotovoltaik modüllerin çalışma U-I karakteristikleri, üretimi en üst düzeye çıkarmak için elektroliz edici çalışma U-I karakteristiğine ayarlanmıştır. Hesaplanan hidrojen üretim hızı, saatte 1.138 gramdır. Çalışma sırasında sistem, 122 evi çalıştırabilen ve 1.31 MWh olarak hesaplanan 1.234 MWh enerji üretmiş ve 906 kg karbon veya 23 ağacın
eşdeğeri olarak hesaplanmıştır (Kovač ve ark., 2019).
Yüksek sıcaklıkta buhar elektrolizi yoluyla hidrojen üretimi, reaksiyon için daha elverişli termodinamik ve elektrokimyasal kinetik koşulların bir sonucu olarak, geleneksel düşük sıcaklıktaki su elektrolizine kıyasla daha az elektrik enerjisi tüketimi içerdiğinden ümit verici bir teknolojidir. Brisse ve arkadaşlarının yaptıkları bu çalışmada, Katı Oksit Elektrolizör Hücresi (SOEC) performansını, çalışma parametrelerinin sıcaklık, nem ve akım yoğunluğunun bir fonksiyonu olarak rapor etmişlerdir. Elektrolit direncinden ve elektrot proseslerinden gelen hücre davranışındaki farklı kayıp terimlerini tanımlamak için akım gerilim ölçümleri empedans spektroskopisi ile birleştirilmiştir. Hidrojen enerji dönüşüm verimleri bakımından oldukça yüksek olan elektriksel enerji elde edilmiştir (örneğin, 1 ve 2 Acm, 900 ve 800
0C'de sırasıyla 1.0 ve 1.25 V hücre gerilimleri). Ayrıca elde edilen sonuçlar, elektroliz
mutlak nem değerlerinde, hidrojen / buhar elektrotundaki buhar difüzyonu olabileceğini göstermiştir (Brisse ve ark., 2008).
LeRoy (1983) yaptığı çalışmada, sudan hidrojen üretimi için mevcut ve gelişen teknolojiler, süreci yöneten temel termodinamik ve kinetik kısıtlamalar çerçevesinde gözden geçirmiştir. Önceliği doğrudan elektroliz işlemlerine yönelik olmuştur. Alkali tek kutuplu ve iki kutuplu, katı polimer elektrolit ve buhar fazı teknolojileri karşılaştırılmıştır. Buhar fazı elektrolizinin, önemli ancak daha uzun vadeli bir ilgi alanı olduğu bir gelişme olduğu halde, 150 °C'nin altındaki sıcaklıklarda alkalin elektrolizinin sonraki on yılda ekonomik olarak tercih edileceği sonucuna varılmıştır (LeRoy, 1983).
Hidrojen üretimi için suyun elektroliz teknolojilerini gözden geçirmekte ve aynı zamanda yenilenebilir enerjilerle suyun elektroliz entegrasyon teknolojisinin durumunu da incelemektedir. İlk olarak, elektroliz hücrelerinin nasıl çalıştığını ve büyük elektroliz modülleri oluşturmak amacıyla nasıl birleştirilebileceğini daha iyi anlamak için termodinamik ve elektrokimyasal işlemlere dikkat edilmesi gerektiği vurgulanmıştır. Elektroliz işlemi ve mevcut üç ana elektroliz teknolojisi (alkali, polimer elektrolit membran ve katı oksit elektrolit, özellikleri, avantajları, sakıncaları ve zorlukları) tartışılmıştır. Mevcut üreticiler ve ticari olarak satılan elektrolizörlerin ana özellikleri kapsamlı bir şekilde incelenmiştir. Son olarak hem otonom hem de şebekeye bağlı sistemlerde suyun elektroliz ünitelerinin yenilenebilir enerji kaynakları ile entegrasyonunu mümkün kılan muhtemel konfigürasyonlar sunulmuş ve bazı ilgili tanıtım projeleri yorumlanmıştır (Ursua ve ark., 2011).
Suyun elektroliziyle hidrojen üretiminin verimliliği konusunda elektrotlar arasındaki kabarcıkların efekti deneysel olarak incelenmiştir. %10 potasyum hidroksit sulu çözeltisinin suyun elektrolizi, elektrotlar olarak Ni-Cr-Fe alaşımı kullanılarak atmosferik basınç altında gerçekleştirilmiştir. Elektrotlar arasındaki boşluk oranını incelemek için aşağıdaki parametreler kontrol edilmiştir: Ayırıcı olan veya olmayan akım yoğunluğu, sistem sıcaklığı, boşluk, yükseklik, eğim açısı ve elektrotların yüzey ıslanabilirliği. Suyun elektrolizinin verimliliği, belirli bir akım yoğunluğunda gerilim düşüşü değeri ile nitel olarak değerlendirilmiştir. Deneysel sonuçlar, elektrot boşluğunu azaltarak elektrotlar arasındaki boşluk oranının artmasının, elektroliz etkinliğinin azalmasına neden olduğunu; yani, belirli bir akım yoğunluğunda optimum bir su
elektroliz koşulu olduğu gözlemlenmiştir. Ek olarak, deneysel sonuçların kalitatif eğiliminin bir bölümünü temsil ettiği bulunan elektrotlar arasındaki fiziksel bir boşluk fraksiyonu modeli sunulmuştur (Nagai ve ark., 2003).
Katı oksit elektroliz hücrelerinin (SOEC'ler) bozulması, muhtemelen yüksek sıcaklıktaki buhar elektrolizi (HTSE) alanındaki en büyük endişe kaynağıdır. Anot destekli, YSZ bazlı mikro tüp katı katı oksit yakıt hücreleri (SOFC) yakıt hücresi modunda ve ayrıca elektroliz modunda yüksek gerilimlerde (2,8 V'a kadar) test edilmiştir. Yüksek buhar dönüşüm oranlarında hücre gerilimi doyma eğilimindedir. Hipotezin elektronik iletkenlik kayıplarını indükleyen ince YSZ elektrolitinin elektrikle indirgenmesinden kaynaklandığı şeklinde olduğu düşünülmüştür. YSZ azaltma katot aktivitesini arttırıp, aşırı katot miktarını azaltmıştır. Hücrenin ağır elektrolit azaltma koşullarında çalışması, yoğun YSZ elektrolitinin tahıl sınırlarında boşlukların oluşmasıyla SEM deneylerinde gözlendiği gibi, YSZ elektrolitinde geri dönüşümsüz hasara neden olmuştur. Bu hasarın kanıtı, AC empedansı ile ölçülen omik direncin artmasıyla da verilmiştir. Hem EDX analizi hem de hücrenin enine kesiti boyunca yapılan mikro Raman spektroskopisi ile elektrolit bozulma belirtileri de bulunmuştur. Gözlenen oksijen elektrot delaminasyon, elektrolit/oksijen elektrot ara yüzünde gerçekleşen yüksek oksijen kısmi basınç gradyanları ile ilişkili olduğu bulunmuştur (Laguna-Bercero ve ark., 2011).
Gai (2006) yaptığı çalışmada, elektrolitik bir çözelti ile bir anot ucu arasında lokal olarak üretilen plazma tarafından indüklenen sulu faz Difenil'in bozulması araştırılmıştır. Sonuçlar, uygulanan gerilimin arttırılmasıyla bozulma oranının büyük ölçüde arttırılabileceğini göstermiştir. Göreceli olarak daha yüksek alkalilik veya asitlik için daha hızlı temizleme oranı sağlanabilmektedir. Fe2+, difenil eliminasyonu üzerinde
belirgin bir katalitik etkiye sahipken, n-bütanol mevcudiyeti bozulmayı önlemektedir. Bozunma işleminin ana ve ara ürünleri HPLC analizi ile tanımlanıp bir bozunma yolu önerilmiştir.
Son yıllarda enerji taşıyıcı olarak hidrojen, enerji ve ekolojik sorunların en iyi çözümlerinden biri haline gelmektedir. Özellikle saf hidrojenin gerekli olduğu proton değişim membranına (PEM) dayanan yakıt hücrelerinin yoğun gelişimi, hidrojen enerjisi ve teknolojisinde gelecekteki uygulamalar için elektrolizör gelişimini teşvik
etmektedir. Yazarların bakış açısından PEM elektrolizi bu amaç için çok perspektiftir. Bu tip elektrolizörlerin diğer uygulama alanlarına göre avantajları ve kullanım alanları gözden geçirilmiştir. PEM elektrolizinde şimdiye kadar elde edilen ve yazarların son başarısı dahil olmak üzere elde edilen bazı sonuçlar özetlenmiştir (Grigoriev ve ark., 2006).
Saksono ve ark. (2014) yaptıkları çalışmada plazma elektroliz işleminin elektrik tüketiminde Faraday elektrolizinden çok daha yüksek verimde olduğu kanıtlanmıştır. Sıcaklık, gerilim ve asetik asidin hidrojen üretimi için plazma destekli elektrolizin etkililik sürecine etkisini vurgulamaktadır. Kullanılan elektrolit, 0.01 M, 0.02 M, 0.03 M ve 0.5 M, 1 M ve 1.5 M asetik asit ile 0.05 M konsantrasyonlu sodyum karbonattır. Sonuç, sıcaklık yükseldiğinde akımın düştüğünü ve hidrojen üretiminin arttığını gözlenmiştir. Sıcaklık 75 °C'den düşük olduğunda, plazma rengi turuncu iken sıcaklık 75 oC'den yüksekken plazma rengi mor olarak gözlemlenmiştir. Gerilim etkileriyle ilgili
olarak gerilim artmasıyla enerji tüketiminin azalması gözlenmiştir. Sonuçlar, asetik asit katkı maddesinin artmasının, enerji tüketiminin azalmasına neden olduğunu göstermiştir. Asetik asit ilavesinde akımın önemli ölçüde düşmesine neden olduğu ve daha fazla asetik asit ilavesinde belirgin bir şekilde yükselmediğini ve asetik asidin artması, hidrojen üretimini önemli ölçüde arttırdığını göstermiştir. Bu kayda değer artış, asit çözeltisindeki hidrojen iyonuna artmasına neden olmuştur. Hidrojen iyonunun artması, plazmadaki H popülasyonunun ve hidrojen üretiminin artmasına neden olabildiği gösterilmiştir.
Güneş ve rüzgâr enerjisi gibi yenilenebilir enerji ile elde edilen suyun elektrolizi, yüksek saflıkta, basit ve yeşil işlemden dolayı hidrojen üretimi için sürdürülebilir bir yöntem olduğu görülmiştir. Zorluklardan biri, gelecekte büyük çapta uygulama için suyun elektrolizinin enerji tüketimini azaltmaktır. Enerji tüketiminin önemli bir kriteri olan hücre gerilimi, teorik ayrışma gerilimi (Uθ), omik gerilim düşüşü (+∑R) ve aşırı
reaksiyonundan (η) oluşmaktadır. Bu derlemede, yüksek hücre geriliminin kinetik ve termodinamik kökleri sistematik olarak analiz edilmiştir. Suyun elektrolizi sırasında, elektrot yüzeyinde kabarcık kaplaması ve elektrolitte kabarcık dağılımı, yani kabarcık etkisi, yüksek omik gerilim düşüşü ve aşırı reaksiyona neden olmuştur. Kabarcık etkisi, yüksek enerji tüketimi için en önemli faktörlerden biridir. Teorik analizlere dayanarak, suyun elektrolizinin son yoğunlaştırma teknolojilerini üç kategoride özetlemişlerdir.
Bunlar; dış alan, yeni elektrolit bileşimi ve yeni termodinamik reaksiyon sistemidir. Bu yoğunlaştırma teknolojilerinin temelleri ve gelişimi tartışılmış ve gözden geçirilmiştir. Reaksiyon aşırı potansiyeli ve omik gerilim düşümü, dış alan veya yeni elektrolit bileşimi ile kinetik olarak iyileştirilebilmektedir. Suyun termodinamik ayrışma gerilimi, katı oksit elektroliz hücresi (SOEC) ve karbon destekli su elektrolizi (CAWE) gibi yeni reaksiyon sistemleriyle de azalması olası olarak görülmüştür (Wang ve ark., 2014).
3. MATERYAL ve YÖNTEM 3.1. Materyal
Elektrik enerjisine olan talebin her geçen gün artmasıyla birlikte alternatif enerji kaynaklarının önemi de giderek artmaktadır. Bu nedenle hidrojen üretimini arttırmak amacıyla araştırmacılar sürekli çalışmalar yapmaktadırlar. Hidrojen üretiminin büyük bir çoğunluğu da suyun elektrolizi yöntemiyle sağlanmaktadır. Mevcut suyun elektrolizi yöntemlerinde kullanılan bağ kırma işlemi yüksek akım yardımıyla yapılmaktadır. Bu tür yöntemlerde akım çok yüksek olduğundan ve kayıplar akımın karesi ile doğru orantılı olduğundan dolayı kayıplar istenilen seviyelerde olamamaktadırlar. Bu çalışmada, gerilim değeri çok yüksek değerlere çıkartılarak ve akım değerleri ise buna karşın çok düşük değerlerde tutularak uygulanan güç değeri, mevcut yöntemlerdekinden çok daha küçük olacak şekilde uygulanmış ve bu sayede elektriksel kayıplar minimum değerlere çekilmiştir. Bu deneysel çalışmada kullanılacak elektrot sistemi için özel olarak tasarlanmış bir reaktör prototipi tasarlanmıştır. Bu prototipin tasarımında kullanılacak malzemenin türü reaktörün verimli çalışabilmesi için oldukça önemlidir. Elektrot sistemi olarak, yüzeyi pürüzsüz ve paslanmaz çelikten imal edilmiş olan ve elektrik akımını iyi iletebilen 100*50*2 mm ölçülerinde kesilmiş 2 adet düzlemsel elektrot kullanılmıştır. Deneysel uygulamalarda farklı frekans ve gerilim değerlerinde ve sabit buhar akışında kapalı bir reaktör içinde plazma işlemi uygulanarak ölçümler alınmıştır.
Deneysel çalışmalar Siirt Üniversitesi, Mühendislik Fakültesi B blok binasında bulunan yüksek gerilim laboratuvarında gerçekleştirilmiştir. Deney sistemindeki reaktör için 5 mm kalınlığındaki fiberglas malzeme kullanılmıştır. Kapalı reaktöre istenilen nem miktarını verebilmek için ultrasonik soğuk buhar makinesi; gerilimi istenilen seviyede ayarlayabilmek için ise ayarlanabilir gerilim kaynağı; reaktör çıkışındaki gaz ölçümlerini yapabilmek için hassas bir dijital gaz analizörü ile AC beslemeli 0-33 kV arasında istenilen değerde çıkış gerilimi verebilen gerilim trafosu kullanılmıştır. Trafonun topraklanma bağlantısı ise laboratuvar da bulunan toprak bağlantısının dışında yeni bir toprak hattı çekilmesiyle gerçekleştirilmiştir. Uygulamalarda kullanılan dâhili tip gerilim trafosu Şekil 3.1’de gösterilmiştir.
Şekil 3.1. Dâhili tip gerilim trafosu görüntüsü
Dahili gerilim trafosunun besleme için kullanılan 0-220 V aralığında 1 V aralıklarla çıkış gerilim verme özelliğine sahip tek fazlı varyak Şekil 3.2’de gösterilmiştir. Çıkış gerilimi ise sağ üst kısımda bulunan dijital voltmetre yardımıyla istenilen seviyede ayarlanabilmektedir.
Reaktör içine soğuk su buharını verebilmek için ise hikoneb home-type marka ve modelli buhar makinesinden yararlanılmıştır. Buhar makinesi ise 400 ml su kapasitesine sahip olup buhar kapasitesi ise 0-5 ml/dk özelliklerini taşımaktadır.
Şekil 3.3. Soğuk buhar makinesi görüntüsü
Deney sisteminde dâhili gerilim trafosunu beslemek amacıyla kullanılan kumanda ve ölçüm cihazları (0-220 V gerilim çıkışlı varyak ve AC güç kaynağı, 45-500 Hz arasında ayarlanabilir frekans ve osiloskop) Şekil 3.4’te gösterilmiştir.
Şekil 3.4. Deney sisteminin kumanda ve ölçüm elemanları
Gerilim trafosu, reaktör, soğuk hava üreticisi ve nem ölçerin bir arada kullanıldığı deney sisteminin bir görüntüsü Şekil 3.5’te gösterilmiştir.
Şekil 3.5. Deney sisteminin genel görüntüsü
Reaktörlerin giriş ve çıkışlarından çıkan gazların analizlerinin yapılması ve reaktörlerin ne kadar verimle çalıştığını test etmek için bir adet gaz analizör cihazı kullanılmıştır. Şekil 3.6’da gösterilen bu cihazın markası MRU OPTİMA 7 Portatif Multifonksiyon Baca gazı Analiz Cihazı olarak bilinir.
Şekil 3.7 incelendiğinde reaktör sistemi 2 dış katman ve 1 ara katmandan oluşmaktadır. 3 ana katman için de fiberglas malzemeden yapılmış sert plastik kullanılmıştır. Dış katmanların ölçüleri şekilden de anlaşılacağı gibi 10*5*1,25 cm ölçüleri ve 5 mm kalınlığındaki fiberglas malzemeden yapılmıştır. Ara katman ise aynı ölçü boyutlarına sahip ancak kalınlığı 3 mm olan malzeme kullanılmıştır. Ara katmanda geçirgenliği sağlamak için de 5 mm çapında delikler açılmıştır.
Şekil 3.7. Deneysel çalışmalarda kullanılan reaktörün teknik çizimi ve kapalı şeması Elektroliz olayının gerçekleşebilmesi için elektrotlar olarak da 90*40 mm boyutlarında paslanmaz çelik sac malzeme kullanılmıştır. Reaktörün su buharı beslemesi için ise 7 mm çapındaki silindirik bir fiberglas boru kullanılmıştır. Oluşan
gazların miktarını ölçmek için de fiberglas malzemeden yapılmış olan 3 mm çapındaki boru şekilli 2 farklı çıkış kullanılmıştır.
3.2. Yöntem
Suyun elektrolizi ile ilgili literatürde yapılan çalışmalar, genellikle P=U*I bağıntısına göre gerilim değerinin düşük; akım değerinin ise yüksek olması temeline dayanmaktadır. Ayrıca bu tür çalışmalar suyun sıvı fazında gerçekleştirilmektedir. Dolayısıyla, çözeltinin iletkenliği parametresinin önemi büyüktür. Bu nedenle, iletkenliği arttırmak amacıyla çözelti ortamına bazen iletkenliği arttırıcı kimyasallar da kullanılmaktadır.
Bu tez çalışmasında ise mevcut durumdan farklı olarak; aynı bağıntıya (P=U*I) göre, gerilim değeri yüksek; akım değerinin ise düşük olması yöntemi denenmiştir. Böylece, ortamın iletkenliğinden ziyade ortamın yalıtkanlık parametresinin etkinliği ön plana çıkmaktadır. Elektriksel plazma kapasitif özellikli olduğundan dolayı ortam direnci ne kadar yüksek olursa, plazmanın etkinliği açısından verimin de o oranda yüksek olması beklenir. Bu nedenle, elektroliz işleminin etkin bir şekilde yapılabilmesi için mevcut uygulamalardan farklı olarak suyun sıvı fazı yerine, suyun buhar fazı kullanılarak uygulamalar gerçekleştirilmiştir. Elektriksel plazma aralığının direncinin büyük olmasını sağlamak amacıyla çözeltiye herhangi bir kimyasal madde eklenmeyip, deneyler kaynak suyunun buhar fazı ile gerçekleştirilmiştir. Sıcaklık parametresinin etkisini yok etmek amacıyla bir ultrasonik nebulizatör yardımıyla uygulamalar, soğuk buhar şeklinde ve oda sıcaklığında gerçekleştirilmiştir.
Elektriksel plazma yardımıyla suyun elektrolizinin diğer bir önemli avantajı ise plazma ortamında elde edilen ürünlerin aktif bir iyon veya molekül haline gelerek çeşitli bileşikler oluşturma eylemini gerçekleştirmesidir. Bu durumda üretilen O
ve H+ iyonları, plazmanın etkisiyle ortamda aktif olarak bulunan diğer elementlerle (örneğin
C, S, N gibi) bağ yaparak çeşitli ürünlerin elde edilmesine olanak sağlamaktadır. Bu
4. BULGULAR
Elektriksel plazma yöntemiyle gerçekleştirilen suyun elektrolizi işlemlerinde elde edilen Hidrojen ve Oksijenin net miktarları, ortamda üretilen ürünlerin bileşimlerindeki miktarlar ile doğrudan üretilen miktarların toplanmasıyla belirlenmiştir. Plazma ortamında hidrojen ve oksijenin doğrudan üretilmelerinin yanı sıra, ortamdan elde edilen çeşitli azot ve karbon bileşiklerindeki oksijen ve hidrojen sayılarının hesaplanmalarıyla net miktarları ortaya konulmuş ve grafik ortamında değerlendirilmiştir. Yapılan ölçümler ve hesaplamalarda saatte ortalama 300 ml su ultrasonik yöntemle soğuk buhara dönüştürülerek işlemler gerçekleştirilmiştir. Sıcaklık parametresinin sonuçları etkilemesini önlemek amacıyla uygulamalar oda sıcaklığında gerçekleştirilmiştir. Ayrıca, plazma oluşumunda akım değerleri çok küçük (µA veya mA seviyelerinde) olduğundan dolayı elektriksel bakır kayıpları yok denecek kadar az olmaktadır. Böylece çözelti ortamının ısınması da söz konusu değildir. Tez çalışmasında kullanılan yöntem sayesinde alınmış olan verilerin grafiksel gösterimleri ve yorumlamaları aşağıda verilmiştir.
Plazma destekli elektrolizde genel olarak Gerilim-Akım karakteristiği Şekil 4.1’deki gibidir. Gerilim ve akım sıfırdan başlayarak, gerilim değeri arttıkça akımdaki değişim de OHM Kanunu’na göre lineer olarak değişmektedir. Şekilde farklı frekans değerlerine göre Gerilim-Akım değerleri gösterilmiştir. Aynı gerilim değerlerinde frekans değeri daha küçük olanda daha fazla akım geçtiği görülmüştür.
0 2 4 6 8 10 12 14 16 0 2 4 6 8 Akım (m A) Gerilim (kV) f=50 Hz f=100 Hz f=200 Hz f=350 Hz f=500 Hz
f=50 Hz frekansında gerilim-gaz miktarı Şekil 4.2’den de görüldüğü gibi lineere
yakın olarak artmaktadır. Tam olarak lineer olması için ortamın izole olması gerekmektedir. Şekilden de anlaşılacağı gibi suyun elektrolizinden oluşan hidrojen ve oksijen miktarı (ppm) arasında 2 katlık bir fark bulunmaktadır.
0 20 40 60 80 100 0 2 4 6 8 G a z m ikt a rı (p p m ) Gerilim (kV)
f=50 Hz
O2 H2Şekil 4.2. f=50 Hz frekansında alınan Gerilim-Gaz miktarı karakteristiği
Şekil 4.3’e bakıldığında f=100 Hz frekansında Gerilim-Gaz miktarı, gerilimin 5
kV’un üstüne çıkmasıyla birlikte, Şekil 4.2’ye göre üretilen hidrojen ve oksijen
miktarından daha fazla olduğu görülmektedir. Artış miktarının lineer olmaması, plazma ortamının kademeli olarak gelişmesine bağlıdır. Şekilden de anlaşılacağı gibi suyun elektrolizinden oluşan hidrojen ve oksijen miktarı (ppm) arasında ortalama 2 katlık bir fark bulunmaktadır. Frekansın artmasına balı olarak gaz miktarının artmasının temel nedeni, plazma ortamında oluşan hareketli yüklerin sayılarının artmasına bağlı olarak daha fazla sayıda molekül bağlarının kırılması sonucu üretilen gaz miktarında önemli derecede artış görülmesi ile açıklanabilir. Genel durumlarda, grafiklerde görülen basamaklı değişim durumları ise, plazmanın gelişiminin basamaklı olarak meydana gelmesi ve özellikle plazmanın gelişimi esnasında ortamdaki hareketli uzay hacim yüklerinin karşılıklı iyonizasyon ve rekombinasyon olaylarının farklı değişimler göstermesinin bir sonucu olarak değerlendirilebilir. Bu durum literatürdeki çalışmalarla iyi uyum göstermektedir.
0 20 40 60 80 100 120 140 0 1 2 3 4 5 6 7 G a z m ikt a rı (p p m ) Gerilim (kV)
f=100 Hz
O2 H2Şekil 4.3. f=100 Hz frekansında alınan Gerilim-Gaz miktarı karakteristiği
f=200 Hz frekansında oluşan gaz miktarı diğer şekillerdeki gibi gerilimin
artmasıyla orantılı olarak artmaktadır. Şekil 4.4 incelendiğinde U=4 kV değerlerinin üstüne çıktığı ve bu durumda boşalma olayı çığ şeklinde geliştiği için zamanla oluşan gaz miktarındaki artışlarda üstel bir değişim gözlemlenmiştir.
0 10 20 30 40 50 60 70 80 90 0 1 2 3 4 5 6 7 G a z m ikt a rı (p p m ) Gerilim (kV)
f=200 Hz
O2 H2Şekil 4.4. f=200 Hz frekansında alınan Gerilim-Gaz miktarı karakteristiği
f=350 Hz frekansında oluşan gaz miktarı diğer şekillerdeki gibi gerilimin
artmasıyla orantılı olarak artmaktadır. Şekilden de anlaşılacağı gibi gerilim U=3 kV değerinin üzerine çıkarıldığında boşalma olayı çığ şeklinde geliştiği için zamanla oluşan gaz miktarındaki artışlar da üstel olarak artmıştır.
0 10 20 30 40 50 60 0 1 2 3 4 5 6 7 G a z m ikt a rı (p p m ) Gerilim (kV)
f=350 Hz
O2 H2Şekil 4.5. f=350 Hz frekansında alınan Gerilim-Gaz miktarı karakteristiği
Şekil 4.6’ya bakıldığında frekans değeri çok yüksek olduğundan gerilimin artmasıyla oluşan gaz miktarında büyük artış gözlenmemiştir.
0 10 20 30 40 50 60 0 1 2 3 4 5 6 7 G a z m ikt a rı (p p m ) Gerilim (kV)
f=500 Hz
O2 H2Şekil 4.6. f=500 Hz frekansında alınan Gerilim-Gaz miktarı karakteristiği
Şekil 4.7 incelendiğinde U=3 kV değerinde sabitken iken frekansın artmasıyla oluşan gaz miktarları gösterilmektedir. f=100 Hz frekansında oluşan gaz miktarı en fazla değerine ulaşmıştır ancak frekans artmasıyla plazma ortamına geçildiğinden gaz miktarı neredeyse sabitlenmiştir.
0 5 10 15 20 25 30 35 40 45 50 0 100 200 300 400 500 600 G a z m ikt a rı (p p m ) Frekans (Hz)
U=3 kV
O2 H2Şekil 4.7. U=3 kV sabit gerilimde alınan karşılaştırmalı Frekans-Gaz miktarı karakteristiği Şekil 4.8’e bakıldığında farklı frekans değerlerinde Zaman-Güç karakteristiği gösterilmiştir. 5 farklı frekans değeri içinde uygulanan süre arttıkça deney setindeki güç miktarı da orantılı olarak artış göstermektedir.
0 10 20 30 40 50 60 70 80 90 100 0 5 10 15 20 25 G ü ç (W) Zaman (s) f=50 Hz 100 Hz 200 Hz 350 Hz 500 Hz
Şekil 4.8. Çeşitli frekans değerlerine ait Zaman-Güç karakteristiği
Şekil 4.9’da elektriksel plazmanın tutuşmadan önceki Townsend Moduna ait akım osilasyonları verilmiştir. Şekilden de görüldüğü üzere boşalma başlamıştır fakat henüz Townsend Modu’ndadır ve ayrıca kararlıdır. Akım osilasyonlarından görüldüğü
gibi ortamda henüz uzay hacim yükleri oluşmamış ve dolayısıyla Trichell darbeleri bu aşamada görülmemektedir.
Şekil 4.9. Plazmanın Townsend Modu’ndaki Giriş/Çıkış akım osilasyonları görüntüsü Şekil 4.10’da elektriksel plazmanın tutuşma anındaki başka bir deyişle Townsend Modundan hemen sonraki anına karşılık gelen akım osilasyonlarına ait görüntüler verilmiştir. Şekilden de görüldüğü üzere boşalma başlamıştır ve boşalmayla birlikte uzay hacim yükleri de harekete geçmeye başlamıştır. Bu durumda boşalmada kararsız rejimler başlamıştır.
Akım osilasyonlarından görüldüğü gibi akım osilasyonları üzerinde Trichell darbeleri oluşmaya başlamıştır. Bu durumda hem pozitif alternanslarda hem de negatif alternanslarda korona boşalması meydana gelmiştir. Boşalma akımı üzerindeki Trichell darbelerinin pozitif ve negatif alternansların tepe değerlerine yakın bölgelerde oluşmalarının temel nedeni ise gerilim seviyelerinin artışıyla birlikte boşalmanın da reaktör içerisindeki lokal bölgelerde tutuşmaya başladığının bir nedeni olarak yorumlanabilir. Darbelerin yoğunluğu ise boşalmanın iyice gelişerek ark olayına yakın bir safhaya geldiğini ifade eder.
Şekil 4.10. Plazmanın Townsend Modundan hemen sonraki aşamasına ait Giriş/Çıkış akım osilasyonları
görüntüsü
Şekil 4.11’de elektriksel plazmanın tutuşmadan sonraki bir anına karşılık gelen; yani boşalmanın gelişim evresine ait akım osilasyonları görüntüleri verilmiştir. Şekilden de görüldüğü üzere boşalma iyice gelişmiş ve kararsızlık durumları belirginleşmiştir. Boşalmayla birlikte uzay hacim yükleri iyice harekete geçmiştir. Bu durumda boşalmanın kararsızlığı daha da artmıştır. Bu aşamada akım osilasyonları üzerindeki Trichell darbelerinin sayısı ve yoğunlukları daha da artmıştır. Bu durumda pozitif ve negatif koronalar daha da belirginleşmiştir.
Şekil 4.12’de elektriksel plazmanın ark aşamasından önceki bir anına karşılık gelen; yani boşalmanın aşırı gelişim evresine ait akım osilasyonlarının görüntüleri verilmiştir. Şekilden de görüldüğü üzere boşalma gelişmenin ötesi bir aşamaya geçmiş ve kararsızlık miktarı iyice artmıştır. Bu aşamada uzay hacim yüklerinin mobiliteleri ileri derecede artmıştır. Buna bağlı olarak boşalmanın kararsızlığı çok daha fazla artmıştır. Bu aşamada akım osilasyonları üzerindeki Trichell darbelerinin sayısı ve yoğunlukları daha fazla artmıştır. Boşalmanın bu durumdaki akım değerleri mikroamperlerden miliamperler seviyelerine çıkmıştır. Trichell darbelerinin sayılarının artması, aynı zamanda elektroliz ortamında bulunan su buharı moleküllerinin ayrışarak Hidrojen ve Oksijen üretimine pozitif yönde etki yapmaları sağlanmış olur. Boşalmanın bundan sonraki aşaması ise ark aşaması olacaktır.
Şekil 4.12. Plazmanın Ark Modu öncesine ait Giriş/Çıkış akımlarının osilasyon görüntüleri Elektriksel plazmanın suyun elektrolizi üzerinde etkisinin araştırılmasında bazı özel durumlara da rastlanılmıştır. Elektroliz olayında hidrojen gazı ve oksijen gazı üretiminin yanı sıra bu gazların iyonik bileşikleri de elde edilmiştir. Bu durum endüstriyel açıdan önemli bir özelliğe sahiptir. Elektriksel plazma etkisiyle iyonik halde elde edilen bu gazların ortamında bulunan azot veya karbon miktarlarıyla reaksiyon oluşturmaları neticesinde bazı azot ve asit bileşiklerinin oluşumuna da rastlanılmıştır. Gelecekte bu tür yöntemlerin kullanılmasıyla bazı endüstriyel değeri yüksek olan bileşiklerin elde edilmeleri sağlanabilir.
5. SONUÇLAR ve ÖNERİLER 5.1. Sonuçlar
Günümüzde enerji kaynaklarına duyulan ihtiyacın sürekli artmasıyla hidrojen enerjisi ile yapılan çalışmalar da her geçen gün artmaktadır. Hidrojen üretiminde en çok kullanılan yöntemlerin başında suyun elektrolizi gelmektedir. Ancak suyun elektrolizi yönteminde kayıplar çok yüksek olduğundan dolayı, araştırmacılar kayıpları azaltmak için birçok yöntem denemiştirler. Bu çalışmada kayıpları minimuma indirebilmek için mevcut yöntemlerin dışında olan yeni bir yöntem önerilmiş ve bu sayede kayıplar minumum düzeylere indirilmiştir. Önerilen bu yöntem sayesinde kayıpların azaltılması için mevcut yöntemlerdeki akımla bağ kırma yöntemi yerine, kuvvetli elektrik alanının dövme veya bombardıman etkisiyle su buharı moleküllerine ait bağları kırmaya yönelik işlemler yapılmıştır. Moleküllerin bağlarının kırılabilmesi için gerilimin çok yüksek değerlere çıkartılması sayesinde plazma ortamı oluşturularak, ortamdaki yüklü parçacıkların bombardımanı etkisi sonucu üretilen Hidrojen ve Oksijen miktarları incelenmiştir. Kayıplar ise akımın karesi ile doğru orantılı olduğundan dolayı ve plazma akımlarının mikroamperler veya miliamperler düzeyinde olması nedeniyle oluşacak kayıp miktarları da oldukça düşük seviyelere gerilemiştir. Deneysel uygulamalarda çeşitli frekans değerlerindeki yarı doğru akım ve farklı gerilim değerlerinde oluşturulan elektriksel plazmanın kullanılmasıyla üretilen gaz miktarları ölçülmüş ve elde edilen sonuçlar aşağıda sıralanmıştır:
Frekans değerlerinin artmasına bağlı olarak plazma ortamındaki yüklü parçacıkların sayısı da buna bağlı olarak artmıştır. Dolayısıyla bu durum yüklü parçacıkların bombardıman etkisini de arttırdığı görülmüştür.
Frekansın artmasıyla birlikte üretilen gaz oranlarının da önemli derecede arttığı görülmüştür fakat 100 Hz ile 200 Hz aralığındaki bir değerde, üretilen gaz miktarı açısından bir dönüm noktası elde edilmiştir.
Uygulama geriliminin artmasına paralel olarak elektriksel plazmanın etkinliği de artmış ve buna bağlı olarak üretilen gaz miktarı da benzer oranlarda artış göstermiştir.