GİRİŞ
Serbest radikaler yapılarında eşlenmemiş elektron bulunduran ve çevresindeki her madde ile tepkime verme yatkınlığı olan, negatif yüklü elektron sayısının çekirdekteki pozitif yüklü proton sayısı ile eşit olmadığı moleküllerdir. Mitokondrial, endoplazmik ve nükleer elektron taşıma sistemlerinde (sitokrom P-450), peroksizomlarda, monosit ve nötrofillerin fagositozu gibi normal metabolik olaylar sırasında çok miktarda serbest radikal üretilmekte ve vücutta önemli moleküllerle örneğin proteinlerle, lipitlerle ve nükleik asitlerle zincirleme oksidasyon tepkimeleri verebilmektedirler. Yapıları, fiziksel ve kimyasal özellikleri, hücresel kaynakları, rol oynadıkları tepkimeler ve etkileri ile çeşitli klinik durumların ve hastalıkların patojenezinde rol oynarlar [1].
Serbest radikallerin hasar verici etkilerinin azaltılması ve nötralize edilmesi amacına yönelik hücreler değişik antioksidan sistemler geliştirmiştir. Organizmada oluşan serbest radikalleri zararsız hale getirmeye çalışan süperoksit dismutaz (SOD), katalaz (KAT), glutatyon peroksidaz (GPx), glutatyon S-transferaz (GST) gibi antioksidan enzimler bulunmaktadır. SOD enzimi hem sitoplazmada hem de mitokondride süperoksit radikallerini hidrojen peroksite çevirmektedir. Peroksizomal KAT ve sitoplazmik GPx enzimleri oluşan hidrojen peroksiti hidroksi radikaline dönüşmeden nötralize etmektedirler. GPx enzimi antioksidan molekül olan indirge glutatyonu (GSH), hidrojen peroksiti indirgemede kullanmaktadır. Yine aynı şekilde sitoplasmik GST, indirge glutatyonu kullanarak hücrelerdeki oksidan stresi azaltmaya yönelik rol almaktadırlar. GST’ler aynı zamanda oksidatif olarak modifiye edilmiş molekülleri hücre içerisinde detoksifiye
Diyabetik Sıçan Karaciğer Dokularında Oksidatif Hasar Parametrelerinin ve Antioksidan
Enzimlerin Değişimleri
Gökhan SADİ1, Özlem SADİ2
1 Biyoloji Bölümü, Karamanoğlu Mehmetbey Üniversitesi, Karaman, Türkiye 2 Eğitim Bilimleri Bölümü, Karamanoğlu Mehmetbey Üniversitesi, Karaman, Türkiye
*Sorumlu Yazar Geliş Tarihi : 04.11.2010
e-posta: sadi@kmu.edu.tr Kabul Tarihi : 08.12.2010
Özet
Diyabet vücutta birçok organı etkileyen ve bir dizi komplikasyon serisi olarak nitelendirilen bir hastalıktır. Yüksek kan şekerinin neden olduğu hiperglisemi, serbest radikal üretimine glukoz otoksidasyonu, enzimatik olmayan protein şekerlenmesi, polyol ve heksozamin yolununa artan sübstrat akışı ve protein kinaz C aktivasyonu ile serbest radikal üretimini arttırmaktadır. Oksidatif stresin diyabetin patolojisinde rol aldığı bir çok çalışma ile kabul edilmiştir. Bu çalışmada serbest oksijen radikallerinin detoksifikasyonunda görevli antioksidan enzimlerin; süperoksit dismutaz (SOD), katalaz (KAT), glutatyon peroxidaz (GPx) ve glutatyon S-transferaz (GST)’ın, streptozotocin (STZ) ile diyabetik hale getirilmiş sıçan karaciğer dokularında aktiviteleri ölçülmüştür. Diyabette SOD ve KAT aktivitelerinin kontol hayvanlara kıyasla düştüğü, GPx ve GST aktivitelerinde ise anlamlı bir değişikliğin olmadığı bulunmuştur. Bunun yanında lipit peroksidasyonu ve protein karbonil seviyelerinin diyabette anlamlı oranda arttığı ve glutatyon (GSH) seviyelerinin konrol grubuna kıyasla azaldığı belirlenmiştir. KAT ve SOD gibi iki ana antioksidan enzim aktivitesinin enzim inaktivasyonu ile azalması, doku hasarındaki artış ve aynı zamanda GSH miktarındaki anlamlı azalma diyabette meydana gelen oksidatif stres ve olası tepki mekanizmaları ile açıklanabilmektedir.
Anahtar Kelimeler: Diyabet, oksidatif stres, antioksidan enzimler, lipit peroksidasyonu, protein karbonilasyonu
Abstract
Diabetes mellitus is a disease which has been characterized by a series of complications affecting several tissues in the body. High blood glucose concentrations leading hyperglycemia also cause free radicals to be produced via glucose autoxidation, non-enzymatic protein glycation, increased influx toward polyol pathway, activation of protein kinase C and increased flux through hexosamine pathway. The involvement of oxidative stress in the pathogenesis of diabetes mellitus has been confirmed by numerous studies. In this study, activities of main antioxidant enzymes, superoxide dismutase (SOD), catalase (CAT), glutathione peroxidase (GPx) and glutathione S-transferase (GST) which are involved in the detoxification of reactive oxygen species, was measured in the streptozotocin (STZ) induced diabetic rat liver tissues. The enzyme assays showed that there was a significant decrease in both SOD and CAT activities compared to control animals even though there was not significant alteration in GPx and GST activities. Furthermore, it has been found that lipid peroxidation and protein carbonylation levels were increased significantly in diabetic animals and glutathione (GSH) levels were decreased as compared to control rats. The decrease in activities of CAT and SOD by enzyme inactivation, increased tissue damage and the decreased GSH amounts elucidates the role of oxidative stress in diabetes and the possible outcomes of that disease.
ederek, hücresel peoksitleri nötr hale getirmektedirler. Antioksidan moleküller ise serbest radikallerin oksitleme etkilerini önleyen, radikallerdeki serbest elektronları kendileri radikal olmadan kabul edebilen moleküllerdir. Hücrelerdeki ana moleküler antioksidanlar E vitamini (VE), C vitamini (VC), Lipoik Asit (LA) ve indirge glutatyon (GSH)’tır. Lipofilik bir madde olan VE (α-tokoferol) ve LA hücre zarını zincirleme lipit peroksidasyonu tepkimelerinden korur. VC ve LA’nın indirgenmiş formu dihidrolipoik asit (DHLA) oksitlenmiş diğer antioksidanların hücre içerisinde yenilenmesinden sorumludur. VC ve LA’nın okside tokoferol’u tekrar eski haline getirerek redoks çemberinde önemli fonksiyonları bulunmaktadır.
Serbest radikaller ile antioksidan savunma sistemleri arasındaki hassas dengenin, peroksidan ve oksidan maddelerin lehine kayması oksidan stresinin gelişmesine yol açmakta, ve buda diyabet gibi önemli hastalıkların bir çoğunda ikincil komplikasyonlara neden olmaktadır. Insülin hormonunun yokluğu, yetersizliği veya etkisizliği nedeniyle vücuttaki bir çok organı etkileyen ve serbest oksijen radikallerinin patalojisinde yer aldığı bir hastalık olan diyabette, vücuttaki glukoz miktarına bağlı olarak artan glukozun otoksidasyonu [2], enzimsel olmayan protein şekerlenmesi [3] ve polyol yolundaki enzim aktivitelerinin artması [4] diyabetli dokularda serbest oksijen radikallerin artmasına neden olmakta, dolayısı ile hücrelerin enzimsel ve enzimsel olmayan antioksidan savunma sistemlerini etkilemektedir [5].
Bu çalışma ile KAT, SOD, GPx ve GST gibi kuvvetli antioksidan enzimlerin tip I diyabet hastalığındaki değişimleri, enzim aktivitesi seviyesinde incelenmiş, aynı şekilde doku oksidatif hasar parametreleri olan protein karbonillenmesi ve lipit peroksidasyonu son ürünü olan malondialdehit (MDA) seviyeleri ve indirge glutatyon (GSH) miktarı ölçülerek serbest radikallerin diyabetteki olası etkileri belirlenmeye çalışılmıştır.
GEREÇLER VE YÖNTEMLER
Eşit yaşta erkek Wistar sıçanları diyabetik ve kontrol olmak üzere iki guruba ayrıldı ve sıçanlarda diyabet STZ ile; sıçan ağırlığının her 1 kg’ı için 50mg, 0.05M citrat tamponu (pH:4.5) içinde hazırlanmış STZ’nin intraperitonial yoldan enjekte edilmesiyle oluşturuldu. Kontrol grubuna her 1 kg sıçan ağırlığı için 50 mg fizyolojik salin çözeltisi verildi. STZ uygulamasından 5 gün sonra ve deneylerin devam ettiği 4 hafta boyunca bütün hayvanlarda açlık kan şekerleri AccuCheckGO (Roche) cihazi ile günlük olarak ölçüldü. STZ uygulaması sonucu ölçülen açlık kan şekerleri 200mg/dl nin üzerinde olan hayvanlar diyabetik olarak kullanıldı. STZ uygulamasından sonra dört hafta boyunca hayvanların ağırlıkları ve açlık kan şekerleri düzenli olarak ölçülerek kaydedildi. Ardından, sıçanların kesilerek ayrılan dokuları sıvı azot ile dondurulduktan sonra -85oC de
saklandı. Deney hayvanlarının yetiştirilmesi, deneysel uygulamalar ve hayvanların kesimi Fırat Üniversitesi etik kurulu onayı ile uluslararası deney hayvanı yetiştirme ve kullanma kurallarına göre gerçekleştirildi.
Karaciğer dokularının (diabetik (n=9) ve kontrol (n=9)) bir bölümü cam-teflon homojenizator ile KCl (1.15% w/v), Potasyum fosfat tamponu (25mM, pH:7.4), PMSF (0.2mM) ve DTT (0.2mM) içeren homojenizasyon çözeltisi kullanılarak (3x30 sn) buz içinde homojen hale getirildi. Ardından homojenat 1.500g de 15 dakika sentrifüjlenerek, üst kısımdan enzim aktivite ölçümleri için S1 örnekleri ayırıldı. Daha sonra kalan süpernatant 16.000g de 20 dakika çevirildi ve mitokondrial pelet atılarak sitoplazmik fraksiyonlar (S16) indirge glutatyon (GSH), protein karbonilasyonu ve lipit peroksidasyonu ölçümü için ayırıldı. Ayrıştırılan S1 ve S16 fraksiyonlarında toplam protein miktarı Lowry ve arkadaşlarının [6] metodu ile tayin edildi.
Lipit peroksidasyonu son ürünü olan MDA miktarları diyabetik ve kontrol karaciğer dokularının S16 fraksiyonlarında ölçüldü [7]. Bu metoda göre lipit peroksidasyonu son ürünü olan malonedialdehit (MDA), tiyobarbitürik asit (TBA) ile reaksiyona girerek 532 nm de spektroskopik olarak okunabilen son ürün vermektedir. Bu ürünün absorbansı ve ekstinksiyon katsayısı değeri 1.56x105 M-1.cm-1 kullanılarak kontrol ve diyabetik karaciğerlerde oksidatif lipit hasarı göstergesi olarak lipit peroksidasyonu ölçüldü. Bunun için 0.2mL homojenat 0.8mL PBS (137mM NaCl, 2.7mM KCl, 10mM Potasyum fosfat tamponu pH:7.4), 0.025mL BHT (40mM) ve 0.5mL 30% (w/v) TCA ile karıştırıldı. Daha sonra proteinler 2.000g de 15dk sentrifujlenerek çökeltildi. Ardından, 1mL süpernatanta, 0.25mL TBA (0.05N NaOH ile %1 w/v hazırlanmış) ve 0.075mL EDTA (0.1M) eklenerek 45 dakika boyunca su banyosunda kaynatıldı ve 532nm de absorbansları ölçüldü.
Glutatyon (GSH) tayini Sedlak ve Lindsley’in [8] metodu kullanılarak yapıldı. Bu metoda göre indirge glutatyon, 5,5’-dithiobis-(2-nitrobenzoik asit) (DTNB) ile tepkimeye girerek 412nm de okunabilen soluk sarı bir renk oluşturmakta, GSH standart kalibrasyon eğrisi kullanılarak dokulardaki GSH miktarı tayin edilebilmektedir. 0.25mL homojenat, 0.75mL Tris tamponu (0.2M Tris, 0.02M EDTA, pH:8.2), 0.05mL DTNB (0.01M) ve 3.95mL metanol ile karıştırılarak 30dk boyunca oda sıcaklığında bekletildi ve ardından 3.000g de 15dk boyunca sentrifüjlenerek proteinler atıldı ve 412nm de absorbans değerleri okundu.
Oksidatif stres sonucu proteinler üzerinde oluşan karbonil gruplarının tayini Levine ve arkadaşlarının metodu [9] kullanılarak yapıldı. Bu metoda göre protein karbonil grupları 2,4-dinitrophenylhydrazine (DNPH) ile reaksiyona girerek stabil 2,4-dinitrophenyl (DNP) hydrazone oluşturmaktadır. Oluşan bu son ürün spektrofotometrik olarak 360nm de okunabilmektedir. Bu yöntemde molar absorblama katsayısı olan 2.2x104 M-1.cm-1 kullanılarak diyabetik ve kontrol gruplarında
meydana gelen protein karbonillenmesi hesaplandı. Bu metoda göre 0.2mL homojenat 0.8mL 10mM DNPH (2M HCl içinde) ile karıştırılarak oda sıcaklığında bir saat bekletildi. Ardından 0.5mL 30% (w/v) TCA eklenerek buzda 15 dk bekletildi ve 11.000g de 5 dk sentrifüjlenerek proteinler çökeltildi. Daha sonra pelet 1.5mL ethanol/ethyl acetate (1/1) ile üç kere yıkandı ve proteinler 1.5mL guanidin hidroklorür (20mM Potasyum fosfat tamponu pH:2.5 içinde 6M hazırlanmış) içinde çözünerek 360nm de absorbansları okundu.
Katalaz enzim aktivitesi Aebi’nin yöntemi [10] kullanılarak ölçüldü. Bu yöntemde katalazın substratı olan hidrojen peroksit kullanıldı. Ultra viole ışık bölgesi olan 240nm de absorbans veren hidrojen peroksitin katalaz tarafından suya dönüştürülmesinin spektrofotometrik olarak ölçülmesine dayanan bu metotda ekstinksiyon katsayısı 43.6 M-1. cm-1 olarak kullanıldı. Aktivite ölçümü için S1 fraksiyonları ilk önce %1 lik Triton X-100 ile 10 kat seyreltildi ve ardından ekstra 200 kat dilüsyon potasyum fosfat (50mM, pH:7.0) tamponu ile yapıldı. 2mL enzim solüsyonuna 1mL H2O2 (30mM) koyularak başlatılan enzimatik reaksiyon 240nm de 1dk boyunca ölçüldü. Katalaz aktivitesi bir dakikada bir miligram protein içeren S1 fraksiyonun nötürleştirdiği hidrojen peroksit miktarı olarak belirlendi.
Süperoksit dismutaz aktivitesi Marklund ve Marklund’un [11] kullandıkları yöntem ile ölçüldü. Bu metoda göre SOD’un sübstratı olan süperoksit radikali alkalin pH da ışık ve atmosferik oksijen ile pyrogallol otooksidasyonu sonucu oluşmakta ve oluşan bu radikal, pyrogallolü sarı renkli kromofora çevirmektedir. Oluşan kromoforun 440nm de ölçülmesi ile süperoksit dismutaz aktivitesi ölçülebilmektedir. Bunun için 2.8mL Tris-EDTA tamponu (50mM Tris, 10mM Tris-EDTA, pH:8.2) içine değişik miktarlarda S1 homojenatı ve 0.1mL pyogallol (15mM) eklenerek pyrogallolün otooksidasyonu 440nm de 1dk boyunca ölçüldü. Ortamdaki SOD miktarına bağlı olarak pyrogallol otooksidasyonu engellendi ve bir ünite SOD aktivitesi pyrogallol otoksidasyonunu %50 engelleyen protein miktarı olarak belirlendi.
GPx enzim aktivitesi, NADPH oksidasyonunun spektrofotometrik olarak 340nm’de takip edilemesi ile ölçüldü [12]. 3mL’lik quratz küvet içerisine 2.525mL Tris tamponu (0.1M, pH 8.0), 75µL GSH (80 mM), 100µL glutatyon redüktaz (0.24 U), 100µL S1 fraksiyonu ve 100µL NADPH (2 mM) eklenerek oda sıcaklığında 3 dakika bekletildi. Ardından 100µL hidrojen peroksit (1.5 mM) eklenerek reaksiyon başlatıldı ve 340nm’de NADPH (ε340=6220 M-1.cm-1) oksidasyon hızı 3 dakika boyunca belirlendi. GPx aktivitesi bir dakikada bir miligram protein içeren S1 fraksiyonun oksitlediği NADPH miktarı olarak belirlendi.
Toplam GST aktivitesi ise fosfat tamponu, indirge glutatyon ve 1-chloro-2,4-dinitrobenzene (CDNB) içeren reaksiyon ortamına homojenat eklenmesi ile başlayan
absorbans değişiminin 340 nm de 2 dakika boyunca ölçülmesi ile belirlendi [13]. Bunun için 3mL’lik quartz küvetin içerisine 2500 µL potasyum fosfat tamponu (100 mM, pH 7.5), 200µL GSH (20 mM), ve 150µL S1 eklendi ve 150 µL 25 mM CDNB ile başlatılan enzimatik reaksiyon 340nm’de spektrofotometrik olarak 2 dakika boyunce ölçüldü (ε340=0.0096 µM-1.cm-1). Toplam GST aktivitesi bir dakikada bir miligram protein içeren S1 fraksiyonun oluşturduğu tiyoeter miktarı olarak belirlendi.
BULGULAR
Deney Hayvanlarının Açlık Kan Şekerleri ve Ağırlıkları
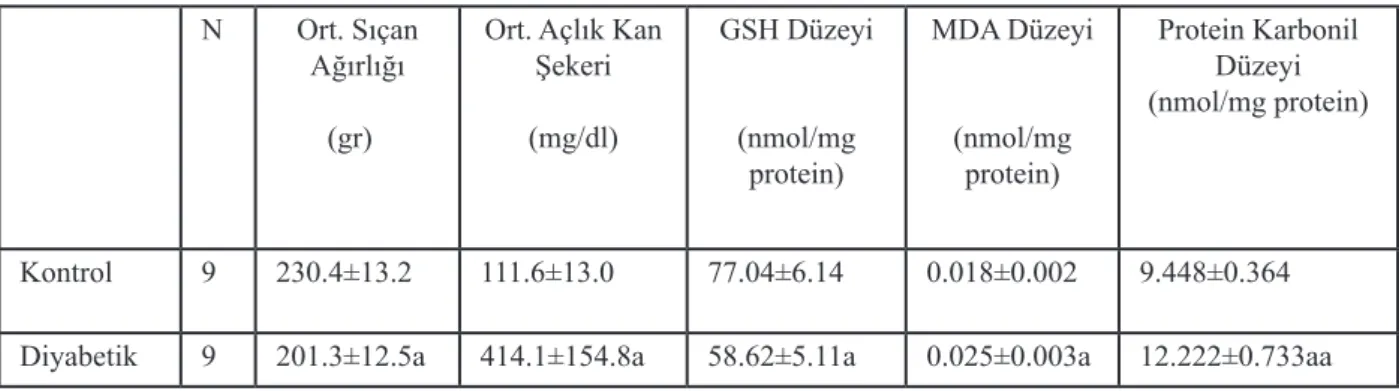
Tek doz STZ uygulaması diyabetin hayvansal modelinin oluşturulmasında yeterli olmuş ve diyabetli hayvanlarda anlamlı bir kilo kaybı meydana gelmiştir (Tablo 1). Kan şeker seviyesinin yüksekliğine rağmen, insülin hormonu yokluğu nedeniyle diyabetin vücuttaki glukoz kullanımını düşürdüğü ve dokularda glukoz alternatifi besin kaynaklarının (yağ ve protein) yakılmasını hızlandırdığı bilinmekte ve anlamlı kilo kaybını açıklamaktadır.
Doku Glutatyon Miktarlarının Karşılaştırılması
Kimyasal yollar ile oluşmuş toksisiteler ile savaşan en önemli moleküllerden biri olan GSH miktarının tayininin, diyabette meydana gelen kimyasal ve oksidatif stresin bir göstergesi olabileceği bir çok araştırmacı tarafından kabul edilen ortak bir görüştür. Bu nedenle çalışmamızda diyabetik ve kontrol sıçan karaciğer dokularında indirge glutatyon (GSH) miktarını kıyasladık (Tablo 1). Görüldüğü gibi hepatik GSH konsantrasyonu diyabetik hayvanlarda anlamlı miktarda azalmıştır. Yaklaşık 24% olarak hesaplanan bu düşüş istatistiksel olarak anlamlı bulunmuştur (p<0.05).
Doku Lipit Peroksidasyonu Karşılaştırılması
Doymamış yağların serbest radikaller tarafından başlatılmış zincirleme oksidasyonu lipit peroksidasyonu olarak adlandırılır. Normal koşullarda dokularda sınırlı miktarlarda peroksit bulunur fakat ortamda bulunan oksidan stresi, doku lipit peroksit seviyesinin artmasına neden olabilmektedir. Bu nedenle lipit peroksidasyonu diyabette meydana gelen doku hasarının erken bir göstergesi olarak kabul edilir [14,15]. Tablo 1’de görüldüğü gibi, diyabetik sıçan karaciğer dokularında lipit peroksidasyonunun 39% oranında arttığı gözlemlenmiş olunup, bu artma istatistiksel olarak anlamlı bulunmuştur (p<0.05).
Doku Protein Karbonilasyonu Karşılaştırılması
Protein oksidasyonu, proteinlerin reaktif oksijen türevleri veya oksidatif stres ürünleri ile kovalent olarak modifikasyonu sonucu meydana gelir. Protein
oksidasyonunun biyokimyasal sonuçları enzim aktivitesindeki azalma, protein fonksiyonlarının kaybı, proteaz inhibitör aktivitesinin kaybı, proteolize artmış/ azalmış yatkınlık, gen transkripsiyonundaki değişimler, immünojen aktivitedeki artış olarak sıralanabilir. Protein karbonil miktarı bize oksidatif strese bağlı protein oksidatif hasarı hakkında bir çok bilgi vermektedir. Tablo 1’de gösterildiği gibi diyabetik sıçan karaciğerlerinde protein karbonillerinin anlamlı ölçüde arttığı görülmüştür.
Doku Antioksidan Enzim Aktivitelerinin
Karşılaştırılması
Vücutta oksidatif stres sonucu oluşan süperoksit radikali ve hidrojen peroksiti etkisiz hale getiren SOD, KAT, GPx ve GST enzimlerinin aktiviteleri diyabetik ve kontrol gruplarında ölçülmüş ve sonuçlar tablo 2’de özetlenmiştir. Diyabetik hayvanlarda SOD ve KAT enzim aktivitesi anlamlı derecede azalmış olup hesaplanan bu değerler istatistiksel olarak anlamlı bulunmuştur (SOD için p<0.05 ve KAT için p<0.005). GPx ve GST aktivite ölçümlerine göre ise diyabet bu enzim aktivitelerinde anlamlı bir değişikliğe neden olmamıştır.
TARTIŞMA VE SONUÇ
Bu çalışma kapsamında diyabetik hayvanlarda bulunan yüksek lipit peroksidasyonu, protein karbonilasyonu ve düşük glutatyon miktarı, serbest radikallerin diyabetteki önemli rolünü göstermektedir. Artan lipit peroksidasyonu diyabette meydana gelen oksidatif stresin ve bunun sonucu olarak oluşan lipit peroksidasyonunun göstergesidir. Artan lipit peroksidasyonunun nedeni serbest radikalleri yok eden mekanizmaların zarar görmesi veya serbest radikal miktarının artması yada bu iki olayın birlikte oluşması ile açıklanabilir. Daha önceden bu konuda yapılan çalışmalar, aynı bizim bulgularımız gibi diyabette lipit peroksidasyonunun normalden çok daha fazla olduğunu ve bunun sebebinin ise diyabette var olduğu düşünülen oksidan stresi ile açıklamışlardır [16-19]. Doku indirge glutatyon miktarının diyabette düşmesi, GSH’ın detoksifikasyon enzimleri (GST’ler) yada peroksidazlar (GPx’ler) tarafından fazla kullanımını gösteren bir mekanizma olabilir. Diyabette gözlenen bu düşüş literatürde birçok makale tarafından da belirtilmiştir. Bu sonuçlar bize GSH’nın diyabette daha çok kullanıldığına dair bilgiler vermektedir. Bu kullanımın büyük ihtimalle diyabette meydana gelen oksidatif stresi azaltmak amacıyla oluştuğunu düşünmekteyiz [20].
Diyabetik hayvanlarda gözlenen protein
karbonillenmesindeki artış, serbest oksijen radikalleri ile proteinler üzerindeki oksidasyona uğrayan amino asit grupları ile reaksiyonların artmasının bir göstergesidir. Çünkü serbest radikaller, proteinlerin üzerindeki arjinin, prolin ve lysin gibi amino asitlerin yapısını değiştirerek proteinlerin yapı ve fonksiyonlarının değişmesine neden olabilmektedirler. Diyabette bulduğumuz artan
protein oksidasyonu, literatürde benzer araştırmalarla aynı yöndedir [21,22]. Serbest radikallerin üretiminin artması ve (veya) bunları ortadan kaldıracak etki mekanizmalarının azalması proteinler ve lipitler üzerindeki oksidatif değişmelere neden olabilmektedir.
Antioksidan enzim aktiviteleri ile ilgili sonuçlar, serbest oksijen radikallerinin detoksifikasyonunda görevli iki enzimin; süperoksit dismutaz (SOD) ve katalaz (KAT)’ın enzim aktivitelerinin diyabetik sıçanlarda, kontrol hayvanlara oranla düştüğünü göstermiştir. Enzim aktivitelerindeki bu değişiklikler diyabette meydana gelen oksidatif hasar sonucu oluşan enzim inaktivasyonun göstergesidir. Günümüz literatür bilgileri diyabette var olduğu düşünülen oksidatif değişimlerin nedenlerinden birinin dokulardaki antioksidan enzim aktivitelerindeki değişiklikler olduğunu göstermektedir. Oksidatif streste, organizmanın antioksidan savunma sistemini oluşturan enzimlerin adaptif cevap ile uyarıldıklarını ve ayrıca, oksidatif stress karşısında enzim inaktivasyonunu gösteren çalışmalar mevcuttur [23,24]. Diyabetin başlangıç aşamasında (1-4 hafta) antioksidan enzimlerin aktivitelerinin diyabette azaldığı gözlemlenmiştir [16,25,26]. Fakat diyabetin ileri aşamalarında (6-8 hafta) antioksidan enzim aktivitelerinin diyabette daha fazla olduğunu belirten makaleler de mevcuttur [17,27]. Diyabette meydana gelen antioksidan enzim aktivitelerindeki değişik sonuçlar birçok nedenden dolayı olabilmektedir. Örneğin, deney hayvanlarının yaşı, cinsiyeti, beslenme koşulları, diyabetin nasıl oluşturulduğu, insülin uygulamasının olup olmadığı gibi faktörler aktivitedeki değişimleri etkiliyebilmektedir.
Sonuç olarak, diyabette oksidanların ve/veya antioksidanların dokuların yapı ve fonksiyonu üzerine etkilerini düzenleyen mekanizmaların tam olarak aydınlatılamadığı bilinmekte ve birçok bilim insanı tarafından ileri çalışmaların yapılması önerilmektedir. Serbest oksijen radikalleri olarak adlandırılan reaktif moleküllerin hücre doku ve yapısına etkilerinin; özellikle antioksidan enzimlerin transkripsiyon, translasyon ve post-translasyon kontrol mekanizmalarının araştırılmasına yönelik güncel çalışmalar devam etmektedir ve günümüze kadar yapılan bilimsel çalışmalar, oksidatif stresin zararlı etkilerini önlemek için, antioksidan enzim aktivitelerini regüle eden, son derece karmaşık kontrol mekanizmalarının varlığını göstermektedir.
REFERANSLAR
[1] Wassmann S. Wassmann K. Nickenig G. 2004. Modulatoion of oxidant and antioxidant enzyme expression and function in vascular cells. Hypertention. 44:381-386
[2] Wolff SP. Dean RT. 1987. Glucose autoxidation and protein modification. The potential role of autoxidative glycosylation’ in diabetes. Biochem J. 245: 243-250
[3] Ceriello A. 1997. Acute hyperglycaemia and oxidative stress generation (Review). Diabet Med. 14(3): 45-49
[4] Williamson JR. Chang K. Frangos M. et al. 1993. Hyperglycemic pseudohypoxia and diabetic complications. Diabetes. 42: 801-13
[5] Brownlee M. 2001. Biochemistry and molecular cell biology of diabetic complications. Nature. 414: 813-820
[6] Lowry OH. Rosebrough NJ. Farr AL. et al. 1951. Protein measurement with the Folin Phenol Reagent. J Biol Chem. 248: 265-275
[7] Jain SK. Levine SN. 1995. Elevated lipid peroxidation and Vitamin E quinine levels in heart ventricles of streptozoticin-treated diabetic rats. Free Radic Biol Med. 18: 337-341
[8] Sedlak J. Lindsay RH. 1968. Estimation of total, protein-bound, and nonprotein sulfhydryl groups in tissues with Ellman’s reagent. Anal Biochem. 25: 192-205
[9] Levine RL. Garland D. Oliver CN. et al. 1990. Determination of carbonyl content in oxidatively modified proteins. Methods Enzymol. 186: 464-78 [10] Aebi H. 1984. Catalse in vitro. Academy Press,
Methods Enzymol. New York 105: 121-126 [11] Marklund SL. Marklund G. 1947. Involvement of
the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase. Eur J Biochem. 47: 469-474
[12] Paglia ED. Valentine WN. 1967. Studies on the quantitative and qualitative characterization of erythrocytes glutathione peroxides. J Lab Clin Med. 70: 158-169
[13] Habig WH. Pabst MJ. Jakoby WB. 1974. Glutathione-S-transferases: the first enzymatic step in mercapturic acid formation. J Biol Chem. 249: 7130-7139
[14] Sarkhail P. Rahmanipour S. Fadyevatan S. et al. 2007. Antidiabetic effect of Phlomis anisodonta: Effects on hepatic cells lipid peroxidation and antioxidant enzymes in experimental diabetes. Pharmacological Research. 56(3): 261-266
[15] Gutteridge JM. 1995. Lipid peroxidation and antioxidants as biomarkers of tissue damage. Clin Chem. 41: 1819-1828
[16] Anwar MM. Meki AR. 2003. Oxidative stress in streptozotocin-induced diabetic rats: effects of
garlic oil and melatonin, Comp Biochem Physiol A Mol Integr Physiol. 135(4): 539-47
[17] Dincer Y. Telci A. Kayali R. et al. 2002. Effect of alpha-Lipoic Acid on Lipid Peroxidation and Anti-Oxidant Enzyme Activities In Diabetic Rats. Clin Exp Pharmacol Physiol. 9:281-284
[18] Baynes JW. Thorpe SR. 1999. Role of oxidative stress in diabetic complications:a new perspective on an old paradigm. Diabetes. 48: 1-9
[19] Coudray FC. Rock E. Coudray C. et al. 1999. Lipid peroxidation and antioxidant status in experimental diabetes. Clin Chim Acta. 284(1): 31-43
[20] Kamalakkannan N. Prince PSM. 2006. Rutin improves the antioxidant status in streptozotocin-induced diabetic rat tissues. Mol Cell Biochem. 293: 211-219
[21] Kayali R. Cakatay U. Telci A. et al. 2004. Decrease in mitochondrial oxidative protein damage parameters in the streptozotocin-diabetic rat. Diabetes Metab Res Rev. 20(4): 315-321
[22] Telci A. Cakatay U. Salman S. et al. 2000. Oxidative protein damage in early stage Type 1 diabetic patients. Diabetes Res Clin Pract. 50(3): 213-223
[23] Seven A. Guzel S. Seymen O. et al. 2004. Effects of Vitamin E supplementation on oxidative stress in STZ induced diabetic rats: Investigation of Liver and Plasma. Yonsei Med Journal. 45(4): 703-710 [24] Kakkar R. Kalra J. Mantha SV. et al. 1995. Lipid
peroxidation and activity of antioxidant enzymes in diabetic rats. Mol Cell Biochem. 151: 113-119 [25] Maritim A. Dene BA. Sanders RA. et al. 2003.
Effects of Pycnogenol Treatment on oxidative stress in streptozotocin induced diabetic rats. J Biochem Mol Toxicology. 17(3): 193-199
[26] Genet S. Kale RK. Baquer NZ. 2002. Alterations in antioxidant enzymes and oxidative damage in experimental diabetic rat tissues: Effect of vanadate and fenugreek (Trigonella foenum graecum). Mol Cell Biochem. 236: 7-12
[27] Yildirim O. Buyukbingol Z. 2002. Effects of supplementation with a combination of cobalt and ascorbic acid on antioxidant enzymes and lipid peroxidation levels in streptozocin diabetic rat liver. Biological Trace Element Research. 90: 143-154
Tablo 1: Diyabetik ve kontrol sıçan karaciğer dokularında ölçülen ortalama hayvan ağırlıkları, açlık kan şekeri
düzeyleri ve doku oksidatif hasar parametreleri (GSH, MDA ve Protein Karbonil grubu)
N Ort. Sıçan
Ağırlığı (gr)
Ort. Açlık Kan Şekeri (mg/dl) GSH Düzeyi (nmol/mg protein) MDA Düzeyi (nmol/mg protein) Protein Karbonil Düzeyi (nmol/mg protein) Kontrol 9 230.4±13.2 111.6±13.0 77.04±6.14 0.018±0.002 9.448±0.364
Diyabetik 9 201.3±12.5a 414.1±154.8a 58.62±5.11a 0.025±0.003a 12.222±0.733aa
a-%95 güvenilirlilik ile kontrol gruplarına göre istatistiksel olarak anlamlılığı, aa-%99,5 güvenilirlilik ile kontrol gruplarına göre istatistiksel olarak anlamlılığı ifade etmektedir.
Tablo 2: Diyabetik ve kontrol sıçan karaciğer dokularında ölçülen antioksidan enzim; KAT, SOD, GPx ve toplam
GST aktiviteleri N KAT Aktivitesi (U/mg protein) Toplam SOD Aktivitesi (U/mg protein) GPx Aktivitesi (U/mg protein) GST Aktivitesi (U/mg protein) Kontrol 9 236.2±12.2 1.232±0.075 0.546±0.031 367.6±22.3
Diyabetik 9 108.5±10.7aa 0.840±0.049a 0.547±0.027 379.4±32.3
a-%95 güvenilirlilik ile kontrol gruplarına göre istatistiksel olarak anlamlılığı, aa-%99,5 güvenilirlilik ile kontrol gruplarına göre istatistiksel olarak anlamlılığı ifade etmektedir.