100
Şekil 4.31. 8.26 µg/mL EZE’in pH 9.0’da logİp – logv grafiği
4.6.2. CV Yönteminde Pik Potansiyelleri Üzerine Tarama Hızının etkisi
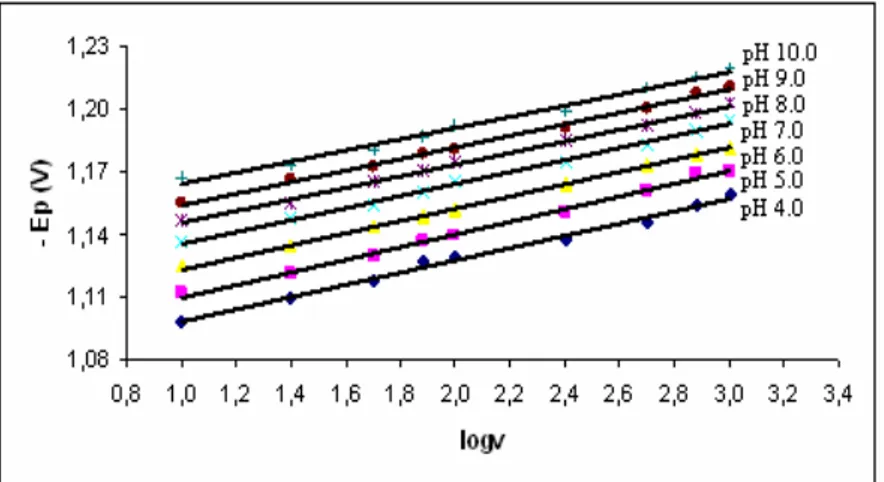
EZE’in indirgenme pikinin potansiyeline farklı pH değerlerinde tarama hızının etkisi CV yöntemi ile incelenmiştir. Tarama hızının logaritmasına karşı pik potansiyelleri grafiğe geçirilmiştir (Şekil 4.32). Elde edilen doğruların denklemleri Tablo 4.22’de verilmiştir.
Şekil 4.32. 8.26 µg mL-1 EZE’in farklı pH değerlerinde kaydedilen dönüşümlü voltamogramlarından elde edilen Ep – logv grafikleri
101
Tablo 4.22. 8.26 µg/mL EZE’in pik potansiyellerinin logv ile değişimlerinin doğru denklemleri pH Eşitlik 4.0 5.0 6.0 7.0 8.0 9.0 10.0 Ep (V) = - 0.0303 logv – 1.0950 Ep (V) = - 0.0295 logv – 1.1025 Ep (V) = - 0.0291 logv – 1.1175 Ep (V) = - 0.0286 logv – 1.1250 Ep (V) = - 0.0280 logv – 1.1398 Ep (V) = - 0.0274 logv – 1.1480 Ep (V) = - 0.0259 logv – 1.1561 4.6.3. Kronoamperometri Bulguları
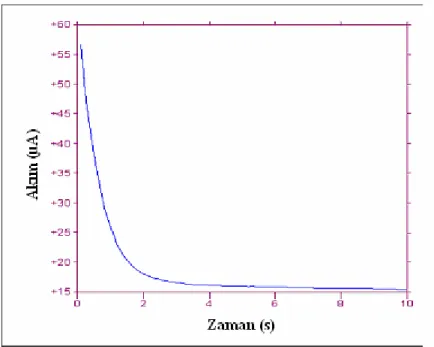
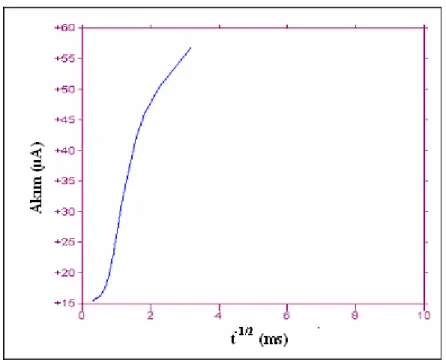
EZE çözeltisinin [(-1070) – (-1300)] mV’luk potansiyel aralığında CA çalışmaları gerçekleştirilmiştir. Akımın zamanla değişim grafiği Şekil 4.33’da, akımın zamanın kareköküyle değişim grafiği Şekil 4.34’de verilmiştir.
Şekil 4.33. 63.00 µg/mL EZE’in kronoamperometrik voltamogramı (İ – t) Başlangıç potansiyeli E1 = - 1070 mV,
102
Şekil 4.34. 63.00 µg/mL EZE’in kronoamperometrik voltamogramı (İ – t-1/2) Başlangıç potansiyeli E1 = - 1070 mV,
İndirgenmenin olduğu potansiyel E2 = - 1300 mV
4.6.4. Kronokulometri Bulguları
EZE çözeltisinin [(-1070) – (-1300)] mV’luk potansiyel aralığında CC çalışmaları gerçekleştirilmiştir. Elektrot tepkimesi sonucu oluşan yükün zamanla değişim grafiği Şekil 4.35’de, yükün zamanın kareköküyle değişim grafiği Şekil 4.36’da verilmiştir.
103
Şekil 4.35. 63.00 µg/mL EZE’in kronokulometrik voltamogramı (Q – t) Başlangıç potansiyeli E1 = - 1070 mV,
İndirgenmenin olduğu potansiyel E2 = - 1300 mV
Şekil 4.36. 63.00 µg/mL EZE’in kronokulometrik voltamogramı (Q – t1/2 ) Başlangıç potansiyeli E1 = - 1070 mV
122
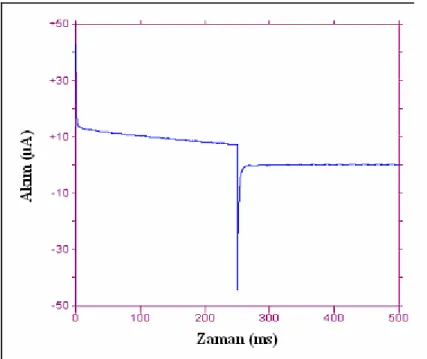
Şekil 5.6’da EZE için çift potansiyel tekniği uygulanarak elde edilen akım zaman grafiği görülmektedir. 10 ms süresinde grafikten okunan İb ve İf değerlerinin oranı (İb/İf) hesaplanmıştır. Bu değer 0.089 bulunmuştur. (İb/İf) değerinin 1’den küçük olması geri potansiyelde gözlenen akımın küçük olduğunu, dolayısıyla indirgenme ürününün kimyasal tepkimeye girdiğini göstermektedir. Bu durum indirgenmenin EC mekanizmasına göre olduğunu doğrulamaktadır.
Şekil 5.6. 118.00 µg / mL EZE’in çift potansiyelli kronoamperometrik voltamogramı
Başlangıç potansiyeli E1 = - 1070 mV
İndirgenmenin olduğu potansiyel E2 = - 1300 mV
Seçilen 10 ms süresinde (İb / İf) oranı için bulunan değer Şekil 5.7’de verilen çalışma grafiğinde (49) yerine konarak elektron aktarımını takip eden kimyasal tepkimenin hız sabiti 1.derece olduğu varsayılarak 3.14 x 10-3 s-1 olarak hesaplanmıştır. Takip eden kimyasal tepkimenin hız sabitinin çok küçük olmaması da elektron aktarımından sonra kimyasal tepkimenin oluştuğunun göstergesidir.
CV yönteminde düşük tarama hızlarında anodik pikin gözlenmemesi de (Bkz. Şekil 4.29) takip eden kimyasal tepkimenin varlığını gösterir.