T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
ORTOPEDİ VE TRAVMATOLOJİ ANABİLİM DALI
EWİNG SARKOM HASTALARINDA TEDAVİ SONUÇLARIMIZ
UZMANLIK TEZİ Dr.İsmail Eralp KAÇMAZ
TEZ DANIŞMANI Yard. Doç.Dr. Burçin KEÇECİ
İZMİR 2015
T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
ORTOPEDİ VE TRAVMATOLOJİ ANABİLİM DALI
EWİNG SARKOM HASTALARINDA TEDAVİ SONUÇLARIMIZ
UZMANLIK TEZİ Dr.İsmail Eralp KAÇMAZ
TEZ DANIŞMANI Yard. Doç.Dr. Burçin KEÇECİ
İZMİR 2015
ii
ÖZET
EWİNG SARKOM HASTALARINDA TEDAVİ SONUÇLARIMIZ
Amaç: Ewing sarkom malign kemik tümörleri içerisinde az görülmesine rağmen genç yaşta ortaya çıkması ve prognozunun kötü olması nedeniyle önemli bir hastalıktır. Hastaların genellikle ikinci dekatta tanı alması bu yaşlardaki fiziksel performans ve sportif aktiviteleri nedeniyle yumuşak doku travması olarak değerlendirilmekte ve tanıda gecikmeler olmaktadır. Özellikle semptomların hastalar, aileleri veya doktorları tarafından önemsenmemesi tanıda gecikmeye neden olmaktadır. Geciken tanıyla beraber hastalığın ilerlemesi ve prognozun kötüleşmesi kaçınılmaz olmaktadır. Tezimizde tanısal ve prognostik faktörlerin sağ kalımla ilişkisinin irdelenmesi amaçlanmıştır.
Hastalar ve Yöntem: Ege Üniversitesi Ortopedi ve Travmatoloji Anabilim Dalı’na 1994-2014 yılları arasında tanı koyulup tedavi ve takip edilmiş 120 Ewing sarkom hastası retrospektif olarak değerlendirildi. Hastaların yaş, cinsiyet, başvuru şikayeti, kitle lokalizasyonu, kitle boyutu, tanı anında metastaz varlığı, neoadjuvant tedavi özellikleri, operasyon özellikleri, adjuvant tedavi özellikleri, postoperatif süreçte metastaz ve lokal nüks durumları sayısal ve oransal olarak incelendi. Ayrıca bu kriterlerin sağ kalımla ilişkisi de incelendi.
Bulgular: Hastaların ortalama yaşının 18,0±8,6, cinsiyet oranının E/K= 1.4, en sık başvuru şikayetinin ağrı (%76) ve en sık kitle lokalizasyonunun ise pelvis (%29.2) olduğu saptandı. Olguların çoğunun (%69.7) tümör boyutunun 8 cm’den fazla olduğu gözlendi. Kliniğe başvuran olguların % 46’sında tanı anında metastaz saptandı. Tanı anında metastaz varlığı ve lokal nüks gelişmesinin sağ kalım üzerine olumsuz etkisi olduğu gösterildi.
Sonuç: Ewing sarkom hastalarında ağrı ve şişlik şikayetlerinin birlikteliği, aksiyel yerleşim, tümör boyutunun büyük olmasının, tanı anında metastaz varlığının, opere edilemeyen olguların sağ kalımlarının düşük olduğu gösterilmiştir.
iii
ABSTRACT
TREATMENT RESULTS IN EWING’S SARCOMA PATIENTS
Purpose: Ewing’s sarcoma is an important disease because of bad prognose and early occurance in terms of age; despite its rarely seen among malign bone tumors. As patients are generally diagnosed in second decade, most of the symptoms are considered to be soft tissue trauma, under the vision of their physical performance and sports which is resulting late diagnosis. Especially, neglectance of the symptoms by patients, relatives and medical professionals is causing the delay on diagnosis. With the delayed diagnosis, prognos is getting worse and disease is advancing. Purpose of the thesis is, to address the relativity between diagnostic/prognostic factors and survival rates.
Patients and Method: 120 Ewing’s Sarcoma patients are evaluated between 1994 – 2014 whom diagnosed, cured and followed retrospectively in Ege University, Faculty of Medicine, Department of Orthopedics and Traumatology. Patients are evaluated in terms of; age, gender, complaints, mass localization, mass size, metastases presence during diagnosis., neoadjuvant treatment specifications, operation specifications, metastases and local relapse in the period both numerically and proportionally. Furthermore, all these criterias are evaluated in terms of the bond with survival.
Results: It’s determined that, average age of the patients are 18,0±8,6, gender ratios M/F= 1.4, most often complaints is pain (%76) and most often mass localization is pelvis (%29.2). In most of the cases (%69.7) tumor size was bigger than 8 cm. In 46% of the cases, metastases is observed during diagnosis. It’s stated that, there is a negative effect on survival rates if metastases and local relapse are observed during diagnosis.
Conclusion: It’s proved that Ewing’s Sarcoma patients’ survival rates are low when; pain and swelling complaints are together, axial localization, larger tumor sizes, metastases observation during diagnosis, non-operable cases.
iv
ÖNSÖZ
Ewing sarkom etkilediği yaş grubu ve yaşam beklentisi nedeniyle dikkatli tanı koyulması ve özenle tedavi edilmesi gereken bir hastalıktır. Tezimizde Ewing sarkom hastalarının genel özelliklerini ve sağ kalımlarını etkileyen parametreleri, yurt içi ve yurt dışı literatür bilgileri ile kıyaslayarak inceledik. Amacımız prognozu kötü olan hasta özelliklerini belirlemek ve bu hastaların tedavilerini daha uygun hale getirmektir.
Tezimin hazırlanması aşamasında her zaman bana yol gösteren, sonsuz hoşgörüsü ile beni destekleyen sayın hocam Yard. Doç. Dr. Burçin KEÇECİ’ye ve ortopedik onkoloji konusunda deneyimlerinden yararlandığım sayın hocam Prof. Dr. Dündar SABAH’a sonsuz teşekkürlerimi sunarım.
Tez sürecinde yardımlarını esirgemeyen Radyasyon Onkolojisi Kliniği öğretim üyesi sayın Prof. Dr. Serra KAMER’e teşekkürlerimi sunarım.
Asistanlık eğitimim boyunca öğrenim görmekten büyük mutluluk ve gurur duyduğum kliniğimizin tüm hocalarına, en sıkıntılı ve en keyifli günlerimi geçirdiğim, birlikte çalışmaktan büyük keyif aldığım asistan arkadaşlarıma, sevgi ve desteklerini benden esirgemeyen aileme ve tezimin her aşamasında yanımda olan eşim Deniz KAÇMAZ’a teşekkürü bir borç bilirim.
Ayrıca tezimin istatistiksel analizlerinde desteğini aldığım tıbbi istatistikçi Hüseyin CANDAN’a da teşekkür ederim
Annemin hastalığı ve vefatı sürecinde desteklerini esirgemeyen ve yanımda olan Ege Üniversitesi Ortopedi ve Travmatoloji Kliniği’nin tüm çalışanlarına teşekkür ederim.
Dr. İsmail Eralp KAÇMAZ İZMİR 2015
v
İÇİNDEKİLER
I. GİRİŞ ... 1
II. GENEL BİLGİLER ... 2
a. TARİHÇE ... 2 b. KARSİNOGENEZ ... 3 c. ETİYOLOJİ... 5 d. EPİDEMİYOLOJİ ... 6 e. SINIFLAMA ... 7 f. TANI ... 9 i. KLİNİK ... 9 ii. LABORATUVAR ... 9 iii. RADYOLOJİ ... 10 g. BİYOPSİ ... 15 h. PATOLOJİ ... 18 i. AYIRICI TANI ... 20 j. EVRELEME ... 20 k. TEDAVİ ... 23 i. KEMOTERAPİ ... 24 ii. RADYOTERAPİ ... 29 iii. CERRAHİ ... 32 l. PROGNOZ ... 36
m. REKÜRRENS, METASTAZ VE SEKONDER MALİGNİTELER . 38 III. HASTALAR VE YÖNTEM ... 41
IV. İSTATİSTİKSEL YÖNTEM ... 52
V. BULGULAR ... 53
VI. TARTIŞMA ... 3
VII. SONUÇ ... 73
vi
TABLOLAR
Tablo 1: Malign Kemik Tümörleri’nin Cinsiyete Göre Dağılımı ... 6
Tablo 2: Ewing-Pnet Cinsiyet Dağılımı ... 7
Tablo 3: Kemik Tümörleri Sınıflaması ... 8
Tablo 4: Yurt Dışı Çalışmalardaki Primer Tümör Lokalizasyonları ... 13
Tablo 5 : Yurt İçi Çalışmalardaki Primer Tümör Lokalizasyonları ... 14
Tablo 6: Translokasyonlar, Füzyon Genleri Ve Sıklık ... 20
Tablo 7 : Tnm Evrelemesi ... 21
Tablo 8 : Histopatolojik Derecelendirme ... 21
Tablo 9 : “Musculoskeletal Tumour Society” Malign Kemik Lezyonları Sınıflaması ... 21
Tablo 10 : Enneking Evrelemesi ... 22
Tablo 11 : Ajcc/Uıcc Evrelemesi ... 22
Tablo 12 : Standart Tedavi Tablosu ... 23
Tablo 13 : Eıcess-92 Ve Euro-Ewing 99 Tedavi Protokolleri ... 28
Tablo 14 : Tanı Anında Metastaz Saptanma Oranları ... 36
Tablo 15 : Toplam Sağ Kalım Örnekleri... 38
Tablo 16 : Genel Bulgular ... 53
Tablo 17 : Genel Bulgular 2 ... 54
Tablo 18 : Primer Lezyon Lokalizasyonu ... 56
Tablo 19 : 10 Yaş Altı, 10 Yaş Ve Üzeri Yaş Gruplarına Göre Tümör Lokalizasyonu ... 57
Tablo 20 : Tanı Anından Metastaz Varlığına Göre Olguların Özellikleri ... 59
Tablo 21 : Pelvik Tutulumu Olan Olgularda Postoperatif Uzak Metastaz - Sağ Kalım Etkileşimi ... 60
vii
ŞEKİLLER
Şekil 1:Tarihsel Gelişim Süreci ... 3
Şekil 2 : Güncel Risk-Adaptif Ewing Sarkom Tedavi Stratejisi ... 24
Şekil 3 : Cess 81 Ve Cess 86 Protokolleri ... 26
Şekil 4 : Ege Üniversitesi Çocuk Onkoloji Kliniği Standart Tedavi Şeması ... 29
GRAFİKLER Grafik 1 : Cinsiyet Dağılımı ... 53
Grafik 2 : İlk Başvuru Şikayeti ... 55
Grafik 3 : Aksiyel-Ekstremite Yerleşimi ... 55
Grafik 4 : Operasyon Tipi ... 58
Grafik 5 : Pelvik Tutulumu Olan Olgularda Postoperatif Uzak Metastaz - Genel Sağ Kalım Etkileşimi ... 60
Grafik 6 : Pelvik Tutulumu Olan Olgularda Postoperatif Uzak Metastaz - Hastalıksız Sağ Kalım Etkileşimi ... 61
Grafik 7 : Tümör Boyutu – Sağ Kalım Süresi... 61
Grafik 8 : Akciğer Metastaz Zamanı – Sağ Kalım Süresi ... 62
Grafik 9 : Metastazın Ortaya Çıktığı Ay – Sağ Kalım Süresi ... 62
FOTOĞRAFLAR Fotoğraf 1: Kas İskelet Sistemi Tümörleri Konseyi ... 17
viii
RESİMLER
Resim 1: James Stephen Ewing ... 2
Resim 2: Flı1 Geni ... 4
Resim 3: Ews-Flı1 Füzyon Geni ... 5
Resim 4:Ewing Sarkomda Görülen Füzyon Genleri Ve Translokasyonlar ... 5
Resim 5: Ewing Sarkom X-Ray ... 10
Resim 6: Ewing Sarkom Mrg ... 10
Resim 7: Soğan Zarı Şeklinde Periost Reaksiyonu ... 11
Resim 8: Klavikula Yerleşimli Ewing Sarkom X-Ray ... 11
Resim 9: Klavikula Yerleşimli Ewing Sarkom Mrg ... 12
Resim 10 :Ewing Sarkom Primer Tümör Lokalizasyon Şeması ... 13
Resim 11 : Ewing Sarkom Mr Görüntüsü ... 15
Resim 12 : Kalın İğne (Core Biyopsi)... 16
Resim 13 : Kalın İğne Biyopsi Uygulaması ... 16
Resim 14: Ewing Sarkom Işık Mikroskobu Görüntüsü ... 18
Resim 15 : Ewing Sarkom Elektron Mikroskopi Görüntüsü ... 19
Resim 16 : Vaskülarize Fibula Grefti İle Rekonstrüksiyon ... 35
Resim 17 : Primer Lezyon Lokalizasyonu ... 57
FORMLAR: Form 1 : Msts Formları ... 43
ix
KISALTMALAR
ES: Ewing Sarkoma
BT: Bilgisayarlı Tomografi
MRG: Manyetik Rezonans Görüntüleme X-Ray: Röntgen
PET: Pozitron Emisyon Tomografi RT: Radyoterapi
KT: Kemoterapi Gy: Gray
MET: Metastaz
PNET: Primitif Nöroektodermal Tümör ESTA: Ewing Sarkom Tümör Ailesi Ark.: Arkadaşları
LDH: Laktat Dehidrogenaz
99mTc-MDP: 99mTc-Methyl Difosfonat PMMA: Polimetil Metakrilat
PAS: Periyodik Asit Schiff
RT-PCR: Ters Transkripsiyon-Polimeraz Zincir Reaksiyonu JOA: Japanese Orthopaedic Association
AJCC: American Joint Committee on Cancer UICC: International Union Against Cancer CESS86: Cooperative Ewing’s Sarcoma Study 86
EICESS92: European Intergroup Cooperative Ewing’s Sarcoma Study 92 EE99: Euro-Ewing Intergroup 99
POG-CCG: Pediatric Oncology Group-Children's Cancer Group GPOH: Gesellschaft für Pädiatrische Onkologie und Hämatologie CCLG: Children’s Cancer and Leukaemia Group
SFCE: Société Française de Lutte Contre les Cancers et les Leucémies de l’Enfant et de l’Adolescent
EORTC: European Organisation for Research and Treatment of Cancer G-CSF: Granülosit-koloni Stimüle Edici Faktör
COG: Children’s Oncology Group
x UCLA: University of California, Los Angeles
MSTS: Musculoskeletal Tumour Society Score VIDE: Vinkristin, İfosfamid, Doksorubisin, Etoposid VAIA: Vinkristin, Daktinomisin, İfosfamid, Doksorubisin VACA: Vinkristin, Daktinomisin, Siklofosfamid, Doksorubisin EVAIA: Etoposid, Vinkristin, Daktinomisin, İfosfamid, Doksorubisin
1
GİRİŞ
Malign kemik tümörleri tüm malign tümörlerin %1’ini oluşturur.[1] Ewing sarkomunun (ES) insidansı 0.5/100.000’dir.[1] Bu kadar az görülmesine rağmen her ortopedist tarafından tanısı koyulması ya da en azından şüphelenilmesi gereken bir hastalıktır. Bu şekilde tanı gecikmeleri ve yanlış tedavi uygulamaları önlenebilmektedir. Toplumda az görülmeleri önemsenmemesine neden olmamalıdır. Ancak bu tümörler hem fatal seyrettikleri için hem de adolesan veya genç erişkinleri tuttukları için daha dikkatli ve özenli davranılması gereken tümörlerdir.
İlk başvuru sırasında oyun ve spora uygun aktivite düzeyinde olan genç erişkin hastada ekleme yakın kemik bölgelerinde ağrı olması hem hekimi hem de hastayı malignite düşünmekten uzaklaştırmaktadır. Ancak bu durum tanı gecikmesine neden olabileceği için hekimlerin daha dikkatli olması ve akıllarından malignite ihtimalini çıkarmamaları gerekmektedir.
2
GENEL BİLGİLER
Resim 1: James Stephen EWİNG http://www.uscap.org/about/history/past-presidents/james-ewing
Ewing sarkomu 1921 yılında James Stephen EWİNG (1866-1943) isimli Amerikalı patolog tarafından “kemiğin diffüz endotelyoması” şeklinde tanımlanmıştır. Küçük yuvarlak hücrelerle karakterize primer malign kemik tümörüdür. [2]
30 yaş altında osteosarkomdan sonra ikinci, 10 yaş altında ise ilk sırada yer alır. Primer malign kemik tümörlerinin yaklaşık %10’unu oluşturur. [3]
Ewing sarkomu tümör ailesi (ESTA) nöroektodermal kökenli küçük yuvarlak hücreli tümörlerdir. Ewing sarkoma, primitif nöroektodermal tümör (PNET), Askin tümörü (torakopulmoner) bu ailenin içeriğini oluşturur. [4]
TARİHÇE
Tarihsel süreçte birçok kez tanımlanmaya çalışılan Ewing sarkom için çeşitli isimlendirmeler kullanılmıştır. 1866 yılında Lucke tarafından küçük yuvarlak hücreler şeklinde patolojisi gösterilmiş olup 1918 yılında Stou ve arkadaşları tarafından ulnar sinirde rozet formasyonu gösterilmiş ve “nöroepitelyoma” olarak adlandırılmıştır.
1921 yılında James Stephen Ewing 14 yaşında bir kızın radiusunda yuvarlak hücreli sarkom olarak tümörü tespit etmiş ve “kemiğin diffüz endotelyoması” olarak adlandırmıştır.[5]
Uzun yıllar boyunca araştırmacılar Ewing sarkom ile PNET’in aynı tümör olduğunu düşünmüşlerdir. Ancak benzer yönleri olmasına rağmen 1980’li yılların
3 başlarında mikroskobik olarak farklarının ortaya koyulmasından sonra bu iki tümör “Ewing Sarkom Tümör Ailesi” (ESTA) olarak adlandırıldı. Angervall ve Enzinger ise “kemik dışı Ewing Sarkom”u ilk gösteren araştırmacılardır. [6]
Şekil 1:Tarihsel Gelişim Süreci
KARSİNOGENEZ
Ewing sarkom hücreleri asetil kolin transferaz salgılarlar. Bu özelliklerinden yola çıkarak araştırmacılar Ewing sarkom hücrelerinin postganglionik parasempatik otonom ganglion liflerinden kaynaklandığını tespit etmişlerdir. Daha iyi diferansiye olmuş haline ise primitif nöroektodermal tümör (PNET) ismi verilmektedir. [7]
ESTA (Ewing sarkom tümör ailesi) hücreleri aynı zamanda IGF-1 ve gastrin üreten hücrelerdir. Tümör hücrelerinin üzerinde de bu moleküllerinin reseptörlerinin bulunması bu hücrelerin bölünme açısından otonomi kazanmasını sağlamaktadır. [8], [9]
4 Genetik açıdan incelendiğinde ES olgularının %85-95’inde t(11;22)(q24;q12) translokasyonu görülür ve 11. kromozom üzerindeki murin FLI 1 geninin insan homoloğunun DNA bağlayıcı bölgesi ile 22. kromozom üzerindeki EWS geninin 5’ ucunun üst üste gelmesi ile sonuçlanır. [10]
Geriye kalan %5-15’lik kısmı ise 4 farklı translokasyon oluşturmaktadır. ERG t(21;22)(q22;q12) bu translokasyonlardan en sık rastlananıdır. EWS-ETV1 t(7;22)(p22;q12), EWS-EIAF t(17;22)(q12;q12) ve EWS-FEV t(2;22)(q33;q12) diğer translokasyonlardır. Del(22), del(16q) ve del(1p36), Trizomi 8, Trizomi 12 gibi kromozomal anomalilere de rastlanmaktadır. Bu anomalilerin saptanması kötü prognoz belirteçleridir. [11], [12]
Translokasyonlar sırasında bazı füzyonlar oluşmaktadır. t(11;22)(q24;q12) sırasında en sık görülen füzyon EWS’ye ait ekson 7 ile FLI1’e ait ekson 6 (tip 1; %55-60) ve EWS’ye ait ekson 7 ile FLI1’e ait ekson 5 arasında (tip 2; olguların %25’inde) meydana gelir. Bu meydana gelen transkriptin prognostik öneme sahip olduğu gösterilmiştir. [10], [13, 14]
Resim 2: FLI1 Geni
X-Y seks kromozomlarının çiftleşme bölgesinde MIC2 adında bir gen bulunur. Bu gen hem pNET hem de ES hücrelerinde eksprese edilir. Bu özellik ES ve pNET hücrelerini diğer tümörlerden ayırmasının yanında bu iki tümörün de aynı aileden geldiğini gösterir.[15]
5
ETİYOLOJİ
Etiyoloji tam olarak bilinmemektedir. Belirli gen translokasyonları sıklıkla eşlik etmektedir. Hastalarda %90 oranıyla en sık t(11;22)(q24;q12) translokasyonu varlığı gözlenmektedir. [16]
Kromozom 11q24 bölgesindeki FLI1 geni ile kromozom 22q12 bölgesindeki EWS geni dengeli translokasyonu sonucu oluşan EWS-FLI1 kimerik geni hastalığa neden olmaktadır. [17] Kalan %10unda ise t(21;22)(q22;12) ve t(7;22) (p22;q12) translokasyonu görülür.
Resim 3: EWS-FLI1 Füzyon Geni
Resim 4:Ewing Sarkomda Görülen Füzyon Genleri Ve Translokasyonlar
(Ewing Sarcoma Treatment (PDQ®) Health Professional Version PDQ Pediatric Treatment Editorial Board. Published online: November 9, 2015.)
6
EPİDEMİYOLOJİ
Çocukluk ve adolesan çağı primer malign kemik tümörleri arasında en sık ikinci tümördür ve primer kemik tümörlerinin %10’unu oluşturmaktadır. Sıklıkla 5-25 yaş arasında görülür. Hastaların yaklaşık %80’i 20 yaşından küçüktür. 5 yaşından küçük hastalarda kemik tümörü görüldüğünde tanı sıklıkla nöroblastomdur. 30 yaşın üzerinde saptandığında ise sıklıkla metastatik karsinom akla gelmelidir. Literatürde bildirilen en küçük hasta 5 aylık iken en yaşlı hasta ise 83 yaşındadır. Erkeklerde kadınlardan daha sık görülür (E/K:3/2). Beyaz ırk dışında çok nadir görülür.
Dünya sağlık örgütünün verilerine göre Ewing sarkom primer malign kemik tümörlerinin %6-8’ini oluşturmaktadır. Myelom, osteosarkom ve kondrosarkomdan sonra dördüncü sıklıkta görülmektedir.
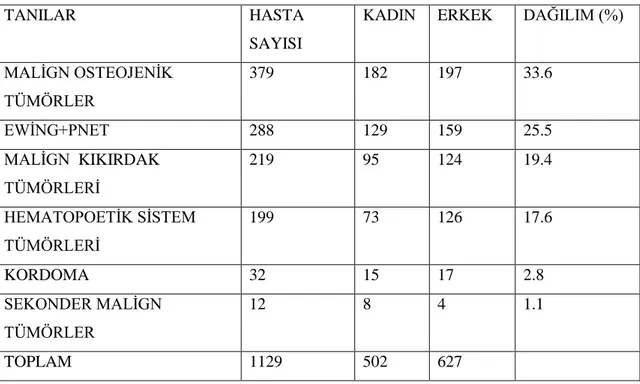
Yücetürk ve ark’nın 2011 yılında yaptıkları çalışmada 1989-2009 yılları arasında Ege Üniversitesi İskelet Sistemi Tümörleri Konseyi’nde tartışılan yaklaşık 6,000 hasta değerlendirilmiştir. Tablo 1 ve Tablo 2’de bu hastaların tüm kemik tümörleri içinde ve Ewing sarkom ailesi tümörlerin kendi içinde cinsiyet dağılımı gösterilmektedir. [18]
Tablo 1: Malign Kemik Tümörleri’nin Cinsiyete Göre Dağılımı
(Yuceturk G, Sabah D, Kececi B, Kara AD, Yalcinkaya S. Prevalence of bone and soft tissue tumors. Acta orthopaedica et traumatologica turcica 2011;45:135-43)
TANILAR HASTA
SAYISI
KADIN ERKEK DAĞILIM (%)
MALİGN OSTEOJENİK TÜMÖRLER 379 182 197 33.6 EWİNG+PNET 288 129 159 25.5 MALİGN KIKIRDAK TÜMÖRLERİ 219 95 124 19.4 HEMATOPOETİK SİSTEM TÜMÖRLERİ 199 73 126 17.6 KORDOMA 32 15 17 2.8 SEKONDER MALİGN TÜMÖRLER 12 8 4 1.1 TOPLAM 1129 502 627
7 Tablo 2: Ewing-PNET Cinsiyet Dağılımı
(Yuceturk G, Sabah D, Kececi B, Kara AD, Yalcinkaya S. Prevalence of bone and soft tissue tumors. Acta orthopaedica et traumatologica turcica 2011;45:135-43)
KEMİK YUMUŞAK DOKU
EWİNG PNET EWİNG PNET
204 20 23 41
KADIN ERKEK KADIN ERKEK KADIN ERKEK KADIN ERKEK
92 112 2 18 13 10 22 19
224 64
288
Ailesel geçiş acısından anlamlı fark yoktur. [19] Çocuğunda ES olan annelerde beklenenden daha fazla malignite görülmemektedir.
SINIFLAMA
Kemik tümörleri malign ve benign olmak üzere iki alt gruba ayrılır. Malign kemik tümörleri ise kemik oluşturan, kıkırdak oluşturan, kemik iliği kaynaklı, vasküler kaynaklı, bağ dokusu kaynaklı ve metastatik tümörler olmak üzere alt gruplara ayrılır. Ewing sarkom malign kemik tümörlerinin kemik iliği kaynaklı olanlar grubundadır. Bu grubun diğer tümörleri; primitif nöroektodermal tümör, kemiğin malign lenfoması ve myelomadır.
8 Tablo 3: Kemik Tümörleri Sınıflaması
Kaynak doku Benign Benign - agressif Malign
Kemik • Osteom • Osteoblastom • Osteoid osteom • Agressif osteoblastom • Osteosarkom • Santral (medüller) • Yüzeyel (periferik) • Parosteal • Periosteal
• Yüksek gradeli yüzeyel
Kıkırdak • Kondromlar • Enkondromlar • Osteokondromlar • Periosteal (jukstakortikal) • Soliter • Multipl herediter • Kondroblastom (epifizer kondroblastom) • Kondromiksoid fibrom • Kondrosarkom • Dedifferansiye kondrosarkom • Jukstakortikal (periosteal) kondrosarkom • Mezenkimal kondrosarkom • Berrak hücreli kondrosarkom • Habis kondroblastom (?)
Dev hücre • Dev hücreli kemik tümörü
(osteoklastom) Kemik iliği hücreleri (yuvarlak hücreli tümörler) • Ewing sarkom • Kemiğin nöroektodermal tümörü
• Kemiğin malign lenfoması • Myelom Damar kökenli tümörler • Hemanjiom • Lenfanjiom • Glomus tümörü (glomanjiom) • Hemanjioendotelyoma (epiteloid hemanjioendoteliom, histiositik hemanjiom) • Hemanjioperisitoma • Anjiosarkom • Habis hemanjioperisitom
Diğer bağ dokusu
tümörleri • Benign fibröz histiyositom • Lipom • Desmoplastik fibrom
• Liposarkom • Fibrosarkom
• Malign fibröz histiyositom • Habis mezenkimom • Leiomiyosarkom • Dediferansiye sarkom
Diğer tümörler • Nörilemmoma • Nörofibroma • Kordoma • Adamantinoma
Tümör benzeri lezyonlar
• Soliter kemik kisti • Anevrizmal kemik kisti • Jukstaartiküler kemik kisti (intraosseöz ganglion) • Metafizer fibröz defekt (nonossifiye fibrom) • Eozinofilik granülom (soliter) • Fibröz displazi ve osteofibröz displazi • Miyozitis ossifikans • Hipertirodiye bağlı 'Brown tümörü'
• Paget hastalığı
• İntraosseöz epidermoid kist • El ve ayağın dev hücreli (reparatif) granülomu
9
TANI
KLİNİK
ES hastaları çoğunlukla lokal semptomlarla başvururlar. Ele gelen kitle, şişlik, ağrı, venöz dilatasyon ve hiperemi bunlardan bazılarıdır. En sık şikayet ağrı ve lokalize şişliktir. Ağrı değişken karakterdedir ve geceleri de olabilen bir ağrıdır. Hastalar metastaza bağlı patolojik kırıklarla da başvurabilirler. Spinal metastazlar sırt-bel ağrısına ve eğer ilerlerse spinal paraliziye neden olabilirler. Mayo Clinic’de yapılan bir çalışmaya göre hastaların % 96’sı ağrı, % 61’i palpabl kitle ile başvurmuştur. Başvuruların % 16’sı patolojik kırık, %2’si ise ateş ile olmuştur. [20]
Ağrının yavaş başlangıçlı olması nedeniyle hasta hekime erken dönemde gelmemektedir. Bu nedenle tanıda gecikme olabilmektedir. Bu gecikmeye rağmen semptomların başlamasından tanıya kadar geçen süre, zaman içinde gelişen teknolojiler ve yöntemler yardımı ile 1984 yılında ortalama 9.6 ay iken 2003 yılında bu süre 4.7 aya inmiştir. [21]
Başlangıç semptomu ele gelen kitle olan hastalarda, kitle doktora hastayı erken dönemde yönlendirmekte ve daha erken tanı koyulabilmektedir.
Yüzeyel yerleşimli tümörlerde veya zayıf hastalarda erken dönemde tanı konulabilirken derin yerleşimli tümörlerde hastalar geç dönemde metastatik hastalıkla başvurabilir. Metastazlar genellikle hematojen yolla olur. En sık akciğer, kemik ve kemik iliğine yayılım görülür.[22] Kemiklerden en sık vertebra metastazı görülür.[20] Peritona ve gastrointestinal sisteme metastaz da görülebilmektedir.
LABORATUVAR
Laboratuvar bulguları Ewing sarkom hastalığına spesifik olmamakla birlikte tanı koymada tanıyı güçlendirici bulgular olarak kullanılmaktadır. Ewing sarkom hastalarında anemi ve lökositoz gözlenir. Sedimantasyon yükselir. LDH, alkali fosfataz, C-reaktif protein seviyesi yükselir.
LDH seviyesi ile prognoz arasında ters orantı vardır. LDH seviyesi yükseldikçe prognoz kötüleşir. [21]
Ağrı ile birlikte ateş, eritem, şişlik görülmesi, laboratuvar tetkiklerinde lökositoz, CRP ve sedimentasyon hızı artışı olması enfeksiyon ile karışmasına neden olur. Osteomiyelit ile karışabilir. Enfeksiyon ön tanısıyla aspirasyon yapılmış ise alınan örneklerin patolojiye de gönderilmesi tanıya katkıda bulunur.[3] Aynı şekilde
10 malignite açısından yapılan açık biyopsi materyalinin de mikrobiyolojiye gönderilmesi gereklidir.
RADYOLOJİ
Tanı ve tedavi planlanması için görüntülemenin basamak atlamadan ve eksiksiz yapılması gerekmektedir. Bu amaçla; düz grafiler, MRG görüntülemesi, akciğer BT’si ve kemik sintigrafilerinin yapılması gerekmektedir.
Resim 5: Ewing Sarkom X-Ray
11 Ewing sarkom tipik olarak uzun kemiklerin diyafizinde sınırları belirsiz destrüktif lezyon şeklinde görülür. Periost reaksiyonu (soğan zarı) ve yumuşak doku kitlesi görülebilir.
Resim 7: Soğan Zarı Şeklinde Periost Reaksiyonu
Klasik olarak uzun kemiklerin diyafizinde, metafize uzanım gösteren veya kostalar üzerinde soğan zarı şeklinde lamellar periost reaksiyonu ile birlikte görülür. Düz kemiklerde sklerotik görünüme neden olabilir. Omuz ve pelvisin yassı
kemiklerini de tutar. Nadiren omurgada, el ve ayak küçük kemiklerinde görülür. [3]
12 Resim 9: Klavikula Yerleşimli Ewing Sarkom MRG
Lokalize hastalıkta distal ekstremite tutulumlarının en iyi prognoza sahip olduğu, proksimal ekstremite tutulumunun daha kötü prognoza sahip olduğu gösterilmiştir. En kötü prognoz ise santral veya pelvik tutulumlarda gözlenmiştir. [23-25]
En sık tutulum yeri femur distal metafizi ve diafizi, sonra sırasıyla pelvis, tibia, humerus, daha nadir olarak ise el ve ayakların trabeküler kemikleridir. Kraniofasiyal kemiklerden en sık mandibula tutulur. Kemiklerin her bölgesinde görülebilmekle birlikte daha çok diafizer tutulum gösterir.
Bernstein ve arkadaşlarının 2006 yılında yaptıkları çalışmaya göre en sık yerleşim yeri yassı kemikler olup uzun kemiklerde diafiz bölgesi tutulmaktadır. Sırasıyla pelvik kemikler, alt ekstremitenin uzun kemikleri ve göğüs duvarı kemiklerinin tutulduğunu tespit etmişlerdir. [26]
13 Resim 10 :Ewing Sarkom Primer Tümör Lokalizasyon Şeması
(Bernstein M, Kovar H, Paulussen M, Randall RL, Schuck A, Teot LA, et al. Ewing's sarcoma family of tumors: current management. The oncologist 2006;11:503-19.)
Tablo 4: Yurt Dışı Çalışmalardaki Primer Tümör Lokalizasyonları[25, 27-33]
YAZAR YIL OLGU SAYISI (n) PROKSİMAL EKSTREMİTE (n,%) DİSTAL EKSTREMİTE (n,%) PELVİS (n,%) DİĞER KEMİKLER (n,%) Nesbit 1973-1978 331 94(28) 83(25) 62(19) 9(28) Grier 1989-1992 389 140(35) 86(22) 93(23) 79(20) Bacci 1983-2006 888 304(34) 262(30) 271(30) 51(6) Paulussen 1986-1991 301 75(25) 60(20) 81(27) 85(28) Paulussen 1990-1995 171 37(22) 26(15) 61(36) 47(27) Craft 1978-1986 142 30(21) 36(25) 29(21) 47(33) Hayes 1978-1986 50 10(20) 12(24) 13(26) 15(30) Oberlin 1988-1998 141 26(18) 35(25) 30(21) 50(36)
14 Tablo 5 : Yurt İçi Çalışmalardaki Primer Tümör Lokalizasyonları
ÇALIŞMA SAYI (n) TAKİP ARALIĞI PRİMER LOKALİZASYON (%) Bülbül ve ark. 2010 27 1980-2010 femur (26), tibia (14.8), pelvis (14.8) Kutluk ve ark. 2004 133 1972-1999 femur (23), tibia (14), pelvis (13.8) Sevinir ve ark. 2010 31 1996-2009 pelvis (32.3), femur (12.9)
Güler ve ark. 2010 16 2001-2009
humerus (43.7), pelvis (25), femur (18.7)
EICESS 1426
pelvis (26), femur (20), göğüs duvarı (16)
Ewing sarkom myelojen bir tümör olması nedeniyle vücutta herhangi bir kemikte görülebilir. Japonya’da 2006-2011 yılları arasındaki 188 vaka incelenmiş tutulum bölgelerinin genel olarak pelvis, kostalar ve femur olduğu gözlemlenmiş. 138 iskelet dışı Ewing sarkom hastasında (JOA Musculoskeletal Tumor Committee) ise tutulumun genel olarak uyluk, gluteal bölge, sırt, bacak ve retroperitoneal bölgede olduğu gösterilmiştir.
Ewing sarkom lezyonları litik destrüktif lezyonlardır. Güve yeniği tarzında destrüksiyon yapar. Osteosarkom gibi atlama (skip) lezyonlar yapabilir. Ancak genelde tüm kemiği tutan lezyonlar yapar. Bazen kemik içindeki kitle düz grafilerde görülemeyebilir. Yumuşak dokudaki kitle gölgesi tanıda yol gösterici olabilir. Periost reaksiyonu ise dıştan içe doğru invazyon ve yumuşak doku kitlesinin dıştan periosta doğru basması sonucu “çay tabağı” şeklinde bir görünüm oluşturabilir. Bu görüntüyle birlikte permeatif destrüksiyon yapan lezyon görünümü Ewing sarkomu osteomyelitten ayırır. [1]
Lezyonun yumuşak dokuya ve intramedüller alana yayılımını en iyi değerlendiren yöntem manyetik rezonans (MRG) görüntülemedir. Myelom, osteosarkom, kondrosarkom, histiyositik lenfoma ile ayırımın yapılabilmesini sağlar. MR tanı, evreleme, kemoterapiye yanıtın değerlendirilmesi ve ileri dönem takipler için altın standart yöntemdir. Çekilecek olan MR skip metastazları atlamamak için mutlaka tüm kemiği göstermelidir. T1’de orta-düşük intensitede iken; T2 ağırlıklı görüntülerde hiperintens bir lezyondur. Tutulum heterojen olabilir. [1]
15 Resim 11 : Ewing Sarkom MR Görüntüsü
Pulmoner metastaz Ewing sarkomda sık görülür. Bundan dolayı tanı koyulduğunda mutlaka akciğer grafisi ve bilgisayarlı tomografi (BT) çekilmelidir. Tanı esnasında akciğer BT ile metastazların saptanması prognozu belirlemede oldukça önemlidir.
Kemik sintigrafisinde yüksek 99mTc-MDP, pozitron emisyon tomografide (PET) ise yüksek 18-FDG tutulumu söz konusudur. [34] Sintigrafi ve PET gibi yöntemler BT ve MR ile birlikte değerlendirildiğinde anlamlıdır. Bunun dışında tek başlarına değerlendirildiklerinde düşük özgüllükleri nedeniyle yanlış tanıya neden olabilirler. PET aynı zamanda uygulanan kemoterapiye yanıtı değerlendirmek için de kullanılabilir.
BİYOPSİ
Tüm malign kitlelerdeki biyopsi yaklaşımı aynı şekildedir. Biyopsi insizyonel veya eksizyonel şekilde alınabilir. İnsizyonel biyopsi ince iğne biyopsi veya core (kalın iğne) biyopsi şeklinde olabilir. Bizim klinik olarak tercihimiz erişkin hastalarda lokal anesteziyle core biyopsi, çocuk hastalarda ise genel anestezi altında açık biyopsi yapmak şeklindedir. İnce iğne biyopsisi tercih edilen bir yöntem değildir. Sadece sitolojik tanı koyulabildiği için genellikle patologlar tarafından yetersiz materyal olarak raporlanmaktadır.
16 Resim 12 : Kalın İğne (Core Biyopsi)
(http://www.medicalexpo.com/prod/mdl/product)
Resim 13 : Kalın İğne Biyopsi Uygulaması
http://ls.bettercare.co.za/breast-care/3.html
Biyopsi alan kişinin mutlaka tedavinin devamını getirebileceği donanıma sahip olması gerekir. Gerek kişisel bilgi ve tecrübe açısından gerekse onkolojik tedavinin devamını sağlayabilecek ekip açısından donanım sağlanmış olmalıdır. Bu amaçla Ege Üniversitesi’nde 1988 yılından beri her Perşembe günü “Kas İskelet Sistemi Tümörleri Konseyi” yapılmaktadır.
17 Fotoğraf 1: Kas İskelet Sistemi Tümörleri Konseyi
Biyopsi alınırken malign patoloji çıkabilme ihtimaline karşı mutlaka eksizyon sırasında kullanılacak olan cerrahi alanlar hesap edilerek eksizyon yapılmalıdır. Kitle eksizyonu sırasında biyopsi traktı da eksize edileceği için bu traktın planlanan insizyon hattında olması sağlanmalıdır.
Biyopsi sonrası turnike indirildiğinde oluşacak olan tümör embolisinden kaçınmak için turnike kullanılmamalıdır.
Açık biyopsi rejyonel veya genel anesteziyle yapılabilir. İnsizyon hattının longitudinal düzlemde olması önemlidir. Transvers insizyonlar lokal fleplerin kontaminasyonuna ve nörovasküler yapılara yaklaşılmasına neden olur. Biyopsi öncesi MR, BT ve X-Ray üzerinden iyi planlama yapılmalıdır. Nekroz veya hemoraji bölgelerinden alınan biyopsiler tatminkar olmayan patoloji raporlarına neden olur. Özellikle kitlenin periferinden örnek alınmalıdır. Biyopsi alınan bölgede kırığa neden olabilecek kortikal destrüksiyon yapıldıysa bu bölge kortikal tıkaç veya kemik çimentosu (PMMA) ile doldurulmalıdır.
Katlar kapatılmadan önce mutlaka insizyon hattı doğrultusunda ve insizyon hattına yakın mesafeden hemovak dren uygulanmalıdır. Biyopsi sonrası cilt altı tabakalar arası hemorajiye bağlı olarak tümör yayılımı istenmeyen bir durumdur.
18
PATOLOJİ
Ewing sarkom makroskopik olarak yumuşak kıvamlı veya tamamen sıvı görünümde olabilir. Pürülan görünümü osteomyelit ile karışmasına neden olabilir. Büyük şeffaf sitoplazmalı, yuvarlak çekirdekli, dimorfik paternli, büyük kümeler oluşturan indiferansiye hücrelerden oluşur.[35] İntrasellüler glikojen miktarı fazladır. Bu özelliğiyle periodik asit Schiff (PAS) boyası ile boyanırlar. İntersellüler matriks üretimi azdır. Tümör içinde nekrotik odaklar görülebilir.
Resim 14: Ewing Sarkom Işık Mikroskobu Görüntüsü
(https://en.wikipedia.org/wiki/Ewing%27s_sarcoma#/media/File:Ewing_sarcoma_-_PAS_-_very_high_mag.jpg)
Küçük yuvarlak mavi hücreli tümörler; çocuk yaşlarda Ewing sarkom ve nöroblastom, erişkinlerde ise plasmositom/ multipl myelom, lenfoma ve küçük yuvarlak hücreli karsinomu içeren bir tümör grubudur.
Histopatolojik olarak ES tanısı diğer küçük yuvarlak hücreli tümörlerin ekarte edilmesi ile konur. Bu grupta en az nöroektodermal farklılaşma gösteren Ewing sarkomudur.
İmmunohistokimyasal olarak S-100 proteini ve PGP9.5 gibi nöral markerlar da bazen gösterilebilir. %90’dan fazla Ewing sarkom olgusunda sitoplazma membranında MIC-2 geninin bir ürünü olan CD99 proteini görülür. Bu yüzey antijenine spesifik O13, 12E7, ve HBA71 gibi monoklonal antikorlar ile diffüz membran boyanması izlenir. Buna rağmen CD99 Ewing sarkoma spesifik değildir. Sinoviyal sarkom, lenfoblastik lösemi ve lenfomada da görülebilir. [36]
19 İmmünohistokimyasal olarak vimentin ve HBA-71 reaktiftirler. HBA-71, özellikle hücre yüzeyinde eksprese edilen ve hücre yüzey antijeni olan MIC-2’yi tanıyan bir monoklonal antikordur. [15], [35]
MIC2 geninin bir ürünü olan p30/32 antijeni monoklonal antikor boyama ile hastaların %90’ında tespit edilebilir. Ewing sarkoma spesifiktir. [37]
PAS(+), retikülin (-) olması lenfomalar ile ayırıcı tanısının yapılmasını sağlar. Lenfomalar Ewing sarkomun tam tersi PAS(-), retikülin (+) boyanır.
Hücreler geniş sitoplazmalı yuvarlak hücrelerdir ancak sinir lifleri veya nöropililer gibi matür nöral elementler göstermezler.[3]
Tanı amaçlı elektron mikroskopi kullanılmasına yönelik yapılan bir araştırmada indiferansiye veya az diferansiye küçük yuvarlak hücreli tümörlerin tanısını koymada faydalı olduğu gösterilmiş olup diğer durumlarda ışık mikroskopinin yeterli olduğu belirtilmiştir. [38]
Resim 15 : Ewing Sarkom Elektron Mikroskopi Görüntüsü
(http://www.biosciencetechnology.com/news/2013/04/3d-scaffolds-help-mimic-tumor-growth-drug-response)
ESTA’ya ait bir tümörün tanısını koymak için en az iki farklı nöral antijenin ve/veya Homer Wright rozetlerinin veya ganglion hücrelerinin gösterilmesi gerekmektedir. (Kiel pediatrik tümör kayıt sistemi) [39]
20
FÜZYON GEN ANALİZİ
Son yıllarda tanıyı kesinleştirmek için spesifik kromozom translokasyonlarını gösteren ters transkripsiyon-polimeraz zincir reaksiyonu (RT-PCR) ve floresan in situ hibridizasyon (FISH) yöntemleri kullanılmaktadır. Kemik iliği aspirasyon materyali ile çalışılırlar. Bu füzyon ürünleri onkojenik transkripsiyon faktörleri olarak çalışırlar. [40]
Tablo 6: Translokasyonlar, Füzyon Genleri Ve Sıklık TRANSLOKASYON FÜZYON GENİ SIKLIK (%)
t(11;22)(q24;q12) EWSR1-FLI1 85 t(11;22)(q24;q12) EWSR1-ERG 10 t(11;22)(q24;q12) EWSR1-ETV1 nadir t(11;22)(q24;q12) EWSR1-ETV4 nadir t(11;22)(q24;q12) EWSR1-FEV nadir AYIRICI TANI
Radyolojik olarak osteomyelit, osteosarkom, eosinofilik granülom, ve lenfoma ile karışabilir. Patolojik olarak ise diğer malign küçük yuvarlak hücreli tümörler ile karışır. Şişlik, kızarıklık ve sistemik bulgular ile birlikte değerlendirildiğinde klinik olarak osteomyelit ile karışır. Bundan dolayı biyopsi alınırken mutlaka mikrobiyolojik örnekler de alınmalıdır.
Kemik lenfoması hem radyolojik hem de patolojik olarak Ewing sarkom ile karışabilir. Osteosarkom ile ayırımı radyoloji ile yapılabilir. Osteosarkom genellikle uzun kemik metafizini tutar ve kemik destruksiyonu komşuluğunda tam mineralize olamamış kemik matriksi osteoid yapan hücrelerden kaynaklanması nedeniyle osteosarkomda görülürken Ewing sarkomda görülmez. [41, 42]
EVRELEME
Ewing sarkomda kullanılan spesifik bir evreleme yöntemi yoktur. Diğer solid tümörlerde de olduğu gibi TNM evrelemesi kullanılır. Kemik ve yumuşak doku kitleleri için Musculascaletal Tumor Society, American Joint Committee on Cancer (AJCC)/International Union Against Cancer (UICC) sınıflamaları mevcuttur ancak bu sınıflamalar Ewing sarkomda geniş kullanım alanı bulamamış sınıflamalardır. Primer tümör alanına odaklanamamaları bu sistemlerin ortak eksikliğidir. Primer tümör yerleşim alanı en önemli prognostik faktörlerden
21 biridir.[43] Süperfisiyal ve derin tümörlerin aynı prognostik grupta olması nedeniyle 2010 yılında bu sınıflandırmalar revize edilmiştir.
Tablo 7 : TNM Evrelemesi
TNM EVRELEMESİ
Primer tümör(T)
TX: primer tümör saptanamaz T0: primer tümöre ait kanıt yoktur T1: en uzun tümör çapı ≤ 5 cm T1a: süperfisyal tümör T1b: derin tümör T2: en uzun tümör çapı > 5 cm
Bölgesel lenf nodu (N) NX: bölgesel lenf nodu saptanamaz
N0: bölgesel lenf nodu metastazı yok
N1: bölgesel lenf nodu metastazı var
Uzak metastaz (M) M0: uzak metastaz yok M1: uzak metastaz var
Tablo 8 : Histopatolojik Derecelendirme
HİSTOPATOLOJİK DERECELENDİRME Stage 1A: T1a N0, NX M0 düşük derece --- T1b N0, NX M0 düşük derece Stage 1B: T2a N0, NX M0 düşük derece --- T2b N0, NX M0 düşük derece Stage 2A: T1a N0, NX M0 yüksek derece --- T1b N0, NX M0 yüksek derece Stage 2B: T2a N0, NX M0 yüksek derece --- T2b N0, NX M0 yüksek derece Stage 3: herhengi bir T, N1 M0 yüksek derece Stage 4: herhangi bir T, herhangi bir N, M1 yüksek derece
Tablo 9 : “Musculoskeletal Tumour Society” Malign Kemik Lezyonları Sınıflaması
EVRE ÖZELLİK
IA düşük derece, intrakompartmantal IB düşük derece, ekstrakompartmantal IIA yüksek derece, intrakompartmantal IIB yüksek derece, ekstrakompartmantal
III Metastatik
22 Tablo 10 : Enneking Evrelemesi
23
TEDAVİ
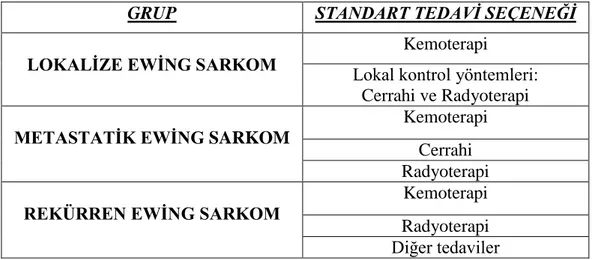
Tablo 12 : Standart Tedavi Tablosu
GRUP STANDART TEDAVİ SEÇENEĞİ
LOKALİZE EWİNG SARKOM
Kemoterapi Lokal kontrol yöntemleri:
Cerrahi ve Radyoterapi
METASTATİK EWİNG SARKOM
Kemoterapi Cerrahi Radyoterapi
REKÜRREN EWİNG SARKOM
Kemoterapi Radyoterapi Diğer tedaviler
Tüm onkolojik patolojisi olan hastalarda olduğu gibi Ewing sarkom hastalarında da öncelik hayatı kurtarmaktır. Daha sonra ekstremiteyi kurtarmak ve fonksiyonları korumak gelir. Baştan sona Ewing sarkomlu bir hastanın tedavisi küratif amaçla yapılmalıdır. Tedavinin kalitesi deneyimli ve multidisipliner çalışma sistemini oturtmuş ekipler tarafından artırılabilir.
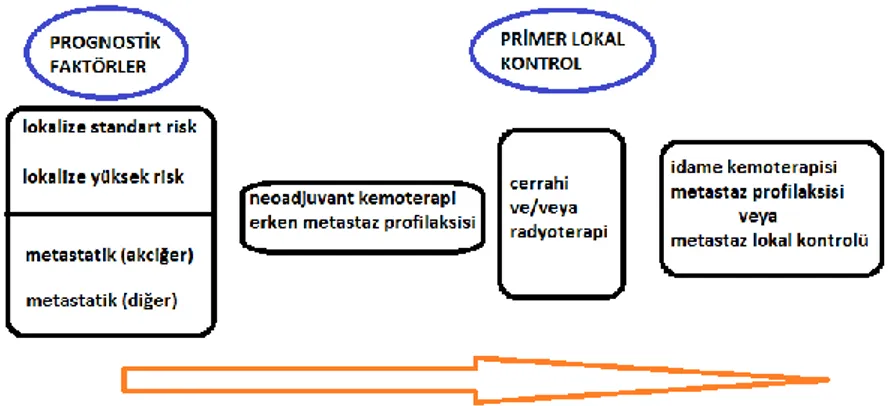
Tedavide temel prensip neoadjuvant kemoterapiyle primer tümörün boyutlarını küçültmek, sonrasında geniş rezeksiyon, radyoterapi ve adjuvant kemoterapi ile lokal kontrolü sağlamaktır. [44]
Ewing sarkom sistemik bir hastalıktır. Bundan dolayı tanı anında dahi mikrometastazlar olabileceği göz önünde bulundurularak tedavi düzenlenmelidir. Uygulanan sistemik kemoterapiler hem bu mikrometastazlar üzerine hem de primer tümörün boyutları üzerine etkilidir. Primer tümörün boyutlarının küçülmesi uygulanacak cerrahi veya radyoterapi gibi lokal kontrol yöntemlerinin etkinliğini artırır.
Lokal tedaviler ile sistemik kemoterapi arasında dikkat edilmesi gereken bir husus; lokal tedavilerin sistemik tedaviyi geciktirmemesi gerekliliğidir. Cerrahi veya radyoterapi uygulamaları sırasında kemoterapinin ertelenmesi uzak metastazların belirginleşmesine ve prognozun kötüleşmesine neden olmaktadır.
Günümüzde lokalize hastalığa sahip ES hastalarının 5 yıllık genel sağ kalımı %65-75 arasındadır. İzole pulmoner metastazı olan hastaların 5 yıllık genel sağ kalımı %50 civarındadır. Metastatik hastalıkta ise bu oran %30’un altına inmektedir.
24 EWS-FLI1 proteininin moleküler yapısıyla ilgili çalışmalar arttıkça tedavi yöntemleri de şekillenmektedir. Günümüzde Ewing sarkomun standart tedavisi lokal kontrol ile birlikte neoadjuvant ve adjuvant kemoterapidir.
Tedavi protokollerinin belirlenmesi ulusal ve uluslararası klinisyenler, patologlar ve biyologların katılımıyla biyobankalarda toplanan örnekler üzerinde yapılan çalışmalarla belirlenmektedir. Bunlardan en önemli ve güncel olanları: EICESS92 (European Intergroup Cooperative Ewing’s Sarcoma Study 92) ve EE99 (Euro-Ewing Intergroup 99)’dur. [45]
Şekil 2 : Güncel risk-adaptif Ewing sarkom tedavi stratejisi
(Gaspar N, Hawkins DS, Dirksen U, Lewis IJ, Ferrari S, Le Deley MC, et al. Ewing Sarcoma: Current Management and Future Approaches Through Collaboration. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2015;33:3036-46.)
KEMOTERAPİ
Neoadjuvan kemoterapinin 3 amacı vardır: 1) Tanı anındaki mikrometastazları yok etmek
2) Cerrahi öncesinde eksize edilecek kitle hacmini küçültmek 3) Postoperatif kemoterapi ajanlarını belirlemek
Ewing sarkom kemoterapisinde vinkristin, doksorubisin, ifosfamid ve etoposid herzaman kullanılan ilaçlardır. Çoğu protokol siklofosfamidi de içerir. Bazılarında da daktinomisin kullanılır. EICESS çalışmasında düşük risk grubunda 1.2 g siklofosfamidin 6 g ifosfamide eşdeğer hastalıksız sağ kalıma katkısı gösterilmiştir. Yüksek risk grubunda ise etoposid kullanımı gerekmektedir. [46]
25 A.B.D.’nde genellikle vinkristin, siklofosfamid ve doksorubisin protokollerde yer alan ilaçlardır. [47] Avrupa protokollerinde ise vinkristin, doksorubisin ve bir
alkilleyici ajan kullanılır. Tedaviye etoposid de eklenebilir. [48]. Primer kemoterapi süresi 6 aydan 1 yıla kadar değişebilmektedir.
Vinkristin ;vinka alkoloidi, aktinomisin-D ; antitümör antibiyotik, siklofosfamid ; alkilleyici ajan, doksorubisin; antitümör antibiyotik, ifosfamid; alkilleyici ajan, etoposid ; vinka alkoloidi içerikli ilaçlardır. Etoposid ve ifosfamid tedavi protokolüne 1980’li yıllarda eklenmiştir.
Grier ve arkadaşlarının 2003 yılında yaptıkları çalışmaya göre Ewing sarkomda VAC-VACA (vinkristin, doksorubusin, aktinomisin-D, siklofosfamid) tedavisi incelenmiştir. Yaklaşık 5 yıllık sağ kalım bu tedaviyle %60 civarlarındadır. Ancak pelvik yerleşimli ve metastatik tümörlerde bu oran yarıya kadar inmektedir. İfosfamid ve etoposid kombinasyonu tekrarlayan Ewing sarkom olgularında kullanılmaktadır. Bu iki ilaç IESS-3 çalışmasında etkinlik açısından değerlendirilmiş. Sonuçta IE+VAC+D tedavisi ile 5 yıllık hastalıksız sağ kalım %68 bulunurken VAC+D tedavisiyle 5 yıllık sağ kalım %54 olarak bulunmuştur. Bu sonuçlar neticesinde birçok ülkede İE+VAC+D tedavisi yaygın olarak kullanılmaktadır. [27]
IESS-1 (the Intergroup ES Study) çalışmasında VAC ve VAC-D rejimleri 331 hastada karşılaştırılmış ve VAC-D rejimi sürvi açısından daha iyi bulunmuştur. [25]
1980’lerde ifosfamid ve etoposid kombinasyonu protokollerde kullanılmaktaydı. Pediatric Oncology Group-Children's Cancer Group (POG-CCG) INT-0091 çalışmasında VACD-İE kombinasyonunun 5 yıllık sağ kalım oranının %69 olduğunu göstermiştir. [26] Ancak bu oran lokalize hastalık durumunda geçerli bir orandır. Metastatik hastalıkta sürvi daha düşüktür.
26 Şekil 3 : CESS 81 Ve CESS 86 Protokolleri
Euro-EWİNG-99 çalışmasında ise VIDE tüm hastalarda başlangıç standard tedavi protokolü olarak kullanılmaktadır. [49] EICESS-92 (by Gesellschaft für Pädiatrische Onkologie und Hämatologie [GPOH] ve Children’s Cancer and Leukaemia Group [CCLG]) çalışmalarında lokalize Ewing sarkom olgularında ifosfamid ve siklofosfamidin etkinliklerinin aynı olduğu gösterilmiştir.[50].
EE99 R1 (by GPOH, CCLG, Société Française de Lutte Contre les Cancers et les Leucémies de l’Enfant et de l’Adolescent [SFCE] ve European Organisation for Research and Treatment of Cancer [EORTC]) çalışmasında siklofosfamid ve ifosfamid VAC ve VAI kombinasyonlarında standart risk ES hastaları (tümör hacmi <200 ml veya neoadjuvant tedaviye histolojik yanıt < %10 ) için karşılaştırılmıştır. Bu çalışmada ise siklofosfamidin üstünlüğü gösterilmiştir.[51]
Kemoterapi gören hastalarda oluşan lökopeni, granülosit-koloni stimüle edici faktör (G-CSF) ile, trombositopeni transfüzyonlarla, anemi ise transfüzyonlar ve eritropoietin ile önlenmeye çalışılır. Bulantı, kusma, alopesi de diğer yan etkilerdir. Bunun yanında granülosit koloni stimüle edici faktör (filgrastim) siklofosfamid ve ifosfamid dozlarının artırılmasına ya da uygulama sırasındaki intervalin kısaltılmasına olanak sağlayarak daha yüksek doz kemoterapi uygulanabilmesini kolaylaştırır. [52]
27 2012 yılında yayınlanan COG (Children’s Oncology Group) çalışmasında VDC-IE kemoterapisinin 2 hafta ve 3 hafta uygulanması arasındaki fark incelenmiş ve 5 yıllık hastalıksız sağ kalım oranının %73’e %65 3 haftalık uygulama lehine olduğu gösterilmiştir. Çalışmada toksisitenin de artmadığı tespit edilmiştir. [53]
Metastatik hastalık veya rekürrens durumunda siklofosfamid/topotekan, irinotekan/ temozolomid veya yüksek doz ifosfamid kullanılır. [54]. Oberlin ve ark’nın yaptıkları bir çalışmada metastatik hastalıkta yüksek doz busulfan ve melfalan (BuMel) uygulanmış. 5 yıllık hastalıksız sağ kalımın sadece akciğer metastazı olan hastalarda %52, yaygın metastazı olan hastalarda ise %36 olduğunu saptamışlardır. [55]
2014 yılında Odri ve ark. tarafından yapılan bir çalışmaya göre in vitro koşullarda zoledronik asitin ES hücrelerinin gelişimini inhibe ettiği, in vivo koşullarda ise primer odaktan akciğer metastazı gelişimini engellediği gösterilmiştir. ancak gelişmiş olan bir akciğer metastazı üzerine inhibe edici etki gösterilememiştir. [56]
2012 yılında Brenner ve ark. tarafından PARP-1 isimli enzim üzerinde çalışmalar yapılmış. PARP-1 EWS-FLI1 ve EWS-ERG füzyon genlerinin aktivite gösterebilmeleri için sentezledikleri proteinlerin üretim basamağında görevli bir enzim. araştırmacılar bu enzimi inhibe ederek protein sentezini engellemeyi planlamışlar ve bu amaçla temozolamid kullanmışlardır. Sonuçta in vitro koşullarda başarılı olmuşlardır. [57]
EE99 çalışmasında VIDE (vinkristin, ifosfamid, doksorubisin, etoposid) başlangıç kemoterapisinden sonra tüm akciğer ışınlaması+VAI kemoterapisi ile tüm akciğer ışınlaması olmadan yüksek doz busulfan melfalan tedavisi arasındaki farkı araştırmaktadır. Çalışmanın sonuçları henüz yayınlanmamıştır.
28 Tablo 13 : EICESS-92 Ve Euro-Ewing 99 Tedavi Protokolleri
(Gaspar N, Hawkins DS, Dirksen U, Lewis IJ, Ferrari S, Le Deley MC, et al. Ewing Sarcoma: Current Management and Future Approaches Through Collaboration. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2015;33:3036-46.)
SR: standart risk, YR: yüksek risk, NS: not significant (anlamsız), met.:metastaz RT: radyoterapi, AC: akciğer, YD: yüksek doz
VAIA: vinkristin, daktinomisin, ifosfamid, doksorubisin VACA: vinkristin, daktinomisin, siklofosfamid, doksorubisin EVAIA:etoposid, vinkristin, daktinomisin, ifosfamid, doksorubisin VIDE:vinkristin, ifosfamid, doksorubisin, etoposid
VAI: vinkristin, daktinomisin, ifosfamid VAC: vinkristin, daktinomisin, siklofosfamid
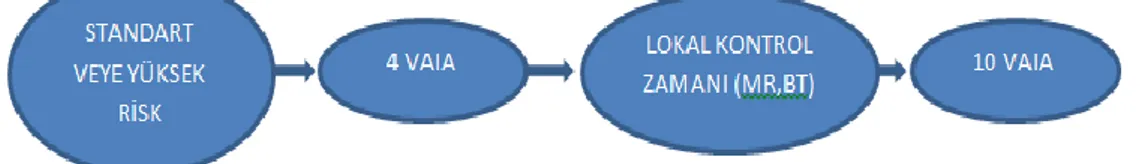
Ege Üniversitesi Medikal Onkoloji Kliniği’nde tedavi uygulaması EICESS-92 şeması baz alınarak yapılmaktadır. Genel hatlarıyla şemayla uyum gösterirken bazı uygulama farklılıkları vardır. Hastalar EICESS-92’deki gibi standart risk veya yüksek risk olarak ayrılmamakta, tüm hastalara aynı tedavi protokolü uygulanmaktadır. 4 kür VAIA tedavisi sonrası lokal kontrol durumu kontrol MR veya BT istenerek incelenir. Cerrahi tedaviye uygun olan hastalara ameliyat planlanırken diğer hastalara 10 kür VAIA uygulanarak tedavi şeması sonlandırılır.
29 Ardından tekrar kitlenin ve hastanın durumu değerlendirilerek tedavinin ne şekilde devam edeceğine karar verilir. VACA tedavisi siklofosfamidin yan etkileri nedeniyle hastanemizde uygulanmamaktadır.
Şekil 4 : Ege Üniversitesi Çocuk Onkoloji Kliniği Standart Tedavi Şeması
RADYOTERAPİ
Ewing sarkom radyosensitif bir tümördür. Tedavide hem definitif hem de adjuvan olarak kullanılabilir. Lokal kontrolün esas basamağı ise cerrahidir. Neoadjuvant kemoterapi sonrası veya öncesinde MR ile değerlendirilir. Eğer kitle cerrahiye olanaklı ve hastada postoperatif dönemde fonksiyonel olarak kabul edilebilir sonuçlar öngörülür ise cerrahi uygulanır.
Kemoterapi rejimleri geliştirilmeden önce radyoterapi Ewing sarkomda definitif tedavi amacıyla kullanılıyordu (5hafta 45-50 Gy). Radyosensitif tümörler olması nedeniyle Ewing sarkomda radyoterapi hem definitif hem de adjuvan olarak kullanılmaktadır. Özellikle pelvik ve vertebral yerleşimli cerrahi uygulamanın zor ve fonksiyonel sonuçların kötü olacağı bölgelerde radyoterapi definitif amaçla kullanılabilmektedir.
CESS86 (Cooperative ES Study) çalışmasında pozitif cerrahi sınırı olan hastalara postoperatif 46 Gy radyoterapi uygulanmış. Opere olmayan diğer gruba ise 60 Gy radyoterapi uygulanmış. İki grubun tedavi sonuçları arasında anlamlı fark bulunamamış ve 60 Gy radyoterapinin lokal kontrolü sağlayabildiği kanaatine varılmıştır. [58]
Bacci ve ark. radyoterapi ve cerrahi birlikte uygulanan hastalarda %100 lokal kontrol, sadece radyoterapi uygulananlarda ise %67 lokal kontrol sağlandığını göstermişlerdir. [59]
Wilkins ve ark. 5 yıllık sağ kalım oranlarını cerrahi ve radyoterapi kombine tedavisiyle % 72, sadece radyoterapiyle % 27 olarak yayınlamışlardır. [20]
30 2003 yılında CESS ve EICESS çalışmalarının sonuçlarına göre Schunk ve ark. postoperatif radyoterapinin kemoterapiye cevap vermeyen hastalarda lokal kontrolü sağlamada etkin olduğunu göstermişlerdir. [60]
Total akciğer ışınlaması (14-17 Gy) uygulanan hastaların uygulanmayanlar göre akciğer metastazı açısından daha iyi prognoza sahip olduğu gösterilmiştir. Ancak Ewing sarkomlu hastaların akciğer fonksiyonel kapasitelerindeki sınırlanmalar göz önünde bulundurularak uygulama yapılmalıdır. [61]
Son yıllarda karbon-iyon radyoterapi (carbon-ion radiotherapy=CIRT) lokal kontrol amaçlı uygulanmıştır. Iwata ve ark. 1999-2009 yılları arasında rezeke edilemeyen (unrezektabl) kabul edilen 5 hastayı retrospektif olarak incelemişler. CIRT ile birlikte yüksek doz kemoterapi uygulanan hastalarda uygulanmayanlara göre lokal kontrolün daha iyi olduğu ancak uzak metastazdan korunadığını göstermişlerdir. [62]
Postoperatif radyoterapi aynı zamanda yakın veya pozitif cerrahi sınırlarla çıkarılan kitlelerden sonra nüks gelişimini önlemek amacıyla da kullanılır. Güvenli sınırlar kemik için 2-5 cm, kas için 5mm, fasya için 2mm’dir.
Postoperatif radyoterapi bir de adjuvan kemoterapiye yanıt vermeyen hastalarda uygulanabilmektedir. [63]
Radyoterapinin yan etkileri arasında fibrozise bağlı hareket kısıtlılığı, patolojik kırık gelişimi, büyüme plaklarının erken kapanması, ve lenfödem sayılabilir. Yapılan çalışmalarda gösterilmiştir ki radyoterapi sonrası 30 yılda sekonder malignite gelişme olasılığı %5-10 arasındadır. [64]
Total definitif radyoterapi inoperabl tümörlerde uygulanabilen bir yöntemdir. 2 cm güvenli sınırı olan biyopsi skarını da içerecek şekilde uygulanan 54-55 Gy’lik radyoterapi dozu definitif tedavi için yeterli olacaktır. [65] Tümör boyutu arttıkça uygulanması gereken radyoterapi dozu da artırılmalıdır. Ancak radyosensitize edici etkisinden dolayı busulfan içeren tedavi protokolleri uygulandıktan sonra radyoterapi zamanlaması ve dozuna dikkat edilmelidir. [66], [67].
Postoperatif radyoterapi tam olmayan cerrahi rezeksiyon sonrası uygulanması gereken bir yöntemdir. [68] Ancak Avrupa’da güvenli sınırlarla rezeke edilmiş kitlelerde neoadjuvant tedaviye yanıt iyi değilse de postoperatif radyoterapi uygulanmaktadır.[33, 60]. EE99 (Euro-Ewing 99) çalışmasında indüksiyon kemoterapisi sonrası uygulanan postoperatif radyoterapinin lokal kontrol sağlamaya olumlu katkısı gösterilmiştir. Postoperatif radyoterapinin riskleri ve faydalarını
31 incelemek açısından yeni çalışmalar yapılmaktadır. Euro-Ewing 2012 çalışmasında postoperatif radyoterapi endikasyonları genişletilmiştir.
Günümüzde Ewing sarkomda radyoterapinin prensipleri NCCN’de (National Comprehensive Cancer Network) yayınlanan tedavi algoritmasına göre belirlenmektedir. Hastaların tedavisi primer tümör ve metastatik hastalık olarak 2 ana gruba ayrılır.
1)Primer tümörün tedavisi: kendi içinde definitif radyoterapi, preoperatif radyoterapi, postoperatif radyoterapi ve hemitoraks ışınlama şeklinde 4 başlık altında incelenir.
A) Definitif Radyoterapi:
-VAC/IE tedavisinin 12. haftasında veya VIDE tedavisinin 18. haftasında başlanır. Gross tümör hacmine (GTV) 45 Gy + 1-1,5 cm klinik hedef hacim 1 (CTV1) için+ 0,5-1 cm planlanan hedef hacim 1 (PTV1) için uygulanır.
-İlk kemik yayılımını çevrelemek için Cone-down (CD) + 55.8 Gy postkemoterapi yumuşak doku hacmi (GTV2) için + 1-1,5 cm CTV2 için + 0.5-1 cm PTV2 için uygulanır
-Kemoterapiye cevabın <%50 olduğu hastalarda ise boost dozu 59.4 Gy’e çıkılır. B) Preoperatif Radyoterapi:
-Konsolidasyon kemoterapisi dozunda ve cerrahi sırasında en az marjinal rezeke edilebilecek tümörlerde uygulanır. GTV+2 cm, 36-45 Gy dozunda uygulanır.
C) Postoperative Radyoterapi:
-Postoperatif 60 gün içinde başlanmalıdır. Konsolidasyon kemoterapi dozuna uygun olarak uygulanmalıdır.
-R0 rezeksiyon (rezidü tümör yok): 45 Gy GTV2 için + 1-1,5 cm CTV1 için + 0.5-1 cm PTV1 için uygulanır
-R1 rezeksiyon (mikroskobik rezidü): 45 Gy GTV2 için + 1-1,5 cm CTV1 için + 0.5-1 cm PTV0.5-1 için uygulanır.
-R2 rezeksiyon (makroskopik rezidü): 45 Gy GTV2 için + 1-1,5 cm CTV1 için + 0.5-1 cm PTV1 için uygulanır. Ardından rezidual volüm için CD+ 55.8 Gy GTV2 için + 1-1,5 cm CTV2 için + 0.5-1 cm PTV2 için uygulanır.
D) Hemitoraks ışınlaması: plevral tutulumlu göğüs kafesi tutulumlarında kullanılmalıdır. Uygulama 15-20 Gy sonrası primer bölgeye CD şeklindedir.
32 2)Metastatik hastalık tedavisi:
-Kemoterapinin tamamlanması veya metastazektomiyi takiben tüm akciğer ışınlaması şeklinde uygulanır.
-<14 yaş hastalarda 15 Gy, >14 yaş hastalarda 18 Gy uygulanır.(COG çalışması <6 yaş 12Gy, >6 yaş 15 Gy )
Ege Üniversitesi Radyasyon Onkolojisi Kliniği’nde de NCCN’deki (National Comprehensive Cancer Network) tedavi algoritmasına göre uygulama yapılmaktadır.
Radyasyon dozu cerrahi prosedürden sonra kalan rezidüel hacime göre belirlenmelidir. Radyoterapi dozu genelde total olarak 55.8 Gy olmalıdır. Ewing sarkom tanılı 40 hastada yapılan randomize çalışmada bir gruba toplam 55.8 Gy doz, diğer gruba ise toplam 39.6 Gy doz uygulanmış. Lokal kontrol ve hastalıksız sağ kalım üzerine etkilerinin farklı olmadığı bulunmuştur.[69]
Hiperfraksiyone radyoterapinin artmış lokal kontrol veya azalmış morbiditeyle ilşkisi gösterilememiştir. [70]
Göğüs duvarında kitle saptanan hastalarda tüm hemitoraks ışınlama ile göğüs duvarı ışınlaması karşılaştırılmış. Hemitoraks ışınlama uygulanan hastalarda hastalıksız sağ kalım istatistiksel olarak anlamlı olmasa da daha uzun saptanmıştır. [71]
Rezeksiyon sonrası rezidü kitle kalan hastalarda INT-0091 (Intergroup Ewing Sarcoma Study) çalışmasına göre eksizyon bölgesine 45 Gy uygulanmalıdır. Mikroskopik rezidü saptanan hastalara 5.4 Gy boost, makroskopik rezidü saptanan hastalara ise 10.8 Gy boost doz uygulanmalıdır. Mikroskobik rezidü saptanmayan hastalara ise adjuvant radyoterapiye gerek yoktur. [68]
CERRAHİ
Enneking ve arkadaşları dört temel cerrahi eksizyon yöntemi tarif etmişlerdir[72].
1) intralezyoner eksizyon 2) marjinal eksizyon 3) geniş eksizyon 4) radikal eksizyon
Ewing sarkom gibi tüm sarkomlarda rekürrensi önlemek için tümörün doğal bariyerleri açılmadan paket olarak çıkarılması gerekmektedir. Bu nedenle Ewing sarkomda intralezyoner ve marjinal eksizyonlar uygun olmamaktadır. Tümörün
33 bulunduğu kompartmanla birlikte radikal olarak çıkarılması veya en azından etrafındaki bir miktar tümörsüz doku ile birlikte geniş olarak çıkarılması gerekmektedir.
Ewing sarkomda cerrahi tedavi kapsamında rezeksiyon sonrası kemik rekonstrüksiyonu ve yumuşak doku rekonstrüksiyonu yapılmaktadır. Rekürrens gelişimini önlemek için tüm sarkomlarda olduğu gibi kitle mutlaka geniş rezeke edilmelidir. Kesinlikle intralezyonel veya marjinal işlemlerden kaçınılmalıdır. Rezeksiyon sonrası geride kalan dokular değerlendirilerek rekonstrüksiyon işlemleri yapılır. Ancak ameliyat öncesi bu plan mutlaka yapılmış ve hastaya bu konuda ayrıntılı bilgi verilmiş olması gerekmektedir. Amptasyon veya çevirme plastisi (turn-up plasty) cerrahi seçenekler arasında yer alabileceği gibi ekstremite koruyucu cerrahiler de uygulanabilmektedir. Rezeksiyon sonrası oluşan boşluklar; otogreft (iliak kanat, vaskülerize fibula vs…) , allogreft veya xenogreftler ile doldurulabilmektedir. Rezeksiyon sonucu artrodez de bir rekonstrüksiyon seçeneği olabilir. Eklemi içeren kitlelerin rezeksiyonu sonucu geriye kalan kemiğin durumu, hastanın yaşı ve performansı dikkate alınarak protezi ile rekonstrüksiyon, uzun segmentlerde modüler tümör rezeksiyon protezleri uygulanabilir. Özellikle çocuk hastalarda ve eklemi invaze etmeyen tümörlerde hastanın kendi kemiğini otogreft olarak kullanmak amacıyla çıkarılan kemiğin irradiye edilip implantlar yardımıyla çıkarılan yere geri koyulduğu “ekstrakorporeal irradiye otogreft ile rekonstrüksiyon” yöntemi uygulanabilir. Yumuşak doku defektleri; kısmı kalınlıkta veya tam kat cilt grefti, rotasyonel flep veya serbest vasküler flepler ile rekonstrükte edilebilir.
Ewing sarkomun radyosensitivitesi ilk tanımladığı zamanlardan beri bilinmektedir. [73] Buna rağmen özellikle büyük kitlelerdeki radyoterapi sonrası rekürrens oranlarının fazlalığı ve neden olduğu geç yan etkiler (büyüme duraksaması, sekonder maligniteler) sebebiyle Ewing sarkom lokal tedavisinde bazı özel durumlar haricinde (cerrahinin teknik olarak imkansız olabileceği durumlar, hastanın cerrahiyi kaldıramayacak kadar düşkün olması vs. ) cerrahinin önüne geçememiştir.
Protezler, allogreftler, vaskülarize otogreftler ile ilgili teknikler ve teorik bilgilerin gelişmesiyle cerrahi yöntemler de şekillenmiş ve gelişmiştir. [74] [75]. Marjinal veya geniş cerrahi sınırın sağlanabileceği durumlarda cerrahi yöntemlerin tercih edilmesi gerekmektedir. Çünkü lokal kontrolde cerrahi rezeksiyon definitif radyoterapiden daha iyidir. [31, 65, 68, 76-79]
34 Schuck ve ark’nın 2003 yılında yaptıkları çalışmada neoadjuvan radyoterapi sonrası intralezyoner veya debulking cerrahi uygulanan hastalarla definitif radyoterapi uygulanan hastaların sonuçları arasında fark bulunamamıştır. Bundan dolayı intralezyoner veya debulking cerrahi Ewing sarkom hastalarında uygulanması doğru bir yöntem değildir.
Tümör lokalizasyonu veya hasta yaşı nedeniyle radyoterapinin etkin olamayacağı hastalarda amputasyon da cerrahi seçenekler arasında yer almaktadır. Uygun yaş grubundaki çocuklarda rotasyonplasti amputasyona alternatif bir yöntem olarak uygulanabilir. [80]
Children's oncology group (COG) protokollerine göre cerrahi sınır: kemikte en az 1 cm (2-5cm) yumuşak dokuda ise en az 5 mm, fasyal alanlarda en az 2 mm olmalıdır. Ewing sarkom tedavisinde tümör yükünü azaltmaya yönelik debulking cerrahi uygulanmamalıdır.
Rezeksiyon sonrası rekonstrüksiyon planlanırken dikkat edilecek en önemli hususlardan biri enfeksiyona eğilimli materyallerin kullanılmamasıdır. Son yıllarda sıvı nitrojen ile işlem görmüş kemik greftleri kullanılmaktadır. Bu greftler bir çeşit kriyo-immunolojik cevap oluşturarak enfeksiyon oranlarını düşürmektedir. [81]
Pelvik yerleşimli Ewing sarkomların eksizyonları sonrasında vaskülarize veya non-vaskülarize fibula greftleri kullanılmaktadır. [82]
35 Resim 16 : Vaskülarize Fibula Grefti İle Rekonstrüksiyon
Erken yaşlarda, kemik büyümesinde gerilemeye neden olabileceği için radyoterapi cerrahiye göre daha morbid olabilmektedir.
Cerrahinin başka bir faydası da rezidüel canlı tümör hacmini azaltmasıdır. Fransa’da yapılan bir çalışmada; %5’ten az canlı rezidü tümör kalan hastalarda hastalıksız sağ kalımın %75, %5-30 arası olanlarda %48, %30’dan fazla olanlarda ise %20 olduğu gösterilmiştir. [33]
Finlandiya'da yapılan bir çalışmada ise 1990-2009 yılları arasında cerrahi yöntemler uygulanan 57 hasta araştırılmıştır. 54 tanesi küratif cerrahi olurken 3 tanesi debulking cerrahi ile tedavi edilmiş. Pozitif cerrahi sınır ile sonuçlanan ameliyatlardan sonra 5 yıllık relapssız yaşam oranı %33 iken , cerrahi sınır negatif saptanan hastalarda bu oranın % 84 olduğu gözlenmiş. Geç komplikasyonların genellikle kemik rekonstrüksiyonları ile alakalı olduğu ve büyük kısmının periferal yerleşimli kitlelere sahip olan hastalar olduğu gözlenmiştir. [83]
Prognozu en çok etkileyen tedavi komponenti cerrahi sınırdır. Cerrahi tedavide amaç tümörün geniş sınırlarla çıkartılmasıdır. Amputasyon veya ekstremite kurtarıcı cerrahi kararını vermede etkili olan faktör ise geniş sınırların sağlanabilirliğidir. Cerrahi ile geniş sınır elde edilemeyecekse veya fonksiyonel
36 kayıp çok fazla olacak ise radyoterapi ile definitif tedavi uygulanabilir. Pelvik yerleşimli tümörü olan bazı olgularda rezeksiyon hem teknik olarak güç hem de fonksiyonel olarak kötü olmaktadır. Bu olgularda definitif radyoterapi ve sistemik kemoterapi uygulanabilmektedir. [1]
PROGNOZ
Ewing sarkomda prognostik faktörler tümörün yeri, boyutu, kemoterapi cevabı, tanı anında metastaz varlığı ve relapstır. Yerleşim açısından değerlendirildiğinde ekstremitelerin distalinde yerleşim gösterenler proksimaline veya sakrum ve pelvis gibi santral yerleşimli olanlara göre daha iyi prognoza sahiptir. Tümör hacmi açısından bakıldığında yerleşim yerile korelasyon görülmektedir. Sakrum, pelvis ve proksimal femur yerleşimli olan kitlelerin boyutları diğer bölgelere göre daha büyüktür ve prognozları daha kötüdür.
BT ve MRG’de 8-10 cm’den büyük veya tümör hacmi 100 ml ve üzerinde olan kitlelerin prognozu kötüdür. Tanı anında metastazın varlığı en kötü prognostik faktördür. [44] İzole pulmoner metastaz varlığı uzak metastaza göre daha iyi bir prognostik faktördür. 3 yıllık hastalıksız sağ kalım oranı çeşitli çalışmalara göre %29-52 arasında değişmektedir.[27, 50, 55, 66, 84]
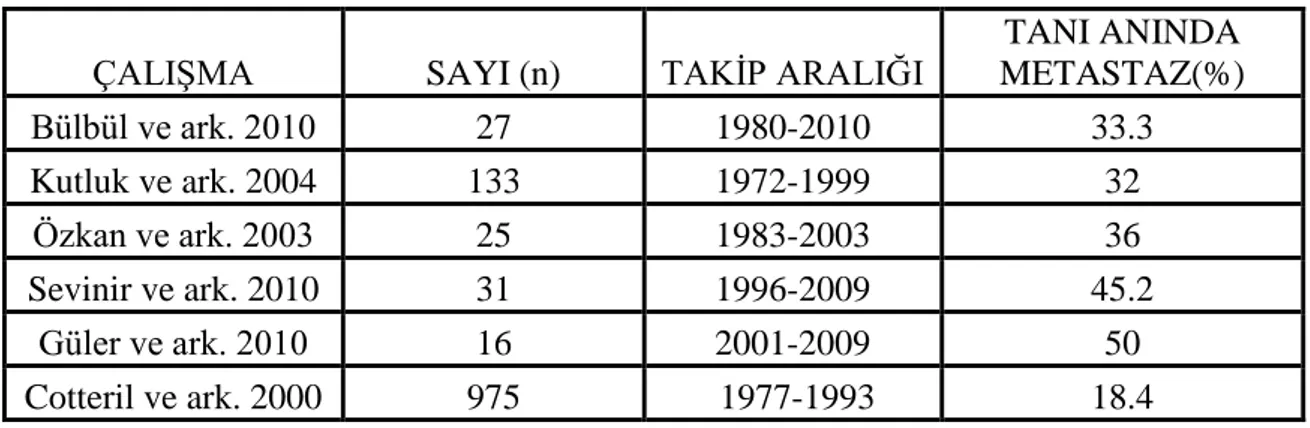
Tablo 14 : Tanı Anında Metastaz Saptanma Oranları
ÇALIŞMA SAYI (n) TAKİP ARALIĞI
TANI ANINDA METASTAZ(%) Bülbül ve ark. 2010 27 1980-2010 33.3 Kutluk ve ark. 2004 133 1972-1999 32 Özkan ve ark. 2003 25 1983-2003 36 Sevinir ve ark. 2010 31 1996-2009 45.2 Güler ve ark. 2010 16 2001-2009 50 Cotteril ve ark. 2000 975 1977-1993 18.4
EE99 (Euro Ewing Intergroup Study 99) primer dissemine multifokal çalışması ek prognostik faktörler ortaya çıkarmıştır. Bunlar: tanı yaşının 14 üzeri olması, tümör hacminin 200 ml üzeri olması, kemik lezyonlarının varlığı ve sayısı, ek pulmoner metastaz ve kemik iliği invazyonudur. Bunlar daha sensitif prognostik faktörler olarak kabul edilmektedir.

![Tablo 4: Yurt Dışı Çalışmalardaki Primer Tümör Lokalizasyonları[25, 27-33]](https://thumb-eu.123doks.com/thumbv2/9libnet/3038940.2722/24.892.225.678.102.495/tablo-yurt-disi-calismalardaki-primer-tumor-lokalizasyonlari.webp)