1
T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
ÇOCUK SAĞLIĞI VE HASTALIKLARI
ANABİLİM DALI
Prof. Dr. Savaş KANSOY
GRAM NEGATİF BAKTERİ ÜREMESİ OLAN
ÜRİNER SİSTEM ENFEKSİYONU TANILI
OLGULARDA
MONOSİT KEMOATRAKTAN PROTEİN-1 VE
RANTES GEN POLİMORFİZMİNİN YERİ VE
GENOTİP-FENOTİP İLİŞKİSİ
Dr. Medine KAHRAMANER UZMANLIK TEZİ
TEZ DANIŞMANI
Prof.Dr. S. Caner KABASAKAL İZMİR – 2016
2 TEŞEKKÜR
Çocuk hekimi olarak yetişmemde büyük katkıları olan, bilgi ve deneyimlerini bana aktaran , başta Anabilim Dalı Başkanı’mız Prof. Dr. Savaş KANSOY olmak üzere kliniğimizin tüm öğretim üyelerine, tez çalışmam süresince tecrübelerinden faydalandığım, bilimsel bilgi ve desteğini benden esirgemeyen tez danışmanım Prof. Dr. S. Caner KABASAKAL’a, tezim ile ilgili sadece laboratuvar çalışmalarında değil tüm aşamalarında bana hep destek olan Prof. Dr. Afig BERDELİ’ye, birlikte çalışmaktan zevk duyduğum uzman doktor ve asistan arkadaşlarıma, sevgi ve destekleriyle sürekli yanımda olan sevgili aileme teşekkürlerimi borç bilirim.
3 İÇİNDEKİLER TEŞEKKÜR ………... I İÇİNDEKİLER………. II TABLOLAR DİZİNİ……… IV ŞEKİLLER DİZİNİ……….. V KISALTMALAR……….. VI 1. GİRİŞ VE AMAÇ………... 1 2. GENEL BİLGİLER………... 3
2.1. ÇOCUKLUK ÇAĞI İDRAR YOLU ENFEKSİYONLARI ……… 3
2.1.1. İdrar Yolu Enfeksiyonu Tanımı ve Sınıflaması ………. 3
2.1.2. Epidemiyoloji ……….. 3
2.1.3. Etyoloji ……….... 4
2.1.4. Risk Faktörleri ………. 5
2.1.5. Patogenez ……… 5
2.1.6. Klinik ve Laboratuvar Bulgular ……… 11
2.1.7. Tanı ……… 13
2.1.8. Tedavi ve Profilaksi ………. 17
2.1.9. Komplikasyonlar ve Prognoz ………...… 19
2.2. İMMÜNİTE VE İDRAR YOLU ENFEKSİYONU ………... 20
2.2.1. Doğal İmmünitenin Çalışma Prensibi ……….. 20
2.2.2. Doğal İmmün Sistem, TLR’ler ve İYE ………. 21
2.2.3. Doğal İmmün Sistem, Kemokinler ve İYE ……….. 25
2.2.3.1. RANTES, MKP-1 ve İYE ……….….. 28
3. GEREÇ VE YÖNTEM ………... 30
4 5. TARTIŞMA………... 48 6. SONUÇLAR………... 57 ÖZET………... 59 İNGİLİZCE ÖZET……….. 60 KAYNAKLAR………... 61
5 TABLOLAR DİZİNİ
Tablo 2.1. İYE tanımları
Tablo 2.2. İYE’na yol açan patojenler Tablo 2.3. İYE için risk faktörleri
Tablo 2.4. İdrar tetkiki bileşenlerinin duyarlılık ve özgüllükleri
Tablo 2.5. İdrar kültürü alınma yöntemi ve koloni sayısına göre idrar yolu enfeksiyonu tanı ölçütleri
Tablo 2.6. Sistitli hastalarda antibiyotik tedavisi
Tablo 2.7. Pyelonefritli hastalarda oral antibiyotik tedavisi Tablo 2.8. Pyelonefritli hastalarda İV antibiyotik tedavisi
Tablo 4.1. Hasta grubunda idrar yolu enfeksiyonuna ait semptomlar Tablo 4.2. İdrar kültüründe üreyen mikroorganizmalar ve sıklıkları
Tablo 4.3. Üst İYE ile alt İYE olan hastaların yaş, BKS, MNS ve CRP değerleri Tablo 4.4. Hasta ve kontrol gruplarında RANTES-403 G>A
Tablo 4.5. Hasta ve kontrol gruplarında RANTES-28 C>G Tablo 4.6. Hasta ve kontrol gruplarında MKP-1-2518 A>G Tablo 4.7. Üst ve alt İYE gruplarında MKP-1-2518A>G
6 ŞEKİLLER DİZİNİ
Şekil 2.1. Asendan yol ile İYE gelişimi
Şekil 2.2. Üriner sistemi koruyan konak faktörleri Şekil 2.3. İYE’nda konak yanıtının patogenezi Şekil 2.4. Renal skar oluşum mekanizması Şekil 2.5. TLR çalışma prensibi
Şekil 2.6. Glomerüler ve tübüler sistemde TLR’lerin yerleşimi
Şekil 2.7. TLR-LPS tanınması ve sonrasındaki aktivasyon mekanizmaları Şekil 2.8. E.coli’nin TLR tarafından tanınması
Şekil 3.1. RANTES -28 C>G heterozigot nükleotit yer değişimi Şekil 4.1. Hasta ve kontrol grubunun cinsiyet dağılımları
Şekil 4.2. Hasta ve kontrol gruplarının yaş ortalamalarının karşılaştırılması Şekil 4.3. Hasta grubunda İYE’na ait bulgular
Şekil 4.4. Hasta grubunda tanı anında BKS ve MNS ortalamaları Şekil 4.5. Hasta grubunda tanı anında CRP değerleri
Şekil 4.6. Hasta grubunda üst ve alt İYE dağılımı Şekil 4.7. Üst İYE ve alt İYE grubunda yaş ortalamaları Şekil 4.8. Üst İYE ve alt İYE grubunda BKS ve MNS Şekil 4.9. Üst İYE ve alt İYE grubunda CRP değerleri
7 KISALTMALAR
BKS: Beyaz küre sayısı CRP: C-reaktif protein
DMSA: Dimerkaptosüksinik asit
DTPA: Dietilen triamin pentaasetik asit ESH: Eritrosit sedimentasyon hızı
GSBL: Genişlemiş spektrumlu beta-laktamaz HİMP: Hasar ilişkili moleküler paternler İDF3: İnterferon düzenleyici faktör 3 İL: İnterlökin
İYE: İdrar yolu enfeksiyonu LE: Lökosit esteraz
LPS: Lipopolisakkarid
MAEPK: Mitojence aktive edilmiş protein kinaz MAG: Merkapto asetil triglisin
MKP: Monosit kemoatraktan protein MNS: Mutlak nötrofil sayısı
MSÜG: Miksiyon sistoüretoerografi NF-κB: Nükleer faktör-kappa B
NLR: NOD-like reseptörler (NOD benzeri reseptörler)
PİMY: Patojen ilişkili moleküler yapı (‘pathogen-associated molecular pattern’) PZR: Polimeraz zincir reaksiyonu
RANTES: ‘Regulated on activation, normal T cells expressed and secreted’ RLR: RIG-like reseptörler (RIG benzeri reseptörler)
8 TMP: Trimetoprim
TLR: Toll-like reseptörler (Toll benzeri reseptörler) US: Ultrasonografi
VÜR: Vezikoüreteral reflü
9 1. GİRİŞ VE AMAÇ
İdrar yolu enfeksiyonu (İYE), çocuklarda üst solunum yolu enfeksiyonlarından sonra en sık karşılaşılan enfeksiyon nedenidir (1). İdrar yolu enfeksiyonu sıklığı, cinsiyete ve yaş grubuna göre değişmektedir. Hayatın ilk bir yılında erkeklerde insidansı yüksekken, diğer tüm yaş gruplarında kızlar İYE geçirmeye daha yatkındırlar (2). İYE’nda en sık görülen etkenler kolon kaynaklı bakteriler, özellikle de E.coli’dir (2). Bunun dışında mantar, parazit, virüs gibi herhangi bir patojen de idrar yollarında kolonize olabilir ve İYE’na neden olabilir. İYE her yaş grubunda görülmesine karşın İYE’ye yatkınlığı arttıran birçok risk faktörü vardır (2). İYE gelişimini etkileyen faktörler konağa ait faktörler veya mikroorganizmaya ait faktörler olabilir. Dolayısıyla idrar yollarına ulaşan her mikroorganizma İYE yapamaz. Bunu engelleyen mekanizmalarda normalden sapmalar olursa bireyler bu hastalıklara daha açık hale gelirler. Yine bu mekanizmalarda olabilecek normalden sapmalar, bireyin o hastalığa karşı normalden daha fazla inflamatuar yanıt vermesine de yol açabilir. Bu yanıt oluşabilecek komplikasyonlar ve özellikle renal skar açısından önemlidir. Çünkü bu süreç içinde son nokta böbrek yetmezliği olmaktadır (3).
Şu ana kadar birçok çalışma İYE pategenezinde yer alan birçok faktörü araştırmıştır. Konağa ait savunma mekanizmaları ve mikroorganizmaya ait virülans faktörleri bunların en bilinenleridir. Son zamanlarda İYE patogenezinde bu mikroorganizmaların idrar yollarına girdikten sonra tanınmalarını sağlayan mekanizmalar, bu tanınmaya yardımcı olan moleküller ve bunlarda olan patolojiler ilgi çeken alan olmaktadır. Bununla bağlantılı olarak mikroorganizmanın tanınma sürecinden sonra ortaya çıkan hücresel düzeyde olan birçok mekanizma da araştırılan diğer konular olmuştur (4).
Doğuştan var olan (innate) immün sistem, patojenlerde ortak olan bir dizi moleküler yapıyı tanıyabilmekte ve böylece konağa ait olan ve olmayanı belirleyerek savunmayı sağlayabilmektedir. Doğal immun sistem, bir dizi reseptör ve bir takım sinyal moleküllerinden
10 oluşur. Doğal immun sistem, mikroorganizmalardaki bazı yapıları tanıyan ve lökositlerde inflamasyon sinyalizasyonunu uyaran Toll benzeri reseptörler (‘Toll-like reseptörler) (TLR), NOD benzeri reseptörler (‘NOD-like reseptörler’) (NLR), RIG benzeri reseptörler (‘RIG-like reseptörler’) (RLR), ve C-tip lektinleri içerir (5). Bu reseptörler aracılığıyla çevreden gelen uyarıları sürekli alır, oluşturduğu sinyaller ile inflamasyonun oluşmasına yol açan hücrelerin o alana göçlerini ve aktivitelerini sağlar (6). Bunu sağlayan aracı moleküller ise kemokinlerdir. Kemokinlerin veya onların reseptörlerinin normal olmadığı veya fonksiyon görmediği durumlar bazı hastalıkların fizyopatolojisinde rol oynamaktadır. Bu nedenle, bu proteinlerin üretilmesini sağlayan genlerde olan polimorfizmler üretilecek proteinin yapısında değişikliğe, bu da normalden daha az fonksiyon gören, normalden daha fazla fonksiyon gören veya hiç fonksiyon görmeyen protein yapılarının ortaya çıkmasına neden olacaktır (7). Yapılan çalışmalar, bir hastanın İYE’na yanıtını tek nükleotid polimorfizmlerinin belirleyebileceğini göstermektedir (7).
Monosit kemoatraktan protein 1 (MCP-1) ve ‘Regulated on activation, normal T cells expressed and secreted’ (RANTES) iki önemli kemokin olup birçok çalışmada inflamatuar süreçte aktif rol aldıkları gösterilmiştir (8). Ancak İYE patogenezinde RANTES ve MCP-1 çok çalışılmış moleküller olmadıklarından bu patogeneze katkıları çok açık değildir.
Bu çalışmamızda, İYE olan olgularda ve sağlıklı bireylerde RANTES-403 G>A, RANTES-28 C>G ve MCP-1-2518 A>G sıklıklarını inceleyerek, bu polimorfizmlerin İYE’na yatkınlık oluşturup oluşturmadığını değerlendirmeyi amaçladık.
11 2. GENEL BİLGİLER
2.1. ÇOCUKLUK ÇAĞI İDRAR YOLU ENFEKSİYONLARI 2.1.1. İdrar Yolu Enfeksiyonu Tanımı ve Sınıflaması
Normalde steril olan posterior üretra, mesane, üreterler, renal pelvis veya böbrek parankiminde; genelde bakterilere bağlı gelişen enfeksiyon İYE olarak tanımlanmaktadır (9). İYE, çocukluk çağında idrar yollarının en sık hastalığıdır (1). Genellikle bakterilerin, daha az sıklıkta mantarların, nadiren virüslerin ve parazitlerin invazyonu sonucu ortaya çıkar.
İdrar yollarının enfeksiyonlarında varolan bulgulara göre farklı tanımlamalar bulunmaktadır. Bunlar; anlamlı bakteriüri, asemptomatik bakteriüri, semptomatik İYE, alt İYE, üst İYE, akut üretral sendrom, rekürren İYE ve İYE relapsı olup, tanımları Tablo 2.1’de sunulmuştur (9).
2.1.2. Epidemiyoloji
İYE, çocuklarda sıktır. Üst solunum yolu enfeksiyonlarından sonra en sık karşılaşılan enfeksiyon nedenlerindendir (1,10). Çocukluk çağında erkeklerin %1’inde, kızların %3-5’inde İYE’ye rastlanmaktadır (11). Ancak İYE sıklığı, cinsiyete ve yaş grubuna göre değişmektedir. Hayatın ilk bir yılında erkeklerde insidansı yüksekken, diğer tüm yaş gruplarında kızlar İYE geçirmeye daha yatkındırlar (2). İlk bir yaşta İYE insidansı için erkek/kız oranı 2,8-5,4/1 iken, bir yaştan sonra bu oran 1/10’dur (12). Bir yaşına kadar İYE insidansı kızlarda %0,7, erkeklerde %2,7’dir (2). Bir ile beş yaş arası çocuklarda yıllık insidans kızlarda %0,9-1,4, erkeklerde %0,1-0,2 arasındadır. Altı ile 16 yaş arası kızlarda yıllık insidans %0,7-2,3 iken erkeklerde insidans %0,04-0,2’dir (2).
12 Anlamlı bakteriüri Bazen genital ya da periüretral floranın bulaşması nedeniyle sağlıklı
kişilerin idrarında da bakteri bulunabilmektedir. Orta akım idrarında 105/mm3 veya sonda ile alınan idrar örneğinde 104/mm3 üzerinde
veya suprapubik aspirasyonla alınan idrar örneğinde tek bir gram negatif mikroorganizma kolonisi üremesi anlamlı bakteriüri olarak değerlendirilir ve İYE için anlamlı olarak kabul edilir.
Asemptomatik bakteriüri Herhangi bir semptom bulunmadan idrar yollarında bakteri
bulunması durumudur. Okul çağındaki kız çocuklarında daha sıktır. Semptomatik İYE Hastada dizüri, sık sık ve zorlanarak idrar yapma, ateş, karın ağrısı
gibi yakınmaların bir veya daha fazlasının idrar örneğinde bakteri ile birlikte bulunmasıdır.
Alt İYE (=Sistit) Mesane mukozasının inflamasyonudur.
Yakınmalar: Ağrılı ve sık idrar yapmadır. Sıklıkla ateş eşlik etmez. Üst İYE (=Piyelonefrit) Renal parankimin inflamasyonudur.
Yakınmalar: Ateş, kusma, karın ağrısı gibi sistemik yakınmalar Akut üretral sendrom İdrarda anlamlı bakteriüri olmaksızın ağrılı idrar yapma, sık idrara
çıkma yakınmalarının olduğu klinik durum
Rekürren İYE Semptomsuz dönemlerle birbirinden ayrılan, tekrarlayan İYE epizodları mevcuttur. Farklı mikroorganizmalar ya da aynı mikroorganizmanın farklı suşları etken olabilir.
İYE relapsı Uygun antibiyotik tedavisine rağmen üriner sistemde aynı tür ve suşta mikroorganizmanın saptanması.
2.1.3. Etyoloji
İYE’nda en sık görülen etkenler kolon kaynaklı bakterilerdir (2). Bunun dışında mantar, parazit, virüs gibi herhangi bir patojen de idrar yollarında kolonize olabilir ve İYE’na neden olabilir. İdrar yolu enfeksiyonuna yol açan patojenler Tablo 2.2’de sunulmuştur (13).
Çocukluk çağında İYE’lerin çoğunluğundan E.coli sorumludur. Ülkemizde yapılmış bir çalışmada yenidoğan sonrası ilk semptomatik İYE’lerin yaklaşık %62’sinde E.coli saptanmıştır (14). E.coli hastane kaynaklı İYE’lerde de ilk sırayı alır. Diğer yaygın gram negatif mikroorganizmalar Klebsiella, Proteus, Enterobacter ve Pseudomonas’tır. Gram pozitif
13 patojenler yenidoğan ve infantlarda, sık olarak görülür. Fungal enfeksiyonlar nadir olmakla birlikte daha çok diyabetik, immunsüpresif, özellikle uzun süre antibiyotik tedavisi almış ve mesane kateterizasyon öyküsü olan hastalarda görülür (13). Candida böbrekte kolonize olarak üreterlerde mantar kümeleri yapar ve tıkanmalar oluşturabilir (13). Nozokomiyal İYE; E.coli,
Candida, Enterococcus, Enterobacter ve Pseudomonas gibi mikroorganizmalar ile meydana
gelir ve tedavisi daha zordur (13). Anaerob bakteriler nadiren İYE nedeni olurlar. Adenovirus gibi viral patojenler sistite neden olabilir. Tüberküloz basili ise kronik üriner sistem enfeksiyonlarına yol açabilir. İYE’nda birden fazla etkenin saptanması kontaminasyon sebebiyle olabilirse de, kronik, rekürren enfeksiyonlarda ve üriner girişimlerden sonra gelişen İYE’larında da birden fazla etken saptanabilir. Üriner sistemde obstrüktif üropati, konjenital anomaliler, nörojenik mesane gibi yapısal bozuklukların eşlik ettiği İYE’lerde en sık etkenler Pseudomonas, Proteus, Entorobacter ve Klebsiella’dır (12,13).
2.1.4. Risk Faktörleri
İYE her yaş grubunda görülmesine karşın var olan risk faktörleri İYE’ye yatkınlığı arttırmaktadır (2). İdrar yolu enfeksiyonunda risk faktörleri Tablo 2.3’te gösterilmiştir (14-17).
2.1.5. Patogenez
Üretranın distal kısmı hariç üriner sistem sterildir. İYE gelişiminde patojenler üriner sisteme üç yolla ulaşmaktadır (10).
- Asendan yol - Hematojen yol - Komşuluk yolu
14 Sık görülenler (Bakteriler)
Gram (-) mikroorganizmalar
E.coli, Klebsiella, Proteus, Pseudomonas aeroginosa, Serratia, Citrobacter, Morganella morganii, Providencia, Gardnerella vaginalis
Gram (+) mikroorganizmalar
Enterecoccus, S.aureus, S.epidermidis, S.fecalis, Grup B Streptococcus
Sık Görülmeyen Diğer Mikroorganizmalar
Ureaplazma urealiticum Chlamidia trochomatis Mycobacterium tuberculosis
Mantarlar (Candida, Coccidioides, Blastomyces)
İYE’larının %99’u asendan yolla oluşmaktadır. İYE etkeni olan mikroorganizmalar sıklıkla perineyi kolonize eden flora bakterileri veya daha çok erişkinlerde ön plana çıkan vajinal rezervuar kaynaklıdır. Bu üropatojenler üriner sisteme girer ve buradan yayılarak ve çoğalarak İYE oluştururlar (Şekil 2.1). Kız çocuklarda, İYE’nin daha sık görülmesi vajinal floranın ve asendan yolun önemini ortaya koymaktadır.Kız çocuklarda, İYE’nin daha sık olmasının en büyük nedeni kızlarda üretranın daha kısa olması ve fekal bulaşma ile asendan enfeksiyonun daha kolay gelişmesidir (10). Yenidoğan döneminde ise bakteriler üriner sisteme daha çok hematojen yolla ulaşır. Daha büyük çocuklarda, İYE hematojen yayılıma bağlı sepsisten sonra oluşur (10). Komşuluk yoluyla İYE gelişmesi, mikroorganizmaların üst üriner sisteme bağırsak fistülü ya da vajinal fistül yolu ile ulaşması sonucunda görülebilir (10).
İdrar yolu enfeksiyonu gelişimini etkileyen faktörler iki başlık altında toplanabilir (18): - Konağa ait faktörler (Şekil 2.2)
- Mikroorganizmaya ait faktörler
Konağa ait faktörler konak savunma mekanizmalarındaki bozukluklar ve konağa ait predispozan faktörlerdir.
15 Kız cinsiyet
Neonatal/ infantil dönem Vezikoüreteral reflü İşeme disfonksiyonu Obstrüktif üropati Nörojenik mesane Anatomik anomaliler Üretral kateterizasyon Konstipasyon Paraziter enfestasyonlar
Fekal ve perineal kolonizasyon P fimbriyalı bakteriler
Genetik faktörler (üroepitelyal reseptörler) İmmun sistemin baskılanması
Antibiyotik kullanımı Yetersiz tuvalet eğitimi
Kızlarda arkadan öne doğru temizlik Sünnetsiz olma
İdrar yollarının distal üretra hariç steril kalabilmesi normal koşullarda bazı konak faktörleri ile sağlanmaktadır. Bu konak faktörleri mekanik, hidrodinamik, antiadherans ve immünolojik faktörlerdir (19,20). Periüretral kolonizasyonun patojen mikroorganizmalara karşı bariyer oluşturması, işemenin yıkayıcı etkisi, idrarın asit pH’sı, idrarda bulunan immünglobulinler, Tamm Horsfall proteini, mukozal polisakkaritler; bakterilerin idrar yollarındaki epitele yapışmasını engelleyen konak savunma mekanizmalarıdır. Bu mekanizmalarda olan herhangi bir bozukluk ve/veya eksiklik, İYE’ye yatkınlığa neden olur (20).
Mesaneye ulaşabilen tüm bakteriler her zaman İYE oluşturamaz. Çünkü İYE oluşturabilmek için mesane kaynaklı savunma mekanizmalarını da yenmeleri gerekir. Bu savunma mekanizmalarının en önemlisi mesanenin periyodik ve tam olarak boşaltılmasıdır. Mesanenin etkin bir şekilde boşaltılması ile sağlıklı bir mesane kendisine ulaşmış olan bakterilerin büyük çoğunluğunu atabilir. İşeme disfonksiyonu olan hastalarda tekrarlayan İYE’nin sık görülmesi de konağa ait bu savunma mekanizmasının varlığını desteklemektedir (21).
16 İdrarın antibakteriyel aktivitesini oluşturan faktörler, idrarın düşük pH’ya sahip olması, yüksek üre konsantrasyonu, yüksek osmolarite ve organik asit içeriği, idrarda glukozun bulunmaması olarak sayılabilir (22).
Şekil 2.1. Asendan yol ile İYE gelişimi
Mesane mukozasının transizyonel epitel hücrelerini örten ince bir mukopolisakkarit tabakanın varlığı ve patojenler için antiadheran bir bariyer oluşturması diğer bir konak koruyucu mekanizmasıdır. Bakterilerin hücre yüzeyindeki reseptörlere bağlanabilmeleri için bu tabakayı geçmesi gerekir (22). Henle kulbunun çıkan kolundan salgılanan Tamm Horsfall proteinleri de benzer mekanizma ile bariyer oluşturmaktadırlar (23). İdrardaki sekretuvar IgA,
17 hücrelerinin periodik olarak dökülmesi de bakterilerin tutundukları yerden ayrılmasına yol açmaktadır (22).
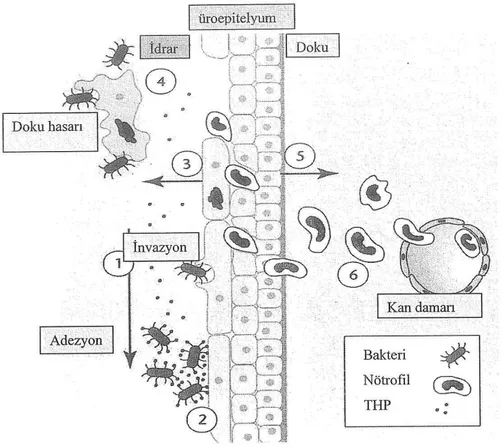
Şekil 2.2. Üriner sistemi koruyan konak faktörleri (1-İdrar akımı, 2-Antiadezyon faktörleri, 3- Antimikrobiyal faktörler, 4-Hücre dökülmesi, 5- Kemokin ve sitokin üretimi, 6- Nötrofiller)
Ayrıca doğal immünitenin kendisi de İYE için koruyucu bir sistem oluşturmaktadır. Son yıllarda yapılan birçok çalışmada TLR’lerin, patojene ait molekülleri hatırlayarak gerekli immun yanıtın aktivasyonunu sağladığı görülmüştür. Çalışmalarda TLR eksikliği oluşturulan farelerde İYE’ye yatkınlığın artmış olduğu saptanmıştır (24,25).
Konağa ait predispozan faktörler içinde en önemlisi vezikoüreteral reflüdür (VÜR). VÜR idrarın mesaneden üreterlere doğru geri kaçması olarak tanımlanmaktadır (26). Sağlıklı bireylerde üreter mesaneye eğimli girer ve mesaneye açılmadan önce submukozal üreter
18 olarak seyreder. Normalde, mesane idrarla dolduğunda submukozal üreter mukoza ve detrüsör kası arasında sıkışır ve basıyla kapanarak idrarın mesaneden üreter ve böbreklere geçişine izin vermez (26). VÜR’lü hastalarda ise bu mekanizmada bozukluk mevcuttur. VÜR’lü hastaların yarıdan fazlası düşük derecelidir (evre I ve II) ve bunların %85 kadarı yıllar içinde kendiliğinden düzelir (26). Yüksek dereceli reflülerin düzelmesi ise daha yavaştır. İYE’de VÜR prevalansı %21-57 arasında değişir ve yaşla birlikte azalır. İYE olan bir çocukta VÜR’ün olup olmadığının saptanması önemlidir; böylece antibiyotik profilaksisi veya cerrahi düzeltme ile yineleyen enfeksiyonlar, buna bağlı gelişebilecek renal skar ve skara bağlı renal yetmezlik önlenebilir (17,27,28). Vezikoüreteral reflü dışında posterior üretral valv gibi doğuştan olan ya da mesane taşları gibi sonradan obstrüksiyona yol açan nedenler, at nalı böbrek, hipoplastik böbrek gibi malformasyonlar ve kateterizasyon da İYE’ye yatkınlığı arttırmaktadır.
Virülans, bir mikroorganizmanın hastalık oluşturma yeteneğine verilen isimdir. İYE oluşturan bakteriler için en önemli virülans faktörü yapışma (adherans) özelliğidir. Bunun dışında bakterilerin yaşaması ve immün sistemden kaçabilmeyi sağlayan faktörler ve toksinler diğer virülans faktörleri olarak yer almaktadır (14). Üropatojenik bakteriler, üroepiteliyal reseptörlere fimbria (H antijeni) denilen pililer aracılığıyla bağlanarak, üriner sistemde ek bir bozukluk olmadan da, daha üst kısımlara ulaşabilirler (27). Örneğin üropatojenik E.coli’ler, P-fimbriaya sahiptirler. Bu P-fimbriyalar, P-fimbriyaya sahip E.coli için idrar yollarındaki epitele tutunmayı sağlayan en önemli virülans faktörüdür. Üropatojenler, uygunsuz çevre ve beslenme koşullarında yaşayabilmek için bazı stratejiler geliştirmişlerdir. Bu koruyucu faktörler arasında, sideroforlar, üreaz ve kapsül en önemlileridir (14). Bakteriler İYE patogenezine katkıda bulunan toksinler salgılamaktadırlar. LPS yapısında olan bu toksinler, sistemik ve lokal immün yanıtı başlatmaktadırlar. Toksin salınımı genellikle enfeksiyonun
19 ilerlemesine ve doku hasarına yol açar (28). İdrar yolu enfeksiyonunda konak yanıtının patogenezi Şekil 2.3’te gösterilmektedir (9).
2.1.6. Klinik ve Laboratuvar Bulgular
Çocuklarda İYE, klinik olarak asemptomatik bakteriüriden komplike pyelonefrite kadar geniş bir spektrum göstermektedir. İYE’nda klinik bulgular çocuğun yaşına, üriner sistemde etkilenen bölgelere ve inflamasyonun şiddetine göre değişmektedir. Örneğin, yenidoğan döneminde yakınmalar belirsizdir. Tartı alımında yavaşlama, ısı dengesinde düzensizlik (hipotermi ya da hipertermi), beslenme güçlüğü, huzursuzluk, kusma, batında distansiyon, tedavi gerektiren ya da uzamış sarılık ilk başvuru yakınması olabilmektedir. Bu dönemde sepsis sıklıkla tabloya eşlik etmektedir. Kan ve idrar kültürlerinden elde edilen mikroorganizmalar bu dönemde %30 oranında benzerlik göstermektedir. Bir yaşın altındaki hastalar genel olarak ateş, huzursuzluk, hasta görünüm, beslenmenin reddedilmesi, kusma ve ishal yakınmaları ile gelirler (9). Buna karşın beş yaşından sonra dizüri, acil işeme hissi, sık idrara çıkma gibi alt üriner sistem bulguları ve kostovertebral açı hassasiyeti daha belirgin hale gelir.
İYE tutulan anatomik bölgelere göre alt İYE ve üst İYE olarak sınıflandırılabilir (9,29). Alt üriner sistem enfeksiyonu, mesane ile sınırlı, böbreğin etkilenmediği, dizüri, pollaküri, acil idrar yapma hissi (urgency) ve bazen suprapubik ağrı ve hassasiyetle seyreden, anlamlı bakteriürinin saptandığı enfeksiyonlardır. Büyük çocuklar ve erişkinlerde dizüri, sık ve ani idrara çıkma, yeni başlayan enürezis, suprapubik ağrı, hassasiyet görülebilir ve pıhtılı idrar yapma, hematüri gibi belirti ve bulgular olabilir. Süt çocukları ve küçük çocuklarda ise halsizlik, kusma ve karın ağrısı gibi özgül olmayan belirtiler mevcuttur. Sistitli hastaların çoğunda piyüri mevcuttur. İdrar kültüründe 105 koloni/ml ve daha fazla mikroorganizma
20 Şekil 2.3. İdrar yolu enfeksiyonunda konak yanıtının patogenezi
Böbrek parankimi veya toplayıcı sistemin enfeksiyonuna ise üst İYE (=pyelonefrit) denir. Piyelonefriti olan hastalarda yüksek ateş, yan ağrısı, kostovertebral açı hassasiyeti bulunur. Daha küçük çocuklarda kusma ve diğer özgül olmayan bulgular ortaya çıkabilir. Üst İYE’de lökositoz, yüksek eritrosit sedimentasyon hızı (ESH) ve/veya artmış C-reaktif protein (CRP) düzeyi saptanır. İdrar mikroskopisinde lökosit silendirleri görülebilir (27). Akut pyelonefrit, çocuklardaki İYE’nin en ciddi şeklidir ve renal skar açısından büyük bir risk oluşturur (32). Böbrek parankimi, bakteri ile karşılaşınca inflamatuar yanıt uyarılır, toksik ürünler ve serbest oksijen radikalleri salınır. Serbest oksijen radikalleri hem bakteri hem de böbrek tübül
21 hücrelerine toksik etki gösterir. Lökositlerin agregasyonu ve ödem sonucunda fokal iskemi, tubulus hücre ölümü, inflamasyonun yayılması ve renal skar ortaya çıkar (10). Piyelonefritin böbreklerde kalıcı hasar bırakabilmesi bakımından tedavisine hızlıca başlanması önemlidir (27).
Piyüri varlığına rağmen idrar kültüründe bakteri üretilememesi steril piyüri olarak adlandırılır. İdrar kültüründe üreme olmaması idrarın steril olduğu anlamına gelmemektedir. Steril piyüri İYE dışında vajinit, kistik renal hastalık, meatal ve üretral irritasyon, dehidratasyon, taş hastalığı, tubulointerstisyel nefrit gibi durumlarda da saptanırken, rutin idrar kültüründe üreyemeyen klamidya, tüberküloz basili, mikoplazma gibi mikroorganizmalar sebebiyle de olabilir (9,10).
2.1.7. Tanı
İYE tanısı uygun şartlarda alınan idrar kültürü ile konur. Ancak idrar kültürünün sonuçlanması zaman alacağından idrar analizi, İYE tanısını destekler nitelikte bilgilerin erken elde edilmesi açısından önemlidir. Erken tanı ya da idrar tetkiki bulguları ve kliniğin birleştirilmesi (yüksek ateş; >38,5°C, kostovertebral açı hassasiyeti, kusma, titreme, letarji, lökositoz, yüksek ESH ve CRP düzeyi ) sonucu yönlenme özellikle skar bırakma olasılığı yüksek olan üst İYE’de erken ampirik tedavi başlama imkanı sağlaması açısından değerlidir. Sistit ise çoğunlukla yüzeyeldir ve sıklıkla inflamatuar yanıt gelişmez (9,29).
İdrar yolu enfeksiyonu tanısında ilk kullanılacak tetkik idrarın mikroskobik incelemesidir. Bunun için orta akım idrarı kullanılır. Örnek santrifüj edildikten sonra, x40 büyütmede değerlendirilir ve her sahada 5’ten fazla lökosit görülmesi piyüri olarak değerlendirilir (33,34). İdrar sedimentinde lökosit silendirlerinin görülmesi patognomonik olmasa da pyelonefriti akla getirmelidir. İdrar mikroskopisinin sensitivitesi düşüktür. İdrar örneğinde lökosit görülmemesi İYE’yi dışlamaz (9).
22 Lökosit esteraz ve nitrit testlerinin duyarlılığı idrarın mikroskobik incelemesinden daha düşük olmasına rağmen, bu üç test birlikte değerlendirildiğinde tanıyı koymada daha etkilidirler. Bu iki testin pozitifliği bakteriüriyi dolaylı olarak gösterir (35). Lökosit esteraz testi aktive lökositlerin lökosit esteraz üretmesine dayanır. Nitrit testi ise nitratların bazı bakteriler tarafından nitritlere indirgenmesi esasına dayanır. Bakterilerin nitratı nitrite dönüştürebilmesi için idrarın mesanede en az 4 saat beklemiş olması gerekir. Bu nedenle nitrit testi için en uygun örnek sabah ilk idrardır (33,34).
İdrar tetkiki bileşenlerinin İYE tanısını saptamada duyarlılık ve özgüllükleri Tablo 2.4’te görülmektedir (33,34,36-38).
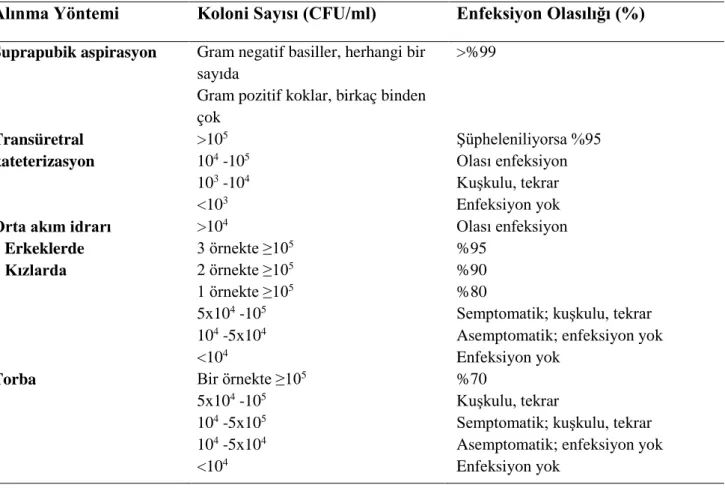
İdrar kültürü İYE tanısında altın standart yöntemdir (39,40). Kültür için örnek alımı farklı şekillerde olabilir:
- idrar torbası - kateter
- suprapubik aspirasyon - orta akım idrarı
İYE tanısında idrar kültürü kriterleri Tablo 2.5’te özetlenmiştir (36,38,41).
İdrar yolu enfeksiyonu geçiren hastalarda mevcut durumun değerlendirilmesi, olası komplikasyonların saptanması amacıyla ek tetkikler de endikasyonlar dahilinde yapılır. İYE geçiren çocuklarda görüntüleme yöntemlerinin hedefi enfeksiyon gelişimini kolaylaştıran anatomik bozuklukları ve ilerleyici böbrek hasarı açısından risk altındaki hastaları saptamaktır. Bunlardan ultrasonografi (USG), miksiyon sistoüretoerografi (MSÜG), DMSA-renal kortikal statik sintigrafi en sık kullanılan yöntemlerdir (42).
23 Tablo 2.4. İdrar tetkiki bileşenlerinin duyarlılık ve özgüllükleri
Duyarlılık (%) Özgüllük (%)
LE 83 (67-94) 78 (64-92)
Nitrit 53 (15-82) 98 (90-100)
LE veya nitrit pozitifliği 93 (90-100) 72 (58-91)
Piyüri 73 (32-100) 81 (45-98)
Bakteriüri 81 (16-99) 83 (11-100)
LE veya nitrit veya
mikroskopi pozitifliği 99 (99-100) 70 (60-92)
LE: Lökosit esteraz
USG en sık kullanılan görüntüleme yöntemlerindendir. Üriner USG, invaziv bir yöntem değildir, iyonize radyasyon içermez, ucuz ve kolay uygulanabilir. Renal yapısal anomali, böbrek büyüklükleri, ekojeniteleri, parankim kalınlıkları ve konturları, üreteral dilatasyon ve duplikasyon, üriner sistem taşları, işeme sonrası kalan idrar miktarı, mesane duvar kalınlıkları ve trabekülasyonu hakkında bilgi verir. Buna karşın böbrek fonksiyonları konusunda fikir vermemesi, uygulayan kişiye bağımlı olması ve sonuçların geriye dönük olarak yeniden değerlendirilememesi eksik yanlarıdır (11,43).
MSÜG alt üriner sistemin anatomisi hakkında (mesane yapısı ve posterior uretral valv gibi anomaliler) bilgi verir. VÜR’yü saptamada faydalıdır. USG düşük dereceli VÜR’ü göstermede yetersizdir (44).
Nükleer görüntüleme yöntemlerinden olan 99Tc DMSA sintigrafisi renal korteksi en iyi görüntüleyen radyofarmosötik maddedir. Tubuler fonksiyonlar hakkında bilgi vermez. Akut pyelonefritte renal parankimde radyoizotop tutulumu fokal ya da diffüz olarak azalır. Renal skarda ise kortekste volüm kaybı görülür (45). DMSA sintigrafisi böbrekteki skarı gösteren en duyarlı tetkiktir (46).
24 Teknesyum 99m dietilen triamin pentaasetik asit (DTPA) glomeruler filtrasyonla atılan radyonüklid ajandır. Sadece glomeruler filtrasyonla atıldığından, dolaylı şekilde glomeruler filtrasyon hızının ölçülmesi de mümkün olur. Bu yöntemle parankim içi lezyonlar çok iyi görülmezler (46). Teknesyum 99m merkapto asetil triglisin 3 (MAG3) son olarak geliştirilmiş tubüler bir ajandır. Teknesyum 99m MAG3 sintigrafisi, diüretikli veya diüretiksiz olarak böbrek işlev bozukluğunun saptanmasında yararlıdır (46).
Kontrastlı bilgisayarlı tomografi ya da manyetik rezonans ürografi fokal bakteriyel nefrit, komplike piyelonefrit gibi intrarenal ve perirenal enfeksiyonları değerlendirmede ve USG’de tam olarak tanımlanamamış anormalliklerde cerrahi tedavi planlanan hasta grubunda anatomik detay elde etmede faydalıdır (46).
Tablo 2.5. İdrar kültürü alınma yöntemi ve koloni sayısına göre İYE tanı ölçütleri
Alınma Yöntemi Koloni Sayısı (CFU/ml) Enfeksiyon Olasılığı (%) Suprapubik aspirasyon Gram negatif basiller, herhangi bir
sayıda
Gram pozitif koklar, birkaç binden çok >%99 Transüretral kateterizasyon >105 104 -105 103 -104 <103 Şüpheleniliyorsa %95 Olası enfeksiyon Kuşkulu, tekrar Enfeksiyon yok Orta akım idrarı
Erkeklerde Kızlarda >104 3 örnekte ≥105 2 örnekte ≥105 1 örnekte ≥105 5x104 -105 104 -5x104 <104 Olası enfeksiyon %95 %90 %80
Semptomatik; kuşkulu, tekrar Asemptomatik; enfeksiyon yok Enfeksiyon yok
Torba Bir örnekte ≥105
5x104 -105 104 -5x105 104 -5x104 <104 %70 Kuşkulu, tekrar
Semptomatik; kuşkulu, tekrar Asemptomatik; enfeksiyon yok Enfeksiyon yok
25 2.1.8. Tedavi ve Profilaksi
İYE varlığında veya sebebi açıklanamayan ateşi olan küçük çocuklarda idrar analizi ve idrar kültürü ile İYE saptanması durumunda gecikilmeden antimikrobiyal tedaviye başlanılmalıdır. Yapılan bir çalışmada akut pyelonefrit tedavisinde iki günden fazla gecikmenin parankim zedelenmesini, dört günden fazla gecikmenin ise renal skar oluşumunu arttırdığı gösterilmiştir (47).
İYE tedavisinde çocuğun yaşı ve hastalığın şiddetine göre yaklaşım farklılıkları mevcuttur. Genel yaklaşım, istisnalar olmakla birlikte üç ay altı İYE tanılı hastaların hastaneye yatırılarak tedavi edilmesi, daha büyük yaştaki İYE tanılı hastaların ise hastanın genel durumu ve enfeksiyonun komplike olup olmadığına bakılarak hospitalizasyona karar verilmesi şeklindedir (9). Komplike olmayan İYE olan çocuklarda ise ateş olabilir fakat toksik görünüm ve dehidratasyon yoktur ya da hafiftir. Bu hastalar oral sıvı ve ilaçları alabilir, tolere edebilir. Komplike İYE olan çocuklarda ise yüksek ateş, toksik görünüm, kusma, dehidratasyon ve huzursuzluk mevcuttur (9).
İYE varlığında şu durumlarda hospitalizasyon ve geniş spektrumlu antibiyoterapi başlama endikasyonları mevcuttur (9):
- İki-üç ayın altındaki bebekler - Oral alımı tolere edemeyen hastalar - Sistemik enfeksiyon bulguları olması - İmmun yetmezlik durumunun olması
Ampirik antibiyotik seçiminde yerel direnç oranları, E.coli’nin en sık patojen olduğu göz önüne alıınarak tedaviye başlanmalıdır. Uygun tedavi ile ateş ve diğer klinik bulgular 2-3 günde düzelir, idrar 24-48 saat içinde steril hale gelir, pyüri ise 3-4 günde kaybolur. CRP 4-5 günde, ESH 2-3 haftada normal sınırlara gerilerken, idrar konsantrasyon defekti ise 2-3 ayda düzelir (9). Tedavinin başlanması ile 48 saatte klinik olarak yanıt yoksa hastadan tekrar kültür
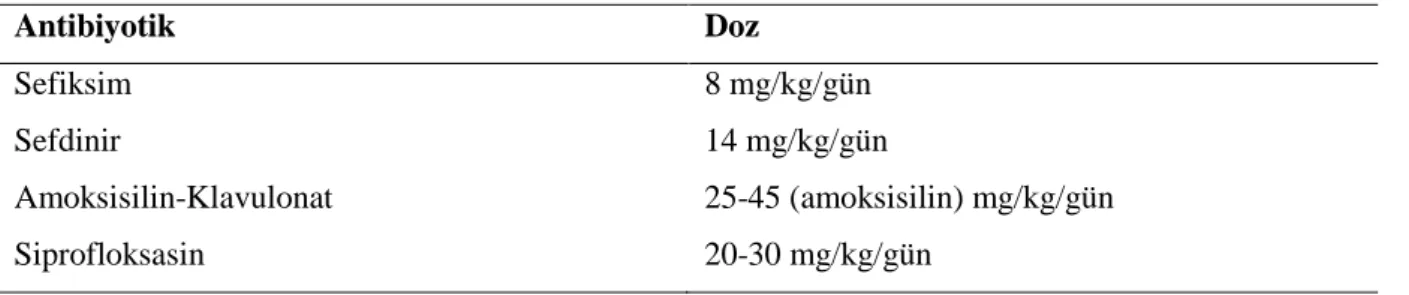
26 alınmalıdır. Tedavi başlanması ile 24-48 saat içinde USG ve 4-6 hafta sonra MSÜG yapılması planlanır. Tablo2.6, 2.7 ve 2.8’de alt ve üst İYE tedavisinde kullanılan ilaçlar görülmektedir (48).
Tablo 2.6. Sistitli hastalarda antibiyotik tedavisi
Antibiyotik Doz Trimetoprim (TMP)/Sulfometoksazol 8 mg (TMP)/kg/gün Nitrofurantoin 5-7 mg/kg/gün Amoksisilin 25-45 mg/kg/gün Amoksisilin-Klavulonat 25-45 (amoksisilin) mg/kg/gün Sefaleksin 20-50 mg/kg/gün Sefiksim 8 mg/kg/gün
Tekrarlayan İYE geçirenler, VÜR’sü olan çocuklar, kısmi obstrüksiyonu olan veya anatomik bozukluklara sahip hastalar ile immunsupresif tedavi alan ya da immun yetmezliği olan hastalarda antibiyotik proflaksisi başlanması önerilmektedir (35). Tekrarlayan İYE’nin tedavisi hastanın yaşına, semptomların şiddetine, altta yatan anatomik bozukluk olup olmamasına göre farklılıklar gösterir. Tekrarlayan İYE’na yol açan predispozan faktörlerin bilinmediği hastalarda profilaktik antibiyotik kullanımı ile İYE sıklığı azalmakta ancak ilaç kesildikten sonra tekrar aynı duruma dönmektedir (49). Profilakside kullanılan antibiyotik dozu tedavide kullanılan dozun 1/2-1/4‘ü olarak ayarlanmaktadır. Profilakside kullanılan ajanlar nitrofurantion, sefaleksin, ampisilin, amoksisilin ve trimetoprim-sülfometoksazoldür.
27 Tablo 2.7. Pyelonefritli hastalarda oral antibiyotik tedavisi
Antibiyotik Doz
Sefiksim 8 mg/kg/gün
Sefdinir 14 mg/kg/gün
Amoksisilin-Klavulonat 25-45 (amoksisilin) mg/kg/gün
Siprofloksasin 20-30 mg/kg/gün
Tablo 2.8. Pyelonefritli hastalarda İV antibiyotik tedavisi
Antibiyotik Doz Ampisilin 100 mg/kg/gün Sefotaksim 100-200 mg/kg/gün Seftriakson 50-100 mg/kg/gün Sefepim 100 mg/kg/gün Gentamisin 7,5 mg/kg/gün 2.1.9. Komplikasyonlar ve Prognoz
Akut piyelonefrit geçiren çocukların %15-52’sinde, ilerleyen dönemde renal skar gelişir (50,51). Yineleyen İYE ile birlikte VÜR ya da obstrüktif idrar yolu anomalileri, E.coli dışındaki bakterilerin neden olduğu İYE’ler, yenidoğan ve infant döneminde İYE geçirme ve tedavide gecikme skar oluşumu için risk faktörleridir (2). Skar oluşumunda patogenez net bilinmemekle birlikte sorumlu faktörler bilinmektedir (Şekil 2.4) (52). Tek yanlı böbrek hasarı olan çocukların diğer böbreklerinde kompensatuvar hipertrofi vardır ve glomerüler filtrasyon hızı normal sınırlar içinde kalır. Çift yanlı böbrek hasarı olan çocuklarda glomerüler filtrasyon hızı çoğu kez azalır, kronik böbrek yetmezliğine gidiş saptanır (9). Geçirilmiş İYE’larına bağlı olarak erişkin dönemde hipertansiyon riski %7-17 arasında değişmektedir (9).
28 Şekil 2.4. Renal skar oluşum mekanizması
2.2. İMMÜNİTE VE İYE
2.2.1. Doğal İmmünitenin Çalışma Prensibi
Adaptif immün sistemin, antijen tanıma kapasitesi çok geniş bir reseptör repertuarıyla özgüllüğü sağlarken, doğal immün sistem patojenlerde ortak olan bir dizi moleküler yapıyı tanıyabilmekte ve böylece konağa ait olan ve olmayanı belirleyerek savunmayı sağlayabilmektedir (53).
Doğal immün sistem; bir dizi reseptör ve bir takım sinyal moleküllerinden oluşur. Öncül formdaki ligandlara karşı immun yanıtı başlatır. Doğal immün sistem, mikroorganizmalara ait yapıları tanıyan ve lökositlerde inflamasyon sinyalizasyonunu uyaran TLR, NLR, RLR, ve C-tip lektinleri içerir (54). Bu reseptörler aracılığıyla, çevreden gelen uyarıları sürekli alır, kendi yapılarını tanır ve allerjik ve otoimmun yanıtlar ile organ naklinde red mekanizmasında
29 olduğu gibi kendinden olmayan yapıların ayrımını sağlar, ayrıca hasarlanmaya yanıt olarak doku iyileşmesini ve onarımını düzenler (55).
Mukozal doğal immun sistemdeki reseptörlerin tanıdığı ligandlar iki gruba ayrılır: hasar ilişkili moleküler paternler (HİMP) ve patojen ilişkili moleküler yapı (‘pathogen-associated molecular pattern’) (PİMY). PİMY’lar korunmuş mikrobiyal ve viral yapılardır. Üriner sistemde, PİMY’ların epitelyal yüzeydeki reseptörlerce tanınması sonrası çeşitli sinyal yolakları aktifleşir ve antibakteriyel peptidler ve kemokinler salgılanır. Kemokinler hızlıca inflamatuar hücrelerin dolaşımdan mukozaya göçüne ve enfeksiyon bölgesinde toplanmasına neden olur. Özellikle nötrofiller antibakteriyel savunmada etkin hücreler olarak görev alır. Bu süreç ve bakterinin eliminasyonu kemokin reseptör ekspresyonu ile kontrol edilir (56).
Doğal immün sistem hücreleri üzerinde PİMY’ları tanıyan reseptörlere de yapıları tanıyan reseptörler (‘Pattern Recognition Receptor’) (YTR) adı verilmektedir (57). Bu YTR’ler endositik, sekrete edilen ve sinyal iletenler olmak üzere üç grupta incelenmektedir. TLR ailesi bu gruplar içinde sinyal ileten grupta yer almaktadır (57). Şu ana kadar tanımlanmış çok sayıda TLR vardır. Her birinin geni farklı kromozomlar üzerinde bulunmaktadır (58).
2.2.2. Doğal İmmün Sistem, TLR’ler ve İYE
Her bir TLR, mikroorganizmalar üzerindeki farklı yapılara yanıt vermektedir. Örneğin, TLR2 gram pozitif bakterilerin peptidoglikan kısmını tanırken, TLR4 gram negatif bakterilerin lipopoliskkarid yapısını tanımaktadır. Bu reseptörler aynı yapının farklı antijenlerine bağlanarak farklı birçok sonucun oluşmasına yol açarlar (Şekil 2.5) (59).
Mukozal epitel yüzeyinde bulunan TLR’ler bakteriyel komponentlerin tanınmasında ve çeşitli intrasellüler sinyal yolakları ile yönlendirilen inflamatuar yanıtın başlamasında görev alır. Bu reseptörler PİMY’ları tanırlar ve proinflamatuar sitokinler ve kemokinlerin ekspresyonunu düzenleyen transkripsiyon faktörlerinin aktivasyonu yoluyla sinyal iletim yollarına aracılık
30 ederler. Bu yanıt patojenik ajanlara karşı savunmada ilk basamaktır ve antijen spesifik T hücrelerinin ve B hücrelerinin aracılık ettiği edinsel immun yanıtın gelişebilmesi için gereklidir (60).
Şekil 2.5. TLR çalışma prensibi
TLR’ler lökositler (TLR1, TLR2), periferik kandaki monositler (TLR2, TLR4), eritrositler, makrofajlar, immatür dendritik hücreler, NK hücreleri, T ve B lenfositler (TLR7, TLR9, TLR10) ve ayrıca doku hücreleri (pulmoner hücreler, intestinal hücreler, böbrek ve mesane epitelyal hücreleri, mezangial hücreler) üzerinde bulunur (61).
TLR’ler organizmada birçok yerde olduğu gibi idrar yolları mukozasında da patojenleri immün sisteme ilk tanıtan yapılar olarak yer almaktadır. Böbrek hücre kültürlerinde, TLR mRNA salınımı olduğu ve lokalizasyonu tespit edilmiştir. Renal dokuda eksprese edilen TLR’lerin glomerül içinde ve tubuler epitelyal hücrelerde yaygın olarak bulunduğu düşünülmektedir (62) (Şekil 2.6).
31 Şekil 2.6. Glomerüler ve tübüler sistemde TLR’lerin yerleşimi
TLR4 gram negatif bakteri LPS’i için başlıca reseptördür. LPS’in TLR4 tarafından algılanması için CD14 ve MD2 gereklidir. CD14; TLR4 ve LPS arasındaki sinyal iletiminde görev alır. MD2 ise TLR4’ün ekstrasellüler kısmı ile ilişkilidir ve LPS ile indüklenmiş hücre aktivasyonunu artırır (62). TLR4’ün patojeni tanıması sonrası Toll benzeri/interlökin 1 reseptörü (TIR) parçası aracılığıyla MyD88 ekspresyonu uyarılır, MyD88 artışı mitojence aktive edilmiş protein kinazların (MAEPK) ve bir transkripsiyon faktörü olan nükleer faktör-kappa B’nin (NF-κB) aktivasyonuna yol açar. MAEPK’lar ve transkripsiyon faktörü olan interferon düzenleyici faktör 3 (İDF3) aktivasyonu ile hücre düzeyinde transkripsiyon faktörlerinin sentezi başlar (63) (Şekil 2.7).
32 Şekil 2.7. TLR-LPS tanınması ve sonrasındaki aktivasyon mekanizmaları
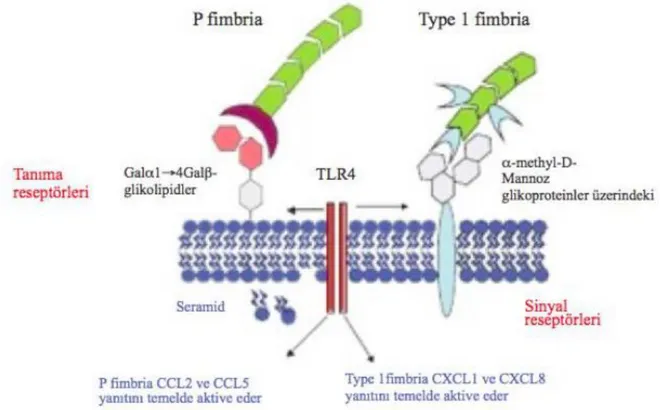
Akut piyelonefritte, virulan üropatojenik E.coli suşları Tip 1 fimbriaları ile LPS aracılığıyla TLR4 aktivasyonunu sağlayarak MyD88 yoluyla İL-1 ve İL-8 salınımına neden olurken, P fimbriaları ile TLR4’ü aktive ederek adaptör proteinler TRIF ve TRAM aracılığıyla CCL2 (MCP-1) ve CCL5 (RANTES) salınımını uyarır (56) (Şekil 2.8). Buradan da görüldüğü üzere doğal immün sistemin bir parçası olan TLR ve onların uyarmaları sonucu ortaya çıkan kemokinler bir dizi ortak yolu ve sonuçları paylaşmaktadırlar.
Karoly ve ark. tarafından yapılan bir çalışmada TLR4 geni 896G alleli ve 896AG genotipi İYE hastalarında kontrol grubuna göre daha yüksek oranda gözlenmiştir. Bunun yanısıra 896G alleli ve 896AG genotipinin VÜR saptanmamış tekrarlayan İYE geçiren hastalarda, VÜR’sü olan tekrarlayan İYE hastalarına oranla daha sık olduğu bulunmuş ve bu genotip ve
33 allel tekrarlayan İYE ile ilişkilendirilmiştir (64). Buna karşın Hawn ve ark.’nın çalışmasında tekrarlayan İYE geçiren 431 erişkin hastada TLR4-896AG ve GG genotipi ve 896G allelinin tekrarlayan İYE’den korunma ile ilişkili olduğu tespit edilmiştir (65).
Şekil 2.8. E.coli’nin TLR tarafından tanınması
2.2.3. Doğal İmmün Sistem, Kemokinler ve İYE
Doğal immünitenin diğer bir elemanı da kemokinler ve onların resptörleridir. İnflamasyonda ve infeksiyonlara karşı konakçı yanıtında lökositlerin dokulara yerleşimi önemli bir basamağı oluşturmaktadır. Bu süreç kemotaktik sitokinler olarak bilinen kemokinler tarafından kontrol edilmektedir. Kemokinler, N-terminalde sistein rezidüler içeren düşük molekül ağırlıklı geniş bir protein ailesinin üyesidirler. Kemokinlerin organizmada gerçekleşen birçok biyolojik süreçte önemli rolleri bulunmaktadır. Kemokinlerin görevleri (66):
34 - Migratuar hücrelerin aktive olmalarını sağlamak.
- T ve B hücre iletişiminde ve primer immün yanıtın oluşmasında rol almak
İnsan vücudunda faaliyet gösteren birçok kemokin bulunmaktadır. Bugüne kadar yapılan çalışmalarda insanlarda yaklaşık olarak 50 kadar kemokin molekülü ve 20’den fazla kemokin reseptörü tanımlanmıştır. Temel olarak kemokinler 4 gruba ayrılmış olsa da görevleri ayrıntılarıyla belirlenmiş 2 temel grup bulunmaktadır. Bunlar alfa ve beta kemokin gruplarıdır. Alfa kemokinlerde, iki sistein rezidüsü tek bir aminoasit (X) tarafından ayrılmış durumdadır (Sistein-X aminoasidi- Sistein). Bu grup CXC kemokin olarak adlandırılır. Buna karşılık beta kemokinlerde, ilk iki sistein rezidüsü birbiriyle yan yana bulunur (Sistein- Sistein). Bu grup kemokinler CC kemokin olarak sınıflandırılır. Diğer iki grup ise C ve CX3C
kemokin gruplarıdır (67).
CC kemokinler 3 temel kemokinden oluşur. CCL2 (MCP-1), CCL4 (MIP-beta) ve CCL5 (RANTES). Her üç kemokin de T hücre, nötrofil ve monositlerin ilgili alana göçünü uyarır ve onların aktive olmalarına yol açar (67).
CXC kemokinler ise 2 gruba ayrılır. ELR içerenler ve ELR içermeyenler. ELR içerenler nötrofillerin aktivasyonunda görev alırlar. Bunlar; CXCL1 (GRO alfa), CXCL3 (GRO gama), CXCL5 (ENA-78), CXCL8’dir. ELR içermeyenlerin ise, nötrofil aktivasyonları çok zayıftır, buna karşılık NK ve T hücre migrasyonunun sağlanmasında ve aktivasyonlarında yer alırlar. Bunlar; CXCL9 (Mig), CXCL10 (IP-10)’dur (67).
Kemokin genleri spesifik lokuslarda yer almaktadır. CC kemokin genleri 17q11.2-12 ve CXC kemokin genleri de 4q13 lokusunda bulunurlar (67).
Tüm kemokin reseptörleri membran bağımlı moleküllerdir. Sadece membrana bağlı olarak eksprese olurlar ve G proteinleriyle ilişki içindedirler. Her bir kemokinin bir veya daha fazla reseptörü, aynı şekilde her bir kemokin reseptörünün de bir veya daha fazla ligandı bulunmaktadır. Örneğin; CCR5, RANTES, makrofaj inflamatuvar protein için reseptör olarak
35 görev yaparken; RANTES, CCR5 yanında CCR1 ve CCR3 adlı reseptörlere de bağlanabilir. Her ne kadar bir kemokin reseptörü birden fazla kemokine bağlanma özelliğine sahipse de, CC kemokin reseptörleri sadece CC kemokinlerine ve CXC kemokin reseptörleri de sadece CXC kemokinlerine bağlanmaktadır. Kemokin reseptörleri farklı tipteki lökositler üzerinde eksprese olmaktadırlar. Bazı reseptörler hücrelere sıkıca bağlıdırlar. Örneğin; CXCR1 resepörü sadece nötrofiller üzerinde bulunur. Buna karşılık diğerleri geniş olarak diğer tüm hücrelerde eksprese olmaktadırlar. Örneğin; CCR2 reseptörü hem monositler, hem T, NK, dendritik hücreler ve bazofiller üzerinde eksprese olmaktadır (66).
Bazı kemokin reseptörleri nöronlar, astrositler, epitelyal hücreler ve endotelyal hücreler gibi non-hematopoetik hücreler üzerinde eksprese olmaktadırlar. Bu bilgiler kemokin sisteminin lökosit kemotaksisi dışında diğer önemli görevlerinin de bulunduğunu göstermektedir (66). İnflamasyon boyunca kemokinlerin sekresyonunda bir artış olur. Kemokin üretimi için en önemli uyarı İL-1, tümör nekrozis faktör-α gibi erken proinflamatuar sitokinlerdir (66). İnflamasyonda birçok dokuda (beyin, deri, eklem, akciğer, kan damarları, böbrek) kemokinlerin varlığı tespit edilmiştir. Kemokin moleküllerinin sentezlenmesi ve ortama salınması sonucu bu kemokinler ilgili reseptörleriyle birleşerek bir dizi olayın meydana gelmesini sağlamaktadırlar. Kemokin reseptör aktivasyonu hücresel aktivasyon sinyallerinin başlamasına yol açar. Bunun sonucu olarak ilk başta, intrasellüler kalsiyum açığa çıkar ve bu olay protein kinaz C’nin aktivasyonu ile sonuçlanır (68).
Mekanizma birlikte değerlendirildiğinde ateş ve akut faz reaktanları yüksekliği olan ve üst İYE düşünülen bir hastada lokal konak savunma sisteminin bir parçası olan kemokinlerin inflamasyon sırasında miktarlarının saptanması inflamasyonun boyutu hakkında yararlı bilgi verebilir. Aynı şekilde, bu mekanizma içinde var olan moleküllerin gen ekspresyonlarındaki değişikler de bu hastaların İYE’na yatkınlıklarını veya oluşan İYE’nin ağırlığının saptanmasını sağlayabilir (69).
36 İYE’lerde mukozal kemokin yanıtının varlığı çalışmalarla gösterilmiştir. Örneğin semptomatik ve ateşli İYE olan hastalarda CXCL8 düzeyleri hem serum hem de idrarda yüksek saptanırken, nedeni bilinmeyen ateşle takip edilen hastalarda ise düşük bulunmuştur (70). Bu da saptanan bulgunun ateşe değil İYE’ye spesifik olduğunu göstermektedir. Ürosepsisli hastalarda yapılan çalışmada ise hem CC hem de CXC kemokinlerinin yüksek olduğu saptanmıştır (70-72).
Kemokin reseptörlerinin normal olmadığı veya fonksiyon görmediği durumlar bazı hastalıkların fizyopatolojisinde rol oynamaktadır. Bu nedenle, bu proteinlerin üretilmesi daha doğrusu bilgiyi vererek kodlanmasını sağlayan gen bölgeleri önem kazanmaktadır. Bu reseptör gen yapısında veya ligandı kodlayan gen bölgesinde olabilecek polimorfizmler, üretilecek proteinin yapısında değişikliğe yol açarak normalden daha az fonksiyon gören, normalden daha fazla fonksiyon gören veya hiç fonksiyon görmeyen protein yapılarının ortaya çıkmasına neden olacaktır. Yapılan çalışmalar, bir hastanın İYE’na yanıtını tek nükleotid polimorfizmlerinin belirleyebileceğini göstermektedir (7).
2.2.3.1. RANTES, MCP-1 ve İYE
RANTES, çeşitli proinflamatuar hücre tiplerini aktive etme yeteneğine sahip olan kemokinlerden biridir (73). RANTES, 68 aminoasitlik küçük bir proteindir. Lökosit göçünü, 7 transmembran G proteini olan spesifik reseptörlerine bağlanarak indüklemektedir. Bu reseptörlerin başlıcaları CCR1, CCR3, CCR4 ve CCR5’dir (74). RANTES, in vitro ortamında T hücrelerinin kemotaksisini ve aktive olmasını sağlar ama nötrofillere etki etmez (75). RANTES; T lenfositler, monositler, bazofiller ve NK hücreleri arasında farklı kemokin reseptörleri vasıtasıyla ilişki kuran kemokindir. RANTES aynı zamanda karaciğer ve böbrek hücrelerinde de reseptörleri bulunan kemoatraktan bir kemokindir. Ayrıca dentritik hücreler ve mast hücreleri üzerinde belirgin etkileri mevcuttur. CD+8 T hücreler, epitelyal hücreler,
37 fibroblastlar ve trombositler tarafından dominant olarak salınımı artırılan RANTES’in kendisi de belirli konsantrasyondan sonra inflamasyonun bir parçası haline gelmektedir (74). Transplant rejeksiyonu, ateroskleroz, artrit, atopik dermatit, astım, kronik bronşit, gecikmiş tip hipersensitivite reaksiyonları, glomerulonefritler, endometriozis, Alzheimer hastalığı ve bazı malignitelerde RANTES’in rolü bulunmaktadır. Tüm bu patolojilerde RANTES inflamasyon alanına lökositlerin akışını başlatmakta ve artırmaktadır.(74,76) Bir çalışmada RANTES’te saptanan polimorfizmin artmış RANTES transkripsiyonu dolayısıyla ile artmış RANTES ilişkili inflamatuar cevapla sonuçlandığı görülmüştür (77).
MCP-1, diğer adıyla CCL2 veya MCAF (monosit/makrofaj kemotaktik ve aktifleyici faktör) , CC kemokin ailesine ait 76 aminoasit içeren 8,6 kDa’luk diğer bir kemokindir. RANTES’te olduğu gibi T hücre ve monositlerin inflamasyon alanına olan göçlerine ve onların aktifleşmelerine aracılık eden bir yapıdır. Her iki hücre grubunu etkilese de adından da anlaşılacağı üzere esas etkilediği hücre monositlerdir. 1’in reseptörü CCR2’dir. MCP-1’in geninde meydana gelebilecek polimorfizmler de aynı RANTES’te olduğu gibi, bu kemokinin transkripsiyonunu etkileyerek inflamatuar yanıtın değişmesine yol açabilir (77).
38 3. GEREÇ VE YÖNTEM
Bu çalışmaya, 104 İYE olan hasta (hasta grubu) ve 100 sağlıklı gönüllü olgu (kontrol grubu) dahil edildi.
3. 1. Hasta ve kontrol gruplarının oluşturulması
Hasta grubuna; genel poliklinik ve acil servise başvuran, herhangi bir yaş grubunda olan, geçmişte idrar yolu enfeksiyonu geçirme öyküsü bulunan ve başvuru zamanı idrar kültüründe gram negatif üremesi olan hastalar dahil edildi. Çalışma dahilinde istenmesi planlanan tetkiklerinde eksiklikler olanlar, saptanmış üriner sistemle ilgili anatomik veya fonksiyonel defekte sahip olanlar, enfeksiyona yatkınlık oluşturma özelliği olan hastalık tanısı almış olanlar ile kronik hastalık, önceden konstipasyon ve enürezis bildirenler çalışma dışı bırakıldı. Kontrol grubu ise; idrar yolu enfeksiyonu öyküsü ve kronik hastalığı olmayan, birinci derece akrabalarında idrar yolu enfeksiyonu öyküsü bulunmayan, genel çocuk polikliniğine enfeksiyon harici herhangi bir nedenle başvurmuş, hasta grubu ile benzer yaş ve cinsiyete sahip olgulardan oluşturuldu. Kronik hastalık öyküsü olan, kronik vasıfta ilaç kullanım öyküsü olan, enfeksiyon tablosu olan hastalar çalışma dışı bırakıldı. Hasta grubu üst ve alt İYE olmak üzere iki gruba ayrılarak değerlendirildi (9,29).
3.2. Onam
Bu çalışma için Ege Üniversitesi Tıp Fakültesi Yerel Etik Kurulu’ndan onay alındı. Çalışmaya dahil edilen hasta grubu ve kontrol grubu hastalar onamları alınmasından sonra çalışmaya dahil edildi.
39 3.3. Olgu rapor formları
Hasta ve kontrol grupları için olgu rapor formları dolduruldu.
Hasta olgu rapor formlarında demografik veriler (doğum tarihi, cinsiyet), üriner sistem anatomik defektinin varlığı ile ilgili bilgiler, saptanan yakınmaları, fizik muayene bulguları, idrar bilgileri, idrar kültürü ile ilgili bilgiler (idrar kültürünün alınma şekli, idrar kültüründe üreyen mikroorganizma), renal USG, DMSA ve MSÜG bilgilerini içermekteydi.
Kontrol gruplarının olgu rapor formlarında demografik veriler (doğum tarihi, cinsiyet) ve medikal özgeçmişleriyle ilgili bilgiler (geçirilmiş İYE öyküsü, kronik hastalık öyküsü vb) yer almaktaydı.
3.4. Laboratuvar tetkikleri
Hasta grubundan, hemogram, üre, kreatinin, CRP için kan örneği ve tam idrar tetkiki ve idrar kültürü alındı. Hasta grubunda bu tetkiklere ek olarak ve kontrol grubundaki tüm hastalardan 2 cc EDTA’lı kan alınarak, bu örnekten genomik DNA elde edildi. Çalışmamızdaki genler için polimorfizm çalışmaları, elde edilmiş bu DNA’lar kullanılarak yapıldı.
3.5. Polimorfizm çalışmaları 3.5.1. DNA İzolasyonu
Hastalardan EDTA’lı tüpe alınan 2 cc kandan 200µl alınarak genomik DNA elde edildi. Bu yöntem için Invitrogen Purelink Genomic Blood DNA Purification DNA izolasyon mini kiti kullanıldı. DNA eldesi işlemleri kit prospektüsüne göre yapıldı.
Genomik DNA eldesinin aşamalarında kullanılan solüsyonların amaçları şu şekildedir:
Hücre lizis solüsyonu: Hücre zarının uzaklaştırılıp hücre içeriklerinin açığa çıkmasını, proteinaz K ile tüm hücresel ve nükleer histon proteinlerin ve RNA’nın uzaklaştırılmasını sağlar.
40 Alkol: DNA’nın membranda presipitasyon basamağı ile yıkaması gerçekleştirilir. Membrana bağlama basamakları sonucunda alkol, protein ve membran lipid kontaminasyonlarından uzaklaştırılmış olur.
Elüsyon basamağı: En son uygulanan DNA’nın saf olarak eldesi sağlanır. Elüsyon tampon çözeltisi ile membrana bağlı kalan nükleik asidin %85-100’ü elde edilir.
Invitrogen Purelink Genomic Blood DNA Purification (K1820-01) DNA izolasyon mini Kit prosedürü:
Hazırlama:
• Su banyosu 550C'ye ayarlanır.
• Her hasta için 1,5 ml'lik ependorf, spin ve kolon tüpler hazırlanır. • Etil alkol saf olması için yeni olarak hazırlanır. (%95>)
Prosedür
• Steril bir ependorf tüpüne 200μl donmuş ya da taze kan örneği konur. • Üzerine 20 μl Proteinaz-K eklenir.
• 20 μl Rnase A ekleyin ve vortekslenir, oda sıcaklığında 2 dakika inkübe edilir. • 200 μl Genomik/Lysis tamponundan eklenir ve homojen olana kadar vortekslenir.
• Protein sindirimini hızlandırmak için 550C'de 10 dk. su banyosunda inkübe edilir.
• 200 μl %96-100'lük etil alkol eklenir, 5 saniye kadar vortekslenir. • Ependorftaki lizattan toplama tüplerine ~640 μl eklenir.
• 8.000 rpm'de 1 dakika santrifüj edin. Kolonları atılır ve temiz tüpe yerleştirilir. • 500 μl Wash Buffer 1 ilave edilir.
41 • 500 μl Wash Buffer 2 ilave edilir.
• 3 dakika maksimum hızda santrifüj edilir. Kolonları atın ve temiz tüpe yerleştirilir.
• 25-200 μl (ort. 100 μl) Elution Buffer eklenir, 1-2 dakika oda ısısında bekletilir.
• Maksimum hızda 1 dakika santrifüj edilir.
• Elde edilen DNA toplama tüpünde birikmiştir, buradan mikropipetle ependorfa aktarılarak +40C'de ya da -200C''de saklanılarak, gerekirse dilüe edilerek
kullanılır. DNA'nın kontrolü:
2 μl (100 ng) DNA çözeltisi %1’lik agaroz jelde elektroforez işlemine tabi tutuldu. DNA saflığının ölçülmesi için, NanoDrop Spektrofotometre cihazında 260/280 nm dalga boyunda ölçüm yapıldı. Kontrolü tamamlanan DNA molekülleri, DNA sekans analizine başlamak üzere +40C’de saklandı.
3.5.2. MCP geni için PCR koşulları
MCP geni için özgül olan oligonükleotid primerler ile PCR amplifikasyonu gerçekleştirilmiştir. PCR işlemi için toplamda 25 µl olacak şekilde; içerisinde; 1µl genomic DNA, Gene Amp Gold Buffer (15 mmol/l Tris-HCl, pH 8,0, 50 mmol/lKCl), 2,5 mmol MgCl2 hazırlandı. Her birinden 50 µmol/l dGTP,dATP, dTTP ve dCTP, 5 pmol forward ve reverse primer ve 1.0U Ampli Taq Gold polimeraz eklendi.
PCR reaksiyonu 1 ul (100 ng) genomik DNA, Enhancer Buffer (20 mM Tris (pH 8.3), 50 mM KCl, 1.5 mMMgCl2) 2.5 uL, d NTP mix karışımı 0,5 uL (0.2 mM), forward primer 1 uL (10 pmol/ul), reverse primer 1 ul (10 pmol/ul) (Invitrogen), 1.0 U PlatiniumTaq DNA Polymerase (Invitrogen, Carlsbad, CA), deiyonize su ile 25 uL total volüme tamamlanmıştır. MyGene
42 Gradient Thermal Cycler cihazında gradient programında PCR amplifikasyonu gerçekleştirilmiştir.
PCR örnekleri %2lik jel hazırlanarak görüntülenir.. PCR ürünleri PvuII restriksiyon enzimi kullanılarak 37oC’de en az 16 saat inkübasyona bırakılır. %3lük agaroz jelde görüntülenir.
3.5.3. CCL5 geni (RANTES) için PCR koşulları
CCL5 geni için özgül olan oligonükleotid primerler ile PCR amplifikasyonu gerçekleştirilmiştir. PCR işlemi için toplamda 25 µl olacak şekilde; içerisinde; 1µl genomic DNA, Gene Amp Gold Buffer (15 mmol/l Tris-HCl, pH 8.0, 50 mmol/lKCl), 2,5 mmol MgCl2 hazırlandı. Her birinden 50 µmol/l dGTP,dATP, dTTP ve dCTP, 5 pmol forward ve reverse primer ve 1.0U Ampli Taq Gold polimeraz eklendi.
PCR reaksiyonu 1 ul (100 ng) genomik DNA, Enhancer Buffer (20 mM Tris (pH 8.3), 50 mM KCl, 1.5 mMMgCl2) 2,5 uL, d NTP mix karışımı 0,5 uL (0.2 mM), forward primer 1 uL (10 pmol/ul), reverse primer 1 ul (10 pmol/ul) (Invitrogen) , 1,0 U PlatiniumTaq DNA Polymerase (Invitrogen, Carlsbad, CA), deiyonize su ile 25 uL total volüme tamamlanmıştır. MyGene Gradient Thermal Cycler cihazında gradient programında PCR amplifikasyonu gerçekleştirilmiştir.
3.5.4. Nükleotid dizisinin okunması
PCR'ı başarılı olan hastaların ürünleri ABI 3130XL Genetic Analyser otomatik DNA dizileme cihazına konuldu ve piklere göre nükleotid dizisi okundu.
Otomatik DNA dizi analiz cihazları basit olarak, sabit bilgisayarda yüklü programlar ile bu programların yönettiği elektroforez sistemini içerir. Elektroforetik ünitelerde bulunan lazer ışık kaynağı ile monokromatik bir ışık oluşturulur. Söz konusu DNA’nın bulunduğu jelmatriks bu monokromatik ışık ile taranır. Elektroforez süresince DNA’ya bağlanan floresan
43 boya ışık ile taranan bölgeye geldiğinde uyarılır. Uyarılan boya kendi için karakteristik olan dalga boyunda ışığı geri yansıtır. Yansıyan bu ışık demeti bir detektör tarafından kaydedilir. Kaydedilen veriler bilgisayar programları ile sonuçlar grafiksel olarak bilgisayar ekranına aktarılarak değerlendirilir (Şekil 3.1).
Şekil 3.1. RANTES -28 C>G heterozigot nükleotit yer değişimi
DNA dizileme sonucunda nükleotid değişimleri, National Institute of Health’in web sayfasındaki (www.ncbi.nih.gov) ‘genbank’ ve ‘protein database’ referans dizileri ile karşılaştırılmıştır.
3.6. İstatistiksel analizler
Çalışmanın sonuçları, Hardy–Weinberg Dengesine uygunluk testi ile kontrol edildi. Çalışma için seçilen popülasyonun Hardy-Weinberg dengesine uyduğu ortaya konulmuştur. Veriler SPSS 15.0 programına kayıt edilerek istatistiksel analizleri yapıldı.
Yaş hesaplamasında doldurduğu ay esas alındı. Yaş ortalamaları ay olarak verildi. Gruplar arasında cinsiyet açısından istatistiksel olarak farklılığın olup olmadığı ki kare testiyle araştırıldı.
44 Ölçüm değerlerinin ortalama değerlerinin normal dağılıma uygunluğu tek örneklem Kolmogorov Smirnov testiyle değerlendirildi. Gruplar arası ölçüm değerlerinin karşılaştırılmasında student t testi, uygun olmadığı durumlarda ise Mann-Whitney U veya Kruskal-Wallis testi uygulandı. Sonuçlar, ortalama ± standart sapma (SD) (alt-üst değer) olarak verildi. Nomimal değişkenlerin karşılaştırıldığı durumlarda ki kare testi kullanıldı. Genotip ve allel frekansı dağılımı ile hastalık arasında istatistiksel olarak anlamlı ilişki olup olmadığı Odds Oranı ve %95 güven aralığı hesaplanarak incelendi. p değeri <0,05 istatistiksel olarak anlamlı kabul edildi.
45 4. BULGULAR
Bu çalışmaya 104 idrar yolu enfeksiyonu olan hasta (hasta grubu) ve 100 sağlıklı olgu (kontrol grubu) dahil edildi. Hasta grubunda 38 erkek (%36,5) ve 66 kız (%63,5) bulunmaktaydı (Şekil 4.1). Kontrol grubunda ise 42 erkek (%42) ve 58 kız (%58) vardı (Şekil 4.1). Her iki grubun cinsiyet dağılımları benzerdi (p=0,635).
Şekil 4.1. Hasta ve kontrol grubunun cinsiyet dağılımları
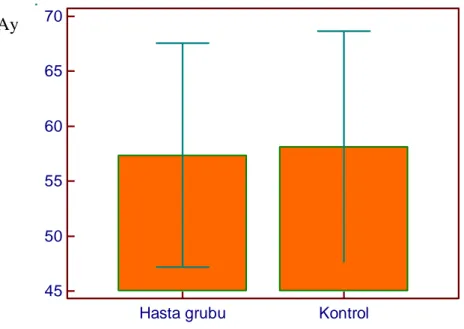
Hasta grubunun yaş ortalaması 57,4±52,5 ay (2,4-180 ay), ortanca yaş değeri 36 ay idi. Kontrol grubunun ise yaş ortalaması 58,3±54,5 ay (3,1-171 ay), ortanca yaş değeri 39 ay idi. Hasta ve kontrol gruplarının yaş ortalamaları benzer saptandı (p=0,895) (Şekil 4.2).
Hasta grubunda hiçbir hastada postnatal saptanan üriner sisteme ait anatomik defekt, VÜR yoktu. Elli hastanın (%48,1) tuvalet eğitimi yokken, geriye kalan 54 hastada (%51,9) tuvalet eğitimi mevcuttu. Tüm hastaların kan basıncı değerleri yaşa göre normal sınırlar içinde saptandı.
46 45 50 55 60 65 70
Hasta grubu Kontrol
Şekil 4.2. Hasta ve kontrol gruplarının yaş ortalamalarının karşılaştırılması
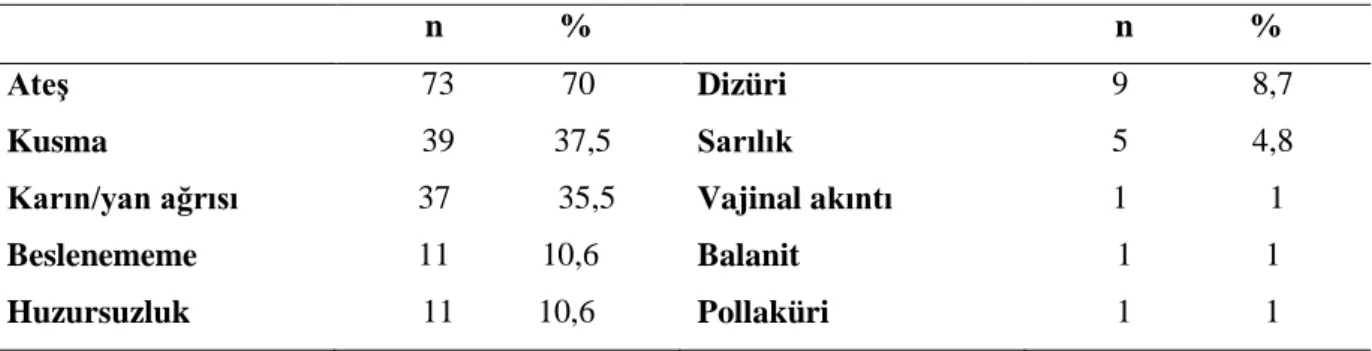
Hasta grubunda idrar yolu enfeksiyonuna ait semptomlar tablo 4.1’de özetlenmiştir. En sık semptom ateş (n=73; %70,2), ikinci en sık semptom ise kusma (n=39; %37,5) idi (Şekil 4.3) olarak saptandı. Yenidoğan dönemine yakın dönemde, 5 hastada (%4,8) başvuru yakınmaları arasında uzamış ikter, on birer hastada (%10,5) huzursuzluk ve beslenememe bulunmaktaydı. Hasta grubunda 83 hastada (%79,8) piyüri mevcuttu. On dört hastada (%13,5) nitrit pozitif idi. Yirmi bir hastada (%20,2) idrar bakısında lökosit sayısı her sahada beşten az saptandı. Bu hastalarda aynı zamanda nitrit negatifliği de mevcuttu. Yüz dört hastanın 97’sinde (%93,3) idrar kültürü torba, 7 tanesinde (%6,7) kateter ile alınmıştı.
47 Tablo 4.1. Hasta grubunda idrar yolu enfeksiyonuna ait semptomlar
n % n %
Ateş 73 70 Dizüri 9 8,7 Kusma 39 37,5 Sarılık 5 4,8 Karın/yan ağrısı 37 35,5 Vajinal akıntı 1 1 Beslenememe 11 10,6 Balanit 1 1 Huzursuzluk 11 10,6 Pollaküri 1 1
Şekil 4.3. Hasta grubunda idrar yolu enfeksiyonuna ait semptomlar
Hasta grubunda tanı anında beyaz küre ortalaması 12900±5312/µL (5690-36800/ µL), mutlak nötrofil sayısı 6934±4489/µL (1090-18600/µL), hemoglobin değeri ortalaması 11,9±1,6 g/dl (6,2-17,2 g/dl), CRP ortalaması 3,1±3,6 mg/dl (0,1-15,0 mg/dl) olarak saptandı (Şekil 4.4, Şekil 4.5). On yedi hastada sedimentasyon değeri çalışılmıştı. Bu hastalarda ortanca sedimentasyon değeri 40 mm/saat (4-110 mm/saat) olarak bulundu.
Hastaların tümünde üre ve kreatinin değerleri normal sınırlarda saptandı (17,3±4,3 mg/dl ve 0,6±,02 mg/dl).
48 0 5000 10000 15000 20000 25000 30000 35000 40000
Beyaz küre sayısı Mutlak nötrofil sayısı
Şekil 4.4. Hasta grubunda tanı anında beyaz küre ve mutlak nötrofil sayısı ortalamaları
0 2 4 6 8 10 12 14 16 CRP
Şekil 4.5. Hasta grubunda tanı anında CRP değerleri
Hasta grubunda idrar kültüründe en sık üreyen mikroorganizmalar, E.coli (n=83; %79,8) ve
Klebsiella pneumonia (n=11; %10,6) idi. Üreyen mikroorganizmalar ve sıklıkları tablo 4.2’de
49
Citrobacter freundii, iki Enterobacter cloacae ve bir Enterobacter aerogenes genişlemiş
spektrumlu beta-laktamaz (GSBL) pozitif olarak saptandı.
Tablo 4.2. İdrar kültüründe üreyen mikroorganizmalar ve sıklıkları
Üreyen mikroorganizma n % E. coli 83 79,8 Klebsiella pneumonia 11 10,6 Proteus mirabilis 3 2,9 Pseudomonas aureginosa 2 1,9 Enterobacter cloacae 1 1 Citrobacter freundi 1 1 Klebsiella oxytoca 1 1 Morganella morgagni 1 1 Enterobacter aerogenes 1 1
Hastaların tümü ultrasonografi ile değerlendirilmişti. On iki (%11,5) hastada pelvikaliektazi/hidronefroz (grade 1 ila 4 arasında) saptanırken, yedi hastada nefrolitiazis (%6,7), iki hastada (%1,9) renal basit kist, iki hastada (%1,9) at nalı böbrek saptandı. Kırk sekiz hastaya DMSA çekilmişti. Bu hastalardan 5 tanesinde (%10,4) skar saptanırken, diğer 43 tanesi (%89,6) normal sınırlardaydı. Otuz iki hasta MSÜG (%30,7) ile değerlendirilmişti. Bu hastalardan altısında (%18,7) VÜR saptanırken, bir hastada işeme sonrası mesanede rezidü idrar vardı. Yirmi beş hastanın miksiyon sistoüreterografisi normal sınırlardaydı.
Yakınma, fizik muayene ve laboratuvar tetkikleri birlikte değerlendirildiğinde, yüz dört hastanın 50 tanesi (%48,1) üst İYE, 54 tanesi (%51,1) alt İYE olarak değerlendirildi (Şekil 4.6).