RENAL İNSÜLİN SİNYAL İLETİM YOLAĞINDA TİP 1 DİYABETLE MEYDANA GELEN MOLEKÜLER DEĞİŞİMLERİN
ARAŞTIRILMASI: RESVERATROLÜN ETKİLERİ Gamze ŞAHİN
Yüksek Lisans Tezi Biyoloji Anabilim Dalı
Programı: Moleküler Biyoloji ve Genetik Danışman: Yrd. Doç. Dr. Gökhan SADİ
İkinci Danışman: Yrd. Doç.Dr. M. Bilgehan PEKTAŞ Şubat-2016
T.C.
KARAMANOĞLU MEHMETBEY ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
RENAL İNSÜLİN SİNYAL İLETİM YOLAĞINDA TİP 1 DİYABETLE MEYDANA GELEN MOLEKÜLER DEĞİŞİMLERİN ARAŞTIRILMASI:
RESVERATROLÜN ETKİLERİ
YÜKSEK LİSANS TEZİ Gamze ŞAHİN
Anabilim Dalı: Biyoloji
Programı: Moleküler Biyoloji Ve Genetik Tez Danışmanı: Yrd.Doç.Dr. Gökhan SADİ İkinci Danışmanı: Yrd.Doç.Dr. M. Bilgehan PEKTAŞ
TEZ BİLDİRİMİ
Tez yazım kurallarına uygun olarak hazırlanan bu tezin yazılmasında bilimsel ahlak kurallarına uyulduğunu, başkalarının eserlerinden yararlanılması durumunda bilimsel normlara uygun olarak atıfta bulunulduğunu, tezin içerdiği yenilik ve sonuçların başka bir yerden alınmadığını, kullanılan verilerde herhangi bir tahrifat yapılmadığını, tezin herhangi bir kısmının bu üniversite veya başka bir üniversitedeki başka bir tez çalışması olarak sunulmadığını beyan ederim.
i ÖZET
Yüksek Lisans Tezi
RENAL İNSÜLİN SİNYAL İLETİM YOLAĞINDA TİP 1 DİYABETLE MEYDANA GELEN MOLEKÜLER DEĞİŞİMLERİN ARAŞTIRILMASI:
RESVERATROLÜN ETKİLERİ
Gamze ŞAHİN
Karamanoğlu Mehmetbey Üniversitesi Fen Bilimleri Enstitüsü
Biyoloji Anabilim Dalı
Danışman: Yrd. Doç. Dr. Gökhan SADİ
İkinci Danışman: Yrd. Doç. Dr. M. Bilgehan PEKTAŞ Şubat 2016, 71 sayfa
İnsülin hormonunun yokluğu veya yetersizliği sonucu oluşan, karbonhidrat, yağ ve protein metabolizmasını etkileyen diyabet, pek çok dokuda harabiyet meydana getirmektedir. Kuvvetli bir antioksidan ve anti-inflamatuar molekül olan resveratrol, çeşitli hastalıkların önlenmesinde veya tedavisinde kullanım potansiyeline sahip bir bileşiktir. Bu çalışma, diyabetin böbrek dokularında meydana getirdiği oksidatif stres ve inflamasyon durumunun ortaya çıkarılması ve bu değişimlerin, antioksidan enzimleri (cat, sod, gpx ve gst) ve insülin sinyal iletimini (insülin Rβ, irs-1, pi3k, akt, mtor) nasıl etkilediklerini ortaya çıkarmaya yönelik gerçekleştirilmiştir. Ayrıca resveratrolün bu parametreler üzerine etkileri araştırılmıştır.
Çalışmada erkek eşit yaşta Wistar sıçanları; diyabetik (n=12), kontrol (n=12), resveratrol verilmiş diyabetik (n=9), resveratrol verilmiş kontrol (n=12) olmak üzere dört gruba ayrıldıktan sonra iki grupta diyabet, streptozotocin’in (55 mg/kg) intraperitoneal yoldan enjekte edilmesiyle oluşturulmuştur. Diyabet oluşumunun bir hafta ardından 20 mg/kg resveratrol, ilgili gruplara günlük tek doz olarak 3 hafta boyunca enjekte edilmiştir.
ii
Diyabetin böbrek dokularında meydana getirdiği oksidatif stres ve inflamasyon durumu; lipid peroksidasyonu son ürünü MDA ve IL-6, IL-8, TNF-α gibi proinflamatuar sitokinlerin anlamlı (p<0,05) artışıyla ortaya çıkarılmış, resveratrol uygulamasının böbrek dokularındaki inflamasyonu azaltıcı etkileri gösterilmiştir. qRT-PCR ve Western blot sonuçlarına göre böbrek dokularında antioksidan enzimlerin diyabetle anlamlı ölçüde baskılandığı görülmüş ve bu durum antioksidan genlerin transkripsiyon düzeylerini etkileyen nfkb’nin oksidatif strese bağlı olarak etkilerinin azalması ile açıklanmıştır. Ayrıca, böbrek dokularında insülin sinyal iletim elemanlarının diyabetle gen ekspresyonu düzeyinde belirgin bir şekilde up-regüle olduğu belirlenmiş ve bu artışın protein düzeyinde anlamlı bir yükselmeye neden olduğu ortaya çıkarılmıştır. Resveratrol uygulaması, böbreklerde insülin sinyal iletiminde meydana gelen hassasiyeti gen ekspresyonu düzeyinde normal değerlere getirmiştir. Çalışmanın sonuçları, yeni ilaç üretimi ve gen tedavisi gibi diyabet araştırmalarında yol gösterici olabilecek moleküler mekanizmaları diyabetik böbrek dokularında açıklayıcı veriler içermektedir.
Anahtar Kelimeler: Diyabet, Böbrek, Oksidatif stres, İnflamasyon, İnsülin sinyal iletimi, Gen ekspresyonu, Western blot
iii ABSTRACT
Ms Thesis
INVESTIGATION OF MOLECULAR CHANGES IN RENAL INSULIN SIGNALING PATHWAY WITH DIABETES:
EFFECTS OF RESVERATROL
Gamze ŞAHİN
Karamanoğlu Mehmetbey University Graduate School of Natural and Applied Sciences
Department of Biology
Supervisor: Asst. Prof. Dr. Gökhan SADİ Co-advisor: Asst. Prof. Dr. M. Bilgehan PEKTAŞ
February 2016, 71 pages
Diabetes, a disease arising by the lack of insulin hormone or its inability of usage, affects carbohydrate, lipid and protein metabolism leading to the destruction in variety of the tissues in the body. A strong antioxidant and anti-inflammatory agent resveratrol has a high potential to prevent or treat some of the diseases. This study was conducted to reveal the oxidative stress and tissue inflammation associated with diabetes in the kidney tissues and to examine the changes in antioxidant enzymes (cat, sod, gpx and gst) and the components of insulin signaling (insulin Rβ, irs-1, pi3k, akt, mtor) with diabetes. Additionally, effects of resveratrol on these parameters were evaluated.
Male Wistar rats of equal age were divided into four groups as follows; diabetic (n=12), control (n=12), diabetic group supplemented with resveratrol (n=9), control group supplemented with resveratrol (n=12). Diabetes was induced in respective groups with single intraperitoneal streptozotocin (55 mg/kg) administration. One week after the diabetes, resveratrol was given as 20 mg/kg/day throughout 3 weeks.
The status of the oxidative stress and inflammation in the kidney tissues of the diabetic rats were assessed by measuring the significant (p<0.05) increase in the MDA levels
iv
which the end product of lipid peroxidation and proinflamatuar cytokines such as IL-6, IL-8, TNF-α.
Resveratrol was found to be effective in reducing the inflammatory markers. qRT-PCR and Western blot studies reflected that antioxidant enzymes were down-regulated in the kidney tissues of diabetic rats and this situation was devoted to the reduced gene expression of nfkb because of oxidative stress. Moreover, the components of insulin signaling elements were up-regulated at gene expression levels in diabetic rat kidney tissues, and this increase in gene expression leads the protein levels to be enhanced. Resveratrol treatment decreased the sensitization of insulin signaling towards the normal levels at gene expression level. The results of this study contain the supplementary data for the molecular mechanisms of the diabetes induced changes in the kidney tissues to put forward to orient new studies searching for new drugs and gene treatments for diabetes.
Keywords: Diabetes, Kidney, Oxidative stress, Inflammation, Resveratrol, İnsulin signaling Pathway, Gene expression.
v ÖNSÖZ
Yüksek lisans eğitimim boyunca değerli bilgi ve deneyimlerinden yararlandığım, insani ve ahlaki değerleri ile de örnek edindiğim, yanında çalışmaktan onur duyduğum, tecrübelerinden yararlanırken göstermiş olduğu hoşgörü ve sabrından dolayı değerli hocam Sayın Yrd. Doç. Dr. Gökhan SADİ’ye tüm içtenliğimle teşekkürlerimi sunuyorum.
Benden yardımlarını esirgemeyen değerli hocam Yrd. Doç.Dr. M. Bilgehan PEKTAŞ’a sonsuz teşekkürlerimi sunarım.
Ayrıca çalışmamda bilgi ve tecrübelerinden faydalandığım, çalışmanın her aşamasında her türlü yardım ve desteğini esirgemeyen Arş. Gör. Hicret Aslı YALÇIN’a başta olmak üzere bütün araştırma laboratuvarında çalışan arkadaşlarıma, maddi manevi desteğini esirgemeyen ve bu günlere gelmemde büyük pay sahibi olan aileme teşekkürlerimi sunarım.
Çalışmayı maddi olarak destekleyen Türkiye Bilimsel ve Teknolojik Araştırma Kurumu’na (112T159 nolu proje) ve Karamanoğlu Mehmetbey Üniversitesi BAP birimine (20-M-15 nolu proje) teşekkür ederim.
Gamze ŞAHİN
vi İÇİNDEKİLER Sayfa ÖZET ... i ABSTRACT ... iii ÖNSÖZ ... v İÇİNDEKİLER ... vi ÇİZELGELER DİZİNİ ... viii ŞEKİLLER DİZİNİ ... xi
SİMGELER VE KISALTMALAR DİZİNİ ... xii
1. GİRİŞ ... 1
2.GENEL BİLGİLER ... 3
2.1. Serbest radikaller ... 3
2.2. Antioksidan savunma sistemleri ... 4
2.3. Diabetes mellitus ... 7
2.4. İnsülin sentezi, insülin sinyal yolağı ve etki mekanizması ... 8
2.3.1. Diyabet ve oksidatif stres ... 10
2.3.2. Diyabet, inflamasyon ve insülin direnci ... 10
2.5. Konu ile ilgili diğer literatür çalışmaları ... 11
3. AMAÇ VE GEREKÇE ... 15
4. MATERYAL VE YÖNTEM ... 17
4.1. Materyal ... 17
4.1.1. Kullanılan kimyasal maddeler ... 17
4.1.2. Kullanılan kitler ... 17
4.1.3. Kullanılan antikorlar ... 17
4.1.4. Kullanılan primerler ... 17
4.2. Deneysel diyabetin oluşturulması ve resveratrolün uygulaması ... 18
4.3. Böbrek dokularının homojenizasyonu ... 20
4.4. Böbrek dokularında gerçekleştirilen biyokimyasal ölçümler ... 20
4.4.1. Toplam protein tayini... 20
4.4.2. Doku glikoz ölçümü ... 21
4.4.3. Doku total kolesterol ölçüm yöntemi... 22
vii
4.4.5. Doku malondialdehit (MDA) ölçüm yöntemi ... 22
4.4.6. Doku IL-1β düzeylerinin ölçümü ... 22
4.4.7. Doku IL-6 düzeylerinin ölçümü ... 22
4.4.8. Doku IL-8 düzeylerinin ölçümü ... 22
4.4.9. Doku TNF-α düzeylerinin ölçümü ... 23
4.5. Böbrek dokularında antioksidan enzimlerin ve insülin sinyal iletim yolağındaki proteinlerin Western blot tekniği ile belirlenmesi ... 23
4.6.Toplam RNA izolasyonu, cDNA sentezi ve real time PCR ile antioksidan enzimler ve insülin sinyal iletimi ile ilgili genlerin ekspresyonlarının ölçülmesi ... 28
4.7. Antioksidan enzim aktivitelerinin belirlenmesi ... 31
4.7.1. Glutatyon peroksidaz (GPx) enzim aktivitesi tayini ... 31
4.7.2. Toplam süperoksit dismutaz (SOD) aktivitesi tayini ... 31
4.7.3. Katalaz (CAT) enzim aktivitesi ölçümü ... 32
4.7.4. Toplam glutatyon-S-transferaz (GST) aktivitesi ölçümü ... 33
4.8. İstatistiksel analiz ... 34
5. BULGULAR ... 35
5.1. Diyabet ve/veya resveratrolün hayvan ağırlıkları ve böbrek dokularında bazı metabolik parametreler üzerine etkileri ... 35
5.2. Böbrek homojenatlarının toplam protein konsantrasyonları ... 36
5.3. Böbrek dokularında inflamatuar belirteçlerin değişimi ... 37
5.3. Böbrek dokularından toplam RNA izolasyonu, miktar ve kalite tayini ... 38
5.4. Antioksidan enzimlerin diyabet ve/veya resveratrol ile değişimleri... 39
5.4.1. Diyabet ve/veya resveratrolün antioksidan enzimlerin gen ekspresyonlarında meydana getirdiği değişimler ... 40
5.4.2. Antioksidan Enzimlerin Western Blot Analizi ... 43
5.4.3. Böbrek dokularında antioksidan enzimlerin aktivite düzeylerinin belirlenmesi .. 45
5.5. İnsülin sinyal iletimi elemanlarının diyabet ve/veya resveratrol ile regülasyonları.46 5.5.1. İnsülin sinyal iletimi elemanlarının gen ekspresyon düzeylerinin diyabet ve/veya resveratrol ile değişimleri ... 47
5.5.2. İnsülin sinyal iletimi elemanlarının, SIRT-1 ve iNOS protein düzeylerinin böbreklerde diyabet ve/veya resveratrol ile değişimleri ... 49
6. TARTIŞMA VE SONUÇ ... 51
viii
APPENDİKS ... 63 ÖZGEÇMİŞ ... 71
ix
ÇİZELGELER DİZİNİ
Çizelge Sayfa Çizelge 4. 1. Antioksidan enzimler ile insülin sinyal iletim yolağında bulunan bazı
genlerin ekspresyon analizlerinde kullanılan primer çiftleri...18
Çizelge 4. 2. Poliakrilamit jellerinin hazırlanışı………..24
Çizelge 4. 3.Western blot yönteminde jellere yüklenen proteinlerin miktarları……...25
Çizelge 4. 4. Kullanılan antikorlar ve seyreltme oranları. ... 27
Çizelge 4. 5. Kullanılan ikincil (sekonder) antikorlar ve seyreltme oranları ... 27
Çizelge 5. 1. Diyabet ve resveratrolün hayvan ağırlığı, açlık kan şekeri düzeyleri ve bazı metabolik parametreler üzerine etkileri……… 36
Çizelge 5. 2. Mikro Lowry yöntemine göre hesaplanan doku homojenat toplam protein konsantrasyonları (mg/ml)………...37
Çizelge 5. 3. Böbrek dokularından izole edilen toplam RNA örneklerinin konsantrasyonları (µg/ml ) ve bu RNA’ların bütünlüklerini gösteren OD260/OD280 oranları. ... 40
x
ŞEKİLLER DİZİNİ
Şekil Sayfa
Şekil 2.1. Serbest radikallerin oluşumu ve antioksidan enzimleri serbest
radikalleri ortadan kaldırıcı etkileri……….………..5
Şekil 2.2. Antioksidan enzimlerin glutatyon redoks döngüsü ile beraber serbest radikal kaynaklarını ortadan kaldırma mekanizması. ... 6
Şekil 2.3. Trans-Resveratrol’ün molekül şekli. ... 6
Şekil 2.4. Diyabet çeşitlerinin ortaya çıkışında görülen farklılıklar. ... 7
Şekil 2.5. İnsülin hormonunun yapısı. ... 8
Şekil 2.6. İnsülin-PI3K-Akt sinyal iletim yolağı elemanları ve aralarındaki normal fonksiyonel ilişkiler mavi oklarla gösterilmiştir. ... 9
Şekil 3.1. Diyabetin ve/veya resveratrolün insülin sinyal iletimi üzerine olası etkileri.. 16
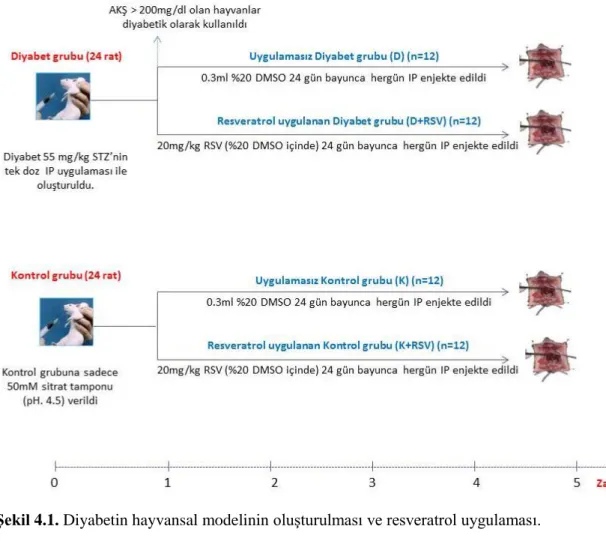
Şekil 4.1. Diyabetin hayvansal modelinin oluşturulması ve resveratrol uygulaması. .... 19
Şekil 4.2. Böbrek dokularının homojenizasyonu. ... 20
Şekil 4.3. Mikro Lowry yöntemi ile oluşturulan BSA standart kalibrasyon eğrisi. ... 21
Şekil 4.4. Ayırıcı ve sıkıştırıcı poliakrilamid jellerin hazırlanma basamakları. ... 24
Şekil 4.5. Örneklerin inkübasyonu, poliakrilamit jellere yüklenmesi ve dikey elektroforez ile birbirinden ayrılması. ... 25
Şekil 4.6. SDS-PAGE ile birbirinden ayrılan proteinlerin Trans-blot turbo cihazı ile PVDF membranlara aktarım işlemleri. ... 26
Şekil 4.7. ChemiDocTM MP (Bio-Rad) kemiluminesan görüntüleme sistemi. ... 28
Şekil 4.8. Toplam RNA izolasyonu protokolünün genel görüntüsü (Qiagen, Venlo, Hollanda). ... 29
Şekil 4.9. Roche LightCycler 480 II qPCR cihazı ve elde edilen örnek amplifikasyon eğrileri ve melt (erime) analizleri. ... 30
Şekil 4.10. GPx aktivite ölçüm metodu prensibi. ... 31
Şekil 4.11. Pyorogallol’ün süperoksit radikali ile otooksidasyonu ve SOD aktivite ölçüm metodunun prensibi. ... 32
Şekil 4.12. GST ile katalizlenen enzimatik reaksiyonun mekanizması. ... 33
Şekil 5.1. Böbrek dokularında diyabet ve resveratrol ile inflamatuar sitokinlerden A) TNF-α; B) IL-1β; C) IL-6 ve D) IL-8 düzeylerinde meydana gelen değişimler.. ... 38
xi
Şekil 5.2. Böbrek dokularından elde edilen örnek RNA’ların agaroz jel elektroforezi görüntüsü.. ... 39 Şekil 5.3.Böbrek dokularında diyabet ve resveratrol uygulamaları ile A) cat mRNA
ifade düzeylerinin değişimi, B) gpx mRNA ifade düzeylerinin değişimi, C) sod-1 mRNA ifade düzeylerinin değişimi, D) sod-2 mRNA ifade
düzeylerinin değişimi, E) gstmu mRNA ifade düzeylerinin değişimi, F) nfkb mRNA ekspresyon düzeylerinin değişimi. ... 42 Şekil 5.4. Böbrek dokularında diyabet ve/veya resveratrolün antioksidan enzimlerin
protein düzeylerinde meydana getirdiği değişimler gösterilmektedir. ... 44 Şekil 5.5. Böbrek dokularında diyabet ve resveratrol uygulamaları ile A) CAT enzim
aktivitesi, B) GPx enzim aktivitesi, C) Toplam SOD enzim aktivitesi, D) Toplam GST enzim aktivitesindeki değişimler. ... 45 Şekil 5.6. Böbrek dokularında diyabet ve/veya resveratrol uygulamaları ile insülin
sinyal iletim yolağında görevli A) insülin Rβ, B) irs-1, C) irs-2, D) pi3k, E) akt, F) mtor gen ekspresyon düzeylerinin değişimi.. ... 48 Şekil 5.7. Böbrek dokularında diyabet ve/veya resveratrolün insülin sinyal iletiminde
görevli proteinler ile SIRT-1 ve iNOS protein ekspresyon düzeylerinde meydana getirdiği değişimler. ... 50 Şekil A1. Kontrol, diyabetik, resveratrol uygulanmış kontrol (C+RSV) ve resveratrol
uygulanmış diyabetik (D+RSV) sıçan böbrek dokularında CAT proteini için gerçekleştirilen Western blot görüntüsü ... 62
Şekil A2. Kontrol, diyabetik, resveratrol uygulanmış kontrol (C+RSV) ve resveratrol uygulanmış diyabetik (D+RSV) sıçan böbrek dokularında SOD-1 proteini için gerçekleştirilen Western blot görüntüsü ... 63
Şekil A3. Kontrol, diyabetik, resveratrol uygulanmış kontrol (C+RSV) ve resveratrol uygulanmış diyabetik (D+RSV) sıçan böbrek dokularında SOD-2 proteini için gerçekleştirilen Western blot görüntüsü ... 64
Şekil A4. Kontrol, diyabetik, resveratrol uygulanmış kontrol (C+RSV) ve resveratrol uygulanmış diyabetik (D+RSV) sıçan böbrek dokularında insülin-Rβ proteini için gerçekleştirilen Western blot görüntüsü ... 65
Şekil A5. Kontrol, diyabetik, resveratrol uygulanmış kontrol (C+RSV) ve resveratrol uygulanmış diyabetik (D+RSV) sıçan böbrek dokularında PI3K proteini için gerçekleştirilen Western blot görüntüsü ... 66
xii
Şekil A6. Kontrol, diyabetik, resveratrol uygulanmış kontrol (C+RSV) ve resveratrol uygulanmış diyabetik (D+RSV) sıçan böbrek dokularında Akt-1 proteini için gerçekleştirilen Western blot görüntüsü ... 67
Şekil A7. Kontrol, diyabetik, resveratrol uygulanmış kontrol (C+RSV) ve resveratrol uygulanmış diyabetik (D+RSV) sıçan böbrek dokularında iNOS proteini için gerçekleştirilen Western blot görüntüsü ... 68
Şekil A8. Kontrol, diyabetik, resveratrol uygulanmış kontrol (C+RSV) ve resveratrol uygulanmış diyabetik (D+RSV) sıçan böbrek dokularında SIRT-1 proteini için gerçekleştirilen Western blot görüntüsü ... 69
xiii SİMGELER VE KISALTMALAR DİZİNİ Simgeler Açıklama dH2O Distile Su G Gram H2O2 Hidrojen peroksit L Litre M Molar Mg Miligram Ml Mililitre Mm Milimolar Mmol Milimol O2.- Süperoksit radikali OH. Hidroksil radikali
xiv
Kısaltmalar Açıklama
BSA Bovin serum albümin
CAT Katalaz
Cu/Zn SOD Bakır/çinko süperoksit dismutaz
DNA Deoksiribo nükleik asit
EDTA Etilendiamin tetraasetikasit
FAD Flavin adenin dinükleotit
Fe SOD Demir süperoksit dismutaz
GSH Glutatyon
GPx Glutatyon peroksidaz
GR Glutatyon redüktaz
GSSG Okside glutatyon
GST Glutatyon-S-transferaz
Mn SOD Mangan süperoksit dismutaz
NAD Nikotinamid adenin dinükleotid
NAD+ Yükseltgenmiş nikotinamid adenin
NADH İndirgenmiş nikotinamid adenin
NADPH Nikotinamid adenindinükleotid fosfat
RNA Ribonükleik asit
RSV Resveratrol
SOD Süperoksit dismutaz
1 1. GİRİŞ
İnsülin hormonunun azalması/yokluğu ya da hücrelerde etkisinin azalmasıyla ortaya çıkan diyabet hastalığı; metabolizma bozukluğu (karbonhidrat, protein ve yağ metabolizması), hiperglisemi olarak bilinen anormal derecede yüksek kan şekeri seviyesi ve glikozüri gibi bazı karakteristik özelliklere sahiptir. Yüksek kan şekerine bağlı olarak glikozun artan oto-oksidasyonu, enzimsel olmayan protein şekerlenmesi ve polyol yolağında bulunan enzim aktivitelerinin artması hücresel pek çok metabolik faaliyeti de etkilemektedir (Giacco ve Brownlee, 2010; Maritim ve ark., 2003). Metabolizmadaki bu değişimler doku ve hücrelerde serbest radikal üretimini arttırmakta ve dolayısıyla oksidatif stres ve inflamasyon oluşturmaktadır (Giacco ve Brownlee, 2010).
Yapılan çalışmalarda deneysel olarak diyabet oluşturulan hayvanlarda ve diyabetik hastalarda serbest oksijen radikallerinin ve lipit peroksidasyonunun önemli derecede arttığı ve oksidatif stresin diyabet etiyolojisinde ve ilerlemesinde rolü olduğu bildirilmiştir (Winiarska ve ark., 2006; Trigginani ve ark., 2006; Da Ros ve ark., 2004). Bunlara ilave olarak uzamış oksidatif stresin ve antioksidan kapasitede görülen değişikliklerin diyabetin kronik komplikasyonlarının ortaya çıkışı ile de ilişkili olabileceği araştırmacılar tarafından vurgulanmaktadır (Sadi ve ark., 2014). Bu bağlamda diyabetin oluşumunu önlemede ve tedavisinde, radikal oluşumunu önleyici antioksidan moleküllerin kullanılabileceği düşüncesi ortaya çıkmıştır.
Resveratrol (3,4,5-trihidroksistilben); üzüm, yer fıstığı, çilek ve kiraz gibi kırmızı renkli meyvelerde bol miktarda bulunan polifenolik yapıda doğal bir bileşiktir (Szkudelska ve Szkudelski, 2010). Antioksidan, anti-inflamatuar ve anti-apoptotik etkileri gösterilen resveratrolün, diyabetin patofizyolojisinde oksidatif hasara karşı koruma özelliği ve enzimlerin gen ekspresyon seviyelerini etkilediği de çeşitli çalışmalarda gösterilmiştir (Li ve ark., 2006; Stervbo ve ark., 2007; Sayın ve ark., 2008; Robb ve ark., 2008).
2
Güçlü bir antioksidan olan resveratrol diyabetik hayvanlarda insülin etkisini arttırıcı etkiler de göstermektedir (Su ve ark., 2006). Diyabetik hayvanlarda metabolik parametreleri iyileştirdiği, plazma glikoz ve trigliserit konsantrasyonlarını azalttığı, bunlara paralel olarak da insülineminin etkisini azalttığı belirlenmiştir (Su ve ark., 2006). Ayrıca diyabette hipergliseminin yol açtığı oksidatif stres sonucunda böbrekte gelişen nefropatiyi önleyebileceği de bildirilmiştir (Kitada ve ark., 2011).
İnsülin hormonu, etkisini hücresel düzeyde etkili anahtar proteinler aracılığıyla gösterir. Bu proteinler insülin reseptöründen (İnsülin Rβ) başlamak üzere hücresel aktiviteden sorumlu birçok transkripsiyon faktörüne kadar devam etmektedir. İnsülinin reseptörüne bağlanması, insülin reseptör substrat (IRS) ailesi üyesi adaptör proteinleri aktive eder. Bunun sonucunda insülinin dokular üzerinde etkisi gerçekleşir (Lizcano ve Alessi, 2002). Son yıllarda yapılan güncel araştırmalar, bozulmuş glikoz metabolizmasının insülin sinyal iletim yolağında bulunan bazı proteinlerin (örneğin IR, IRS-1, IRS-2, PI3K ve Akt) içeriklerini etkileyerek insülin sinyal yolağı üzerindeki olumsuz etkilere yol açtığını ortaya çıkartmıştır (Babacanoglu ve ark., 2013, Sadi ve ark., 2015a ). Ayrıca resveratrolün karaciğer dokularında IRS-1, IRS-2, sirtuin-1 ve FOXO3a yolaklarının faaliyetlerini düzenleyen bir fitoaleksin olduğu belirlenmiştir (Babacanoglu ve ark., 2013; Yu ve ark., 2013). Güncel olarak gerçekleştirdiğimiz bir çalışmada, diyabetin karaciğer dokularında insülin sinyal iletimi ile ilgili proteinleri baskıladığı, bu durumun doku inflamasyonu ile ilişkili olduğu ve resveratrolün bu değişimleri kısmen normalize ettiği ortaya çıkarılmıştır (Sadi ve ark., 2015a). Ancak diyabette böbrek dokularının nasıl etkilendiği ve insülin sinyal iletimi ilgili genlerin ve proteinlerin böbrek dokularında nasıl kontrol edildiklerine dair bilgiler henüz net olarak aydınlatılamamıştır.
Bu bağlamda bu projenin amacı diyabetin böbrek dokularında inflamasyon ve oksidatif stres oluşturup oluşturmayacağını ortaya çıkarmak ve diyabetin böbrek dokuları üzerine etkisini insülin sinyal iletimi (insülin-PI3K-Akt yolağı) ile açıklamaya çalışmaktır. Ayrıca resveratrolün böbrek dokularında oksidatif stres belirteçleri üzerine olası koruyucu-tedavi edici etkilerini anlamak ve insulin-PI3K/Akt sinyal yolağındaki potansiyel değişimlerle ilişkilerini ortaya çıkarmaktır.
3
Bulunacak sonuçlar doğrultusunda böbrek dokularında diyabetle meydana gelebilecek inflamasyon ve insülin sinyal iletim yolağındaki değişiklikler ilişkilendirilecek, elde edilecek veriler resveratrolün diyabet patolojisindeki moleküler etki mekanizmasının açığa çıkarılmasında önemli bir rol oynayacaktır.
2.GENEL BİLGİLER 2.1. Serbest Radikaller
Serbest radikaller atomik ya da moleküler yapılarda eşleşmemiş bir veya daha fazla elektron taşıyan moleküllerdir. Başka moleküllerle çok kolay bir şekilde elektron alışverişine giren bu moleküllere oksidan moleküller veya reaktif oksijen türleri de denmektedir. Serbest radikaller hücrelerde bulunan DNA, protein ve lipitler gibi biyomoleküllere kalıcı hasarlar vermeleri sebebiyle oldukça zararlıdırlar. Radikallerin vücuttaki endojen kaynakları mitokondriyal elektron taşıma sistemi, araşidonik asit metabolizması, fagositoz ve bazı enzim reaksiyonlarıdır. Ekzojen kaynaklar arasında radyasyon, ozon, sigara, UV ışınlar, kimyasal maddeler, ilaçlar, metaller yer alır. Gerek endojen gerekse ekzojen kaynaklar sonucu oluşan radikaller ve onların metabolizma ürünleri, vücudun antioksidan savunma mekanizmalarıyla zararsız hale getirilirler. Oksijen molekülü dışarıdan bir elektron alırsa, dış yörüngesinde bir fazla elektron bulunduran süperoksit radikali oluşur (Çavuşoğlu, 2006). Bu molekül radikal olarak tanımlanmasına karşın çok reaktif değildir (Nordberg ve Arner, 2001). Ancak iki molekül süperoksit, enzimsel olarak protonlanarak hidrojen peroksiti (H2O2) oluşturur.
Hücresel hidrojen peroksitin bir numaralı kaynağı olması ve geçiş metallerini indirgeyebilmesi nedeniyle biyolojik olarak önemli bir radikaldir.
O2.- + O2-. + 2H+ H2O2 + O2
Hidrojen peroksit bir serbest radikal değildir. Ancak biyolojik membranlardan kolayca geçebildiği için çok önemli bir moleküldür. Başta hidroksil radikali olmak üzere birçok oksidanın oluşmasına yol açar (Deaton ve Marlin, 2003).
Hidroksil radikali, hidrojen peroksitin geçiş metalleri varlığında indirgenmesiyle (Fenton reaksiyonu), hidrojen peroksitin süperoksit radikali ile reaksiyonuyla
(Haber-4
Weiss Reaksiyonu) ve suyun yüksek enerjili iyonize edici radyasyona maruz kalması sonucunda oluşur (Cheesman ve Slater, 1993; Halliwell, 1999; Song, 2004). Biyolojik sistemlerde yarılanma ömrü son derece kısa olan hidroksi radikali lipitler, proteinler ve nükleik asitler dâhil hemen hemen bütün biyolojik molekülleri okside edebilir (Fantel, 1996).
Güçlü reaktif özelliklere sahip olan serbest radikaller, hücresel bütün yapıları; DNA, protein, lipit, karbonhidrat ve enzim sistemleri gibi tüm önemli bileşikleri kolayca etkileyerek yıkıma uğratabilirler (İşbilir, 2008). Bu zararlarından dolayı kalp-damar hastalıkları, yaşlılık hastalıkları, katarakt, kanser, bağışıklık sisteminde zayıflama, romatizmal hastalıklar, diyabet, Alzheimer ve sinir sistemi hastalıkları gibi birçok hastalığa veya hastalığın ikincil komplikasyonlarına sebep olurlar (Diplock, 1998). 2.2. Antioksidan Savunma Sistemleri
Reaktif oksijen türlerinin oluşumu ve bunların meydana getirdiği hasarı önlemek üzere vücutta birçok savunma mekanizması bulunur. Bunlara antioksidan savunma sistemleri veya antioksidanlar denir. Bu mekanizmalar; radikallerin ya da başka bir ifade ile oksidanların biyolojik hedeflerle reaksiyona girmesini, radikal zincir reaksiyonları oluşturmalarını veya oksijenin oldukça reaktif ürünlere dönüşmesini engelleyerek oluşacak hasarı en aza indirmeye çalışırlar (Bagchi ve Puri, 1998; Azzi ve ark., 2004). Doğal antioksidanlar; etki mekanizmalarına göre enzimatik ve enzimatik olmayan (non-enzimatik) antioksidanlar olarak iki gruba ayrılır. Bu antioksidanlardan enzimler ve düşük moleküler ağırlıklı moleküller vücutta üretilmektedir. Enzimatik olmayan antioksidanlar ise genellikle vücuda beslenme yoluyla alınmaktadır.
Bu moleküllerin başında polifenoller gelmektedir. Ayrıca vitaminler, karotenoidler, organosülfürlü bileşikler ve mineraller de non-enzimatik antioksidan sınıfına girmektedir (Cihaner, 2009).
Serbest radikaller ve olası hasarları, antioksidan bileşiklerle beraber antioksidan enzimler tarafından denetlenmektedir.
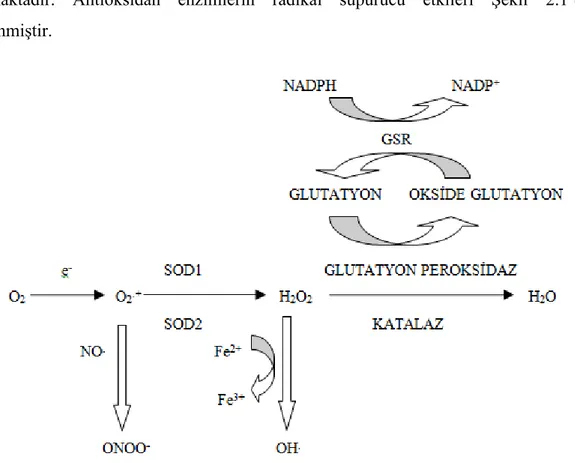
Organizmada meydana gelen serbest radikalleri zararsız hale getirmeye çalışan süperoksit dismutaz (SOD), katalaz (CAT), glutatyon peroksidaz (GPx) ve glutatyon
S-5
transferaz (GST) gibi enzimler hücreleri serbest radikallerin toksik etkilerine karşı korumaktadır. Antioksidan enzimlerin radikal süpürücü etkileri Şekil 2.1’de özetlenmiştir.
Şekil 2.1. Serbest radikallerin oluşumu ve antioksidan enzimlerin serbest radikalleri ortadan
kaldırıcı etkileri.
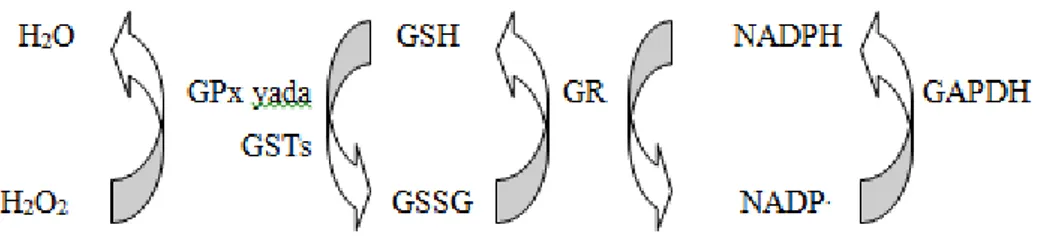
SOD enzimi hem sitoplazmada hem de mitokondride süperoksit radikallerini hidrojen peroksite çevirmekte, peroksizomal CAT ve sitoplazmik GPx enzimleri ise oluşan hidrojen peroksiti hidroksil radikaline dönüşmeden nötralize etmektedirler. GPx enzimi hidrojen peroksiti indirgemede antioksidan molekül olan indirge glutatyonu (GSH), kullanır. Yine aynı şekilde sitoplazmik GST enzimleri de indirge glutatyonu kullanarak hücrelerdeki oksidan stresi azaltmaya yönelik görev alır (Şekil 2.2). GST’ler aynı zamanda oksidatif olarak modifiye edilmiş molekülleri hücre içerisinde detoksifiye ederek, hücresel peroksitleri de etkisiz hale getirirler (Kwag ve ark., 1999).
6
Şekil 2.2. Antioksidan enzimlerin glutatyon redoks döngüsü ile beraber serbest radikal
kaynaklarını ortadan kaldırma mekanizması.
Polifenoller; flavonoidler, antosiyaninler, lignanslar, fenolik asitler ve stilbenleri içeren bir antioksidan ailesidir. Polifenolik bir bileşik olan resveratrol (3,4,5-trihydroxystilbene) (Şekil 2.3) stilbenlerin alt grubu olup üzüm, şarap, yer fıstığı ve yabanmersininde bulunur (Li ve ark., 2006).
Şekil 2. 3. Trans-Resveratrol’ün molekül şekli.
Antioksidan, anti-inflamatuar ve anti-apoptotik etkileri olan resveratrolün, diyabetin patofizyolojisinde oksidatif hasara karşı koruma özelliği çeşitli çalışmalarda gösterilmiştir (Robb ve ark., 2008).
Diyabetik hayvanlarda insülinin etkisini arttırıcı bir etki gösteren resveratrol (Su ve ark., 2006), pro-oksidatif ve anti-oksidatif enzimlerin (NOX, SOD1 ve GPx1) mRNA ve protein düzeylerinde meydana getirdiği değişikliklerle (Spanier ve ark., 2009) antioksidan enzimlerin etkinliklerini düzenleyebilmektedir (Mokni ve ark., 2007; Robb ve ark., 2008). Ayrıca biyolojik sistemlerde bulunan antioksidanların hücre içi miktarlarının sürdürülmesini de sağlamaktadır. Yapılan bir çalışmada, resveratrolün hidrojen peroksit ile aktive olan insan lenfositlerinde glutatyon miktarını arttırdığı belirtilmiştir (De La Lastra ve Villegas, 2007).
7
Başka bir çalışmada ise resveratrolün insan lenfositlerinde GPx, GR ve GST gibi glutatyon metabolizmasıyla ilgili enzimlerin miktarını arttırdığı gösterilmiştir (Das ve Maulik, 2006).
2.3. Diabetes Mellitus
Diabetes mellitus (DM), insülin hormonunun üretiminin ve/veya insüline karşı doku cevabının mutlak veya göreceli olarak azlığı sonucunda karbonhidrat, protein ve yağ metabolizmasında bozukluklara sebep olan kronik hiperglisemik bir metabolizma hastalığıdır. Tip I ve Tip II olmak üzere bilinen iki tipi bulunmaktadır (Şekil 2.4).
Şekil 2.4. Diyabet çeşitlerinin ortaya çıkışında görülen farklılıklar (Anonim, 2016).
Diyabet tiplerinden ilki, insüline bağımlı diyabet olarak adlandırılan ve genellikle genç yaşlarda görülen Tip I diyabettir. Pankreastaki beta hücrelerinin viral yollarla ya da otoimmün sistemlerce hasar görmesi sonucu insülin üretme yeteneklerini yitirmeleri sonucu oluşan diyabet çeşididir (Şekil 2.4B). Tip II olarak adlandırılan diğer bir diyabet tipi ise genellikle yetişkin ve kilolu insanlarda görülür. Her iki diyabet tipinde de başlangıç sebepleri farklı olmasına rağmen hastalığın seyrinde, insülin salınımında ya da insülin hormonu duyarlılığında (ya da her ikisinde) bozukluklar (Şekil 2.4C) olmaktadır (Kazkayası, 2011).
8
Gestasyonel diyabet gebeliğe bağlı ve gebelik sürecinde ortaya çıkan hiperglisemi halidir. Tip 2 diyabetle daha çok benzerlik gösterir. Bu hastalıkta da daha az insülin salgılanması ya da insülin direnci gelişmesi söz konusudur.
2.4. İnsülin Sentezi, İnsülin Sinyal Yolağı ve Etki mekanizması
İnsülin, pankreastaki beta hücreleri tarafından üretilen yaklaşık 5800 dalton molekül ağırlıklı, sülfür bağları ile bağlı iki polipeptid zincirinden (Şekil 2.5) oluşan bir hormondur.
Şekil 2. 5. İnsülin hormonunun yapısı.
İnsülin, hidrofobik pre-proinsülin formunda granüler endoplazmik retikulum üzerinden taşınarak golgi kompleksinde sentezlenir. Pre-proinsülinin insüline dönüşümünde Ca+2
bağımlı endopeptidaz enzimi sorumludur (Gürlek ve Kayaalp, 2005). İnsülin salınımını
uyaran en önemli ekzojen maddeler arasında glikoz ve aminoasitler, endojenler içinde ise glukagon, gastrointestinal hormonlar (sekretin, gastrin, vazoaktif intestinal peptit, kolestokinin), büyüme hormonu, glukokortikoidler, prolaktin, cinsiyet hormonları sayılabilir (Gürlek ve Kayaalp, 2005).
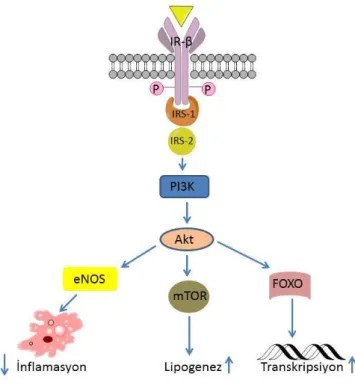
İnsülin hormonu etkisini hücresel düzeyde etkili anahtar proteinler yoluyla gösterir. Bu proteinler insülin reseptöründen (İnsülin Rβ) başlamak üzere hücresel aktiviteden sorumlu birçok transkripsyon faktörüne kadar devam etmektedir (Şekil 2.6).
İnsülinin reseptörüne bağlanması, insülin reseptör substrat (IRS) ailesinin üyeleri olan birçok adaptör proteini aktive eder. Bunun sonucunda bir lipit kinaz olan PI3-kinaz aktifleşir (Lizcano ve Alessi, 2002).
9
PI3-kinazın sinyal yolağında, akış-aşağı efektörü hücre zarından serbest bırakılan Akt proteinidir.
Şekil 2.6. İnsülin-PI3K-Akt sinyal iletim yolağı elemanları ve aralarındaki normal fonksiyonel
ilişkiler mavi oklarla gösterilmiştir.
Akt, aktifleştirildikten sonra sitoplazmaya girer ve bu da glikoneojenez ve glikojenoliz üzerinde etkili çeşitli substratların fosforilasyonuna neden olur. Substratlarından biri de serin-treonin kinaz olarak işlev gören mTOR proteindir. PI3-kinaz ve Akt proteinlerinin GLUT4 translokasyonunda rol oynadığı bilinmektedir (Lizcano ve Alessi, 2002). Ayrıca, Akt tarafından fosforilasyonun ardından çekirdeğe yönlendirilen forkhead transkripsiyon faktörleri (FOXO), insülin sinyal yolağında gen ekspresyonu regülasyonunda görev almaktadır (Barthel ve ark., 2001; Schmoll ve ark., 2000). Dolaşımdaki insüline karşı biyolojik yanıtın azalması insülin direnci olarak tanımlanır ve özellikle tip 2 diyabet ve insülin direnci arasında doğrudan bir ilişki bulunmaktadır. İnsülin direncinin ortaya çıkmasında genetik etmenlere ilave olarak çevresel etmenlerin etkisi de oldukça önemlidir. Çevresel etmenlerin en önemlileri şişmanlık (obezite) ve hareketsizliktir. Ayrıca, insülin sinyal iletiminde meydana gelen bozukluklarda insülin direnci oluşturabilmektedir.
10 2.3.1. Diyabet ve Oksidatif Stres
Son yıllarda yapılan çalışmalarda, diyabette gelişen komplikasyonların artan oksidatif strese bağlı olduğu bildirilmektedir. Oksidatif stres, diyabet ve diyabetin daha sonraki komplikasyonlarında etkin olarak rol almaktadır. Bununla beraber diyabette oksidatif stresi artıran mekanizmalar olarak antioksidan savunma sistemindeki çeşitli değişikliklerin yanında, enzimatik olmayan glikozilasyon, otooksidatif glikozilasyon, sorbitol yolu aktivitesi, hipoksi gibi nedenler gösterilmektedir (Brownlee, 2001; Baynes ve Thorpe, 1999). Oksidatif stresin artması, diyabet ve komplikasyonlarının gelişimini ve ilerlemesini arttırmaktadır (Ayan, 2007).
Diyabetin hasar oluşturduğu hedef organlar arasında böbrekler önemli yer tutmaktadır. Diyabette kolay oluşan idrar yolu ve renal enfeksiyonlar ve makrovasküler bozulmalar nefropati gelişimine zemin hazırlamaktadır (King ve ark., 1998).
2.3.2. Diyabet, İnflamasyon ve İnsülin Direnci
İnflamasyon, organizmanın endojen ve/veya ekzojen uyaranlara karşı başlattığı yaşamın devamlılığı için gerekli fakat spesifik olmayan bir yanıtıdır. Bu yanıtın biyolojik amacı, uyaranın neden olduğu hücresel yaralanmayı tamir etmek, hücre ve yabancı cisim atıklarını temizlemek, bakteri ve/veya uyaranı sınırlandırarak organizma üzerine olan zararlı etkileri engellemektir. Diyabetin patogenezinde hem vücutta artan oksidatif stresin varlığı, hem de inflamatuar aktivitenin etkin olduğuna dair kanıtlar gün geçtikçe artmaktadır. Örneğin diyabetle plazma TNF-α düzeylerinin arttığı ve proinflamatuar bir sitokin olan TNF-α'nın insülin direncine neden olduğu saptanmıştır (Hotamisligil ve ark., 1993).
Başka bir çalışmada ise diyabet modeli oluşturulmuş sıçanların adipoz dokularında TNF-α, IL-1β, IL-6, IL-10, leptin ve adiponektin gibi birçok sitokin ve mediyatörün düzeylerinde artış gösterilmiştir (Shoelson ve ark., 2006).
Bununla birlikte, diyabet T ve B hücrelerini uyararak bağışıklık sistemini aktive etmektedir (Sell ve ark., 2012). İnterlökin-1β (IL-1β), interlökin-6 (IL-6), interlökin-8 (IL-8), tümör nekroz faktör-α (TNF-α) ve monosit kemoatraktan protein-1 (MCP-1) gibi
11
proinflamatuar adipokinlerin birçoğu beyaz adipoz doku tarafından üretilmekte ve bu bileşiklerin tümü insülin direnciyle ilişkilendirilebilmektedir.
2.5. Konu ile İlgili Diğer Literatür Çalışmaları
Resveratrol (3,4’,5-trihydroxystilbene), fıstık itadori çayı ve üzüm gibi bitkiler tarafından çeşitli enfeksiyon durumlarına karşı sentezlenen polifenolik bir bileşiktir (Szkudelska ve Szkudelski, 2010). Bu bileşiğin moleküler etki mekanizmaları tam olarak aydınlatılmasada, kardiyoprotektif, anti-tümör ve anti-inflamatuar etkileri çeşitli çalışmalarla kanıtlanmıştır (Brasnyó ve ark., 2011; Palsamy ve Subramanian, 2011; Yu ve ark., 2013). Ayrıca, diyabetin patofizyolojisinde oksidatif hasara karşı koruma yeteneği ve enzimlerin gen ekspresyonu seviyelerini etkilediği de çeşitli çalışmalarda gösterilmiştir (Robb ve ark., 2008; Sadi ve ark., 2014).
Resveratrolün anti-diyabetik etkilerinin ise insülin sinyal yolağında meydana geldiği ileri sürülmüş ve insülin reseptörü (IR) ile resveratrolün bağlanmasının insülin reseptörü substrat 1 (IRS-1) ve insülin reseptörü substrat 2 (IRS-2) fosforilasyonunu uyardığı bulunmuştur (Liu vd., 2008). Resveratrolün diyabetik sıçanlarda karbonhidrat metabolizmasında yer alan bazı enzimlerin (hekzokinaz, piruvat kinaz, laktat dehidrojenaz, glu-6 fosfataz, Fru 1,6 bifosfataz, Glu-6P dehidrojenaz, glikojen sentaz ve fosforilaz) aktiviteleri üzerine etkileri araştırılmış ve karbonhidrat metabolizmasında yer alan bu enzimlerin aktivitelerindeki değişimler belirlenmiştir (Palsamy ve Subramanian, 2009). Resveratrolün insan endotel hücrelerinde antioksidan enzimlerin (SOD-1 ve GPx) mRNA ve protein düzeylerinde meydana getirdiği değişiklikleri gösteren (Spanier ve ark., 2009) ve diyetle alınan resveratrolün fare beyinlerinde antioksidan enzimlerin aktivitelerini değiştirdiğini (Mokni ve ark., 2007; Robb ve ark., 2008) belirten çalışmalar, resveratrolün metabolik ve diyabete karşı koruyucu etkileri üzerinde yoğunlaşmışlardır.
Resveratrol antioksidan özelliği ile hücreyi oksidatif hasara ve inflamasyona karşı koruyabilmektedir. Antioksidan, anti-inflamatuar, anti-apoptotik etkileri olan resveratrolün karaciğer dokularında meydana gelen inflamasyon ve oksidatif hasara karşı koruma yeteneği diyabetik hayvan modelleri kullanılarak gösterilmiştir (Sadi ve
12
ark., 2015b). Ayrıca antioksidan savunmasında görev alan enzimlerin ifadelenmesini düzenleyici etkileri de belirlenmiştir (Sadi ve Konat., 2015b).
STZ ile oluşturulmuş diyabetli sıçanlarla yapılan bir çalışmada resveratrolün renal fonksiyon kaybını ve oksidatif stresi büyük oranda azalttığı anlaşılmıştır. Aynı şekilde resveratrol uygulanmış, yüksek glikozla indüklenmiş hücrelerde oksidatif stresin ve apoptotik değişikliklerin azaldığı gözlenmiştir (Sharma ve ark., 2006; Su ve ark.,2006) Ghanim ve arkadaşlarının yaptığı bir çalışmada, resveratrol ve üzüm kabuğu polifenollerinin kombinasyonundan oluşan bir takviyenin, karbonhidrat ve lipit bakımından zengin bir yemekten sonra insanlardaki etkisi ölçülmüş, Nrf2 ve glutatyon-S-transferaz gibi antioksidan enzimlerin ekspresyonunda artış gözlenmiştir (Ghanim ve ark., 2010).
Chi ve arkadaşları (2007) resveratrol uygulamasının STZ-diyabetik ve normal ratlarda insülin düzeyini arttırdığını, resveratrolün STZ ile diyabetik hale getirilmiş ratlarda 90 dakika sonra hipoglisemik etki gösterdiğini yayınlamışlardır. Bunun sonucunda resveratrolün hipoglisemik etki göstermesinde insüline bağımlı ve bağımlı olmayan mekanizmaların etkili olduğunu ileri sürmüşlerdir.
Brasnyó ve arkadaşlarının yapmış olduğu bir çalışmada, diyabetik hastalarda resveratrol takviyesinin oksidatif stresi azaltarak, insülin sinyal iletimi Akt yolağının daha etkili olmasını sağladığı ve insülin duyarlılığını geliştirmede katkıda bulunduğu tespit edilmiştir (Brasnyó ve ark., 2011).
Son yıllarda yapılan çalışmalar, karaciğer dokusunda bozulmuş glikoz metabolizmasının IRS-1 IRS-2, eNOS ve sirtuin-1 protein içeriklerini etkileyerek insülin sinyal yolu üzerindeki olumsuz etkilerini göstermiştir (Babacanoglu ve ark, 2013; Sadi ve ark., 2015a).
Bazı bitkilerde doğal olarak bulunan resveratrol, antioksidan ve anti-inflamatuar etkileriyle doku ve hücrelerde IRS-1 IRS-2, sirtuin-1 ve FOXO3a yollarını düzenleyebilmektedir (Babacanoglu ve ark, 2013; Yu ve ark, 2013). İnsülin reseptörünü uyararak IRS-1 ve IRS-2 fosforilasyonunu etkilediği (Liu ve ark., 2015) gösterilen
13
resveratrol, IRS-1, PI3K ve Akt fosforilasyonunu azaltarak endotelyal nitrik oksit sentazın (eNOS) doku fonksiyonlarını düzenlemektedir (Symons ve ark., 2009).
Yapılan bir çalışmada, insan tübüler epitel hücrelerinde (HK-2), yüksek glikoz tarafından indüklenen epitel mezenkimal geçişe (EMG) karşı resveratrolün etkisi ve ilgili mekanizması incelenmiştir. Bulunan sonuçlar resveratrolün, renal tübüler hücrelerde, yüksek glikoz kaynaklı EMG karşı NADPH oksidaz-ROS-ERK1/2 yolağının baskılanmasını sağlayan güçlü bir ajan olduğu gösterilmiştir (He ve ark., 2014).
Vasküler düz kaslar üzerinde yapılan birçok çalışmada resveratrolün eNOS aktivasyonuna neden olarak vasküler reaktiviteyi artırdığı da gösterilmiştir (Akar ve ark., 2012; Rakici ve ark., 2005). Bununla birlikte, hiperglisemi ile senkronize gelişen metabolik sendrom modeli oluşturulmuş dişi ve erkek sıçanların torasik aortalarında resveratrolün eNOS, IRS-1 ve IRS-2 ile insülin duyarlılığının önemli bir parametresi olan SIRT1 düzeylerini artırdığı, iNOS, plazma trigliserit ve VLDL düzeylerini azalttığı gösterilmiştir (Pektaş ve ark., 2015). Resveratrol, metabolik sendrom ve diyabet modeli oluşturulmuş sıçanların karaciğer dokularında da koruyucu etkinlik göstermiştir. Fruktoz tüketimi sonucu gelişen karaciğer yağlanmasını normalize ederken diyabetle gelişen karaciğer dejenerasyonunu azaltmış, insülin duyarlılığını artırmıştır (Sadi ve ark., 2015c).
Pankreas, karaciğer ve hipotalamus gibi pek çok organda diyabetle IL-1 düzeylerinin arttığı ve diyabetin bu dokularda disfonksiyona neden olduğu bildirilmiştir (Lontchi-Yimagou ve ark., 2013).
Diyabet modeli oluşturulmuş farelerin böbrek dokularında ise NfκB, Nrf-2 ve anjiotensinojen düzeylerinin arttığı tespit edilmiştir (Abdo et al., 2014). Benzer bir çalışmada ise diyabet ile böbrek dokularında iNOS düzeylerinin arttığına işaret edilmektedir (Venneri et al., 2015).
Diyabet hastaları üzerinde yapılan bir klinik çalışmada günlük düzenli resveratrol alımının inflamatuar sitokinleri ve oksidaitf stresi azalttığı gösterilmiştir (Marfella et al., 2006). Arterler üzerinde yapılan bir çalışmada ise resveratrol tedavisinin TNF-α ile
14
oluşturulan endoteliyal sitotoksisite üzerinde koruyucu etkisi olduğu saptanmıştır (Xiao et al., 2013).
Streptozotocin ile oluşturulmuş diyabet modelinde, resveratrolün karaciğer ve böbrek dokularında SOD ve aminolevülinik asit düzeylerini yükselttiği saptanmış, bu durum resveratrolün antioksidan etkinliği ile ilişkilendirilmiştir (Schmatz et al., 2012). Diğer bir çalışmada ise, streptozotocin ile diyabet oluşturulmuş sıçanlarda resveratrolün oluşan nörodejenerasyon ve ensefalopatide TNF-α, IL-6 ve NF-kB düzeylerini azalttığı gösterilmiştir (Jing et al., 2013).
15 3. AMAÇ VE GEREKÇE
Diyabette antioksidanların ve/veya oksidanların böbrek yapı ve fonksiyonu üzerine etkilerini düzenleyen mekanizmaların tam olarak aydınlatılamadığı bilinmekte ve birçok bilim insanı tarafından ileri çalışmaların yapılması önerilmektedir. Bu nedenden dolayı böbrek dokularında oksidatif stres ve inflamasyon kaynaklı patolojilerin moleküler seviyede etkilerinin incelenmesi ve bu çalışmaların yaşam kalitesini arttırmak için derinleştirilmesi gerekmektedir.
Son yıllarda labaratuarımızda yapılan çalışmaların birinde, tip 1 diyabetin karaciğer dokularında insülin sinyal iletiminde görev alan gen ve/veya proteinleri baskıladığı, dolayısıyla insülin direncine katkıda bulunduğu ortaya çıkarılmıştır (Sadi ve ark., 2015a). Ayrıca insülin sinyal iletimine ait gen ve proteinlerin baskılanmasının doku inflamasyonu ile doğrudan ilişkili olduğu gösterilmiştir. Fakat günümüz literatür bilgisi böbrek dokularının diyabette nasıl etkilendiğini, antioksidan enzimlerin ve insülin sinyal iletiminin nasıl düzenlendiğini moleküler düzeyde henüz tam olarak aydınlatamamaktadır.
Gerçekleştirdiğimiz bu çalışmanın birinci amacı, diyabetin böbrek dokularında oksidatif stres ve inflamasyon durumu oluşturup oluşturmayacağını belirlemektir. Bu kapsamda diyabetik hayvanların böbrek dokularında lipit peroksidasyonu son ürünü olan MDA düzeyleri ve inflamatuar sitokinlerden IL-1β, IL-6, IL-8 ve TNF-α düzeyleri biyokimyasal yöntemlerle belirlenmiştir. Ayrıca oksidatif ve inflamatuar değişimlerin antioksidan enzimleri (SOD, CAT, GST, GPx) nasıl etkilediğini moleküler üç düzeyde; mRNA, protein, aktivite ortaya çıkarmak, resveratrol gibi kuvvetli bir antioksidan molekülün diyabetin neden olduğu olası değişimleri iyileştirici veya düzenleyici etkilerini belirlemektir.
Çalışmamın ikinci amacı ise diyabetin ve/veya resveratrolün insulin-PI3K/Akt sinyal iletim yolağındaki potansiyel etkilerini sıçan böbrek dokularında analiz etmektir.
16
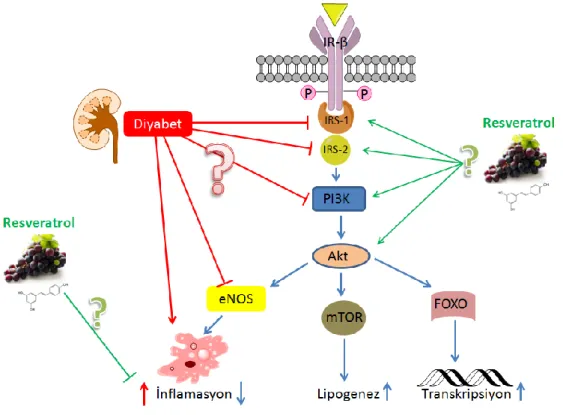
Bu bağlamda inflamasyon belirteçleri ve insülin sinyal iletimi ile ilgili bileşenler moleküler düzeyde araştırılacak, inflamasyon ve insülin sinyal iletim yolağındaki değişiklikler ilişkilendirilerek resveratrolün diyabet patolojisindeki moleküler etkileri böbrek dokularında ortaya çıkarılacaktır. Kısacası çalışmanın bu amacı Şekil 3.1’de belirtilen soru işaretli yerlerin aydınlatılmasıdır.
Şekil 3. 1. Diyabetin ve/veya resveratrolün insülin sinyal iletimi üzerine olası etkileri.
Diyabetin düşünülen olası etkileri kırmızı oklarla, resveratrolün olası etkileri ise yeşil oklarla belirtilmiştir. Ok işaretleri aktivasyonu, blok işaretleri baskılanmayı göstermektedir.
17 4. MATERYAL VE YÖNTEM
4.1. Materyal
4.1.1. Kullanılan Kimyasal Maddeler
Streptozotocin, Bakır (II) sülfat pentahidrat (CuSO4.5H2O), Sodyum hidroksit (NaOH),
Hidroklorik asit (HCl), Sodium dodecyl sulfate (SDS), Ammonium persulfate (APS), Tween-20, Sodyum klorür (NaCl), KH2PO4, Serum albümini (BSA), Na-K tartarat,
Folin-fenol reaktifi, Ammonium persulfate (APS), Tween-20, Gliserol, Glutathione, Glutathione redüktaz, Akrilamit, Bisakrilamit (Sigma). Resveratrol (Molekula). Tris-HCl, yağsız süt tozu (AppliChem). Ethylenediaminetetraacetic acid (EDTA), Tetramethylethylenediamine (TEMED) (Amresco). Posasyum klorür (KCI), Pyrogallol, Amonyum sülfat, Glisin, Sodyum karbonat (Merck).
4.1.2. Kullanılan Kitler
RNeasy Toplam RNA saflaştırma kiti (Qiagen), cDNA sentez kiti (Fermentas), FastStart Universal SYBR Green Master Mix with Rox (Roche), ClarityTM ECL reagent
kit (Biorad).
4.1.3. Kullanılan Antikorlar
Anti-CAT Rabbit IgG, Anti-GPx Rabbit IgG, Anti-SOD-2 Rabbit IgG, Anti-GAPDH Rabbit IgG, Rabbit Anti AKT IgG, Rabbit Anti CAT IgG, Rabbit Anti İNOS IgG, Rabbit Anti IR-β IgG, Rabbit Anti PI3K IgG, Rabbit Anti SIRT IgG, Goat Anti Rabbit IgG-HRP (Santa Cruz). Anti-SOD-1 Rabbit IgG (Callbiochem).
4.1.4. Kullanılan Primerler
Kullanılan bütün primerler Iontek (Bursa, Türkiye) firmasında sentezlenmiştir. Böbrek dokularında antioksidan enzimler ve insülin sinyal iletim yolağı ile ilişkili genlere ait mRNA miktarları, SYBR Green I reaksiyon kimyası ve gerçek zamanlı PCR ile Çizelge 4.1’de belirtilen primer çiftleri kullanılarak belirlenmiştir.
18
Çizelge 4.1. Antioksidan enzimler ile insülin sinyal iletim yolağında bulunan bazı genlerin
ekspresyon analizlerinde kullanılan primer çiftleri.
Gen ismi İleri primer (5’3’) Geri primer (5’3’)
Gapdh TCCTTGGAGGCCATGTGGGCCAT TGATGACATCAAGAAGGTGGTGAAG
Cat GCGAATGGAGAGGCAGTGTAC GAGTGACGTTGTCTTCATTAGCACTG
Gpx CCACCACCGGGTCGGACATAC CTCTCCGCGGTGGCACAGT
sod-1 TAGCAGGACAGCAGATGAGT GCAGAAGGCAAGCGGTGAAC
sod-2 GCACATTAACGCGCAGATCA AGCCTCCAGCAACTCTCCTT
gst-mu AGAAGCAGAAGCCAGAGTTC GGGGTGAGGTTGAGGAGATG
insülin Rβ GTGCTGCTCATGTCCTTAGA AATGGTCTGTGCTCTTCGTG
irs-1 GCCAATCTTCATCCAGTTGC CATCGTGAAGAAGGCATAGG
irs-2 CTACCCACTGAGCCCAAGAG CCAGGGATGAAGCAGGACTA
Enos TGCACCCTTCCGGGGATTCT GGATCCCTGGAAAAGGCGGT
İnos CAATCCACAACTCGCT TCCCGAAACGCTACACT
sirt1 CGGTCTGTCAGCATCATCTTCC CGCCTTATCCTCTAGTTCCTGTG
4.2. Deneysel Diyabetin Oluşturulması ve Resveratrolün Uygulaması
Deneylerde kullanılan eşit yaşta erkek Wistar sıçanları Kobay Deney Hayvanları Laboratuvarı AŞ’den satın alınmıştır. 48 Adet erkek eşit yaşta sıçanın bakımı, diyabet oluşturulması, resveratrolün günlük olarak enjeksiyonu, veteriner hekim gözetiminde yerel etik kurul onayı ile (KMU yerel etik kurulu 04.08.2011 tarihli 02/01 sayılı onay) hayvan deneyleri kullanım sertifikasına sahip araştırmacılar tarafından gerçekleştirilmiştir. Deney hayvanları üzerine yapılan uygulamalar Şekil 4.1’de özetlenmiştir. Buna göre 48 adet eşit yaşta, yaklaşık eşit ağırlıkta (>300 gr) erkek Wistar rat; Kontrol (K), Diyabetik (D), resveratrol verilmiş kontrol (K+RSV), resveratrol verilmiş diyabetik (D+RSV) olmak üzere dört gruba ayrılmıştır.
İki grupta diyabet, 50 mM sitrat tamponu (pH: 4,5) içerisinde hazırlamış streptozotocin(STZ)’nin (55 mg/kg) intraperitoneal yoldan enjekte edilmesiyle oluşturulmuştur. Kontrol hayvanlarına ise sadece 0,3 ml 50 mM sitrat tamponu (pH:4,5) verilmiştir.
19
Şekil 4.1. Diyabetin hayvansal modelinin oluşturulması ve resveratrol uygulaması.
STZ uygulamasının iki gün sonrasında kuyruk toplardamarından alınan kanlarda, açlık kan şekeri ölçümü Abbott (Abbott Laboratories, Abbott Park, Illinois, USA) şeker ölçüm cihazı ile gerçekleştirilmiş, açlık kan şekerleri 200 mg/dl’nin üzerinde olan hayvanlar diyabetik olarak kullanılmıştır. STZ enjeksiyonun bir hafta sonrasında K+RSV ve D+RSV gruplarına resveratrol 20 mg/kg olacak şekilde %10’luk DMSO içerisinde sıçanların intraperiton bölgelerine enjeksiyonu ile 24 gün boyunca günlük olarak verilmiştir. Aynı süre zarfında K ve D gruplarına sadece %10’luk DMSO enjekte edilmiştir. Sıçan ağırlıkları günlük, açlık kan şekerleri ise haftalık olarak ölçülmüştür. Diyabet grubuna resveratrol verildikten iki hafta sonra, bu gruptaki (D+RSV) hayvanlardan biri ölmüş ve ikisi ise diyabetik durumdan kurtulmuştur (AKŞ<110mg/dl). Bu nedenle D+RSV grubu örnek sayısı dokuza inmiştir (n=9). Diyabetik durumdan kurtulan hayvanların dokuları, deneylerin optimizasyonu için kullanılmıştır.
20
Diyabet ve resveratrol uygulamalarının ardından deney hayvanları, anestezi uygulamadan giyotin ile dekapite edilmiş, böbrek dokuları sıvı azot içerisinde dondurulmuş ve deneylerde kullanılmak üzere -85oC de saklanmıştır.
4.3. Böbrek Dokularının Homojenizasyonu
Böbrek dokusu örneklerinin yağlı bölge ve adrenal bez içermeyen bölümleri, 3 katı kadar hacimde homojenizasyon tamponu (50 mM fosfat tamponu (pH:7,0), 5 mM EDTA, 0,5 mM PMSF, 1,15 % KCI) içerisinde homojenizatör (Tissue RuptorTM,
Qiagen, ABD) kullanılarak homojenize edilmiştir (Şekil 4.2).
Şekil 4.2. Böbrek dokularının homojenizasyonu.
Homojenizasyonu takiben nüklear kısım ve parçalanmayan hücrelerin ayırımı için örnekler 1500×g’de 4°C derecede 15 dakika süreyle santrifüj edilmiştir. Oluşan süpernatanlar ependorf tüplerine aktarılarak -85 °C’de muhafaza edilmiştir.
4.4. Böbrek Dokularında Gerçekleştirilen Biyokimyasal Ölçümler
4.4.1. Toplam Protein Tayini
Homojenize edilen dokularda toplam protein konsantrasyonu, mikoplaka ölçümlerine uyarlanmış Lowry yöntemine (Lowry ve ark., 1951) göre belirlenmiştir. Bu yöntemde alkali ortamda bakır iyonu (Cu+2) proteinlerdeki peptid bağlarıyla kompleks
oluşturmakta ve Cu+1’ e indirgenmektedir. İndirgenmiş bakır yine proteinlerde yer alan
21
reaktifini indirgeyerek protein konsantrasyonu ile doğru orantılı olarak renk değiştiren ve 660 nm’de spektrofotometrik olarak ölçülebilen ürün oluşturmaktadır.
Yönteme göre toplam protein tayini yapabilmek için 96’lık mikroplaka kuyucuklarına 50 kat seyreltilmiş örnekler ve standart BSA (0,02-0,75 mg/ml) çözeltileri 40 µl olarak yüklenmiştir. Üzerlerine 200 µl ACR reaktifi [(Reaktif I (%2 CuSO4.5H2O): Reaktif II
(%2 Na-K Tartarat): Reaktif A (0,1 N NaOH içerisinde %2 Na2CO3)(1:1:100 oranında)]
eklenerek oda sıcaklığında ve karanlıkta 10 dakika inkübe edilmiştir. Bekleme süresinin ardından örnekler üzerine 20 µl Folin-fenol reaktifi (1 N) eklenerek karanlıkta 30 dakika renk oluşumu sağlanmıştır.
Örneklerin renk yoğunluğu spektrofotometrik mikroplaka okuyucusu (MultiScanGo, Thermo, ABD) kullanılarak 660 nm’de ölçülmüş, oluşturulan kalibrasyon eğrisi (Şekil 4.3) yardımı ile protein miktarları hesaplanmıştır.
Şekil 4.3. Mikro Lowry yöntemi ile oluşturulan BSA standart kalibrasyon eğrisi. X-ekseni
standart protein konsantrasyonunu (mg/ml), Y ekseni ise 660 nm absorbans değerlerini ifade etmektedir.
4.4.2. Doku Glikoz Ölçümü
Doku homojenatında Glikoz düzeyleri enzimatik hekzokinaz yöntemi ile Spinreact marka ticari kitler kullanılarak (Spinreact, SA., Santa Coloma, Spain) prospektüste belirtildiği şekilde gerçekleştirilmiştir. Sonuçlar doku homojenatının protein düzeyiyle oranlanarak mg/g protein olarak verilmiştir.
22 4.4.3. Doku Total Kolesterol Ölçüm Yöntemi
Doku homojenatında Total Kolesterol düzeyleri enzimatik kolorimetrik kolesterol oksidaz-peroksidaz yöntemi ile Spinreact marka ticari kitler kullanılarak (Spinreact, SA., Santa Coloma, Spain) prospektüste belirtildiği şekilde gerçekleştirilmiştir. Sonuçlar doku homojenatının protein düzeyiyle oranlanarak mg/g protein olarak verilmiştir.
4.4.4. Doku Trigliserid Ölçüm Yöntemi
Doku homojenatında Trigliserid düzeyleri enzimatik kolorimetrik gliserol-3-oksidaz-peroksidaz yöntemi ile Spinreact marka ticari kitler kullanılarak (Spinreact, SA., Santa Coloma, Spain) prospektüste belirtildiği şekilde gerçekleştirilmiştir. Sonuçlar doku homojenatının protein düzeyiyle oranlanarak mg/g protein olarak verilmiştir.
4.4.5. Doku Malondialdehit (MDA) Ölçüm Yöntemi
Doku homojenatında lipit peroksidasyonu son ürünü olan MDA seviyeleri, HPLC yöntemi ile Chromsystems Diagnostics (Munich/Germany)’den sağlanan kit ve HPLC floresan dedektör (Ex:515 Em:553 nm) ile belirlenmiştir. Sonuçlar doku homojenatının protein düzeyiyle oranlanarak µmol/g protein olarak ifade edilmiştir.
4.4.6. Doku IL-1β Düzeylerinin Ölçümü
Doku homojenatında IL-1β ölçümü eBioscience marka Rat IL-1β Platinum Elisa kiti ile yapılmıştır (Bender MedSystems GmbH, Vienna, Austria). Absorbans okuması ChemWell 2910 marka elisa okuyucu cihazında yapılmıştır (Awareness Technology, Inc. Martin Hwy. Palm City, USA). Sonuçlar doku homojenatının protein düzeyiyle oranlanarak ng/g protein olarak verilmiştir.
4.4.7. Doku IL-6 Düzeylerinin Ölçümü
Doku homojenatında IL-6 ölçümü eBioscience marka Rat IL-6 Platinum Elisa kiti ile yapılmıştır (Bender MedSystems GmbH, Vienna, Austria). Absorbans okuması ChemWell 2910 marka elisa okuyucu cihazında yapılmıştır (Awareness Technology,
23
Inc. Martin Hwy. Palm City, USA). Sonuçlar doku homojenatının protein düzeyiyle oranlanarak ng/g protein olarak verilmiştir.
4.4.8. Doku IL-8 Düzeylerinin Ölçümü
Doku homojenatında IL-8 ölçümü eBioscience marka Rat IL-8 Platinum Elisa kiti ile yapılmıştır (Bender MedSystems GmbH, Vienna, Austria). Absorbans okuması ChemWell 2910 marka elisa okuyucu cihazında yapılmiştir (Awareness Technology, Inc. Martin Hwy. Palm City, USA). Sonuçlar doku homojenatının protein düzeyiyle oranlanarak ng/g protein olarak verilmiştir.
4.4.9. Doku TNF-α Düzeylerinin Ölçümü
Doku homojenatında TNF-α ölçümü e Bioscience marka Rat TNF-α Platinum Elisa kiti ile yapılmıştır (Bender MedSystems GmbH, Vienna, Austria). Absorbans okuması ChemWell 2910 marka elisa okuyucu cihazında yapılmıştır (Awareness Technology, Inc. Martin Hwy. Palm City, USA). Sonuçlar doku homojenatının protein düzeyiyle oranlanarak ng/g protein olarak verilmiştir.
4.5. Böbrek Dokularında Antioksidan Enzimlerin ve İnsülin Sinyal İletim Yolağındaki Proteinlerin Western Blot Tekniği İle Belirlenmesi
Antioksidan enzimlerin ve insülin sinyal iletim yolağındaki genlerin böbrek dokusundaki protein düzeyindeki farklılıklar Western blot tekniği ile belirlenmiştir. Bu teknik dört temel aşamadan oluşmaktadır.
1. Proteinlerin SDS-PAGE ile birbirinden moleküler ağırlıklarına göre kısmi olarak ayrılması,
2. Jeldeki proteinlerin PVDF membranlara transferi (Western blot), 3. PVDF membran üzerindeki proteinlerin antikorlarla etiketlenmesi,
24
SDS-PAGE tekniği genellikle proteinlerin moleküler büyüklüğünü analiz etmek amacıyla kullanılan elektroforetik bir yöntemdir. Ancak Western blot tekniğinde ön basamak olarak proteinleri ayrıştırarak antikorlarla işaretlenmelerini kolaylaştırmaktadır.
Yönteme başlamadan önce poliakrilamit jellerin uygun yüzdelerde hazırlanması gerekmektedir. Kullanılan %12’lik ayırıcı jel; 1,7 ml dH2O, 2 ml akrilamit (%30 T, 2,67
C), 1,25 ml ayırıcı jel tamponu (1,5 M Tris-HCl pH: 8,8), 50 µl SDS (10mg/ml), 50 µl amonyum persülfat (APS) (%10 a/h) ve 5 µl TEMED karışımı ile, %4’lük sıkıştırıcı jel ise 3,05 ml dH2O, 0,65 ml Akrilamit (%30 T, 2,67 C), 1,25 ml sıkıştırıcı jel tamponu
(0,5 M Tris-HCl pH: 6,8), 50 µl SDS (10 mg/ml), 25 µl APS (%10 a/h) ve 5 µl TEMED karışımı ile hazırlanmıştır (Çizelge 4.2; Şekil 4.4).
Çizelge 4.2. Poliakrilamit jellerinin hazırlanışı. %12’lik ayırıcı jel %10’lik ayırıcı jel* %4’lük sıkıştırıcı jel dH2O 1,7 ml 2,05 ml 3,05 ml Akrilamit (%30 T, 2,67 C) 2 ml 1,65 ml 0,65 ml 1,5 M Tris.HCl, pH 8,8 1,25 ml 1,25 ml -0,5 M Tris.HCl, pH 6,8 - - 1,25 ml %10 SDS (10 mg/ml) 50 µl 50 µl 50 µl APS (%10 a/h) 50 µl 50 µl 25µl TEMED 5 µl 5 µl 5 µl
*100 kD’un üzerindeki proteinler için %10’luk ayırıcı jeller kullanılmıştır.
25
Ardından örnek yükleme tamponu (62,5 mM Tris-HCI, pH:6,8, %25 gliserol, %2 SDS, %0,01 Bromfenol mavisi, β-mercaptoetanol (%0,05 h/h)) ile 1/1 oranında karıştırılan ve 5 dakika boyunca 95ºC’de bekletilen (Şekil 4.5) örneklerden kuyucuklara eşit miktarlarda protein yüklenmiş (Çizelge 4.3) ve proteinler birbirlerinden 200 V sabit voltajda Mini Protean Tetra elektroforez cihazı (Bio-Rad Laboratories, Hercules CA, USA) kullanılarak yapılan dikey elektroforez ile ayrılmıştır.
Çizelge 4. 3. Western blot yönteminde jellere yüklenen proteinlerin miktarları.
Şekil 4. 5. Örneklerin inkübasyonu, poliakrilamit jellere yüklenmesi ve dikey elektroforez ile
birbirinden ayrılması.
SDS-PAGE yöntemiyle birbirinden ayrılan proteinler sabitlenmek ve antikorlar ile işaretlenmek üzere Western blot tekniği ile PVDF (Polyvinylidene fluoride) membranlara aktarılmıştır (Towbin ve ark.,1979).
Jelden membrana aktarım Trans-blot TurboTM (Bio Rad Laboratories, Hercules CA,
ABD) cihazı kullanılarak yarı kuru ortamda 1 amper akım ile 30 dakikada gerçekleştirilmiştir (Şekil 4.6 ). 100 kD’un üzerindeki proteinler için transfer süresi 45 dakika uygulanmıştır.
İncelenen Protein Jele yüklenen toplam protein miktarı SOD-1 10µg SOD-2 10µg AKT 100µg CAT 20µg İNOS 100µg IR 150µg PI3K 75µg SIRT 50µg
26
Blotlamadan çıkan PVDF membranlar, TBST solüsyonu (0,5 M NaCI, 20 mM Tris pH: 7,4, %0,05 Tween-20) ile üç kez yıkandıktan sonra, membran üzerindeki protein içermeyen bütün bölgelerin kapanmasını (bloklama) sağlayacak %5’lik sığır serum albümini (BSA) (TBST içinde hazırlanmış) ile orbital çalkalayıcıda bir saat çalkalanmıştır.
Şekil 4.6. SDS-PAGE ile birbirinden ayrılan proteinlerin Trans-blot turbo cihazı ile PVDF
membranlara aktarım işlemleri.
Daha sonra membranlar aşağıda belirtilen primer antikorlarla (İnsülin Rβ, IRS-1, iNOS, CAT, SOD-1, SOD-2, PI3K ve Akt) oda sıcaklığında ve çalkalayıcıda iki saat bekletilmiştir. Kullanılan primer ve sekonder antikorlar ve seyreltme oranları Çizelge 4. 4 ve 4.5’de özetlenmektedir. Membranlar, TBST tamponu ile beş kez yıkandıktan sonra Horse Radish Peroksidaz (HRP) ile konjuge edilmiş ikincil antikorlarla (Goat Anti Rabbit IgG-HRP, Santa Cruz, ABD) aynı şekilde bir saat muamele edilmiştir.
27 Çizelge 4. 4. Kullanılan antikorlar ve seyreltme oranları.
Protein Kullanılan primer antikor Antikor marka ve
katalog numarası Seyreltme Oranı GAPDH Rabbit Anti GAPDH IgG Santa Cruz,sc-25778 1/2000
SOD-1 Goat Anti SOD-1 IgG Calbiochem,574597 1/6000
SOD-2 Rabbit Anti SOD-2 IgG Santa Cruz,sc-30080 1/1000
AKT Rabbit Anti Akt IgG Santa Cruz, sc-8312 1/100
CAT Rabbit Anti CAT IgG Santa Cruz sc-50508 1/500
İNOS Rabbit Anti iNOS IgG Abcam ab-15323 1/500
İnsülin Rβ Rabbit Anti İRβ IgG Santa Cruz sc-711 1/100
PI3K Rabbit Anti PI3K IgG Santa Cruz sc-423 1/100
SIRT Rabbit Anti SIRT IgG Santa Cruz sc-15404 1/100
Çizelge 4. 5. Kullanılan ikincil (sekonder) antikorlar ve seyreltme oranları. Protein Kullanılan ikincil antikor Antikor marka ve
katalog numarası Seyreltme Oranı GAPDH Goat Anti rabbit IgG Santa Cruz, sc-2030 1/10.000
SOD-1 Rabbit Anti goat IgG Santa Cruz, sc-2768 1/30.000
SOD-2 Goat Anti rabbit IgG Santa Cruz, sc-2030 1/10.000
AKT Goat Anti rabbit IgG Santa Cruz, sc-2030 1/10.000
CAT Goat Anti rabbit IgG Santa Cruz, sc-2030 1/10.000
İNOS Goat Anti rabbit IgG Santa Cruz, sc-2030 1/10.000
İnsülin Rβ Goat Anti rabbit IgG Santa Cruz, sc-2030 1/10.000
PI3K Goat Anti rabbit IgG Santa Cruz, sc-2030 1/10.000
SIRT Goat Anti rabbit IgG Santa Cruz, sc-2030 1/10.000
Ardından ClarityTM ECL görüntüleme solüsyonu (Bio-Rad) ile 5 dakika inkübe edilip
membranların kemiluminesan görüntüleri ChemiDocTM MP görüntüleme sistemi (Şekil
4.7) (Bio-Rad Laboratories, Hercules CA, ABD) ile alınmıştır. Normalizasyon için membranlar yukarıda belirtildiği gibi GAPDH antikoru ile muamele edilerek, gruplara ait internal standart görüntüleri de elde edilmiştir. Image Lab4.1 Programının (Bio-Rad) yardımı ile bant yoğunlukları ölçülmüş ve proteinlerin ekspresyonları GAPDH ekspresyonu ile oranlanmıştır.
28
Şekil 4. 7. ChemiDocTM MP (Bio-Rad) kemiluminesan görüntüleme sistemi.
4.6. Toplam RNA İzolasyonu, cDNA Sentezi ve Real Time PCR ile Antioksidan Enzimler ve İnsülin Sinyal İletim ile İlgili Genlerin Ekspresyonlarının Ölçülmesi
Böbrek dokularının bir bölümü (50 mg) kullanılarak toplam RNA izolasyonu RNAeasy (Qiagen, Venlo, Hollanda) saflaştırma kitiyle üreticinin kılavuzuna uygun olarak gerçekleştirilmiştir (Şekil 4.8). Yönteme göre dokular 600 μl RLT tamponu ile homojenize edilmiş ve 25ºC’de 3 dakika 1000 g hızla santrifüj edilmiştir. Ependorf tüpü içerisindeki süpernatant, başka bir tüpe alındıktan sonra üzerine 600 μl % 70’lik etanol ilave edilmiş ve bu karışımın 700 μl’si RNeasy spin kolonuna aktarılarak 10.000 g hızla 1 dakika santrifüj edilmiştir.
Toplama tüpündeki süzüntü dökülmüş ve etanol süpernatant karışımının kalanı spin kolonuna tekrar yüklenerek işlem tekrarlanmıştır. Ardından kolonlara 700 μl RW1 tamponu eklenmiş ve 10.000 g’de 1 dakika santrifüj edilmiştir. Süzüntü atıldıktan sonra kolonlara 500 μl RPE tamponu eklenerek 10.000 g’de 2 dakika boyunca santrifüj gerçekleştirilmiştir. Aynı işlemin tekrarlanmasının ardından toplama tüpleri değiştirilerek 1 dakika 10.000 g’de boş santrifüjleme yapılmıştır. Son olarak kolonlar DNase ve RNase içermeyen yeni eppendorf tüplerine yerleştirilmiş ve 50 μl su eklenerek 10.000 g’de 1 dakika sentrifüj edilen RNAlar kolanlardan toplanmıştır.