T.C.
SELÇUK ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ
AKRİLAMİDİN HEK293 HÜCRE HATTINDA GENOTOKSİK
VE SİTOTOKSİK ETKİLERİNİN ARAŞTIRILMASI
Fatma SEÇER ÇELİK
YÜKSEK LİSANS TEZİ
TIBBİ GENETİK ANABİLİM DALI
Danışman
Prof. Dr. Tülin ÇORA
ii
T.C.
SELÇUK ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ
AKRİLAMİDİN HEK293 HÜCRE HATTINDA GENOTOKSİK
VE SİTOTOKSİK ETKİLERİNİN ARAŞTIRILMASI
Fatma SEÇER ÇELİK
YÜKSEK LİSANS TEZİ
TIBBİ GENETİK ANABİLİM DALI
Danışman
Prof. Dr. Tülin ÇORA
Bu araştırma Selçuk Üniversitesi Bilimsel Araştırma Projeleri Koordinatörlüğü tarafından 14202016 proje numarası ile desteklenmiştir.
iv
ÖNSÖZ
Tez çalışmamın hazırlanmasında yardımcı ve destek olan danışmanım Prof. Dr. Tülin ÇORA’ya, her türlü desteği, ilgisi ve deneyimleriyle her zaman yanımda olan bölüm başkanımız Prof. Dr. Hasan ACAR’a, tezime katkılarından dolayı Yrd. Doç. Dr. Nadir KOÇAK’a ve maddi manevi desteklerinden dolayı tüm Tıbbi Genetik Anabilim dalı ekibi arkadaşlarıma teşekkür ederim.
Bu tezi, hayatım boyunca desteğini asla üzerimden çekmeyen canım babam Aziz SEÇER’e, her daim manevi desteğini hissettiğim canım annem Nokta SEÇER’e ve biricik oğlum Muhammed Musab’a ithaf ediyorum.
v İ Ç İ N D E K İ L E R S a y f a SİMGELER ve KISALTMALAR ... iv 1.GİRİŞ ... 1 1.1.Akrilamidin Kimyası ... 4 1.2.Akrilamidin Oluşumu ... 5
1.3. Akrilamidin DNA ile Etkileşimi ... 7
1.4. Akrilamidin Genotoksisitesi ... 8
1.5. Akrilamid ve Kanser ... 9
1.6. Akrilamidin Alınımı, Metabolizması ve Atılımı ... 11
1.7. Akrilamidin Gıdalardaki Değerleri ... 16
1.8. Oksidatif Stres ... 16
1.8.1. Glutatyon (GSH) ... 18
1.8.2. Superoksit Dismutaz (SOD) ... 19
1.8.3. Katalaz (CAT) ... 20 2. GEREÇ ve YÖNTEM ... 21 2.1. Kimyasallar ... 21 2.2. Hücre Kültürü ... 21 2.3. Hücre Sayımı ... 21 2.4. Canlılık Analizi ... 22
2.5. Genotoksik Etkinin Analizi ... 22
2.6. Floresan In Situ Hibridizasyon (FISH) ... 22
2.6.1. FISH Preperatı Hazırlama ... 23
2.6.2. FISH Hibridizasyonu ... 23
2.6.3. FISH Preperatlarının Yıkanması ... 23
2.6.4. FISH Sonuçlarının Değerlendirilmesi ... 23
vi
2.8. Verilerin İstatistiksel Analizi ... 24
3.BULGULAR ... 25
3.1. Hücre Kültürü ... 25
3.2. Akrilamid Hücre Canlılığını Düşürür ... 25
3.3. Akrilamid Genotoksik Etki Gösterir ... 27
3.4. Akrilamid DNA Kırıklarına Sebep Olur ... 28
3.5. Akrilamid Hücre Redoks Modülatörlerinin Düzeyini Değiştirir ... 30
3.5.1.Süperoksit Dismutaz (SOD) Miktarı ... 30
3.5.2.Glutatyon (GSH) Miktarı ... 30
3.5.3. Katalaz (CAT) Miktarı ... 31
4.TARTIŞMA ... 32 5.SONUÇ ve ÖNERİLER ... 39 6. ÖZET ... 40 7.SUMMARY ... 41 8.KAYNAKLAR ... 42 9.EKLER ... 47 10.ÖZGEÇMİŞ ... 48
vii
SİMGE ve KISALTMALAR
IARC : Uluslararası Kanser Araştırma Ajansı ROS : Reaktif Oksijen Türleri
GST : Glutatyon S-transferaz
CYP 450 2E1 : Sitokrom P-450 ailesi-2 alt ailesi-Enzim polipeptid-1 DNA : Deoksiribonükleik Asit
EH : Epoksit Hidrolaz FDA : Gıda ve İlaç Dairesi WHO : Dünya Sağlık Örgütü CAT : Katalaz
SOD : Süperoksit Dismutaz GSH : Glutatyon
GSH-Px : Glutatyon Peroksidaz GSSG : Okside Glutatyon H2O2 : Hidrojen Peroksit
LD50 : %50 Letal Doz
NIOSH : Ulusal Sağlık ve Güvenlik Enstitüsü
IUPAC : Uluslararası Temel ve Uygulamalı Kimya Birliği EPA : Amerikan Çevreyi Koruma Kuruluşu
HEK293 : İnsan Embriyonik Böbrek Hücre Hattı FISH : Fluoresan In Situ Hibridizasyon FBS : Fetal Sığır Serumu
1
1. GİRİŞ
Akrilamid veya akrilik amid formülü C3H5NO olan kimyasal bir bileşiktir.
IUPAC (Uluslararası Temel ve Uygulamalı Kimya Birliği) adlandırması prop-2-enamiddir. Bir vinil polimeri olan ve suda iyi çözünen akrilamid, poliakrilamid malzemeleri yapmak için kullanılan bir kimyasaldır.Akrilamid, ilk olarak kimyasal yollarla sentezlenmiş ve tekstil, kâğıt, kozmetik sanayi gibi çok değişik endüstriyel alanlarda kullanılmaya başlanılmıştır.
Akrilamidden yüksek moleküler ağırlıklı polimerik özelliği olan poliakrilamid sentezlenmektedir. Bu polimer, kimyasal olarak nontoksik ve genellikle kararlı bir yapıdır. Poliakrilamidin matbaacılıktaki kullanım amacı, kâğıdın dayanıklılığını arttırmaktır. Ayrıca atık suların arıtılmasında sıklıkla kullanılmaktadır. Bunların dışında poliakrilamid; losyon, deodorant gibi birçok değişik kozmetik ürünlere de katılmaktadır. Poliakrilamidler, kişisel bakım ürünlerine yağlı ve yumuşatıcı bir özellik kazandırmaktadır. Poliakrilamid oluşum reaksiyonları sonrasında, az bir miktar serbest akrilamid ortamda bulunmaktadır. Bu nedenle kişisel bakım ürünlerinin kullanımı sırasında, çok düşük seviyede de olsa akrilamide maruz kalma söz konusu olmaktadır. Ancak bu çok düşük düzeydeki akrilamid çok düşük oranda risk oluşturmaktadır.
2000 yılına kadar, akrilamidin doğal olarak oluşmadığı, ancak kimyasal olarak sentez edilebileceği bilgisi kabul görmekteydi. Stockholm üniversitesinden Tareke ve arkadaşları, bu görüşü tamamen geçersiz kılmış, gıdaların 120oC’nin üzerindeki sıcaklık derecelerinde pişirilmesi sırasında bol miktarda akrilamid oluştuğunu bilim dünyasına duyurmuşlardır (Tareke ve ark 2000, Tareke ve ark 2002). Pişirilme sırasında meydana gelen akrilamid miktarı, maruz bırakılan sıcaklık derecesi ve süresi ile doğru orantılı olarak artmaktadır. Sharp ve arkadaşları yaptıkları çalışmada karbonhidrat ve protein açısından zengin olan besinlerin ortalama 248oF (120 oC) derecede pişirilmesi sonrası, ortalama 1 mg/kg düzeyinde akrilamid oluştuğunu bildirmişlerdir (Sharp ve ark 2003). Akrilamidin pişirilmiş gıdalarda varlığı tespit edildikten sonra günlük olarak nekadra akrilamidi
2
vücudumuza aldığımız ile ilgili ilk yapılan çalışma Hollanda da yapılmıştır. Bu çalışmaya göre yüksek ısıda pişirilen yemeklerle beslenen insan deneklerinin günlük olarak vücut ağırlığına bağlı olarak ortalama 0,5 μg/kg akrilamidi vücutlarına aldıkları tespit edilmiştir (Stadler ve ark 2002).
Akrilamid, gıdaların yüksek sıcaklık derecelerinde pişirilmesinin doğal bir sonucu olarak oluşan bir madde olması nedeni ile bu tür gıdaların yasaklanmasının mümkün değildir. Ancak, akrilamidin sağlık üzerinde meydana getirebileceği riskler dikkate alınarak, gıdalarda izin verilen maksimum akrilamid seviyeleri ile ilgili yasal limitler getirilebilir. Henüz yeterli bilimsel veri olmaması nedeniyle gıdalarla alınan akrilamidin potansiyel sağlık riskleri ile ilgili olarak kesin bir yargıya varmak mümkün değildir. Bu nedenle, söz konusu çalışmalar tamamlanana kadar, Dünya Sağlık Örgütü (WHO); gıdaların çok yüksek sıcaklıklarda ve uzun sürelerde pişirilmemesi, kızartılmış ve yağlı gıdaların ölçülü tüketilmesi yönünde tavsiyelerde bulunmaktadır (Health Organization, Geneva, 2002). Diğer yandan, gıdaların pişirilmesi sırasında oluşan akrilamid miktarının azaltılması veya akrilamid oluşumunun önlenmesi ile ilgili çalışmalar da yoğun bir şekilde sürdürülmektedir.
Gıda kaynaklı akrilamid konusu, yüksek ısıl işlemine tabii tutulan ve yüksek nişasta içeren gıdaların önemli seviyelerde akrilamid içerdiğini bulunması ile gündeme gelmiş (Tareke ve ark 2002), bunun ardından dünya bilim çevrelerinde gıda kaynaklı akrilamidin neden olabileceği sağlık risklerinin belirlenmesi amacıyla çok sayıda çalışma başlatılmıştır. Çeşitli araştırma kuruluşları tarafından geçmiş yıllarda fareler üzerinde yapılan deneylerde akrilamidin deney hayvanlarında kötü huylu tümör oluşumuna neden olduğu belirlenmiştir (Heath ve ark 1975,Bull ve ark 1984). Uluslararası Kanser Araştırmaları Kurumu (The Internatıonal Agency for Research on Cancer, IARC), akrilamidi “insanlar için potansiyel kanserojen madde (Grup 2A)” olarak sınıflandırmaktadır. Akrilamid, gıda maddelerine katılan bir katkı maddesi değil, pek çok gıda grubunda doğal bileşen olarak bulunan karbonhidrat (glukoz) ve proteinlerin (özellikle asparajin amino asidi) yüksek sıcaklık koşullarında tepkimesi sonucunda oluşan bir maddedir. Bu nedenle karbonhidrat ve proteince zengin, yüksek ısı işlemine tabii tutulmuş ürünler arasında özellikle fırıncılık ürünleri ve kızartmalar dikkat çekmekte ve araştırmalara konu olmaktadır (Mottram ve ark
3
2002, Stadler ve ark 2002). Avrupa’da yapılan çalışmalar, günlük tüketim miktarlarının yüksekliği dikkate alınarak özellikle kahve, patates ürünleri ve ekmeğin gıda kaynaklı akrilamid alımında ilk sıralarda yer aldığını ortaya koymuştur (Friedman ve ark 2003, Troxell ve ark 2008). Kızartma ile pişirilme sırasında bol miktarda akrilamid oluşturan gıdaların (Rosen ve ark 2002) suda haşlanarak pişirilmesi sırasında ise akrilamid meydana gelmediği tespit edilmiştir (Margeretha ve ark 2005). Bu bilgi çok önemlidir; çünkü gıda kaynaklı akrilamid toksisitesinden korunmak için, gıdaların kızartılarak pişirilmesi yerine haşlanarak pişirilmesinin tercih edilmesi yeterli olacaktır (Pelucci ve ark 2006).
Yapılan çalışmalarda, akrilamidin neden olabileceği kanser riskinin göz ardı edilemiyeceğini, ancak ”gıda kaynaklı düşük düzeyli akrilamid, kanser riskini artırmaktadır” şeklinde bir tespitin yapıldığını görmekteyiz (Rice ve ark 2005, Manjanatha ve ark 2015). Çünkü gıda kaynaklı akrilamidin hangi seviyelerinin risk oluşturduğu, hangi seviyenin altının insan sağlığı için kabul edilebilir olduğu yönünde herhangi bir bilgi bulunmamaktadır. Bu konu net bir şekilde ortaya konulamamıştır. Bu nedenle, riskin bilimsel anlamda doğru bir şekilde belirlenebilmesi ve gıdalar için limit değerlerin tanımlanabilmesi için devam eden ileri çalışmaların sonuçları beklenmektedir.
Akrilamidin toksik etkilerini ortaya çıkarmak amacıyla geniş kapsamlı araştırmalar yapılmıştır. Bu araştırmaların önemli bir kısmı, gıda kaynaklı akrilamidin oluşum mekanizmalarının nasıl ortaya çıktığını göstermek amaçlıdır. Yapılan araştırmalar akrilamidin insan ve hayvanlarda nörotoksik etkiler gösterdiğini, üreme sistemi için toksik, germ hücreleri için yüksek derecede kanserojen etkiye sahip olduğunu ortaya koymaktadır (Shipp ve ark 2006, Calleman ve ark 1996, Dearfield ve ark 1995).
Gıda kaynaklı akrilamidin geniş kitleleri etkileyen bir sağlık problemi olması nedeniyle, Ulusal Sağlık ve Güvenlik Enstitüsü (National Institute of Occupational Safety and Health, NIOSH, 1976), WHO (1985), IARC (1986 -1994), Amerikan Gıda ve İlaç Dairesi (Food and Drug Administration, FDA) ve Avrupa Birliği (European Union, EU, 2002) gibi kuruluşlar bu konuyu gündemlerine almışlardır.
4
Özellikle US FDA ve WHO, akrilamid ile ilgili olarak yapılması gereken hususlar konusunda yıllık haraket planları hazırlayarak kamuoyuna duyurmuş ve konuyu sürekli gündemde tutmuşlardır. Bunlardan ayrı olarak Amerikan Çevreyi Koruma Kuruluşu (U.S. EPA), akrilamidin kabul edilebilir, toksik ve kanserojen dozları ile ilgili olarak çok sayıda araştırma yaptırarak bazı referans değerler ortaya koymuş ve bu bilgileri kamuoyuna duyurmuştur. İçme suyu kalitesi için, WHO’nun yönergesine göre, bir litre içme suyunda 0,5 μg/L akrilamid olarak bildirilmiştir (WHO 1993). Avrupa Birliğinde bu rakam 0,1 μg /litre sudur (Cavalli 2004).
1.1. Akrilamidin Kimyası
Akrilamid doymamış çift bağ içeren bir amiddir (Blasıak ve ark 2004). 2-propenoamid, etilen karboksamid, akrilik asit amid, vinil amid, propenoik asid amid olarak da bilinmektedir. Sıvı halde iken beyaz bir kristal gibi görünür, kokusuzdur ve suda yüksek çözünürlüğe sahiptir. Erime sıcaklığı 84,56 oC, kaynama sıcaklığı (25 mm Hg) 125 oC’dir (atmosfer basıncında 192,66 oC) (Yasuhara ve ark 2003). Akrilamid nükleofillerle özellikle tiyolat anyonlarıyla reaksiyona girebilir (Tong ve ark 2004). Akrilamidin kimyasal yapısı Şekil 1.1.’de verilmiştir.
Şekil 1.1. Akrilamidin kimyasal yapısı.
Akrilamid üre (CO(NH2)2 ve formaldehit (HCHO) veya glioksal (CHO)2,
aldehitler (RCHO), aminler (R2NH), tiyoller (RSH) gibi küçük reaktif moleküllerle
5
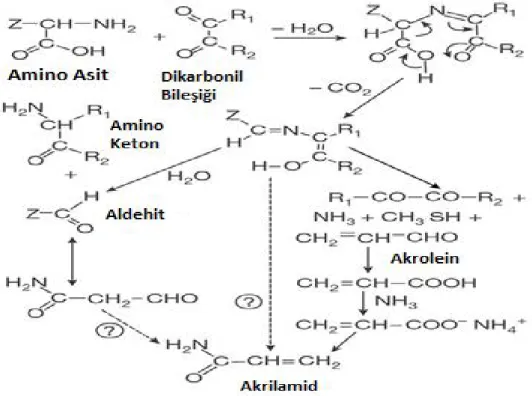
1.2. Akrilamidin Oluşumu
Gıda kaynaklı akrilamid, 120 oC’nin üstündeki sıcaklılarda fruktoz ya da glukoz gibi monosakkaritlerle asparajin gibi aminoasitler arasında meydana gelen Maillard reaksiyonu sonucunda oluşur (Şekil 2.).
Proteinlerin yapısına giren standart 20 aminoasitten özellikle asparajin, akrilamid oluşumunda kilit rol oynar. Gıdaların haşlanması sırasında akrilamid oluşumu söz konusu değildir (Mottram 2002).
Şekil 1.2. Maillard Reaksiyonu ve Akrilamid Oluşumu (Nature 419, 448-449 October 2002).
Besinlerin yüksek ısıda pişirilmesi sırasındaki akrilamid oluşum mekanizması, ısının etkisiyle asparajin amino asidi ile şekerin reaksiyona girmesine dayanmaktadır. (Şekil 1.3.) Ancak ısıtma sırasında ortamda bulunan amino asid ve şekerin çok küçük bir kısmı reaksiyona girerek akrilamid oluşturmaktadır. Bu oran asparajin için % 0,1 – 0,3 civarlarındadır (Surdyk ve ark 2004).
6
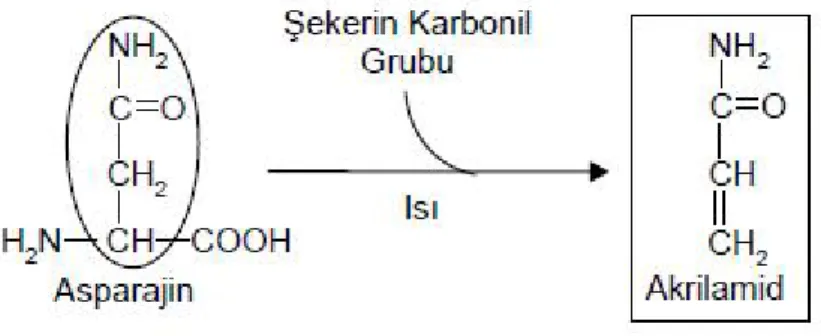
Surdyk ve arkadaşları, ekmek hamuruna farklı miktarlarda asparajin katarak yaptığı çalışmada, pişirme sonrası ekmekteki asparjinin % 0,3’nün akrilamide dönüştüğünü tespit etmiştir. Mısır nişastası, buğday unu ve patatesteki akrilamid oluşumu üzerine yapılmış diğer araştırmalardaki asparajin-akrilamid dönüşüm oranları biraz daha yüksekti, ancak bu oran genel olarak % 1’in altında bulunmuştur . Surdyk’nin yaptığı çalışmalara göre, pişirilme işleminden önce hamurda asparajin yoğunluluğunun artırılması, pişirilme sırasında ekmekte oluşan akrilamid miktarını önemli derecede artırmıştır. Buna karşılık asparajin oranının çok yoğun olduğu patates pişirme işleminden önce asparajinaz enzimiyle muamele gördükten sonra pişirildiğinde, akrilamid oluşumunun düştüğü görülmüştür. Besinlerin indirgen şeker ve amino asit içeriğine bakarak tercih edilmesi, pişirme esnasında oluşacak akrilamidin çok düşük seviyelerde kalmasını sağlayabilir (Surdyk ve ark 2004).
Şekil 1.3. Asparajin ve şekerin karbonil grubunun etkileşimi ve akrilamid oluşumu (Surdyk ve ark 2004).
Günümüzde bebek beslenmesinden yetişkin beslenmesine kadar birçok hazır gıdada ve evde sıklıkla kullanılan şeker, yağ ve sütün yüksek sıcaklıkta pişirilmesiyle gerek bisküvi ve gerekse de muhallebi gibi ürünlerde maillard reaksiyonuyla akrilamid oluşmakta, bu ise sağlığı olumsuz yönde etkilemektedir. Maillard reaksiyonu nedeniyle sütteki bazı proteinlerin yapısı bozulmakta ve karaciğer üzerinde toksik etki oluşturduğu bildirilmektedir. (Becalsk ve ark 2003).
Besinlerin pişirilerek hazırlanması sırasında oluşan akrilamid oranları, besinde bulunan glukoz, fruktoz gibi indirgen şekerlerin ve asparajin amino asidinin miktarına, uygulanan sıcaklık derecesine ve uygulama süresine bağlı olarak
7
değişiklik göstermektedir. Örneğin; 180 oC’de kızartılan patateste, 120 oC derecede kızartılan patatese göre 30 kat daha fazla akrilamid oluşmaktadır. Bu durum bize çeşitli yiyeceklerin pişirilmesi, kızartılması veya kavrulması işleminin yanı sıra, sıcaklık derecesinin ve uygulama süresinin akrilamid oluşum oranı açısından çok önemli bir rol oynadığını göstermektedir (Troxell ve ark 2008).
1.3. Akrilamidin DNA ile Etkileşimi
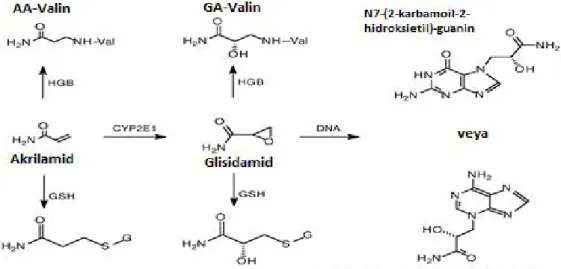
Akrilamidin DNA’nın adenin ve guanin bazlarının amino grupları ile de tepkimeye girdiği ve çok sayıda farklı bileşiğin meydana geldiğini bunun yanı sıra hemoglobine de katıldığı gösterilmiştir (Solomon ve ark 1985) (Şekil 1.4.). DNA üzerinde meydana gelen bu genotoksik etkilerin, akrilamidden ziyade büyük oranda akrilamidin metaboliti olan glisidamidden kaynaklandığı ortaya konulmuştur (Paulsson ve ark 2003). Fare ve sıçanlara akrilamid verilerek yapılan deneysel çalışmalarda, akrilamidden bol miktarda glisidamid oluştuğu ve glisidamidin bu hayvanların karaciğer, akciğer ve böbrek DNA’larının pürin bazları ile etkileşerek genotoksik etkiler meydana getirdiği gözlemlenmiştir (Segerback ve ark 1995, Gamboa ve ark 2003).
Şekil 1.4. Akrilamidin glisidamid formu ile glutatyon konjugatlar, DNA ve HGB katılımının gösterimi (Gamboa ve ark 2003).
8
Şekil 1.5. Akrilamid ve Glisidamidin DNA ile etkileşimi sonucunda oluşan temel bileşikler (Segerback ve ark 1995, Gamboa ve ark 2003).
Gamboa’nın çalışmasında glisidamidin DNA ile yoğun bir şekilde etkileştiği ve baskın olarak N7-(2-karbamoil-2-hidroksietil) guanin, N3-(2-karbamoil-2-hidroksietil) adenin ve N1-(2-karboksi-2-N3-(2-karbamoil-2-hidroksietil)-2'-deoksiadenosin şeklinde baz değişikliğine yol açtığı ortaya konulmuştur (Gamboa ve ark 2003) (Şekil 1.5.).
1.4. Akrilamidin Genotoksisitesi
Akrilamidin memelilerde yapılan çalışmalarda genotoksik ve kanserojen olduğu ortaya koyulmuştur. (Dearfield ve ark 1995, Favor ve ark 2005). Akrilamidin insanlarda 2A grubu bir kanserojen olduğunu belirten Uluslararası Kanser Araştırma Ajansı (IARC), bu kararını akrilamidin kemirgenlerin üreme ve somatik hücrelerinde yaptığı kromazomal anormalliklere ve gen mutasyonlarına dayandırmıştır (IARC,1994). Ayrıca labaratuvarda hücre kültüründe yapılan çalışmalarda da akrilamidin gen mutasyonları ve kromazomal anormallikler yaptığı görülmüştür (Besaratinia ve ark 2003). İnsanlarda glisidamid oluşumunun çok düşük
9
düzeylerde gerçekleşmesi nedeniyle akrilamidin insanlar üzerindeki mutajenik etkisi hayvanlara göre oldukça düşüktür (Dearfield ve ark 1995, Favor ve ark 2005)
Yapılan çalışmalarda, akrilamid’in canlılarda genotoksik olduğunu ve genotoksisitesinin akrilamidden ziyade glisidamidden kaynaklandığını ortaya koymuştur. Hayvanlara verilen glisidamidin aynı dozdaki akrilamidden daha mutajenik olduğu tespit edilmiştir (Gamboa ve ark 2003, Sumner ve ark 1999, Favor ve ark 2005). Glisidamid ya da akrilamid ile muamele edilen hücreler, kendiliğinden mutasyona uğrayan kontrol hücrelerinden daha fazla Adenin-Guanin geçişleri ve Guanin-Sitozin tranversion’ları göstermişlerdir. Glisidamid ile muamele edilen hücrelerde Guanin-Timin transversion’ları çok daha yüksek düzeylerde gerçekleşmiştir. Bilim adamları, akrilamidin insan ve fare hücrelerindeki mutajenitesinin, akrilamid metabolitleri ve glisidamidin DNA ile yaptıkları promutajenik bağlanma kapasitesinden kaynaklandığını belirtmişlerdir (Gamboa ve ark 2003, Besaratinia ve ark 2004).
1.5. Akrilamid ve Kanser
Farelerde ve sıçanlarda akrilamid’in kanserojenitesi ile ilgili birçok çalışma 1980’lerde yayımlanmıştır. Sıçanlarda iki yıllık bir çalışmayı ve farelerde daha kısa süreli birçok çalışmayı içeren bu deneylerde akrilamid, çeşitli yollarla sistemli bir şekilde verildiği zaman hem farelerin (Heath ve ark 1975, Bull ve ark 1984), hem de sıçanların (Johnson ve ark 1986) çeşitli dokularında tümörlere neden olmuştur.
Akrilamid, fare ve sıçanlar için kanserojendir. İnsanlar içinse potansiyel karsinojendir. Sıçanlarda yapılan akrilamid uygulaması testis, tiroid ve memeyle ilgili tümör oluşumunu tetiklediğini ortaya koymuştur. Başka bir çalışmada; hipofiz ve klitoral salgı bezlerinin adenoması, ağız boşluğunun papilloması, rahmin adenokarsinoması ve böbreküstü bezine ait tümörlere rastlanmıştır (Friedman ve ark 1995)
Akrilamid içeren gıdalarla beslenen toplumlar ve mesleklerinden dolayı akrilamide maruz kalan işçiler üzerinde yapılan epidemiyolojik çalışmalarda, akrilamidin insanlarda kanser riskini arttırdığına dair tutarlı ve kesin bir delil
10
bulunamamıştır (Collins ve ark 1989, Marsh ve ark 1999, Mucci ve ark 2008). Yüksek miktarda akrilamide maruz bırakılan işçilerde pankreas kanseri insidansı ikiye katlanmış, fakat tutarlı bir maruz kalma-etki ilişkisi saptanamamıştır (Marsh ve ark 1999). 8508 kişi üzerinde yapılan bu kohort çalışmasında genel bir istatiksel değerlendirme yapılmış olup laboratuvar çalışması yoktur bu sebeple son on yılda yapılan ve akrilamidi kanserle ilişkisini tespit eden birçok çalışma mevcuttur. Tezimizde de bir kısmına değinilmiştir.
Akrilamid’in hayvanlarda kansere sebep olduğu ve belli dozların üzerine çıkıldığında, insan ve hayvan sinir sisteminde nörotoksisiteye yol açtığı bilinmektedir. Farelerde yapılan araştırmalar; akrilamidin, gıdaların pişirilmesi sırasında oluşan diğer kanserojenlere benzer bir etkiye sahip olduğunu göstermektedir. İnsanlar için, gıdalardan kaynaklanan kanserojen ajanların etkileri çok iyi bilinmemektedir. Akrilamidin diyette, diğer gıda kaynaklı kanserojenlere nazaran daha yüksek düzeylerde bulunması, akrilamidin kanserojen olabileceği şüphesini ciddi derecede artırmıştır (Yang ve ark 2005). Laboratuvar hayvanları üzerinde yapılan çalışmalar da, monomerik bir yapıya sahip olan akrilamidin hem sinir hemde üreme sistemlerinde hücresel hasara neden olduğu ve özellikle hormonal duyarlılığı olan dokularda tümör gelişimini artırdığı gösterilmiştir (Friedman ve ark 1995).
Fullerton ve Barnes’ın yaptıkları çalışmada sıçanlara akut ve subakut dozda akrilamid vererek yaptığı çalışmada, akrilamidin nörotoksik etkilerine bağlı olarak arka ayaklarda zayıflık, arka ayakları sürükleme ve kısmi felçlere neden olabileceğini gözlemlemişlerdir. Bu çalışmada dişi sıçanlara 100 mg/kg ya da 203 mg/kg (LD50) dozda akrilamid verilmiştir. 203 mg/kg akrilamid uygulanan grupta 48 saat boyunca bir titremenin açıkça görüldüğü ve ayrıca bu sıçanların ya hemen iyileştikleri ya da 2-3 gün içinde öldükleri belirtilmiştir. Diğer grupta ise verilen ilk 100 mg/kg’lık dozdan sonra sıçanlarda titreme başlamış ve 24 saat sonra uygulanan ikinci dozdan sonra bünyede zayıflık, halsizlik ve devamında da 3 gün içinde ölümle sonuçlanan bir tablo ortaya çıkmıştır (Fullerton ve ark 1966).
11
Akrilamidin akciğer tümörü gelişimi üzerine etkisini araştırmak amacıyla yapılan bir çalışmada, erkek ve dişi farelere sondayla çeşitli dozlarda akrilamid verilmiş, hayvanlar yedi ay sonra dekapite edildiğinde, akciğer adenoma’lı farelerin sayısında ve fare başına akciğer adenomaları sayısında doz ile alakalı önemli bir artış olduğu saptanmıştır (Bull ve ark 1984).
1.6. Akrilamidin Alınımı, Metabolizması ve Atılımı
Akrilamidin besinlerle vücuda alınışı konusunda İsveç, Hollanda, Norveç ve diğer avrupa ülkelerinde çok sayıda çalışma yapılmış ve sonuçları yayınlanmıştır (Svensson ve ark 2003, Konings ve ark 2003, Dybing ve ark 2003). Bu çalışmalar, yiyeceklerdeki akrilamid miktarının ürüne ve hazırlama şekline göre büyük değişiklikler gösterdiğini ortaya koymuştur.
İsviçre’deki çalışmalar, kahvenin günlük akrilamid girişinin %36’ sını oluşturabileceğini, dolayısıyla düşük miktarda kızarmış patates tüketen ağır bir kahve tiryakisinin, hiç kahve içmeyen ama haftada iki porsiyon kızarmış patates tüketen birinden önemli ve yüksek akrilamid girişine sahip olabildiğini göstermiştir. Derin yağda kızartılmış patateslerde oluşan akrilamidin miktarı kızarmış patatesin rengi ile doğru orantılıdır ve 20-1000 mg/kg arasında değişebilmektedir. Hollanda’da 344 yiyecek maddesi üzerinde yapılan bir araştırmada, yiyeceklerin içerdiği akrilamid miktarının 30-3100 mg/kg arasında değiştiği tespit edilmiştir (Konings ve ark 2003). Gıda kaynaklı akrilamidin vücuda alınım miktarları konusunda yapılan araştırmalar, bir çok toplumda yetişkinlerde günlük ortalama 0.5 mg/kg akrilamidin vücuda alındığını göstermektedir (Svensson ve ark 2003). Akrilamid kaynaklı kanser gelişim riski olan organlar; böbrek, kalın bağırsak, idrar torbası, ağız boşluğu, yutak, yemek borusu, gırtlak, göğüs ve yumurtalıklar olduğu belirtilmiştir (Pelucci ve ark 2006).
Yapılan çalışmalar sonucu elde edilen bilgiler, akrilamidin mide ve barsaklar yoluyla çok hızlı ve etkili biçimde emildiğini göstermektedir. Bununla birlikte, türler arasındaki emilim seviyelerinin farklılıklarının da altı önemle çizilmiştir. Örneğin köpeklerde ağız yoluyla verilen akrilamidin gastrointestinal emilimi çok hızlı bir
12
şekilde gerçekleşirken domuzlarda gerçekleşen emilim köpeklere oranla oldukça yavaştır (Ikeda ve ark 1983).
Twaddle ve arkadaşları (2004) ile Doerge ve arkadaşları (2005) yaptıkları çalışmalarında fare ve sıçanlara oral yolla 50 mg/kg dozda akrilamid muamele ederek her iki çalışmada da maksimum plazma yoğunluğuna akrilamidde 30 dakikada, glisidamidde ise iki saatte ulaşmışlardır. Doerge ve arkadaşları yaptıkları deneysel çalışmalarında benzer protokolleri kullanarak akrilamidin fare ve sıçanlardaki toksikokinetik özelliklerini incelemişlerdir. Bu amaçla erkek ve dişi fare ve sıçanlara 0,1 mg/kg akrilamid’i damar içi, sonda ya da oral yoldan tek doz muamele ederek akrilamidin serum ve dokulardaki toksikokinetik özelliklerini incelemişlerdir. Sıçanlarda akrilamidin en yüksek serum yoğunluğuna ulaşma süresi, uygulama tekniğine bağlı olarak damar içi uygulamada 15 dakika, sondayla uygulamada 1-2 saat ve gıda ile beslenmede 2 saat olarak tespit edilmiştir. Glisidamidin en yüksek serum yoğunluğuna ulaşma süresi ise, sonda ile uygulamada 2 saat, gıda ile beslenmede ise 4 saattir. Glisidamid/akrilamid oranı damar içi uygulamada en düşük, gıda ile beslenmede ise en yüksek seviyelerde olduğu gözlemlenmiştir. Fare ve sıçanlarda yapılan çalışmalar, akrilamidin oral yolla uygulanması sonrası büyük oranda emilime uğradını ve çok hızlı bir şekilde vücudun bütün dokularına dağıldığını göstermiştir (Twaddle ve ark 2004, Deorge ve ark 2005).
Akrilamid’in insanlardaki emilimi konusunda, gönüllü insan denekleri üzerinde yapılmış olan sınırlı sayıda araştırma bulunmaktadır. Fennell ve arkadaşları gönüllü insan denekleri üzerinde yaptığı çalışmada, gruplardan birine çeşitli dozlarda akrilamid içeren sudan içirmişler, diğer gruba ise akrilamid içermeyen su içirmişlerdir. Akrilamid tatbikini takip eden 24 saat içinde idrarda yapılan tetkiklerde, uygulanan dozun % 34’ünün idrarla atıldığı tespit edilmiştir. Birkaç gün devam eden serum ve idrar tetkiklerinden elde edilen sonuçlar, akrilamid’in bir bölümünün de hemoglobin ya da serum proteinlerine bağlanmış olduğunu göstermiştir (Fennell ve ark 2005).Bu sonuçlar, emilimin aslında % 34’den çok daha fazla olduğunu ortaya koymuştur. Fuhr ve arkadaşları insanlar üzerine yaptıkları çalışmalarında, gönüllülere 0,94 mg akrilamid içeren bir yemek yedirdiler. 72 saat
13
sonra alınan idrar örneklerinin analizi, besinlerle uygulanan akrilamidin % 60’ının idrarla atıldığını göstermiştir. Konunun uzmanları, eldeki tüm bu bulguları değerlendirerek, besinlerle alınan akrilamidin emiliminin en yüksek düzeyde olduğu konusunda hemfikir olmuşlardır. İnsanlar üzerinde yapılan bu çalışmalarda, idrarla atılan akrilamid ve glisidamid metabolitleri analiz edilerek incelenmiştir. Elde edilen sonuçlar, insanlarda glisidamid oluşumunun farelerden 2 ya da 4 kat daha az olduğunu ortaya koymuştur (Fuhr ve ark 2006).
Oral yolla akrilamid alımından sonra araştırmacılar deri emilimini incelemek için çeşitli araştırmalar yapmıştır. Sumner, radyoaktif işaretli akrilamidi 162 mg/kg dozda 4 erkek sıçana sıvı içinde deri yüzeyine uygulamıştır. Deri uygulaması sonrası yapılan radyoaktivite ölçümleri, uygulamaya tabii tutulan hayvanlarda akrilamidin deriden emilerek sistemik dolaşıma geçiş oranının %14-30 arasında olduğunu göstermiştir (Sumner ve ark 2003).Akrilamid ve akrilamidin diğer bütün formlarının (poliakrilamid gibi) çok hızlı bir şekilde ve büyük oranda deriden emilime uğradığı kanıtlanmıştır (Diembeck ve ark 1998). Fennell yaptığı çalışmada, gönüllü insan deneklerinden iki gurup oluşturmuştur. Gruplardan biri kontrol gurubu (0 mg/kg), diğeri ise 5 gönüllüden oluşan ve 3 mg/kg dozda % 50’lik akrilamid (1,2,3-13C) solusyonunu uyguladığı gruptur. Bu gruba 3 gün boyunca temiz ve kuru cilt üzerine uygulama yapılmış ve her bir uygulama sonrası 24 saatlik periyotlar halinde kan numuneleri toplanarak emilim miktarı hesaplanmaya çalışılmıştır. Uygulama bölgesi her uygulamadan önce iyice yıkanmıştır. Uygulanan total akrilamidin %65 ile % 71’inin yıkama sıvısında ve uygulama bölgesinde kaldığı görülmüştür. Uygulanan akrilamidin %25 ile %29’unun (3 günün ortalaması %26 ) deriden emildiği görülmüştür. Buda bize uygulanan akrilamidin günlük olarak 0,73 ile 0,86 mg/kg miktarında olduğunu ve 3 günün sonunda toplam 2,35 mg/kg olduğunu göstermiştir. Bu durumda akrilamid deri emiliminden dolayı hücrelerde toksik etki gösterebileceğini öne sürmüştür. (Fennell ve ark 2005).
Oral ya da deriden alınan akrilamidin gebelerde fetüse geçip geçmediğinin araştırılması amacıyla yapılan bir çalışmada; gebe sıçan, tavşan, tazı ve minyatür domuzlara ağız yoluyla radyoaktif akrilamid uygulanmış ve her bir türün fetus dokularında akrilamid düzeyleri ölçülmüştür. Araştırma sonuçları dört tür arasında
14
çok önemli bir farkın olmadığını göstermiştir. Ancak domuz fetuslarının beyin dokularında ölçülen akrilamid düzeylerinin, köpek fetuslarında tespit edilen düzeylerden çok yüksek olduğu tespit edilmiştir (Ikeda ve ark 1983).
Akrilamidin temel metabolik yolları şekil. 1.6.’de verilmiştir. Akrilamidin glisidamide dönüşümü ve sonrasında her iki yapının katabolizması glutatyona bağımlı enzimatik yolla gerçekleşmekte ve idrarla vücud dışına atılmaktadır. Akrilamidin başlıca atılım metaboliti, N-asetil–S-(3-Amino-3-okzopropil) sistein yapısıdır. Akrilamidin glutatyonla oluşturduğu bileşiklerin oranı ya da okside olmasıyla oluşan glisidamidin yüzdesi hayvan türleri arasında önemli farklılıklar göstermektedir (Dybing ve ark 2005).
Şekil 1.6. Akrilamidin temel metabolik yolları (Dybing ve ark 2005).
Akrilamid, birbiriyle rekabet eden iki farklı enzimatik reaksiyonla yıkılıma uğrar. Akriamid, Glutatyon S-Transferaz tarafından redükte glutatyonla konjuge edilebildiği gibi, Sit P450 enzim sistemi ile de okside edilerek glisidamide dönüştürülebilir. Bu iki enzimatik reaksiyon, akrilamidi substrat olarak kullanma konusunda birbiri ile yarışırlar (Calleman ve ark 1990, Sumner ve ark 1992).
15
Farelerde bu reaksiyon, yalnızca sit P450 2E1 tarafından gerçekleştirilir (Sumner ve ark 1999). Akrilamid, mide ve barğırsaktan emildikten sonra kanda 1 mol hemoglobin molekülüne 4 mol akrilamid olacak şekilde karaciğere kadar taşınır ve burada iki metabolik yoldan birine dahil olur. Ya glutatyonla konjuge edilerek toksik olmayan bir glutatyon molekülü olan N-Asetil-S-(2-karbamoiletil) sisteine dönüşürek zararsız bir şekilde idrarla atılımı sağlanır ya da karaciğerde bulunan sitokrom P450 enzim sisteminin CYP 2E1 enzimiyle oksidasyona uğrayarak daha toksik olan glisidamide dönüşür. Oluşan bu glisidamid dokuların DNA’larına bağlanarak mutasyonlara sebep olabilir. Akrilamid glisidamide dönüştükten sonra redükte glutatyon (GSH) ile reaksiyona girerek glutatyon metabolitleri olan N-asetil-S-(2-hidroksi-2 karbamoiletil) sistein ve N-asetil-S-(1karbamoil-2-hidroksietil) sistein metabolitleri şeklinde detoksifiye edilir ve idrarla atılımı sağlanır. Glisidamidin izleyeceği diğer bir yol ise epoksid hidrolaz (EH)’la daha stabil bir metabolit olan 2,3-dihidroksipropionamid (gliseramid)’e dönüşerek vücud dışına atılmasıdır (Dybing ve ark 2005) (Şekil 1.6.).
Akrilamidin glisidamide dönüşüm oranı, diğer hayvanlara göre farelerde en yüksek olduğu bildirilmiştir. İnsanlarda, akrilamidin glisidamide dönüşüm oranının çok düşük olduğu görülmüştür. Sıçan, fare ve insanlar üzerinde yapılan araştırmalar, akrilamidin oksidasyonu sonucu oluşan en baskın metabolitin, NasetilS(3amino -3-oksopropil) sistein olduğu ortaya konulmuştur (Miller ve ark 1982). Glisidamidin oksidasyonundan kaynaklanan ve idrarla atılan metabolitlerin glisidamide oranının sıçanlarda % 33, farelerde % 59 olduğu gösterilmiştir. Oral yoldan uygulanan akrilamidin sıçanlarda yaklaşık % 59’u, farelerde % 40’ı ve insanlarda % 86’sı idrarla vücud dışına atılmaktadır (Sumner ve ark 1992,Fennell ve ark 2005).
Hayvanlar üzerinde yapılan çalışmalarla, akrilamidin vücuttan en yoğun ve kolay atılım yolunun idrar olduğu ortaya konulmuştur. Akrilamid çeşitli yollarla hayvanlara uygulandığında, akrilamid ve akrilamid ürünlerinin % 40-70’inin idrarla, % 5-6’sının dışkıyla, % 6’sının solunum yoluyla ve % 15’inin dışkıyla atıldığı görülmüştür (Ramsey ve ark 1984).
16
Günde 500 gr patates kızartması ya da ekmek kızartması tüketen insanlarda yapılan analizler, idrarla atılan akrilamid miktarının 5 mg’a kadar yükseldiğini göstermektedir. Ancak bu çalışmada, 500 gr patates kızartması ya da ekmek kızartmasında ne kadar akrilamid bulunduğu bilgisi verilmemiştir (Sörgel ve ark 2002).
1.7. Akrilamidin Gıdalardaki Değerleri
Stockholm üniversitesinde yapılan çalışmalarda 120°C’nin üzerindeki sıcaklık derecelerinde kızartılmış veya pişirilmiş yiyeceklerde yoğun miktarlarda akrilamid oluştuğunu tespit ettikten sonra çok sayıda kuruluş kendi ülkelerinde gıdaların akrilamid düzeylerini ve sınır değerlerini tespit etmek üzere çalışma başlatmışlardır. Amerikan gıda ve ilaç dairesi (U.S. FDA) 2002 yılından beri periyodik olarak her yıl piyasadan örnekleme şeklinde aldığı gıda maddelerinde akrilamid ölçümleri yapmakta ve bu sonuçları kendi Web sitesinden kamuoyuna duyurmaktadır.
1.8. Oksidatif Stres
Oksidatif stres basit bir şekilde vücudun antioksidan savunması ile hücrelerin lipid tabakasının peroksidasyonuna neden olan serbest radikal üretimi arasındaki dengesizlik olarak tanımlanabilir. Oksidatif stres, toksisitenin önemli bir mekanizması olarak son yirmi yıldır toksikolojik araştırmaların odağı haline gelmiştir. Antioksidan savunma sistemleri ise vücutta çeşitli zararlı maddelerin etkisi ile oluşan ve genel olarak serbest radikal olarak adlandırılan oksidan ve reaktif oksijen ürünlerinin (ROS) zararlı etkilerini uzaklaştırmak ve dokuda oluşturdukları hasarı tamir etmekle görevli olan sistemlerdir. Glutatyon peroksidaz (GPx), katalaz (CAT), süperoksit dismutaz (SOD) ve malondialdehit (MDA) gibi biyomarkırlar bu savunma sisteminde yer alırlar (Jomova ve ark 2011).
17
DNA, oksidan radikaller tarafından kolaylıkla hasarlanabilmektedir. Proteinlerde olduğu gibi DNA‟da da hızlı zincir reaksiyonlarının olma ihtimali çok zayıftır. Hasarın oluşabilmesi için serbest radikallerin spesifik yerlere yüksek konsantrasyonda bağlanarak, zincir kırılmalarına yol açmaları veya replikasyon olmadan önce tamir sistemlerini etkisiz hale getirerek mutasyonlara yol açmaları gerekir (Niki ve ark 2010).
Akrilamid kaynaklı olası toksik etkiler temel olarak birbiriyle ilişkili iki yolla gerçekleşmektedir (Ghanayem ve ark 2005). 1. Doğrudan, akrilamid ve türevlerinin oluşturduğu etkiler. 2. CYP2E1 aktivasyonu sırasında oluşan reaktif oksijen radikalleri ile oluşan etkiler. Akrilamidin CYP2E1 aracılı detoksifikasyonu, reaktifliği yüksek ara bileşiklerle gerçekleşmektedir. Eğer konjugasyon basamağı (Faz II), aktivasyon basamağını (Faz I) izlemezse, aktive olmuş akrilamid molekülü kendi çevresindeki diğer moleküllerle tepkimeye girebilmekte ve toksik etki göstermektedir (Tong ve ark 2004, Zödl ve ark 2007).
18
1.8.1. Glutatyon (GSH)
Redükte glutatyon (GSH) vücudun en önemli non-enzimatik antioksidan molekülüdür. GSH, serbest oksijen radikallerini (SOR) non-enzimatik yolla detoksifiyeederek dokuları oksidatif stresin zararlı etkilerinden korur. Çok daha önemli olan diğer bir işlevi de, dokuların en önemli enzimatik antioksidanlarından olan glutatyonStransferaz (GST) ve glutatyon peroksidaz (GSH-Px) aktivitesi için şiddetle ihtiyaç duyulan bir koenzim olmasıdır. Fizyolojik şartlarda tüm dokularda oksidanlarla antioksidanlar arasında bir denge söz konusudur. Bu oksidan/antioksidan dengesi, vücutta doğal olarak üretilen SOR’ların etkisizleştirilmesini ve dokuların radikallerebağlı hasarlardan korunmasını sağlar (Fantone ve ark 1982).
Oral yolla alınan akrilamid, sindirim sistemi boyunca yeterli düzeyde GSH mevcut ise, GST tarafından glutatyonla konjuge edilerek (akrilamid-glutatyon) etkisizleştirilir ve kolaylıkla atılır. Tüm vücutta bulunan redükte glutatyonun yaklaşık %60’ı karaciğerde bulunduğu için karaciğerde çok daha yüksek bir kapasite ile akrilamid, akrilamid-glutatyon konjugatına çevrilerek büyük oranda idrarla vücut dışına atılır. Ancak akrilamidin, suda çözünürlüğünün yüksek olması nedeniyle bir kısmı da bütün vücut dokularına dağılım gösterir. Vücudun tüm dokuları, GST / GSH düzeylerine bağlı olarak akrilamidi GSH ile konjuge ederek etkisizleştirebilir (Freeman ve ark 1982).
Akrilamid ayrıca, karaciğerde sitokrom P450 2E1 (CYP 450 2E1) ile okside edilerek çok daha genotoksik olan glisidamide dönüştürülür. Glisidamid molekülü de GST / GSH sistemiyle glisidamid-glutatyon konjugatına çevrilerek detoksifiye edilir ve idrarla vücut dışına atılır. Ancak, akrilamidin katabolizması sırasında en önemli sınırlayıcıfaktör, ortamda yeterli düzeyde GSH’ın bulunabilirliğidir.
19
1.8.2. Süperoksit Dismutaz (SOD)
McCord ve Fridovich tarafından 1969’da sığır eritrositlerinden izole edilen SOD, süperoksit iyonunun hidrojen peroksit ve oksijene dönüşüm reaksiyonunu katalize eder (Marklund ve ark 1980).
2O2 + 2H+ → H2O2 + O2
SOD bütün aerobik organizmalarda mevcuttur. Anaeroblarda bulunmaz veya çok düşük konsantrasyonlarda bulunur. Metal içeriklerine göre Cu/Zn, manganez (Mn) ve demir (Fe) olmak üzere 3 tip SOD karakterize edilmiştir. Örneğin Fe-SOD mikroorganizmalarda (örnegin E. Coli‟nin plazmasında) ve bazı bitkilerde bulunmaktadır (Halliwell ve ark 1994). SOD insanlarda özellikle beyinde, karaciğerde, kalpte, eritrositlerde ve böbrekte yüksek konsantrasyonlarda olmak üzere 3 formda bulunur: sitozolik Cu-Zn SOD, mitokondriyal Mn-SOD ve ekstraselüler SOD. Ekstraselüler SOD; dokular arası boşluklarda ve hücreler arası sıvılarda bulunur ve plazmadaki, lenfteki ve sinoviyal sıvılarındaki SOD aktivitesinin genelini oluşturur.Hücrede ve hücreler arası ortamlarda mevcut SOD miktarı oksidatif strese bağlı hastalıkların önlenmesinde önemlidir.SOD bakteriyel yaralanmada, oksidatif metabolitler tarafından oluşturulan hasarda koruyucu etkiye sahiptir. SOD dışarıdan verilirse süperoksit oluşturucu enzim sistemlerinin veya aktive fagositlerin yol açtığı hücre ve doku yaralanması önlenir. Süperoksitin yol açtığı hasara karşı koruyucu bir rolü vardır. SOD dışarıdan verilirse süperoksit oluşturucu enzim sistemlerinin veya aktive fagositlerin yol açtığı hücre ve doku yaralanması önlenir. SOD ile katalizlenen reaksiyonlar son derece hızlıdır. Hücrelerde ve dokularda yeterli miktarda enzim bulunması tipik olarak; süperoksit konsantrasyonunu düşürür (Fantone ve ark 1982).
Çalışmamızda akrilamid uygulanan hücrelerin uygulanmayan hücrelere göre oksidatif stresi nekadar arttırdığını incelemek amacıyla SOD miktarı incelenmiştir. Literatürde akrilamid-SOD ilişkisi hakkında yeterli ve tatmin edici bilgi yoktur.
20
1.8.3. Katalaz (CAT)
Katalazın doğada sık olarak bulunan bir enzim olduğu 1901‟de O. Loew tarafından rapor edilmiştir. İlk kez 1937‟de Sumner ve Dounce tarafından sığır karaciğerinden kristal şeklinde izole edilmiştir (Aebi ve ark 1974). Dokuların katalaz aktivitesi çoğunlukla değişkenlik gösterir. Genelde karaciğer ve böbrekte minimal olarakda bağ dokusunda bulunmaktadır. Dokularda temelde mitokondri ve peroksizomlardadır (Freeman ve ark 1982). Eritrositlerde çözünmüş olarak mevcuttur. Kandaki katalaz aktivitesi eritrositlerden kaynaklanmaktadır. Katalazın katalizlediği reaksiyon aşağıdaki şekildedir (Bast ve ark 1991).
2H2O2→ 2H2O + O2
Yapmış olduğumuz çalışmada literatürde çok fazla yer almayan akrilamide maruz kalan hücrelerin SOD ve CAT miktarlarına nasıl etki ettiğini araştırılmıştır.
Akrilamid bazı doku hücrelerinde sitotoksik ve genotoksik etki göstermektedir. Yapılan in vivo çalışmalarda da nörotoksik olduğu ve tümör oluşturduğu tespit edilmiştir. Ancak diyetle alınan akrilamid bu çalışmalarda kullanılan dozların çok altında ve uzun sürelidir. Buna dayanarak düşük dozda akrilamidin hücresel hangi mekanizmaları kullanarak tümöre sebep olduğunu araştırmak amacıyla bu tez çalışması yapılmıştır. Oksidatif stres hücresel dengenin radikal oksijen ürünleri yönünde bozulmasıdır. Öncelikle akrilamidin oksidatif stres üzerinden hücresel dengeyi bozarak kanserogeneze sebep olacağı seçeneğinden yola çıkarak yapmış olduğumuz çalışmamızda oksidatif stres modülatörlerinin düzeylerini incelenmiştir. Son olarak tüm sonuçlar birlikte değerlendirilmiştir.
21
2. GEREÇ ve YÖNTEM
2.1. Kimyasallar
Akrilamid kimyasalı Sigma Aldrich(St Louis, MO, USA)firmasından, tüm hücre kültür reaktifleri ve tamponlar Gibco (Rockville, MD, USA) firmasından, GSH/GSSG Assay Kit, Superoxide Dismutase Assay Kit ve Catalase Assay Kit Bioassaysys (Hayward, USA) firmasından temin edildi.
2.2. Hücre Kültürü
Embriyonik böbrek hücre hattı HEK293 kullanıldı. Bu hücreler, %10 FBS (Fetal Bovine Serum) (Biochrome, Almanya) ve %1 penisilin/streptomisin (100 U/ml penisilin ve 100 µg/ml streptomisin) (Biochrome, Almanya) içeren RPMI (Biochrome, Almanya) kültür vasatında farklı flasklarda kültürü yapıldı. Hücreler flaskın %80 ini kapladıktan sonra 1xPBS (Gibco, ABD) ile yıkanarak % 0,25 Trypsin-EDTA (Biochrome, Almanya) enzimatik solüsyonu ile kaldırıldı ve eşit miktardaki FBS içeren besiyeri ile inaktive edildi. Yedeklenecek hücreler, %10 DMSO içeren dondurma vasatında -80 °C de stoklandı. Çalışmaya devam edilen hücre kültürleri, 2 günde bir besiyerlerinin değiştirilmesi suretiyle, 37 °C ve %5 CO2 ortamda etüvde yeterli doluluk oranına ulaşıncaya kadar kültür edildi.
2.3. Hücre Sayımı
100 μl hücre süspensiyonu 1,5 ml’lik ependorf tüpe aktarıldı ve üzerine dilüsyon faktörü 2 olmak üzere 100 μl %0,04 trypan blue boya solüsyonu eklendi ve hafiften pipetaj yapıldı. Boyanmış hücre süspansiyonu 5 dakika oda ısısında bekletildi, daha sonra hemositometri lamına 20 μl hücre süspansiyonundan yüklendi ve canlı hücreler ışık invert mikroskop altında (100× büyütme) 5 farklı bölgede sayıldı ve sayı ortalaması alındı. Toplam, canlı ve ölü hücre sayısı aşağıdaki formül uygulanarak hesaplandı:
22
İleriki çalışmalar için hücreler ayrı ayrı çoğaltıldı ve 1 ml dondurma medyumu (%10 DMSO, %90 FBS) içinde ve -85°C derin dondurucuda arşivlendi.
2.4. Canlılık Analizi
Hücre canlılığı MTT (Thiazolyl Blue Tetrazolium Bromide) redüksiyon testi ile araştırıldı. Hücreler 3x103-4.5x103 yoğunluğunda, 100 µl olacak şekilde 96lık hücre kültür plaklarına ekildi. Akrilamidin sitotoksik profilini belirmek için; farklı akrilamid konsantrasyonlarına sahip (2, 1, 0.1, 0.01, 0.001, 0.0001 M) besiyerleri hücrelere verildi ve 37 °C de 5% CO2 li ortamda farklı zaman aralıklarında (24, 48 ve 72 saat) kültüre edildi. Kültürü tamamlanan hücrelere 10µl thiazolyl blue tetrazolium bromide eklendi ve 3 saat etüvde bekletildi. Daha sonra her kuyucuktan 80 µl besiyeri boşaltıldı ve 50 µl DMSO eklendi, 20 dk etüvde inkübe edildi. Son olarak sitofotometride 490 nm absorbansta ölçüm yapıldı. Kontrol grupları %100 canlılık olarak baz alındı, her doz için 6lı tekrar yapıldı. Akrilamidin HEK293 hücre hattı için IC50 değeri Graph Pad Prism Software (version 5.03, La Jolla, CA, USA) kullanılarak hesaplandı.
2.5. Genotoksik Etkinin Analizi
Akrilamidin HEK293 hücre hattındaki genotoksik etkisi Sitokinez Bloke Mikronükleus Testi ile bakıldı. 2.5x103 hücre T25 lik kültür flasklarına ekildi ve 48 saat inkübe edildi. Hücrelere farklı konsantrasyonlarda (0.1, 0.01, 0.001 M) akrilamidli besiyeri eklendi ve 24 saat inkübe edildi. 48. Saatte taze besiyeri ile birlikte sitokhalasin-B eklendi ve 24 saat daha inkübe edildi. Hücreler tripsinize edilerek kaldırıldı, yıkandı, gerekli santrifüj aşamalarından sonra soğuk metanol ile kuru slaytlar üzerine sabitlendi. Kuruduktan sonra Giemsa boyama ve sonra ışık mikroskopuyla sayım yapıldı. MN frekansı için; 1000 çift çekirdekli hücre sayıldı ve MN/1000BN (Mikronukleus sayısı/1000 Binukleatidli hücre sayısı) oranı alındı.
2.6. Floresan In Situ Hibridizasyon (FISH) Tekniği
Hazırlanan preparatlara tüm sentromer gen bölgelerinin probları (Cytocell) kullanılarak FISH (Floresan In Situ Hibridizasyon) yöntemi uygulandı.
23
2.6.1. FISH Preperatı Hazırlama
2.5x103 hücre T25 lik kültür flasklarına RPMI hücre besiyeri içinde ekildi ve 48 saat inkübe edildi. Hücrelere yüksek oranda mikronükleus oluşturan doz baz alınarak akrilamidli medium uygulandı ve 24 saat inkübe edildi. Hücreler 2 ml tripsin kullanılarak kaldırıldı, PBS ile yıkandı,1500 rpm de 5 dk santrifüj yapıldıktan sonra soğuk metanol ile kuru slaytlar üzerine sabitlendi.
2.6.2. FISH Hibridizasyonu
Lamlar kuruduktan sonra işaretlenmiş olan bölgelere ilgili proplardan 10 µl eklendi ve üzeri lamel ile kapatıldı. Lamelin etrafı entellan veya uygun bir yapıştırıcı ile hava almayacak bir biçimde yapıştırıldı. Lamlar hot-plate de370C sıcaklıkta 10 dk bekletildi. Hot-plate’in sıcaklığı 750C ye yükseltildi ve preparatlar 2 dk bu sıcaklıkta bekletildi. Sıcaklık tekrar 370C ye düşürüldü ve cihazın su haznesine su eklenip, preparatlar 1 gece bu şekilde bırakıldı.
2.6.3. FISH Preperatlarının Yıkanması
Benmarinin sıcaklığı 720C ye ayarlandı; 4×SSC’nin sıcaklığı benmarinin sıcaklığına ulaşıncaya kadar bekletildi. Lamların üzerindeki yapıştırıcı ve lamel uzaklaştırıldıktan sonra lamlar, 4×SSC de 2 dk ve oda sıcaklığındaki 2×SSC de 30 sn bekletildi. Preparatların işaretli bölgeleri üzerine 10 µl DAPI ilave edilerek lamelle kapatıldı ve preparat analiz edilene kadar -20 0C de bekletildi.
2.6.4. FISH Sonuçlarının Değerlendirilmesi
Preparatlar Nikon ECLIPSE E 600 fluoresan mikroskopta uygun filtreler kullanılarak incelendi. FISH sinyalleri içeren nükleuslar analiz edildi ve fotoğraflandı.
24
2.7. Hücre Redoks Modulatör Düzeylerinin İncelenmesi
Akrilamid uygulanan hücrelerde redoks modülatörlerinin miktar tayini için Bioassay Systems Firmasına ait kitler kullanıldı (GSH için EnzyChrom™ GSH/GSSG Assay Kit, SOD için EnzyChrom™ Superoxide Dismutase Assay Kit, CAT için EnzyChrom™ Catalase Assay Kit ). Her kite ait prosedür izlendi. Ulaşılan veriler analiz edildi.
2.8. Verilerin İstatistiksel Analizi
Etken madde ile muamele edilmiş çalışma grupları negatif kontrol olan muamelesiz gruplar ile istatistiki karşılaştırma yapıldı ve anlamlılık P değeri hesaplanarak incelendi. Gruplar içi farklılık bağımlı Ttesti ve gruplar arası farklılık varyans analizi (ANOVA) uygulanarak araştırıldı. Bütün istatistik işlemleri GraphPad Prism® V.5.00 (GraphPad software Inc.) ve MINITAB® Release 14 programı kullanılarak gerçekleştirildi. P<0.05 istatistiksel fark olarak kabul edildi.
25
3. BULGULAR
3.1. Hücre Kültürü
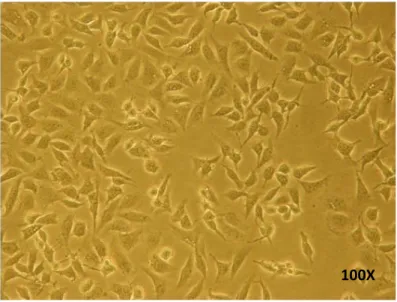
HEK293 hücreleri ATCC'da tanımlandığı gibi kültür edildi ve hücrelerin mitotik indeksleri dikkate alınarak optimizasyonları gerçekleştirildi. Etken maddesi optimize edilen hücre kültürleri (Şekil 3.1) projenin diğer amaçları için kullanıldı.
Şekil 3.1. HEK293 Hücre Hattına Ait Mikroskop Görüntüleri.
3.2. Akrilamid Hücre Canlılığını Düşürür
Hücrelerin canlılık analizi için MTT metodu kullanıldı. Akrilamid, çalışma da kullanılmak üzere literatür ile uyumlu 2, 1, 0.1, 0.01, 0.001 M dozlar seçildi ve karar verilen dozlar 24, 48 ve 72 saat boyunca hücrelere uygulandı. Ulaşılan sonuçlar Şekil 3.2. de gösterilmiştir. Ulaşılan sonuçlara göre ICF dozu ise 0.01 M olarak belirlendi.
26
Şekil 3.2. Akrilamid uygulanan HEK293 Hücrelerinin A) 24 saat B) 48 saat C) 72 saat MTT sonuç grafikleri.
Akrilamid uygulanan HEK293 hücrelerinde akrilamid uygulanmayan kontrole göre canlılığın 24 (p=0,0004), 48 (p=0,0060) ve 72 (p=0,0220) saat sonunda azaldığı tespit edildi. (Şekil 3.2). Bu anlamlı düşüş akrilamidin hücre canlılığına olan negatif ve proliferasyonu düşürücü etkisini açıkça gösterdi. Bu durumu genotoksik olarak incelemek amacıyla sitokinez bloke mikronükleus testi ile çalışmaya devam edildi.
C)
B)
A)
27
3.3. Akrilamid Genotoksik Etki Gösterir
MTT testi ile ICF dozu belirlendi ve bu doza uygun yeni doz seçimleriyle mikronükleus testine geçildi. İlk doz seçiminde hücre canllığını çok fazla düşüren 2 ve 1 M dozları mikronükleusta kullanılmadı çünkü analiz edilecek miktarda hücre eldesi zorlaştı. Oluşan mikronükleus örnekleri Şekil 3.3. de gösterilmiştir.
Şekil 3.3. Akrilamid uygulanan HEK293 hücre hattında oluşan mikronükleus
Dozlara göre sayılan toplam hücre sayısı, oluşan tek sitoplazmalı ve çift çekirdekli hücreler ve bunların mikronüleus içerenler hücreler sayıldı (Tablo 1.). Binükleus sayısı 1200 de sabitlendi ve oranlama buna göre yapıldı.
Tablo 1. Akrilamidin belirli dozlarda Hek293 hücre hattınada oluşturduğu mikronükleus sayıları.
Farklı dozlarda akrilamid uygulanan hücrelere ait mikronükleus sayımların ardından mikronükleus frekansları hesaplandı (Tablo 2.) ve istatistiksel hesaplaması yapıldı (Şekil 3.4.).
28
Tablo 2. Mikronükleus Frekansları
Şekil 3.4. Mikronüklus Sayılarının İstatistiksel Değerleri.
Kontrolle karşılaştırıldığında 0,001 M akrilamid için p= 0,020; 0,01 M akrilamid için p=0,0039; 0,1 M akrilamid için p=0,00047 istatistiksel değerler hesaplanmıştır.
3.4. Akrilamid DNA Kırıklarına Sebep Olur
Mikronükleus testi ile ulaşılan sonuçlar FISH tekniği ile konfirme edildi. Bu tekniğe göre, mikronükleusların sentromer probu ile işaretlenmip işaretlenmemesi dikkate alındı. İşaretlenmiş mikronükleuslar sentromer bölgesine sahip olarak değerlendirildi. Böylece mikronükleusların kromozomal kaynağı tespit edildi.
29
Şekil 3.5. Mikronüklueslara ait FISH görüntüleri A) Sentrik Mikronükleuslar B) Asentrik Mikronükleuslar
A B
A
30
3.5. Akrilamid Hücre Redoks Modulatörlerinin Düzeylerini Değiştirir
3.5.1. Süperoksit Dismutaz (SOD) Miktarı
Şekil 3.6. Akrilamidin dozlarına bağlı olarak SOD miktarındaki değişim.
SOD, endojen ya da ekzojen olarak hücrede reaktif oksijen türlerinin H2O2 ye
dönüştürülmesini sağlayarak diğer reaksiyonlara katılmasını sağlar. Bu işlemi yaparken SOD kapasitesi düşüş gösterir. Bulgularımıza göre akrilamid doza bağlı olarak hücrede SOD miktarını düşürmüştür.
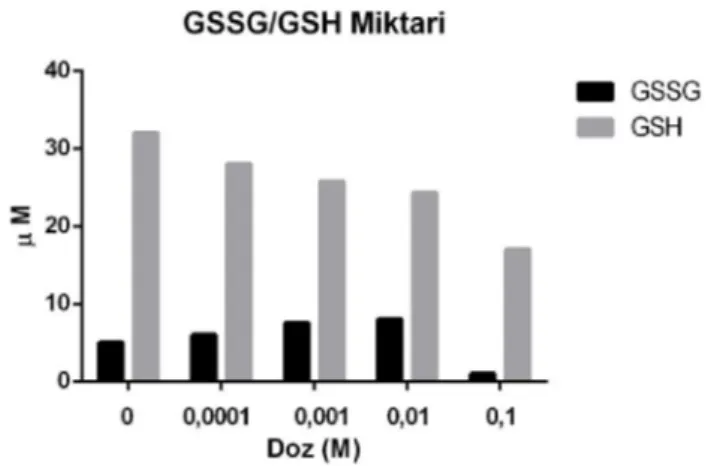
3.5.2. Glutatyon (GSH) Miktarı
Şekil 3.7. Uygulanan Akrilamid dozlarına göre GSH ve GSSG miktarlarındaki değişim.
31
Hücrede SOD tarafından oluşturulan H2O2, CAT ve GPX tarafından suya
dönüştürülerek etkisiz hale getirilir. GSH, H2O2 ile reaksiyona girerek okside
glutatyon olan GSSG’yi oluşturur. Miktarı azalan GSH, GSSG miktarının artmasına sebep olur. Bulgularımıza göre beklenen sonucu elde ettik IC50 dozuna kadar bu şekilde GSH miktarı düşerken GSSG miktarı artmıştır. Fakat IC50 dozundan itibaren okside glutatyon miktarını da etkili şekilde düşmüştür. Bu durum CAT miktarındaki değişimle birlikte tartışmada tartışılmıştır.
3.5.3. Katalaz (CAT) Miktarı
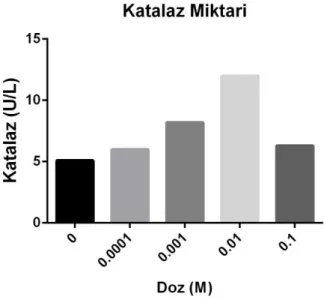
Şekil 3.8. Uygulanan Akrilamidin dozlarına bağlı olarak CAT miktarındaki değişim.
SOD ile hücrede miktarı artan H2O2 ilk olarak GSH ve CAT tarafından
tutulur, GSH Okside forma dönüşürken CAT tek reaksiyon ile H2O2’yi suya çevirir.
Akrilamidin farklı dozları uygulandığında CAT miktarı doza bağlı olarak artmış fakat IC50 dozundan itibaren düşmüştür. Bu düşüşün sebebi GSH ile aynı basamakta olmalarıdır.
32
4. TARTIŞMA
Akrilamid, deri emilimi ve oral yolla insanların istemeden maruz kalabildikleri ancak henüz genetik riskleri tam olarak belirlenememiş bir ksenobiyotiktir (Dearfield ve ark 1995). Ksenobiyotikler vücudumuza dışarıdan aldığımız az ya da çok zararı olan maddelerdir. Kullanılan ilaçlar ksenobiyotik olarak değerlendirilebilir. Akrilamid 2002 yılına kadar gıda kaynaklı olduğu bilinmediği için sadece mesleki maruziyet çalışmaları yapılmıştır. Daha sonra kozmetik ürünlerde kullanımı ksenobiyotik olarak vücuda alımını gündeme getirmiştir. Ksenobiyotikler kendilerinden ziyade metabolize olduktan sonra zararlı metabolitler oluşturması açısından da önemlidir. Akrilamid hücre içine alındığında kendinden daha aktif bir metabolit olan glisidamide dönüşmektedir. Yapılan çalışmalarda glisidamidin genotoksisiteyi arttırdığı bulunmuştur (Fuhr ve ark 2006, Mucci ve ark 2008, Bandarra ve ark 2013).
İnsan sağlığına olan asıl tehdit oral yolla alınan akrilamiddir. Çünkü günlük diyetimizde pişirilme koşullarından kaynaklanan birçok gıdada akrilamid oluşmakta ve uzun süreçte insanlar bu kimyasala maruz kalmaktadır (Biederman ve ark 2003).
Gıdalardaki akrilamid miktarı, içerdikleri aminoasit ve şeker oranı ile bağlantılıdır. Pişirilme koşulları akrilamid oluşumunu sağlar. Kızartılan gıdalarda yağ sıcaklığı arttıkça oluşan akrilamid miktarının arttığı tespit edilmiştir. Buna karşın haşlanarak pişirilen gıdalarda akrilamide rastlanmamıştır (Mottram ve ark 2002, Margeretha ve ark 2005). İsveç’te yapılan bir araştırmada, bir kişinin yiyeceklerle aldığı akrilamid miktarının günlük olarak ortalama 35 mg olduğu tespit edilmiştir. Yetişkin bir insanın vücut ağırlığının ortalama 70 kg olduğunu düşünürsek, kg canlı ağırlık başına ortalama 0,5 μg akrilamidin günlük olarak vücuda alındığı görülmektedir (Svensson ve ark 2003). Avrupa’nın diğer ülkelerinde yapılan araştırmalarda da benzer sonuçlar elde edilmiştir (Konings ve ark 2003, Dybing ve ark 2003).
İnsanlar için diğer bir akrilamid kaynağı da sigaradır. Yapılan araştırmalar sigara içenlerde sigara dumanı ile yoğun miktarlarda akrilamidin akciğerler kanalıyla
33
vücuda alındığını göstermektedir. Hatta bazı araştırıcılar, sigara içenlerde çok sık rastlanan akciğer kanserinin ana sebebinin, sigara ile akciğerlere alınan akrilamid olabileceğini ileri sürmektedirler (Bergmark ve ark 1997, Schettgen ve ark 2003).
Bağırsaklardan emilerek kana geçen akrilamid büyük oranda karaciğer ve diğer dokulara çok hızlı bir şekilde dağılım gösterir. Akrilamid, yarılanma süresinin kısa olması nedeniyle kandan çok hızlı bir şekilde temizlenmektedir. Karaciğere alınan akrilamidin bir kısmı GST/GSH sistemiyle konjuge edilerek detoksifiye edilir, bir kısmı ise sitokrom P450 enzim sistemiyle okside edilerek glisidamide dönüştürülmektedir. Glisidamid, akrilamidin okside edilmiş formudur. Glisidamidin katabolizması iki enzimatik yolla meydana gelmekte ve glisidamidin etkisizleştirilerek vücut dışına atılması sağlanmaktadır. Birinci reaksiyonda glisidamid, Epoksi Hidrolaz (EH) ile gliseramide okside edilerek yıkıma uğratılmakta ve büyük oranda idrarla dışarı atılmaktadır. İkinci enzimatik yıkım yolu ise, GST’nin glisidamidi GSH ile konjuge ederek detoksifiye etmesi şeklinde gerçekleşir (Sumner ve ark 1992).
Puppel ve arkadaşlarının yaptıkları çalışmada, hücre içi GSH seviyelerinin, akrilamid ve glisidamidin meydana getireceği genotoksisite düzeyleri açısından önemli bir faktör olup olmadığını test etmişlerdir (Puppel ve ark 2005). Hücre içi yüksek düzeydeki GSH, akrilamidin GSH’la konjugasyonunu artırarak glisidamid oluşumunu azalttığı ve glisidamid kaynaklı genotoksik hasarları önemli derecede engellediği ortaya konulmuştur. Bunun yanı sıra, GSH sentez inhibitörü verilen hayvanlara düşük düzeyde akrilamid uygulaması (1 mM) bile, hücre DNA’larında önemli derecede zincir kırıkları, baz kayması ve baz değişikliklerinin meydana gelmesine yol açmıştır. Bu sonuçlar, gerek akrilamid ve gerekse de glisidamid kaynaklı genotoksik etkilerin önlenmesinde hücre içi GSH düzeylerinin çok önemli olduğunu göstermektedir. Puppel ve arkadaşlarının yaptıkları bu çalışma bizim çalışmamızla uyum göstermektedir, sonuçlarımıza göre akrilamid uygulanan HEK293 hücrelerinde zincir kırıkları sebebiyle oluşan mikronükleuslar tespit edilmiştir.
34
Yaptığımız çalışmada, akrilamidin HEK293 hücre hattında ilk olarak canlılığı nasıl etkilediğini incelenmiştir. Buna göre akrilamidin miktarı arttıkça yapılan MTT redüksiyon testi sonuçlarına göre hücre canlılığının anlamlı şekilde düştüğü tespit edilmiştir. Susana Bandarra ve arkadaşlarının yaptığı proliferasyon testi çalışmasında ulaşılan sonuçla bizim elde ettiğimiz sonuçlar paralellik göstermektedir (Bandarra ve ark 2013). Hücre canlılığının düşmesi birçok sebebe dayandırılabilir. Bunlar arasında hücrenin genetik materyalinde olan hasarlar, hücrede oksidatif stres dengesinin bozulması vb. durumlar etkili olabilmektedir. Manjanatha nın çalışmasında ise farelerin içme suyuna katılan akrilamid ve glisidamid in akciğer dokusunda cll mutasyonlarını 2-5 kat arttırdığı görülmüştür. Bu çalışmaya göre A:T -> T:A, G:C -> C:G transversyonları ve +1/-1 çerçeve kayması mutasyonları tespit etmişlerdir (Manjanatha ve ark 2015). Akrilamidin oluşturduğu mutasyon çalışmalarından bir tanesi de von Tungeln ve ark yaptığı LOH analizidir bu çalışmaya göre intragenik mutasyonlar tespit edilmiştir (Tungeln ve ark 2009).
Mevcut çalışmada, hücrelerde oluşan genotoksik etkiye sitokinez bloke mikronüklus testi ile bakıldı, sonuç olarak akrilamid hücrede mikronükleus oluşumunu tetiklemiştir. Sitokinez bloke mikronükleus metodu öncelikle sitogenetik hasarı ölçmek için kullanılmaktadır. Bu teknik ile klastrojen ve anojenler tespit edilir (Fenech ve ark 2000). Çalışmamızda akrilamid doz miktarı arttıkça sitotoksik etki oluşturarak hücre canlılığını doğrudan düşürmektedir. Ancak akrilamid IC50 dozunun altında sadece mikronüklus oluşturmuş, üst dozlarda mikronükleus sayımı yapılamayacak kadar canlılığı düşürmüştür. Bandarra ve arkadaşlarının yaptığı çalışmada da akrilamid meme hücrelerinde mikronükleus oluşturmuş ve oksidatif stresten bağımsız olarak hücrenin direkt genetik materyaline zarar verdiği tespit edilmiştir (Bandarra ve ark 2013).
Son yıllarda yapılan çalışmalar, akrilamid ve glisidamid’in hücre DNA’sı üzerinde genotoksik (mutajenik) etki meydana getirerek DNA zincirinde kırılmalar, çapraz zincir bağlanmaları, baz kayması ve baz değişiklikleri gibi çok ciddi hasarlara neden olduğunu göstermektedir. Aslında DNA üzerinde meydana gelen bu genotoksik etkilerin, akrilamidden ziyade büyük oranda akrilamidin metaboliti olan glisidamidden kaynaklandığı bildirilmiştir. Glisidamid ve DNA katılma
35
çalışmaları HPLC/MS metodu ile bakılmış 1 µM gibi çok düşük dozda bile GA-DNA katılımı gösterilmiştir (Susana ve ark 2013). Gamboa nın yaptığı çalışmada da farelere uygulanan glisidamidin akrilamidin 5-7 kat üstünde DNA ya katılım gösterdiği tespit edilmiştir (Gamboa ve ark 2003).
Mevcut çalışmamızda hem mikronükleus oluşumunu konfirme etmek hemde oluşan mikronükleusların kaynağını tespit etmek amacıyla floresan in situ hibridizasyon (FISH) metodu kullanılmıştır. FISH sonuçlarına göre oluşan mikronükleuslarda sentromer bölgesi taşıyanların taşımayanlara göre 3 kat daha az olduğu tespit edilmiştir. Kontrol grubunda ise hiç mikronükleus görülmemiştir. Bu verilere göre akrilamidin DNA kırıklarına sebep olarak genotoksik etki oluşturduğu bulunmuştur. Buna ek olarak sentromerli tespit edilen mikronükleuslar ise hücre bölünmesi esnasında iğ ipliklerine de etki etki ettiği ve böylelikle sentromer bölgesi taşıyan kromozom ya da kromozom parçalarının da ayrıldığını göstermektedir. Bu durum akrilamidin hücrelerde anöploidi oluşumunu arttığını göstermektedir. Högstedt ve Karlsson’ın geliştirdikleri modifiye metotlarla anöploidiye yol açan ajanlar ile klastojenleri birbirinden ayırmada MN büyüklük farkından yararlanmışlar; klastojenlerce uyarılan MN’lerin asentrik kromozomal fragmanlar içerenlerin küçük, anojenlerce uyarılan MN’lerin tam kromozomlar içeren daha büyük ebatlı olduğunu göstermişlerdir (Högstedt ve ark 1985). FISH sonuçlarımızda da sentrik MN’lerin asentriklere oranla daha büyük olduğunu tespit ettik. Sayısal olarak asentrik mikronükleusların sentrik olanlara oranı üç kat daha fazla olduğunu tespit ettik. Bu durum akrilamidin iğ ipliklerinden daha çok DNA kırıklarına sebep olduğunu göstermektedir.
Çalışmamızda yaptığımız ön çalışmalarda akrilamidin hücre canlılığına etki ettiği bulunmuştur bundan yola çıkarak düşük dozların hücresel hangi mekanizmalarda etkili olabileceği üzerinde durulmuştur. Oksidatif stres yolağının ksenobiyotikler için kritik bir yolak olduğu düşünülmüş ve oksidatif stres belirteçleri olan GSH, SOD ve CAT aktiviteleri de incelenmiştir.
Oksidatif stres, hücrelerde SOR’ların aşırı artışı veya antioksidanların düzeyinin düşmesi sonucunda oksidan/antioksidan dengenin oksidanlar lehine
36
bozulması durumudur. Bu durumda, SOR’lar yeterli düzeyde detoksifiye edilemediği için hücrenin lipid, protein, karbonhidrat, DNA gibi yapısal makromoleküllerinde oksidatif hasarlanmalar meydana gelir (Bast ve ark 1991). Oksidatif stresin; aterosklerozun, yangının, şeker hastalığının, iskemi/reperfüzyon hasarının patogenezinde, gen mutasyonunda, kanser gelişiminde ve ksenobiyotiklerin dokularda meydana getirdiği hasarlanmalarda aktif olarak rol oynadığı gösterilmiştir (Akkus ve ark 1995, Speit ve ark 2002).
İnsanlar, deney hayvanları ve hücre kültürleri üzerinde yapılan araştırmalar, akrilamid uygulanmasının serbest oksijen radikallerinin üretimini artırarak oksidan/antioksidan dengeyi bozduğunu ve oksidatif strese neden olduğunu göstermektedir. Akrilamidin hücrelerde özellikle GSH ve GST aktivite düzeylerini azaltarak oksidan/antioksidan dengeyi oksidanların lehine bozduğu ve bunun sonucunda da hücrelerde oksidatif hasarlanmalar meydana geldiği bildirilmiştir (Blasıak ve ark 2004, Puppel ve ark 2005).
Srivastava ve arkadaşlarının ratlara tek ve tekrarlayan dozlarda akrilamid uyguladıkları çalışmalarında, akrilamid’in beyin dokusunda GST aktivite ve GSH düzeylerini önemli derecede azalttığını, bunun sonucunda ise akrilamid kaynaklı oksidatif hasarlanmaların meydana geldiğini belirtmişlerdir (Srivastava ve ark 1986).
Bjorge ve arkadaşları, akrilamid uygulaması sonrası meydana gelen aşırı serbest oksijen radikallerinin, akrilamidin DNA’da meydana getirdiği hasarlanmalarda önemli bir rol oynadığını belirtmişlerdir. Ancak, antioksidan vitaminlerin akrilamidle beraber uygulanmasının, SOR’ları ortadan kaldırması nedeniyle akrilamid kaynaklı DNA hasarlarını önemli derecede azalttığı sonucuna varmışlardır (Bjorge ve ark 1996).
Akrilamid kaynaklı oksidatif hasarlanmaları ortaya koymak amacıyla yapılan en önemli çalışmalardan biri olan, Yousef ve El-Demerdash tarafından, erkek ratlara değişik dozlarda akrilamid uygulamasının farklı dokularda antioksidan enzim düzeyleri ve lipid peroksidasyonu üzerine etkilerini araştırmak amacıyla yapılmıştır. Bu amaçla ratların içme suyuna 0.5, 5, 25, 50, 250 ve 500 μg/kg vücut ağırlığı