T.C.
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ
ÇOCUK SAĞLIĞI VE HASTALIKLARI ANABİLİM DALI
TİP 1 DİYABETES MELLİTUSLU HASTALARDA
OTOİMMUN HASTALIKLARIN
DEĞERLENDİRİLMESİ
(Uzmanlık Tezi)
Dr. Handan Bayhan
(Tez Yöneticisi)
Prof. Dr. Kenan HASPOLAT
DİYARBAKIR 2009İÇİNDEKİLER
KONULAR SAYFA
İçindekiler………l Teşekkür………..ll Kısaltmalar………..………lll Tablo ve Grafik Listesi………lV
Giriş ve Amaç………..………...1 Genel Bilgiler……….………..…3 Materyal ve Metod………….……….……….….…40 Bulgular….….……….……….….………..……...42 Tartışma………..…….………...49 Sonuçlar……….………...55 Özet……….…56 Abstract..………57 Kaynaklar……….……….…….58
TEŞEKKÜR
Uzmanlık eğitimim süresince bilgi ve tecrübelerinden yararlandığım değerli hocalarım; Anabilim Dalı Başkanımız Prof. Dr. Mehmet Ali TAŞ, tezimin her aşamasında büyük katkı ve desteği olan Prof. Dr. Kenan HASPOLAT, Doç. Dr. Mehmet BOŞNAK ve Prof. Dr. Yusuf Çelik, diğer hocalarım Prof. Dr. Celal DEVECİOGLU, Prof. Dr. Fuat GÜRKAN, Prof. Dr. Murat SÖKER, Prof. Dr. Aydın ECE, Prof. Dr. Ahmet YARAMIŞ, Prof. Dr. Mehmet KERVANCIOĞLU, Doç. Dr. Bünyamin DİKİCİ, Doç. Dr. Selahattin KATAR, , Doç. Dr. Fatma ÇELİK, Yrd. Doç. Dr. Ayfer GÖZÜ, Yrd. Doç. Dr. M.Nuri Özbek, Yrd. Doç. Dr. Sultan MENTEŞ ECER, Yrd. Doç. Dr. Mustafa TAŞKESEN’ e teşekkür ederim.
Uzmanlık eğitimimin her aşamasında ve hayatım boyunca her konuda desteklerini esirgemeyen aileme, tüm doktor, hemşire ve personel çalışma arkadaşlarıma ilgi ve yardımlarından dolayı teşekkür ederim.
Dr. Handan Bayhan Diyarbakır–2009
KISALTMALAR
ADA (American Diabetes Association) : Amerikan Diyabet Birliği BMI (Body Mass Index): Vücut Kitle İndexi
DCCT (Diabetes Control ve Complications Trial): Diyabet Kontrolü ve Komplikasyonları Çalışması
DKA: Diyabetik Ketoasidoz DM: Diyabetes Mellitus
EURODIAB (The Epidemiology and Prevention of Diabetes) : Epidemiyolojik Temeli Çocukluk Çağı Diyabetinin Etiyolojisi Çalışması
HbA1c: Glikolize Hemoglobin HLA: Human Leukocyte Antibody IGF–1: İnsülin benzeri büyüme faktörü–1 MHC: Monoclonal Histocompatibility Complex MODY: Maturity Onset Diabetes of Young OGTT: Oral Glikoz Tolerans Testi
SD: Standart Sapma
UÇADİVET: Ulusal Diyabet Programı Çocuk- Adölesan Diyabeti İnsidansı Verileri Türkiye
WHO (World Health Organization): Dünya Sağlık Örgütü GAD: Glutamik Asid Dekarboksilaz
ICA: Adacık hücre antikoru a-TG: Tiroglobulin antikoru a-TPO: Tiroit peroksidaz antikoru EMA: Endomisyum antikoru FT4: Serbest T4
TABLOLAR, GRAFİKLER VE ŞEKİL LİSTESİ
TABLO LİSTESİ Sayfa no
Tablo 1: Diyabetes Mellitusta Tanı Kriterleri (ADA 2003)………..………9
Tablo 2: Yaşa Göre Hedeflenen HbA1c Değerleri………..….10
Tablo 3: İnsülin Tipleri ve Özellikleri………...19
Tablo 4: HbA1c değerlerine göre metabolik kontrol sınıflandırılması………….….25
Tablo 5: Tüm olguların genel verileri………43
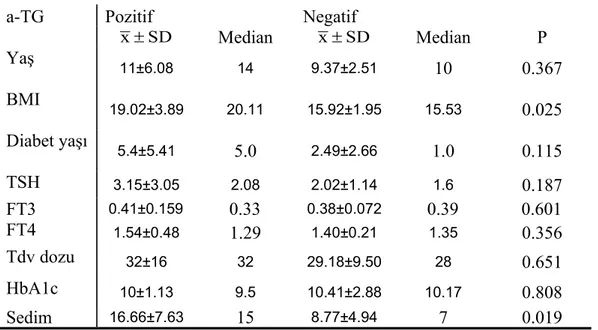
Tablo 6: Çalışma grubunda a-TG ye göre yaş ,BMI ,diyabet yaşı, TSH, FT3, FT4, tdv dozu, HbA1c ve sedim düzeylerinin dağılımı………..45
Tablo 7 : Çalışma grubunda a-TPO ye göre yaş, BMI, diyabet yaşı, TSH, FT3, FT4, tdv dozu, HbA1c ve sedim düzeylerinin dağılımı………...45
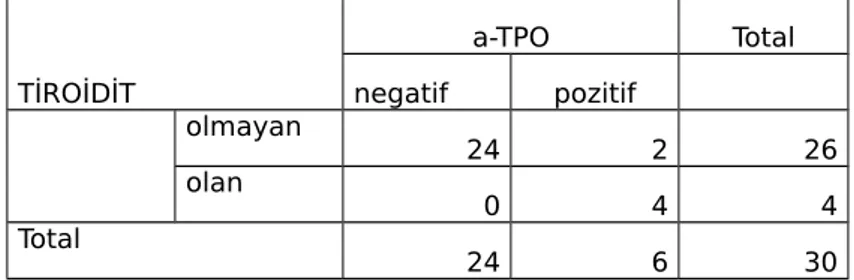
Tablo 8 :Hastaların a-TG’ ye göre tiroidit olma- olmama durumu…...46
Tablo 9 :Hastaların a-TPO’ ya göre tiroidit olma- olmama durumu………..46
Tablo 10 :Hastaların EMA’ ya göre çölyak hastalığı olma- olmama durumu……...47
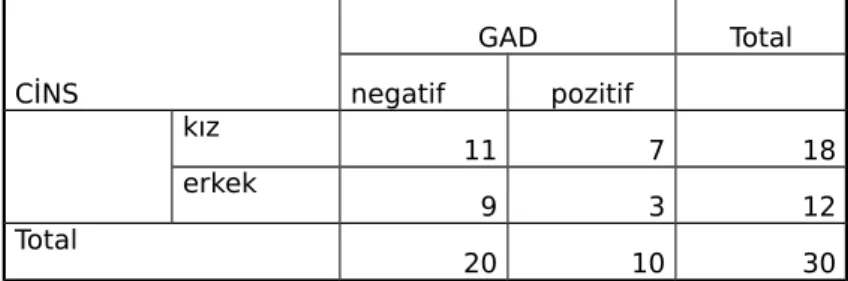
Tablo 11 :Çalışma grubunda cinsiyetlere göre GAD dağılımı………..….47
Tablo 12 :Çalışma grubunda cinsiyetlere göre a-TG dağılımı………..….48
Tablo 13 :Çalışma grubunda cinsiyetlere göre a-TPO dağılımı………....48
Tablo 14 :Çalışma grubunda cinsiyetlere göre EMA dağılımı………..48
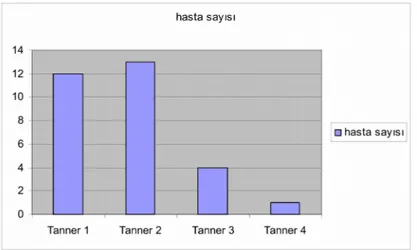
GRAFİK LİSTESİ Grafik 1: Olguların Tanner Evreleri……….……….44
GİRİŞ VE AMAÇ
Diabetes mellitus (DM) insülin yokluğu, yetersizliği veya insülin reseptörleri direnci ile gelişen, kronik hiperglisemi ile seyreden, karbonhidrat yağ ve protein metabolizmasında bozukluklar ile karakterize bir hastalıktır.
Tip 1 diyabet, uygun genetik zeminde, çevresel faktörlerin etkisiyle pankreas beta hücrelerine yönelik başlayan otoimmün harabiyet ve bunu izleyen enflamatuar
olaylar sonucunda, uzun süreli preklinik dönemi takiben ortaya çıkan, multifaktöriyel
kronik bir hastalıktır.
Tip 1 diyabet insidansı, gerek topluluklar arasında gerekse aynı topluluk içinde bölgelere göre farklılıklar göstermektedir (1,2). ABD’de okul çocuklarında diyabet prevelansı 1.9/1000’dir. Ancak sıklık yaş ilerledikçe artmaktadır. Örneğin; 5 yaşında 1/1430 iken, 16 yaşında 1/360’dır.
Ülkemizde 1996’da 19 bölgeyi kapsayan çok merkezli bir çalışmada 0-15 yaş arası diyabet insidansı 2.52/100.000/yıl olarak bulunmuştur. Hemen tüm ülkelerde tip 1 diyabet insidansı giderek artmakta olup, yaklaşık yıllık artışın ortalama % 3 olduğu belirtilmektedir (3).
Tip1 ve/veya Tip 2 DM’li ailelerin çocuklarında hastalığın görülme sıklığının, diyabetli olmayanlara göre daha yüksek olması diyabetli babanın ve annenin çocuğunda daha sık diyabet gelişmesi, HLA DR3/DR4 allelerine sahip olanlarda ve onların çocuklarında diyabet gelişmesi, belli bölgelerde yaşayan ve dışarıdan göç almayan bölgelerde yapılan çalışmalar kalıtımın etkisini kanıtlamaktadır (4,5).
İmmun sistemdeki humoral (örneğin adacık hücre antikorları) ve hücresel (örneğin T hücrelerindeki değişimler) değişimlerle birlikte otoantijenlere tolerans
yüzey ve sitoplazmik bileşenlerine karşı oluşan otoantikorlar, otoimmunitenin bir göstergesidir. Tip1 DM genetik ve otoimmunite özelliklerinden dolayı diğer otoimmun hastalıklarla birlikte sık görülmektedir (6,7). Tip1 DM’da otoimmun harabiyet β-hücrelerin yanında, genetik yatkınlığın belirlediği spesifik organlara veya dokulara ait hücreleri de etkilemektedir. Tip 1 diabetes mellitus ile kendisine eşlik eden otoimmun hastaliklar arasındaki ilişki bugün artık açık olarak bilinmekte, fakat bunların oluşum mekanizmaları henüz net olarak açıklanamamaktadır.
Genetik olarak yatkın bireylerde çevresel faktörlerin tetiklemesi ile gelişen immun sistem değişikliklerinin, klinik semptomlar ortaya çıkmadan önce başladığı görülmüştür. Klinik öncesi bu dönem asemtomatik seyretmektedir ve otoimmun organ tahribatı henüz oluşmamıştır. Bu hastaların tanınması için humoral otoimmunite belirteçlerine bakılmalıdır. Bu dönemde diyabetik hastaların tanısında kullanılan adacık hücre antikorlarına ek olarak, tiroid hastalıklarına, çölyak hastalığına, pernisyöz anemiye , Addison hastalığına ve diğer birçok hastalığa bağlı antikorlar da sıklıkla oluşmaktadır. Önceleri antikor pozitifliğiyle kendisini belli eden otoimmunite zaman içinde organ tahribatı ile otoimmun hastalık haline dönüşür. Günümüzde birçok otoimmun hastalığın diyabetle ilişkisi bilinmektedir. Bu hastalıklar arasında haşimato tiroiditi ve çölyak hastalığı en çok karşılaşılanıdır.
Tip 1 diyabetik hastalarda rastlanan artmış tiroid otoantikorları otoimmun tiroid hastalıkları için karakteristiktir. Klinik bulgular ortaya çıkmadan önce yüksek antikor düzeylerinin saptanması önemlidir. Yüksek düzeydeki antikorlar tiroid fonksiyonunu değiştirebilmektedir. Hastalarda bazen yüksek antikor titrelerine rağmen normal tiroid fonksiyonları görülmekte ise de bunlarda daha sonra tiroid disfonksiyonu gelişebilmekte bu da kötü kontrollü diabetin ortaya çıkmasına yol açabilmektedir (8,9).
Çölyak hastalığı Tip 1 diyabetik hastalarda sık rastlanılan hastalıklardan birisidir. Normal popülasyona göre Tip 1 diabetlilerde daha sık görülmesi iki hastalğın benzer genetik mekanizmalar ile oluşabileceğini düşündürmektedir (10,11). Bu grup hastalarda tarama serolojik testlerle anti-gliadin ve anti-endomisyum antikor testleriyle yapılır. Kesin tanısı barsak biyopsisinde villus atrofisi, kript hiperplazisi ve lamina propriada inflamasyonun görülmesiyle konulmaktadır. Dibetik hastalarda,
çölyak hastalığı tanısı konulduktan sonra glutensiz diete başlanmasıyla glisemik kontrollerinde iyileşmeler gözlenmiştir (12).
Bu çalışmada, Tip 1 DM le beraber en sık görülen iki otoummin hastalık olan otoimmun tiroidit ve çölyak hastalığının prevelansı ve bu hastaların klinik ve labaratuar özellikleri araştırılmıştır.
GENEL BİLGİLER
DİYABETES MELLİTUS TANIMIDiabetes Mellitus (DM), insülin sekresyonunun ve/veya insülin etkisinin mutlak veya göreceli azlığı sonucunda protein, karbonhidrat ve yağ metabolizmasında bozukluklara yol açan, hiperglisemi ile karakterize metabolik bir hastalıktır (13,14). Birçok araştırmacıya göre diyabet otoimmun, genetik ve çevresel faktörlerin etkisiyle gelişen otoimmun bir hastalıktır (15,16). Diyabetin kliniğinde insülinin dokularda kullanılamaması sonucunda ortaya çıkan hipergliseminin neden olduğu poliüri, polidipsi, kilo kaybı, bazen polifaji ve görmede bulanıklık yer almaktadır (4). Kronik bir metabolizma hastalığı olan diyabetes mellitusta akut metabolik komplikasyonların yanı sıra, kronik mikrovasküler ve makrovasküler komplikasyonlar, mortalitenin en önemli nedenidir (17).
DİYABETES MELLİTUS TARİHÇESİ
Yunanca dia+betes ve mellitus kelimelerinden türeyen ve “tatlı idrar yapma” anlamına gelen diyabet, insanlığın ilk dönemlerinden itibaren tarihte yerini almıştır. DM’ un ilk tarifine milattan 1500 yıl önce Mısır Ebers papirüslerinde rastlanır. M.Ö 150 yıllarında, Kapadokyalı Arataeus çok su içme, çok idrara çıkmayı vurgulayarak hastalığı erime hastalığı olarak izah etmeye çalışmıştır (18).
Milattan sonra 200. yıllarda Kapadokya'lı Areateus hastalığa “diyabetes” ismini vermiştir. Thomas Willis 1600’lü yılların sonunda diyabetik hastaların idrarlarının tatlıolduğunu göstermiş ve hastalığa Diyabetes Mellitus adını vermiştir.
İdrarla şeker atıldığını ilk kez 1776 yılında İngiliz Matthew Dobsoy göstermiştir. İdrarı kaynatarak, buharlaştırmış sonra kurutmuş ve kristalleştirmeye terk etmiştir.
1777’ de Pool ve 1778’ de Cawley, kimyasal olarak idrarda şeker bulmuş ve idrardaki şekerin glikoz olduğunu kanıtlamışlardır.
İdrarda kantitatif olarak şeker arama metodunu Fehling, 1850 yılında tarif etmiştir.
Diyabetik komada idrarda aseton bulunduğunu ilk kez Prague’ den Lerch tanımlamış, onu 1857 yıllarındaki çalışmalarıyla Williams Paters izlemiştir.
Claude Bernard 1849–1855 tarihleri arasında yaptığı çalışmalarda hastalığın klinik bulguları yanı sıra, biyokimyasal bulgularıyla da ilgilenmiş ve glikozun karaciğerde glikojen olarak depolandığını göstermiştir.
1869' da Paul Langerhans pankreastaki hücre tiplerini ve Langerhans adacıklarını, 1875'de Claud-Bernard diyabetin nörohormonal mekanizmasını, 1889'da Mering ve Minkowski pankreotektomiyle diyabet oluşturarak hastalığın merkez organını tanımlamışlardır.
1921’ de Best ve Banting,hayvan pankreas ekstresinden ilk insülini izole etmişlerdir. 1922’ de Thompson bu insülini insanda ilk olarak kullanmıştır.
1926 yılında Frank, bugünkü oral anti diyabetiklerin atası Synthalini buldu. 1942’ de Laubatier, sülfonamidlerin hipoglisemik etkisini bulduktan sonra Sulfanilüre türevleri tıp dünyasına girdi.
1946–1950 yıllarında çeşitli uzun etkili insülinler bulundu.
1972’de saf insülinlerin yaygın olarak kullanılmaya başlamasından sonra, 1993’te diyabet tedavisinde metabolik kontrol sağlayabilen yöntemin, endojen insülinin fizyolojik salınımını en iyi taklit edebilen yöntem olduğu, böylece intensif insülin tedavisinin diyabetik komplikasyonları önlemede ve geriletmede daha başarılı bir uygulama biçimi olduğu ortaya konmuştur (19).
Amerikan Diyabet Birliği (ADA) Temmuz 1997’ de, 1979’ da basılan Ulusal Diyabet Veri Grubunun kriterinin yerini alacak tanı ve sınıflama kriterini yayınlamıştır. Bu kriterler hastalığı anlamamızdaki iyileşme ve bir önceki önerilerdeki genel yanlış anlaşılmaların düzeltilmesi amacıyla 2003 yılında tekrar düzenlemiştir.
Geçmişte juvenil diyabet, ketoza yatkın diyabet, otoimmun diyabet, insüline bağımlı diyabetis mellitus terimleri yerine 1998 de ulusal kabul ile Tip 1 diyabet adını almıştır. Tip 2 diyabet ise önceleri erişkin diyabet, insüline bağımlı olmayan diyabet olarak bilinirdi ( uzlaşı rehperi).
2004 yılında gözden geçirilerek etiyolojisine göre yapılan yeni sınıflamada ek olarak IFG (bozulmuş açlık glikozu), IGT (bozulmuş glikoz toleransı) yerine pre-diyabet tanımı getirilmiştir (20). Bu grupta, glukoz intoleransında bile, koroner arter hastalıklarının gelişebileceği gösterildiğinden vasküler risklerin belirlenmesi ve tedavi önem taşımaktadır.
Eski sınıflama sisteminde çocukta, gençte ve erişkinde diyabeti olan ve otozomal dominant geçişin gösterildiği aileler vardı. Diyabetin bu türüne erişkin yaşta ortaya çıkan gençlerin diyabeti (Maturity Onset Diabetes of the Young (MODY)) denilmekte ve Tip 2 DM bir alt tipi olarak düşünülmekteydi. Yeni sınıflama sisteminde ise MODY ‘diğer spesifik diyabet tipleri’ arasında yer almaktadır, çünkü beta hücre fonksiyonunda bu hastalığın meydana gelmesini sağlayan belirli bir genetik defekt vardır. Fakat Tip 2 diyabetin en önemli noktalarından biri olan insülin etkisinde minimal veya hiç defekt yoktur (21).
Yeni sınıflama aynı zamanda ‘malnütrisyon ilişkili diyabet’ tanımını sınıflandırmadan çıkarmıştır, çünkü protein eksikliğinin diyabete yol açtığı konusunda bir delil bulunamamıştır.
Diyabetes Mellitusun sınıflaması beş klinik sınıfı içerir; Tip 1 DM, Tip 2 DM, diğer spesifik diyabet tipleri, gestasyonel diyabetes mellitus ve prediyabet.
Yeni sınıflamada prediyabet olarak sınıflandırılan grupta; açlık plazma glikozu 100–125 mg/dl ve oral glikoz tolerans testinin 2.saat ölçümü 140–199 mg/dl olan hastalar yer alır. Bu kategorinin önemi, gelecekte diyabet ve kardiyovasküler hastalık için risk olmasıdır (22).
Diyabetin etiyolojik sınıflandırılması
L-TİP1 DM
(genellikle tam insülin eksikliğine yol açan B hücre harabiyeti) A-İMMÜN MEKANİZMAYA BAĞLI DİABET(TİP 1 A)
B-İDİOPATİK DİYABET (TİP1B) LL-TİP 2 DM
( insülin eksikliğine yol açan belirgin insülin direncinden,İnsülin direnci ile birlikte olan insülin salgı kusuruna kadar değişen geniş bir dağılım gösterir)
III -DİĞER SPESİFİK TİPLER
A-Β-HÜCRE GENETİK DEFEKTLERİ
1-KROMOZOM 12, HNF-1Α (MODY 3) 2-KROMOZOM 7, GLUKOKİNAZ (MODY 2) 3-KROMOZOM 20, HNF-4Α (MODY 1)
4-KROMOZOM 13, İNSÜLİN PROMOTER FAKTÖR-1(IPF-1; MODY 4)
5-KROMOZOM 17, HNF-1Β (MODY 5) 6-KROMOZOM 2, NEUROD1 (MODY 6) 7-MİTOKONDRİAL DNA (MELAS) 8-DİĞER
B-İNSÜLİN ETKİ MEKANİZMASINDA GENETİK DEFEKTLER 1-TİP A İNSÜLİN DİRENCİ
2-LEPRECHAUNİSM
3-RABSON-MENDENHALL SENDROMU 4-LİPOATROFİK DİYABET
5-DİĞER
C-EKZOKRİN PANKREASIN HASTALIKLARI
2-TRAVMA / PANKREOTEKTOMİ 3-NEOPLAZİ 4-KİSTİK FİBROZ 5-HEMOKROMATOZ 6-FİBROKALKÜLÖZ PANKREOTOPATİ 7-DİĞER D-ENDOKRİNOPATİLER 1-AKROMEGALİ 2-CUSHİNG SENDROMU 3-GLUKAGONOMA 4-FEOKROMASİTOMA 5-HİPERTİROİDİZM 6-SOMATOSTATİNOMA 7-ALDOSTERONOMA 8-DİĞER
E-İLAÇ YA DA KİMYASAL MADDELERE BAĞLI DİYABET
1- INSULIN EKSIKLIGI: ALLOKSAN VACOR L-ASPARAGINAZ STREPTAZOSIN TACROLIMUS DIAZOKSIT SIKLOSPORIN VE DIGER
2-INSULIN DIRENCI : GLUKOKORTIKOITLER Αinterferon buyume hormonu ve diger F-infeksiyonlar [CMV,KONJENİTAL RUBELLA]
G-İmmun Mekanizmaya Bağlı Nadir Formlar
1-“Stiff-man” sendromu
2- Anti-insülin reseptör antikorları
3-Diğer F-İnfeksiyonlar (CMV, KONJENİTAL RUBELLA) H-Diyabetle ilişki olabilen genetik sendromlar 1-Down sendromu 2-Klinefelter sendromu 3-Turner sendromu 4-Wolfram sendromu 5-Friedrich ataksisi 6-Huntington koresi 7-Laurence-Moon-Biedl sendromu 8-Myotonik distrofi 9-Porfiri 10-Prader-Willi sendromu 11-Diğer
DİYABETES MELLİTUS TANI KRİTERLERİ
Diyabetes Mellitus tanısında kullanılan kriterler ADA tarafından belirlenmiştir (23,20).
1.Günün herhangi bir saatinde öğüne bakılmaksızın ölçülen plazma glikoz değeri
≥200 MG/DL (>11 MMOL/L) ve eşlik eden diyabet semptomlarının (poliüri, polifaji, açıklanamayan ağırlık kaybı) olması,
2.En az 8 saatlik açlık sonrası plazma glikozu≥126 MG/DL (>7 MMOL/L) ,
3. OGTT sırasında 2. saat plazma glikozu >200 MG/DL (>11 MMOL/L).
ADA’ nın 1997’de ve WHO’ nun 1999 yılında yeniden belirlediği kriterlere göre, normal açlık glikozu 110 mg/dl’ nin altındadır. 8 saatlik açlık sonrası kan şekeri, 110–126 mg/dl arasında ise bozulmuş açlık glikozu, oral glikoz tolerans testinde 2. saatte 140–200 mg/dl arasında ise glikoz intoleransı olarak tanımlanır. Açlıkta plazma glikoz değerinin 200 mg/dl’ den büyük olması diyabet olarak kabul edilir (Tablo 1).
Açlık plazma glikoz düzeyi 100 mg/dl altında olan ve diyabet açısından yüksek risk taşıyan bireylerde belirli aralıklarla OGTT yapılarak bozulmuş glikoz toleransı veya diyabet aranmalıdır. Açlık kan şekeri tek başına tanı kritelerlerini sağlıyorsa OGTT’ ne gerek yoktur. Eğer hastada semptomlar yok veya hafif var ise ve glisemi tanılarını zorluyor ise OGTT gerekebilir. Ayrıca bozulmuş glikoz tolerans tanısı içinde OGTT’ ne gerek vardır (20).
ADA; bozulmuş açlık glikozu ve bozulmuş glikoz toleransı durumlarında, 5– 10 yıl içerisinde diyabet gelişme riski yüksek bulunduğundan, her ikisini de
prediyabet olarak sınıflandırmıştır. Bunların arasından yılda %1,5 ila %7,3 oranında, 5–10 yıl içerisinde yaklaşık %33’ ünde Tip 2 DM vakası gelişmektedir (4,24,25).
Karbonhidrat metabolizmasındaki bozulma, kesintisiz bir süreçtir ve diyabet tablosuna doğru yavaş bir gelişim görülmektedir (20,25).
Tablo 1: Diyabetes Mellitusta Tanı Kriterleri (ADA 2003).
Plazma glikozu (mg/dl) Açlık değeri: Normal < 110
Bozulmuş açlık glikozu 110–126 Diyabet > 126
OGTT (2.saat): Normal < 140
Bozulmuş glikoz toleransı 140–199 Diyabet > 200
Rastgele değer: (semptom varsa)Diyabet > 200
DM, yaygın bir hastalık olmasına rağmen rutin taramanın sadece risk altındaki kişilere yapılması önerilmektedir. Akut stres sırasında hiperglisemi gelişen çocukların çoğu genellikle diyabet hastası değildir. Acil birimlerinde tedavi edilen ve diyabetes mellitus hastalığı olmayan çocukların %3,8’ inde 150 mg/dl’ yi aşan hiperglisemiye rastlanmaktadır. Bu çocuklarda genellikle ciddi hastalık tablosu (ateş, hastaneye yatış gerektiren ağır hastalık, iv sıvı tedavisi verilmesini gerektiren durumlar) veya astımlı hastalarda olduğu gibi epinefrin ve steroid kullanımına bağlı geçici hiperglisemi tablosu mevcuttur ve sadece %2’ sinde diyabet vardır. Ciddi bir hastalık olmaksızın hiperglisemi görülen hastalar diyabet açısından çok daha büyük risk altındadır (4,26,27).
Klinik bulguların ve hipergliseminin yanı sıra idrarda glikoz ve keton cisimciklerinin saptanması da (glikozüri, ketonüri) tanı kriterleri içinde yer almaktadır. Çocuklarda renal glikoz eşik değeri olan 180 mg/dl’ nin aşılması sonucu glikozüri meydana gelmektedir. Ancak glikozüri bazen normal renal glikozüri yapan diğer nedenler (izole renal glikozüri, Fanconi sendromu veya diğer renal tübülopatiler) ve nadiren galaktozemi, pentozüri ve fruktozüri ile karışabilirse de hiperglisemi yokluğu ile DM tanısı kolaylıkla dışlanır.
Bazen travma veya enfeksiyona bağlı olarak hafif hiperglisemili glikozüriler görülebilir. Bu vakalar akut hastalık tablosu geçtikten haftalar sonra doğru teknikle yapılmış OGTT ile DM açısından araştırılmalıdır. Bu gibi durumlarda oto antikorların tayini de yararlıdır (4,26,28).
Tanı kriterleri içerisinde yer almayan ancak plazma glikozunun kontrolünü yansıtan glikolize hemoglobin (HbA1c), kan şekerine karşı bir takım avantajlar sunar. Kişinin aç kalmasına veya OGTT için iki saat beklemesine gerek yoktur. Hem açlık hem de tokluk glikozunu, üç aylık süredeki kan glikoz kontrolünü yansıttığı için her ikisine karşı bir avantajı olabilir. Fakat HbA1c diyabet tanısı koymak için yeterli değildir. HbA1c’nin ölçümündeki hassasiyet çok önemlidir. Çünkü HbA1c’deki % 1 lik yükselme ortalama kan şekeri düzeyinde %25–35 mg/dl’ ye karşılık gelir (27,29).
HbA1c ölçümlerinde normal değer, diyabetli olmayanlara ait olan %4–6 arasındaki değerdir. ADA, çocuklarda ve adölesanlarda diyabetin takibinde normal değerleri yaş dönemlerine göre ayırmıştır (Tablo 2).
Buna göre süt çocukluğu ve 6 yaş altı okul öncesi dönemindeki çocuklarda, ağır hipoglisemi gelişmesini ve onun bilişsel fonksiyonlar üzerindeki kalıcı olabilen etkilerini önlemek amacı ile HbA1c değerinin %8,5’ in altında fakat %7,5’ un üzerinde olmasını önermektedir. 6–12 yaş arasındaki preadölesanlar ve okul dönemi çocuklarda HbA1c değerinin %8’ in altında olmasını önerirken, adölesanlar ve genç erişkinlerde bu değerin %7,5’ un altında, hipoglisemi riskinden dolayı %7,0’ nin üstünde olmasını önermektedir (30).
Yaş HbA1c (%)
<6 ≤ 8.5
6–12 ≤8.0
13–18 <7.5
* American Diabetes Association. Standards of Medical Care in Diabetes, Diabetes Care 30,4–41, 2007.
TİP 1 DİABETES MELLİTUS
Tip 1 diyabet, uygun genetik zeminde, çevresel faktörlerin etkisiyle pankreas
beta hücrelerine yönelik başlayan otoimmun harabiyet ve bunu izleyerek gelişen inflamatuar olaylar sonucu ortaya çıkan tablodur (31).
İlk zirve okula başlamakla birlikte enfeksiyonlara daha fazla maruz kalınmasına, puberte döneminde artış ise cins steroidleri, büyüme hormonu artışı ve ruhsal streslere bağlanmaktadır. Tip 1 diyabetin ortaya çıkışında mevsimsel farklılıklar olmaktadır, sonbahar ve kış aylarında en sık görülmektedir. Erkek ve kızlar eşit olarak etkilenmektedir.
Tip 1 DM, Amerikan Diabet Birligi (ADA)’nın sınıflamasında 2 grupta ele alınmıstır (31). Tip 1A DM adacık otoantikorlarının pozitifligi ve insülitis tablosuyla karakterize otoimmun formudur. Bu form neredeyse her vakada ciddi insülin eksikligi ile sonlanır. HLA ile kuvvetli bir iliski söz konusudur. Tip 1B DM (idiyopatik) ise beta hücre otoimmunitesine yönelik bulguların olmadıgı fakat ciddi insülin eksikliginin görüldügü formdur. Ekzokrin pankreas bozuklukları tip 1B DM’a eslik edebilir. Bu vakaların bir kısmı daimi insülopenik olup ketoasidoza egilimlidirler. İdiyopatik tip 1 DM’lu hastaların çogu Afrika ve Asya orijinlidir (32).
Son 20 yıldaki epidemiyolojik çalışmalar, tip 1 DM’nin görülme insidensinde ve prevalansında dramatik değişikliklerin ve dünya ülkeleri arasında belirgin farklılıkların olduğunu göstermektedir. Bu durum çeşitli etnik gruplarda genetik ve çevre faktörlerinin derecesinin ve etkinliğinin ayrı oluşundan, sosyal ve ekonomik durumun değişik olmasından ve kullanılan araştırma metodlarının farklı olmasından kaynaklanmaktadır (22,33,34).
Görülme sıklığındaki artışın yanı sıra görülme yaşının da giderek 5 yaş altına indiği bildirilmektedir. Beş yaş civarındaki genel prevalansın 1/1430 olduğu saptanırken 16 yaş civarındaki prevalansın 1/360 olduğu saptanmıştır (35,36).
Ülkemizde 1996 yılında 19 bölgeyi kapsayan çok merkezli bir çalışma olan UÇADİVET–1 sonuçlarına göre Türkiye’de 0–15 yaş arası Tip 1 diyabet insidansı 2.52/100.000/yıl olarak saptanmıştır (3).
Tip 1 DM insidensinin 1997 yılına göre 2010 yılında %40 daha yüksek olacağı tahmin edilmektedir (35,37). Dünyada tip 1 DM’nin çocukluk yaş grubundaki global artış insidensinin %2.4 olduğu bildirilmektedir (38).
Tip 1 DM insidensinin 20. yüzyılda, genetik şifte bağlı olarak kuzey Amerika ve batı Avrupa ülkelerinde artma eğiliminde olduğu saptanırken birçok doğu Avrupa ülkelerinde artmış olan insidansta yavaşlama olduğu bildirilmektedir (39).
En sık görülme yaşı 5–7 yaş ve pubertenin başladığı 12-14 yaş grubudur. İlk zirve, okula başlanılması ile enfeksiyonlara daha fazla maruz kalınmasına bağlanırken, pubertadaki artış pubertanın etkisi ile artan cins steroidlerine, büyüme artışına ve ruhsal streslere bağlanmaktadır (35,36).
Sonbahar ve kış aylarında tip 1 diyabetin görülme sıklığı artmaktadır. Cotellessa ve ark.(40)’ nın 0–14 yaş arası tip 1 diyabetli çocuklarda, hastalığın mevsimlere göre görülme sıklığını inceledikleri çalışmada; hastalık tanısının konulduğu mevsimler; % 34,2 kış, % 18,7 ilkbahar, % 24,2 yaz ve % 22,8 sonbahar olarak saptanmıştır.
Tip1 DM’in sıklığı açısından kızlar ve erkekler arasında belirgin bir fark bulunmamaktadır. Erkeklerde 5 yaş civarında görülmekle birlikte, pubertede kızlar ve erkekler arasındaki fark oldukça azalır. Hatta bu dönemde kızlarda erkeklerden
daha fazla rastlanmaktadır. Songini ve arkadaşlarının yaptığı çalışmaya göre Tip 1 DM erkeklerde kızlardan 1,5 kat fazla görülmektedir (41).
TİP 1 DİABETES MELLİTUS ETYOPATOGENEZİ
Etyolojide, genetik, çevresel ve otoimmun faktörler önemli rol oynamaktadır.
1.Genetik faktörler
Genetik faktörler tip 1 DM’a hem yatkınlık hem de rezistansı etkilerler.
Genetik yatkınlık önemli olmakla birlikte, yeni tanılı tip 1 DM olguların birinci derece akrabalarınının %85’inde tip 1 DM öyküsünün olmadığı saptanmıştır (42,43). Fakat buna rağmen tip 1 diyabetli bir bireyin birinci derece akrabalarında diyabet gelişme riskinin 15–20 kat daha yüksek olduğu saptanmıştır (42,44).
Tek yumurta ikizlerinde tip 1 DM gelişme riskinin %30–50 olduğu bildirilmesine karşın ayrı yumurta ikizlerinde risk %6–10 ve ikiz kardeşi olmayanlarda risk %6 olarak bildirilmektedir (39,42,43).
Anne tip 1 diyabetli ise çocuklarında diyabet görülme riski %2, baba diyabet ise bu risk %7 olarak saptanmıştır ( 42,43). Babanın tip 1 DM olmasının anneye göre çocuklarda tip1 DM geliştirme riskini 1.8 kat artırdığı saptanmıştır (45).
Tip 1 DM’de genetik yatkınlıktan ve koruyuculuktan sorumlu HLA genleri, 6p21 kromozomda yer alan “Major Histocompatibility Complex”’ine (MHC) lokalize bölgelerdir (10,15,17,32). 6. kromozomun HLA bölgesi sınıf 1 (HLA A, B, C), sınıf 2 (HLA-DR, DQ,DP) ve sınıf 3 antijenlerini kodlayan genleri içermektedir. HLA (+) olan bir bireyde diyabet gelişme riski %15 iken, HLA(-) olanlarda bu risk %1’dir. Beyazlarda DR4-DQ8 ve DR3-DQ2 haplotipleri maksimum yatkınlık sağlar. Buna göre genel populasyonda DR3:DRB1*0301DQA1*0501 DQB1*0201, DR4: DRB1*0401 DQA1*0301DQB1*0302, DR4: DRB1*0402DQA1*0301 DQB1*0302 genleri yüksek riskli; DR8: DRB1*0801 DQA1*0401 DQB1*0402ve DR2: DRB1*1501 DQA1*0102 DQB1*0502 genleri ılımlı riskli olarak Tip 1 DM’in gelişmesinde yatkınlık sağlayan genlerdir.
Buna karşılık bazı haplotiplere diyabetik hastalarda son derece nadir rastlanmakta ve diyabetten koruyucu oldukları düşünülmektedir. Koruyuculuğu olduğu düşünülen genler HLA DR ile ilişkili DR15, DR2 ve DR5; DQ veya DQB1
allellerinden DQB1(*0602 ve *0301 güçlü, ve *0302 zayıf), DQA1(*0102 ve 0501 güçlü, *0301 zayıf) ve DRB1 (*0401*0403*0301 zayıf)’dir.
Otoimmun poliglandüler sendrom-1 olan DQA1*0102, DQB1*0602 genlerine sahip Tip 1 DM’lu 200’den fazla hastada yapılan çalışmada koruyucu gene sahip 2 hastadan birinde, 21. kromozomun otozomal resesif mutasyonunun diyabetten koruyucu etkiyi kaldırdığı, üstelik diyabete yatkınlığa neden olabileceği belirtilmiştir.
HLA genleri Tip 1 DM’de yatkınlığı sağlayan ancak fonksiyonları tam olarak bilinmeyen birbileri ile ilişkisi olmayan yaklaşık 20 ilişkili gen ve bunlar içersinde de fonksiyonları bilinen iki gen tanımlanmıştır. Bunlar, diyabete yatkınlığın %10’nundan sorumlu olan ve 11p5.5. kromozomda yer alan IDDM2 ile 2q33 kromozomda yer alan ve T hücre aktivasyonundan sorumlu olan IDDM12 genleridir (35,42,48).
2-Otoimmünite
Genetik ve çevresel faktörler pankreasın adacık hücrelerine karşın otoimmün sürecin başlamasında tetikleyicidirler (35,49,53). Tanı sırasında adacık hücrelerini çevreleyen lenfosit infiltrasyonu, adacık hücrelerine karşı otoantikor oluşumu, dolaşımda aktive olmuş lenfositlerin varlığı, belirli HLA’larla ilişkisi otoimmunitenin rolünü destekleyen kanıtlar olarak sayılabilir. HLA DR ve DQ yatkınlığı olanlarda kronik lenfosit tiroidit ve atrofik gastrit görülme sıklığı artmıştır. HLA DR3- DQB1*0201 geni Tip 1 DM ve otoimmun tiroiditi olanlar için ortak risk içermektedir (6,16,50,51).
Yeni tanı konulan Tip1 DM’li hastalarda antikorlar %60-80 oranında pozitif iken genel populasyonda bulunma oranı %0.5’tir. Tip1 DM’li hastaların birinci dereceden akrabalarında bu antikorlar %3-4 oranında pozitif bulunmuştur. Yeni tanılı tip 1 diyabetli bir hastada GAD65A antikor pozitifliği %60-80 oranında saptanırken, adacık antikoru (ICA=Islet Cell Antibody) %70, adacık hücre yüzey antikoru olan tirozin fosfataz (ICA512A(IA-2)) antikorunun %40-60, insülin (IAA) antikorunun %35-60 oranında pozitif saptanma olasılığının olduğu bulunmuştur (35,49,52).
Beş yıllık süreçte, tek antikor pozitifliği olanlarda diyabet gelişme riskin %20–25 olduğu bildirilirken, iki antikor pozitifliği gösterenlerde bu riskin %50–60, üç antikor pozitifliği gösterenlerde %70, dört antikor pozitifliği olanlarda bu riskin
%80’lere çıktığı saptanmıştır (52,53,54). Yeni tanı almış tip 1 diyabetli hastada antikorlardan birinin pozitif olma oranı %95 iken, iki antikorun pozitif saptanma oranın %80, üç antikorunda pozitif saptanma oranının %25 olduğu bildirilmektedir (49).
Tip 1 diyabetli hastalarda otoimmun süreç dört fazda gerçekleşmektedir; 1-Çevresel faktörlere maruziyet, 2- T hücrelerinin uyarılması, 3- T hücrelerinin farklılaşması, 4- beta hücrelerinin haraplanması (35).
Otoimmun kaynaklı tip 1 DM’de insülin sekresyonudaki azalma iki mekanizma ile olmaktadır. Bunlardan birincisi pankreasın beta hücrelerinin haraplanması iken diğer mekanizma ise ortamdaki sitokinlerin pankreasın beta hücrelerinden insülin sekresyonunu azaltmaları ile olmaktadır.
Tip1 DM kısa süreli değil, yıllarca devam eden bir yıkımın sonucunda oluşmaktadır. Hastalık ancak β-hücrelerinin %80-90 oranında yıkıma uğramasından sonra belirginleşen insülin eksikliğinin hiperglisemi veya ketoasidoza yol açması ile fark edilmektedir. Hiperglisemi oluşmadan immünolojik olarak β- hücrelerine yönelik otoantikorların gösterilmesi veya İV glukoz tolerans testinin uygulanması ile bu süreç tablo ağırlaşmadan önce fark edilebilmektedir (4,55,56,57).
3-Çevresel faktörler
Çevresel faktörler, tip 1 DM gelişiminde önemli olan otoimmunitenin başlamasında, süpresyonunda veya başlamış olan otoimmunitenin progresyonunda önemli rol oynamaktadırlar (45,58).
Bilinen çevresel faktörler viral enfeksiyonlar, diyet, stres ve kimyasal ajanlardır. Tip 1 DM, yaz dönemi daha az epidemiler yaparken kış ve sonbahar aylarında viral enfeksiyon sıklığındaki artışla ilişkili olarak epidemi sıklığının daha yüksek olduğu saptanmıştır (35,36,58). Perinatal dönemde veya yaşamın erken döneminde enfeksiyonlara maruziyetin riski artırdığı öne sürülmüştür (49,53,58). Bugün için diyabet ve viral enfeksiyonlarla ilişkisi en iyi bilinen konjenital rubella enfeksiyonudur ve konjenital rubella enfeksiyonlarında tip 1 DM görülme sıklığının artığı saptanmıştır (42,49,58). Kabakulak, rota virüs, suçiçeği, ECHO virüs, Ebstein Barr virüs, retrovirüsler ve CMV diyabete neden olduğu gösterilen viral etkenlerdir (4,59). Anne sütünün ilk iki-üç ay gibi kısa bir sürede kesilmesi, bunun yerine inek
sütü veya inek sütü ile hazırlanan formül mamaların verilmesi ve 4. aydan önce buğday içeren ek gıdalarla beslenmeye başlanması Tip1 DM’in gelişmesinde etkili olduğu tespit edilen beslenme faktörleridir (1,59,60,61). Yeterli anne sütü alımının vitamin D alımı ile desteklenmesi durumunda β-hücre otoimmunitesine karşı koruma sağlandığını belirtmişlerdir (62,63).
Anne yaşının 35’ten büyük ve doğum ağırlığının 4500 gr’ ın üzerinde olması diyabet gelişimi için belirgin bir risk faktörüdür (4,59). Buna karşılık Hindistan’da yapılan bir çalışma, anne yaşının küçük olmasının ve düşük doğum ağırlığının Tip1 DM gelişme riskini arttırdığını bildirmektedir (64).
Emosyonel ve fiziksel stresler de diyabet gelişimini tetikleyebilmektedir.
TİP 1 DİABETES MELLİTUS’ DA KLİNİK
Tip 1 DM, akut başlangıç, remisyon (balayı), şiddetlenme ve total diyabet evrelerinden oluşur.
Çocukluk yaş grubunda diyabet tanısı, semptomların akut başlaması nedeniyle kolaylıkla konabilmektedir.
Çocuk ve adölesan yaşlarda diyabetin en sık klasik başvuru semptomları poliüri, polidipsi, kilo kaybı, halsizlik ve yorgunluktur.
Diyabetin diğer klasik bulgularından olan polifaji belirtisi çocukluk döneminde ketozisin anoreksik etkisi nedeni ile sık görülmemektedir (58).
Metabolik bozukluğun ilerlemesi durumunda hastalar kusma, solunum düzensizliği (kussmaul solunum), ağızda aseton kokusu, karın ağrısı, ağır dehidratasyon bilinç bulanıklığı ve koma bulguları ile başvurabilmektedirler (35,58,65,66).
Okul öncesi çocuklarda, beta hücrelerinin otoimmun haraplanması daha agresif seyretmektedir. Bu nedenle bu yaş grubundaki çocuklarda semptom sürelerinin daha kısa olduğu bildirilmekte ve sıklıkla da ketoasidoz semptomları olan letarji ve kusma semptomları ile başvurmaktadırlar. Adolesan yaş grubunda ise otoimmun haraplanmanın daha yavaş progresyonlu olması nedeniyle semptom sürelerinin daha uzun olduğu bildirilmektedir (67),
Tuvalet alışkanlığı kazanmış olgularda poliürinin ilk bulgusu enürezis nokturna olabilmektedir (35,58,65).
Puberte dönemindeki kız çocuklarında pyojenik deri enfeksiyonları ve moniliazise bağlı vajinit ilk şikayetleri olabilir (4,26).
Yeni tanı alanlarda insülin ihtiyacı bir süre sonra azalır. Balayı (remisyon) dönemi olarak adlandırılan bu dönem insülin salgılanmasında kısmi iyileşmeye bağlı geçici düzelmedir. Bu dönem hastaların %65’inde görülür. İnsülin ihtiyacı 0,5 İÜ/kg/günün altında ve HbA1c < %7,0’ dır. Bu süre 1-2 yıla kadar uzayabilir. Remisyon dönemi tanı aldıktan sonraki ilk yıl içerisinde geliştiğinden sonraki yıllarda çıkabilecek remisyon dönemleri genelde altta yatan bir başka endokrin hastalığın habercisi olabileceğinden dikkatli olunması gerekmektedir (4,26,27,28).
Diyabet ile ilişkili semptomların ortaya çıkışından birkaç yıl içinde, endojen insülin yapımının progressif olarak azalması sonucu klinik ve biyokimyasal bulguların daha hâkim olduğu total diyabet evresi başlamaktadır. Total diyabet takdirde diyabetik evresi insülin tedavisinin zorunlu olarak uygulanması gerektiği ve uygulanılmadığı ketoasidozun ve komanın kaçınılmaz olduğu evredir (66).
TİP 1 DİYABETES MELLİTUS TEDAVİSİ
Temel amaç Tip 1 diyabetli hastalarda akut ve ileri yaşlarda oluşabilecek komplikasyonlardan korunmalarını sağlamak, böylece hastanın sağlıklı bir hayat sürerek yaşam kalitelerini artırmaktır.
Tip 1 DM li çocukta uygun tedavi ile iyi bir metabolik kontrolün sağlanması, kısa dönem komplikasyonları olan diyabetik ketoasidozun ve hipogliseminin önlenmesi, uzun dönemde vasküler komplikasyonların ortaya çıkmasının önlenmesi, dengeli kalori alımı ile normal büyüme ve gelişmenin sağlanması ve hastaların psikolojik sorunlarının önlenmesi gereklidir
Tip 1 DM tedavisi; uzman hekim, diyet uzmanı, diyabet hemşiresi ve psikoloğun katıldığı bir ekip tarafından yönetilmelidir.
İnsülin tedavisinin tipi ve uygulama saatlerinin seçimi hastanın psikososyal gelişimini bozmayacak ve en uygun metabolik kontrol sağlayacak şekilde
bireyselleştirilmelidir. Bunun için diyabet ekibi tarafından çocuğun yaşı uygun ise çocukta dâhil olmak üzere aileye diyabet eğitimi verilmelidir (68,69).
Tedavide insülin kullanımı, beslenme planı, egzersiz ve eğitim dört önemli basamağı oluşturmaktadır (4,26).
İNSÜLİN TEDAVİSİ
Tip 1 DM tedavisindeki temel amaç, diyabetik olmayan bireylerdeki gibi mümkün olduğunca stabil plazma insülin düzeyi sağlamaktır.
İnsülin, pankreasın langershans adacıklarındaki beta hücrelerinden salgılanan, polipeptid yapıda bir hormondur. En önemli fonksiyonu; glikozun hücre içine girişini sağlayarak, kan glikoz düzeyini düşürmektir (70,71).
İnsülin molekül ağırlığı 5808 olan, 51 aminoasit ve A-B zincirleri ile bunları birleştiren C peptid bölümünden oluşmuş küçük bir proteindir. Fizyolojik olarak insülin beta hücrelerinden salındıktan sonra vena porta’ ya ulaşarak karaciğerdeki metabolik etkileri oluşturduktan sonra periferik dolaşıma katılmaktadır. Portal vendeki insülin düzeyi, perifere göre yaklaşık on kat daha yüksektir. İnsülin, besin-enerji homeostazını düzenleyen anabolik bir hormondur (72,73).
İnsülinin vücuttaki temel etkileri;
Glikozun yağ, kas ve karaciğer hücresine girişini sağlar, Hücrelerde glikoz yıkımını (glikoliz) arttırır,
Glikozun glikojene çevrilerek depolanmasını,
Yağların yağ asitlerine çevrilmesi ve trigliserid şeklinde depolanmasını, Protein sentezini arttırarak depolanmasını sağlar .
İnsülin tedavisinin amacı; insülinin kantitatif ve fonksiyonel yetmezliği sonucu gelişen olayları, eksojen insülin uygulayarak beta hücresinin dinamiğine ve ritmine yakın bir model ile normale çevirmek esasına dayanır (74).
İnsülin tedavisi ile normal insülin salınımı taklit edilerek, sağlıklı bireylerde olduğu gibi insülin ve kan glikozu arasındaki uyumu sağlamak amaçlanmaktadır (75,76).
Her tip 1 DM ‘li hastanın insülin tedavisi, hastaya ve aile yaşantısına göre düzenlenmelidir.
Tip 1 DM bulguları ile başvuran olgulara insülin tedavisinin uygulama yolu hastanın kliniğine göre değişkenlik göstermektedir. Diyabetik ketoasidoz ile başvuran olgularda ilk seçenek intravenöz yoldur. Başvuru esnasında kusması olmayan metabolik olarak stabil, asidozu olmayan olgulara insülin tedavisinin verilme tercihi subkutan yoldur Koma dışında yada ketoasidozdan çıktıktan sonra kullanılan insülin dozu genellikle 0.5-1 U/kg/gündür. Puberte öncesi insülin ihtiyacı ortalama 0,5-0,7 Ü/kg/24 saat olup, puberte sonrasında yaklaşık 1.0 -1.5 Ü/kg/24 saate çıkabilir. Beslenme, günlük aktivite, cerrahi işlem sırasında, enfeksiyon, artan stres durumunda insülin gereksinimi günlük gereksinimin %10- 20’si kadar artar. Tanı konulduktan sonra 1 yıl içinde geçici remisyon döneminde insülin ihtiyacı 0,5 Ü/kg/24 saate kadar düşer. Ancak bu dönemin sona ermesiyle aniden insülin ihtiyacı artar. İnsülin gereksinimi sürekli 1.5U/kg/gün üzerinde olan kişilerde aynı zamanda insülin direncini de düşünmek gerekir (4,26,28).
İnsülin tipleri; Diyabet tedavisinde kullanılan insülinler, elde edildikleri kaynaklara göre; domuz, sığır kaynaklı ve rekombinant DNA tekniği ile hazırlanan insan ve analog insülinlerdir (Tablo 3) (75,76).
Tablo 3: İnsülin Tipleri ve Özellikleri *
Tipi Görünüm Etki Başlangıcı Pik Etki Etki Süresi
Hızlı Etkili İnsülinler
Lispro (Humolog) Berrak 10–15 dakika 30–60 dk. 4–5 saat Aspart (NovoRapid) Berrak 10–15 dakika 45 dk. 3–5 saat
Kısa Etkili İnsülinler
Regüler Berrak 30–60 dakika 2–4 saat 4- 8 saat
Orta Etkili İnsülinler
NPH Bulanık 2–4 saat 6–10 saat 14–18 saat
Lente Bulanık 3–4 saat 6–12 saat 16–20 saat
Uzun Etkili İnsülinler
Ultralente Bulanık 4–6 saat 10–16 saat 20–24 saat Detemir (Levemir) Berrak 1–2 saat 4–10 saat 12–20 saat
Karışım İnsülinler
70/30 Bulanık 30 dakika 2–12 saat 24 saat
50/50 Bulanık 30 dakika 3–5 saat 24 saat
Humolog 25/75 Bulanık 15 dakika 30–90 dk. 24 saat
* http://www.clinical.diabetesjournals.org ( 2002 ).
Hayvan kaynaklı ve insan insülinleri arasında aminoasit dizilimi yönünden farklılıklar vardır. Domuz insülini 1, sığır insülini ise 3 aminoasit yönünden insan insülininden farklıdır (72,77,78). Sığır ve domuz insülininin antijenik özellikte olması ve immün yanıtı tetiklemesi (gamma globülin üretimini uyarması), özellikle sığır insülininin insülin alerjisi ve insülin direncini arttırması nedeniyle günümüzde tercih edilmemektedir (79).
Mikrobiyolojik tekniklerin gelişmesiyle 1980’ lerin başında biyosentetik insan insülini ticari olarak elde edilir hale gelmiştir.(80)
İnsülin tedavisi için hastaya etkin kan glikoz kontrolü sağlayacak ve hastanın uygulayabileceği yöntem önerilmelidir. Her hastaya uygun tedavi rejimi seçilmeli ve bu tedavi sürekli güncelleştirilmelidir (71).
İnsülin tedavisinde kullanılan yöntemler;
Sağlıklı bireylerde insülin salınımı iki fazdan oluşmaktadır.
1.Bazal Salınım: Pankreas yemekten bağımsız olarak 24 saat boyunca sürekli olarak
az miktardaki insülini portal vene salgılamaktadır. Bazal insülin salınımının glukoz metabolizmasındaki esas rolü; hepatik glukoz çıkışını kontrol etmektir. Bazal insülin düzeyi 1 ünite/ saattir. 24 saatlik toplam miktarı günlük insülin ihtiyacının yaklaşık % 40-50’sini karşılar (73,78,81).
2.Bolus (stimüle) insülin: Pankreas yemekle beraber yükselen glikoz seviyesine
göre salgıldığı insülin miktarını on kata kadar çıkmaktadır. İlk salınım fazı, gıda alınımı takiben 5 dakika içinde gerçekleşmekte ve karaciğerin glukoz üretimini supresse etmektedir. Bu faz 8-10 dakika sürer. Bundan sonra 30-60 dakika arasında ikinci faz gerçekleşip insülin
düzeyi pik yapmaktadır. Bolus insülin salınımı, her bir öğünde toplam günlük insülin gereksiniminin % 10-20’sini karşılar. İnsülin tedavisi ile normal insülin salınımı taklit edilerek, sağlıklı bireylerde olduğu gibi insülin ve kan glikozu arasındaki uyumu sağlamak amaçlanmaktadır (75,76).
Konvansiyonel İnsülin Tedavisi:
Günde 1 ya da 2 doz NPH veya karışım insülin uygulanan tedavi rejimidir. Günlük insülin dozu hastanın kilosuna göre 0,5–1,0 ünite/kg/gün olarak hesaplanarak dozun 2/3’ü sabah, 1/3’ü akşam dozu olarak uygulanır.. Sabah dozu % 70 NPH % 30 Regüler, akşam dozu % 50 NPH % 50 Regüler insülin olarak düzenlenir.
Tedavi planı, kan glikoz değerlerine göre her hasta için özel olarak düzenlenmelidir (82).
Çocuk ve adölesanların uzun dönemde iyi bir glisemik kontrol için yoğun insülin tedavisine gereksinim vardır (71). Konvansiyonel tedavi rejiminde akut enfeksiyonlar ve stres durumlarında doz ayarlaması güçtür (75).
Çoklu Doz İnsülin Tedavisi (Multipl enjection):
Günümüzde insülin tedavisinde endojen insülin salınımını en iyi taklit eden, günlük yaşamda en fazla esneklik sağlayan ve daha iyi glisemik kontrol elde edilen en seçkin tedavi yöntemidir. Çoklu doz insülin tedavisi, ana öğün öncesi günde 3 kez uygulanan hızlı veya kısa etkili insülin ve gece yatmadan önce uygulanan NPH ya da uzun etkili insülin tedavi rejimidir. Bu tedavi yönteminde diyabetli bireyler, yemek öncesi kan glikoz düzeyini ölçmekte ve alacakları besin miktarını belirleyerek insülin dozlarını ayarlayabilmektedirler (83).
Çoklu doz insülin tedavisi kullanmak ve metabolik hedeflere ulaşmak için, diyabetlinin kendi kendine kan glikoz düzeyini izlemesi oldukça önemlidir.
Çoklu doz insülin tedavisi, daha iyi bir metabolik kontrol sağlaması bakımından tercih edilmekle birlikte bu uygulamada aile ve çocuğun tedaviye uyumu çok önemlidir. Çoklu doz insülin tedavisi, konvansiyonel tedaviye göre daha yakından izlem gerektirir (1).
Diyabetli bir hastaya nutrisyonel destek verilirken hastanın yaşam biçimi, alışkanlıkları ve ailenin sosyoekonomik durumu dikkate alınmalıdır. Diyabetli çocukların sağlıklı büyüme ve gelişmeleri için özel bir diyet planı yoktur. Ayrıca diyabetik olmayan diğer sağlıklı çocukların ihtiyacından farklı bir diyet uygulanması gerekliliği ile ilgilide bir kanıt da yoktur. Her bir çocuğun diyeti çocuğun yaşına uygun olarak hazırlanmalı ve aldığı kaloriye uygun insülin tedavisi verilmelidir (35,39).
Diyabette diyetin amacı, çocuğun yaşı, cinsi, ağırlığı, beslenme alışkanlıkları ve aktivitesine uygun bir beslenme ile en uygun büyüme ve gelişmeyi sağlamak, ideal vücut ağırlığını korumak, obeziteden kaçınmak, hipo-hiperglisemi ve kronik komplikasyonları önlemek ve çocuğun yaşam kalitesini yükseltmektir.
Günlük kalorinin %55’i karbonhidrat, %30’u yağ, % 15’i protein olan bir diyet ideal olanıdır.
Alınan total enerjinin %60-70’inin karbonhidratlardan ve doymamış yağlardan alınması önerilmektedir (39). Alınan karbonhidratlarında %70’ nin kompleks karbonhidratlar olması ve basit şeker gibi karbonhidratlardan uzak durulması önerilmektedir (35,39). Yağlardan elde edilen kalorinin %10’ nunun doymamış yağ asitlerinden %10’ nundan azının ise doymuş yağ asitlerinden alınması ve diğer kısmının ise monosatüre yağlardan alınması önerilmektedir (35,65).
Günlük toplam kalorinin %20’si kahvaltıda, % 20’si öğle yemeğinde, % 30’u akşam yemeğinde ,%10’u 3 ara öğünde alınacak şekilde ayarlanması ideal olanıdır Ancak katı bir beslenmeplanından çok, çocuğun günlük aktivitelerine göre ayarlanarak esneklik getirilebilir (26).
EGZERSİZ
Egzersiz dokularda glikoz kullanımını artırır, pospbrandial kan glikoz düzeyini düşürür, insülin reseptörlerinin sayısını ve sensitivivitesini artırır, ketonemiyi önler, stres ve anksiyiteyi azaltarak çocuk ve adölesanın kendine güvenini ve yaşam kalitesini artırır.
Tip 1 DM’ lu çocuklarda egzersizin HbA1c’yi %1 oranında düşürerek, glisemik kontrolü sağladığı gibi, aşırı kilo alımından koruduğu, plazma kolesterolünde %10–15 oranında düşme ve HDL kolesterolünde artış sağlayarak, geç
kardiyovasküler hastalıkların gelişmesini önleyici bir faktör olarak rol oynadığı gösterilmiştir.
Bununla birlikte ara vermeden ve kalori alımına dikkat etmeden ağır sporlarla uğraşanlarda, hipogliseminin ciddi nöroglisemik komplikasyonlarının sık tekrarlaması halinde santral sinir sistemine kalıcı hasar verilebilir. Bazen de egzersizden sonra geç ortaya çıkan, uykuda gelen hipoglisemiler görülebilir. Planlı egzersiz öncesi insülin dozu % 10 azaltılmalıdır. Egzersiz sonrası, 12 saat boyunca kan glukoz düzeyi sıklıkla takip edilerek insülin dozları da ona göre ayarlanmalıdır (84).
Çok ciddi bir komplikasyon olmadıkça çocuğun egzersiz yapması engellenmemelidir (4,26,28).
EĞİTİM
Diyabet eğitiminin amacı; diyabetli bireyin tedavisinde etkin rol almasını
sağlamak; akut ve kronik komplikasyonları önlemek ve tedavi etmek için gerekli bilgi ve beceriyi kazandırmak, tedavi maliyetini azaltmak ve yaşam kalitesini arttırmaktır (85).
Diyabetli bireye ve onların bakımından sorumlu olan aile bireylerine, diyabetin bakımını ve yönetimini öğretmek tedavi planının bir parçasıdır. Diyabetlinin eğitimi; kendi kendine bakma gücünü kullanmasına yardım etmektir.
Her diyabetli birey, farklı kültürel, psikososyal, demografik özelliklere sahiptir. Bu nedenle hedeflenen bilgi ve beceriyi kazandıracak eğitim programı bireyin özellikleri ve öz-bakım gereksinimleri dikkate alınarak, bireye özgü düzenlenmelidir. Eğitim planı; her bireyin yaşına, diyabetinin evresine, olgunluk düzeyine, yaşam biçimine uygun ve ayrıca bireyin kültürüne duyarlı olmalı ve kişisel gereksinime uygun bir tempoda uygulanmalıdır (86).
Diyabet eğitimini planlamada dikkate alınması gereken en önemli özelliklerden birisi yaştır. Eğitimde çocukların yaşı, büyüme-gelişme ve zihinsel gelişim düzeyleri göz önünde bulundurulmalıdır. Küçük çocuklarda, görsel-işitsel araçların kullanılması eğitimin inandırıcı ve etkileyici olmasını sağlayabilir.
Yeni tanı almış Tip1 diyabet hastası taburcu edildikten sonra ilk ay haftada bir, sonraki üç ay ayda bir, daha sonra ise 3-6 ayda bir çağrılmalıdır. Diyabetli çocuğun uzun süreli klinik izleminde 3 aylık aralıklarla büyüme ve gelişme, beslenme, spor aktivitelerine katılımı ve psikolojik durumu değerlendirilir. 3-6 ay arayla hastanın tartı, boy ölçümü ve puberte değerlendirmesi yapılır.
DM’ lu hastanın metabolik kontrolünün sağlanmasında bireysel izlem önemlidir. Bireysel izlem; diyabetli bireyin glisemi, glikozüri, kanda/ idrarda keton ölçümleri yaparak diyabet bakımının sorumluluğunu almasıdır. Hastanın kendisi tarafından sık aralarla ve doğru bir şekilde yapılan ölçümler glisemik kontrolün değerlendirilmesi için en iyi yoldur (87,88,89).
DM bireyin bireysel izlemde kullanacağı yöntemler; Kan glikozu ölçümü, Glikozüri ölçümü, Keton ölçümü, Glukozillenmiş Hemoglobin (HbA1c).
Kan Glikozu Ölçümü:
ADA; Tip 1 diyabetli çocuklar için günde 4 kez veya daha sık aralıklarla kan glikozu ölçümünü önermektedir. Gün içinde multiple glisemi kontrolü ile insülin dozları uygun şekilde ayarlanarak oluşabilecek hipo/hiperglisemi tablosu engellenmiş olur.
Kan glikozu ölçümünün ne sıklıkla yapılacağı; insülin rejimine, çocuğun yaşına ve diyabetin stabilitesine göre ayarlanmalıdır. Oyun çocuğu ve okul öncesi dönemde çocuklar hipoglisemi epizodlarını tanımlayamayabilirler. Bu dönemde glisemi kontrolünün daha sık aralarla yapılması gerekir (71,84).
Genelde açlık kan şekerinin 80-120 mg/dl arası, postprandiyal kan şekerinin ise 150-180 mg/dl arasında tutulması istenir. Ancak 6 yaş altı çocuklarda hipoglisemiden kaçınmak için açlık kan şekerinin 100-140 mg/dl gibi daha yüksek sınırlarda tutulması önerilir.
Glikozüri Ölçümü:
İdrarda glikoz ölçümleri, kan ve idrardaki glikoz düzeyleri arasında zayıf bir korelasyon olduğundan glisemik kontrolün takibinde tavsiye edilmemektedir. İdrardaki glikoz seviyesi hipoglisemi ile ilgili hiçbir bilgi vermez (71).
Keton düzeyi kanda ve idrarda keton ölçümü ile belirlenir. Kan glikoz değeri 300 mg/dl’ nin üzerine çıktığı durumlarda, akut hastalıklar, enfeksiyon, stres durumları ve bulantı, kusma ve karın ağrısı gibi ketoasidoz tablosu semptomları olduğunda kanda/idrarda keton bakılmalıdır. İdrarda keton, keton stripleri ile bakılmaktadır. Son yıllarda geliştirilen glukometreler ile kan keton düzeyi ölçülebilmektedir (26).
Hipergliseminin yanı sıra ketonürinin varlığı şiddetli insülin eksikliğini gösterir ve ketoasidoz tablosuna gidişin önlenmesi için acil tedaviyi gerektirir. Kan glukozunun düşük olduğu durumlarda ketonürinin bulunması ise açlık halini gösterir ve bu durum hipoglisemiye karşı yanıtın sonucudur (71).
Glukolizillenmiş Hemoglobin (HbA1c):
Glukozun nonenzimatik yolla hemoglobine bağlanması ile oluşan glukozillenmiş hemoglobin (HbA1C) ölçümü ile yaklaşık 2-3 aylık bir dönemdeki ortalama glukoz düzeyi değerlendirilebilir.
Kanda ne kadar çok glikoz varsa o kadar çok glukozillenmiş hemoglobin oluşur. HbA1c testi ile eritrositlerin içinde hemoglobine bağlı olarak taşınan kan glikozunun yüzdesi ölçülür. HbA1c düzeyi, önceki 2–3 aylık glisemi düzeylerini yansıtır. HbA1c ölçümlerinin sonuçları, diyabet ekibine kan glikozunun uzun süreli değerlendirilmesinde ve tedavi planında değişiklik yapılmasında rehberlik eder (89).
HbA1c düzeyleri ölçüm yöntemlerine göre değişmekle birlikte sağlıklı bireylerde % 6’nın altındadır. Diyabetli bireylerde ise % 6,5–7,5 arası değerler iyi metabolik kontrolü, % 7,5–9,0 arası değerler orta metabolik kontrolü % 9,0’ nun üzerindeki değerler ise kötü metabolik kontrolü gösterir (Tablo 4) (3).
Tablo 4: HbA1c değerlerine göre metabolik kontrol sınıflandırılması. Metabolik kontrol sınıflandırılması HbA1c değerleri
İyi metabolik kontrol (optimal) % 6,5-%7,5 Orta metabolik kontrol (suboptimal) %7,5-%9,0 Kötü metabolik kontrol (non-optimal) %9,0
DİABETES MELLİTUS’UN KOMPLİKASYONLARI:
Komplikasyonlar akut, ara dönem (subakut), kronik komplikasyonlar olmak üzere başlıca üç gruba ayrılmaktadır
Diyabetin akut komplikasyonları ciddi olsalar da, hastaların morbidite ve mortalitesinden uzun dönemdeki mikro ve makrovasküler komplikasyonları sorumludur (4).
Akut metabolik komplikasyonlar:
A- Ketoasidoz koması B- Hipoglisemi C- insülin alerjisi D- Enfeksiyona eğilim E-Kilo kaybı ve kilo alımı * Ara dönem komplikasyonları
A-Lipodistrofi
B-Kısıtlı eklem hareketleri
C-Büyüme geriliği, pubertal gecikme ve mentrüal bozukluklar D-Katarakt
E-Kognitif fonksiyonlarda bozulma
Kronik komplikasyonlar:
A-Makrovasküler komplikasyonlar: B-Mikrovasküler komplikasyonlar:
- Serebrovasküler hastalıklar - Diyabetik nefropati - Kardiyovasküler hastalıklar - Diyabetik retinopati - Periferik damar hastalıkları - Diyabetik nöropati - Diyabetik ayak
Tip1 DM hastaları yaşamlarının devamı için insülin kullanmak zorundadırlar. İnsülin kullanımı yaygınlaşmadan önce, hastalar 50 yaşından önce ketoasidoz nedeniyle kaybediliyordu. İnsülin kullanımının glisemi kontrolünü sağlamasıyla birlikte yaşam süreleri uzamış ama kronik komplikasyonların görülme sıklığı artmıştır.
Komplikasyonların gelişmesinde öncelikle diyabetin süresi ve metabolik kontrol önemlidir (4).
Komplikasyon gelişimini etkileyen faktörler, kan basıncı, hormonal faktörler, çevresel faktörler ve genetik faktörlerdir.
DİYABETİK KETOASİDOZ
Hiperglisemi [kan şekeri>300 mg/dl], asidoz [pH<7.3], düşük bikarbonat, ketonemi ve ketonüri ketoasidoz tanısını koydurur.
DKA Tipleri:
1) Hafif DKA: Arteryel kan pH:7,35-7,25 arası veya venöz pH:7,30-7,20 arası 2) Orta DKA: Arteryel kan pH:7.24-7.15 arası veya venöz pH:7.19-7.10 arası 3) Ağır DKA: Arteryel kan pH:<7.15 veya venöz pH:<7.10
Diyabetik ketoasidoz (DKA), Tip 1 DM’ li çocukların hospitalize edilmesinin en sık sebebidir. 6 yaşın altındaki çocuklarda sık (%64) ve ağır seyreder. Çocukluk çağındaki diyabete bağlı ölümlerin başlıca etmenidir. Son yıllarda erken teşhis, tanı alan çocuklarda insülin tedavisindeki ilerlemeler ve ailelerin eğitimi nedeniyle DKA sıklığı azalmıştır (4.23).
Tip 1 DM’ lilerin % 5–14’ ü DKA ile başvurarak yeni tanı alır. Yapılan bir çalışmada DKA nedeni ila hastaneye başvurma insidansı 21,4/100000 olarak bulunmuştur. Cinsiyetler arasında belirgin bir fark bulunmasa da bu çalışmada özellikle adölesan kızlarda DKA sıklığı belirgin olarak fazla bulunmuştur (90).
İzlemde;
1. Hasta klinik olarak (tansiyon, nabız, şuur vb) yakın takip edilir.
2. Kan gikozu 300 mg dl nin altına ininceye kadar saatte bir, daha sonra 2-4 saatte birkan glikozu tayin edilir.
3. Kan gazı pH normale gelinceye kadar elektrolitler, üre ve kreatinin0-4-8-12. saatlerde bakılır. İdrarda keton ve glikoz 6 saatte bir değerlendirilir.
DKA, enfeksiyon ya da emosyonel düzensizlik nedeniyle, artan insülin ihtiyacı, insülinin yetersiz alımı veya tam kesilmesi sonucunda gelişmektedir. İnsülin eksikliği halinde, karşıt düzenleyici hormonlar olan büyüme hormonu, adrenalin ve glukagon miktarları artar. Birlikte hiperglisemi, lipoliz ve keton cisimleri oluşumu görülür. İnsülin eksikliği ve asidoz nedeniyle potasyum ve fosfat kaybı olur. Eritrosit 2,3-difosfogliserat düzeyinin düşmesiyle beyin oksijenlenmesi azalır, bilinç bulanıklığı artar. Aynı zamanda idrarla sodyum kaybı olur, aldosteron ve ADH artışı potasyum kaybını artırır (4,26,28).
DKA’ da klinik tablo insülin eksikliğinin şiddeti ve süresine bağlı olarak değişen metabolik bozukluğun derecesine bağlıdır. Hipovoleminin derecesine göre bulgular mukozalarda kuruluk, nabızda hızlanma, ortostatik hipotansiyon, turgorda azalma ve kapiller dolum zamanında uzama, extremitelerde soğukluk ve şok tablosuna kadar değişebilmektedir.
Asidozun solunum merkezini baskılaması nedeniyle solunum yavaş ve düzensiz bir hal alır ve kussmaul solunumu ortaya çıkar. Hastanın bilinci açık veya değişik derecelerde bulanık olabilir. Bilinç düzeyi genellikle serum osmolaritesindeki artış ile korelasyon göstermektedir.
Hiperglisemi, glikozüri, ketonemi, ketonüri, artmış anyon açığı ile birlikte metabolik asidoz, hipovolemiye bağlı kan üre azotunda artış, hiperlipidemi, hemokonsantrasyona bağlı olarak hematokritte artış ve stres hormonlarının etkisi ile lökositoz beklenen laboratuar bulgularıdır (4).
Tedavide amaç sıvı ve elektrolit bozukluğunun düzeltilmesi, insülin eksikliğinin giderilmesi ve altta yatan etkenlerin tespit edilerek ortadan kaldırılmasıdır. Bu hastalarda glikoz 300 mg/dl’ nin altına ininceye kadar saat başı, daha sonra 2–4 saat arayla plazma glikoz ölçümü tekrarlanır. Kan pH’ sı, elektrolitler, bikarbonat (gerekirse üre, kreatinin) ilk 12 saatte 4 saat arayla, idrarda keton ve glikoz 6 saatte bir değerlendirilmelidir (28).
Beyin ödemi diyabetik ketoasidozun en ölümcül olan ve en korkulan, nadir olarak DKA tablosundaki çocukların %0,2–1’ inde görülen komplikasyonudur. Tedavinin ilk 3–12 saatinde görülür. Çok hızlı, hipotonik ve fazla miktarda sıvı
verilerek ozmotik dengenin hızlı değiştirilmesi, fazla bikarbonat verilmesi ve glikoz düzeyi düşerken serum sodyum düzeyinin yükselmemesi beyin ödeminin başlıca nedenleridir. Baş ağrısı, davranış değişikliği, üriner inkontinansı, kan basıncında değişiklik, bradikardi, anizokori, pupilla refleksinin kaybı, papil ödemi başlıca bulgulardır. Tedavi edilmezse konvülziyon ve herniasyon gelişebilir. Bilgisayarlı tomografi ile beyin ödemi saptanabilir, ancak klinik bulgular destekliyorsa tedaviye başlamak için tomografi zorunlu değildir. Bulgular ortaya çıkmışsa intravenöz sıvının hızı azaltılmalıdır. Gerekirse hasta entübe edilir, mannitol 1g/kg intravenöz yolla uygulanır ve yoğun bakımda izlenir (4,26).
Hastanın kliniği stabilize edilip asidoz tablosu düzelinceye ve kusmaları düzelip oral beslenmeye geçebilecek duruma gelinceye kadar intravenöz sıvıya devam edilir. Kan şekeri 300 mg/dl altına inip asidoz düzelince subkutan insüline geçilir, ancak ilk subkutan insülin enjeksiyonundan 1 saat sonraya kadar intravenöz insüline devam edilir. Deri altı insülin uygulamasına öğünlerden 30 dakika önce 0,25 Ü/ kg dozda kristalize insülinle başlanır ve 6 saat aralarla tekrarlanır. Sık aralarla plazma glikozu kontrolü ile 1–2 gün süreyle kristalize insülinle tedaviye devam edilir, sonra ikili veya çoklu insülin uygulamasına geçilir (4,26).
HİPOGLİSEMİ
Hipoglisemi; plazma glukoz konsantrasyonunun 60 mg/dl’nin altına inmesi ve merkezi sinir sistemi bulgularının görülmesi olarak tanımlanmaktadır (91).
Hipoglisemide gelişen semptomlar nörojenik ( otonom sinir sisteminin direkt
olarak aktive olması sonucunda gelişen bulgular ) ve nöroglikopenik ( beyinde glukozun düşüklüğüne bağlı olarak gelişen bulgular ) bulgular olmak üzere gruplandırılmaktadır (91) Nöroglikopeni; düşünme bozukluğu, ruh hali değişikliği, irritabilite, baş dönmesi, başağrısı, yorgunluk, konfüzyon, daha sonra da konvülziyonlar ve koma ile kendini gösterir. Otonomik aktivasyon ile açlık hissi, solukluk, terleme, tremor, görme bulanıklığı, çarpıntı gibi hipoglisemi bulguları ortaya çıkar. Nöroglikopeni otonomik aktivasyondan önce gelişebildiğinden hipoglisemi fark edilmeyebilir (4,26,28).
Otonomik aktivasyon için kan şekeri eşiği deneysel olarak çocuklarda erişkinlerden daha yüksek olduğu gösterilmiştir. Otonomik aktivasyon eşiği, kötü kontrol, yüksek kan şekeri düzeyi, geçirilmiş hipoglisemi öyküsü ve uyku ile düşebilir. Diyabetli hastalarda, plazma glikozu sağlıklı kişiler için belirtilen hipoglisemi sınırlarına inmeden (<60 mg/dl) belirti verebilir.
Hipoglisemi üç guruba ayrılır;
Hafif Hipoglisemi: Bu durumdaki çocuklar hipoglisemi bulgularını
kendileri tanıyıp tedavi edebilirler. 5 yaşın altındaki çocuklar hipoglisemi bulgularını bilemeyeceklerinden bu yaş grubunda hafif hipoglisemi tanımı kullanılmaz.
Orta Derece Hipoglisemi: Diyabetli çocuk ancak bir başkasının
yardımıyla hipoglisemisini tedavi edebilir. Bu durumdaki hipoglisemi, ağızdan tedavi edilebilir.
Ağır Hipoglisemi: Hipoglisemi geliştiğinde çocuk veya adölesanda
bilinç kaybı vardır. Aşırı yönelim bozukluğu nedeniyle ağızdan glukoz alamaz ve tek tedavi şekli glukagon enjeksiyonu veya İV glukoz verilmesidir (91).
Klinik tablo değişken olabilir. Hafif hipoglisemi geçici baş dönmesi ya da bilinç bulanıklığından periferik sinirlerde uyarı belirtilerine hatta geçici hemiplejiye kadar değişen tipik geri dönüşümlü nörolojik disfonksiyon bulgularına neden olabilir. Konvülziyona neden olan ciddi uzamış hipoglisemi özellikle küçük çocuklarda kalıcı santral sinir sistemi bozukluğuna yol açabilir.
Hipoglisemi insülin, yemek, egzersiz arasındaki uyumsuzluğun sonucu olarak gelişir. Öğünleri kaçırmak ya da düzensiz yemek, fiziksel aktivitede değişiklik, insülin dozunda hatalar ve emiliminde değişiklikler gibi rutinin düzensizleşmesi, 6 yaşından küçük olması, HbA1c düşüklüğü, endojen insülinin tam eksikliği, önceden geçirilmiş hipoglisemi atakları, hipogliseminin farkında olmama, glukagon ve katekolamin ile ilgili kontrregulatuar bozukluklar, adölesanın alkol alması hipoglisemiye neden olan diğer faktörlerdir (4,23).
İlk kez 1938’de Somogyi ve Kirstein tarafından tanımlanan bu fenomen, özetle posthipoglisemik hiperglisemidir (92). Gece yarısı meydana gelen hipoglisemiyi kompanse etmek amacıyla insülin karşıtı düzenleyici hormonlar salgılanır ve karaciğerde glikogenezis artar. Böylece dolaşıma fazla glukoz verilerek sabah hiperglisemisi ortaya çıkar. Nedeni akşam yapılan insülin dozunun fazlalığıdır. Gece ve sabah erken saatlerde terleme, gece korkuları, baş ağrıları şeklinde ortaya çıkan hipoglisemi ve bunu izleyen hiperglisemi, glikozüri ve ketonüri ile tanınmaktadır.
Kahvaltı öncesi kan şekerinin düşük olması, geceleri oluşan bilinç bulanıklığı, kâbus, konvülziyon, ya da uykudan uyandığında şaşkınlık, uyku hali, duygusal durumda değişiklik veya baş ağrılarının olması ve sabah açlık plazma glikozunun düşük olduğu durumlarda (sıklıkla < 80 mg/dl) nokturnal hipoglisemiden şüphelenilmelidir.
Kuşkulu vakalarda saat 03.00–04.00 civarı alınan kanda glukoz < 60 mg/dl’ nin altında ise akşamki orta etkili insülin dozunu %10–15 oranında azaltmak gerekir. Saat 22.00’deki kan glukoz düzeyinin 100–120 mg/dl (okul öncesi dönemde 140 mg/dl) altına düşmemesine dikkat edilmelidir Akşam yatmadan önce çocuğa kompleks karbonhidrat içeren bir ara öğün verilmesi kan şekeri düzeyini yüksek tutarak hipoglisemiyi önlemeyi sağlayabilir (4,26,28).
DAWN (ŞAFAK) FENOMENİ
Sabah erken saatlerde görülen anlamlı hiperglisemidir. Gece büyüme hormonu sekresyonunun artmasına bağlı olarak sabah kan glukozu yüksekliği meydana gelir. Dawn etkisiyle sabah kan glukozu değeri 25-35 mg/dl kadar artacaktır. Somogy etkisinden farklı olarak hiperglisemi öncesi hipoglisemi görülmez. Eğer gece (03.00 ) ölçülen kan glukozu normal, sabah yüksekse bu durumun dawn fenomenine bağlı olduğu düşünülmelidir. Büyüme dönemindeki çocuklarda ve özellikle büyüme pikinin meydana geldiği ergenliğin son döneminde bu durum sık yaşanır. Tedavi, orta etkili insülinin akşam