T.C.
BALIKESİR ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
KİMYA ANABİLİM DALI
ÇOK DİŞLİ SCHİFF BAZLARININ SENTEZİ VE BAZI GEÇİŞ METALLERİ ( M=Ni2+, Zn2+, Cd2+ ve Cu2+) İLE YAPTIĞI KOORDİNASYON
BİLEŞİKLERİNİN HAZIRLANMASI, YAPILARININ AYDINLATILMASI VE TERMAL DAVRANIŞLARININ İNCELENMESİ
DOKTORA TEZİ
Alper YARDAN
qoK Di$Li SCI{iFF
BAZLARJNIN
SENTEZi
VE BAZI GECiS
METALLERi
1-M:Ni2*,
zn2*,,cd2*
vecu2) iLE yApTtCI xoonoiNisvoN
BILE$IKLERININ HAZIRLAI{MASI, YAPILARININ AYDII\LATILMASI
VE TERMAL DAVRANI$LARININ iNCELEI{MESI
T.C.
BALIKESiR UNiVERSiTESi
FEN
BiLiMLEni rNsrirtisU
rln rya aN,q,sir,ivr
n,rlr
DOKTORATEZi
AIpeTYARDAN
Tez Damgmanr:
Dog. Dr. Raif KURTARAN
Srnav Tarihi: 23.07.2010
Jiiri iiyeleri: Dog. Dr. Raif KURTARAN (BAU-Danrgman)
EnstitiiYiinetimKurulunun
tarih...,...,.sayrhoturumunun...
nolu kararr ile
Mezun olmustur.
Yrd. Doe.
Dr. MecitAKSU (BzKjL\q_:_
ii ÖZET
ÇOK DİŞLİ SCHİFF BAZLARININ SENTEZİ VE BAZI GEÇİŞ METALLERİ ( M=Ni2+, Zn2+, Cd2+ ve Cu2+) İLE YAPTIĞI KOORDİNASYON
BİLEŞİKLERİNİN HAZIRLANMASI, YAPILARININ AYDINLATILMASI VE TERMAL DAVRANIŞLARININ İNCELENMESİ
Alper YARDAN
Balıkesir Üniversitesi, Fen Bilimleri Enstitüsü Kimya Anabilim Dalı
(Doktora Tezi/Tez Danışmanı: Doç. Dr. Raif KURTARAN) Balıkesir, 2010
Bu çalışmada, ONONO tipi beş dişli LA, ONNO tipi 4 dişli LB ve LC Schiff
bazı ligandlarının bir, iki ve üç çekirdekli kompleksleri ile ONO tipi üç dişli LD ve
LE Schiff bazı ligandları sentezlendi ve yapıları aydınlatıldı. Çalışmada yer alan tüm
ligandların yapısı UV-Vis spektroskopisi, IR spektroskopisi, termal analiz, 1H-NMR ve 13C-NMR ile karakterize edildi. Bununla beraber tek kristali elde edilebilen LD ve
LE ligandlarının yapısı tek kristal X-ışınları tekniğiyle aydınlatıldı.
Tez çalışması süresince ONONO tipi LA ligandının bakır (II) ve nikel (II)
kompleksleri sentezlendi ve karakterize edildi. Tek kristali elde edilebilen LA
ligandının bakır (II) kompleksinin tek kristal X-ışını tekniğiyle yapısı aydınlatıldı. Komplekste bakır metali ligand ile altılı koordinasyon oluşturmuştur.
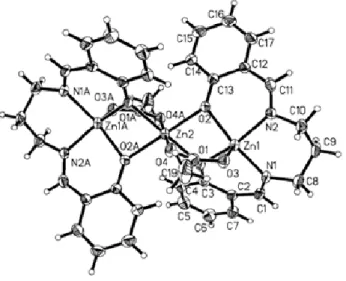
Çalışmada ONNO tipi LB ligandının iki çekirdekli çinko-nikel ve üç
çekirdekli nikel-kadmiyum kompleksleri sentezlendi ve tek kristal X-ışını tekniğiyle yapıları aydınlatıldı. Çinko-nikel kompleksinde, çinko iyonlarının altılı, nikel iyonlarının ise dörtlü koordinasyon yaptığı gözlenmiştir. Nikel-kadmiyum kompleksinde ise nikel (II) ve kadmiyum (II) iyonlarının ikisi de altılı koordinasyon yapmıştır.
LC ligandının bir çekirdekli nikel (II) kompleksi tek kristal olarak
sentezlenmiş ve tek kristal X-ışını tekniğiyle yapısı aydınlatılmıştır. Komplekste nikel metalinin dörtlü koordinasyon yaptığı gözlenmiştir.
ANAHTAR SÖZCÜKLER: Schiff bazı, ONONO, ONNO, ONO, metal kompleksleri, termal analiz, tek kristal X-ışınları tekniği.
iii ABSTRACT
SYNTHESIS POLYDENTATE SCHIFF BASES AND PREPARATION COORDINATION COMPOUNDS WITH SOME TRANSITION METALS (M=Ni2+, Zn2+, Cd2+ ve Cu2+), CHARACTERIZATION OF THEIR STRUCTURES
AND INVESTIGATION OF THEIR THERMAL BEHAVIORS
Alper YARDAN
Balıkesir University, Institute of Sciences Department of Chemistry
(Ph.D. Thesis/Supervisor: Assoc. Prof. Dr. Raif KURTARAN)
Balıkesir-Turkey, 2010
In this study, mono, di and trinuclear complexes of ONONO type pentadentate LA, ONNO type tetradentate LB and LC Schiff base ligands and ONO type tridentate Schiff base ligands LD and LE were synthesized and characterized. All ligands obtained in the study were characterized by UV-Vis spectroscopy, IR spectroscopy, thermal analysis, 1H-NMR and 13C-NMR. For all that, LD and LE ligands were able to be obtained as single crystals and their structures were determined by single crystal X-ray technique.
In thesis study duration, copper (II) and nickel (II) complexes of ONONO type LA ligand were synthesized and characterized. Copper (II) complex of LA ligand was able to be obtained as single crystal and they structure were determined by single crystal X-ray technique. In the complex, copper ions with ligand are six-coordinated.
In study, dinuclear zinc-nickel and trinuclear nickel-cadmium complexes of ONNO type LB ligand were synthesized and their structures determined by single crystal X-ray technique. In zinc-nickel complex, zinc (II) ions are six-coordinated but nickel (II) ions are four-coordinated. In nickel-cadmium complex, both of nickel (II) and cadmium (II) ions are six-coordinated.
Mononuclear nickel (II) complex of LC ligand was able to be obtained as single crystal and they structure determined by single crystal X-ray technique. In this complex, nickel (II) ions are four-coordinated.
KEYWORDS: Schiff base, ONONO, ONNO, ONO type, metal complexes, thermal analysis, single crystal X-ray technique
iv
İÇİNDEKİLER Sayfa
ÖZET, ANAHTAR KELİMELER ii
ABSTRACT, KEYWORDS iii
İÇİNDEKİLER iv
SEMBOL LİSTESİ viii
ŞEKİL LİSTESİ ix
TABLO LİSTESİ xv
ÖNSÖZ xvi
1 GİRİŞ 1
1.1 Koordinasyon Bileşikleri ve Genel Kavramlar 1
1.2 Koordinasyon Bileşiklerinin Kararlılığı 3
1.3 Schiff Bazları 5
1.3.1 Schiff Bazlarının Oluşum Mekanizması 7
1.3.2 Schiff Bazlarının Sentez Yöntemleri 9
1.3.3 Schiff Bazlarının Metal Kompleksleri 12
1.3.4 Schiff Bazı Ligand ve Komplekslerinin Sınıflandırılması 13
1.3.4.1 ON Tipi Schiff Bazları 13
1.3.4.2 ONO Tipi Schiff Bazları 14
1.3.4.3 ONN Tipi Schiff Bazları 14
1.3.4.4 ONNO Tipi Schiff Bazları 15
1.3.4.5 SNNS Tipi Schiff Bazları 15
1.3.4.6 NNN Tipi Schiff Bazları 16
1.3.4.7 NNNN Tipi Schiff Bazları 16
v
1.3.5 Schiff Bazı Komplekslerinde µ-köprüleri 17
1.3.6 Schiff Bazlarının İnfrared Spektrumları 19
1.3.7 Schiff Bazlarının NMR spektrumları 21
1.3.8 Schiff Bazı Komplekslerinin Kullanım Alanları 22
1.4 Literatürdeki Bazı Çalışmalar 23
1.5 Çalışmanın kapsamı 35 2 MATERYAL VE YÖNTEM 36 2.1 Kullanılan Cihazlar 36 2.2 Kullanılan Kimyasallar 37 2.3 Ligandların Sentezi 37 2.3.1 N,N’-bis(4-metoksi-salisiliden)-2-hidroksi-1,3-diaminopropan (LA) Ligandının Sentezi 37 2.3.2 N,N’-bis(2-hidroksi-salisiliden)-1,3-diaminopropan (LB) Ligandının Sentezi 37 2.3.3 N,N’-bis(5-metoksi-salisiliden)-2,2-dimetil-1,3-diaminopropan (LA Ligandının Sentezi 38
2.3.4 2’-(2-hidroksi-aniliden)-4-hidroksi-pentan (LD) Ligandının Sentezi 38
2.3.5 4’(2-hidroksi-5-klor-aniliden)-2-hidroksi-pentan (LE)
Ligandının Sentezi 39
2.4 Komplekslerin Sentezi 40
2.4.1 CuLA Kompleksinin Hazırlanması 40
2.4.2 NiLA Kompleksinin Hazırlanması 40
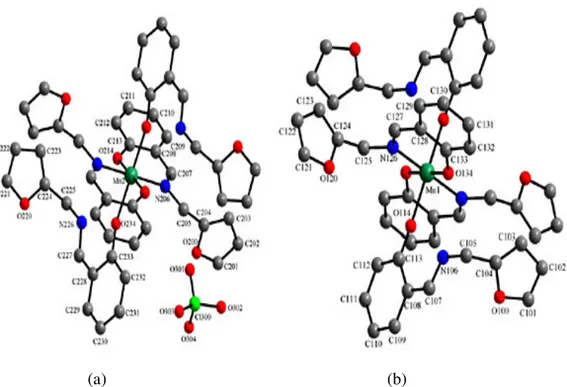
2.4.3 [ZnLBNiCl2(DMF)2] Kompleksinin Hazırlanması 41
2.4.4 [(NiLB)2(H2O)2(NCS)2Cd(DMF)2]Kompleksinin Hazırlanması 41
2.4.5 NiLC Kompleksinin Hazırlanması 42
3 BULGULAR 43
vi
3.2 1H-NMR ve 13C-NMR Spektrumları 49
3.3 Termal Analiz Eğrileri 68
3.3.1 LA Ligandının TG ve DTA Eğrileri 68
3.3.2 CuLA Kompleksinin TG ve DTA Eğrileri 69
3.3.3 NiLA Kompleksinin TG ve DTA Eğrileri 70
3.3.4 LB Ligandının TG ve DTA Eğrileri 71
3.3.5 [ZnLBNiCl2(DMF)2] Kompleksinin TG ve DTA Eğrileri 72
3.3.6 [(NiLB)2(H2O)2(NCS)2Cd(DMF)2]Kompleksinin TG ve DTA Eğrileri 73
3.3.7 LC Ligandının TG ve DTA Eğrileri 74
3.3.8 NiLC Kompleksinin TG ve DTA Eğrileri 75
3.3.9 LD Ligandının TG ve DTA Eğrileri 76
3.3.10 LE Ligandının TG ve DTA Eğrileri 77
3.4 UV-Vis Spektrumları 78
3.5 Tek Kristal X-Işınları Çalışmaları 83
3.5.1 CuLA Kompleksinin Tek Kristal X-Işınları Çalışmaları 83
3.5.2 [ZnLBNiCl2(DMF)2] Kompleksinin Tek Kristal X-Işınları Çalışmaları 87
3.5.3 [(NiLB)2(H2O)2(NCS)2Cd(DMF)2]Kompleksinin Tek Kristal X-Işınları
Çalışmaları 90
3.5.4 NiLC Kompleksinin Tek Kristal X-Işınları Çalışmaları 95
3.5.5 LD Ligandının X-Işınları Çalışmaları 98
3.5.6 LE Ligandının X-Işınları Çalışmaları 101
4 TARTIŞMA VE SONUÇ 104
4.1 İnfrared (IR ) Spektrumları 104
4.1.1 LA Ligandı ve Komplekslerinin İnfrared (IR) Spektrumları 104
4.1.2 LB Ligandı ve Komplekslerinin İnfrared (IR) Spektrumları 105
4.1.3 LC Ligandı ve Komplekslerinin İnfrared (IR ) Spektrumları 106
4.1.4 LD ve LE Ligandlarının (IR) Spektrumları 106
4.2 NMR Spektrumları 107
4.2.1 LA Ligandının NMR Spektrumları 107
4.2.2 CuLA Kompleksinin NMR Spektrumları 108
vii
4.2.4 LB Ligandının NMR Spektrumları 109
4.2.5 [ZnLBNiCl2(DMF)2] Kompleksinin NMR Spektrumları 109
4.2.6 [(NiLB)2(H2O)2(NCS)2Cd(DMF)2] Kompleksinin NMR Spektrumları 110
4.2.7 LC Ligandının NMR Spektrumları 110
4.2.8 NiLC Kompleksinin NMR Spektrumları 111
4.2.9 LD Ligandının NMR Spektrumları 111
4.2.10 LE Ligandının NMR Spektrumları 112
4.3 Termal Analiz Eğrileri 113
4.3.1 LA Ligandı ve Komplekslerinin Termal Analiz Eğrileri 113
4.3.2 LB Ligandı ve Komplekslerinin Termal Analiz Eğrileri 114
4.3.3 LC Ligandı ve Komplekslerinin Termal Analiz Eğrileri 115
4.3.4 LD ve LE Ligandlarının Termal Analiz Eğrileri 115
4.4 UV-Visible Sonuçları 116
4.5 X-ışınları Sonuçları 117
4.5.1 CuLA Kompleksinin Kristal Yapısı 117
4.5.2 [ZnLBNiCl2(DMF)2] Kompleksinin Kristal Yapısı 118
4.5.3 [(NiLB)2(H2O)2(NCS)2Cd(DMF)2] Kompleksinin Kristal Yapısı 118
4.5.4 NiLC Kompleksinin Kristal Yapısı 119
4.5.5 LD Ligandının Kristal Yapısı 120
4.5.6 LE Ligandının Kristal Yapısı 120
4.6 Sonuçlar 120
viii SEMBOL LİSTESİ LA N,N’-bis(2-hidroksi-4-metoksi-salisiliden)-2-hidroksi-1,3-diaminopropan LB N,N’-bis(2-hidroksi-salisiliden)-1,3-diaminopropan LC N,N’-bis(2-hidroksi-5-metoksi-salisiliden)-2,2-dimetil-1,3-diaminopropan LD 4’(2-hidroksi-aniliden)-2-hidroksi-pentan LE 4’(2-hidroksi-5-klor-aniliden)-2-hidroksi-pentan XRD X-ışını kırınımı
UV-Vis Ultraviole-görünür bölge
IR İnfrared
DTA Diferansiyel termal analiz TG Termogravimetri
NMR Nükleer manyetik rezonans
A Absorpsiyon
ε Molar absorptivite katsayısı DMF N,N-dimetilformamid DMSO Dimetil sülfoksit EtOH Etanol
MeOH Metanol
λ Dalga boyu
ix
ŞEKİL LİSTESİ
Şekil No. Şekil Adı Sayfa
Şekil 1.1 Bir kompleks bileşiğin oluşum reaksiyonu 2 Şekil 1.2 (a) Aldimin ve (b) Ketimin oluşum reaksiyonları 5
Şekil 1.3 İmin oluşum mekanizması 7
Şekil 1.4 Asidik ortamda elektrofilik gücün artışı, nükleofilik
gücün azalışı 8
Şekil 1.5 Bazik ortamda elektrofilik gücün azalışı, nükleofilik
gücün artışı 8
Şekil 1.6 Schiff bazlarının genel sentez reaksiyonu 9
Şekil 1.7 Diimin eldesi 9
Şekil 1.8 Hidrazon eldesi 10
Şekil 1.9 Azin eldesi 10
Şekil 1.10 (a) ve (b) Semikarbazon eldesi 10
Şekil 1.11 Semikarbazonların oluşum mekanizması 11
Şekil 1.12 α-amino asitlerin aldehitlerle reaksiyonu 11
Şekil 1.13 Hidroksilaminden Schiff bazı eldesi 12
Şekil 1.14 Asetonun anilin ile reaksiyonu 12
Şekil 1.15 ON tipi Schiff bazı 13
Şekil 1.16 ONO tipi Schiff bazı 14
Şekil 1.17 ONN tipi Schiff bazı 14
Şekil 1.18 ONNO tipi Schiff bazları 15
Şekil 1.19 SNNS tipi Schiff bazı 15
x
Şekil 1.21 NNNN tipi Schiff bazı 16
Şekil 1.22 Kompartıman tipi Schiff bazları 17
Şekil 1.23 Tiyosiyanat iyonunun (a) kükürt (b) azot üzerinden
koordinasyona katılması 18
Şekil 1.24 Tiyosiyanat iyonunun köprü olarak metal iyonuna
bağlanması (a)
µ
1,1-SCN (b)µ
1,1-NCS (c)µ
1,3-SCN 19Şekil 1.25 apacaH3 ligandı 23
Şekil 1.26 [Ni2(apaca)(OAc)] kompleksinin %50 olasılıkla çizilmiş
ORTEP diyagramı 23
Şekil 1.27 (a) pfpd ligandı (b) [Co(pfpd)(NCS)2] kompleksinin
%40 olasılıkla çizilmiş ORTEP diyagramı 24 Şekil 1.28 [Cu2(µ1,1-NCO)2(NCO)2(dpyam)2] kompleksinin
%50 olasılıkla çizilen ORTEP diyagramı 25
Şekil 1.29 [Me2Sn(OC6H3ClCH=NC5H3NO)] kompleksinin
%50 olasılıkla çizilmiş ORTEP diyagramı 25 Şekil 1.30 [Me2Sn(OC6H3ClCH=NC5H3NO)] kompleksinin C ekseni
boyunca paketlenme diyagramı 26
Şekil 1.31 [CuLCl]2 kompleksinin %30 olasılıkla çizilmiş
ORTEP diyagramı 27
Şekil 1.32 [CuLCl]2 kompleksinin muhtemel kare piramit (SP)
ve üçgen çift piramit (TBP) koordinasyonları 27 Şekil 1.33 [MnL(H2O)2](ClO4) kompleksinin %50 olasılıkla
çizilmiş ORTEP diyagramı 28
Şekil 1.34 [MnL(H2O)2](ClO4) dimerik kompleksi ve komplekslerin
perklorat anyonuyla paketlenmesini sağlayan hidrojen
bağlarını gösteren diyagram 28
Şekil 1.35 NiL kompleksinin % 30 olasılıkla ORTEP Diyagramı 29 Şekil 1.36 (1) nolu kompleksin molekül yapısı. (a) ve (b) birbirinden
xi
Şekil 1.37 (2) numaralı kompleksin molekül yapısı 30 Şekil 1.38 N,N´-bis (salisilaldehit)-1,3-diaminopropan (Salpr) ligandı
ve Co(Salpr) kompleksinin molekül yapıları 31 Şekil 1.39 FeL kompleksine ait kristal yapının %50 olasılıkla gösterimi 32 Şekil 1.40 FeL kompleksinin olası O2 koordinasyonları 32
Şekil 1.41 ZnL kompleksinin %30 olasılıkla ORTEP diyagramı 33 Şekil 1.42 ZnL kompleksinin paketlenme diyagramı 34 Şekil 1.43 Co3(L)2 kompleksinin oluşum reaksiyonu 34
Şekil 1.44 Co3(L)2 kompleksinin kristal yapısı 35
Şekil 2.1 LA Ligandının sentezi 37
Şekil 2.2 LB Ligandının sentezi 38
Şekil 2.3 LC Ligandının sentezi 38
Şekil 2.4 LD Ligandının sentezi 39
Şekil 2.5 LE Ligandının sentezi 39
Şekil 2.6 CuLA kompleksinin hazırlanması 40
Şekil 2.7 NiLA kompleksinin hazırlanması 40
Şekil 2.8 [ZnLBNiCl2(DMF)2] kompleksinin hazırlanması 41
Şekil 2.9 [(NiLB)2(H2O)2(NCS)2Cd(DMF)2] kompleksinin hazırlanması 41
Şekil 2.10 NiLC kompleksinin hazırlanması 42
Şekil 3.1 (a) LA Ligandı (b) CuLA kompleksinin IR spektrumları 43
Şekil 3.2 (a) LA Ligandı (b) NiLA kompleksinin IR spektrumları 44
Şekil 3.3 LB ligandı ve [(NiLB)2(H2O)2(NCS)2Cd(DMF)2]kompleksinin
IR spektrumları 45
Şekil 3.4 (a) LB ligandı (b) [ZnLBNiCl2(DMF)2] kompleksinin
IR spektrumları 46
Şekil 3.5 (a) LC ligandı ve (b) NiLC kompleksinin IR spektrumları 47
Şekil 3.6 LD ve LE ligandına ait IR spektrumları 48
Şekil 3.7 LA ligandının DMSO içinde 300 K ve 400 MHz’de
1H-NMR spektrumu 49
Şekil 3.8 LA ligandının DMSO içinde 300 K ve 400 MHz’de
13C-NMR spektrumu 50
Şekil 3.9 CuLA kompleksinin DMSO içinde 300 K ve
xii
Şekil 3.10 NiLA kompleksinin DMSO içinde 300 K ve
400 MHz’de 1H-NMR spektrumu 52
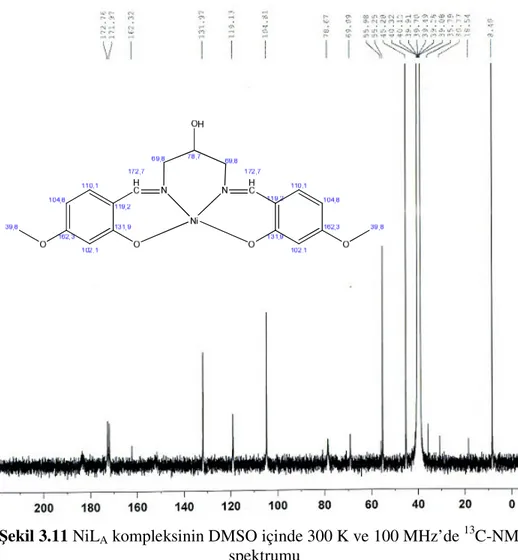
Şekil 3.11 NiLA kompleksinin DMSO içinde 300 K ve
400 MHz’de 13C-NMR spektrumu 53
Şekil 3.12 LB ligandının DMSO içinde 300 K ve 400 MHz’de 1H-NMR
spektrumu 54
Şekil 3.13 LB ligandının DMSO içinde 300 K ve 400 MHz’de
13C-NMR spektrumu 55
Şekil 3.14 [ZnLBNiCl2(DMF)2]kompleksinin DMSO içinde
300 K ve 400 MHz’de 1H-NMR spektrumu 56
Şekil 3.15 [ZnLBNiCl2(DMF)2]kompleksinin DMSO içinde
300 K ve 400 MHz’de 13C-NMR spektrumu 57 Şekil 3.16 [(NiLB)2(H2O)2(NCS)2Cd(DMF)2] kompleksinin DMSO
içinde 300 K ve 400 MHz’de 1H-NMR spektrumu 58 Şekil 3.17 [(NiLB)2(H2O)2(NCS)2Cd(DMF)2]kompleksinin
13C-NMR spektrumu 59
Şekil 3.18 LC ligandının DMSO içinde 300 K ve 400 MHz’de
1H-NMR spektrumu 60
Şekil 3.19 LC ligandının DMSO içinde 300 K ve 400 MHz’de
13C-NMR spektrumu 61
Şekil 3.20 NiLC kompleksinin DMSO içinde 300 K ve 400 MHz’de
1H-NMR spektrumu 62
Şekil 3.21 NiLC kompleksinin DMSO içinde 300 K ve 400 MHz’de
13C-NMR spektrumu 63
Şekil 3.22 LD ligandının DMSO içinde 300 K ve 400 MHz’de
1H-NMR spektrumu 64
Şekil 3.23 LD ligandının DMSO içinde 300 K ve 400 MHz’de
13C-NMR spektrumu 65
Şekil 3.24 LE ligandının DMSO içinde 300 K ve 400 MHz’de
1H-NMR spektrumu 66
Şekil 3.25 LE ligandının DMSO içinde 300 K ve 400 MHz’de
13C-NMR spektrumu 67
Şekil 3.26 a) LA ligandının yapısı (b) LA ligandının TG ve DTA eğrileri 68
Şekil 3.27 (a) CuLA kompleksinin yapısı (b) CuLA kompleksinin
xiii
Şekil 3.28 (a) NiLA kompleksinin yapısı (b) NiLA kompleksinin
TG ve DTA eğrileri 70
Şekil 3.29 (a) LB ligandının yapısı (b) LB ligandının TG ve DTA eğrileri 71
Şekil 3.30 (a) [ZnLBNiCl2(DMF)2]kompleksinin yapısı
(b) [ZnLBNiCl2(DMF)2]kompleksinin TG ve DTA eğrileri 72
Şekil 3.31 (a) [(NiLB)2(H2O)2(NCS)2Cd(DMF)2]kompleksinin yapısı
(b) [(NiLB)2(H2O)2(NCS)2Cd(DMF)2]kompleksinin TG ve DTA
eğrileri 73
Şekil 3.32 (a) LC ligandının yapısı (b) LC ligandının TG ve DTA eğrileri 74
Şekil 3.33 (a) NiLC kompleksinin yapısı (b) NiLC kompleksinin
TG ve DTA eğrileri 75
Şekil 3.34 (a) LD ligandının yapısı (b) LD Ligandının TG ve DTA eğrileri 76
Şekil 3.35 (a) LE ligandının yapısı (b) LE Ligandının TG ve DTA eğrileri 77
Şekil 3.36 LA ligandının absorptivite-konsantrasyon eğrisi ( λ=240 nm) 79
Şekil 3.37 CuLA kompleksinin absorptivite-konsantrasyon eğrisi
( λ=289 nm) 79
Şekil 3.38 LB ligandının absorptivite-konsantrasyon eğrisi ( λ=238 nm) 80
Şekil 3.39 LC ligandının absorptivite-konsantrasyon eğrisi ( λ=250 nm) 80
Şekil 3.40 NiLC kompleksinin absorptivite-konsantrasyon eğrisi
( λ=277 nm) 81
Şekil 3.41 LD ligandının absorptivite-konsantrasyon eğrisi ( λ=297 nm) 81
Şekil 3.42 LE ligandının absorptivite-konsantrasyon eğrisi ( λ=240 nm) 82
Şekil 3.43 CuLA kompleksinin kristal yapısı 83
Şekil 3.44 CuLA kompleksinin birim hücrede c ekseni boyunca görünümü 84
Şekil 3.45 [ZnLBNiCl2(DMF)2] kompleksinin ORTEP çizimi 87
Şekil 3.46 [ZnLBNiCl2(DMF)2]kompleksinin birim hücrede
c ekseni boyunca paketlenme diyagramı 87
Şekil 3.47 [(NiLB)2(H2O)2(NCS)2Cd(DMF)2]kompleksinin
kristal yapısı 90
Şekil 3.48 [(NiLB)2(H2O)2(NCS)2Cd(DMF)2] kompleksinin a ekseni
xiv
Şekil 3.49 NiLC kompleksinin kristal yapısı 95
Şekil 3.50 NiLC kompleksinin b ekseni boyunca paketlenme diyagramı 95
Şekil 3.51 LD ligandının kristal yapısı 98
Şekil 3.52 LD ligandının birim hücrede, c ekseni boyunca
paketlenme diyagramı 98
Şekil 3.53 LE ligandının kristal yapısı 101
Şekil 3.54 LE ligandının birim hücrede, c ekseni boyunca paketlenme
xv TABLO LİSTESİ
Tablo No. Tablo Adı Sayfa
Tablo 1.1 Bazı aromatik Schiff bazlarının C=N grubuna ait titreşim bantları 20 Tablo 3.1 Ligand ve komplekslere ait UV-Vis. değerleri 78 Tablo 3.2 CuLA kompleksine ait tek kristal X-ışını sonuçları 85
Tablo 3.3 CuLA kompleksine ait seçilmiş bağ uzunlukları 86
Tablo 3.4 CuLA kompleksine ait seçilmiş bağ açıları 86
Tablo 3.5 [ZnLBNiCl2(DMF)2]kompleksine ait tek kristal X-ışını sonuçları 88
Tablo 3.6 [ZnLBNiCl2(DMF)2] kompleksine ait seçilmiş bağ uzunlukları 89
Tablo 3.7 [ZnLBNiCl2(DMF)2] kompleksine ait seçilmiş bağ açıları 89
Tablo 3.8 [(NiLB)2(H2O)2(NCS)2Cd(DMF)2] kompleksine ait
tek kristal X-ışını sonuçları 92
Tablo 3.9 [(NiLB)2(H2O)2(NCS)2Cd(DMF)2]kompleksine ait seçilmiş bağ
uzunlukları 93
Tablo 3.10 [(NiLB)2(H2O)2(NCS)2Cd(DMF)2]kompleksine ait seçilmiş
bağ açıları 94
Tablo 3.11 NiLC kompleksine ait tek kristal X-ışını sonuçları 96
Tablo 3.12 NiLC kompleksine ait seçilmiş bağ uzunlukları 97
Tablo 3.13 NiLC kompleksine ait seçilmiş bağ açıları 97
Tablo 3.14 LD ligandına ait tek kristal X-ışını sonuçları 99
Tablo 3.15 LD ligandına ait seçilmiş bağ uzunlukları 100
Tablo 3.16 LD ligandına ait seçilmiş bağ açıları 100
Tablo 3.17 LE ligandına ait tek kristal X-ışını sonuçları 102
Tablo 3.18 LE ligandına ait seçilmiş bağ uzunlukları 103
Tablo 3.19 LE ligandına ait seçilmiş bağ açıları 103
Tablo 4.1 LA ligandı ve komplekslerinin IR spektrum değerleri 104
xvi ÖNSÖZ
Tez konumun belirlenmesinden başlayarak, tezimin her aşamasında yardımlarını esirgemeyen değerli hocam Doç Dr. Raif KURTARAN’a sonsuz teşekkürlerimi sunarım.
Manevi desteklerini her zaman hissettiren eşime, çocuklarıma ve tüm aileme sonsuz teşekkür ederim.
Tez süresince çalışmalarımı takip eden ve yönlendiren değerli hocalarım Doç. Dr. Sefa DURMUŞ ve Doç. Dr. Halil GÜLER’e teşekkürü bir borç bilirim.
Çalışmalarımda desteklerini esirgemeyen laboratuvar arkadaşlarım Dr. Çiğdem HOPA ve Ahmet KARAHAN’a çok teşekkür ederim.
xvii
Bu çalışma, Balıkesir Üniversitesi Bilimsel Araştırma Projeleri Birimi tarafından desteklenmiştir. Proje no: 2007/10
1 1. GİRİŞ
Schiff bazları ve bu bazların kompleksleri üzerine yapılan çalışmalar son yıllarda önemli bir ivme kazanmıştır. 80’li yılların başlarından günümüze X-ışını difraktometrelerinde yaşanan artış, kompleks bileşiklerin yapılarını aydınlatmayı oldukça kolaylaştırmıştır. Özellikle tek kristal X-ışını tekniğinde, atomların kompleks yapısındaki pozisyonları, atomlar arası bağ uzunlukları ve bağ açıları gibi bir çok özellik gözlemlenebilmektedir. Bu durum kompleks yapılarında daha önce anlaşılamayan çok çekirdeklilik gibi kavramların açığa çıkmasına neden olmuştur [1,2].
Schiff bazları ve kompleksleri, kimyacılar kadar biyologlar, fizikçiler ve diğer bilim adamlarının da ilgisini çekmektedir. Literatürde Schiff bazı komplekslerinin biyolojik aktivite, manyetik özellik gibi davranışlarını inceleyen birçok yayın bulunmaktadır [3,4,5,6]. Canlı yapısında, Schiff bazları üzerinden yürüyen bir çok biyokimyasal reaksiyon basamağı bilinmektedir [5,7]. Bu durum, Schiff bazlarının ne derece önemli olduğunu bir kez daha kanıtlamaktadır.
Bu çalışmada yeni Schiff bazlarının ve komplekslerinin elde edilmesi planlanmıştır. Elde edilen yeni bileşiklerin yapıları çeşitli spektroskopik yöntemlerle aydınlatılarak literatüre katkı yapılması amaçlanmıştır.
1.1 Koordinasyon Bileşikleri ve Genel Kavramlar
Bir koordinasyon bileşiğinin oluşum reaksiyonu, Lewis asit-baz reaksiyonu (Şekil 1.1) gibi düşünülebilir. Elektronları ortaklaşa kullanmak üzere merkez atomunun elektron çifti alıcı, ligandların ise elektron çifti verici oldukları ifade
2
edilebilir. Oluşan metal-ligand bağının koordine kovalent bağ olduğu kabul görür. Bunun sebebi, ortaklaşa kullanılan her iki elektronun da ligand tarafından sağlanmasıdır. Ligand atomlarının donör gruplarını genel olarak N, S, O atomları oluşturmaktadır [8,9,10]. 2
0
Şekil 1.1 Bir kompleks bileşiğin oluşum reaksiyonu
Günümüzde koordinasyon bileşikleri endüstriyel ve bilimsel birçok alanda kullanılmaktadır. Bunların arasında; metallerin saf olarak elde edilmesi, enzim inhibisyonu, suların sertliğinin giderilmesi, radyoaktif metallerin uzaklaştırılması, metal iyonlarının titrasyonu, kağıt kromatografisi, amino asitlerin nicel tayinleri, peroksitlerin ve askorbik asitin (C vitamini) stabilize edilmesi, bitkilerdeki bazı metal eksikliklerinin giderilmesi gibi alanlar bulunmaktadır. Koordinasyon bileşiklerinin, biyolojik sistemlerde de önemi her geçen gün artmaktadır. Örneğin bazı metal komplekslerinin organizmalardaki biyolojik aktivitelerinin gözlemlenmesi, bu bileşiklere olan ilgiyi oldukça arttırmaktadır [11].
Koordinasyon kimyasında, 1980'li yılların başından itibaren µ-köprülü kompleksler ile ilgili yayınların sayısı belirgin şekilde artmıştır. Bu artışa sebep olarak 1980'li yılların başında ortaya çıkan enstrümantal analiz yöntemlerindeki gelişmeler gösterilebilir. Kompleks yapılarında bulunan yalancı (pseudo) koordinasyonlar ve katı hal polimerleri bu yıllardan sonra ortaya çıkmış sonuçlardır. Bu yapılar materyallerin manyetik, elektrokimyasal, spektral ve kimyasal özelliklerini etkilemektedir. Elektriksel ve termal iletkenlik gibi özellikler de bu yapılar sebebiyle önemli ölçüde değişmektedir [2].
3 1.2 Koordinasyon Bileşiklerinin Kararlılığı 21
Koordinasyon kimyası alanında kompleks kararlılığı üzerine etki eden çeşitli faktörler vardır. Komplekslerin oluşumunun araştırılmasına yönelik bu çalışmalar sonucunda bazı metal iyonlarının bazı ligandlara karşı olan ilgilerinin daha fazla olduğu ve bu ligandlarla oluşturdukları komplekslerin daha sağlam olduğu gözlenmiştir. Bu durumun sebeplerinin anlaşılmasına yönelik olarak metal iyonları ve ligandlar kimyacılar tarafından çeşitli birimlere ayrılmıştır. Bu birimlerden bazıları aşağıdaki gibidir:
i) Spektrokimyasal seri ve Irwing-Williams serisi: Komplekslerin elektronik
spektrumları incelenerek ligandların metal atomlarının ∆ kristal alan kararlılık enerjisine (KAKE) etkileri incelenmiş ve sonuçlandırılmıştır. Bütün metal iyonları için ligandların kristal alan kararlılık enerjilerine etkilerini gösteren sıralama spektrokimyasal seri olarak bilinen düzenle değişir. Bu sıralama aşağıda belirtilmiştir:
CO > CN- > NO2- > phen> bipy >en > NH3~piridin > NCS- > H2O > C2O42- > OH
->F- > NO3- > Cl- > SCN-> Br- > I
-Kompleks oluşumunun sulu çözelti ortamında olması durumunda, spektrokimyasal serinin üstünde yer alan bir ligandın su molekülü ile yer değiştirmesi ile kristal alan kararlılık enerjisindeki artış, net entalpi değişikliğini uygun bir ölçüde destekler. Bu etki metal iyonlarının Irwing-Williams serisi ile ilgilidir. Spektrokimyasal seride suyun üzerinde yer alan ligandlar için metal iyonlarının belirli bir ligandla oluşan komplekslerinin oluşum sabitleri aşağıdaki sırada verilmiştir:
Ba2+ < Sr2+ < Ca2+ < Mg2+ < Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ < Zn2+
ii) a ve b sınıfı metaller: Metal iyonlarına ait ilk önemli sınıflandırma Chatt, Ahrland
ve Davies tarafından yapıldı. Bu sınıflandırmada, metal iyonlarını a ve b sınıfı olarak ikiye ayırdılar. a sınıfı akseptörler olarak bilinen bazı metal iyonları en kararlı
4
komplekslerini N, O ya da F donör atom içeren ligandlarla yaparlar. b sınıfı olarak bilinen metal iyonları ise en kararlı komplekslerini daha ağır elementleri içeren donör atomlar ile yaparlar. 1A ve 2A grubu metalleri daha içteki geçiş metalleri ile birlikte ve geçiş metallerinin daha önceki üyeleri (3A, 4A, 5A) a sınıfı metallere girerler. Rh, Pd, Ag, Ir, Pt, Au ve Hg b sınıfı metaller içine girerler. Bunların dışında kalan geçiş metalleri ara sınıf olarak kabul edilirler. a sınıfında bulunan akseptörler daha elektropozitif elementlerden oluşur. Bu sınıflandırma tamamen deneysel olarak yapılmıştır ve b karakteri sadece su gibi polarlığı yüksek olan çözücülerde ortaya çıkmaktadır. Gaz fazında ise tüm metaller a karakterine sahiptirler.
iii) Metallerde Sertlik ve Yumuşaklık Kavramı: Kompleks yapılarının önemli bir
unsuru olan metallerin sınıflandırılmasına ilişkin diğer bir sınıflandırmada sert-yumuşak kavramlarına göre yapılan sınıflandırmadır. Metal atomlarını polarizasyona uğrama davranışlarına dayanarak iki sınıfa ayıran Pearson, sert ve yumuşak akseptör kavramlarını literatüre sokmuştur. Bütün b sınıfı metalleri dış orbitallerinde kolaylıkla delokalize olabilen çok sayıda d elektronu bulundururlar yani polarize olabilme yetenekleri yüksektir. Bu sınıfta yer alan metaller öncelikle polarize olabilme yeteneği yüksek olan ligandları tercih ederler. a sınıfı metallerin ise polarize olabilme yetenekleri düşük olduğu için en az polarize olabilen ligandları seçerler. Pearson, polarize olabilme yeteneğinin kompleks oluşumu üzerine etkisinden dolayı a sınıfı metallere sert metaller, b sınıfı metallere ise yumuşak metaller denilmesini önermiştir. Bunun yanında, ara sınıf elementler yüksek oksidasyon basamaklarında sert, düşük oksidasyon basamaklarında yumuşak özellik gösterirler.
Sert-yumuşak kavramı, sert akseptörlerin sert donörleri, yumuşak akseptörlerin yumuşak donörleri tercih ettiğini, sert-yumuşak etkileşiminin ise zayıf olduğunu ortaya koyar. Bu genellikle doğru olmakla beraber ara sınıf elementlerin çeşitli ligandlar karşısındaki davranışları farklıdır. Bir ara sınıf metal iyonu sert ligandla koordine olursa yumuşak akseptör olarak davranır. Bu olay “simbiosis” terimi ile ifade edilir. Simbiosis özellikle birçok metal iyonunun ara sınıf elementi olduğu ve çevresine göre yumuşak veya sert karakter aldığı biyolojik sistemler için çok önemlidir [12,13,14].
5 1.3 Schiff Bazları
Hugo Schiff (1834-1915) 1869 yılında Schiff bazlarını ilk kez sentezledi. Takip eden yıllarda Schiff bazları ve onların geçiş metali kompleksleri büyük önem kazandı. Schiff bazlarını ligand olarak ilk kez Pfeiffer 1932 yılında kullandı. Özellikle son 30 yılda Schiff bazları ve kompleksleri üzerine çok sayıda ilgi çekici çalışmalar yapılmıştır [1].
Aldehit ve ketonlarla primer aminlerin reaksiyonları sonucu oluşan ve zayıf bazik özellik gösteren kondensasyon ürünleri Schiff bazlarıdır. Karbonil bileşikleri olan aldehit ve ketonlar primer amin grupları ile kondensasyon reaksiyonları verir ve karbon azot çifte bağı meydana gelir. Bu bağa imin veya azometin bağı adı verilir. Karbonil bileşiği aldehit ise oluşan bağ azometin (aldimin), keton ise oluşan bağa imin veya (ketimin) adı verilir. Aldimin ve ketimin oluşum reaksiyonları şekil1.2’de gösterilmiştir [15,16,17].
(a)
(b)
6
Schiff bazları, yapılarında bulunan N, S, O gibi donör atomlar vasıtasıyla rahatlıkla kompleks yapısı oluşturabilmektedir. Sözü edilen donör atomlarının türü ve sayısının, kompleks yapısı ve çeşitliliği üzerine etkisi büyüktür fakat oluşan kompleks yapısı sadece donör atomlarına bağlı olarak şekillenmez. Ligandın reaksiyona girdiği metal tuzu, reaksiyona giren ligand ve metal tuzunun molar oranı gibi etkenler de kompleksin yapısı üzerine etki edebilmektedir. Bulundurdukları donör atomlarının türüne ve sayısına bağlı olarak Schiff bazları NO, ONO, ONN, ONNO, ONS, N6 (NNNNNN) ve benzeri tipte ligandlar olarak sınıflandırılabilir
[18,19,20].
Çeşitli biyokimyasal reaksiyonlar ve bu reaksiyonların mekanizmaları incelendiğinde farklı Schiff bazı yapılarının oluşabildiği gözlenmektedir. Treonin biyosentezi sırasında oluşan homoserin-4-fosfat’ın, Schiff bazı basamağı üzerinden L-Treonin’e dönüşmesi bu duruma bir örnek olarak verilebilir. Aminoasitler, üzerlerinde amin grubu bulundurdukları için kolaylıkla Schiff bazı yapısı oluşturabilirler. Vücut içerisinde pek çok metal-ligand kompleksinin varlığı bilinmektedir. Hemoglobin, miyoglobin, B12 Vitamini gibi bir çok kompleks vücut içinde hayati önem taşımaktadır. Bu komplekslerden biri olan miyoglobin, kandaki oksijen basıncının düştüğü durumlarda depoladığı oksijeni serbest bırakarak gerekli ihtiyacı karşılar. Miyoglobinin yapısı incelendiğinde, merkezdeki demir atomu etrafına yerleşmiş polipeptit zincirinden oluştuğu görülür. Ayrıca biyokimyasal reaksiyonların ara basamaklarında da metal-ligand komplekslerinin oluştuğu bilinmektedir. Bu yüzden biyokimyasal reaksiyonların açıklanmasında N, S, O donör atomları içeren ligandların çeşitli metallerle verdiği kompleksler model olarak seçilmekte, bunların koordinasyon geometrileri, metal-donör atom bağ uzunlukları ve kararlılıkları incelenmektedir [7].
Çok çekirdekli kompleksler yapısal özelliklerinden dolayı koordinasyon kimyasının son yıllarda üzerinde durduğu en önemli konulardan biridir. Çok çekirdeklenme elektrik iletimi, manyetizma ve enzimatik hidrolizle ilgili olduğundan biyoinorganik kimya ve tüm temel bilimleri direkt olarak ilgilendirmektedir. Elektron çekici grup içeren ligandların metal komplekslerinin biyolojik
7
aktivitelerinin fazla olduğu, bütün bakır komplekslerinin anti bakteriyel aktivite gösterdiği, özellikle hidroksi sübstitüe Schiff bazı ve komplekslerinin daha fazla aktivite gösterdiği bulunmuştur [2,21].
1.3.1 Schiff Bazlarının Oluşum Mekanizması
Primer aminlerle karbonil bileşiklerinin kondensasyonundan oluşan alkil veya aril grubu bağlı imin yapısındaki Schiff bazları, hidrolize karşı çok dayanıklı değildir. Asidik ortamlarda kendisini meydana getiren karbonil ve amin bileşiklerine ayrılır. Bu reaksiyon iki yönlüdür ve denge genel olarak hızlı gerçekleşir. Reaksiyon azot atomunda en az bir tane çiftleşmemiş elektron içeren elektronegatif atom bulunan aminlerle ( hidrazin, hidroksil amin, semikarbazit, vb.) yapıldığı takdirde tek yönlüdür. Bu durumda reaksiyon ürünü kolay hidrolize uğramadığından yüksek bir verimle elde edilebilir. Hidrolize yatkın olmaları nedeniyle Schiff bazlarının elde edilmesinde daha çok susuz ortamda çalışılır. Aromatik grubu olan ketonlardan Schiff bazı elde edilmesinde reaksiyon suyunun uzaklaştırılması gerekirken, aldehit ve dialkil ketonlardan Schiff bazı sentezinde suyun uzaklaştırılması gerekmemektedir. Buradan aromatik grubu olan ketiminlerin hidrolize karşı daha az dayanıklı olduğu sonucuna varılabilir. Azometin grubundaki azot atomuna elektron salıcı bir alkil ya da aril grubu bağlandığında azometin bileşiğinin kararlılığı artmaktadır [22].
8
İmin oluşumu çok düşük ve çok yüksek pH’da yavaştır. Genel olarak pH 4-5 aralığında en hızlı gerçekleşir. İmin oluşumu için verilen mekanizmadan asit katalizörün gerekliliği anlaşılabilir (şekil 1.3). Burada önemli olan basamak, protonlanmış alkolün bir su molekülü kaybederek iminyum iyonu haline geldiği basamaktır. Burada asit, alkol grubunu protonlayarak, ayrılan OH grubunu suya çevirir. Eğer hidrojen iyonu derişimi çok yüksek ise tepkime daha yavaş ilerler. Çünkü aminin kendisi de önemli oranda protonlanır ve bu da ilk basamakta gerekli nükleofil derişimini azaltacak bir etkendir (şekil 1.4). Hidrojen iyon derişimi çok az ise, tepkime yine yavaşlar; çünkü protonlanmış amino alkol derişimi azalır (şekil 1.5). Dolayısıyla en uygun pH aralığı 4-5 civarı olmalıdır [23].
Karbonil Bileşiği Karbokatyon
Reaktif Amonyum Katyonu
Şekil 1.4 Asidik ortamda elektrofilik gücün artışı, nükleofilik gücün azalışı[17]
Şekil 1.5 Bazik ortamda elektrofilik gücün azalışı, nükleofilik gücün artışı [17]
R NH2 + H+ R NH3+
R NH3+ + OH- R NH
9
Aminler ve aromatik aldehitler düşük sıcaklıkta ve uygun bir çözücü ortamında reaksiyona girerler. Aromatik aminlerin aromatik aldehitlerle kondensasyonu sonucunda, para pozisyonunda elektron çekici bir sübstitüentin aminde bulunması halinde reaksiyon hızının azaldığı, aldehitte bulunması halinde ise reaksiyon hızının arttığı anlaşılmıştır. Aldehitler primer aminlerle kolayca Schiff bazı verebildikleri halde, ketonlardan Schiff bazı elde edilmesi oldukça zordur. Ketonlardan Schiff bazı elde edebilmek için uygun çözücü seçilmesi, katalizör seçimi, uygun pH aralığı ve uygun reaksiyon sıcaklığının seçimi gibi çok sayıda faktörün dikkate alınması gerekir. Özellikle aromatik ketonlardan Schiff bazlarını elde edebilmek için, yüksek sıcaklık, uzun reaksiyon süresi ve katalizör gereklidir. [24,25,26]
1.3.2 Schiff Bazlarının Sentez Yöntemleri
Aldehit ve ketonlar, aminlerle eliminasyon ve katılma reaksiyonları verirler. Bunun için amin ve karbonil bileşiğini alkollü ortamda çözüp ısıtmak yeterli olacaktır (şekil 1.6). Bu reaksiyonlarda aromatik aldehitler daha iyi sonuç vermektedir [27].
Şekil 1.6 Schiff bazlarının genel sentez reaksiyonu
Yukarıdaki reaksiyonda amin yerine diamin kullanılırsa diiminler elde edilir (şekil 1.7) [2,40,63].
10
Hidrazinin aldehit ve ketonlarla vermiş olduğu reaksiyon sonucu reaksiyona giren karbonil bileşiğinin mol sayısına bağlı olarak hidrazon ve azinler oluşmaktadır. Reaksiyonda bir mol aldehit veya keton kullanıldığında hidrazon (şekil 1.8), iki mol aldehit veya keton kullanıldığında ise azin (şekil 1.9) oluşmaktadır [27].
Şekil 1.8 Hidrazon eldesi
Şekil 1.9 Azin eldesi
Semikarbazitler ve tiyosemikarbazitlerin karbonil bileşikleriyle yaptığı reaksiyonlar da Schiff bazı sentezlerinde yaygın şekilde kullanılmaktadır. Semikarbazonlar (şekil 1.10), genellikle oksimler veya hidrazonlara karşılık gelenlerden daha kolay hidroliz olurlar [27].
(a)
(b)
11
Keton ve semikarbazitlerin reaksiyonuyla semikarbazonların oluşumu anilin ile katalizlenmiştir (şekil 1.11). Bu yüzden mekanizma, semikarbazonların normal genel asit katalizi ile oluşan mekanizmasından farklıdır [27].
Şekil 1.11 Semikarbazonların oluşum mekanizması
Schiff bazları ile semikarbazitler arasındaki reaksiyonların hızı, semikarbazitlerin serbest karbonil grupları ile olan reaksiyonlarından daha hızlıdır. Bu durumun, azometin gruplarının, kendilerini oluşturan karbonil gruplarından daha bazik olmasından kaynaklandığı düşünülmektedir [27].
α-amino asitlerin o-hidroksibenzaldehit veya benzer aldehitlerle verdikleri Schiff bazları (şekil 1.12), molekül içi hidrojen bağları nedeniyle kararlı olduğundan dolayı sentezlenebilmektedir [28].
12
Schiff bazlarının sentezi için hidroksilamin de kullanılabilmektedir (şekil 1.13).
Şekil 1.13 Hidroksilaminden Schiff bazı eldesi
Küçük moleküllü aldehit ve ketonlardan oluşan Schiff bazları doymamış karakterli olduklarından polimerizasyona uğrar ve halkasal trimer bileşiklerini meydana getirir. Şekil 1.14’de, asetonun aromatik aminlerle sübstitüe dihidrokinolin vermesi örnek olarak gösterilebilir [29].
Şekil 1.14 Asetonun anilin ile reaksiyonu
1.3.3 Schiff Bazlarının Metal Kompleksleri
Ligandlar, merkezi atoma elektron çiftleri verebilen Lewis bazlarıdır. İmin bağındaki azot atomu çiftleşmemiş elektron bulundurduğu için elektron verici olup bazik karakterdedir. Azometin azotu olarak da tanımlanabilen bu atom bir Schiff bazı için öncelikli koordinasyon noktasıdır. Azot atomunun bir çift bağ ile bağlanmış olduğu azometin sistemi, π-orbitalleri sayesinde geri bağlanmaya uygun d grubu metal iyonları için koordinasyon bölgesi olabilir. Sonuç olarak, azot atomunun da bulunduğu bu grup hem σ-donör hem de π-donör akseptör fonksiyonu gösterebilmektedir. Bu durum, Schiff bazlarının oluşturduğu metal komplekslerinin yüksek kararlılıklarının temel nedenidir [30].
13
Azometin grubunun ligand olarak kararlı kompleksler oluşturabilmesinde ikinci önemli faktör, molekülde hidrojen atomunun kolay uzaklaştırılabildiği azometin bağına yakın bir fonksiyonel grup (tercihen fenolik -OH grubu) bulunmasıdır. Böylece meydana gelen beşli veya altılı şelat halkaları ortaya çıkar ki bu kompleksler metalin kantitatif bağlandığı yapılardır [29].
1.3.4 Schiff Bazı Komplekslerinin Sınıflandırılması
Schiff bazlarının ligandları ve metal komplekslerinin sınıflandırılması, bileşiğin sahip olduğu donör atomlar dikkate alınarak yapılır. Buna göre en çok rastlanan metal kompleksleri: ON, ONO, ONN, ONNO, SNNS, NNNN donör atom sistemine sahip olanlardır [2,16,27]. Bu türden Schiff bazlarına ait örnekler aşağıda gösterilmiştir.
1.3.4.1 ON Tipi Schiff Bazları
Şekil 1.15 ON tipi Schiff bazı
Salisilaldehit ile anilinin oluşturduğu ON tipindeki Schiff bazı (şekil 1.15) iki dişlidir ve metanollü ortamda kararlı olarak elde edilebilmektedir [17].
14 1.3.4.2 ONO Tipi Schiff Bazları
Şekil 1.16 ONO tipi Schiff bazı
2-amino-4-klor fenol ile asetilasetondan oluşan Schiff bazı üç dişli koordinasyon ligandı (şelat) özelliğindedir (şekil 1.16). Söz konusu ligandın yapısı bu çalışmada aydınlatılmıştır.
1.3.4.3 ONN Tipi Schiff Bazları
N-(glisil)-α-pikolilamin ile salisilaldehitten oluşan ürün N-(salisilideniminoaset)-α-pikolil bileşiği (şekil 1.17), ONN tipi Schiff bazı komplekslerine örnektir [31,32].
15 1.3.4.4 ONNO Tipi Schiff Bazları
(a) (b)
Şekil 1.18 ONNO tipi Schiff bazları
Sübstitüe salisilaldehitten oluşan Schiff bazları bu gruba girer. En tanınmış üyesi “salen”dir. Etilendiamin ile salisilaldehitin kondensasyon ürünü olan salen ve benzeri ligandlar “salen tipi ligandlar” olarak da adlandırılmaktadır. 1,3-propandiamin ve salisilaldehitten oluşan salen tipi liganda ait birçok yayına literatürde rastlanmaktadır (şekil 1.18-a). Bu bileşiklerin hemen hepsi dört dişli özellik gösterir ve geçiş elementleri dışındaki bazı metallerle de kompleksler oluşturabilir [6,33].
1.3.4.5 SNNS Tipi Schiff Bazları
Şekil 1.19 SNNS tipi Schiff bazı
Glioksal ile 2-tiyol anilinden oluşan 4 dişli Schiff bazı bu gruba örnek verilebilir (şekil 1.19). Corbin vd. bu ligandın çinko kompleksleri üzerine çalışmalar yapmışlardır [34].
N N
H
C CH
16 1.3.4.6 NNN Tipi Schiff Bazları
Şekil 1.20 NNN tipi Schiff bazı
Üç dişli ligand olarak davranan 2,6-bis(3,4,5-trimetil-pirazol)piridin (btmpp) molekülü (şekil 1.20), NNN tipinde bir ligand olup bu ligandın çeşitli geçiş metalleriyle yaptığı kompleksler literatürde bulunmaktadır [12,60].
1.3.4.7 NNNN Tipi Schiff Bazları
Bu gruba N,N’-bis(2-aminobenzoil)etilendiamin ile salisilaldehitten oluşan N,N’- bis(2-salisilideniminobenzoil)etilendiamin ligandı (şekil 1.21) örnek olarak verilebilir [35].
17 1.3.4.8 Kompartıman Tipi Schiff Bazları
Schiff baz ligandları iki metali bir arada tutabilirler. Metalleri yan yana tutabilen ligand çeşitleri kompartıman (Compartmental) olarak adlandırılır (şekil 1.22). Bu tip ligandlar 1,3,5-triketonların α,ω-etilendiaminlerle kondensasyonu sonucu elde edilebilir [36].
1.22 Kompartıman tipi Schiff bazları
1.3.5 Schiff Bazı Komplekslerinde µµµµ-köprüleri
Schiff bazı komplekslerinde µ-köprüleri oldukça ilginç koordinasyonlar ortaya çıkarmaktadır. SCN- (tiyosiyanat), N3- (azit) ve OCN- (siyanat) gibi anyonlar
kolayca yapısına girdikleri her komplekste çok çekirdekli koordinasyon bileşikleri oluşturabilirler. µ-köprüleri manyetik özellikleri, buna paralel olarak elektriksel iletkenlik, empedans gibi özellikleri de etkiler. µ-köprülü komplekslerde, merkez atomlarının ve ligandların spektral özellikleri, çözünürlük gibi fiziksel özellikleri de değişir [2,14]. Şekil 1.3 ve 1.4’de ifade edildiği gibi tiyosiyanat iyonunun farklı bağlanma şekilleri ilginç yapıda koordinasyonlar ortaya çıkmasına imkân sağlamaktadır.
18
Şekil 1.23 Tiyosiyanat iyonunun (a) kükürt (b) azot üzerinden koordinasyona katılması
Tiyosiyanat iyonunun, metale bağlanma izomerisinde etkili olan birkaç unsur vardır (şekil 1.23). Bunlardan ilki sert-yumuşak atom kavramıdır. Tiyosiyanatta kükürt atomu yumuşak atom sınıfına girerken azot atomu sert atom sınıfına girer. Bu durumda kükürt atomu yumuşak asitlere bağlanmayı tercih ederken azot atomu sert asitlere bağlanır [37].
Sterik etki tiyosiyanat koordinasyonunu etkileyen diğer bir unsurdur. Sterik etkinin fazla olduğu durumlarda tiyosiyanatın bağlanması azot atomu üzerinden gerçekleşirken, az olduğu durumlarda bağlanma kükürt atomu üzerinden gerçekleşmektedir [38].
Ligandların, metale bağlanacak diğer grupların bağlanma izomerisine etkisi literatürde yer almaktadır. Symbiosis teorisine göre sert donör atomlar bağlandıkları metali sert karakterli yapacaktır ve daha sonra eklenecek sert grupların katılımını olumlu yönde etkileyecektir. Benzer durum yumuşak gruplar için de geçerlidir. Bu teori genelde oktahedral sistemlere uygulanmaktadır. Ligandların etkisi üzerine diğer teori ise π bağı teorisidir. Metale bağlanan ligandın π bağı yapma özelliği yoksa tiyosiyanat π bağı yapma özelliği olan kükürt atomu üzerinden metale bağlanır. Eğer kükürt atomundan daha kuvvetli bir π bağı yapıcı ligand metale bağlı ise bağlanma azot atomu üzerinden olacaktır. Çünkü π bağı yapamayan kükürt atomu, sigma bağı söz konusu olduğunda azot atomuna göre dezavantajlıdır [39].
Çözücü yapısının da iki bağlanma izomeri arasında küçük enerji farkları oluşturduğu söylenebilir. Geçiş metallerinin büyük kısmı için, yüksek dielektrik
19
sabitine sahip çözücülerde tiyosiyanatın kükürt atomu üzerinden bağlandığı, düşük dielektrik sabitine sahip çözücülerde ise azot atomu üzerinden bağlanmayı tercih ettiği söylenebilir [36]. Tiyosiyanat iyonunun metal iyonuna bağlanma tipleri şekil 1.24’de verilmiştir.
(a) (b)
(c)
Şekil 1.24 Tiyosiyanat iyonunun köprü olarak metal iyonuna bağlanması (a)
µ
1,1-SCN (b)µ
1,1-NCS (c)µ
1,3-SCN1.3.6 Schiff Bazlarının İnfrared Spektrumları
Schiff bazlarının infrared (IR) spektrumlarında görülen başlıca karakteristik pikler C=N gerilme titreşimi, O-H gerilme-eğilme titreşimi ve aldimin karbonundaki C-H titreşimidir. Ayrıca, orto-hidroksi grubu hidrojeni ile azometin azotu arasındaki muhtemel hidrojen bağı oluşumundan kaynaklanan
ν
OH frekansındaki kaymalar, gözönüne alınması gereken özelliklerdir [16,40].
Schiff bazlarında C=N gerilme titreşimleri genellikle 1610-1640 cm-1'de
görülür. Bütün Schiff bazlarında bu bölgede keskin bir pik gözlenir. Fakat azometin grubuna bağlı metilen grubu taşıyan Schiff bazlarında bu pik 1625-1640 cm-1'de, metilen grubu taşımayanlarda yani doğrudan aromatik halkaya bağlı olanlarda ise 1600-1627 cm-1'de gözlenmiştir.
20
Schiff bazlarının meydana getirdiği komplekslerin IR spektrumlarından, karakteristik bazı piklerin kaybolduğu ya da yerlerinin değiştiği gözlenmiştir. Buna göre C=N titreşim piklerinin kompleks oluşumundan 10-25 cm-1 dalga sayısı kadar daha düşük dalga sayılarına kaydığı görülmüştür. Bu durum, azometin grubuna ait çifte bağın elektron yoğunluğunun azalması ile ilgilidir. Ayrıca ligandın IR spektrumunda gözlenemeyen bazı piklerin kompleks oluşumundan sonra gözlenmesi azometin grubundaki azot ile metal arasındaki bağa ait olan titreşim piki olduğu sanılmaktadır [40].
Genellikle 3500 cm-1'de görülen O-H titreşimleri, O-H grubunun hidrojen
bağı vermeye yatkın olmasından dolayı 2700 cm-1'de görülür. Literatürde halka deformasyon titreşim piklerine de rastlanmıştır. Bu tip titreşimler ilk olarak Nakamato tarafından bakır ve demir(II)'nin asetilaseton ile verdiği komplekslerde ve asetilasetonun kendisinde gözlenmiştir [41]. Ayrıca Schiff bazlarına metal bağlanması durumunda ise bu piklerin tamamen ortadan kaybolması kompleksin oluştuğunu gösteren önemli bir kriterdir. Bazı Schiff bazlarına ait
υ
C=Ntitreşim
bantları tablo 1.1’de verilmiştir.
Tablo 1.1 Bazı aromatik Schiff bazlarının C=N grubuna ait titreşim bantları [26]
Schiff Bazları
υ
C=N(cm-1) N-(4-dimetilamino)benzildin-2- aminofenol 1613 N-(2-hidroksi)benzildinanilin 1622 N-(4-dimetilamino)benzildinanilin 1626 N-(2-nitro)benzildinanilin 1621 N-benzildin-N'-dimetil-4-fenildiamin 1627 N-(4-asetilamino)benzildinanilin 1629 N-benzildinanilin 1631 N-benzildinanilin-2-aminofenol 1629 N-(4-metoksi)benzildinanilin 1630 N-(2-hidroksi)benzildin-2-aminofenol 1624 N-N'-dibenzildin-4-fenildiamin 162821 1.3.7 Schiff Bazlarının NMR Spektrumları
Schiff bazlarının 1H-NMR spektrumları incelendiğinde özellikle dikkat edilmesi gereken birkaç önemli pik vardır. İmin grubu taşıyan Schiff bazlarında
azometin protonuna ait pik bu tip ligandların karakteristik piklerindendir. Azometin grubuna bağlı olan proton genellikle 8 ile 9 ppm aralığında
rezonans olmaktadır. Ayrıca Schiff bazlarında donör grup olarak yer alan OH ve -SH gibi grupların pikleri de oldukça önemlidir. İmin grubunun azot atomu üzerinden koordinasyon gerçekleşse bile azometin protonuna ait pikin yeri neredeyse hiç değişmemekte veya büyük kimyasal kayma değerine doğru biraz oynamaktadır. Koordinasyon oksijen atomu üzerinden gerçekleşmiş ve -OH grubuna ait hidrojen atomu ortamdan ayrılmış ise oluşan kompleksin 1H-NMR spektrumunda liganddan farklı olarak bu pike rastlanmayacaktır. Schiff bazlarının ligand spektrumu ile kompleks spektrumu karşılaştırılırken, -OH, -SH gibi donör grupların piklerinin kaybolması kompleks oluşumunu kanıtlayan bir durumdur [42,43].
13C-NMR spektroskopisinde kimyasal kaymayı etkileyen temel faktörlerden
biri karbon atomunun sahip olduğu hibritleşme türüdür. Hibritleşmeye göre kimyasal kayma değerlerinin sıralaması δsp2>δsp>δsp3 şeklinde gösterilir. Genel
olarak sp3 hibriti yapmış karbon atomları -10 ile 70 ppm değerinde rezonans olurken
sp karbon atomları daha dar bölgede 70–90 ppm değerleri arasında rezonans olurlar. sp2 karbon atomlarının kimyasal kayma değerlerini incelerken, olefinik karbonlar, karbonil karbonları ve imin karbonlarının kimyasal kayma değerleri farklı değerlerde görülmektedir. Olefinik karbonlar 100–150 ppm değerleri arasında rezonans olurken, karbonil ve imin karbonları oldukça geniş bir bölgede 160–210 ppm değer aralığında rezonans olmaktadır. 13C-NMR spektroskopisinde ayrıca elektronik etkilerde önemli rol oynamaktadır. Elektronik etkiler indüktif, mezomerik ve sterik etki olarak üç grup altında değerlendirilir [42].
C
22
1.3.8 Schiff Bazı Komplekslerinin Kullanım Alanları
Koordinasyon bileşikleri sentezinde ligand olarak kullanılan Schiff bazları konusuyla birçok bilim adamı ilgilenmiş ve çeşitli kompleksler elde etmişlerdir. Schiff bazlarının yapılarında bulunan gruplardan dolayı bunlardan elde edilen metal kompleksleri renkli maddeler olduklarından boya endüstrisinde özellikle tekstil sektöründe boyarmadde olarak kullanılmaktadır [44]. Schiff bazı komplekslerinin anti-kanser aktivite göstermesi özelliğinden dolayı tıp dünyasındaki önemi giderek artmaktadır ve kanserle mücadelede reaktif olarak kullanılması araştırılmaktadır [45]. Aromatik aminlerin Schiff bazı kompleksleri özellikle kemoterapi alanında, bazı kimyasal reaksiyonlarda çeşitli substratlara oksijen taşıyıcı olarak kullanılmaktadır [46,47]. Ayrıca bunların kompleksleri tarım alanında, polimer teknolojisinde polimerler için anti-statik madde olarak ve bazı metal komplekslerinde görülen sıvı kristal özelliğinden yararlanılarak uçak sanayinde, televizyon ve bilgisayar ekranlarında, dijital saatlerin göstergelerinde ve daha birçok sanayi dalında kullanılırlar [27,48].
Bazı geçiş metallerinin nükleolitik aktivitelere sahip oldukları bilinmektedir. Bu redoks aktif bileşikler, fizyolojik pH ve sıcaklıkta DNA moleküllerinin fosfodiester iskeletini kırmaktadırlar [48,49].
Bakır (II) kompleksleri biyolojik aktivite bakımından oldukça önemlidir ve anti-tümör ve anti-viral ajanları olarak bilinmektedirler. Özellikle Schiff baz ligandlarından oluşturulan bakır (II) kompleksleri, biyolojik bakır sistemlerinin fiziksel ve kimyasal davranışlarının incelenmesinde önemli model bileşikler olmuşlardır [3,21].
23 1.4 Literatürdeki Bazı Çalışmalar
Şekil 1.25 apacaH3 ligandı
Zhang ve grubu, ONONO tipi ligandın homo iki çekirdekli nikel (II) kompleksini sentezlemişler ve kompleksin yapısını tek kristal XRD yöntemiyle aydınlatmışlardır (şekil 1.25 ve 1.26). Kompleks ve ligandın IR spektrumları incelendiğinde ligandda 1605 cm-1 olan C=N titreşiminin frekansının komplekste
1569 cm-1’e düştüğü gözlenmiştir. Buna sebep olarak, Ni (II) iyonlarının C=N üzerindeki elektron yoğunluğunu azaltması gösterilebilir. Komplekste her iki nikel atomu da kare düzlem koordinasyonuna sahiptir [50].
Şekil 1.26 [Ni2(apaca)(OAc)] kompleksinin %50 olasılıkla çizilmiş ORTEP
24
Rahaman ve grubu, NNNN tipi ligandın kobalt (II) kompleksini sentezlemişlerdir. Bir yalancı halojenür olan tiyosiyanat iyonu da donör azot atomu üzerinden metale bağlanarak kobalt metalinin oktahedral koordinasyonunu tamamlamıştır. Ekvator kısımdaki N-Co-N bağları arasındaki açılar yaklaşık 90o iken dikey kısımdaki N-Co-N bağları arasındaki açılar yaklaşık 180o’dir (Şekil 1.27). Kompleksin IR spektrumunda tiyosiyanat iyonundan kaynaklanan titreşimlerin frekansı 2100 cm-1 de görülmüştür [51].
(a) (b)
Şekil 1.27 (a) pfpd ligandı (b) [Co(pfpd)(NCS)2] kompleksinin %40 olasılıkla
çizilmiş ORTEP diyagramı
Youngme vd., siyanat iyonunun iki farklı şekilde bağlandığı iki çekirdekli bir kompleks sentezlemişlerdir. Kompleks yapısına toplam dört siyanat iyonu katılırken bunlardan ikisi µ-köprüsü pozisyonunda (
µ
1,1-NCO) diğer ikisi ise metalatomuna direk bağlanmışlardır. Bağlanmaların tümü donör azot atomu üzerinden gerçekleşmiştir (Şekil 1.28). Komplekste bakır iyonları kare piramit koordinasyonuna ulaşmışlardır.
25
Şekil 1.28 [Cu2(
µ
1,1-NCO)2(NCO)2(dpyam)2] kompleksinin %50 olasılıkla çizilenORTEP diyagramı
Çalışmada kompleksin manyetik özelliklerine de yer verilmiş ve manyetik süsseptibilite deneyleri sonucunda bakır iyonları arasında zayıf ferrromanyetik etkileşimler gözlendiği belirtilmiştir. [52]
Şekil 1.29 [Me2Sn(OC6H3ClCH=NC5H3NO)] kompleksinin %50 olasılıkla
çizilmiş ORTEP diyagramı
Ancın ve grubu, ONO tipi üç dişli ligandın dimetilkalay (IV) kompleksini sentezlemişlerdir. Kompleksin kalaya bağlı metil grupları dışında kalan kısmı
26
neredeyse düzlemseldir. Burada açılar: Sn–N1–C12–C8: 0.2o, Sn–O2–C8–C12: 0.3o şeklindedir. Metil grupları da hesaba katıldığında kalay iyonlarının üçgen çift piramit ile kare piramit yapıları arasında koordinasyon yaptığı gözlemlenmektedir (şekil 1.29 ve 1.30). Bağ açıları her iki sisteme de tam olarak uymamakla birlikte iki sisteme de eşit uzaklıkta olduğu için ikisi arasında bir yapı olduğu ifade edilmiştir [53].
Şekil 1.30 [Me2Sn(OC6H3ClCH=NC5H3NO)] kompleksinin C ekseni boyunca
paketlenme diyagramı
Ma vd. ONN tipi ligandın (L) homo-iki çekirdekli bakır (II) kompleksini sentezlemişlerdir. Yapıda CuCl2’den gelen klor iyonları µ-köprüsü oluşturmuştur.
Kompleksin tek kristal XRD datalarına göre bakır iyonları yaklaşık olarak üçgen çift piramit koordinasyonu yapmıştır (şekil 1.31). Bunun yanında manyetik çalışmalar üçgen çift piramit ile kare piramit arasında bir yapıyı destekler niteliktedir [5].
Şekil 1.31
Kompleks ile ilgili genel bilgiler C26H22Cl2Cu2N4O2 Kristal sistem:
değerleri: a=14.807(3)Å,
Kompleksin muhtemel kare piramit (SP) ve üçgen çift piramit (TBP) koordinasyonları şekil 1.32’de verilmi
Şekil 1.32 [CuLCl]
27
1 [CuLCl]2 kompleksinin %30 olasılıkla çizilmiş ORTEP
diyagramı
Kompleks ile ilgili genel bilgiler şu şekildedir: Kapalı formül: Kristal sistem: Ortorombik, Uzay grubu: Pbca;
Å, b=8.8132(16)Å, c=18.846(3)Å, α = 90°, β = 90°,
Kompleksin muhtemel kare piramit (SP) ve üçgen çift piramit (TBP) ekil 1.32’de verilmiştir.
[CuLCl]2 kompleksinin muhtemel kare piramit (SP)
piramit (TBP) koordinasyonları
%30 olasılıkla çizilmiş ORTEP
Kapalı formül:
birim hücre = 90°, γ = 90° . Kompleksin muhtemel kare piramit (SP) ve üçgen çift piramit (TBP)
28
Bermejo ve grubu, ONNO tipi ligandın Mn (III) kompleksini sentezlemişlerdir (şekil 1.33). Kompleks dimerik yapıdadır. Perklorat anyonu yapıda hem dimerik komplekslerin paketlenmesinde etkin rol oynamış hem de yük denkliğini sağlamıştır (şekil 1.34). Yapıya katılan iki su molekülü metalin oktahedral koordinasyonunu tamamlamış ve dimerik kompleksin oluşmasında köprü vazifesi görmüştür. Mangan iyonu oktahedral geometriye uymaktadır. Oktahedral sistemde, ligandın donör oksijen ve azot atomları ekvator kısımda, sudan gelen oksijen atomları ise tepe noktalarında bulunmaktadır [54].
Şekil 1.33 [MnL(H2O)2](ClO4) kompleksinin %50 olasılıkla çizilmiş ORTEP
diyagramı
Şekil 1.34 [MnL(H2O)2](ClO4) dimerik kompleksi ve komplekslerin perklorat
29
Stibrany ve grubu, N2S2 tipi (SNNS) ligand (L) ile NiL kompleksini
sentezlemişlerdir. Komplekste Ni-S ve Ni-N bağları yaklaşık olarak düzlemsel yapıdadır (şekil 1.35). Ni-S ve Ni-N bağlarının oluşturduğu sistem kare düzlem yapıya uymaktadır [4].
Şekil 1.35 NiL kompleksinin % 30 olasılıkla ORTEP Diyagramı. Kompleksin kristal parametreleri aşağıdaki gibidir:
Kapalı formül: NiS2N2C13H28; Birim hücre ebatları: a=11.7710(15),
b=14.0419(17), c=10.8293(13) Å; α=90, β=111.946(4), γ=90o; Uzay grubu: P21/c;
Manyetik süsseptibilite, µ:1,4.
Mandal ve grubu, ON tipi iki dişli ligandın farklı mangan (III) komplekslerini sentezlediler (şekil 1.36). (1) numaralı komplekse, ikisi indirgenmiş dört adet ligand katılırken, ligandların ikisi iki dişli (ON), diğer ikisi (indirgenmiş ligandlar) ise tek dişli (O) ligand olarak davranmışlardır. Donör dört oksijen ve iki azot atomu, Mangan (III) metalinin oktahedral koordinasyonunu tamamlamışlardır. Oktahedral sistemde, ekvator kısmını Mn(III) iyonu ve indirgenmemiş iki liganddan gelen ON donör atomları oluştururken, tepe kısımlarını indirgenmiş iki ligandın oksijen donör atomları oluşturmaktadır. Mn(III) perklorat tuzundan gelen perklorat anyonu da yük denkliğini sağlamaktadır [55].
(a)
Şekil 1.36 (1) nolu kompleksin molekül yapısı. (a) ve (b) birbirinden ba
(2) numaralı komplekste ise yapıya iki ligand katılmı komplekste ayrıca azit anyonu da yapıya girmi
sağlamıştır. Fenolik oksijen atomları kare düzlemde trans pozisyonunda konumlanmıştır. Azit anyonu aynı zamanda yük denkli
Şekil 1.3
30
(b)
nolu kompleksin molekül yapısı. (a) ve (b) birbirinden ba adet tek çekirdekli kompleks birimi
numaralı komplekste ise yapıya iki ligand katılmıştır (şekil 1.37) komplekste ayrıca azit anyonu da yapıya girmiş ve kare piramit yapının olu
Fenolik oksijen atomları kare düzlemde trans pozisyonunda Azit anyonu aynı zamanda yük denkliğini de sağlamaktadır
1.37 (2) numaralı kompleksin molekül yapısı
nolu kompleksin molekül yapısı. (a) ve (b) birbirinden bağımsız iki
(şekil 1.37). Bu ve kare piramit yapının oluşmasını Fenolik oksijen atomları kare düzlemde trans pozisyonunda
Schiff bazları ve metal kompleksleri üzerine çok sayıda elektrokimyasal çalışmalarda literatürde yer almaktadır.
(salisilaldehit)-1,3-diaminopropan (şekil 1.38) metal koro Çalışmada ligand ve kompleks
davranışlarını incelemek amacıyla elektrokimyasal empedans spektroskopisi ve potansiyodinamik polarizasyon tekni
Şekil 1.38 N,N´-bis (salis
Demir (II)’nin iki çekirdekli kompleksinin oksijen köprülü komplekslerini Frisch ve arkadaşları sentezlemi
kristal yapıya ait X-ışını verileri demir olduğunu göstermektedir.
vazifesi gören oksijen atomunun varlı
31
Schiff bazları ve metal kompleksleri üzerine çok sayıda elektrokimyasal malarda literatürde yer almaktadır. Abdel-Gaber ve arkadaşları
diaminopropan (Salpr) ligandı ve ligandın kobalt kompleksinin metal korozyonuna etkisini inceleyen bir çalışma yayınladılar. mada ligand ve kompleksin 1M sülfürik asit çözeltisinin, çelik üzerine
larını incelemek amacıyla elektrokimyasal empedans spektroskopisi ve potansiyodinamik polarizasyon tekniği uygulanmıştır [56].
bis (salisilaldehit)-1,3-diaminopropan (Salpr) ligandı ve Co(Salpr) kompleksinin molekül yapıları
(II)’nin iki çekirdekli kompleksinin oksijen köprülü komplekslerini ları sentezlemiş ve yapılarını aydınlatmışlardır (şekil 1.39)
şını verileri demir (II) katyonları arasındaki mesafenin 3, unu göstermektedir. Bu uzaklık iki demir (II) atomunun arasında µ vazifesi gören oksijen atomunun varlığını destekler niteliktedir.
Schiff bazları ve metal kompleksleri üzerine çok sayıda elektrokimyasal ve arkadaşları N,N´-bis ligandın kobalt kompleksinin şma yayınladılar. in 1M sülfürik asit çözeltisinin, çelik üzerine korozyon larını incelemek amacıyla elektrokimyasal empedans spektroskopisi ve
ligandı ve Co(Salpr)
(II)’nin iki çekirdekli kompleksinin oksijen köprülü komplekslerini şekil 1.39). Tek tyonları arasındaki mesafenin 3,54 Å (II) atomunun arasında µ-köprüsü
32
Şekil 1.39 FeL kompleksine ait kristal yapının %50 olasılıkla gösterimi
Komplekste demir (II) atomları beşli koordinasyona sahiptir. Yapının geometrik şekli üçgen çift piramide yakındır. Demir (II) atomları piramidin merkezinde yer alırken dikey pozisyonu ligandın amin grubundaki azot atomu ile µ-köprüsü oluşturan oksijen atomu paylaşmaktadır. Ekvator pozisyonda ise ligandın halka kısmındaki azot atomları ve alkoksi oksijen atomları bulunmaktadır [57].
33
Çalışmada ayrıca bu kompleksin düşük sıcaklıklarda O2 ile reaksiyonundan
çeşitli perokso kompleksleri sentezlenmiştir. Bu komplekslerde O2’nin olası
koordinasyon biçimleri şekil 1.40’da gösterilmiştir.
Schiff bazı komplekslerini elde etmede solvotermal yöntemi de kullanılmaktadır. You ve arkadaşları üç adet, üç çekirdekli Schiff bazı kompleksi sentezlemişlerdir. Kompleksler düzlemsel yapıdadır. Komplekslerde metal atomları arasında üç adet köprü bulunmaktadır. Bunlar ligandın oksijen atomları ile asetat iyonu tarafından oluşturulmaktadır. Komplekslerin her birinde, metal iyonlarından biri sistemin inversiyon merkezinde lokalize olmuş durumdadır. Kompleks merkezindeki metal iyonları oktahedral koordinasyona uymaktadır. Bu metal iyonu komplekste ekvatoryal kısımdan iki Schiff bazının dört oksijen atomu tarafından koordine olurken, dikey kısımdan asetat iyonlarının oksijenleri ile koordinasyonu tamamlamaktadır (şekil 1.41).
Şekil 1.41 ZnL kompleksinin %30 olasılıkla ORTEP diyagramı
Komplekste terminal olarak yer alan çinko (II) iyonları bozulmuş kare piramit koordinasyonuna uymaktadır. Schiff bazının iki oksijen atomu ve iki azot atomu kare piramidin taban kısmını oluştururken, asetat grubunun oksijen atomu koordinasyonun tepe kısmına karşılık gelmektedir. Asetat köprülerinin bağladığı metal iyonları karşılıklı olarak trans pozisyonundadır (şekil 1.42). Söz konusu metal iyonları arasında 3.050(3) Å uzaklık bulunmaktadır [58].

![Şekil 1.26 [Ni 2 (apaca)(OAc)] kompleksinin %50 olasılıkla çizilmiş ORTEP diyagramı](https://thumb-eu.123doks.com/thumbv2/9libnet/5966699.124782/41.918.290.692.637.936/şekil-apaca-oac-kompleksinin-olasılıkla-çizilmiş-ortep-diyagramı.webp)
![Şekil 1.28 [Cu 2 ( µ 1,1 -NCO) 2 (NCO) 2 (dpyam) 2 ] kompleksinin %50 olasılıkla çizilen ORTEP diyagramı](https://thumb-eu.123doks.com/thumbv2/9libnet/5966699.124782/43.918.349.695.116.470/şekil-nco-dpyam-kompleksinin-olasılıkla-çizilen-ortep-diyagramı.webp)
 dimerik kompleksi ve komplekslerin perklorat anyonuyla paketlenmesini sağlayan hidrojen bağlarını gösteren diyagram](https://thumb-eu.123doks.com/thumbv2/9libnet/5966699.124782/46.918.246.738.776.989/kompleksi-komplekslerin-perklorat-anyonuyla-paketlenmesini-sağlayan-bağlarını-gösteren.webp)