Plantagomajor BİTKİSİNİN YAPRAKLARININ FİTOKİMYASAL
ÖZELLİKLERİNİN VE BİYOLOJİK AKTİVİTELERİNİN ARAŞTIRILMASI
Memet AKBAŞ Yüksek Lisans Tezi Organik Kimya Anabilim Dalı
Dr. Öğr. Üyesi Tuba AYDIN AĞRI-2019
T.C.
AĞRI İBRAHİM ÇEÇEN ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ ORGANİK KİMYA ANABİLİM DALI
Memet AKBAŞ
Plantago major BİTKİSİNİN YAPRAKLARININ FİTOKİMYASAL ÖZELLİKLERİNİN VE BİYOLOJİK AKTİVİTELERİNİNARAŞTIRILMASI
YÜKSEK LİSANS TEZİ
TEZ YÖNETİCİSİ Dr. Öğr. Üyesi Tuba AYDIN
ii ÖZET
YÜKSEK LİSANS TEZİ
Plantago major BİTKİSİNİN YAPRAKLARININ FİTOKİMYASAL ÖZELLİKLERİNİN VE BİYOLOJİK AKTİVİTELERİNİN
ARAŞTIRILMASI
Memet AKBAŞ
Tez Danışmanı: Dr. Öğr. Üyesi Tuba AYDIN 2019, 46 sayfa
Bu tez çalışmasında, Plantago major bitkisinin toprak üstü kısımlarının aseton ekstresi fitokimyasal olarak araştırıldı. Ayrıca bitkinin metanol ekstresinin monoamin oksidaz (MAO) A ve B izoenzimleri üzerine inhibisyon etkisi belirlendi. Aseton ve metanol ekstrelerinin İTK ile yürütülmesi sonucunda metanol ekstresinde olup, aseton ekstresinde bulunmayan sekonder metabolitler belirlendi. Çalışmada bitkinin aseton ekstresinden kromatografik yöntemlerle bilinen üç bileşik; n-pentatriakontanol, ursolik asit ve β-sitosterol 3-O-β-D-glukopiranozit saflaştırıldı. n-pentatriakontanol ilk defa bu çalışmada Plantago major’dan izole edildi. İnhibisyon çalışmalarında elde edilen sonuçlara göre MAO-A ve MAO-B izoenzimleri için IC50 değerleri sırasıyla
2,1747 μg/mL (R2=0,8858) ve 21,05103μg/mL (R2=0,8966) olarak hesaplandı. Bu
sonuçlar P. major yapraklarının metanol ekstresinin nörodejeneratif hastalıkların tedavisinde değerlendirilebilecek güçlü MAO-A ve MAO-B inhibitörü olduğunu ortaya çıkarmıştır.
2019, 46 sayfa
iii ABSTRACT
MASTER DISSERTATION
INVESTIGATION OF PHYTOCHEMICAL PROPERTIES AND BIOLOGICAL ACTIVITIES OF LEAVES OF Plantago major
Memet AKBAŞ
Advisor: Assistant Professor Dr. Tuba AYDIN 2019, Page: 46
In this thesis, phytochemicals acetone extract of aboveground parts of Plantago major were investigated. In addition, inhibition effect of its methanol extract was determined on monoamine oxidase (MAO) A and B isoenzymes. Secondary metabolites which are in methanol extract and not in acetone extract were determined by ITK. In this study, three known compounds from the acetone extract of the plant were purified by chromatographic methods as n-pentatriacontanol, ursolic acid and β-sitosterol 3-O-β-D-glucopyranoside. n-pentatriacontanol was first isolated from P. major in this study. According to the results obtained from inhibition studies, IC50 values for MAO-A and
MAO-B isoenzymes were calculated as 2.1747 μg / mL (R2=0.8858) and 21.05103μg / mL (R2=0.8966), respectively. These results revealed that methanol extract of P.
major leaves is a potent MAO-A and MAO-B inhibitor that can be evaluated in the
treatment of neurodegenerative diseases.
2019, 46 pages
iv TEŞEKKÜR
Yüksek Lisans eğitimim boyunca, benden bilgi ve deneyimlerini esirgemeyen, çalışmalarımın tamamlanabilmesi için her türlü şartı sağlayan ve bana her zaman her türlü desteği sunan aynı zamanda akademik çalışmaların önemini bana sevdiren mesleğini çok seven değerli danışman hocam Sayın Dr. Öğr. Üyesi Tuba AYDIN’a teşekkürlerimi sunarım.
Tez savunması için Atatürk Üniversitesi’nden gelerek bizleri onurlandıran, tez çalışması boyunca NMR spektrumlarının alınmasında yardımlarını esirgemeyen, örnek ve ideal bilim insanı değerli hocam Sayın Prof. Dr. Cavit KAZAZ’a teşekkür ederim.
Enzim aktivitesi çalışmalarında desteğini esirgemeyen değerli hocam Sayın Doç. Dr. Hülya AKINCIOĞLU’na teşekkür ederim.
Çalışmalarım esnasında değerli yardımları ile bana yardımcı olan eşim Sayın Nimet AKBAŞ, kızlarım Zeynep Rana ve Elif Reyyan’a ve mesai arkadaşlarım olan Yonca Eczanesi çalışanlarına teşekkürlerimi bir borç bilirim
19.07.2019
v
SİMGELER ve KISALTMALAR DİZİNİ
13C-NMR Karbon-13 Nükleer Manyetik Rezonans
1H-NMR Proton Nükleer Manyetik Rezonans
1-D 1 boyutlu
2-D 2 boyutlu
COSY Two Dimensional 1H-1H Correlation Spectroscopy
d Dublet
dd Dubletin dubleti
t Triplet
DMSO Dimetilsülfoksit
DMSO-d6 Dötero dimetilsülfoksit
g Gram
H Hidrojen
HETCOR Heteronuclear Correlation Spectroscopy
HMBC Heteronuclear Multi Bond Coherence
Hz Hertz
IR Infrared
İTK İnce Tabaka Kromatografisi
J Jiromanyetik sabiti KK Kolon Kromatografisi m Multiplet m/z Kütle/İyon MA Molekül Kütlesi mg Miligram MHz Mega Hertz mL Mililitre MS Kütle Spektrometresi nm Nanometre
NMR Nükleer Manyetik Rezonans
vi
ŞEKİL VE ÇİZELGELER DİZİNİ
Şekil 2. 1. Plantago major bitkisinin toprak üstü kısımları ... 3
Şekil 2. 2. Plantamajoside bileşiğinin kimyasal yapısı ... 4
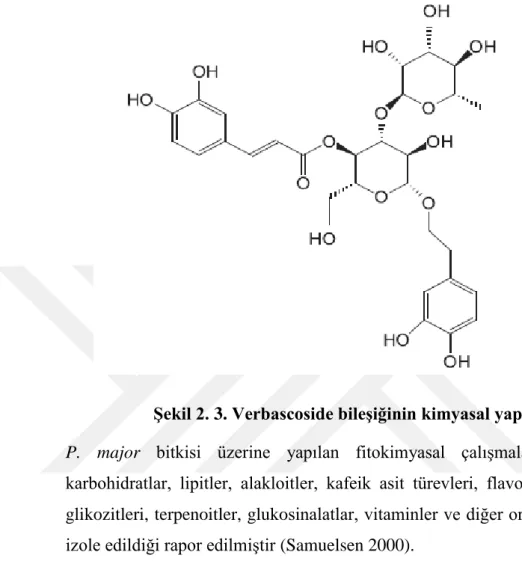
Şekil 2. 3. Verbascoside bileşiğinin kimyasal yapısı ... 5
Şekil 4. 1. Aseton ve metanol ekstrelerinin İTK görüntüleri ... 16
Şekil 4. 2. PM-1’in (n-pentatriakontanol) Q-TOF LC/MS spektrumu ... 19
Şekil 4. 3. PM-1’in (n-pentatriakontanol) 1H-NMR spektrumu (CDCl 3, 400 Mz) ... 20
Şekil 4. 4. PM-1’in (n-pentatriakontanol) 13C-NMR spektrumu (CDCl 3, 100 Mz) ... 21
Şekil 4. 5. PM-2’nin (Ursolik asit) 1H-NMR spektrumu (CDCl 3 ve d6-aseton, 400 MHz) ... 24
Şekil 4. 6. PM-2’nin (Ursolik asit) 13C-NMR spektrumu (CDCl 3 ve d6-aseton, 100 MHz) ... 25
Şekil 4. 7. PM-2’nin (Ursolik asit) DEPT spektrumu (CDCl3 ve d6-aseton, 100 MHz) ... 26
Şekil 4. 8. PM-2’nin (Ursolik asit) 1H-1H COSY spektrumu (CDCl 3 ve d6 -aseton) ... 27
Şekil 4. 9. PM-2’nin (Ursolik asit) 1H-13C HMQC spektrumu (CDCl 3 ve d6 -aseton) ... 28
Şekil 4. 10. PM-2’nin (Ursolik asit) HMBC spektrumu (CDCl3 ve d6-aseton) ... 29
Şekil 4. 11. PM-3’ün (β-sitosterol 3-O-β-D-glukopiranozit) 1H-NMR spektrumu (C5D5N, 400 MHz) ... 31
vii
Şekil 4. 12. PM-3’ün (β-sitosterol 3-O-β-D-glukopiranozit) 13C-NMR
spektrumu (C5D5N, 100 MHz) ... 32
Şekil 4. 13. Metanol ekstresi MAO-A enzimi için % aktivite-[I] grafiği ... 33
Şekil 4. 14. Metanol ekstresi MAO-B enzimi için % aktivite-[I] grafiği ... 34
Çizelge 2. 1. P. major bitkisinden izole edilen bazı bileşiklerin isimleri ... 5
Çizelge 4. 1. Saflaştırılan maddelerin Rf değerleri ... 17
Çizelge 4. 2. Saflaştırılan bileşiklerin isimleri ve yapısal bilgileri ... 17
viii İÇİNDEKİLER ÖZET... ii ABSTRACT ... iii TEŞEKKÜR ... iv SİMGELER ve KISALTMALAR DİZİNİ ... v ŞEKİL VE ÇİZELGELER DİZİNİ ... vi İÇİNDEKİLER ... viii 1. GİRİŞ ... 1 2. KAYNAK ÖZETLERİ ... 2 2.1. Botanik Bilgiler ... 2
2.1.1. Plantaginaceae familyası ve Plantago cinsi ... 2
2.1.2. Plantago major (Sinirli Ot) ... 2
2.2. Plantago major Bitkisi Üzerine Fitokimyasal Çalışmalar ... 3
2.3. Plantago major Bitkisi Üzerine Yapılan Biyolojik Aktivite … Çalışmaları ... 6
2.4. Monoamin Oksidaz (MAO) Enzimi ... 8
3. MATERYAL VE YÖNTEM ... 10
3.1. Materyal ... 10
3.1.1. Bitki materyali ... 10
3.1.2. Kimyasal maddeler ve aletler ... 10
3.1.3. Enzim materyali ... 10
3.1.4. Kullanılan alet ve cihazlar ... 10
3.1.5. Kromatografik çalışmalarda kullanılan adsorbanlar ... 11
3.1.6. Kullanılan revelatörler ... 11
3.2. Yöntem ... 11
3.2.1. Ekstraksiyon ... 11
3.2.2. Aseton ve Metanol Ekstrelerinin İnce Tabaka Kromatografisi ile İncelenmesi ... 12
ix
3.2.3. MAO-A ve MAO-B enzimlerine karşı metanol ekstresinin
inhibisyonun belirlenmesi ... 13
4. ARAŞTIRMA BULGULARI ... 15
4.1. Saflaştırılan Sekonder Metabolitlere Ait Deneysel Bulgular ... 15
4.1.1. Aseton ve metanol ekstrelerinin ince tabaka kromatografisi sonuçları 15 4.1.2 Saf maddelerin ince tabaka kromatografisi sonuçları ... 17
4.2. Saflaştırılan Sekonder Metabolitlere Ait Spektral Bulgular... 17
4.3. Plantago major Bitkisinin Metanol Ekstresinin MAO-A ve MAO-B İzoenzimleri Üzerine İnhibisyon Etkisinin Belirlenmesi ... 33
5. TARTIŞMA VE SONUÇ ... 35
KAYNAKLAR ... 38
1 1. GİRİŞ
Tıbbi bitkiler, yeni farmakolojik tedaviler için paha biçilemez biyoaktif metabolit kaynaklarıdır. Doğu ülkelerinde depresyon gibi nöropsikiyatrik hastalıkların tedavisinde şifalı bitkiler ve bitkisel drogların kullanılması etkili bir alternatif yöntemdir. Günümüzde birçok kronik hastalığın tedavisi bulunamamıştır. Bu yüzden genellikle kronik hastalığa sahip olan insanlar modern tıbbın haricinde farklı tedavi yolları aramaya başlamıştır. Bu bağlamda başvurulan ilk tedavi yöntemi, bitkilerle tedavi olmuştur.
Tarih boyunca insanlar rahatsızlıklarını tedavi etmek amacıyla bitkileri kullanmıştır. Dünya farmakopelerinde 1940-50 yıllarına kadartıbbi bitkiler önemli bir bölüm olarak yer almıştır. Daha sonra sentetik ilaçlar tedavilerde tıbbi bitkilerin yerini almaya başlamıştır. Ancak günümüzde dünya nüfusunun %80’i modern tedaviye ve dolayısıyla sentetik ilaçlara ulaşamamaktadır (Vina et al. 2012). Bu nedenle tıbbi bitkiler hala temel ilaç kaynağı olarak kullanılmaktadır. Ayrıca gelişmiş ülkelerdeki ilaç reçetelerinin %25'i doğrudan veya dolaylı olarak bitkilerle ilgili bileşenleri içermektedir (Vina et al. 2012).
Monoamin oksidaz inhibitörü olan maddeler antidepresan ilaçlar grubuna girer. Bu inhibitörler özellikle depresyon, anksiyete, bipolar, obsesif kompulsif ve yeme bozuklukları gibi hastalıklara sahip insanları tedavi etmeye yarar. Yeni bitkisel ilaç hammaddelerinin bulunması farmakolojik çalışmalarda yol gösterici olması açısından önemlidir. Bu çalışmada Plantago major bitkisinin monoamin oksidaz inhibitörü olma özelliği araştırıldı. Plantago major Kolombiya halkı tarafından stresi ve uykusuzluğu tedavi etmek amacıyla kullanıldığı rapor edilmiştir (Caro et al. 2018).
2
2. KAYNAK ÖZETLERİ
2.1. Botanik Bilgiler
2.1.1. Plantaginaceae familyası ve Plantago cinsi
Plantaginaceae (Sinirli otugiller) familyası, toprak üstünde rozet şeklinde
yaprakları bulunan otlar olarak tanımlanır. Bu familyadaki bitkilerin çiçekleri küçük, aktinomorf, dört halkalı, taç yaprakları zarımsı ve çiçek durumu başak şeklindedir (Karamanoğlu 1977). Plantaginaceae familyasındaki bitkiler dünya üzerinde yaklaşık 275 türü içine almaktadır ve Plantago cinsi bu familyadaki en geniş bitki cinsidir.
Plantago cinsine ait bitkilerin çoğu eliptik şeklinde yapraklı, sivri uçlu ve çok küçük
çiçeklere sahiptir. Plantago türleri sahip oldukları çeşitli özelliklerinden dolayı halk tıbbında yüzyıllardır kullanılmaktadır (Goncalves and Romano 2016).
2.1.2. Plantago major (Sinirli Ot)
Plantago major (Plantago major ssp. major L.) bitkisi Plantaginaceae (Sinirli
otugiller) familyasına ait çok yıllık otsu bir bitki türüdür. Bitkinin yaklaşık olarak boyu 15 cm’ye kadar uzamaktadır ancak yetiştiği ortama göre bu boyut değişkenlik gösterir. Bitkinin yaprakları rozetlerde büyür ve birbirine paralel 5 ile 9 arasında değişen damarları olan eliptik oval biçimindedir (Samuelsen 2000). P. major genellikle fosfor ve potasyum bakımından zayıf olan topraklarda yetişir. Nitrojenin bol olduğu topraklarda özellikle yapraklarının sayısı, gövdesinin büyüklüğü ve toplam biyokütlesi artarken kökleri ise nitrojenli ortamdan çok fazla etkilenmez (Haddadian et al. 2014).
P. major bitkisinin polenlerinde yapılan araştırmalar göstermiştir ki bitki
neredeyse 4000 yıl önce taş devrinde ilk defa ilkel yollarla ekilip biçilirken buna paralel olarak İskandinav ülkelerine de girmiştir (Jonsson 1983; Samuelsen 2000). Bitki Avrupa’dan dünyaya insan eliyle yayılmıştır. Kızılderililer P. major bitkisine “Beyaz adamın ayak izi” adını vermiştir çünkü bitki Avrupa’nın her yerinde bulunmaktadır. Plantago cins ismi ayak tabanı anlamına gelen Latince “planta” ya adapte olmuştur (Samuelsen 2000).
3
Plantago major dünya üzerinde ılıman bölgelerde geniş coğrafi yayılış
gösteren bir bitkidir. Avrupa’nın geniş alanlarında, Asya’nın ılıman bölgelerinde, güney Avustralya’da, kuzey Afrika ve kuzey Amerika’da yayılış gösterir. Bitki Avrupa ve Orta Asya’da kendiliğinden yetişirken günümüzde neredeyse tüm dünya üzerinde yayılmıştır (Haddadian et al. 2014).
Plantago major üzerine yapılan bir araştırmada bitkinin su ekstresinin
uykusuzluk ve anksiyete tedavisinde etkili olabileceği saptanmıştır (Caro et al. 2018).
P. major subsp. intermedia alt türü üzerine yapılan başka bir çalışmada bitkinin
potansiyel antioksidan ve antikolinesteraz aktivitesi gösterdiği saptanmıştır (Kolak et
al. 2011).
Şekil 2. 1. Plantago major bitkisinin toprak üstü kısımları
2.2. Plantago major Bitkisi Üzerine Fitokimyasal Çalışmalar
Plantago türleri çeşitli kimyasal bileşikler içeren önemli tıbbi bitkilerdir. Bitki
içeriğinde fenolik bileşikler (kafeik asit türevleri), flavanoidler, alakloidler, terpenoidler ve C vitamini bulunduğu rapor edilmiştir (Samuelsen 2000; Haddadian et
4
Plantamajoside bileşiği Plantago türlerinde bulunan güçlü biyoaktif doğal bir bileşiktir (Noro et al. 1991). Bileşik ilk defa Plantago major subsp. major ve Plantago
major subsp. pleiosperma bitkilerinden izole edilip yapısı karakterize edilmiştir. Plantago major subsp. pleiospermabitkisinden izole edilen diğer doğal biyokatif
bileşik ise verbascosiddir (Ravn et al. 2015). Yapılan farmakolojik çalışmalarda plantamajoside bileşiğinin çok çeşitli biyolojik aktivitelerinin olduğu ortaya çıkmıştır. Bileşiğin kimyasal yapısı biyolojik aktivitesi açısından oldukça önemlidir (Jime´nez and Riguera 1994; Lopez-Munguia et al. 2011).
Plantamajoside bileşiğinin çok sayıdaki biyoaktivitelerinden dolayı güçlü bir farmasötik olması, endüstride kimyasal sentezi ve biyosentezi üzerine de çeşitli araştırmalar yapılması sonucunu doğurmuştur (Ravn et al. 2015). Özellikle izolasyon ve saflaştırma süreçlerinin uzun zaman alması ve çok zahmetli olması sentetik çalışmalara olan ilgiyi artırmıştır. Bileşiğin ilk defa sentetik olarak üretilmesi Kawada ve arkadaşları (2006) tarafından yapılmıştır.
5
Şekil 2. 3. Verbascoside bileşiğinin kimyasal yapısı
P. major bitkisi üzerine yapılan fitokimyasal çalışmalarda bitkiden
karbohidratlar, lipitler, alakloitler, kafeik asit türevleri, flavonoitler, iridoit glikozitleri, terpenoitler, glukosinalatlar, vitaminler ve diğer organik asitlerin izole edildiği rapor edilmiştir (Samuelsen 2000).
Çizelge 2. 1. P. major bitkisinden izole edilen bazı bileşiklerin isimleri
Bileşiğin adı Referans
Miristik asit (Swiatek et al. 1980)
Palmitik asit (Ahmed et al. 1968)
(Swiatek et al. 1980)
Stearik asit (Ahmed et al. 1968)
(Swiatek et al. 1980)
Oleik asit (Ahmed et al. 1968)
(Swiatek et al. 1980)
Linoleik asit (Ahmed et al. 1968)
(Swiatek et al. 1980)
Linolenik asit (Ahmed et al. 1968)
(Swiatek et al. 1980)
Araşidik asit (Ahmed et al. 1968)
Behenik asit (Ahmed et al. 1968)
6 9-hidroksi-cis-11-oktadekanoik asit (Ahmed et al. 1968) Indicain (Rojas 1968) (Smolenski et al. 1974) (Schneider 1990) Plantagonin (Rojas 1968) (Smolenski et al. 1974) (Schneider 1990)
Apigenin 7-glucosid (Kawashty et al. 1994)
Baicalein (Maksyutina 1971)
Hispidulin (Harborne and Williams 1971)
Hispidulin 7-glucuronide (Kawashty et al. 1994)
Homoplantaginin (Nishibe et al. 1995)
Luteolin 7-glucosid (Kawashty et al. 1994)
Luteolin 7-diglucosid (Kawashty et al. 1994)
Luteolin 6-hydroxy-4%-methoxy-7-galactoside
(Kawashty et al. 1994)
Nepetin 7-glucoside (Kawashty et al. 1994)
Plantaginin (Nishibe et al. 1995)
Scutellarein (Maksyutina 1971)
(Harborne and Williams 1971)
10-Actoxymajoroside (Taskova et al. 1999) 10-Hydroxymajoside (Taskova et al. 1999)
Melittoside (Murai et al. 1996)
Ursolik asit (Ringbom et al. 1998)
Kafeik asit (Pailer and Haschke-Hofmeister 1969)
Klorojenik asit (Maksyutina 1971)
Asperuloside (Bianco et al. 1984)
Aucubin (Long et al. 1995)
Catapol (Murai et al. 1996)
Gardoside (Murai et al. 1996)
Geniposidic asit (Murai et al. 1996)
Majoroside (Handjieva et al. 1991)
2.3. Plantago major Bitkisi Üzerine Yapılan Biyolojik Aktivite Çalışmaları
P. major dünya genelinde geleneksel tedavi için farklı amaçlarla kullanılmıştır.
Bu yüzden bilimsel çalışmalarda bitkinin farklı biyolojik aktiviteleri araştırılmıştır. Bitkiden izole edilen saf maddelerin biyolojik aktivitelerinin araştırılmasının yanında bitkinin farklı organik çözücülerdeki ekstrelerinin de aktiviteleri araştırılmıştır.
Plantago bitkileri yüksek oranda fenolik bileşikler içerdikleri için bu bitkiler
7
P. major bitkisi Türkiye’de geleneksel olarak ülser tedavisinde
kullanılmaktadır. Bitkinin kurutulup öğütülmüş yaprakları her gün kahvaltıdan önce balla birlikte alınır. Ratlarda oluşturulan immersion-stress ülser modelinde bitkinin ekstresinin ülseri inhibe ettiği rapor edilmiştir (Yesilada et al. 1993).
P. major bitkisinin antikanser özelliği çeşitli çalışmalarda araştırılmıştır.
Ratlarda oluşturulan lenfositik lösemi modeline karşı bitkinin kök ve tohumlarından elde edilen ekstresinin in vivo aktivite göstermediği rapor edilmiştir (Bhakuni et
al.1976; Samuelsen 2000). Başka bir çalışmada P. major preparatlarının önleyici
onkoloji tarama sisteminde etkili olduğu ortaya çıkmıştır. Bu etkinin tümörlü farelerde antimetastazik aktivite şeklinde olduğu belirtilmiştir (Yaremenko 1990). Diğer bir çalışmada bitkinin su ekstresinin meme kanserinde koruyucu aktiviteye sahip olduğu rapor edilmiştir (Lithander 1992). Plantago türleri Meksika ve Arjantin’de geleneksel tıpta antikanser olarak kullanılmaktadır. Şili’de ve Venezualla’da ise P. major bitkisinden kanser tedavisinde faydalanılmaktadır (Galvez et al. 2003; Srivastava et
al. 2005).
Geleneksel tedavide P. major bitkisinin yaprakları ve tohumları yüzyıllardır yaralar, ülser ve infeksiyonların tedavisinde kullanılmaktadır. Araştırmalar göstermiştir ki bitkinin yaprakları pektin ve arabinogalakton içeriği ile antikomplementer aktiviteye sahiptir (Samuelsen et al. 1995; 1996; 1998; 1999). P.
major bitkisi halk tıbbında ciltte antibakteriyel ve antifungal etkisi ile ve
gastrointestinal hastalıkların tedavisinde kullanılmıştır (Samuelsen 2000). Bitki Meksika’da ishal ve parazitlere karşı, Tanzanya’da ise sıtma tedavisinde kullanılmıştır (Weenen et al. 1990; Ponce-Macotela et al. 1994).
P. major ile hazırlanan poşet çayların antioksidan kapasiteye ve serbest radikal
tutucu özelliğe sahip olduğu rapor edilmiştir. Aynı çalışmada yeşil çayın yapraklarının antioksidan kapasitesinin P. major ile hazırlanan çaya göre daha yüksek olduğu belirtilmiştir (Campos and Lissi 1995).Yapılan çalışmalarda Guatemala ve Vietnam’da bitkinin yapraklarının diüretik olarak kullanıldığı rapor edilmiştir (Ca´ceres et al. 1987; Doan et al. 1992).
8
P. major’un metanol ekstresinden saflaştırılan terpenoid türevi bir bileşiğin
biyoaktivitesinin araştırıldığı bir çalışmada, P. major’un terpenoit bileşiğinin klinik olarak böbrek taşı düşürmede kullanılan zyloric vepotasyum sitrat ilaçlarına göre kalsiyum okzalat kristallerine karşı daha etkili bir inhibe edici olduğu ortaya çıkarılmıştır (Sharifa et al. 2012) Başka bir çalışmada P. major’ün etken maddesi plantamajoside bileşiğinin Matrix metalloproteinase 9 (MMP9) and Matrix metalloproteinase2 (MMP2) enzimlerini inhibe ettiği bu nedenle meme kanserinde umut verici antikanser ajan olabileceği ortaya çıkarılmıştır (Pei et al. 2015). Yine literatürde başka bir çalışmada P. major bitkisinin su-etanol ekstresinin t-BOOH’a karşı antioksidan ve sitoprotektif etkiye sahip olduğu, dolayısıyla sağlık için faydalı bir bitki olduğu rapor edilmiştir (Mello et al. 2015).
2.4. Monoamin Oksidaz (MAO) Enzimi
Monoamin oksidaz (MAO) beyin, karaciğer, bağırsak mukozası ve diğer organlardaki dış mitokondriyal zarlarda bulunan ve dopamin, serotonin, norinefrin, tiramin, triptozin ve MPTP (N-metil-4-fenil-1,2,3,6-tetrahidropiridin) nörotoksin dahil olmak üzere biyojenik aminlerin oksidatif deaminasyonunu katalizleyen bir flavin-adenin-dinükleotid (FAD) içeren enzimdir (Tipton 1986; Vina et al. 2012). MAO, substrat ve inhibitör seçiciliklerindeki farklılıkları ile ayırt edilen, A ve MAO-B olmak üzere iki izozim olarak görünür. MAO-A tercihen serotonin ve norepinefrin oksidasyonunu katalizler ve klorjilin ile inhibe edilir. MAO-B ise seçici olarak feniletilamin ve benzilaminin oksidasyonunu katalizler ve (R)-deprenil tarafından inhibe edilir. Tiramin, dopamin ve triptamin, her iki enzimin de substratları gibi görünmektedir. MAO, CNS ve periferik organlarda önemli bir fizyolojik role sahiptir. MAO-B'nin anormal aktivitesi Parkinson ve Alzheimer hastalıkları gibi nörolojik bozukluklara neden olurken, MAO-A depresyon gibi psikiyatrik durumlarda etkilidir. Biyojenik aminlerin MAO ile oksidasyonu, hücre oksidatif hasarı için bir risk faktörü oluşturabilen hidrojen peroksit ve aldehitlerin üretilmesiyle sonuçlanmaktadır. Bu nedenle MAO inhibitörlerinin araştırılması yeni ilaç buluşlarında büyük ilgi çekmektedir (Weyler et al. 1990; Vindis et al. 2000; Vina et al. 2012). Özellikle nörodejeneratif hastalıkların tedavisinde önemli rol oynayan MAO inhibitörleri dopamin, serotonin ve noradrenalin etkisini azaltan sinir uçlarında bulunan MAO
9
enzimini inhibe etme aktivitesine sahiptirler. Bunun sonucunda nörotransmitter moleküllerin miktarca azalmasını engelleyip nöronlardaki düzeyinin artmasına sebep olurlar. Dolayısıyla MAO inhibitörlerinin depresif durumlardan sorumlu nörotransmitter eksikliğini giderdiği düşünülmektedir (Nair et al. 1993; Sahoo et al. 2010).
Çalışmanın Amacı
Bu çalışmada amacımız Plantaginaceae (Sinirli otugiller) familyasına ait bir bitki cinsi olan P. major bitkisinin yapraklarının metanol ekstresinin MAO-A ve MAO-B enzimlerine karşı inhibisyon etkilerini araştırmak ve fitokimyasal özelliklerini ortaya çıkarmaktır. Çalışmada bitkinin metanol ekstresinin MAO-A ve MAO-B enzimlerine karşı inhibisyon etkileri araştırıldı. Ayrıca bitkinin aseton ekstresinden saflaştırılan bileşiklerin kimyasal yapıları spektroskopik yöntemlerle karakterize edildi.
10
3. MATERYAL VE YÖNTEM
3.1. Materyal
3.1.1. Bitki materyali
P. major bitkisinin yaprakları 2015 yılı Haziran ayında Ağrı İli merkezinden
toplandı. Bitkinin tür teşhisi Ağrı İbrahim Çeçen Üniversitesi Eczacılık Fakültesi’nde Dr. Öğr. Üyesi Yalçın KARAGÖZ tarafından yapıldı ve bitki Üniversitemiz Merkezi Araştırma ve Uygulama Laboratuvarı’nda muhafaza edildi. Bu tez kapsamında yapılan fitokimya çalışmalarında, bitkinin açık havada ve gölgede kurutulmuş yaprakları kullanılmıştır.
3.1.2. Kimyasal maddeler ve aletler
Bu çalışmada kullanılan kimyasal maddeler Tekkim ve Sigma-Aldrich firmalarından satın alınmıştır. Çalışmada kullanılan maddeler; sülfürik asit (%98), vanilin, aseton, metanol, etanol, etilasetat, kloroform, n-hekzan ve piridindir.
3.1.3. Enzim materyali
Çalışmada kullanılan MAO-A ve MAO-B enzimleri Sigma-Aldrich firmalarından satın alınmıştır.
3.1.4. Kullanılan alet ve cihazlar
NMR Spektrometre Bruker 400 MHz
Spektrofotometre Perkin-Elmer
Rotary Evaporatör Heidolph
UV Lambası Camag UV Bethrachter
UV-VIS Spektrofotometre Shimadzu, UV-1208 Derin dondurucular (30 ve
-86°C)
Sanyo, Japan
pH metre Hanna Instrument
Hassas terazi Scaltec SBA 41
İnkübatör : Elektro-Mag (0-300°C)
Otomatik pipetler Biohit, Socorex ve Oxford Pipettors
Çalkalayıcı Nüve SL 350
11
Saf su cihazı Firstreem Calypso MK 1 Glass Still Magnetik karıştırıcı Stuart Scientific
UV-Spektrofotometre küveti 1 cm3’lük Kuartz Küvet 3.1.5. Kromatografik çalışmalarda kullanılan adsorbanlar
Preparatif İnce Tabaka Kromatografisi (PİTK): Silika jel (Hazır plak, Kiesel gel 60 F254, 0,5 mm, Merck 5557), İnce Tabaka Kromatografisi (İTK); Silika jel (Hazır
plak, Kiesel gel 60 F254, 0,2 mm, Merck, 5554), Kolon Kromatografisi (KK); Silika jel
(Kiesel gel 60, 70-230 mesh, Merck; Kiesel gel 60, 230-400 mesh, Merck).
3.1.6. Kullanılan revelatörler
UV Lambası: UV366 nm ve UV254 nm
Vanilin/Sülfürik asit: Vanilinin derişik H2SO4içerisindeki çözeltisi (%1’lik,
püskürtmeden sonra kromatogram 105°C’de birkaç dakika ısıtılır). 3.2. Yöntem
3.2.1. Ekstraksiyon
Çalışmanın bitki materyali olan P. major bitkisinin yaprakları gölgede kurutulup blender ile öğütüldü. Bu çalışma için öğütülmüş bitki örneğinin metanol ve aseton ekstreleri hazırlandı. Aseton ekstresini hazırlamak için 1400 g bitki aseton (3 L) ile ekstrakte edildi. Ekstraksiyon oda sıcaklığında 24 saat bekletilerek yapıldı ve aseton süzüldü. Aynı işlem 6 defa tekrarlandıktan sonra süzüntüler birleştirildi. Bir rotari evaporatör yardımıyla 50ºC sıcaklık ve düşük basınçta aseton ekstreden uzaklaştırıldı. Ekstraksiyon işleminin sonucunda 56 g aseton ekstresi elde edildi ve bu ekstre fitokimyasal çalışmalar için kullanıldı.
Metanol ekstresini hazırlamak için 20 g bitki örneği ve 250 ml metanol kullanıldı. Aseton ekstresindeki olduğu gibi ekstraksiyon işlemi gerçekleştirildi. Elde edilen metanol ekstresi miktarı 425 mg olarak belirlendi ve bu ekstre MAO-A ve MAO-B enzimlerinin inhibisyonu çalışmalarında kullanıldı.
12
3.2.2. Aseton ve metanol ekstrelerinin ince tabaka kromatografisi ile incelenmesi
Bu bölümde aseton ve metanol ekstreleri, farklı polaritelerdeki organik çözücü karışımlarında İTK üzerinde incelendi.
3.2.3. İzolasyon
Aseton ekstresi önce saf kloroform ile çözüldü. Değişik çözücü sistemlerinde İTK yöntemi ile kontrol edildi. İTK’da oluşan renkler yardımıyla SKK ile fraksiyonlama yapmak için uygun çözücü sistemleri belirlendi. Ekstredeki bileşikleri SKK ile ayırmak üzere, 700 g silika jel 60 (70-230 mesh) kloroform ile süspansiyon haline getirildi ve kolona (9x30 cm) tatbik edildi. Ekstre (56 g) kloroform ile çözüldükten sonra kolona yüklendi. Elüsyona saf kloroform ile başlandı ve kloroform-etil asetat (50:50), kloroform-etil asetat (saf), kloroform-etil asetat-metanol (90:10), kloroform-etil asetat-metanol (80:20) çözücü sistemleri ile devam edildi. Fraksiyonlar 50 ml hacimlerde toplandıktan sonra yoğunlaştırıldı ve İTK ile değişik çözücü sistemlerinde kontrol edilerek aynı Rf değerli bileşikleri taşıyan fraksiyonlar birleştirildi. Fraksiyonlama
işleminin sonucunda ana ekstre 4 alt fraksiyona ayrıldı.
Alt fraksiyonlar PMA (4,936 g), PMB (18,387 g), PMC (2,574 g) ve PMD (4,681 g) olarak kodlandı.
PMA Fraksiyonu üzerinde Yapılan Kromatografik Çalışmalar
PMA alt akstresini fraksiyonlarına ayırmak için 100 g silika jel (Kieselgel, 200-400 mesh) CHCl3:EtOAc (95:5) çözücü karışımı ile süspansiyon haline getirildikten
sonra kolona (2x43 cm) yüklendi. Ekstre aynı sistemde çözüldükten sonra kolona tatbik edildi ve aynı çözücü sistemi ile kolon devam ettirildi. Fraksiyonlar 30 ml hacimler halinde toplandı ve İTK ile kontrol edildi. İTK ile yapılan kontroller neticesinde 36-47. (587 mg) fraksiyonlarda bir maddenin saflaştırılabileceğine karar verildi. Bu amaçla 36-47. fraksiyonları için CHCl3:EtOAc (85:15) çözücü sisteminde
80 g silika jel (Kieselgel, 200-400 mesh) kullanarak kolon (2,5x41 cm) yapıldı. Fraksiyon hacmi 20 ml olan bu kolonun 32-35. fraksiyonlarında beyaz renkli
13
kristalimsi yapıda İTK’da tek leke veren temiz bir madde tespit edildi. Madde PM-1 (110 mg) olarak kodlandı.
PMB Fraksiyonu üzerinde Yapılan Kromatografik Çalışmalar
PMB alt akstresini fraksiyonlarına ayırmak için 200 g silika jel (Kieselgel, 70-230 mesh) CHCl3:EtOAc (70:30) çözücü karışımı ile süspansiyon haline getirildi ve
kolona (4,5x41 cm) yüklendi. Ekstre aynı çözücü sistemiyle çözüldükten sonra kolona tatbik edildi ve bu şartlarda kolon devam ettirildi. Fraksiyonlar 50 ml hacimler halinde toplandı ve İTK ile yapılan kontroller neticesinde 33-96. fraksiyonlarda (3,861 g) major olarak görülen ve kendiliğinden kristallenen bir madde tespit edildi. Madde süzgeç kağıdı ile ayrıldı ve metanol ile iyice yıkandıktan sonra temiz olduğuna karar verildi. Bu madde PM-2(265 mg) olarak kodlandı.
PMC Fraksiyonu üzerinde Yapılan Kromatografik Çalışmalar
PMC fraksiyonu için yapılan kromatografik işlemler sonucunda madde saflaştırılamadı.
PMD Fraksiyonu üzerinde Yapılan Kromatografik Çalışmalar
PMD fraksiyonu evaporatörde tamamen çözücüsü uzaklaştırıldıktan sonra üzerine etil asetat eklendi. Bu işlem neticesinde bir kendiliğinden kristallendi. Beyaz renkli kristaller süzgeç kağıdı ile ayrıldı, metanol ile iyice yıkandı ve PM-3 (180 mg) olarak kodlandı.
3.2.3. MAO-A ve MAO-B enzimlerine karşı metanol ekstresinin inhibisyonun belirlenmesi
Enzim inhibisyon çalışmaları Doç. Dr. Hülya AKINCIOĞLU tarafından bireysel laboratuvarında gerçekleştirildi.
MAO-A ve MAO-B izoenzimleri üzerine inhibisyon çalışmaları, Holt (1997) ve Schmidt (2003) grubu tarafından geliştirilerek modifiye edilen bir yönteme göre 96 kuyucuklu mikroplate okuyucu ile fotometrik bir yöntemle yapıldı. Bu yönteme göre mikroplatenin her kuyucuğuna substrat (2.5 mM tiramin, Sigma-Aldrich) potasyum
14
fosfat tamponu içinde), kromojenik solüsyonu (1 mM vanilik asit (Sigma), 0.5 mM 4-aminoantipirin (Sigma-Aldrich), 4 U/mL peroksidaz (Sigma-Aldrich) potasyum fosfat tamponu), enzim ve inhibitör koyuldu. Blank için ise kuyucuklara enzim yerine potasyum fosfat (0.2 M, pH 7.6) koyuldu. Her 5 dakikada 40 dakika boyunca reaksiyonların 490 nm'de mikroplate okuyucu kullanılarak absorbans değerleri okundu. Çalışma sonuçları için inhibitör konsantrasyonuna karşı % Aktivite grafiği çizildi. Grafik üzerinde IC50 değerleri hesaplandı.
15
4. ARAŞTIRMA BULGULARI 4.1. Saflaştırılan Sekonder Metabolitlere Ait Deneysel Bulgular
4.1.1. Aseton ve metanol ekstrelerinin ince tabaka kromatografisi sonuçları
Aseton ve metanol ekstreleri üç farklı çözücü sisteminde İTK ile yürütüldükten sonra, iki ekstrenin kimyasal içeriği kantitatif olarak karşılaştırıldı (Şekil 4.1).
Şekil 4.1’deki İTK görüntülerine göre, CHCl3:MeOH (80:20) çözücü
sisteminde metanol ekstresinde olup, aseton ekstresinde olmayan renkler mevcuttur. Bu durum bize metanol ekstresine gelen bazı sekonder metabolitlerin aseton ekstesinde bulunmadığını göstermektedir. Benzer durum CHCl3:EtOAc (50:50) ve
EtOAc:n-hekzan (50:50) çözücü sistemlerinde de söz konusudur. Bu sistemlerde
pembe renk veren aynı metabolit her iki ekstrede de mevcuttur. Bununla birlikte en düşük polarite olan EtOAc:n-hekzan (50:50) çözücü sisteminde aseton ekstresinde olup metanol ekstresinde olmayan bir metabolit işaretlenmiştir.
İTK sonuçları bize özellikle yüksek polaritede metanol ekstresine gelen metabolitlerin aseton ekstresinde bulunmadığı bilgisini vermektedir. İzolasyon çalışmalarında aseton ekstresi üzerinden fraksiyonlama yapılarak üç metabolit saflaştırılmıştır. Metanol ekstresinde olup, aseton ekstresinde olmayan maddelerin kantitatif olarak İTK’da tespit edilmesi çalışmanın devamında metanol ekstresi üzerinden de izolasyon çalışmalarının yapılması fikrini doğurmuştur.
16
17
4.1.2 Saf maddelerin ince tabaka kromatografisi sonuçları
P. major bitkisinin yapraklarının aseton ekstresinden saflaştırılan PM-1, PM-2
ve PM-3 bileşiklerinin İTK ile yürütülmesi neticesinde saptanan Rf değerleri Çizelge 4.1’de verilmiştir.
Çizelge 4. 1. Saflaştırılan maddelerin Rf değerleri
Madde Çözücü sistemi Rf değeri Adsorban
PM-1 CHCl3:EtOAc (50:50) 0,56 Silika jel
PM-2 CHCl3:EtOAc (70:30) 0,70 Silika jel
PM-3 CHCl3:EtOAc (70:30) 0,49 Silika jel
4.2. Saflaştırılan Sekonder Metabolitlere Ait Spektral Bulgular
P. major bitkisinin yapraklarının aseton ekstresinden izole edilen 1,
PM-2 ve PM-3 saf maddelerinin molekül yapılarını karakterize etmek üzere 1D ve PM-2D NMR ile Q-TOF LC/MS spektral yöntemleriyle elde edilen bulgular değerlendirilmiştir. Yapılan değerlendirmeler neticesinde bileşiklerin kimyasal yapıları karakterize edilmiştir. Saflaştırılan bileşiklere ait isimlendirmeler Çizelge 4.2’de verilmiştir.
Çizelge 4. 2. Saflaştırılan bileşiklerin isimleri ve yapısal bilgileri
Madde kodu Madde ismi PM-1 n-pentatriakontanol
PM-2 Ursolik asit
18 PM-1 KODLU BİLEŞİK n-Pentatriakontanol (pentatriakontan-1-ol) C35H72O MA: 508.96 g/mol
PM-1 kodlu bileşik beyaz renkli bir kristal olarak saflaştırıldı. UV254 ve UV366
nm’de renk vermeyip H2SO4/vanilin reaktifi püskürtülüp ısıtıldığında (105°C)
pembemsi renk vermektedir. Şekil 4.2’de Q-TOF LC/MS spektral verilerine baktığımız zaman 554,5503 (m/z) olarak görülen pik PM-1 kodlu maddenin kütle yarılmasına aittir. Bu değerden iki adet Naatomunun (MA: 22,98 g/mol) koparılması sonucu tahmin edilen yapının kütlesine (508,96 g/mol) tekabül etmektedir.
PM-1 kodlu bileşiğin yapısı 1D NMR ile Q-TOF LC/MS spektral verileri kullanılarak uzun zincirli bir alifatik alkol olan n-pentatriakontanol olarak karakterize edilmiştir. Bileşiğe ait Şekil 4.3’de1H-NMR spektrumunda δ=3,66 ppm’de görülen triplet sinyal (J=6,56 Hz) alkol karbonuna bağlı hidrojenlere aittir. δ=1,58 ppm’de görülen pentet sinyaller 2 numaralı karbonun hidrojenlerine aittir. En son karbona bağlı olan metil grubunun hidrojenine bağlı sinyaller δ=0,90 ppm’de t (J=6,68 Hz) olarak görülmektedir. δ=1,30 ppm’deki şiddetli sinyaller ise bileşiğin yapısında bulunan fazla sayıdaki CH2 grubuna ait sinyallerdir. İntegrasyon oranları kullanılarak
1 numaralı karbona bağlı iki hidrojen ile şiddetli sinyal veren alifatik bölgedeki hidrojenler kıyaslandığında uzun zincirli karbonlara bağlı toplam 64 H olduğu saptandı. Şekil 4.4’de 13C-NMR spektrumunda toplam 12 karbon sinyali gözlenmiştir.
19
δ=29,7 ppm’de görülen şiddetli sinyaller fazla sayıdaki CH2karbonlarına aittir. Aşağı
alanda δ=63,1 ppm’de gelen sinyal 1 numaralı karbona aittir. Ayrıca literatürde verilen NMR verileri sonuçlarımızla uyum göstermektedir (Parveen et al. 2010).
20
Şekil 4. 3. PM-1’in (n-pentatriakontanol) 1H-NMR spektrumu (CDCl
21
22 PM-2 KODLU BİLEŞİK Ursolik Asit (3β-hidroksi-urs-12-en-28-oik asit) C30H48O3 MA: 457 g/mol
PM-2 bileşiği beyaz kristalimsi yapıda olup, görünür ışıkta, UV254 ve UV366
nm’de renk vermeyen, H2SO4/vanilin reaktifi (105ºC) püskürtülünce pemberenk veren
bir madde olarak saflaştırıldı. Maddenin kimyasal yapısı 1H-NMR, 13C-NMR, DEPT, 1H-1H COSY, 13C-1H HMQC ve 13C-1H HMBC spektral verileri kullanılarak ursolik
asit olarak karakterize edildi.
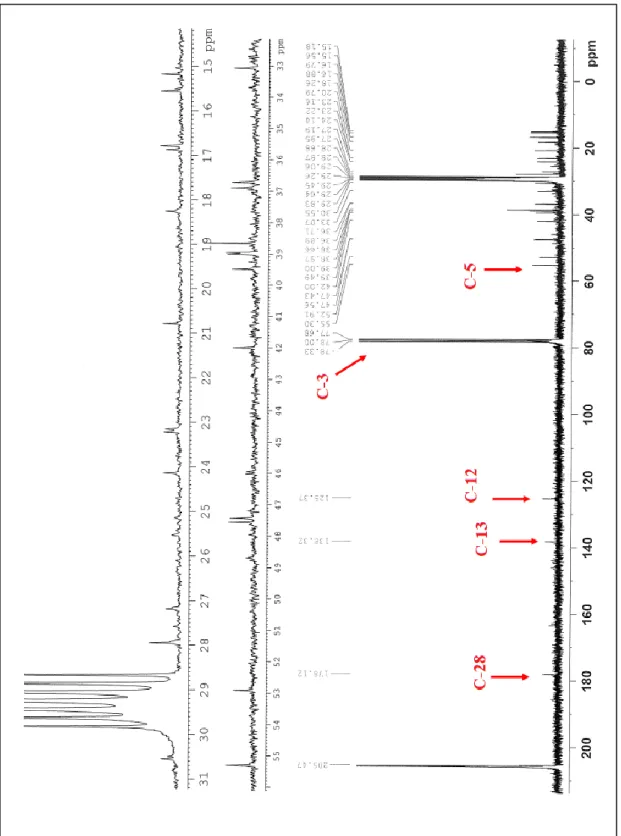
PM-2’nin 1H-NMR spektrumunda (Şekil 4.5) δ=5,23 ppm’de gelen triplet sinyal (J=3,6 Hz) 12 numaralı karbona bağlı hidrojene aittir. δ=3,16 ppm’de dd olarak gelen sinyal (J1=10,3 Hz, J2=5,4 Hz) 3 numaralı karbona bağlı hidrojene aittir. Şekil
4.6’da ursolik asitin 13C-NMR sinyaline baktığımızda δ=178,1 ppm’de 28 numaralı karbonile ait sinyal görülmektedir. δ=138,3 ppm’de C-13, δ=125,3 ppm’de C-12 ve
δ=77,9 ppm’de C-3’e ait sinyaller görülmektedir. Ursolik asitin 13C-NMR
23 13C NMR (CDCI 3 ve aseton-d6, 400 MHz): δC 38.9 1), 28.7 2), 77.9 (C-3), 39.5(C-4), 55.3 (C-5), 18.3 (C-6), 33.1 (C-7), 39.0 (C-8), 47.4 (C-9), 36.9 (C-10), 23,22 (C-11), 125.4 (C-12), 138.3(C-13), 42.0 (C-14), 29.5 (C-15), 24.1 (C-16), 47.6 (C-17), 52.9 (C-18), 38.7 (C-19), 29.8 (C-20), 28,0 (C-21),38,7 (C-22), 28.9 (C-23), 15.6 (C-24), 15,2 (C-25), 16.9 (C-26), 23.2 (C-27), 178.1 (C-28), 16,8 (C-29), 20.8(C-30).
Ursolik asitin NMR spektrumları literatür ile uyum göstermektedir (Guvenalp
24
Şekil 4. 5. PM-2’nin (Ursolik asit) 1H-NMR spektrumu (CDCl
3 ve d6-aseton, 400
25
Şekil 4. 6. PM-2’nin (Ursolik asit) 13C-NMR spektrumu (CDCl3 ve d6-aseton,
26
Şekil 4. 7. PM-2’nin (Ursolik asit) DEPT spektrumu (CDCl3 ve d6-aseton, 100
27
Şekil 4. 8. PM-2’nin (Ursolik asit) 1H-1H COSY spektrumu (CDCl
28
Şekil 4. 9. PM-2’nin (Ursolik asit) 1H-13C HMQC spektrumu (CDCl
3 ve d6
29
30
PM-3 KODLU BİLEŞİK
β-sitosterol 3-O-β-D-glukopiranozit C35H60O6
MA: 576 g/mol
PM-3 kodlu bileşik beyaz kristalimsi bir yapıda izole edildi. Madde U254 ve
UV366 nm’de renk vermezken, H2SO4/vanilin reaktifi püskürtülünce (105°C) pembe
renk vermektedir. Maddenin yapısı bitkiler tarafından yaygın bir şekilde sentezlenen glukosterol olan β-sitosterol 3-O-β-D-glukopiranozit olarak karakterize edildi.
31
Şekil 4. 11. PM-3’ün (β-sitosterol 3-O-β-D-glukopiranozit) 1H-NMR spektrumu
32
Şekil 4. 12. PM-3’ün (β-sitosterol 3-O-β-D-glukopiranozit) 13C-NMR spektrumu
33
4.3. Plantago major Bitkisinin Metanol Ekstresinin MAO-A ve MAO-B İzoenzimleri Üzerine İnhibisyon Etkisinin Belirlenmesi
P. major bitkisinin metanol ekstresinin MAO-A ve MAO-B izoenzimleri
üzerine inhibisyon etkileri belirlendi. Bu amaçla oluşturulan inhibitör konsantrasyonuna karşı % Aktivite grafikleri MAO-A için Şekil 4.12’de, MAO-B için Şekil 4.13’de verilmiştir. Grafiklerden elde edilen IC50 değerleri Çizelge 4.3’de
verilmiştir.
Şekil 4. 13. Metanol ekstresi MAO-A enzimi için % aktivite-[I] grafiği
y = 100e-318,7x R² = 0,8858 0 20 40 60 80 100 120 0 0,001 0,002 0,003 0,004 0,005 % Akt iv ite (490n m ) Konsantrasyon (µg/mL)
34
Şekil 4. 14. Metanol ekstresi MAO-B enzimi için % aktivite-[I] grafiği
Çizelge 4. 3. Aktivite-[I] grafiklerinden elde edilen IC50 değerleri
İnhibitör MAO-A için IC50 (μg/mL) R2 MAO-B için IC50 (μg/mL) R2 Metanol Ekstresi 2,1747 0,8858 21,05103 0,8966 y = 100e-32,92x R² = 0,8966 0 10 20 30 40 50 60 70 80 90 100 0 0,01 0,02 0,03 0,04 0,05 % Akt iv ite (490n m ) Konsantrasyon (µg/mL
35
5. TARTIŞMA VE SONUÇ
Major depresif bozukluğu olan kişilerin önemli bir kısmı, serotonin inhibitörleri gibi genel olarak reçete edilen ilaçlara yeterince yanıt vermez. Bu nedenle her geçen gün yeni ve daha etkili antidepresanlar araştırılmaktadır (Vina et al. 2012). MAO-A inhibitörleri içeren bitkiler ve bitkisel preparatlar, depresyon gibi nöropsikiyatrik hastalıkların tedavisinde etkili bir alternatif olarak yaygın şekilde kullanılmaktadır. MAO-B inhibitörleri, sadece dopaminerjik nörotransmisyonu arttırmakla kalmaz, aynı zamanda Parkinson hastalığında kullanılmaları nedeniyle nöron denaturalizasyon sürecini hafifleterek toksin ve serbest radikal oluşumunu önler (Vina et al. 2012).
Bu çalışmada tıbbi bir bitki olan P. major’un metanol ekstresinin MAO-A ve MAO-B izoenzimleri üzerine inhibisyon etkileri araştırıldı. Çalışmanın deneysel sonuçları değerlendirildi ve MAO-A ve MAO-B izoenzimleri için IC50 değerleri
sırasıyla 2,1747 μg/mL (R2=0,8858) ve 21,05103 μg/mL (R2=0,8966) olarak
hesaplandı. Elde edilen bu sonuçlara göre, güçlü bir monoamin oksidaz inhibitörü olan pargyline (IC50 değerleri MAO-A ve MAO-B izoenzimleri için sırasıyla 4,5 µM ve
0,22 µM) ile kıyaslandığında bitkinin metanol ekstresinin güçlü bir A ve MAO-B inhibitörü olduğu saptandı (Takao et al. 2019).
Doğal ürünler yeni terapotik hedeflerin belirlenmesinde önemli rol oynamaktadır. Piyasada kullanılan mevcut ilaçların yan etkilerinin fazla olması nedeniyle yeni MAO inhibitörlerine ihtiyaç duyulmaktadır. Bu bağlamda doğal ürünler araştırmacılar için yeni ilaç hammaddesi kaynakları olarak büyük ilgi görmektedir. Çalışmamızda P. major bitkisinin güçlü MAO-A ve MAO-B inhibitörü olduğu ilk defa tespit edilmiştir.
Çalışmamızın diğer bir amacı kapsamında P. major bitkisinin aseton ekstresinin fitokimyasal araştırması yapıldı. Bu çalışmada P. major’dan biri ilk defa olmak üzere bilinen üç bileşik saflaştırıldı. Saflaştırılan bileşiklerden uzun zincirli bir alkol olan PM-1 kodlu n-pentatriakontanol, P. major’dan ilk defa izole edildi. Yapılan literatür taramasında bileşik daha önce Peltophorum vogelianum (Benth.) bitkisinden saflaştırılmıştır (Parveen et al. 2010).
36
P. major’un aseton ekstresinden saflaştırılan ikinci bileşik PM-2 olarak
kodlanan triterpenik yapıdaki ursolik asittir. Doğada fesleğen, biberiye ve adaçayı gibi bitkilerde ve elma, armut gibi meyvelerde yaygın olarak bulunan ursolik asit çeşitli farmakolojik etkilere sahiptir. Son yıllarda yapılan çalışmalarda ursolik asitin antikanser, antiobezite, nörodejeneratif ve diğer bazı hastalıklara karşı farmakolojik etki gösterdiği saptanmıştır (Mancha-Ramirez et al. 2016; Katashima et al. 2017; Iqbal
et al. 2018; Yin et al. 2018; Solomon 2019). D-galaktozun neden olduğu
nörodejeneratif değişikliklerde, ursolik asitin antioksidan ve antienflamatuar mekanizmalar yoluyla terapötik potansiyel gösterdiği saptanmıştır (Lu et al. 2010). Ursolik asitin MAO-A ve MAO-B izoenzimleri ile ilişkisini araştırmak üzere docking metoduyla yapılan bir çalışmada MAO-A ile belirgin olarak bağlanma afinitesi gösterdiği saptanmıştır (Singla et al. 2017). Başka bir çalışmada ursolik asitin MAO-A, MAO-B ve dopamin-β hidroksilaz enzimleri üzerine inhibisyon etkileri araştırılmış ve önemli dopamin-β hidroksilaz inhibisyonu gösterdiği saptanmıştır. Bu çalışmada ursolik asitin MAO-B’yi zayıf inhibe ettiği, MAO-A’yı ise inhibe etmediği ortaya çıkarılmıştır (Kim et al. 2012).
Bu tez çalışmasında P. major bitkisinin güçlü monoamin oksidaz inhibitörü olduğu ilk defa belirlendi. Bununla birlikte bitkiden izole edilen ursolik asitin literatürde zayıf monoamin oksidaz inhibisyonu gösterdiği rapor edilmiştir. Ursolik asit P. major’da bulunan marker bileşiklerden biridir (Kartini et al. 2014). Bitki ekstresinin bitkide bulunan major bir bileşikten daha fazla aktivite göstermesi bitkideki bileşenlerin sinerjik etkisinden kaynaklandığı sonucunu doğurmaktadır. Diğer taraftan P. major’un aseton ve metanol ekstrelerinin İTK ile farklı polaritelerde yürütülmesi ile elde edilen sonuçlara göre, özellikle CHCl3:MeOH (80:20) çözücü
sisteminde metanol ekstresine gelen bazı metabolitler aseton ekstresine gelmemiştir. Bu durum bize iki ekstrede farklı sekonder metabolitlerin bulunduğunu kantitatif olarak göstermiştir. Çalışmada aseton ekstresi üzerinden izolasyon yapılmıştır. Bu durum bize bir sonraki aşamada metanol ekstresi üzerinden izolasyon yapılması fikrini vermiştir. Ayrıca metanol ekstresinden saflaştırılacak metabolitlerin de monoamin oksidaz enzim inhibitörü olma özelliklerinin araştırılmasına yönlendirmiştir.
37
Saflaştırılan PM-3 kodlu bileşik bir bitki glukosterolü olan β-sitosterol 3-O-β-D-glukopiranozittir. Bitkilerde yaygın olarak bulunan bu bileşik çeşitli farmakolojik aktivitelere sahiptir.
P. major bitkisinin literatürde birçok biyolojik aktivitesi araştırılmıştır. Bu
çalışma ile ilk defa P. major’un MAO-A ve MAO-B inhibitörü olabileceği belirlendi. Çalışmamız bu açıdan değerlendirildiğinde P. major’un özgün ve yeni bir özelliği ortaya çıkarılmış oldu.
38 KAYNAKLAR
Ahmed, Z.F., Hammouda, F.M., Rizk, A.M. and Wassel, G.M., 1968. Phyochemical studies of egyptian Plantago species. Planta Medica, 4, 404–410.
Bianco, A., Guiso, M., Passacantilli, P. and Francesconi, A., 1984. Iridoid and phenylpropanoid glycosides from new sources. Journal of Natural Products, 47, 901–902.
Bhakuni, D.S., Bittner, M., Marticorena, C., Silva, M., Weldt, E. and Hoeneisen, M., 1976. Screening of Chilean plants for anticancer activity. Lloydia, 39, 225– 243.
Ca´ceres, A., Giron, L.M., and Martinez, A.M., 1987. Diureticactivity of plants used for the treatment of urinary ailmentsin guatemala. Journal of Ethnopharmacology, 19(3), 233-245.
Campos, A.M. and Lissi, E.A. 1995. Evaluation of the antioxidantcapacity of herbal teas by a procedure based on thebleaching of ABTS radical cations. Boletin de la Sociedad Chilena de Quimica, 40, 375-381.
Caro, D.C., Rivera, D.E. Ocampo, Y. Franco, L.A. and Salas. R.D., 2018. Pharmacological Evaluation of Mentha spicata L. and Plantago major L., Medicinal Plants Used to Treat Anxiety and Insomnia in Colombian Caribbean Coast. Evidence-Based Complementary and Alternative Medicine, 2018, 1-7.
Doan, D.D., Nguyen, N.H., Doan, H.K., Nguyen, T.L., Phan TS , van Dau N, Grabe M, Johansson R, Lindgren G, Stjernström N.E., 1992. Studies on the individual and combined diureticeffects of four Vietnamese traditional hermal remedies (Zea mays, Imperata cylindrica, Plantago major and Orthosiphon
stamineus). Journal of Ethnopharmacology, 36(3), 225-231.
Galvez, M. Martin-Cordero, C. Lopez-Lazaro, M. Cortes, F. and Ayuso, M.J. 2003. Cytotoxic effect of Plantago spp. on cancer cell lines. Journal of Ethnopharmacology, 88(2-3), 125-130.
39
Goncalves, S. and Romano. A. 2016. The medicinal potential of plants from the genus
Plantago (Plantaginaceae), Industrial Crops and Products, 83, 213-226.
Guvenalp, Z. Kilic, N. Kazaz, C. Kaya, Y. Demirezer, L.O. 2006. Chemical Constituents of Galium tortumense. Turk Journal of Chemistry, 30, 515-523.
Haddadian, K., Haddadian, K. and M. Zahmatkash. 2014. A review of Plantago plant, Indian Journal of Traditional Knowledge, 13, 681-85.
Handjieva, N., Spassov, S., Bodurova, G., Saadi H., Popov, S., Pureba, O. and Zamjansana, J., 1991. Majoroside, an iridoid glucoside from Plantago major. Phytochemistry, 30, 1317-1318.
Harborne, J.B. and Williams, C.A. 1971. 6-Hydroxyluteolin and scutellarein as phyletic markers in higher plants. Phytochemistry, 10, 367–378.
Holt, A. Sharman, D.F. Baker, G.B. and Palcic, M.M. 1997. A continuous spectrophotometric assay for monoamine oxidase and related enzymes in tissue homogenates. Analytical Biochemistry, 244 (2), 384-392.
Iqbal, J. Abbasi, B. A. Ahmad R., Mahmood, T., Kanwal, S., Ali, B., Khalil A.T., Shah, S.A., Alam, M.M. and Badshah, H., 2018. Ursolic acid a promising candidate in the therapeutics of breast cancer: currentstatus and future implications. Biomedicine & Pharmacotherapy, 108, 752–756.
Jime´nez, C. and Riguera, R., 1994. Phenylethanoid glycosides in plants: structure and biological activity. Natural Product Report, 11, 591-606.
Jonsson, S., 1983. Blomsterboken. Markens Urter, Lyng og Trær. Teknologisk Forlag, Oslo.
Karamanoğlu, K. 1977. Farmasötik Botanik Ders Kitabı, Baskı. Ankara Üniversitesi Eczacılık Fakültesi Yayınları.
Kartini, S. Piyaviriyakul, P. Siripongc, O. Vallisuta, 2014. HPTLC simultaneous quantification of triterpene acids for quality control of Plantago major L. and
40
evaluation of their cytotoxic and antioxidant activities. Industrial Crops and Products, 60, 239–246.
Katashima, C. K. Silva, V. R. Gomes, T. L. Pichard C., and Pimentel, G. D. 2017. Ursolic acid and mechanisms of actions onadipose and muscle tissue: a systematic review. ObesityReviews, 18(6), 700–711.
Kawada, T., Yoneda, Y., Asano, R., Kan-No, I., Schmid, W., 2006. Synthesis ofplantamajoside, a bioactive dihydroxyphenylethyl glycosides from Plantagomajor L. Holzforschung 60, 492–497.
Kawashty, S. A. Gamal-el-din, E. Abdalla, M. F. Saleh, N.A.M. 1994. Flavonoids of Plantago species in Egypt. Biochemical Systematics and Ecology, 22, 729– 733.
Kim, J.H. Kim, G.H. and Hwang, K.H. 2012. Monoamine Oxidase and Dopamine b-Hydroxylase Inhibitors from the Fruits of Gardenia jasminoides. Biomol Ther 20(2), 214-219.
Kolak, U., M. Boga, E. A. Urusak, and A. Ulubelen. 2011. 'Constituents of Plantago major subsp intermedia with antioxidant and anticholinesterase capacities', Turkish Journal of Chemistry, 35, 637-645.
Lithander, A., 1992. Intracellular fluid of waybread (Plantago major) as a rophylactic for mammary cancer in mice. Tumor Biology, 13, 138-141.
Long, C., Moulis, C., Stanislas, E., Fouraste´, E., 1995. L%aucuboside et le catapol dans les feuilles de Plantagolanceolata L., Plantago major L. et Plantago
media L. Journal de Pharmacie de Belgique, 50, 484–488.
Lopez-Munguia, A., Herandez-Romero, Y., Pedraza-Chaverri, J., Miranda Molina, A.,Regla, I., Martinez, A., Castillo, E., 2011. Phenylpropanoid glycoside analogues:enzymatic synthesis, antioxidant activity and theoretical study of their free radical scavenger mechanism. Plos One, 6(6), e20115.
41
Lu, J. Wu, D. M. Zheng Y. L. et al., 2010. Ursolic acid attenuates Dgalactose-induced inflammatory response in mouse prefrontal cortex through inhibiting Ma, J. C., M. Yoshimura, E. Yamashita, A. Nakagawa, A. Ito, and T. Tsukihara. 2004. 'Structure of rat monoamine oxidase A and its specific recognitions for substrates and inhibitors. Journal of Molecular Biology, 338, 103-14.
Maksyutina, N.P., 1971. Hydroxycinnamic acids of Plantago major and Pl.
lanceolata, Chemistry of Natural Compounds, 7, 795.
Mancha-Ramirez A. M. and Slaga, T. J. 2016. Ursolic acid andchronic disease: an overview of UA’s effects on preventionand treatment of obesity and cancer. Advances in Experimental Medicine and Biology, 928, 75-96.
Mello, Joyce C., Mariano V.D., Gonzalez, Vivian W.R., Moraes, Tatiana Prieto, Nascimento, O.R. and Rodrigues, T., 2015. Protective effect of Plantago major extract against t-BOOH-Induced mitochondrial oxidative damage and cytotoxicity, Molecules, 20, 17747-17759.
Murai, M., Tamayama, Y. and Nishibe, S., 1996. Phenylethanoids in the herb of
Plantago lanceolata and inhibitory effect on arachidonic acid-induced mouse
ear edema. Planta Medica, 61, 479–480.
Nair, N.P., Ahmed, S.K. and Kin, N.M., 1993. Biochemistry and Pharmacology of Reversible Inhibitors of MAO-A Agents-Focus on Moclobemide. Journal of Psychiatry & Neuroscience, 18, 214-25.
Nishibe, S. Murai, M. and Tamayama, Y. 1995. Studies on constituents of plantaginis herba 7: Flavonoids from Plantago asiatica and P. augustifolia. Natural Medicines, 49, 340–342.
Noro, Y., Hisata, Y., Okuda, K., et al., 1991. Pharmacognosticalstudies of Plantaginis
herba (VII) on thephenylethanoid contents of Plantago spp. Japanese Journal
42
Pailer, V.M. and Haschke-Hofmeister, E., 1969. Inhaltstoffe aus Plantago major. Planta Medica 17, 139-145.
Parveen, M., R. M. Ghalib, Z. Khanam, S. H. Mehdi, and M. Ali. 2010. A novel antimicrobial agent from the leaves of Peltophorum vogelianum (Benth.). Natural Product Research, 24, 1268-1273.
Pei, S., Yang, X., Wang, H., Zhang, H., Zhou, B., Zhang, D. and Lin, D., 2015. Plantamajoside, a potential anti-tumor herbal medicine inhibits breast cancer growth and pulmonary metastasis by decreasing the activity of matrix metalloproteinase-9 and-2. BMC Cancer, 15(1), 965.
Ponce-Macotela, M., Navarro-Alegria, I., Matinez-Gordillo, M.N. and Alvarez-Chacon, R., 1994. In vitro antigiardiasicactivity of plant extracts. La Revista de Investigacio´nClı´nica, 46, 343-347.
Ravn, H.W., Mondolot, L. Kelly, M.T. and Lykke, A.M., 2015. Plantamajoside-A current review. Phytochemistry Letters, 12, 42-53.
Ringbom, T., Segura, L., Noreen, Y., Perera, P. and Bohlin, L., 1998. Ursolic acid from Plantago major, a selective inhibitor of cyclooxygenase-2 catalyzed prostaglandin biosynthesis. Journal of Natural Products, 61, 1212-1215.
Rojas, I.R., 1968. Contribucion al estudio quimico del llanten(Plantago major L.). Anales de la Facultad de Quimicay Farmacia, 20, 146-150.
Sahoo, A., Yabanoglu, S., Sinha, B. N., Ucar, G., Basu, A. and Jayaprakash V., 2010. Towards development of selective and reversible pyrazoline based MAO-inhibitors: Synthesis, biological evaluation and docking studies. Bioorganic & Medicinal Chemistry Letters, 20, 132-36.
Samuelsen, A.B. 2000. The traditional uses, chemical constituents and biological activities of Plantago major L. A review. Journal of Ethnopharmacology, 71,1-21.
43
Samuelsen, A.B., Cohen, E.H., Paulsen, B.S., Brüll, L.P. and Thomas-Oates, J.E., 1999. Structural studies of a heteroxylan from Plantago major L. seeds by partial hydrolysis, HPAEC-PAD, methylation and GC–MS, ESMS and ESMS/MS. Carbohydrate research, 315(3-4), 312-318.
Samuelsen, A.B. Paulsen, B.S. Otsuka, H. Kiyohara, H. Yamada, H. and Knutsen, S.H. 1996. Characterization of a biologically active pectin from Plantago major L. Carbohydrate Polymers, 30, 37-44.
Samuelsen, A.B. Paulsen, B.S. Wold, J.K. Otsuka, H. Yamada, H. and Espevik, T., 1995. Isolation and partial characterization of biologically active polysaccharides from Plantago major L. Phytotherapy Research, 9, 211–218.
Samuelsen, A.B. Paulsen, B.S. Wold, J.K. Knutsen, S.H. and Yamada, H. 1998. Characterization of a biologically active arabinogalactan from the leaves of
Plantago major L. Carbohydrate Polymers, 35, 145-153.
Schmidt, K. Li, Z. Schubert, B. Huang, B. Stoyanova, S. Hamburger, M. 2003. Screening of entomopathogenic deuteromycetes for activities on targets involved in degenerative diseases of the central nervous system. Journal of Ethnopharmacology, 89 (2-3), 251-260.
Schneider, G., 1990. Arzneidrogen, Ein Kompendium fürPharmazeuten, Biologien und Chemiker. Wissenschaftsverlag, Mannheim, Germany, p. 131.
Sharifa, A.A., Jamaludin, J., Kiong, L.S., Chia, L.A. and Osman, K., 2012. Anti-Urolithiatic Terpenoid Compound from Plantago major Linn. (Ekor Anjing) Aktiviti Anti-Urolitiatik Sebatian “Terpenoid” daripada Plantago major Linn. (Ekor Anjing). Sains Malaysiana, 41, 33-39.
Singla, R.K. Scotti, L. and Dubey, A.K. 2017. In Silico Studies Revealed Multiple Neurological Targets for the Antidepressant Molecule Ursolic Acid. Current Neuropharmacology. 15 (8), 1100-1106.
44
Smolenski, S.J., Silinis, H., Farnswoth, N.R., 1974. Alkaloid Screening. IV. Lloydia 37, 30–61.
Solomon, H., 2019. Antioxidant and Anti-inflammatory Mechanisms of Neuroprotection by Ursolic Acid: Addressing Brain Injury, Cerebral Ischemia, Cognition Deficit, Anxiety, and Depression. Hindawi Oxidative Medicine and Cellular Longevity, 2019 (1-18).
Srivastava, V., Negi, A.S., Kumar, J.K., Gupta, M.M. and Khanuja, S.P.S., 2005. Plant-based anticancer molecules: A chemical and biological profile of some important leads. Bioorganic & Medicinal Chemistry, 13(21), 5892-5908.
Swiatek, K., Kurowska, A. and Gora, J., 1980. Chemical composition of some
Plantago species seed oil. Herba Polonica 4, 213-217.
Takao, K., Shiori, U., Kamauchi, H. and Sugita, Y. 2019. Design, synthesis and evaluation of (indolylmethylidene)-2,3-dihydro-1-benzofuran-3-one and 2-(indolyl)-4H-chromen-4-one derivatives as novel monoamine oxidases inhibitors. Bioorganic Chemistry, 87, 594-600.
Taskova, R., Handjieva, N., Evstatieva, L. and Popov, S., 1999. Iridoid glucosides from Plantago cornuti, Plantago major and Veronica cymbalaria. Phytochemistry, 52, 1443–1445.
Tipton, K.F. 1986. Enzymology of Monoamine-Oxidase. Cell Biochemistry and Function, 4, 79-87.
Vina, D., Serra, S. Lamela, M. and Delogu, G, 2012. Herbal Natural Products As a Source of Monoamine Oxidase Inhibitors: A Review. Current Topics in Medicinal Chemistry, 12, 2131-2144.
Vindis, C., Seguelas, M.H. Bianchi, P. Parini and A. Cambon. C., 2000. Monoamine oxidase B induces ERK-dependent cell mitogenesis by hydrogen peroxide generation. Biochemical and Biophysical Research Communications, 271, 181-185.
45
Weenen, H., Nkunya, M.H.H., Bray, D.H., Mwasumbi, L.B.,Kinabo, L.S., Kilimali, V.A.E.B., 1990. Antimalarial activityof Tanzanian medicinal plants. Planta Medica 56, 368-370.
Weyler, W., Hsu., Y.P.P. and Breakefield X.O., 1990. Biochemistry and Genetics of Monoamine-Oxidase. Pharmacology & Therapeutics, 47, 391-417.
Yaremenko, K.V., 1990. Adaptogens of the natural origin inprophylactyc oncology. Journal of Cancer Research and Clinical Oncology, 116, 82.
Yesilada, E., Sezik, E., Fujita, T., Tanaka, S. and Tabata, M., 1993. Screening of some Turkish medicinal plants for theirantiulcerogenic activities. Phytotherapy Research, 7, 263-265.
Yin, R., Li, T., Tian, J.X., Xi, P. and Liu, R.H. 2018. Ursolic acid, apotential anticancer compound for breast cancer therapy. Critical Reviews in Food Science and Nutrition, 58(4), 568–574.
46 ÖZGEÇMİŞ
Kişisel Bilgiler
Adı Soyadı Memet AKBAŞ
Doğum Yeri ve Tarihi 26.11.1977
Eğitim Durumu
Lisans Öğrenimi İstanbul Üniversitesi Eczacılık Fakültesi Anadolu Üniversitesi Uluslararası İlişkiler
Yüksek Lisans Öğrenimi Ahmet Yesevi Üniversitesi Siyaset ve Kamu Yönetimi (Tezsiz)
Bildiği Yabancı Diller İngilizce Bilimsel Faaliyetler
İş Deneyimi
Stajlar Eczacılık Stajları
Projeler Sağlıklı Yöresel Süt ve Süt Ürünlerinin Üretim Teknikleri
Çalıştığı Kurumlar Eczane Eczacılığı, Eczacı Odası Ağrı İl Temsilciliği, Ağrı Sanayici ve İş Adamları Derneği Başkanlığı, Serhat Sanayici ve İş Adamları Federasyonu Başkanlığı, Türkiye Sanayici ve İş İnsanları Konfederasyonu Yönetim Kurulu Üyeliği, Serhat Kalkınma Ajansı Kalkınma Kurulu Kâtip Üyeliği ve Kalkınma Kurulu Başkanlığı, Sosyal Yardımlaşma ve Dayanışma Vakfı Mütevelli Üyeliği, Tema Vakfı Ağrı İl Temsilciliği
İletişim E-posta Adresi memetakbas@hotmail.com
Mezuniyet Tarihi 2019