T.C.
KASTAMONU ÜNİVERSİTESİ
FEN BİLİMLERİ ENSTİTÜSÜ
TUNUS’TA BULUNAN SIĞIRLARIN (BOS TAURUS TAURUS
LINNAEUS, 1758) İŞKEMBE SİLİYAT (PROTISTA:
CILIOPHORA) FAUNASI
Ali Fouzi Otman Elhadi DAW
Danışman Doç. Dr. Gözde GÜRELLİ Jüri Üyesi Dr. Öğr. Üyesi Zafer SANCAK Jüri Üyesi Dr. Öğr. Üyesi İlkay ÇORAK ÖCAL
YÜKSEK LİSANS TEZİ BİYOLOJİ ANA BİLİM DALI
ÖZET
Yüksek Lisans
TUNUS’TA BULUNAN SIĞIRLARIN (BOS TAURUS TAURUS LINNAEUS, 1758) İŞKEMBE SİLİYAT (PROTISTA: CILIOPHORA) FAUNASI
Ali Fouzi Otman Elhadi DAW Kastamonu Üniversitesi Fen Bilimleri Enstitüsü Biyoloji Ana Bilim Dalı Danışman: Doç. Dr. Gözde GÜRELLİ
Bu çalışmada, Tunus’taki 16 evcil sığırın (Bos taurus taurus Linnaeus, 1758) işkembe siliyat faunası araştırılmıştır. Sonuç olarak, 9 cinse dahil 17 tür ve 10 morfotip tespit edilmiştir. Onaltı evcil sığırın işkembe içeriğindeki ortalama siliyat
yoğunluğu 102,2 ± 36,6 ×104 hücre ml−1’dir. Değerler 48,6 ile 156,9×104 hücre ml−1
arasında değişiklik göstermektedir. Yeni bir tür tespit edilememiştir. İncelenen 16 evcil sığırın işkembesindeki siliyat türlerinin çoğunluğunu %14 ile %100 bulunma oranı ile Entodinium türleri oluşturmaktadır. Bu çalışmada en düşük görülme sıklığına sahip olan tür, Hsiungia triciliata (%6)’dır. Her bir sığırdeki tür sayısı 8,0 ± 3,2 (SD) ortalamayla, 5 ile 14 arasında değişiklik göstermektedir.
Anahtar kelimeler: Siliyat, sığır, işkembe, fauna, Tunus. 2018, 26 sayfa
ABSTRACT
MSc. Thesis
RUMEN CILIATE (PROTISTA: CILIOPHORA) FAUNA OF CATTLE (BOS
TAURUS TAURUS, 1758) IN TUNUSIA
Ali Fouzi Otman Elhadi DAW Kastamonu University
Institute of Science Department of Biology
Supervisor: Assoc. Prof. Dr. Gözde GÜRELLİ
In this study rumen ciliate fauna of domestic cattle (Bos taurus taurus Linnaeus, 1758) living in Tunisia was surveyed. As a result, seventeen species and ten morphotypes in nine genera were identified. The average density of ciliates in the
rumen contents from 16 domestic cattle was 102,2 ± 36,6×104 cells ml−1.Values
ranged from 48,6 to 156,9×104 cells ml−1. No new species is detected in this study.
Most ciliates found in all 16 animals were Entodinium species, which vary from 14% to 100% of the total protozoa. Species that had the lowest frequency of appearance in this study was Hsiungia triciliata 6%. For individual cattle, the total number of species ranged from 5 to 14, with an average of 8,0 ± 3,2 (SD).
Keywords: Ciliate, cattle, rumen, fauna, Tunusia. 2018, pages 26
TEŞEKKÜR
Tez çalışmam esnasındaki faydalı yorumları, görüşleri ve katılımı için, danışmanım Doç. Dr. Gözde GÜRELLİ’ye teşekkürlerimi sunuyorum. Ayrıca, numunelerin toplanması esnasında bana yardımcı olan herkese teşekkür ediyorum. Dahası, aileme teşekkür ediyorum. Uyumlu olmamı sağlayarak ve parçaları bir araya getirmeme yardımcı olarak, bütün süreç boyunca beni destekleyen sevdiklerime teşekkür ediyorum.
Ali Fouzi Otman Elhadi DAW Kastamonu, Mayıs, 2018
İÇİNDEKİLER Sayfa ÖZET………. iv ABSTRACT……….. v TEŞEKKÜR……….. vi İÇİNDEKİLER……….. vii FOTOĞRAF DİZİNİ………. viii TABLO DİZİNİ………. ix 1. GİRİŞ………. 1 2. MARTERYAL VE YÖNTEM……….. 4 3. SONUÇ……….. 5 4. TARTIŞMA………... 15 KAYNAKLAR……….. 22 ÖZGEÇMİŞ………... 26
FOTOĞRAFLAR DİZİNİ
Sayfa
Fotoğraf 3.1. MFS uygulanmış örnekler. a. Entodinium longinucleatum (sağ
taraftan). b. Entodinium simulans m. lobosospinosum (sol taraftan). c. Entodinium simulans m. dubardi (sol taraftan). d.
Entodinium simulans m. caudatum (sağ taraftan)... 8
Fotoğraf 3.2. MFS uygulanmış örnekler. a. Entodinium nanellum (sağ
taraftan). b. Entodinium exiguum (sağ taraftan). c. Entodinium
minimum (sol taraftan). d. Entodinium dilobum (sağ taraftan)... 9
Fotoğraf 3.3. MFS uygulanmış örnekler. a. Entodinium simplex (sağ taraftan).
b. Entodinium bursa (sol taraftan) c. Epidinium ecaudatum m. ecaudatum (sol taraftan).d. Epidinium caudatum m. caudatum (sol taraftan)... 10
Fotoğraf 3.4. MFS uygulanmış örnekler. a. Epidinium ecaudatum m.
bicaudatum (sağ taraftan). b. Epidinium caudatum m. tricaudatum (sağ taraftan). c. Epidinium ecaudatum m. quadricaudatum (sağ taraftan). d. Epidinium ecaudatum m.chattanei (sağ taraftan)... 11
Fotoğraf 3.5. MFS uygulanmış örnekler. a. Hsiungia triciliata. b. Hsiungia
triciliata. c. Diplodinium rangiferi (sağ taraftan). d. Diplodinium rangiferi (sol taraftan)... 12
Fotoğraf 3.6. MFS uygulanmış örnekler. a. Isotricha prostoma. b. Isotricha
intestinalis. c. Dasytricha ruminantium. d. Enoploplastron
triloricatum (sağ taraftan)……….. 13
Fotoğraf 3.7. MFS uygulanmış örnekler. a. Ophryoscolex purkynjei m.
purkynjei (sağ taraftan). b. Polyplastron multivesiculatum (sağ
TABLOLAR DİZİNİ
Sayfa
Tablo 3.1. Tunus’taki 16 evcil sığırın işkembe içeriklerindeki siliyat
yoğunluğu... 5
Tablo 3.2 Tunus’taki 16 evcil sığırın işkembe içeriğindeki siliyatların
görülme sıklığı ve bulunma oranı... 6 Tablo 4.1. Tunus ve diğer ülkelerdeki sığırların işkembe içeriklerindeki
toplam siliyat yoğunluğu ve siliyat cinslerinin, türlerinin ve
morfotiplerinin toplam sayısının dağılımı... 15
Tablo 4.2. Tunus ve diğer ülkelerdeki evcil sığırların işkembe içeriğinde
1. GİRİŞ
İnsanların tükettiği süt ürünlerinin kaynağı geviş getiren hayvanlardan gelir. Bu hayvanlardan tarafından üretilen proteinlerin, sindirim kanalı dahilin de ve özellikle de işkembede meydana gelen mikrobiyal etkinlikler ile büyük bir ilişkisi vardır (Hungate, 1955; Kreier ve Baker, 1987).
Memeliler arasındaki en karmaşık midenin geviş getirenlerde bulunduğu bilinmektedir; geviş getirenlerin dört mide bölümünden; işkembe, retikulum, omasum ve abomasum, oluşan eşsiz bir sindirim sistemleri vardır (Hungate, 1966). Eşsiz sindirim sistemine ek olarak, işkembe otları ve kaba bitkileri parçalayabilecek milyonlarca küçük mikroorganizma ile doludur. İşkembedeki mikroorganizma aktiviteleri bilim insanlarına ilginç gelmiş ve onlar da bu konuyu farklı bakış açılarından incelemiştir (Ogimoto ve Imai, 1981; Williams ve Coleman, 1992). İşkembede, birbirinden oldukça farklı olan 3 fauna grubu yaşamaktadır. Bunlar bakteriler, funguslar ve protozoonlardır. Protozoonlar, kamçılılar ve siliyatlardan oluşur, fakat yoğunluk siliyatlardadır (Mackie, McSweeney ve Klieve, 2002).
İşkembede yaşayan siliyatler ile ilgi pek çok taksonomik, morfolojik ve fizyolojik araştırma yapılmıştır (Coleman, Laurie ve Bailey, 1977; Hungate, 1978; Göçmen ve Gürelli, 2009; Gürelli, 2014). Bu çalışmalar sayesinde, siliyatların bir nitrojen kaynağı olarak konağın beslenmesi için faydalı oldukları kanıtlanmıştır (Hungate, 1978). Siliyatlarda üreme, konjugasyon ile eşeyli olarak ve ikiye bölünme ile eşeysiz olarak gerçekleşir (Dogiel, 1925a). Siliyatler, işkembe içerisinde bölünerek her gün sayılarını ikiye katlamaktadır (Hungate, 1966).
Siliyatlar sayı olarak artmalarının yanı sıra konaklarının sindirim sisteminin arka tarafına taşınmaktadır, abomasum ve ince bağırsak içerisinde bir nitrojen kaynağı olarak sindirilirler. Siliyatler, salgıladıkları çeşitli karbohidraz ve proteolitik enzimler sayesinde selüloz dahil olmak üzere karbonhidrat ve proteinin sindirimine katkıda bulunurlar (Coleman ve Laurie, 1974a; Williams, 1979b, Shinchi, Itoh, Abe ve
Kandatsu, 1986; Shinchi ve Abe, 1987, Göçmen, 1993, 1999a; Göçmen ve Öktem, 1999).
Konağın beslenme ve fizyolojik tutumunun yanı sıra, siliyatler işkembenin durumunu öğrenmek için bir gösterge olarak kullanılabilirler. Siliyatlarin, tek hücreli organizmalar arasındaki en karmaşık yapıya sahip olan ve başka bir türe benzemeyen bir grup olduğu ifade edilmiştir (Ogimoto ve Imai, 1981).
İşkembe siliyatlarının hepsi anaerob’durlar, hiçbiri patojenik değildir. Patojenik olmayan bu canlılar endosimbiyont olarak bilinmektedirler (Hungate, 1955; Williams, 1986). Konağın besin tipinde veya fizyolojik tutumunda ani bir değişim gibi bir dış uyarıcı mevcut değilse, sağlıklı bir hayvanın işkembe içeriğindeki siliyat sayısı, ml olarak, koşullara bağlı olarak 100,000 ve 1,000,000 arasında değişiklik göstermektedir (Ogimoto ve Imai, 1981; Dehority, 1986a).
Hayvanın beslendiği yiyeceğin türü, miktarı, işkembe PH değeri, hacim oranı ve beslenme sıklığı, işkembedeki siliyat tek hücrelilerin yoğunluğunu ve yapısını etkileyen nedenleri oluşturur (Franzolin ve Dehority, 1996).
Siliyatların konaktan konağa aktarımı, yakın veya doğrudan temasa bağlıdır (Ogimoto ve Imai, 1981). Anne yada baba yavrusunu yaladığı zaman, geviş getirme eylemi ile ağza gelen siliyatlar, salya salgısı yoluyla yavruya geçer (Becker ve Hsiung, 1929).
İşkembe siliyatlerının kompozisyonu, filogenetik faktörler ve konaklarının dağılımı ile kontrol edilmektedir (Dogiel, 1927, 1947). Dahası, konağın beslenme alışkanlığı, beslenme türü, beslenme miktarı ve fizyolojik tutumu işkembe kompozisyonunu etkileyen unsurlardır (Giesecke, 1970; Ogimoto ve Imai, 1981). Son olarak, bazı işkembe siliyat türleri arasında görülen antagonizmin fauna içeriğini belirleyen bir unsur olduğu ifade edilmiştir (Eadie, 1956, 1967).
İşkembede yaşayan siliyat türlerinin sayısı ve her bir türün populasyonu oldukça fazladır (Hungate, 1955; Ogimoto ve Imai, 1981; Williams, 1986). Bilhassa herhangi bir konağın işkembesinde pek çok farklı siliyat türü bulunsa da, bazen bir veya
birkaç siliyat türü de bulunabilir. Bu durum özellikle, aç kalma veya asit zehirlenmesi gibi beslenmeye ilişkin bir stres türüne maruz kalan hayvanlarda görülmektedir. Bazı siliyat türleri veya bütün siliyat türleri bu koşullar altında uzaklaştırılabilir (Williams ve Coleman, 1988, 1992).
Siliyatların, işkembe ekosistemindeki diğer mikroorganizmalarla ve bilhassa bakteriler ile muntazam bir ilişkisi vardır (Hungate, 1972). Bu simbiyotik ilişkiden dolayı, saf siliyat kültürlerinin elde edilmesi açısından zorluklar bulunmaktadır (Ogimoto ve Imai, 1981).
Diğer mikroorganizmalar gibi siliyatler, biyolojik verimliliğin yüksek olduğu yaşam alanlarında daha bol bulunma eğilimindedir (Fernández-Galiano T, Serrano ve Fernández-Galiano D., 1985). Dolayısıyla, bu açıdan bakıldığında, işkembe muhtemelen dünyadaki en yüksek biyolojik verimliliğe sahip olan küçük bir ekosistemdir (Lynn, 2008).
Günümüze kadar, işkembe siliyatları ile ilgili sayısız taksonomik, morfolojik ve fizyolojik araştırma gerçekleştirilmiştir (Fried, Weber, Ludwig, McEwan, Newbold, Michalowski ve Schleifer., 2005). Bu sebeple, işkembe siliyatları Vestibuliferida ve Entodiniomorphida olmak üzere iki sınıf olarak incelenmiştir. Vestibuliferida sınıfındaki türlerin sayısı azdır ve evcil ve vahşi geviş getiren hayvanlardaki yaygınlığı düşüktür. Entodiniomorphida sınıfına ait türlerin, evcil geviş getiren hayvanlardaki yaygınlığı çok yüksektir (Fried vd., 2005).
Benqardan, 87/9 doğu boylamı derecesi ve 2/36 kuzey enlemi derecesi arasında Libya sınırı üzerinde, Tunus’un güneydoğusunda bulunmaktadır. 475250 hektarlık bir alana sahiptir. Bu coğrafi çeşitlilik içerisinde, bitkiler, çayırlar, çalılar ve ağaçlar bulunur.
Bu çalışmanın amacı, Tunus’taki evcil sığırların (Bos taurus taurus Linnaeus, 1758) işkembe siliyat faunası ile ilgili bilgi vermek ve elde edilen sonuçları dünya genelinde yapılan diğer araştırmalar ile kıyaslamaktır. Tunus’taki geviş getiren hayvanların işkembe siliyat faunası üzerine herhangi bir araştırma mevcut değildir ve bu çalışma ilk olacaktır.
2. MATERYAL ve YÖNTEM
İşkembe içerikleri, Tunus, Benqardan’daki 16 evcil sığırdan (Bos taurus taurus, 1758) alınmıştır. Benqardan, Libya sınırı üzerinde Tunus’un güneydoğusunda yer alır ve numuneler 2016 yılının Mart ve Ekim ayları arasında toplanmıştır. Numunelerin alındığı evcil sığırların yaşı, 8 ay ve 7 yıl arasında değişiklik göstermektedir. Sığırlar, yeşil otlar ve yem ile beslenmiştir. İşkembe, bir jilet ile derinden kesilerek açılmış ve doğrudan hayvan kesildikten birkaç dakika sonra içerik alınmıştır. İşkembe içeriği %18,5’lik formalin ile sabitlenmiştir (Dehority, 1984). Formalinle sabitlenen numuneler Kastamonu Üniversitesi, Biyoloji Bölümü laboratuarında süzülmüş ve MFS (metil formalin salin) solüsyonu ile boyanmıştır. MFS solüsyonu ile siliyatların nukleusları belirginleştirilmiştir (Göçmen ve Gürelli, 2009).
Mililitredeki toplam siliyat yoğunluğunu belirlemek için Neubauer hemositometresi kullanılmıştır. Hemositometre üzerindeki büyük köşe karelerdeki siliyat sayısı sayılarak, bu hesaplamayla: N=10/4 x a x d (a: köşe karelerdeki siliyat sayısı, d: sulandırma katsayısı) yoğunluk tespit edilmiştir. Her bir siliyatın bir sığırdaki bulunma oranı yayma yöntemi ile hazırlanmış preparatlarda gerçekleştirilen 150-600 hücrelik sayımlardan hesaplanmıştır (Göçmen ve Gürelli, 2009; Gürelli, 2014). Işık mikroskobunda incelemeler için Zeiss mikroskop ve görüntüleme sistemi kullanılmıştır. Sınıflandırma ve türlerin tanımlanması için daha önceki çalışmalardan faydalanılmıştır (Dogiel, 1927; Ogimoto ve Imai, 1981; Öktem, Göçmen ve Torun, 1997; Lynn, 2008).
Elde edilen bütün veriler, copyright © SPSS Inc, 2007, 19.0 sürüm SPSS bilgisayar programı ile istatistiksel olarak analiz edilmiştir.
3. SONUÇLAR
16 evcil sığırın işkembe içeriklerindeki ortalama siliyat yoğunluğu 102,2 ± 36,6 ×104
hücre ml−1 şeklindedir. Değerler 48,6 ile 156,9×104 hücreler ml−1 arasında değişiklik
göstermiştir (Tablo 3.1).
Tablo 3.1. Tunus’taki 16 evcil sığırın işkembe içeriklerindeki siliyat yoğunluğu.
Sığır no. Siliyat yoğunluğu (×104 hücre mL–1)
1 68,5 2 72,5 3 68,8 4 128,6 5 146,5 6 88,6 7 89,5 8 56,2 9 105,6 10 127,5 11 85,6 12 88,6 13 48,6 14 156,9 15 145,8 16 156,5 Ortalama ± SD = 102,2 ± 36,6
Bu çalışmada, 9 cins, 17 tür ve 10 morfotip tanımlanmıştır. Siliyat faunasında ki cinsler Isotricha, Dasytricha, Entodinium, Epidinium, Polyplastron, Enoploplastron,
Ophryoscolex, Diplodinium ve Hsiungia’dır.
İncelenen 16 evcil sığırın işkembesindeki siliyat türlerinin çoğunluğunu %14-%100 görülme sıklığına sahip Entodinium türleri oluşturur. Sığırların çoğunluğu,
Entodinium longinucleatum (%90) ve E. nanellum (%85) türlerini barındırmktadır.
Diğer türlerin görülme sıklığı, %6 ile %85 arasında değişiklik göstermektedir. En düşük görülme sıklığına sahip tür, Hsiungia triciliata (%6)’dır (Tablo 3.2).
Tablo 3.2. Tunus’taki 16 evcil sığırın işkembe içeriğindeki siliyatların görülme sıklığı ve
bulunma oranı.
Cins/tür/ morfotip Görülme sıklığı (%) Bulunma oranı (%)
Ortalama ± SD Ekstr. Isotricha 80 3,3 ± 2,9 0 – 8,8 I. prostoma (Stein, 1858) 80 2,8 ± 2,1 0 – 8,8 I. intestinalis (Stein,1858) 25 0,5 ± 0,8 0 – 2,5 Dasytricha 85 3,4 ± 2,5 0 – 8,5 D.ruminantium (Schuberg, 1888) 85 3,4 ± 2,5 0 – 8,5 Entodinium 100 67,4 ± 23,1 0,4 – 97,5 E. longinucleatum (Dogiel,1925) 90 8,1 ± 4,3 0 – 16,1 E. nanellum (Dogiel, 1923) 85 7,5 ± 4,6 0 – 15,8 E. minimum (Schuberg, 1888) 75 6,1 ± 4,1 0 – 10,9 E. exiguum (Dogiel, 1925) 15 1,2 ± 1,8 0 – 4,8 E. dilobum (Dogiel, 1927) 45 1,8 ± 2,1 0 – 6.8 E. simulans (Lubinsky, 1957) 85 16,4 ± 15,9 0 – 50,3 m. lobosospinosum (Lubinsky, 1957) 50 3,8 ± 5,4 0 – 20,5 m. dubardi (Lubinsky, 1957) 25 3,1 ± 8,8 0 – 34,5 m. caudatum(Lubinsky, 1957) 80 9,5 ± 7,1 0 – 21,4 E. bursa (Stein, 1858) 14 0,4 ± 1,2 0 – 3,8 E. simplex (Dogiel, 1927) 35 3,6 ± 4,4 0 – 16,4 Epidinium 25 1,1 ± 3,2 0 – 13,8 E. ecaudatum 25 1,1 ± 3,2 0 – 13,8 m. ecaudatum (Fiorentini, 1889) 12 0,2 ± 1,4 0 – 6,8 m. caudatum (Fiorentin,1889) 18 0,3 ± 1,1 0 – 4,6 m. bicaudatum (Sharp,1914) 3 0,1 ± 0,2 0 – 1,3 m. tricaudatum (Sharp,1914) 5 <0,1 ± <0,1 0 – 0,2 m. quadricaudatum (Sharp,1914) 12 0,2 ± 0,9 0 – 4,1 m. chattanei (Fiorentini, 1889) 12 0,1 ± 0,5 0 – 2,5 Polyplastron 40 1,4 ± 1,3 0 – 4,8 P. multivesiculatum (Dogiel and Fedorowa, 1925) 40 1,4 ± 1,3 0 – 4,8 Ophryoscolex 50 1,6 ± 2,4 0 – 7,3 O. purkynjei 50 1,6 ± 2,4 0 – 7,3 m. purkynjei (Stein, 1858) 50 1,6 ± 2,4 0 – 7,3 Enoploplastron 15 0,8 ± 1,4 0 – 4,7 E. triloricatum (Dogiel, 1925) 15 0,8 ± 1,4 0 – 4,7
Tablo 3.2’nin devamı
Hsiungia 6 0,4 ± 1,0 0 – 6,3
H.triciliata (Imai, 1988) 6 0,4 ± 1,0 0 – 6,3
Diplodinium 20 1,8 ± 3,7 0 – 12,5
D. rangiferi (Dogiel, 1925) 20 1,8 ± 3,7 0 – 12,5
Toplam tür, morfotip ve cins sayısı: 17, 10 ve 9.
Tek bir sığırdaki tür sayısı 8,0 ± 3,2 (SS) ortalamayla 5 ile 14 arasında değişiklik gösterir. Çalışmada tanımlanan cinsler, türler ve morfotipler fotoğraf 3.1-7’de gösterilmiştir.
Fotoğraf 3.1. MFS uygulanmış örnekler. a. Entodinium longinucleatum (sağ taraftan). b.
Entodinium simulans m. lobosospinosum (sol taraftan). c. Entodinium simulans m. dubardi (sol taraftan). d. Entodinium simulans m. caudatum (sağ
Fotoğraf 3.2. MFS uygulanmış örnekler. a. Entodinium nanellum (sağ taraftan). b.
Entodinium exiguum (sağ taraftan). c. Entodinium minimum (sol taraftan). d. Entodinium dilobum (sağ taraftan).
Fotoğraf 3.3. MFS uygulanmış örnekler. a. Entodinium simplex (sağ taraftan). b. Entodinium
bursa (sol taraftan) c. Epidinium ecaudatum m. ecaudatum (sol taraftan).d. Epidinium caudatum m. caudatum (sol taraftan).
Fotoğraf 3.4. MFS uygulanmış örnekler. a. Epidinium ecaudatum m. bicaudatum (sağ taraftan). b. Epidinium caudatum m. tricaudatum (sağ taraftan).c. Epidinium
ecaudatum m. quadricaudatum (sağ taraftan).d. Epidinium ecaudatum
Fotoğraf 3.5. MFS uygulanmış örnekler. a. Hsiungia triciliata. b. Hsiungia triciliata. c.
Fotoğraf 3.6. MFS uygulanmış örnekler. a. Isotricha prostoma. b. Isotricha intestinalis. c.
Fotoğraf 3.7. MFS uygulanmış örnekler. a. Ophryoscolex purkynjei m. purkynjei (sağ taraftan). b. Polyplastron multivesiculatum (sağ taraftan).
4. TARTIŞMA
Tunus, Benqardan’da yaşayan 16 evcil sığırın (Bos taurus taurus L.) işkembe içeriğinde 9 cinse dahil 17 tür ve 10 morfotip tespit edilmiştir. Tunus’taki evcil sığırların işkembe siliyat faunası üzerine yapılan ilk çalışma olmasına rağmen yeni bir tür kayıt edilememiştir.
Tunus’taki evcil sığırların işkembe içeriğindeki ortalama siliyat yoğunluğu (102,2 ±
36,6 × 104 hücre mL–1), Türkiye, İzmir’deki sığırlardan (52,44 ± 20,73 × 104 hücre
mL–1) (Göçmen, Dehority ve Rastgeldi., 2003), Türkiye, Kastamonu’daki sığırlardan
(96,8 ± 43,3 × 104 hücre mL–1) (Gürelli, 2016) ve Türkiye, İstanbul’daki sığırlardan
(31,8 ± 21,3 × 104 hücre ml−1) (Gürelli ve Akman., 2017), Libya’daki sığırlardan
(8,1× 104 hücre ml−1) (Selim, Imai, El Sheik, Okamoto, Miyagawa ve Maede., 1999)
daha yüksek bulunmuştur (Tablo 4.1).
Tablo 4.1. Tunus ve diğer ülkelerdeki sığırların işkembe içeriklerindeki toplam siliyat
yoğunluğu ve siliyat cinslerinin, türlerinin ve morfotiplerinin toplam sayısının dağılımı. Referans: (1. Selim., Imai., El Sheik, Okamoto, Miyagawa ve Maede (1999): Libya; 2. Göçmen, Dehority ve Rastgeldi (2003): İzmir, Türkiye; 3. Gürelli (2016) : Kastamonu, Türkiye; 4. Gürelli ve Akman (2017): İstanbul, Türkiye).
Konum Toplam siliyat
×104 ml-1 Ekstr ×104 ml-1 Toplam cins s. Toplam tür s. Toplam morfotip s. Referans Libya 8,1 5,0- 10,5 9 27 6 1 İzmir 52,44±20,73 16,00 – 87,50 13 52 36 2 Kastamonu 96,8±43,3 23,5- 169,0 15 47 37 3 İstanbul 31,8±21,3 4,5 – 79,0 9 34 14 4 Tunus 102,2±36,6 48,6 – 156,9 9 17 10 Mevcut çalışma
Bu değişimin nedeni sığır ırkları arasındaki farklılıklar, incelenen konağın sayısı, coğrafi konum, beslenmedeki farklılıklar veya bu unsurların bir karışımı olabilir (Gürelli v.d., 2016; Imai v.d., 1989; Ito ve Imai, 1990).
Benqardan, Tunus Cumhuriyeti’nin güney doğusunda bulunur ve bodur yağmur ormanlarına sahiptir, Benqardan iki doğal alana ayrılır; ilki, çamurlu zeminden oluşan kıyı bölgesi ve ikincisi de, hayvanların otlanması için önemli bitki örtüsü
barındıran çöl bölgesidir. Bu durum, Tunus’taki evcil sığırların daha yüksek siliyat yoğunluğunu açıklayabilir. Genel olarak, 16 evcil sığırın neredeyse tamamının faunası daha çok Entodinium türünlerini içermektedir (ortalama: %30,3; aralık: %8,9–%89,5).
16 sığırın çoğunda Entodinium longinucleatum, E. simulans ve E. nanellum türleri bulunmaktadır. Süt sığırı veya et sığırı olmasına göre farklı beslenme şekillerinin sonucu olarak faunada varyasyon göstermektedir (Dehority ve Odenyo, 2003).
Diplodinium rangiferi türü ilk olarak ren geyiğinde tespit edilmiştir (Dogiel, 1925)
fakat Kastamonu’daki evcil sığırların işkembe siliyatları ile ilgili çalışmada
Diplodinium rangiferi kayıt edilmiştir (Gürelli, 2016). Tunus’taki bu çalışmada da Diplodinium rangiferi gözlemlenmiştir.
Bu çalışmada kaudal ışınsız Entodinium morfotiplerinin yoğunluğu kaudal ışınlı
Entodinium morfotiplerinden daha yüksek bulunmuştur. Kaudal ışınsız siliyat türleri,
hayvan düşük nişasta içeriğiyle beslendiğinde daha yoğun bulunmaktadır (Lubinsky, 1957).
Entodinium spp., Dasytricha ve Isotricha spp., işkembedeki yaygın siliyatlardır.
Muhtemelen bu durum, bu türlerin geniş dağılımından veya hayvanların beslenme alışkanlıklarından kaynaklanabilir. Konaklar yüksek konsantreli besinler tükettiği zaman, Entodinium türünün yüzdesi ve de toplam yoğunlukları daha yüksek bir hale gelmektedir (Hungate, 1966; Ito, Imai ve Ogimoto, 1994).
Entodinium türleri, Entodinium bursa ve Polyplastron multivesiculatum gibi karnivor
olan siliyatlara karşı kaudal ışınlar geliştirerek kendilerini korurlar (Coleman v.d., 1977) fakat hala kaudal ışın gelişiminin tam nedeni açıklanamamıştır.
İşkembe siliyat populasyonları, dört temel grup olarak sınıflandırılmıştır: A, B, K, ve O (Imai, Katsuno ve Ogimoto, 1978; Williams ve Coleman, 1992; Göçmen v.d., 2005).
Dört grubun içeriğinde Isotricha, Dasytricha ve Entodinium cinsleri bulunmaktadır ve bazı türlerin mevcut olmasına veya olmamasına göre birbirlerinden ayırt edilmektedir (Eadie, 1957, 1962; Imai v.d., 1978; Ogimoto ve Imai, 1981; Göçmen v.d., 2005).
A tipi populasyonların, her zaman Polyplastron multivesiculatum’u ve her zaman değilse de, çoğu zaman Metadinium affine’yi içerdiği belirlenmiştir. B tipi populasyonlar Epidinium spp., Eudiplodinium maggii veya her ikisine de sahiptir. K tipi populasyonlar kesinlikle Elytroplastron bubali’ye sahiptir. O tipi populasyonlar sadece Isotricha, Dasytricha ve Entodinium’a sahiptir. P. multivesiculatum avcı bir tür olduğu için, Epidinium spp., Eudiplodinium maggi ve diğer Ophryoscolecidae türlerini elimine edebilmektedir. Bu yüzden tip A populasyonunun daha baskın olduğu düşünülmektedir (Eadie, 1957, 1962; Imai v.d., 1978; Williams ve Coleman, 1992; Göçmen v.d., 2005).
Çalışmada, 16 Tunus evcil sığırının onu (%58,15) A tipi populasyon, geriye kalan 6 hayvan (%41,85) O tipi populasyondur.
Hsiungia triciliata (Fotoğraf 3.5.a-b), sınırlı dağılımı nedeniyle, konaklar arasında
nadir aktarım fırsatına sahiptir. Daha önce Libya’daki develerden (Selim v.d., 1999) ve Türkiye’deki sığırlardan kaydedilmiştir (Gürelli, 2016) ve şu anda Tunus’taki evcil sığırlardan bulunmuştur. Bu çalışmada, Hsiungia triciliata türünün görülme sıklığı (%6) oldukça düşüktür.
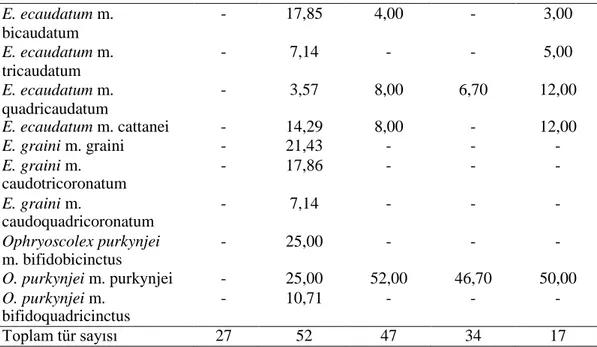
Bu çalışmada Tunus’taki evcil sığırların işkembe içeriklerinden gözlemlenen türlerin ve morfotiplerin görülme sıklığı, diğer ülkelerdeki sonuçlarla Tablo 4.2’de karşılaştırılmıştır.
Tablo 4.2. Tunus ve diğer ülkelerdeki evcil sığırların işkembe içeriğinde tespit edilen siliyat
tür ve morfotiplerin görülme sıklığı. Referanslar: [1. Selim., Imai., El Sheik, Okamoto, Miyagawa ve Maede (1999): Libya; 2. Göçmen, Dehority ve Rastgeldi (2003): İzmir, Türkiye; 3. Gürelli (2016) : Kastamonu, Türkiye; 4. Gürelli ve Akman (2017): İstanbul, Türkiye. 5. Mevcut çalışma: Benqardan, Tunus]. (n)=Sığır sayısı. Tür/morfotip 1 (n = 9) 2 (n = 28) 3 (n = 25) 4 (n = 15) 5 (n = 16) Isotricha prostoma - 100,0 88,00 93,30 80,00 I. intestinalis 22,00 75,0 12,00 33,30 25,00 Dasytricha ruminantium 33,00 75,0 84,00 93,30 85,00 Charonina ventriculi - 25,0 28,00 40,00 - Entodinium basoglui - 25,00 - - - E. bifidum m. bifidum - 7,14 32,00 13,30 - E. bifidum m. monospinosum - - 16,00 20,00 - E. bovis 22,00 53,57 - - - E. palmare - - 4,00 - - E. bursa 78,00 42,86 16,00 33,30 14,00 E. caudatum m. caudatum 67,00 82,14 - - - E. caudatum m. dubardi 11,00 - - - - E. caudatum m. lobosospinosum 44,00 35,71 4,00 - - E. constrictum - 10,71 - - - E. chatterjeei - - 4,00 - - E. dalli m. monospinatum - - 4,00 - - E. dalli m. triangulobatum - - 8,00 - - E. dalli m. rudidorsospinatum - 7,14 4,00 - - E. dilobum - 28,57 56,00 40,00 45,00 E. dubardi 44,00 32,14 48,00 33,30 - E. ellipsoideum - 25,00 64,00 53,30 - E. kastamonicum m. kastamonicum - - 4,00 - - E. kastamonicum m. lobatum - - 4,00 - - E. kastamonicum m. rudidorsospinatum - - 4,00 - - E. kastamonicum m. monospinosum - - 4,00 - - E. kastamonicum m. bifidum - - 4,00 - - E. kastamonicum m. bispinosum - - 4,00 - - E. kastamonicum m. trispinosum - - 4,00 - - E. okoppensis m. okoppensis - - 4,00 - - E. okoppensis m. bifidum - - 4,00 - - E. exiguum 100,0 85,71 20,00 20,00 15,00
Tablo 4.2’nin devamı E. longinucleatum 56,00 96,43 88,00 80,00 90,00 E. minimum 56,00 32,14 72,00 60,00 75,00 E. rostratum - 32,14 - 40,00 - E. nanellum 100,0 85,71 88,00 46,70 85,00 E. ovinum 55,00 64,29 12,00 - - E. parvum 22,00 57,14 - - - E. bimastis - 14,29 28,00 26,70 - E. rectangulatum m. rectangulatum - 10,71 16,00 - - E. rectangulatum m. lobosospinosum - 7,14 4,00 - - E. rectangulatum m. dubardi - 3,57 - - - E. rostratum 56,00 - 40,00 - - E. anteronucleatum m. laeve - 14,29 - - - E. simplex 100,0 89,29 - - 35,00 E. imaii - 21,43 - - - E. oektemae - 7,14 - - - E. quadricuspis - 10,71 - - - E. triacum m. dextrum - 32,14 - - - E. triacum m. triacum - - 36,00 53,30 - E. furca m. furca 56,00 10,71 - - E. simulans m. caudatum - 7,14 84,00 86,70 80,00 E. simulans m. lobosospinosum - - 48,00 26,70 50,00 E. simulans m. dubardi - - 32,00 26,70 25,00 E. williamsi m. williamsi - 7,14 - - - E. williamsi m. turcicum - 7,14 - - - Diplodinium dentatum - 42,86 32,00 40,00 - D. polygonale - - 8,00 - - D. anisacanthum m. anisacanthum - 17,86 4,00 6,70 - D. anisacanthum m. triacanthum - 7,14 4,00 - - D. anisacanthum m. monacanthum - 7,14 - - - D. anisacanthum m. diacanthum - 7,14 - - - D. anisacanthum m. tetracanthum - 3,57 4,00 - - D. anisacanthum m. pentacanthum - 10,71 4,00 - - D. rangiferi m. major - - 12,00 6,70 13,00 D. rangiferi m. minor 33,00 10,71 4,00 - - D. dogieli - - - 6,70 - Eodinium posterovesiculatum m. posterovesiculatum 78,00 14,29 12,00 - -
Tablo 4.2’nin devamı E. posterovesiculatum m. lobatum - - 8,00 - - E. posterovesiculatum m. monolobosum - - 20,00 13,30 - E. posterovesiculatum m. bilobosum - - - 6,70 - E. monolobosum - 14,29 - - - E. lobatum 44,00 - - - - Eudiplodinium rostratum 22,00 67,86 44,00 20,00 - E. maggii - 50,00 12,00 13,30 - E. bovis m. bovis 56,00 57,14 8,00 - - E. bovis m. monolobum - 7,14 - - - E. bovis m. dilobum - 7,14 - - - E. dehorityi - 14,29 - - - E. dilobum 100,0 - 12,00 13,30 - E. bubalus 67,00 - - - - E. monolobum 67,00 - - - - Hsiungia triciliata - - 4,00 - 6,00 Metadinium affine 22,00 50,00 48,00 60,00 - M. medium - 10,71 - 6,70 - Oligoisotricha bubali - - 12,00 - - Ostracodinium anatolicum - - 4,00 - - O. dogieli - - 8,00 26,00 - O. gracile m. gracile - 28,57 28,00 13,30 - O. gracile m. monolobum - 7,14 - - - O. mammosum - - 16,00 6,70 - O. munham - - 8,00 6,70 - O. trivesiculatum - 42,86 8,00 - - O. obtusum 100,0 14,29 - - - O. quadrivesiculatum - 7,14 - - - O. clipeolum 33,00 7,14 - - - Polyplastron multivesiculatum - 60,71 68,00 60,00 40,00 Enoploplastron triloricatum - 7,14 20,00 6,70 15,00 E. ecaudatum m. ecaudatum 100,0 46,43 4,00 20,00 12,00 Epidinium ecaudatum m. bulbiferum - 42,86 - - - E. ecaudatum m. diodonta - 42,86 - - - E. ecaudatum m. triodonta - 42,86 - - - E. ecaudatum m. tetrodonta - 42,86 - - - E. ecaudatum m. pentodonta - 42,86 - - - E. ecaudatum m. caudatum 100,0 42,86 16,00 53,30 18,00
Tablo 4.2’nin devamı E. ecaudatum m. bicaudatum - 17,85 4,00 - 3,00 E. ecaudatum m. tricaudatum - 7,14 - - 5,00 E. ecaudatum m. quadricaudatum - 3,57 8,00 6,70 12,00 E. ecaudatum m. cattanei - 14,29 8,00 - 12,00 E. graini m. graini - 21,43 - - - E. graini m. caudotricoronatum - 17,86 - - - E. graini m. caudoquadricoronatum - 7,14 - - - Ophryoscolex purkynjei m. bifidobicinctus - 25,00 - - - O. purkynjei m. purkynjei - 25,00 52,00 46,70 50,00 O. purkynjei m. bifidoquadricinctus - 10,71 - - - Toplam tür sayısı 27 52 47 34 17
Hsiungia triciliata Libya’da yaşayan sığırlardan (Selim v.d., 1999), İzmir,
Türkiye’de yaşayan evcil sığırlardan (Göçmen, Dehority ve Rastgeldi., 2003) ve İstanbul, Türkiye’de yaşayan evcil sığırdan kayıt edilememiştir (Gürelli ve Akman, 2017). Siliyatların ağız yoluyla diğer bir konağa aktarıldığı bildirilmiştir, bu yüzden, eğer konaklar birbirleriyle yakın temasta bulunurlarsa, siliyatlar konaktan konağa kolaylıkla bulaşabilmektedir (Ogimoto ve Imai, 1981).
Sonuç olarak, konağın beslenme alışkanlıkları, hayvan türleri, işkembe PH değeri, yakın temas ve işkembedeki türler arasındaki rekabet, işkembe siliyat faunasının yapısını oluşturmaktadır.
Afrika’da yaşayan geviş getiren hayvanlarla ilgili ilave çalışmalar yeni bilgiler sağlayacak ve muhtemelen ülkeler arasındaki fauna göçünün açıklanmasını kolaylaştıracaktır.
Sonuç olarak, dünyanın farklı bölgelerindeki çeşitli geviş getiren hayvanlardan alınancak yeni işkembe numuneleri, bu siliyatların dağılımı hakkında daha fazla bilgi verecek ve bilinmeyen yeni işkembe siliyat türlerinin tespit edilmesine yardım edecektir.
KAYNAKLAR
Becker, E. R., & Hsiung, T. S. (1929). The Method By Which Ruminants Acquire Their Fauna of Infusoria, and Remarks Concerning Experiments on The Host-Specificity of These Protozoa. Proceedings of the National Academy of
Sciences, 15(8), 684-690.
Coleman GS, Laurie SI, & Bailey SE (1977). The Cultivation of The Rumen Ciliate
Entodinium bursa in The Presence of Entodinium caudatum. Journal of General Microbiology, 101, 253-258.
Coleman, G. S., & Laurıe, J. I. (1974). The Metabolism of Starch, Glucose, Amino
Acids, Purines, Pyrimidines and Bacteria by Three and Epidinium spp. Isolated from the Rumen. Microbiology, 85(2), 244-256.
Dehority, B. A. (1984). Evaluation of Subsampling and Fixation Procedures used for Counting Rumen Protozoa. Applied and Environmental Microbiology, 48(1), 182-185.
Dehority, B. A. (1986). Protozoa of the Digestive Tract of Herbivorous Mammals.
International Journal of Tropical Insect Science, 7(3), 279-296.
Dehority, B. A. (1986). Rumen Ciliate Fauna of Some Brazilian Cattle: Occurrence of Several Ciliates New to the Rumen, Including the Cycloposthid
Parentodinium africanum. The Journal of Protozoology, 33(3), 416-421.
Dehority, B. A., & Odenyo, A. A. (2003). Influence of Diet on the Rumen Protozoal Fauna of Indigenous African Wild Ruminants. Journal of Eukaryotic
Microbiology, 50(3), 220-223.
Dogiel, V. A. (1925). Neue Parasitische Infusorien Aus Dem Magen Des Renntieres (Rangifer tarandus). Arch. Rus. Protistol, 4(1-2), 43-65.
Dogiel, V. A. (1927). Monographie Der Familie Ophryoscolecidae, Arch
Protistenkd, 59 (1), 1-288.
Dogiel, V. A. (1947). The Phylogeny of the Stomach-Infusorians of Ruminants in the Light of Palaeontological and Parasitological Data. Journal of Cell Science,
3(3), 337-344.
Eadie, J. M. (1956). The Mid-Winter Rumen Microfauna of the Seaweed-Eating Sheep of North Ronaldshay. Proceedings of the Royal Society of Edinburgh.
Section B. Biology, 66(3), 276-287.
Eadie, J. M. (1957). The Mid-Winter Rumen Microfauna of the Seaweedeating Sheep of North Ronaldshay. Proceedings of the Royal Society of Edinburgh.
Eadie, J. M. (1962). Inter-Relationships Between Certain Rumen Ciliate Protozoa.
Microbiology, 29(4), 579-588.
Eadie, J. M. (1967). Studies on the Ecology of Certain Rumen Ciliate Protozoa.
Microbiology, 49(2), 175-194.
Fernández-Galiano T., Serrano S., & Fernández-Galiano D. (1985) General Morphology and Stomatogenesis of Two Species of The Genus Entodinium (Ciliophora, Entodiniomorphida). Acta Protozool. (24) 181–186.
Franzolin, R., & Dehority, B. A. (1996). Effect of Prolonged High-Concentrate Feeding on Ruminal Protozoa Concentrations. Journal of Animal Science,
74(11), 2803-2809.
Fried, J., Weber, S., Ludwig, W., McEwan, N., Newbold, J., Michalowski, T., & Schleifer, K. H. (2005). Identification of Rumen Ciliates Using Small Subunit Ribosomal RNA (18S-rRNA)-Targeted Oligonucleotide Probes and Fluorescence in Situ Hybridization (FISH). Journal of Eukaryotic
Microbiology, 52(2), 7S-27S.
Giesecke, D. (1970). Comparative Microbiology of the Alimentary Tract. Physiology
of Digestion and Metabolism in the Ruminant, 306(31), 8.
Göçmen, B. (1993). Sığır İşkembesinde Endosimbiyont Yasayan Isotricha spp. Stein, 1859 (Isotrichidae, Trichostomatida) Üzerine Işık Mikroskobu Düzeyinde Morfolojik ve Sitolojik Gözlemler. Doğa- Turk Journal of
Zoology, 17, 289-301.
Göçmen, B. (1999a). Ophryoscolex Stein, 1858 (Protozoa: Ciliophora: Entodiniomorphida) Cinsi Hakkında Morfolojik ve Taksonomik Araştırmalar,
Doğa- Turk Journal of Zoology, 23(2), 397-427.
Göçmen, B., & Öktem, N. (1999). İşkembe Siliyatı Entodinium longinucleatum Dogiel, 1925 (Ciliophora: Entodiniomorphida: Entodiniidae)'un Evcil Sığırlardaki Taksonomik Durumu. Doğa- Turk Journal of Zoology, 23, 465- 471.
Göçmen, B., Rastgeldi, S., Karaoğlu, A & Akan, H. (2005). Rumen Ciliated Protozoa of the Turkish Domestic Goats (Capra hircus L.). Zootaxa,
1091(1),53-64.
Göçmen B., Dehority B. A., & Rastgeldi S. (2003) Ciliated Protozoa in The Rumen of Turkish Domestic Cattle (Bos taurus L.). Journal of Eukaryotic
Microbiology, 50(2), 104-108.
Göçmen, B., & Gürelli, G. (2009). The Occurence of The Rumen Ciliate Entodinium
constrictum Dehority, 1974 (Entodiniidae, Entodiniomorphida) from
Domestic Sheep (Ovis ammon aries L.) in Northern Cyprus. North-Western
Gürelli, G. (2014). Rumen Ciliate Fauna (Ciliophora, Protista) of Turkish Domestic Goats Living in İzmir, Turkey. Turkish Journal of Zoology, 38(2), 136-143. Gürelli, G. (2016). Rumen Ciliates of Domestic Cattle (Bos taurus taurus) in
Kastamonu, Turkey, with The Description of a New Species. European
journal of protistology, 56, 51-59.
Gürelli, G., Canbulat, S., Aldayarov, N., & Dehority, B. A. (2016). Rumen Ciliate Protozoa of Domestic Sheep (Ovis aries) and Goat (Capra aegagrus hircus) in Kyrgyzstan. FEMS Microbiology Letters, 363(6).
Gürelli, G., & Akman, F. T. B. (2017). Rumen Ciliate Biota of Domestic Cattle (Bos
taurus taurus) in İstanbul, Turkey and Infraciliature of Metadinium medium
(Entodiniomorphida, Ophryoscolecidae). Acta Protozoologica, 56, 171-180. Hungate, R. E., Fletcher, D. W., Dougherty, R. W., & Barrentine, B. F. (1955).
Microbial Activity in the Bovine Rumen: Its Measurement and Relation to Bloat1. Applied microbiology, 3(3), 161.
Hungate, R. E. (1966). The Rumen and its Microbes (pp.533). Academic Press New York, USA.
Hungate, R. E. (1972). Relationships Between Protozoa and Bacteria of the Alimentary Tract. The American Journal Of Clinical Nutrition, 25(12), 1480- 1484.
Hungate, R. E. (1978). The Rumen Protozoa. Parasitic Protozoa, 2, 655-695.
Imai, S., Katsuno, M., & Ogimoto, K. (1978). Distribution of Rumen Ciliate Protozoa in Cattle, Sheep, and Goat and Experimental Transfaunation of Them. Japanese Journal of Zootechnical Science, 49, 494-505.
Imai, S., Han, S.S., Cheng, K.-J., & Kudo, H., (1989). Composition of The Rumen Ciliate Population in Experimental Herds of Cattle and Sheep in Lethbridge, Alberta, Western Canada. Can. Journal Microbiology, 35, 686–690.
Ito A., & Imai S. (1990) Ciliated Protozoa in The Rumen of Holstein– Friesian Cattle (Bos taurus taurus) in Hokkaido, Japan, with The Description of Two New Species Zoology Science, (7) 449–458.
Ito A, Imai S, & Ogimoto K (1994). Rumen Ciliate Composition and Diversity of Japanese Beef Black Cattle in Comparison with Those of Holstein-Friesian Cattle. Japanese Journal of Veterinary Medical Science, 56, 707–714.
Ito, A., Imai, S., Manda, M., & Ogimoto, K. (1995). Rumen Ciliates of Tokara Native Goat in Kagoshima, Japan. Japanese Journal of Veterinary Medical
Kreier, J. P., & Baker, J. R. (1987). Classification and Evolution of The Symbiotic Protozoa. In Parasitic Protozoa (pp. 1-11). Springer, Dordrecht.
Lubinsky, G. (1957). Studies on the Evolution of the Ophryoscolecidae (ciliata:
Oligotricha): I. A New Species of Entodinium with" caudatum," loboso- spinosum," and" dubardi" Forms, and Some Evolutionary Trends in the
Genus Entodinium. Canadian Journal of Zoology, 35(1), 111-133.
Lynn D. (2008). The Ciliated Protozoa: Characterization, Classification, and Guide
to the Literature. 3rd ed. Dordrecht, the Netherlands: Springer.
Mackie, R. I., McSweeney, C. S., & Klieve, A. V. (2002). Microbial Ecology of The Ovine Rumen. Sheep Nutrition, 71-94.
Ogimoto, K., & Imai, S. (1981). Atlas of Rumen Microbiology (pp.1-231). Tokyo Japan Scientific Societies.
Öktem N., Göçmen, B., & Torun, S. (1997). Türkiye Evcil Koyun (Ovis ammon
aries)’larının İşkembe Siliyat (Protozoa: Ciliophora) Faunası Hakkında Bir
Ön Çalışma: I- Familya Isotrichidae (Trichostomatida) ve Entodiniidae (Entodiniomorphida). Turkish Journal of Zoology, 21, 475–502 (in Turkish). Selim, H. M., Imai, S., el Sheik, A. K., Attia, H., Okamoto, E., Miyagawa, E., &
Maede, Y. (1999). Rumen Ciliate Protozoal Fauna of Native Sheep, Friesian Cattle and Dromedary Camel in Libya. Japanese Journal of Veterinary
Medical Science, 61(3), 303-305.
Shinchi, S., & Abe, M. (1987). Decomposition of Soluble Casein By Rumen Ciliate Protozoa. Japanese Journal of Zootechnical Sci, 58, 833-838.
Shinchi, S., Itoh, T., Abe, M., & Kandatsu, M. (1986). Effect of Rumen Ciliate Protozoa on The Proteolytic Activity of Cell Free Rumen Liquid. Japanese
Journal of Zootechnical Sci, 57, 89-96.
Williams, A. G. (1979). Exocellular Carbohydrase Formation By Rumen Holotrich Ciliates. The Journal of Protozoology, 26(4), 665-672.
Williams, A. G. (1986). Rumen Holotrich Ciliate Protozoa. Microbiological reviews,
50(1), 25-49.
Williams, A. G., & Coleman, G. S. (1988). The Rumen Protozoa. In the Rumen,
Microbial Ecosystem (pp. 73-139). London: Elsevier Science.
Williams, A. G., & Coleman, G. S. (1992). The Rumen Protozoa (pp.1-441). New York: Springer.
ÖZGEÇMİŞ
Adı Soyadı : Ali Fouzi Otman Elhadi DAW
Doğum Yeri ve Yeri : Libya- Msallatah - 1973
Medeni Hali : Evli
Yabancı Dili : İngilizce
E-posta : alifouzi43@gmail.com
Eğitim geçmişi
Lise : Tarek Ben ziad Okulu
Lisans : Fen-Edebiyat Fakültesi. Khums Üniversitesi - Libya
Mesleki Deneyim
İş Yeri : Mezuniyet yılından bugüne kadar Libya'da