T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
RADYASYON ONKOLOJİSİ ANABİLİM DALI
MEME KANSERİ NEDENİ İLE RADYOTERAPİ UYGULANAN OLGULARDA
RADYASYONA BAĞLI RADYOLOJİK AKCİĞER DEĞİŞİKLİKLERİNİN
TANIMLANMASI, KLİNİK VE DOZİMETRİK FAKTÖRLER İLE
İLİŞKİSİNİN DEĞERLENDİRİLMESİ
TIPTA UZMANLIK TEZİ
Dr. Uğur YILMAZ
DANIŞMAN
Doç. Dr. Senem ALANYALI
İZMİR
2016
Önsöz
Bu tez için gerekli çalışmaları yaparken ve sonrasında da tezi yazarken, daha önce hep olduğu gibi varlıklarını her zaman yanımda hissettiğim, beni bugünlere getiren aileme sevgi, saygı ve şükranlarımla.
Asistanlığım süresince bilgi ve yardımlarını benden esirgemeyen Ege Üniversitesi Tıp Fakültesi Radyasyon Onkolojisi Anabilim Dalı’ndaki tüm hocalarıma; tez danışmanım olan, bu süreçte devamlı yardım eden ve zamanını ayıran Doç. Dr. Senem Alanyalı’ya; tezimin radyolojiyle ilgili alanında yardımcı olan Prof. Dr. Recep Savaş’a; tezimin radyasyon fiziği kısmında destek olan Öğr. Gör. Murat Köylü’ye ve uzmanlık eğitimim sürecinde birlikte çalıştığım tüm asistan arkadaşlarıma sonsuz teşekkürler. Bildiğim doğrular bana öğretenlere, yanlışların mülkiyeti ise bana aittir
.
I
Özet
MEME KANSERİ NEDENİ İLE RADYOTERAPİ UYGULANAN
OLGULARDA RADYASYONA BAĞLI RADYOLOJİK AKCİĞER
DEĞİŞİKLİKLERİNİN TANIMLANMASI, KLİNİK VE DOZİMETRİK
FAKTÖRLER İLE İLİŞKİSİNİN DEĞERLENDİRİLMESİ
Amaç
Meme kanseri nedeni ile radyoterapi (RT) uygulanan olgularda akciğerde oluşan radyasyona bağlı değişikliklerin detaylıca tanımlanarak radyasyon pnömonisi/fibrozisi (RP/F) açısından derecelendirilmesi ve bu bulguların klinik ve tedavi özellikleri ile ilişkisinin incelenmesidir.
Gereç ve Yöntem
Ege Üniversitesi Tıp Fakültesi Radyasyon Onkolojisi Anabilim Dalı’nda 2005-2013 yılları arasında meme kanseri nedeni ile RT uygulanan 76 olgu retrospektif olarak değerlendirilmiştir. Onkolojik tedavileri tamamlandıktan sonra rutin takibe alınan olgular radyasyon pnömonisi (RP) açısından sorgulanmış ve takip döneminde elde olunan toraks bilgisayarlı tomografi (BT)’leri radyasyona bağlı radyolojik akciğer değişiklikleri açısından detaylıca incelenmiştir. Yetmiş altı olguya ait toplam 116 toraks BT’si mediasten penceresinde 350/50 Hounsfiel Unit (HU), parankim penceresinde ise 1200/-600, 800/-800, 1800/-600 HU’ları ile değerlendirilmiştir. Toraks BT’ler detaylıca buzlu cam, septal kalınlaşma, konsolidasyon/yamasal opasite değişikliği/alveoler infiltrasyon, subplevral hava kisti, hava bronkogramı, parankimal bant, traksiyon bronşiektazisi, plevral/subplevral kalınlaşma ve volüm kaybı bulguları açısından incelenmiştir. Radyolojik RP/F meme kanseri tanılı olgularda kullanılabilir bir sistem olan Nishioka sınıflama sistemine göre derecelendirilmiştir. Derece 0, RT alanında anlamlı değişiklik olmaması; Derece 1, RT alanında plevral kalınlaşma; Derece 2, RT alanının <%50’sinde pulmoner değişiklikler (plak benzeri, heterojen dansite gibi) ve Derece 3, RT alanının >%50’sinde pulmoner değişiklikler olarak sınıflandırılmıştır. İstatistiksel değerlendirmede tanımlayıcı analizler ve bağıntı analizleri IBM SPSS 22.0 programı ile yapılmış ve bağıntı analizleri için Spearman testi kullanılmıştır. Bağıntı katsayısı (rs) -1 ile +1 arasında olup p<0,05 istatistiksel anlamlı değer olarak kabul edilmiştir.
II
Bulgular
Ortanca yaşı 53 olan olguların %70’ine modifiye radikal mastektomi operasyonu uygulanmış, %58’i invaziv duktal karsinom histolojisinde, %93’ü evre II-III’dür. RT, tüm olgularda meme/göğüs duvarı ve bölgesel lenfatiklere uygulanmıştır.
Ortanca takip süresi 49 ay olan olguların hiçbirinde oksijen veya steroid gerektiren klinik RP gözlenmemiştir. Toraks BT değerlendirmelerinde, tüm zaman aralıklarında en sık görülen radyolojik bulgu buzlu cam olup bunu plevral/subplevral kalınlaşma ve septal kalınlaşma takip etmektedir. Tek değişkenli analizde; RT sonrası 1-6 aylık dönemdeki toraks BT değerlendirmelerinde 53 yaşından büyük veya aromataz inhibitörü kullanan olgularda Nishioka RP/F derecesinin daha yüksek olduğu saptanmıştır (rs=0,42 ve rs=0,663; p=0,012 ve p=0,000). Doz volüm histogram (DVH) parametreleri ipsilateral akciğere ait olup akciğerdeki radyolojik radyasyon hasarıyla arasındaki ilişki değerlendirildiğinde; V5 için >%30 (rs=0,73 ve p=0,000) ve >%44 (rs=0,49 ve p=0,025); V20 için >%15 (rs=0,56 ve p=0,01), >%20 (rs=0,64 ve p=0,002), >%30 (rs=0,51 ve p=0,02) ve >%33 (rs=0,48 ve p=0,02); V40 için >%24 (rs=0,51 ve p=0,02) ve ortalama akciğer dozu (OAD) içinse >16 Gy (rs=0,51 ve p=0,02) olması ile 13-18 ay takip dönemindeki toraks BT Nishioka RP/F derecelerinin doğru orantılı olarak arttığı gözlenmiştir. Benzer olarak V5 için >%30 (rs=0,37 ve p=0,037) ve V20 için >%15 (rs=0,39 ve p=0,028) olması durumunda 18 ay sonrası takip dönemindeki toraks BT’lerinde Nishioka RP/F derecesi daha yüksek bulunmuştur.
Sonuç
Çalışmamızda 1-6 aylık takip dönemindeki değerlendirmelerde; klinik faktörlerden ileri yaş veya aromataz inhibitörü kullanımının Nishioka RP/F şiddetini arttırdığı saptanmıştır. DVH parametrelerinde ise; takip toraks BT incelemelerinde 13-18 aylık dönem için V5, V20, V40 ve OAD, 18 ay sonrası takip dönemi için ise V5 ve V20 değerleri Nishioka RP/F derecesiyle ilişkili bulunmuştur. Klinik pratikte kullandığımız bu DVH parametrelerinin geç dönemde (>12 ay) oluşan radyolojik akciğer hasarında yol gösterici oldukları saptanmıştır.
Anahtar kelimeler
III
Abstract
THE EVALUATION OF RADIATION INDUCED RADIOLOGICAL
CHANGES OF THE LUNG AND ITS ASSOCIATION BETWEEN CLINICAL
AND DOSIMETRIC FACTORS IN BREAST CANCER PATIENTS
TREATED WITH RADIOTHERAPY
Purpose
To perform a detailed analysis of radiotherapy (RT) induced radiological changes of the lung, to grade the radiation pneumonitis/fibrosis (RP/F) and to investigate its association between clinical and treatment related factors of breast cancer patients treated with RT.
Methods
From 2005 to 2013, 76 breast cancer patients treated at Ege University Faculty of Medicine Department of Radiation Oncology were retrospectively reviewed. During follow-up, patients were examined for radiation pneumonitis (RP). Mediastinal window with 350/50 Hounsfiel Unit (HU) and parenchymal window with 1200/-600, 800/-800, 1800/-600 HUs were used for the evaluation of 116 follow-up thorax CTs of 76 patients. Thorax CT scans were analyzed for ground glass opacity, septal thickening, consolidation/patchy pulmonary opacity/alveolar infiltrates, subpleural air cyst, air bronchogram, parenchymal bands, traction bronchiectasis, pleural/subpleural thickening and pulmonary volume loss. The scoring of radiological RP/F was made according to Nishioka classification system. The scoring includes Grade 0, no significant changes in the radiation field; Grade 1, only pleural thickening in the radiation field; Grade 2, pulmonary changes (plaque-like or heterogeneous density) in <50% of the area of the radiation field; Grade 3, pulmonary changes in >50% of the area of the radiation field. Descriptive statistics and correlation analysis with Spearman's correlation coefficient were done with IBM SPSS 22.0 software. Correlation coefficient was between -1 and +1; whereas p<0,05 was considered statistically significant.
Results
Patients’ median age was 53, of whom 70% had modified radical mastectomy, 58% had invasive ductal carcinoma histology and 93% of them had stage II-III disease. All patients were treated with breast/chest wall plus regional lymphatic irradiation.
IV
During 49 months of follow-up, none of the patients were diagnosed with oxygen or steroids requiring clinical RP. For all follow-up periods ground glass opacity was the most common radiological finding followed by pleural/subpleural thickening and septal thickening. Regarding 1-6 months follow-up thorax CT scan evaluation, patients older than 53 years of age or patients taking aromatase inhibitors had more severe Nishioka RP/F grades (rs=0,42 and rs=0,663; p=0,012 and p=0,000) in univariate analysis. Among dose volume histogram (DVH) parameters of 13- 18 months follow-up thorax CT scan, ipsilateral lung V5>%30 (rs=0,73 and p=0,000) and >%44 (rs=0,49 and p=0,025); V20>%15 (rs=0,56 and p=0,01), >%20 (rs=0,64 and p=0,002), >%30 (rs=0,51 and p=0,02) and >%33 (rs=0,48 and p=0,02); V40>%24 (rs=0,51 and p=0,02) and mean lung dose was (MLD)>16 Gy (rs=0,51 and p=0,02) was related with more severe Nishioka RP/F grades. Moreover, after an 18 months period follow-up of thorax CT scans evaluation, Nishioka RP/F grade was more severe in cases with V5 >%30 (rs=0,37 and p=0,037) or V20 >%15 (rs=0,39 and p=0,028).Conclusions
In the study regarding 1-6 months follow-up thorax CT scans, advanced age or aromatase inhibitors as clinical factors were related with more severe Nishioka RP/F grading. Regarding DVH parameters; V5, V20, V40 and MLD are found to be important factors in relation to the Nishioka RP/F grades. These DVH parameters, already used in daily clinical practice, are predictive for late term (>12 months) RT-induced radiological lung changes.
Keywords
Radiotherapy; radiation pneumonitis/fibrosis; Nishioka grading system
V
İçindekiler
Özet ... I
Abstract ... III
İçindekiler ... V
Tablolar ve Şekiller Dizini ... VIII
Kısaltmalar ve Semboller ... XI
1. Giriş ... 1
2. Genel Bilgiler ... 3
2.1. Meme anatomisi, kan ve lenfatik dolaşımı ve innervasyonu ... 3
2.2. Meme kanseri patolojisi ve evreleme ... 4
2.3. Meme kanserinde prognostik ve prediktif faktörler ... 7
2.4. Meme kanserinde genel tedavi yaklaşımı ... 8
2.4.1. Cerrahi ... 8
2.4.2. Sistemik tedaviler ... 10
2.4.2.1. Kemoterapi ve hedefe yönelik tedaviler ... 10
2.4.2.2. Hormonoterapi ... 13
2.4.3. Radyoterapi ... 14
2.4.3.1. Meme koruyucu cerrahi sonrası radyoterapi ... 14
2.4.3.2. Mastektomi sonrası radyoterapi ... 19
2.4.3.3. Bölgesel lenf nodlarına radyoterapi ... 21
2.5. Meme kanseri radyoterapisinde teknikler ... 24
2.5.1. Üç boyutlu konformal radyoterapi ... 27
2.5.2. Yoğunluk ayarlı radyoterapi ... 27
2.6. Meme kanseri radyoterapisinde doz ve fraksiyonasyon ... 28
2.6.1. Meme koruyucu cerrahi sonrası meme radyoterapisinde doz ve
fraksiyonasyon ... 28
2.6.1.1. Tüm meme radyoterapisi ... 28
2.6.1.1.1. Konvansiyonel fraksiyonasyon ... 28
2.6.1.1.2. Hipofraksiyonasyon ... 28
VI
2.6.1.2.1. Akselere parsiyel meme ışınlaması (APMI) ... 30
2.6.2. Mastektomi sonrası radyoterapide saha, doz ve fraksiyonasyon ... 32
2.7. Meme kanserinde radyoterapiye bağlı yan etkiler ... 33
2.7.1. Akciğer toksisitesi ... 33
2.7.1.1. Radyoterapiye bağlı akciğer hasarı ve patofizyolojisi ... 33
2.7.1.2. Radyasyona bağlı akciğer hasarının klinik bulguları ve
derecelendirilmesi ... 36
2.7.1.3. Radyasyona bağlı akciğer hasarının klinik faktörlerle ilişkisi .... 38
2.7.1.4. Radyasyona bağlı akciğer hasarının doz ve volüm parametreleri
ile ilişkisi ... 40
2.7.1.5. Radyoterapinin akciğer toksisitesinin görüntüleme yöntemleri ile
değerlendirilmesi ... 43
2.7.1.6. Radyasyona bağlı akciğer hasarının görüntüleme yöntemlerine
göre radyasyon pnömonisi ve fibrozisi açısından derecelendirilmesi ... 46
2.7.1.7. Radyasyona bağlı akciğer hasarının objektif klinik yöntemlerle
değerlendirilmesi ... 51
2.7.2. Üst ekstremite morbiditesi ... 52
2.7.3. Deri, yumuşak doku ve kemik toksisitesi ... 53
2.7.4. Kalp toksisitesi ... 54
2.7.5. Sekonder maligniteler... 55
3. Gereç ve Yöntem ... 57
3.1. Olgu seçim kriterleri ... 57
3.2. Çalışma tasarımı ... 57
3.2.1. Üç boyutlu bilgisayarlı tomografi simülasyon, konturlama ve
radyoterapi planlama aşamaları ... 57
3.3. Takip dönemindeki toraks bilgisayarlı tomografilerini değerlendirme
protokolü ... 60
3.4. İstatistiki analiz ... 66
4. Bulgular ... 67
5. Tartışma ... 73
VII
7. Kaynaklar ... 80
Ekler ... 107
Ek-1: Etik kurul onayı ... 107
Özgeçmiş ... 108
VIII
Tablolar ve Şekiller Dizini
Tablo 2-1: Meme tümörleri için Amerikan Kanser Komitesi (AJCC) 2010 TNM sınıflaması ... 6
Tablo 2-2: Meme kanserinde evreleme ... 7
Tablo 2-3: MKT konseptinin kesin ve göreceli kontrendikasyonları; NCCN 2016 Versiyon 2 ... 9
Tablo 2-4: Opere edilebilir lokal ileri meme kanseri tanılı olgularda cerrahi ve KT sıralaması avantajları ... 12
Tablo 2-5: Mastektomi ile MKC+RT’yi karşılaştıran prospektif randomize çalışmalar ... 15
Tablo 2-6: Lokal yineleme açısından MKC ± RT’yi inceleyen randomize çalışmalar ... 18
Tablo 2-7: Mastektomi ve sistemik tedavi yapılan olgularda postmastektomi RT’nin araştırıldığı faz III randomize çalışma sonuçları ... 19
Tablo 2-8: Üç boyutlu konformal RT teknikleri ... 27
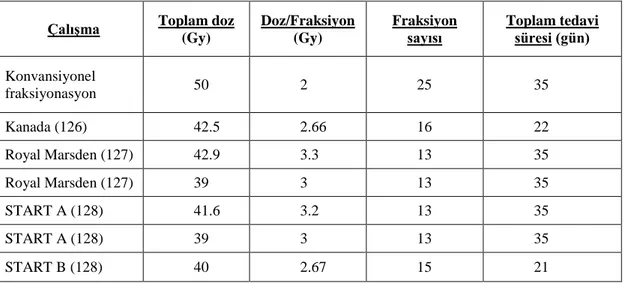
Tablo 2-9: Standart ile hipofraksiyone tüm meme radyoterapi rejimlerinin karşılaştırıldığı yayınlanmış randomize çalışmaların genel özellikleri ... 29
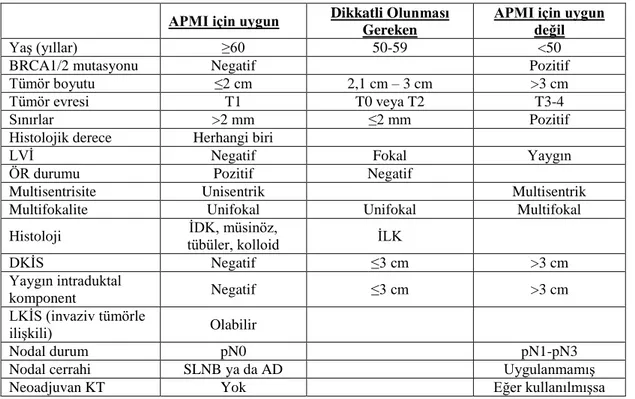
Tablo 2-10: APMI için Seçim Kriterleri; ASTRO ... 31
Tablo 2-11: APMI için Seçim Kriterleri; GEC-ESTRO ... 32
Tablo 2-12: Radyoterapiye bağlı akciğer radyasyon hasarının histopatolojik derecelendirmesi ... 34
Tablo 2-13: Radyasyon pnömonisi ve fibrozisinin patofizyolojisi ... 34
Tablo 2-14: Radyasyona bağlı akciğer hasarında potansiyel tedavi edici ajanlar ... 36
Tablo 2-15: RTOG akut radyasyon morbiditesi, CTCAE pnömoni, RTOG/EORTC geç radyasyon morbiditesi değerlendirme sistemleri ... 37
Tablo 2-16: SOMA/LENT sistemi radyasyona bağlı geç akciğer toksisitesi değerlendirilmesi ... 38
Tablo 2-17: Seçilmiş çalışmalardaki akciğer toksisitesi için prediktif olan doz-volüm parametreleri 41 Tablo 2-18: Çeşitli protokol ve çalışmalardaki doz volüm sınırlamaları ... 42
Tablo 2-19: RT’ye bağlı akciğer hasarını değerlendirmede kullanılan modaliteler ve değerlendirme sonuçları ... 45
Tablo 2-20: Akciğer grafisi ya da bilgisayarlı tomografiye göre radyasyon pnömonisi ve fibrozisi derecelendirme sistemleri ... 46
Tablo 2-21: Jensen radyasyona bağlı akciğer hasarı radyolojik değerlendirme sistemi ... 47
Tablo 2-22: Arriagada sınıflamasında radyolojik değişiklikleri intensitesine göre derecelendirme .... 47
Tablo 2-23: Libshitz radyasyona bağlı akciğer değişiklikleri derecelendirme sistemi ... 48
IX
Tablo 2-25: İkezoe radyasyona bağlı akciğer değişiklikleri derecelendirme sistemi ... 49
Tablo 2-26: Nishioka sınıflaması ... 50
Tablo 2-27: Koenig radyasyon fibrozisi sınıflaması ... 50
Tablo 2-28: Kouloulias radyolojik radyasyon pnömonisi sınıflaması ... 51
Tablo 4-1: Olgu özellikleri ... 67
Tablo 4-2: Radyasyona bağlı akciğer hasarının akciğer parankiminde ve plevral dokuda oluşturduğu değişiklikler ... 68
Tablo 4-3: Nishioka sınıflamasına göre değerlendirilen olguların takip dönemlerine göre BT’lerinde supraklaviküler-tanjansiyel alan derecelerinin birbirleriyle karşılaştırılması ... 69
Tablo 4-4: Takip dönemi toraks BT’lerinde zaman dilimine göre radyolojik radyasyon hasarı dereceleri-olgu sayısı ... 69
Tablo 4-5: Olgu özellikleri-takip dönemi BT’lerinin Nishioka sistemiyle değerlendirilmesi; Spearman bağıntı analizleri ile istatistiki anlamlılık ya da eğilim bulunan sonuçlar ... 70
Tablo 4-6: Olgu özellikleri-takip dönemi BT’lerinin Nishioka sistemiyle değerlendirilmesi; Spearman bağıntı analizleri ile anlamlı bulunmayan sonuçlar ... 70
Tablo 4-7: İpsilateral akciğer dozları ... 70
Tablo 4-8: DVH parametreleri ile takip periyodu toraks BT’lerinin Nishioka derecelendirmesi sistemi sonuçlarının Spearman bağıntı analizi ile değerlendirilmesi; istatistiki anlamlı veya eğilim bulunan sonuçlar ve de ortanca değerleri ... 71
Tablo 4-9: RT sonrası ≥3 farklı takip döneminde BT’si olan olguların Nishioka sistemi ile değerlendirilmesi sonuçları ... 72
Şekil 2-1: Evre I, IIA ya da IIB hastalık ya da T3N1M0, lokal-bölgesel tedavi; NCCN National Comprehensive Cancer Network (NCCN) Versiyon 2.2016 ... 24
Şekil 2-2: RTOG atlasında göğüs duvarı, Mİ alanı, seviye I-II-III ve supraklaviküler alan (seviye IV) konturlaması ... 26
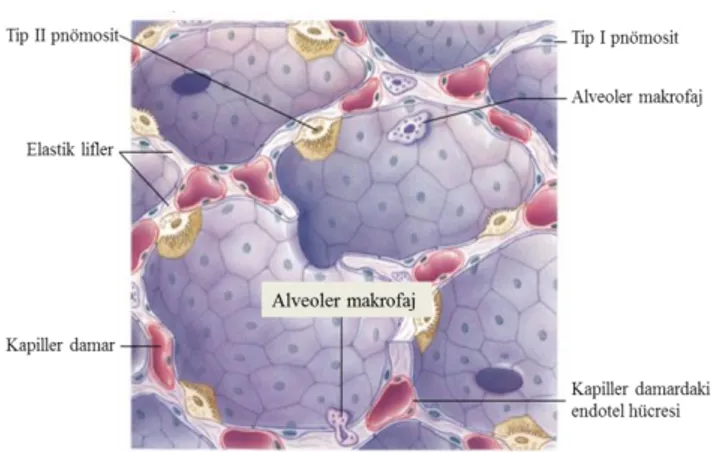
Şekil 2-3: Alveoler organizasyon ... 33
Şekil 2-4: Semptomatik pnömoni ve Ortalama akciğer dozu ilişkisi ... 42
Şekil 3-1: RT planlaması hedef hacimlerin belirlenmesi ... 58
Şekil 3-2: Tedavi sahalarının belirlenmesi ... 59
Şekil 3-3: Örnek bir olguda 5000 cGy doz dağılımı ve mammarya interna sahası ile radyolojik değişikliklerin korelasyonu ... 61
X
Şekil 3-5: Nishioka radyasyon pnömonisi/fibrozisi değerlendirme sistemi; sol taraf olguların RT planlama BT’si, sağ taraf takipte çekilen toraks BT’leri ... 65XI
Kısaltmalar ve Semboller
AC: Adriamisin, Siklofosfamid
ACOSOG: American College of Surgeons Oncology Group
AD: Aksiller Diseksiyon
AJCC: American Joint Committee on Cancer, Amerikan Birleşik Kanser Komitesi
ARDS: Akut Respiratuar Distres Sendromu ASTRO: American Society for Radiation Oncology
bFGF: basic Fibroblast Growing Factor
BIG: Breast International Group BT: Bilgisayarlı Tomografi
CAF: Siklofosfamid, Adriamisin, Florourasil
CALGB: Cancer and Leukemia Group B
CD-31: Cluster of Differentiation 31
CI: “Conformity Index”, Konformite İndeksi
cm: santimetre
CMF: Siklofosfamid, Metotreksat, Florourasil
CO2: Karbondioksit
CTCAE: Common Terminology Criteria for Adverse Events
CTV: Clinical Target Volume
DBCCG: Danish Breast Cancer Cooperative Group
DHI: “Dose Homogeneity Index”, Doz Homojenite İndeksi DKİS: Duktal Karsinoma İn Situ
DLCO: “Diffusing Capacity of the Lungs for Carbon Monoxide”, Karbonmonoksit difüzyon kapasitesi
DRR: Digital reconstructed radiography DSÖ: Dünya Sağlık Örgütü
XII
DVH: “Dose Volume Histogram”, Doz Hacim HistogramıEBCTCG: Early Breast Cancer Trialists’ Collaborative Group
EGFR : Epidermal Growth Factor Receptor
EORTC: European Organisation for Research and Treatment of Cancer
FDG PET: Fluorodeoxyglucose Positron Emission Tomography
FEV1: Forced Expiratory Volume in One Second FIF: “Field-in-Field”, Alan-içi-Alan
FSORO: “French Society of Radiation Oncology”, Fransa Radyasyon Onkolojisi Derneği
FVC: Forced Vital Capacity
g: gram
GEC-ESTRO: Groupe Européen de Curiethérapie of European Society for Radiotherapy and Oncology
GSK: Genel Sağkalım
GTV: Gross Tumor Volume
Gy: Gray
HER-2: Human Epidermal Growth Factor Receptor 2 HKE: Hollanda Kanser Enstitüsü
HRCT: High Resolution Computered Tomography HSK: Hastalıksız Sağkalım
HU: Hounsfield Unit
IBCSG: International Breast Cancer Study Group
ICAM-1: Intercellular Adhesion Molecule 1
IL: Interleukin
İDK: İnvaziv Duktal Karsinom
İHK: İmmünhistokimya
XIII
KAH: Koroner Arter HastalığıKGF: Keratinocytes Growth Factor
KHDAK: Küçük Hücreli Dışı Akciğer Kanseri
KOAH: Kronik Obstrüktif Akciğer Hastalığı
KT: Kemoterapi
LKİS: Lobüler Karsinoma İn Situ
LVİ: Lenfovasküler İnvazyon Mİ: Mammarya İnterna
MKC: Meme Koruyucu Cerrahi
MKT: Meme Koruyucu Tedavi
MLC: “Multi Leaf Collimator”, Çok Yapraklı Kolimatör
MRG: Manyetik Rezonans Görüntüleme
MRM: Modifiye Radikal Mastektomi
NCCN: National Comprehensive Cancer Network
NCIC-CTG: National Cancer Institute of Canada Clinical Trials Group
NF-ĸB: Nuclear Factor ĸB
NSABP: National Surgical Adjuvant Breast and Bowel Project O2: Oksijen
OAD: Ortalama Akciğer Dozu
ÖR: Östrojen Reseptörü
PCI: “Pittsburg Cancer Institute”, Pittsburg Kanser Enstitüsü PDGF: Platelet-Derived Growth Factor
PM: Parsiyel Mastektomi
PM: Parsiyel Mastektomi PR: Progesteron Reseptörü
XIV
QUANTEC: Quantative Analysis of Normal Tissue Effects in the ClinicROS: “Reactive Oxygen Species”, Reaktif Oksijen Ürünleri
RP/F: Radyasyon Pnömonisi/Fibrozisi RT: Radyoterapi
RTOG: Radiation Therapy Oncology Group
RV: Rezidüel Volüm
SAD: Source-axis distance
SFT: Solunum Fonksiyon Testi
SLNB: Sentinel Lenf Nodu Biyopsisi
SOMA/LENT: Subjective, Objective, Management, Analytic/Late Effects NormalTissue
SPECT: Single Photon Emission Computed Tomography
SSD: Source-skin distance
TD5/5: 5 yılda %5 komplikasyon oranını ifade eden tolerans dozu
TGF: Transforming Growing Factor
TLC: “Total Lung Capacity”,Total Akciğer Kapasitesi
TM: Total Mastektomi
TNF-α: Tumor Necrosis Factor-alpha UMSK: Uzak Metastazsız Sağkalım
UOM: “University of Michigan”, Michigan Üniversitesi
V(x): En az (x) doz alan akciğer volümü yüzdesi vb.: ve benzerleri
VCAM-1: Vascular Cell Adhesion Molecule 1
VCU: “Virginia Commonwealth University”, Virginia Commonwealth Üniversitesi
VEGF: Vascular Endothelial Growth Factor”
XV
>: Büyük≤: Küçük eşit
1
1. Giriş
Meme kanseri, Dünya Sağlık Örgütü (DSÖ)’ye göre tüm dünyada 60 yaş altı kadınlarda en sık görülen kanserdir. Meme kanseri nedeni ile 2011 yılında tüm dünyada 508000’den fazla kadın hayatını kaybetmiştir (DSÖ 2013). Meme kanseri görülme insidansı gelişmekte olan ülkelerde her 100000 kişide 40’ın altındadır (GLOBOCAN 2008). Türkiye’de de kadınlarda en sık görülen kanser meme kanseri olup, oranı her 100000 kişide 40,6’dır (Türkiye Halk Sağlığı Kurumu, 2009). Yaşamın uzaması, şehirleşmenin artması ve batı yaşam şeklinin benimsenmesi ile birlikte meme kanseri insidansı artarken; meme kanseri taramaları ve toplum farkındalığı ile meme kanseri günümüzde daha erken evrelerde saptanmaya başlamıştır.
Erken tanı, meme kanseri sağkalımını arttırmada önemli faktörlerdendir. Tüm yaştaki kadınlar için toplum bazlı mammografi taraması yapılanlarda yapılmayanlara göre meme kanserine bağlı ölüm oranının %20 daha düşük olduğu kanıtlanmıştır (DSÖ). Tüm Kuzey Amerika grupları 50 yaş ve üzerindeki tüm kadınların mamografi ve/veya klinik meme muayenesi ile taranmasını önerirken, 40’lı yaşlardaki kadınlar için ise kar-zarar oranları göz önüne alındığında tarama tartışmalıdır.
Meme kanserinde tedavi kararı; tümör (tümör çapı, TNM evresi, tümör biyolojisi vb.) ve hasta (yaş, komorbidite vb.) özelliklerine göre verilmekte olup cerrah, radyasyon onkoloğu ve tıbbi onkoloğun, özellikle genç olgularda tıbbi genetikçiler ve jinekologların da katılımıyla multidisipliner bir yaklaşımla belirlenmelidir (1).
Meme kanserinde radyoterapi (RT), genellikle cerrahi sonrası adjuvan tedavi olarak planlanmaktadır. İnvaziv kanseri olan ya da karsinoma in situ nedeni ile meme koruyucu cerrahi (MKC) yapılan tüm olgulara adjuvan meme RT’si (kategori 1) uygulanmaktadır. Lokal ileri evre olgulara ise total mastektomi (TM) sonrası T3- T4 tümör, aksiller nod metastazı ve cerrahi sınır pozitifliği varlığında adjuvan RT (göğüs duvarına ve periferik lenfatiklere) uygulanmaktadır.
Radyoterapinin, meme kanseri tanılı olgularda sağkalım katkısı sağladığından, etkin ve güvenli bir şekilde uygulanması önem taşımaktadır. Meme kanseri nedeni ile RT alan olgularda erken dönem yan etkiler halsizlik, deride ısı artışı, kızarıklık, radyodermit, geç dönem yan etkiler ise cilt ve cilt altı dokularda fibrozis, yağ nekrozu, meme bölgesinde ağrı, yumuşak doku nekrozu, kosta fraktürü, elde-kolda lenfödem, omuz-kol hareket kısıtlılığı, brakiyal pleksus hasarı, akciğerde radyasyon pnömonisi (RP) ve fibrozis, sol meme kanserinde kardiyak morbidite ve mortalitedir. RT’ye bağlı erken dönem yan etkiler RT’nin uygulama döneminde hastaların çok büyük bir kısmında gözlenmekte ve RT’nin tamamlanması ile azalarak sona ermektedir. Geç dönem yan etkiler ise hastaların çok az bir kısmında (%5’den az) gözlenen ciddi yan etkilerdir.
Toraks bölgesine RT alan akciğer, meme, hematolojik maligniteli olgularda akciğer dokusunun radyasyona maruziyeti sonucunda, bazı olgularda erken dönemde RP ve takip eden dönemde radyasyon fibrozisi gelişmektedir (2, 3). RP, alveollerde akut eksudasyona ve inflamatuar hücrelerin migrasyonuna bağlı olarak genellikle RT bittikten 4-12 hafta sonra oluşur. Klinik RP; kuru öksürük, ateş ve akciğer grafisinde spesifik olmayan görünümle karakterizedir. Belirtiler ciddi olduğunda uzun
2
dönem oral veya inhaler steroid kullanmak gerekmektedir. RP iyileşme ile sonuçlanabileceği gibi şiddetli olduğu zaman fibrozisle de sonuçlanabilir. Radyasyona bağlı akciğer fibrozisi parankimin yanısıra plevrada da görülebilir. Radyasyon pnömonisi ve fibrozisi “Radiation Therapy Oncology Group” (RTOG)/”European Organisation for Research and Treatment of Cancer” (EORTC) kriterlerine göre değerlendirilir ve derece 0’dan 5’e kadar sınıflandırılır. Radyasyona bağlı klinik akciğer pnömonisi insidansı oldukça düşük olup radyolojik akciğer hasarı hemen hemen tüm olgularda görülmektedir. Fibrozis derecesi RT dozuna, RT`den etkilenen akciğer volümüne, fraksiyonasyona, eş zamanlı kemoterapi (KT) kullanımına bağlı olarak değişmektedir (4, 5). “Quantitative Analysis of Normal Tissue Effects in the Clinic” (QUANTEC) radyasyonla organlarda hasar oluşma ihtimali konusunda yapılan çalışmalar sonucunda elde edilen verilere göre çeşitli eşik değerler veren bir rehberdir (6). Akciğerde de RT’ye bağlı semptomatik pnömoni oluşma ihtimali konusunda çeşitli değerler vermektedir. RP riskini %20’nin altında tutmak için total akciğer V20’sini %30-35 aralığında ve ortalama akciğer dozu (OAD)’nu 20-23 Gray (Gy) aralığında sınırlandırmak önerilmektedir (7-10).Çalışmamızda meme kanseri nedeniyle RT uygulanan olguların takip döneminde çekilen toraks bilgisayarlı tomografi (BT)’leri akciğerdeki radyolojik radyasyon hasarı açısından değerlendirilmiş, hasar bulguları detaylıca tanımlanmış, Nishioka radyasyon pnömonisi/fibrozisi (RP/F) sistemine göre derecelendirilmiş ve bu radyolojik değişikliklerin klinik ve dozimetrik veriler ile ilişkisi sorgulanmıştır.
3
2. Genel Bilgiler
2.1. Meme anatomisi, kan ve lenfatik dolaşımı ve innervasyonu
Meme, modifiye bir ter bezidir (11). Anterior torasik duvarın en ön kesiminde yer alır. Medialde sternuma, lateralde ise orta aksiller çizgiye kadar uzanır. Meme şekli genetik faktörler tarafından etkilenir ve diskoid, konik, hemisferik ve benzer şekillerde olabilir (12).
Genellikle 2. kostanın üst kısmı ile 6.-7. kostanın alt kısmı arasında yer alır (13). Toraksın önünde yüzeyel fasyadadır ve derinde pektoral kaslardan derin fasya ile ayrılır. Meme derin fasyadan kolayca ayrılabilir (14). Cooper ligamanları yüzeyel fasyanın derin tabakasından dermişe uzanan bağ dokusu elemanı olup meme parankim lobları arasından geçer ve ayrıca parankim ve duktuslara yapışıktır (13). Derinde memenin büyük kesimi pektoralis major kası üzerindedir. Lateralde serratus anterior kasının, medialde rektus kası kılıfının üst kısmını örter (15). Meme glandüler doku, fibröz doku ve yağ dokusundan meydana gelir (16). Yüzeyelden derine doğru meme üç alana ayrılır (11):
1. Premammarian (subkutan) alan: Cilt ile anterior meme fasyası arasındadır.
2. Mammarian alan: Anterior fasya ile posterior fasya arasındadır. Duktuslar ve dallarını, terminal duktolobüler ünitenin büyük kısmını ve fibröz stromal elemanların büyük kısmını içerir.
3. Retromammarian alan: Yağ, kan damarları ve lenfatikleri içerir.
Meme, 15-20 lobdan (segmentten) meydana gelir (11). Her bir lob meme başından başlayarak ışınsal tarzda doku içine dağılmıştır. Her bir lobun meme başına doğru yönelmiş olan ayrı bir kanalı mevcuttur. Her lob 20-40 lobulus içerir. Her bir lobulusta da 10-100 adet asinus (duktül) vardır. Asinuslar birleşerek terminal duktusa (intralobüler ve ekstralobüler segmentten oluşur) açılırlar (17). Bir terminal duktusun intralobüler segmenti ile buna açılan asinuslar lobulusu oluşturur. Bu yapı terminal duktolobüler ünittir (18, 19). Terminal duktuslar birleşerek subsegmental duktusu oluştururlar. Bunlar da birleşirler ve segmental (laktifer) duktus meydana gelir. Laktifer duktus meme başında genişler, laktifer sinüs olarak isimlendirilir. Laktifer sinüs de ampulla ile meme başından dışarı açılır (17). Laktifer sinüs, laktasyonda sütün toplandığı yerdir (14). Areolada sebase glandlar vardır. Gebelikte areola ve meme başını koruyan bir madde salgılar. Areola altında yağ yoktur. Meme başı areola orta kesiminde yerleşmiş koni ya da silindir şeklinde çıkıntıdır. Yağ içermez. Genellikle dördüncü interkostal aralıktadır. Ancak kişiden kişiye farklılık gösterebilir. Meme başının ucunda laktifer sinüslerin açıldığı yerler vardır (14).
Aksiller kuyruk, yukarı ve laterale doğru uzanan, derin fasyayı delen ve aksiller damarlarla yakın komşulukta olan kısımdır (20).
Kan Dolaşımı:
Arterler: Beslenmesi internal torasik arterin (internal mammarian arter) perforan dalları, interkostal arterler ve aksiller arterden çıkan çok sayıdaki daldan olur (20).
Venöz drenaj: Drenajın büyük kısmı aksiller venedir. Ayrıca internal torasik, lateral torasik ve interkostal venleredir (14).
4
Meme, yüzeyel ve derin lenfatik akıma sahiptir. Yüzeyel lenfatikler meme dokusunun üzerindeki derinin lenfatikleridir ve subepitelyal ve subdermal lenfatik pleksus olarak ikiye ayrılırlar. Memenin yüzeyel lenfatikleri esas olarak derin lenfatikler aracılığıyla aksiller lenf bezlerine, sekonder olarak subklaviküler ve mammarya interna (Mİ) lenf bezlerine drene olurlar (21, 22). Derin lenfatikler ise meme dokusu lenfinin esas drenajını oluşturan gruptur. Aksiller, subklaviküler lenf bezlerine drene olurlar (22).Meme lenfatik drenajında başlıca akım aksillaya doğrudur ve tüm meme drenajının yaklaşık %80-97’sini kapsar. Hem aksilla hem Mİ lenf bezlerine drenaj %20-25, yalnız Mİ lenf bezlerine drenaj ise %3-6 civarındadır (23).
Meme lenf akımının drene olabileceği lenf yolları; 1-) Aksiller lenf yolu
Anatomik
Eksternal mammaryan grup (anterior ya da pektoral grup) Skapuler grup (posterior ya da subskapuler grup)
Santral grup
İnterpektoral grup (Rotter) Aksiller grup (lateral)
Subklaviküler lenf bezleri (apikal) 2-) Supraklaviküler lenf yolu (seviye IV)
3-) Mİ lenf yolu
4-) Karaciğer giden lenf yolu
5-) Kontralateral memeye giden lenf yolu’dur.
İnnervasyon:
Meme 2.-6. interkostal sinirlerin lateral ve anterior kutanöz dalları ile innerve olur. Sensöryel ve sempatik lifler içerirler (24).
2.2. Meme kanseri patolojisi ve evreleme
Meme kanseri yeni tanı alan kanserlerin %23’ünü oluşturmaktadır ayrıca kadınlarda en sık görülen kanserdir. Nadir görülen tiplerde dikkate alındığında oldukça fazla histopatolojik alt grubu içermektedir. En sık görülen tipler epitelyal meme kanserleridir. DSÖ’ne göre en sık görülen meme kanseri tipi invaziv duktal karsinom (İDK) olup, meme kanserleri arasındaki oranı %40 ile %75 arasındadır. Sıklıkla görülen diğer tipler; invaziv lobüler karsinom (İLK), tübüler, medüller, müsinöz ve invaziv kribriform karsinomlardır. Mezenkimal tümörler, hematolojik maligniteler, solid organ tümörü metastazları daha az sıklıkla karşımıza çıkmaktadır.
Meme kanseri evrelemesi tedavi kararını belirlemede önemli yer tutar. Evrelemede, Amerikan Kanser Komitesi (AJCC) 2010 TNM sistemi kullanılmaktadır (Tablo 2-1). TNM’ye göre yapılan evreleme Tablo 2-2’de gösterilmiştir.
5
Klinik evreleme; ayrıntılı cilt, meme ve lenf bezi (aksiller, supraklaviküler ve servikal) gözlemi ve muayenesi, görüntüleme ile de meme veya meme kanserini tanımlayacak diğer dokuların değerlendirme basamaklarını kapsar. Bu bulgular neoadjuvan tedavi ( KT, hormonoterapi ve/veya RT) sonrasında elde edildi ise TNM sınıflamasında “yc” kısaltması kullanılır (25).Patolojik evreleme; klinik evreleme bulgularına ek olarak cerrahi gözlem ve rezeksiyon materyalinin makroskopik ve mikroskobik olarak değerlendirilmesini içerir. Cerrahi girişim neoadjuvan tedavi sonrasında yapıldı ise TNM sınıflamasında “yp” kısaltması kullanılır (25).
6
Tablo 2-1: Meme tümörleri için Amerikan Kanser Komitesi (AJCC) 2010 TNM sınıflamasıT(Tümör) TX : Primer tümör değerlendirilemiyor T0 : Primer tümör bulgusu yok Tis (DKİS) : Duktal karsinoma in situ Tis (LKİS) : Lobüler karsinoma in situ Tis (Paget) : Meme başının Paget Hastalığı T1mi : 1 mm (mikroinvazyon) T1a : >1 mm≤5 mm T1b : >5 mm≤10 mm T1c : >10 mm≤20 mm T2 : >20 mm ≤50 mm T3 : >50 mm
T4a : Göğüs duvarına invazyon (sadece pektoral kas invazyonu yeterli değil) T4b : Ülserasyon ve/veya satellit nodül ve/veya ödem
T4c : T4a+T4b
T4d : İnflamatuar karsinom
N (Bölgesel Lenf Nodları) (Klinik) NX : Bölgesel lenf nodları değerlendirilemiyor
N0 : Bölgesel lenf bezi metastazı yok
N1 : İpsilateral seviye I, II metastazı (fikse değil)
N2a : Fikse ya da grup oluşturmuş ipsilateral aksiller lenf nodlarında metastaz
N2b : Klinik olarak aşikar aksiller lenf bezi metastazı olmadığı durumlarda klinik olarak saptanmış ipsilateral internal mammaryan lenf bezi metastazı
N3a : İpsilateral infraklaviküler lenf bezi metastazı
N3b : İpsilateral aksiller ve internal mammaryan lenf bezi metastazı N3c : İpsilateral supraklaviküler lenf bezi metastazı
N (Bölgesel Lenf Nodları) (Patolojik) pNX : Bölgesel lenf nodları değerlendirilemiyor
pN0(i-) : Histolojik ve immunohistokimyasal olarak negatif
pN0(i+) : Histolojik ve immunohistokimyasal olarak saptanmış izole tümör hücreleri pN0(mol-) : Histolojik olarak metastaz yok, moleküler bulgu (RT-PCR*) yok
pN0(mol+) : Pozitif moleküler bulgular (RT-PCR*) var, histolojik ya da immunohistokimyasal bulgusu yok
pN1mi : Mikrometastaz (>0,2 mm ve/veya >200 hücre, ≤2 mm ) pN1a : 1-3 aksiller lenf bezinde metastaz
pN1b : İnternal mammaryan lenf bezinde makro ya da mikrometastaz
pN1c : pN1a+pN1b
pN2a : 4-9 aksiller lenf bezinde metastaz
pN2b : Aksiller lenf bezi metastazı olmaksızın klinik olarak saptanmış internal mammaryan lenf bezi metastazı
pN3a : 10 ya da daha fazla aksiller lenf bezinde metastaz ya da infraklaviküler (seviye III) lenf bezlerine metastaz
pN3b : Bir ya da daha fazla metastatik aksiller lenf bezi varlığında klinik olarak aşikar ipsilateral internal mammaryan lenf bezi metastazı ya da üçten fazla aksiller lenf bezinde metastaz ve internal mammaryan lenf bezlerinde sentinel lenf bezi biyopsisi ile saptanan mikrometastaz ya da makrometastaz
pN3c : İpsilateral supraklaviküler lenf bezi metastazı M (Uzak Metastaz) M0 : Uzak metastaz yok
cM0(i+) : Klinik ve radyolojik bulgu olmaksızın kemik iliği, uzak organ, lenf bezleri ve kanda dolaşan ≤0,2 mm tümör hücreleri
M1 : Uzak metastaz var
7
Tablo 2-2: Meme kanserinde evrelemeEvre 0 Tis N0 M0 Evre IA T1 N0 M0 Evre IB T0-T1 Nmi M0 Evre IIA T0 T1 T2 N1 N1 N0 M0 M0 M0 Evre IIB T2 T3 N1 N0 M0 M0 Evre IIIA T0 T1 T2 T3 T3 N2 N2 N2 N1 N2 M0 M0 M0 M0 M0 Evre IIIB T4 T4 T4 N0 N1 N2 M0 M0 M0 Evre IIIC T N3 M0 Evre IV T N M1
2.3. Meme kanserinde prognostik ve prediktif faktörler
Meme kanserinin kadınlarda en sık görülen kanser olması, çok geniş popülasyonu etkilemesi ve tedaviyle birlikte sağkalım oranlarının artması dolayısıyla bu kansere neden olan, kanserin hastaya olan etkisini ve prognozu belirleyen, tedaviye olan yanıtı öngörmemizi sağlayan etken ve belirteçler konusunu inceleyen birçok çalışma yapılmıştır. Prognostik faktörler hastalığın doğal gidişatını gösterebilecek ölçülebilir bir değişken iken prediktif faktörler hastalığın gidişatında tedaviye verilen yanıt ile ilişkilidir. Östrojen reseptörü (ÖR), progesteron reseptörü (PR) durumları, “human epidermal growth factor receptor 2” (HER-2) gen amplifikasyonu ve/veya ekspresyonu gibi faktörler hem prognostik hem de prediktif faktörlerdendir.
Prognostik faktörleri Amerikan Patologlar Derneği 1999 yılında üç gruba ayırmıştır (26):
Kategori 1: Prognostik önemi kanıtlanmış ve klinik olarak hasta tedavisinde faydalı olan faktörler.
Örnek olarak; TNM evrelemesi, histolojik tip, histolojik derece, mitotik indeks ve hormon reseptör durumu
Kategori 2: Biyolojik ve klinik olarak yaygın şekilde çalışılmış ancak önemi büyük çalışmalarla istatistiki olarak kanıtlanması gereken faktörler.
Örnek olarak; Her-2 neu proliferasyon indeksi, lenfatik ve kan damarı invazyonu, p53
Kategori 3: Prognostik önemlerini gösterecek yeterince çalışma yapılmamış diğer faktörler.
Örnek olarak; DNA plöidi analizi, mikrodamar dansitesi, “Epidermal Growth Factor Receptor” (EGFR), “Transforming Growing Factor” (TGF)-α, bcl-2, pS2 ve Katepsin D
8
Yapılan çalışmalara baktığımızda; tümör boyutu, lenf bezi metastazı olup olmaması, evre, histopatolojik tip, tümör derecesi, lenfovasküler invazyon (LVİ), ekstensif intraduktal komponent, ırk, yaş, cerrahi sınır ve tümörün proliferatif indeksinin prognostik faktörlerden olduğu gösterilmiştir.2.4. Meme kanserinde genel tedavi yaklaşımı
Meme kanseri tanısı konulduktan sonra tedavi yaklaşımını hastalığın evresine göre cerrahi, RT gibi lokal bölgesel tedaviler ile KT, hedefe yönelik tedaviler ve hormonoterapi gibi sistemik tedaviler oluşturur. Tedavi yaklaşımı ulusal ve uluslararası rehberler ışığında hastanın genel durumu, yaşı, ek diğer hastalıkları, özgeçmişi ve tedaviye uyumu gibi kişisel faktörleri de göz önüne alınarak yapılmaktadır.
2.4.1. Cerrahi
Yüzyıl kadar önce meme kanserinin lokal tedavisini, Halsted tarafından tanımlanan radikal mastektomi oluşturmaya başladı. Radikal mastektomide tüm meme dokusu, pektoral kaslar çıkarılmakta ve aksilla diseke edilmekteydi. Daha sonra bu cerrahi model pektoral kaslar çıkarılmayacak şekilde değiştirilerek modifiye radikal mastektomi (MRM) yapılmaya başlandı.
Kynes, 1937 yılında meme kanseri tedavisinde yeni bir yaklaşım getirerek tümörün lokal eksizyonu ardından eksizyon alanına ve aksillaya radium implantı ile tedavi eklenmesini tanımladı. Meme dokusunun bir kısmının çıkarıldığı bu cerrahi daha sonra; lumpektomi, geniş lokal eksizyon, kadranektomi, tümörektomi, segmental mastektomi, parsiyel mastektomi (PM) ve en yaygın kullanımla MKC olarak tanımlanmıştır. Kynes’in kendi serisi radikal mastektomi ile benzer sonuçlar vermiş olup daha sonra yapılan randomize çalışmalar da erken evre meme kanserinin lokal tedavisinde, MKC ve sonrasında RT’nin standart yaklaşım haline gelmesini sağlamıştır. MRM ile meme koruyucu tedavi (MKT; meme koruyucu cerrahi ve radyoterapi) yaklaşımını karşılaştıran randomize çalışmalar RT bölümü içerisinde detaylıca anlatılacaktır.
National Comprehensive Cancer Network (NCCN) 2016 Versiyon 2 rehberinde (27) MKT konseptinin kesin ve göreceli kontrendikasyonları Tablo 2-3’de özetlenmiştir.
Hem evreleme hem de bölgesel tedavi olarak kullanılan aksiller diseksiyon (AD), meme kanseri yayılımında lenfatik yolun etkili olduğunun anlaşılmasıyla birlikte mastektomi ile birlikte yapılmaya başlanmıştır. AD, radikal ve modifiye radikal mastektomi operasyonun bir parçasıdır. AD’de genel yaklaşım seviye I ve seviye II’deki lenf nodlarını çıkarmak olup optimal aksiller evreleme için en az 10 lenf nodunun çıkarılması önerilmektedir. Eğer seviye II’de gross hastalık varsa AD’u seviye III’ü de dahil edecek şekilde genişletmek gerekmektedir. AD sonrasında kol ödemi, duyusal kusur, ağrı, omuz hareket kısıtlılığı yan etkileri görülebilmektedir. İkibinli yılların başlarında
9
aksillasında klinik değerlendirmede lenf nodu metastazı olmayan hastalarda sentinel lenf nodu biyopsisi (SLNB)’nin AD kadar güvenli olduğu kanıtlanmış ve standart yaklaşım haline gelmiştir.Tablo 2-3: MKT konseptinin kesin ve göreceli kontrendikasyonları; NCCN 2016 Versiyon 2 (27)
Mutlak kontrendikasyonlar Göreceli kontrendikasyonlar
Hamilelikte RT
Yaygın şüpheli ya da malign görünümlü mikrokalsifikasyonlar
Düzgün bir kozmetik ve negatif cerrahi sınırla çıkarılamayacak büyüklükte lezyon olması Yaygın pozitif cerrahi sınır
Daha önce göğüs duvarı ya da memeye RT yapılması
Deriyi içeren aktif bağ dokusu hastalığı (özellikle skleroderma ve lupus) Tümör >5 cm (kategori 2B) Pozitif cerrahi sınır
Meme kanserine bilinen ya da şüpheli yatkınlığı olan kadınlar
Aksiller yaklaşıma göre yan etkilerin sorgulandığı ilk ve önemli bir randomize prospektif çalışma olan Almanac çalışmasında, klinik nod negatif invaziv meme kanserli olgular SLNB veya AD uygulanmasına göre randomize edilmişlerdir (28). Çalışma Kasım 1999-Ekim 2003 arası yapılmış, 515 hastaya SLNB yapılırken 516 hastaya AD uygulanmıştır. SLNB yapılan olgularda metastaz saptanması durumunda tedavi oldukları merkeze göre ya AD eklenmiş ya da aksiller RT uygulanmıştır. Olgular aksiller cerrahi sonrası 1, 3, 6 ve 12. aylarda değerlendirilmişlerdir. Orta veya ciddi lenfödem 12. ayda SLNB grubunda %5, AD grubunda %13 (p<0,001); tedaviden 1 ve 12 ay sonra duyu kusuru SLNB yapılanlarda %18-%11, AD yapılanlarda %62-%31’dir (p<0,001) ve tüm değerlendirme zamanlarında iki grup arasındaki istatistiksel anlamlı farklılık devam etmektedir. Dren kullanımı, hastanede kalış süresi ve normal gündelik yaşama dönme süresi SLNB kolunda daha düşüktür (p<0,001). Omuz fleksiyon ve abduksiyonundaki kısıtlılık 1. ayda SLNB kolunda daha azken (p=0,004 ve 0,001) takip döneminde olguların kısıtlılığının düzelmesiyle arada fark kalmamıştır. Aksilla cerrahi süresi SLNB kolunda ortanca 17 dakika iken AD kolunda 20 dakikadır. (p=0,055) Özetle, SLNB yapılanlarda yaşam kalitesi daha iyi, kol morbiditesi daha az olup çalışmanın sonucunda klinik nod negatif, erken evre meme kanseri tanılı olgularda aksiller yaklaşım olarak SLNB önerilmektedir.
Sadece SLNB yapılan olgularda AD yapılanlara göre lenfödem, ağrı ve duyusal kayıplar gibi kol ve omuz morbiditesi daha düşük oranda gözlenmektedir. Veronesi’nin 2003 yılındaki randomize çalışmasında tümör boyutu 2 cm’den küçük ve PM yapılan olgular iki gruba ayrılmıştır. İlk grup AD grubu olup SLNB ve ardından AD yapılan 257 olgu, ikinci grup ise SLNB grubu olup SLNB sonucuna göre AD kararı belirlenen 259 olgudan oluşmaktadır (29). Bunlardan 92’sinde SLNB’de
10
metastaz olması üzerine AD eklenmiş, kalanına ise ek işlem yapılmamıştır. Çalışmadaki tüm olgular ipsilateral memeye adjuvan RT almış ve KT kötü prognostik kriterlere sahip olanlara verilmiştir. Bu çalışmanın 2010’da 10 yıllık sonuçları yayınlanmış, gruplar arasında genel sağkalım (GSK), uzak metastaz, meme kanserine bağlı gelişen olaylar açısından istatistiki anlamlı bir fark bulunamamış olup AD’nin SLNB sonucuna göre yapılması, SLNB’de lenf nodu metastazı saptanmadığında AD yapılmaması önerilmiştir (30). Bu yaklaşım ile postoperatif morbidite ve hastanede kalış süresinin azalması sağlanmaktadır. “National Surgical Adjuvant Breast and Bowel Project” (NSABP) B-32 çalışmasında klinik olarak aksillası negatif olan hastalar incelenmiş ve bu çalışmanın sonucunda da SLNB’de metastaz saptanmadığı durumda AD yapılmamasının güvenli olduğu gösterilmiştir (31).SLNB’de tümör metastazı saptandığında, yakın geçmişte rutin AD yapılırken artık günümüzde hasta özellikleri ve tümör özellikleri dikkate alınarak hasta bazında bireyselleştirilmiş AD kararı verilmektedir. “American College of Surgeons Oncology Group” (ACOSOG) Z0011 çalışmasında ise klinik T1-T2 invaziv meme kanseri tanılı, fizik muayenede aksiller lenfadenopatisi olmayan SLNB’de 1 veya 2 metastazı olan olgular AD yapılması veya yapılmamasına göre randomize edilmişlerdir (32). Tüm olgulara lumpektomi ve ardından tüm meme RT’si uygulanmıştır. SLNB’de 3 veya fazla lenf nodunda metastaz olanlar, yaygın ekstranodal yayılımı olanlar ve neoadjuvan KT veya HT alan olgular çalışmaya dahil edilmemişlerdir. Çalışmanın sonucunda AD yapılan olgularla yapılmayan olgular arasında 5 yıllık GSK ve hastalıksız sağkalım (HSK) arasında bir fark saptanmamıştır. Bu çalışmanın RT’yi ilgilendiren kısmı ve eleştirisi “Bölgesel lenf nodlarına radyoterapi” konu başlığı altında anlatılmıştır
.
Benzer bir çalışma olan “International Breast Cancer Study Group” (IBCSG) 23-01 çalışmasında tümör boyutu ≤5 cm, SLNB’de 1 veya daha fazla lenf nodülünde mikrometastaz olan (≤2 mm) olan meme kanseri tanılı olgular SLNB sonrası AD yapılıp yapılmamasına göre randomize edilmişlerdir (33). Bu olguların karşılaştırılmasında, 5 yıllık HSK ve GSK açısından bir fark bulunmamıştır.En güncel çalışmalardan biri olan EORTC 10981-22023 AMAROS çalışması neticesinde SLNB’de metastaz saptansa bile AD yerine aksiller RT uygulanmasıyla benzer sağkalım oranları elde edildiği gösterilmiştir (34).
2.4.2. Sistemik tedaviler
2.4.2.1. Kemoterapi ve hedefe yönelik tedaviler
Meme kanserinde adjuvan KT’nin kullanılmasına yönelik yapılan ilk randomize çalışma; 1958 yılında başlayan ve 1967’de yayınlanan Fisher ve ark. tarafından yapılan NSABP B-01 çalışmasıdır (35). Bu çalışmada meme kanseri nedeniyle radikal mastektomi yapılan, aksiller 4 veya daha fazla lenf nodu metastazı olan premenopozal kadınlara Triethylenethiophosphoramide (Thio-TEPA)’nın verilmesiyle yineleme oranının azaldığı belirtilmiştir. Fisher ve ark. tarafından 1975 yılında yayınlanan başka bir çalışmada meme kanseri dolayısıyla adjuvan l-Phenylalanine mustard (L-PAM) verilen premenopozal kadınlarda yinelemenin istatistiki anlamlı şekilde daha az olduğu gösterilmiştir
11
(p=0,008) (36). Meme kanserinde ilk kulanılan kombine KT rejimlerinden birisi siklofosfamid, metotreksat, florourasil (CMF)’dir. CMF’in meme kanserinde adjuvan tedavideki rolü 1976 yılında yayınlanan Bonadonna ve ark. tarafından yapılan Milan çalışmasında gösterilmiştir (37). İçinde antrasiklin içeren siklofosfamid, adriamisin, florourasil (CAF) rejimini CMF ile karşılaştıran 1978 yılında yayınlanan Bull ve ark.’nın çalışmasında, metastatik meme kanseri tanılı olgular değerlendirilmiş olup antrasiklin kolunda tedaviye daha iyi yanıt gözlendiği ancak hem hematolojik hem de genitoüriner yan etkilerin antrasiklin kolunda daha yüksek olduğu belirtilmiştir (38). Bull ve ark.’nın çalışması, NSABP B-15 çalışması ve “Early Breast Cancer Trialists' Collaborative Group” (EBCTCG) meta-analizi de antrasiklin bazlı rejimlerin sonuçlarının CMF’e göre daha iyi olduğunu göstermiştir (39, 40). CAF’ın RT ile etkileşimi merak edilmiş ve eş zamanlı uygulamalarına yönelik çalışmalar yapılmıştır. Yan etkiler dolayısıyla antrasiklin bazlı KT’ler ile RT’nin ardışık olarak uygulanmasının daha uygun olacağı yönünde görüş mevcuttur. RT’nin mi yoksa KT’nin mi öncelikle başlanacağına yönelik yapılan ilk çalışma ise “upfront-outback” çalışmasıdır (41). MKC yapılmış 244 erken evre meme kanseri tanılı olgu, 12 kür siklofosfamid, adriamisin, metotreksat, florourasil ve prednison tedavisini, RT öncesi veya sonrası alacak şekilde randomize edilmiştir. Takip süresinin ortanca 58 ay olduğu erken sonuçlarda RT ile başlayan kolda 5 yıllık uzak metastaz oluşumu %36 iken, KT ile başlayanlarda %25 bulunmuştur (p=0,05). Bu nedenle sistemik metastaz riski taşıyan olgularda, tedaviye öncelikle KT ile başlanmasına karar verilmiştir. Aynı çalışmanın takip süresinin ortanca 135 ay olduğu geç sonuçlarında ise her iki grup arasında fark saptanmamıştır (42). Altı kür KT (CMF veya CAF)’ın arasına 3 kürden sonra RT eklenmesi ve RT sonrası 3 kür daha KT verilmesi yani sandiviç uygulamasının ardışık uygulamalara göre sonucunun daha kötü olduğunu gösteren retrospektif bir çalışma mevcut olup günlük pratikte sandiviç uygulama tercih edilmemektedir (43).İkibinli yıllarla birlikte, hücrenin G2-M fazına etki eden bir KT ajanı olan taksanlar tedavi algoritmalarına girmiştir. Taksanların sağkalım üzerine anlamlı etkisi 15500 hastayı içeren adjuvan taksan çalışmasında gösterilmiştir (44). İyonizan radyasyonun da G2-M fazında hücreye letal etkisinin yüksek olması nedeni ile paklitaksel ve dosetaksel ile eş zamanlı RT uygulamaları araştırılmış fakat cilt hasarı, pnömoni gibi yan etkiler dolayısıyla eş zamanlı değil ardışık uygulanmalarına karar verilmiştir (45-50). Dört kür adriamisin, siklofosfamid (AC) ve sonrasında dört kür Paklitaksel uygulaması, kabul edilebilir toksisite ile rekürrensi %17 oranında önlemiş olup lenf nodu metastazı olan yüksek riskli olgularda standart tedavi haline gelmiştir (51-53).
Adjuvan KT uygulamalarının yanısıra günümüzde neoadjuvan KT’ye eğilim artmaktadır. Neoadjuvan KT alanların cerrahi sonrası adjuvan KT alanlara göre birçok avantajı olduğu gibi bazı dezavantajları da mevcuttur (Tablo 2-4). NSABP B-18 çalışmasında olgular preoperatif (neoadjuvan) veya postoperatif AC almalarına göre randomize edilmişlerdir (54). Neoadjuvan KT grubundaki olgularda operasyon materyali incelendiğinde, olguların %43’ünde klinik kısmi yanıt ve %36’sında klinik tam yanıt görülürken %13 olguda ise patolojik tam yanıt görülmüştür. Neoadjuvan KT uygulanan grup önce cerrahi uygulanan grup ile karşılaştırıldığında, patolojik olarak aksiller lenf nodu negatifliği oranının daha yüksek olduğu saptanmıştır (sırasıyla %58-%42, p<0,001). Tanı anında tümör boyutu 5 cm veya üstünde olan hastalar klasik yaklaşımda TM’ye adayken, neoadjuvan KT ile
12
birlikte tümör boyutundaki küçülme bu hastalara MKC şansını vermektedir. Neoadjuvan ve adjuvan KT grupları arasında GSK ve HSK açısından istatistiki anlamlı bir fark bulunamazken; 50 yaş altı kadınlarda neoadjuvan KT ile, sağkalım avantajı açısından olumlu yönde bir eğilim görülmüştür (p=0,06 ve 0,09) . Diğer bir neoadjuvan KT çalışması olan NSABP B-27 çalışmasında; olgular dört kür AC sonrası cerrahi (grup 1), dört kür AC sonrası dört kür Dosetaksel ve sonrasında cerrahi (grup 2), dört kür AC sonrasında cerrahi ve onun sonrasında da dört kür Dosetaksel (grup 3) olacak şekilde randomize edilmişlerdir (54). Neoadjuvan dört kür AC sonrası dört kür dosetaksel uygulanması, klinik ve patolojik yanıt oranlarını istatistiki anlamlı olacak şekilde arttırmıştır. Dosetaksel eklenmesiyle GSK ve HSK açısından bir avantaj gösterilememiştir. Her iki çalışmada da neoadjuvan KT ile patolojik tam yanıt sağlanan olgularda yanıt vermeyenlere göre GSK ve HSK’ın daha iyi olduğu görülmüştür. Neoadjuvan KT alan hastalarda cerrahi sonrası RT endikasyonları “Postmastektomi radyoterapi” bölümünde anlatılmıştır.Tablo 2-4: Opere edilebilir lokal ileri meme kanseri tanılı olgularda cerrahi ve KT sıralaması avantajları
Cerrahinin önce uygulanması Neoadjuvan KT’nin önce uygulanması
Uzak metastaz kaynağı çıkarılır. KT’ye dirençli olgular için tanı ve
etkili tedavi arasındaki zaman aralığının kısalmasını sağlar.
Orijinal hastalığın büyüklüğü hakkında tam bilgiyi sağlar.
Mastektomi sonrası yineleme riski hakkında net prognostik bilgiyi sağlarken postmastektomi RT endikasyonunu belirlemektedir.
Etkili tümör yanıtı ile MKC yapılmasına olanak sağlar.
KT duyarlılığını değerlendirmeye olanak sağlar. Eğer tümör direçli ise KT değişimine olanak sağlar. Patolojik tümör yanıtı değerlendirilmesine izin verir
ve böylece hastalık prognozu hakkında bilgi verir. Kısa sürede sonlanım amacı olan (patolojik tam
yanıt) klinik çalışmalarla, farklı tedavi rejimlerinin karşılaştırılmasını sağlar.
Tedavi süresince birçok biyopsi alımı ve tümör görüntülemesine olanak sağlayarak tümör duyarlılığı ve direçliliğinin moleküler mekanizma-sını anlamamıza yardımcı olur.
Hedefe yönelik tedavilere baktığımızda HER-2/neu EGFR’ye karşı geliştirilmiş, humanize monoklonal antikor olan trastuzumabı inceleyen 5 randomize çalışmanın meta-analizinde, trastuzumabın mortalite, yineleme ve metastaz oranlarında azalma sağladığı gösterilmiştir (55). Trastuzumabın kardiyotoksisite yan etkisi nedeni ile özellikle antrasiklin bazlı KT’ler ile eş zamanlı kullanılmamaktadır.
Perou ve ark. 2000’li yılların başında meme kanserini heterojen bir hastalık grubu olarak tanımlamış ve moleküler özelliklerine göre; ÖR+/luminal-benzeri, bazal-benzeri, cErb-B2+ ve normal meme şeklinde dört gruba ayırmışlardır (56). Daha sonra luminal grup da kendi içerisinde; luminal A
13
ve luminal B olarak sınıflandırılmış ve bu moleküler alttiplerin KT duyarlılıklarının birbirinden farklı olduğu gösterilmiştir (57). St. Gallen konsensusunda; lenf bezi metastazı, tümör boyutu, derecesi, peritümöral vasküler invazyon, ÖR, PR, Her-2 neu durumu ve yaşa göre düşük-orta-yüksek risk grubu tanımlanmıştır. Yine St. Gallen konsensusunda ÖR, PR, Her-2 neu ve Ki-67 proliferasyon indeksine göre Luminal-A, Luminal-B, Her-2 pozitif ve “Triple negatif” grubu belirlenmiş ve gruplara göre tedavi yaklaşımı tanımlanmıştır. KT’den görülecek olası faydayı öngören prediktif testler geliştirilmiş olup bunlardan en çok kullanılanı Oncotype DX testidir. Rutinde kullanıma giren 21 genin incelendiği Oncotype DX testi yineleme riskini ve sistemik tedavinin faydasını öngörmemizi sağlamaktadır. NSABP B20 çalışmasında; ÖR pozitif olup lenf nodu metastazı olmayan olgularda, risk skoru (düşük risk ≤18, 18<orta risk <31, 31≤ yüksek risk) belirlenmesiyle uzak metastaz ihtimali tahmin edilmekte ve de olguların KT’den elde edeceği yarar ortaya konmaktadır (58). Gen analizini inceleyen testlerden diğeri, Amsterdam 70-gen profili testidir ve sağkalım konusunda bilgi vermektedir.2.4.2.2. Hormonoterapi
Östrojen ve progesteronun meme kanseri gelişimindeki rolü anlaşıldıktan sonra, bu yolağa etki eden tedavi yaklaşımları araştırılmıştır. Tamoksifen hedefe yönelik geliştirilmiş ilk ilaçtır. Modifiye Gail modeli ile 5 yıl içinde meme kanseri riski %1,67 ve daha fazla olan 13388 hastayı içeren NSABP P-1 çalışmasında, 5 yıl tamoksifen kullanımının invaziv ve non invaziv meme kanseri gelişimini %49 ve %50 oranında azalttığı gösterilmiştir (59). Tamoksifenin faydası tüm yaş gruplarında (≤49 yaş, 50-59 yaş ve ≥60 yaş) mevcuttur. Lobuler Karsinoma İn Situ (LKİS) tanılı olgularda da tamoksifenin etkinliği gösterilmiştir. Bu çalışmada, tamoksifenin ÖR pozitif tümör gelişimini azalttığı, ÖR negatif tümör gelişimine etkisinin olmadığı sonucuna varılmıştır. Ancak tamoksifen kullanımına bağlı evre I endometrium kanseri gelişme riskinde minimal bir artış olmaktadır (risk oranı 2,53). NSABP’nin tamoksifenle raloksifeni karşılaştıran randomize çalışması postmenopozal 19474 hastayı içermektedir. Raloksifenin invaziv kanser gelişimini azaltmada tamoksifene benzer etki gösterdiği, tromboemboli yan etkisinin daha az olduğu ama noninvaziv kanser gelişimini engellemede istatistiki anlamlı olmasa da daha etkisiz olduğu görülmüştür (60). NSABP B-24 çalışmasında, Duktal Karsinoma İn Situ (DKİS) tanılı lumpektomi ve RT yapılan olgularda tamoksifenin etkinliği araştırılmıştır (61). Beş yıl tamoksifen kullanan grupta, plasebo grubuna göre hem ipsilateral hem de kontralateral memede kanser gelişim oranının daha az olduğu saptanmıştır. ÖR pozitif olan meme kanseri tanılı kadınlarda 5 yıl tamoksifen kullanımının, 1-2 yıl tamoksifen kullanımına göre daha etkili olduğu EBCTCG’nin iki metaanalizinde gösterilmiştir (62, 63). NSABP B-14 çalışmasında, ÖR pozitif olan ve lenf nodu metastazı olmayan meme kanseri tanılı kadınlarda, 5 yıldan sonra tamoksifen kullanımına devam edilmesinde herhangi bir ek katkı gösterilememiştir (64). Ancak son dönemde yayınlanan ATLAS çalışmasında, ÖR pozitif meme kanseri tanılı kadınlarda 10 yıl tamoksifen kullanımının, 5 yıl tamoksifen kullanımına göre rekürrensi ve mortaliteyi azaltmada daha etkin olduğu gösterilmiştir (65).
Tamoksifenin etkinliği hem premenopozal hem de postmenopozal kadınlarda gösterilmişken daha sonraki çalışmalar postmenopozal kadınlarda aromataz inhibitörleri üzerinde olmuştur. ATAC
14
çalışmasının 10 yıllık takip periyodu sonuçlarında; meme kanseri tanılı postmenopozal kadınlara, tamoksifen yerine 5 yıl anastrazol verilip HSK, yineleme ve uzak metastaza kadar geçen süreye bakıldığında, anastrazol kullanımının istatistiki anlamlı olacak şekilde daha faydalı olduğu gösterilmiştir (66). Bu çalışmada aktif tedavi döneminde anastrazol kullanımıyla birlikte daha fazla kırık olayı gibi iskelet sistemi yan etkisi ile karşılaşılmıştır. “Breast International Group” (BIG) 1-98 çalışmasında postmenopozal hormon pozitif meme kanseri tanılı kadınlarda tamoksifen yerine letrozol kullanımı araştırılmış olup, letrozolün HSK ve uzak metastaz gelişimini engellemede tamoksifene göre istatistiki anlamlı olacak şekilde daha olumlu etkisi olduğu gösterilmiştir (67). “National Cancer Institute of Canada Clinical Trials Group” (NCIC-CTG) MA.17 çalışmasında, postmenopozal hormon reseptörü pozitif olan erken evre meme kanseri tanılı kadınlarda 5 yıl tamoksifen kullanımı sonrası olgular randomize edilmişlerdir (68). Bir gruba 5 yıl letrozol verilirken, diğer gruba plasebo verilmiştir. Letrozol grubunda hastalıksız sağkalım yüzdesi plasebo grubuna göre istatistiki anlamlı olacak şekilde daha yüksek bulunmuştur. Düşük dereceli sıcak basması, artrit, artralji ve miyalji yan etkileri letrozol grubunda daha fazla oranda görülürken vajinal kanama ise daha az oranda görülmüştür. Osteoporoz görülme sıklığı letrozol grubunda fazla iken bu fark istatistiki anlamlı değildir ve kırık oranları iki grup arasında benzerdir. Aromataz inhibitörlerinden exemestanın da postmenopozal kadınlarda etkin olduğu “Intergroup” exemestan çalışmasında ve TEAM çalışmasında gösterilmiştir (69).Meme kanserinde sistemik tedavilerin önemli komponenti olan homonoterapi ajanlarının RT ile eş zamanlı kullanımı, çeşitli çalışmalarda etkinlik ve yan etki profili açısından değerlendirilmiştir. RT ile eş zamanlı tamoksifen kullanılması akciğer fibrozis riskini arttırdığı için (70-74) klinik pratikte RT tamamlandıktan sonra başlanmaktadır. Steroidal ve nonsteroidal aromataz inhibitörlerinin ise RT ile eş zamanlı da uygulanması durumunda gösterilen olumsuz bir etki mevcut değildir.
2.4.3. Radyoterapi
2.4.3.1. Meme koruyucu cerrahi sonrası radyoterapi
Yirminci yüzyılın başında bütün evrelerde meme kanseri cerrahisi Halstedian yaklaşımla tüm meme dokusuyla birlikte göğüs duvarı kaslarının çıkarılması ve AD yapılması iken, erken evre olgularda 1970’lerden itibaren cerrahi ile sadece tümörlü dokunun etrafındaki sağlam doku ile birlikte çıkarılması yani MKC yapılması ve sonrasında adjuvan tüm memeye RT uygulanması geçerli yöntem olmaya başlamıştır.
Şu ana kadar birçok randomize çalışmada erken evre meme kanserinde MKC+RT’nin TM’ye sağkalım sonuçları açısından eş değer olduğu gösterilmiştir. Tablo 2-5’de bu konuda yapılmış randomize çalışmaların bir kısmı özetlenmiştir.
15
Tablo 2-5: Mastektomi ile MKC+RT’yi karşılaştıran prospektif randomize çalışmalarMilan (75) (1973-80) NSABP-B06 (76) (1976-84) NCI (77) (1979-89) EORTC 10801 (78) (1980-86) Danish 82TM (79) (1983-89) Hasta sayısı 701 1219 279 868 731 Takip (yıl) 20 20 25,7 22,1 19,6 GSK MKC+RT(%) Mastektomi(%) 58 59 p=1.0 46 47 p=0,74 38 44 p=0,38 39 45 p=0,225 58 51 p=0,2 NSABP: National Surgical Adjuvant Breast and Bowel Project; NCI: National Cancer Institute; EORTC: European Organization for Research and Treatment of Cancer
İlk randomize çalışma Londra’da Guy’s Hospital’da yapılmıştır (80). Evre I-II meme kanseri tanılı 370 olgu standart radikal mastektomi ve MKC kollarına randomize edilmiş olup mastektomi yapılan grup aksiller, supraklaviküler ve Mİ alanına RT alırken, MKC yapılan grup ek olarak memeye de RT almıştır. Evre I olgularda hem sağkalım hem de uzak metastaz açısından bir fark saptanmazken evre II olgularda meme ve aksiller yineleme oranları MKC+RT kolunda daha yüksek ayrıca artmış uzak metastaz nedeniyle sağkalım oranı da daha düşük bulunmuştur. Bu çalışmanın en önemli zayıf yönlerinden birisi, RT dozunun standart dozlardan oldukça düşük olmasıdır (meme için 35-38 Gy, aksilla için 25-27 Gy).
Fransa Gustave-Roussy Enstitü’sünde 1972-1979 yılları arasında yapılan, tümör boyutu 2 cm ve altında olan olgularda mastektomi ile MKC+RT’yi karşılaştıran prospektif randomize çalışmanın 22 yıllık sonuçlarında gruplar arasında ölüm oranı, bölgesel yineleme, uzak metastaz ve yeni primer kanser gelişimi açısından fark saptanmamıştır. Hem kontralateral memede yineleme hem de lokal yineleme MKC+RT kolunda istatistiki olarak daha yüksek bulunmuştur (p=0,05 ve p=0,03) (81).
Veronesi ve ark. tarafından yapılan Milan çalışmasında (75) ise, tümör boyutu 2 cm veya altında olan meme kanseri tanılı 349 olguya radikal mastektomi yapılırken, 351 olguya MKC (kadranektomi) ve ipsilateral memeye RT (tüm meme 50 Gy) ve ardından tümör yatağına boost (10 Gy) uygulanmıştır. Her iki grupta da eğer aksiller lenf nodu metastazı varsa olgular CMF KT’si almışlardır. Yirmi yıllık takip süresince MKC yapılan 30 olguda (kümülatif insidans %8,8), radikal mastektomi yapılan ise sekiz olguda (kümülatif insidans %2,3) lokal nüks görülmüştür (p<0,001). Kontralateral memede kanser, uzak metastaz, ikinci primer kanser ve uzun dönem sağkalım sonuçları açısından iki grup arasında fark saptanmamıştır.
NSABP B06 çalışmasında tümör boyutu 4 cm ve altında, evre I veya evre II invaziv meme kanseri tanılı ve aksiller lenf nodu metastazı olan veya olmayan 1851 olgu üç gruba randomize edilmiştir. Bu üç grup sırasıyla TM, sadece lumpektomi, lumpektomi ve sonrasında adjuvan meme RT’sidir. RT; tanjansiyel alanla tüm memeye 50 Gy olarak uygulanmış, boost yapılmamış ve aksilla tedavi edilmemiştir. Lumpektomi grubunda aksiller seviye I ve II’yi içeren AD yapılırken, TM