T. C.
İSTANBUL BİLİM ÜNİVERSİTESİ
SAĞLIK BİLİMLERİ ENSTİTÜSÜ
TIBBİ BİYOLOJİ VE GENETİK ANABİLİM DALI
C6 GLİOMA HÜCRELERİNDE MORİNDA CİTRİFOLİA VE
PAKLİTAKSELİN ETKİLERİNİN ARAŞTIRILMASI
Biyolog Elçin ÖZEN
YÜKSEK LİSANS TEZİ
İSTANBUL, 2009
T. C.
İSTANBUL BİLİM ÜNİVERSİTESİ
SAĞLIK BİLİMLERİ ENSTİTÜSÜ
TIBBİ BİYOLOJİ VE GENETİK ANABİLİM DALI
C6 GLİOMA HÜCRELERİNDE MORİNDA CİTRİFOLİA VE
PAKLİTAKSELİN ETKİLERİNİN ARAŞTIRILMASI
Biyolog Elçin ÖZEN
Tez Danışmanı
Prof. Dr. Tuncay ALTUĞ
YÜKSEK LİSANS TEZİ
İSTANBUL, 2009
İÇİNDEKİLER
Sayfa No 1. ÖZET ... 1 2. SUMMARY ... 2 3. GİRİŞ VE AMAÇ ... 3 4. GENEL BİLGİLER ... 4 4.1. GLİOBLASTOMA MULTİFORME (GBM) ... 44.2. C6 GLİOMA HÜCRE SOYLARI ... 5
4.3. MORİNDA CİTRİFOLİA (NONİ) ... 6
4.4. PAKLİTAKSEL ... 7
4.5. HÜCRE SİKLUSU ... 8
4.6. KANSER ... 10
4.7. β-KATENİN MOLEKÜLÜ ... 11
4.8. WNT SİNYAL İLETİ MEKANİZMASI ... 12
5. MATERYAL VE YÖNTEM ... 14
5.1. KULLANILAN KİMYASALLAR ... 14
5.2. KULLANILAN YÖNTEMLER... 15
5.2.1. Hücre kültürü ... 15
5.2.2. Hücre Proliferasyonunun Belirlenmesi ... 15
5.2.2.1. β-katenin İmmünositokimyası ... 15
5.2.2.2. Bromodeoksiuridin (BrdU) İmmünositokimyası ... 16
6. BULGULAR ... 17
6.1. MORİNDA CİTRİFOLİA VE PAKLİTAKSELİN C6 GLİOMA HÜCRELERİNDE PROLİFERASYON ÜZERİNE ETKİLERİNİN BROMODEOKSİÜRİDİN İLE GÖSTERİLMESİ ... 17
6.2. MORİNDA CİTRİFOLİA VE PAKLİTAKSELİN C6 GLİOMA HÜCRELERİNDE β KATENİN EKSPRESYONU ÜZERİNE ETKİLERİ ... 19
7. TARTIŞMA ... 22
8. SONUÇ ... 24
SİMGE VE KISALTMALAR
AEC : Aminoetilkarbezol
APC : Adenomatöz polipozis koli
β TrCP : β Transdusin tekrarları içeren protein
BrdU : Bromodeoksiuridin
CTNNB1 : Katenin β1 geni
Cdk : Siklin bağımlı kinaz
Cyc : Siklin
CKI : Siklin bağımlı kinaz inhibitörleri
Dsh : Dishevelled
DMEM : Dulbecco’nun modifiye eagle medyumu
FCS : Fetal sığır serumu
Fzd : Frizzled
GBM : Glioblastoma multiforme
GSK 3 β : Glikojen sentetaz kinaz 3 β
TNFα : Tümör nekroz faktör α
TCF/LEF : T hücre transkripsiyon faktörü/Lenfoid çoğaltıcı faktör
WHO : Dünya Sağlık Örgütü
1. ÖZET
Bu çalışmada in vitro C6 glioma hücre modelinde Morinda citrifolia (noni) ekstresi ve paklitakselin farklı konsantrasyonlarının β-katenin sinyal yolu ile hücre proliferasyonunda meydana getirdiği değişiklikler immünositokimyasal olarak incelendi.
Hücre proliferasyonunun değerlendirilmesinde hücre siklusunda S fazına özgü bir işaretleyici olan bromodeoksiuridin (BrdU) uygulandı. Noni ile inkübasyon sonrasında BrdU inkorporasyonunda kontrol gruba kıyasla azalma izlenirken, sadece paklitaksel uygulanan ve noniyle paklitakselin birlikte uygulandığı gruplarda S fazında hiç hücre gözlenmedi. Glioma hücrelerinde, plazma membranlarının intraselüler sınırları boyunca β-katenin ekspresyonu izlendi. Noni ekstresi ile inkübasyon sonrasında plazma membranı seviyesinde normal seviyelerde ekspresyon izlendi. Paklitaksel inkübasyonu sonrasında nükleusta belirgin β-katenin ekspresyonu izlendi. Noni ve paklitakselin birlikte uygulandığı gruplarda ise β-katenin ekspresyon ve lokalizasyonunda bir değişiklik olmadığı görüldü.
Çalışmamız sonucunda plazma membranında bulunan β-katenin ekspresyonunun noni ekstresi uygulamasıyla değişmediği, düşük dozda paklitaksel uygulamasında nükleustaki β-katenin ekspresyonunun arttığı izlendi.
2. SUMMARY
In this study, in in vitro C6 glioma cell model, different concentration of Morinda
citrifolia (noni) extract and paclitaxel dependent β-catenin signaling pathway and changes
in the cell proliferation are examined immunocytochemically.
To ases cell proliferation, S-phase spesific marker bromodeoxyuridin (BrdU) immunocytochemistry was performed. While a decrease in BrdU incorporation was observed after noni extract incubation, there was no S-phase cell after paclitaxel and combined noni extract and paclitaxel applications. In glioma cells, β-catenin expression was observed across the intracelluler margin of plasma membrane. After incubation with noni extract, no change in β-catenin expression of existing β-catenin was noticed. A significant increase was observed in nucleus β-catenin expression after paclitaxel incubation. Also after incubation with combined noni extract and paclitaxel no change in existing β-catenin expression was noticed.
As a result of our study, it was determined that, the expression of plasma membrane localized cell adhesion molecule β-catenin was not change by effect of noni extract, and β-catenin expression was decreased by effect of low dose paclitaxel in nucleus.
3. GİRİŞ VE AMAÇ
Morinda citrifolia, deniz seviyesindeki açık sahil kesimlerinde ve deniz
seviyesinden 400 metre yüksekliğe kadar ormanlık alanlarda bulunan yeşil renkli bir ağaçtır (1). Noni olarak da bilinen Morinda citrifolia birçok hastalığın tedavisinde ve ideal sağlık koşullarının oluşturulmasında kullanılmaktadır.
Paklitaksel porsuk ağacının (Taksus brevifolia) kabuğundan izole edilen, 853,9 dalton ağırlığında doğal bir alkoloidtir. Genellikle akciğer, göğüs, baş-boyun bölgesi tümörlerinin tedavisinde kullanılan kemoterapi ilacıdır.
Gliomalar ise malign beyin tümörlerinin büyük bölümünü oluştururlar. Glioblastoma multiforme neoplastik hücrelerin merkezi sinir sistemine infiltrasyonu sonucu nörolojik fonksiyon kaybına ve bunun sonucunda da ölüme yol açar (2).
Çalışmamızda noni ekstresi ve paklitakselin glioma hücreleri üzerindeki etkilerini izleyebilmek için sıçan C6 glioma hücre soyu kullanıldı. Çalışmamızın amacı noni ekstresi ve paklitaksel uygulaması sonrası glioma hücrelerinde β-katenin sinyal yolu ve hücre proliferasyonunda meydana gelen değişiklikleri izlemektir.
4. GENEL BİLGİLER
4.1. GLİOBLASTOMA MULTİFORME (GBM)
Santral sinir sistemi tümörlerinin en büyük grubunu glial hücrelerden gelişen ve glioma olarak bilinen tümörler oluşturur.
Beyin tümörlerinin bugünkü sınıflamasının temelini Wirchow atmıştır. 1860’da beynin hücrelerarası matriksi olan nörogliayı tanımlamıştır. Yine Wirchow tümörlerin mikroskopik ve makroskopik özellikleri arasında bağlantı kurmuş ve glioma tarifini de ilk kez yapmıştır. 1993 yılında Dünya Sağlık Örgütü (WHO) tümörlerin sınıflandırılmasını yayınlamış ve evre I-IV arasında tümörler benignden maligne doğru sınıflanmıştır (3). 2000 yılında bu sınıflandırma histopatolojik özellikler ve yaşam süresi verilerine dayandırılarak WHO tarafından güncellenmiştir (3).
Santral sinir sistemi tümörleri içinde, çocuk yaş grubunda primer tümörlerin yaklaşık %40-45’ini, erişkin yaş grubunda ise %50-60’ını astrosit kökenli tümörler
oluşturur. WHO’a göre astrositik tümörler 2 gruba ayrılır. 1) Diffüz infiltran astrositer tümörler
2) Daha iyi sınırlı astrositomların özel varyantları
Diffüz tipteki astrositomlar artan anaplazi oranına göre sınıflandırılırlar. WHO evreleme sistemine göre 4 gruba ayrılırlar. Evre IV olarak bilinen GBM erişkin yaş grubunda en sık rastlanan primer beyin tümörüdür. GBM primer olarak gelişebildiği gibi daha düşük evre glial tümörlerden de progresyon ile gelişebilmektedir.
Erkeklerde kadınlara göre, beyaz ırkta siyah ırka göre daha sık görülmektedir. Genetik yatkınlık ya da çevresel bir faktör olmadan ortaya çıkar. 10. ve 17. kromozomlardaki tümör supresyon genlerin kaybının GBM’nin ortaya çıkışında etkili olduğu düşünülmektedir. GBM genelde serebral hemisferin derin beyaz maddesinde ortaya çıkar.
4.2. C6 GLİOMA HÜCRE SOYLARI
Gliomalar erişkinde oldukça sık görülen, malign beyin tümörlerinin büyük bölümünü oluştururlar. Hayvan beyin tümörlerinin, insan beyin tümör modelleri ile olan benzerlikleri, klinikte parametrelerin tanımlanması ve doğru tedavinin uygulanması açısından oldukça yol göstericidir. Primer beyin tümörlerinin %60 kadarını gliomalar oluştururlar. GBM neoplastik hücrelerin merkezi sinir sistemine infiltrasyonu sonucu nörolojik fonksiyon kaybına ve sonunda da ölüme yol açan bir kanserdir (2). Yetişkin erkeklerde, kadınlara oranla daha sık görülmekle beraber, 15 yaşın altındaki çocuk tümörlerinin %40-45’ini oluşturmaktadır. Malign beyin tümörlerinin oluşumunun ve gelişmesinin anlaşılmasında, buna dayalı tedavilerin saptanmasında, in vivo ve in vitro çalışmalarda hayvan tümör modelleri vazgeçilmez kaynaklardır (2). C6 glioma hücreleri yüksek mitotik aktivite, nükleer pleomorfizm, tümör nekroz odakları, tümör içi kanama gibi çeşitli malign gliobastoma karakteristik özelliklerine sahip hücreler olarak GBM’nin in vivo özelliklerinin araştırılmasında günümüze kadar başarı ile kullanılmıştır. Wistar Furth soyu sıçanların N-N’nitrozometülüre uygulanmasıyla oluşturulan C6 glioma tümör hattı ilaç etkileşimi çalışmaları için yaygın olarak kullanılmaktadır (2).
4.3. MORİNDA CİTRİFOLİA (NONİ)
Morinda citrifolia (noni) 2000 yıldan beri Polinezyalılar tarafından halk yapımı
ilaçlarda kullanılmaktadır (1). Noni; Morinda citrifolia bitkisi için kullanılan yaygın isimdir. Dünyanın her yerinde, farklı kültürler içinde İndian mulberry (yerli dut), Ba Ji Tian, nono (veya nonu), cheese fruit, nhau gibi değişik isimler almıştır (4). Noni bitkisi, deniz seviyesindeki açık sahil kesimlerinde ve deniz seviyesinden 400 metre yüksekliğe kadar ormanlık alanlarda bulunan, yeşil renkli bir ağaçtır. Bu ağaç genellikle, lav akıntıları boyunca yetişir. Düz gövdesi; geniş, parlak ve elips şeklindeki yaprakları; beyaz çiçekleri ve sarı meyvesi ile tanımlanmaktadır. Meyvesi 12 cm ve üstüne kadar gelişebilir. Olgunlaşmış noni meyvesi, kötü bir tat ve kokuya sahiptir (5).
Noni; farklı hastalıkların tedavisinde ve genel sağlık koşullarını sağlamada kullanılan bir bitkidir. Kanser, enfeksiyon, arterit, diyabet, astım, hipertansiyon ve ağrılar için tedavi edici etkisinin yanı sıra antibakteriyal, antiviral, antifungal, antitümör, antihelmintik, analjezik, antiinflamatuar ile bağışıklığı güçlendirici geniş kapsamlı terapötik etkileri olduğu bildirilmektedir (1).
Noni bitkisinin meyvesi, kökleri ve yapraklarından elde edilen ekstreler; skopoletin, oktoanoik asit, potasyum, C vitamini, terpeneoid, alkoloid, antrakuinon, beta sterol,
karoten, A vitamini, flavon glukosid, linoleik asit, alizarin, aminoasit, akubin, L-asperulosid, kaproik asit, kaprilik asit, ürsolik asit, rutin ve putativ prokseronin
bakımından zengindir (6-17). Noni meyvesindeki akubin, L-asperulosid ve alizarin, Noni köklerindeki bazı antrakinonlar bileşimlerin antibakteriyal etkileri vardır. Nonideki bu antibakteriyal elementler, deri enfeksiyonlarının, soğuk algınlığının, yüksek ateşin ve bazı bakterilerin sebep olduğu sağlık sorunlarının giderilmesinde etkilidir (18). Noninin karsinojenezin başlangıç evresinde önleyici etkisi vardır. Noninin bağışıklık sistemini uyararak bazı malignant tümörler dahil koruyucu ve tümör proliferasyonunu önleyici etkisi olduğu ileri sürülmektedir (19). Noni meyvesinin alkol ekstraktı, endojen tümör destekleyici Tümör Nekroz Faktör-α (TNF-α) üretimini inhibe eder. Böylece TNF-α’nın tümör geliştirici etkisi de inhibe edilir (20). Noni meyve suyu (noni ppt.) ise tümör gelişimini inhibe edici polisakkaritçe zengin bir madde içerir (19). Ayrıca, noninin köklerinin ekstraktının analjezik ve hipotansif etkileri vardır (21).
4.4. PAKLİTAKSEL
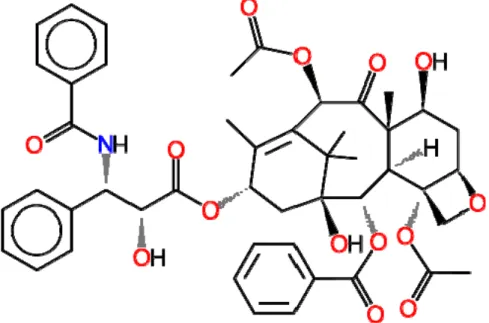
Paklitaksel porsuk ağacının (Taksus brevifolia) kabuğundan izole edilen, 853,9 dalton ağırlığında doğal bir alkoloidtir (22). Tübülin heterodimerlerine bağlanıp, tübülin sentezini stimüle eder, sonuçta mikrotübül yapımı azalır. Paklitaksel, mitoz için gerekli olan, daha önce sentezi tamamlanmış mikrotübüllere bağlanır ve depolimerizasyona karşı kararlılığın sağlanmasında rol oynar (22). Tübülin ve mikrotübül oranı bozulur. Bu durumda hücre siklusu bloke olur, hücreler G2/M fazında birikirler. Böylelikle mitozdan çıkan hücreler apoptoza girerler, paklitaksel apoptozu teşvik eder.
Paklitakselin etki mekanizmasına dayanarak antitümöral bir ajan olduğu söylenebilir. Genellikle klinikte halen akciğer, göğüs, baş-boyun bölgesi tümörlerinin
tedavisinde kemoterapi ilacı olarak kullanılmaktadır (23).
Şekil 2. Paklitakselin molekül yapısı (24)
4.5. HÜCRE SİKLUSU
Vücudumuzdaki hücrelerin sahip oldukları bir yaşam döngüleri vardır. Her hücre temel hücre hipotezinde olduğu gibi, başka bir hücreden köken alır ve belli dönemlerde kendisi gibi başka hücreler üretir. Hücre, yaşam döngüsünü tamamladıktan sonra canlılığını kaybeder. Bu yaşam döngüsünün süresi, hücreden hücreye değişir. Hücrelerin yaşam döngülerindeki süre farklılıkları özellikle, G0 döneminin uzunluğuyla ilişkilidir. Yaşam döngüsünde yer alan dönemler (Şekil 3) (25) ve başlıca özellikleri şunlardır:
G0 dönemi: Normal hücre işlevlerinin devam ettiği dönemdir. Süresi hücreden hücreye farklılık gösterir. Bu dönemde hücre temel işlevlerini yerine getirir.
G1 dönemi: Hücre büyümesinin ön planda olduğu dönemdir. Artan protein sentezi sayesinde hücre organellerinin sayısı iki katına çıkar. Bu dönem, hücre döngüsünde 8 saat ya da daha uzun bir süre alır.
S dönemi: 6–8 saat süren bu dönemde, temelde DNA’nın kendi kopyasının oluşturması (replikasyon) gerçekleşir.
G2 dönemi: 2-5 saat süren bu dönemde protein sentezi ön plandadır.
Mitoz dönemi: Mitoz iğsi, ipliksi anlamına gelen bir sözcüktür. Döneme bu ismin verilmesinin nedeni, çekirdekte izlenen iğsi, ipliksi görünümdür. Mitoz, vücut hücrelerinde izlenen bir bölünme şeklidir. Mitoz dönemi 1-3 saat süren ve birbiri peşi sıra devam eden profaz, metafaz, anafaz ve telofaz dönemlerinden oluşur. Bu süreç hücrenin bu zamana kadar kabaca iki katına çıkardığı organeller ve genetik malzemenin, eşit olarak ikiye bölünmesiyle sonlanır. Mitozu oluşturan dört dönem sonunda genetik malzeme ikiye ayrılırken, son iki dönem olan anafaz ve telofazda sitoplazma ve içerdiği organeller eşit olarak bölünür.
Hücre siklusunda bir faz tamamlanmadan sonraki faza geçilirse genetik materyal tam ve doğru kopyalanmadığı için hücrede hasar meydana gelebilir. Hücre siklusunda G1-S geçişinde, G2-M geçişinde ve metafaz-anafaz geçişinde kontrol noktaları vardır.
Şekil 3. Hücre siklusu (25)
Hücre siklusu siklinler (cyc), siklin bağımlı kinazlar (cdk) ve siklin bağımlı kinaz inhibitörleri (CKI) tarafından kontrol edilir. Bu proteinlerin düzeyleri hücre siklusunun farklı fazlarında farklılık gösterir. Cdk’lar G1-S-G2 ve mitoza geçişi kontrol eder (26-28). Memeli hücrelerinde hücre siklusunun düzenlenmesinde işlevleri bilinen 11 tane cdk ve
Cyc D, E, G1/S fazlarının sınırında geçici olarak sentezlenir, hücre S fazına geçtiğinde ise yıkılır. Cyc A ve B, S/G2/M fazlarının geçişlerinde sentezlenir, siklin A1 mayoz ve embriyogenesis de, siklin A2 çoğalan vücut hücrelerinde bulunur. Cyc B1’in ve cyc B2’nin fonksiyonlarını kontrol ettiği düşünülmektedir.
Cdk’lar protein fosforilasyonu yapan enzimlerdir. Cdk’lar, cyce bağlandığında aktifleşerek aktif Cyc-Cdk komplekslerini oluştururlar. Cyc’ler bu komplekslerin düzenleyici, Cdk’lar ise katalitik komponentleridir (31).
CKI’lar, Cdk aktivitesini kontrol ederler. Bu proteinler Cyc-Cdk kompleksi oluşumunu ve DNA replikasyonunu inhibe ederler. CKI’lar hücre siklusunu frenledikleri için tümör baskılayıcı genlere adaydır.
4.6. KANSER
Organizma, organ ya da doku gelişimi, hücrelerin büyüme ve çoğalmalarını içerdiği gibi hücre ölümlerini de sağlar. Hücre büyümesi, farklılaşması ve çoğalmasında görevli olan proto-onkogenlerde meydana gelen mutasyonlar tümör gelişimine, tümör baskılayıcı genlerde meydana gelen mutasyonlar ise hücre siklusunun inhibisyonunu engelleyerek anormal hücre büyümesine neden olur.
Apoptozis (programlanmış hücre ölümü); dengelenmiş hücre proliferasyonu ve dokulardaki hücre sayısının sabit tutulmasından sorumludur. Apoptozis normal hücre ölümünün yanı sıra mutant hücre çoğalmasını önleyen önemli bir yoldur. Hücre siklusu ve apoptoziste çok sayıda protein ikili rol oynar. Çevresel faktörlerle meydana gelen DNA hasarı hücre siklus kontrol mekanizmalarının bozulmasına neden olur. Pek çok kanser tipinde hücre siklus kontrol noktalarında mutasyonlar belirlenmiştir (26). Büyümenin durdurulması, DNA onarımı ve apoptozisin engellenmesi kanser gelişiminde kritik öneme sahiptir (32). Tümör baskılayıcı genlerde mutasyonlar hasarlı hücrelerin hücre sikluslarının ilerlemesine ve tümör gelişimine neden olur.
Günümüzde birçok maddenin kanser hücreleri üzerine etkileri gerek kimyasal maddelerle indüklenmiş hayvan modellerinde gerekse kanserli hücreler kullanılan in vitro modellerde araştırılmaktadır. Doku kültürlerinde bu amaçla insanlardan veya hayvanlardan elde edilip hücre hattı haline getirilmiş materyaller kullanılmaktadır.
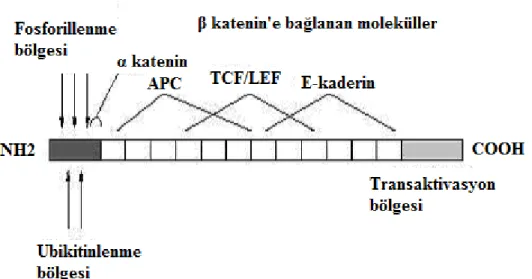
4.7. β-KATENİN MOLEKÜLÜ
β-katenin 781 aminoasitten oluşan, 92kDa’luk bir proteindir. Temel yapısı 100 aminoasitlik bir karboksi-terminal uç, 130 aminoasitlik bir amino uç, 42 aminoasitten oluşan tekrar bögesi içerir. Tekrar bölgesinin süper helikal tarzda bükülmesi, β-kateninin kaderin molekülü, adenomatöz polipozis koli (APC), aksin ve T hücre transkripsiyon
faktörü/Lenfoid çoğaltıcı faktörü (TCF/LEF) ailesine bağlanmasını düzenler (33). β-katenin, sitoplazmada ve plazma hücre membranında yer alır ve hücreler arası adezyonu
düzenleyen kaderin-katenin kompleksinin üyesi olarak görev yapar. Ayrıca β-kateninin WNT sinyal ileti yolunda da önemli görevleri vardır.
4.8. WNT SİNYAL İLETİ MEKANİZMASI
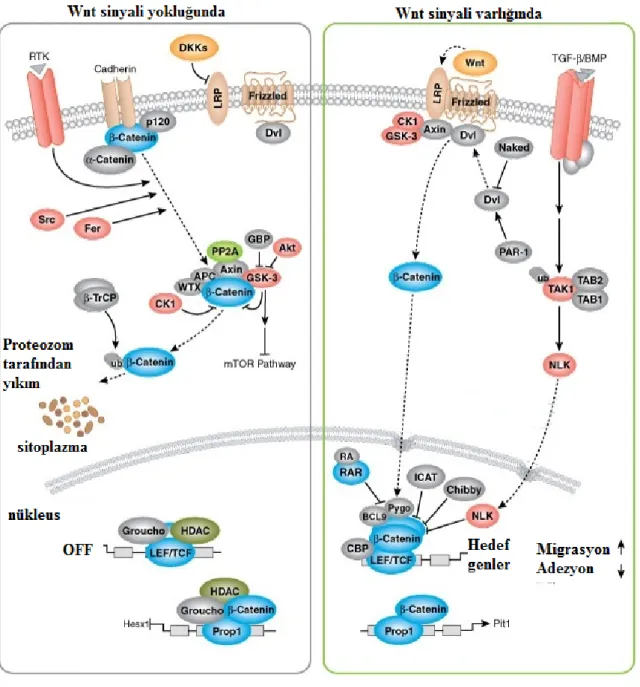
Wnt/β-katenin yolağı omurgalı ve omurgasızlarda embriyonal gelişimde düzenleyici görevindedir. Wnt ailesi sisteince zengin 19 adet proteinden meydana gelir; bunlar, Frizzled (Fzd) ailesinin transmembran reseptörlerine bağlanarak, Wnt sinyal yolunu aktive ederler. Wnt proteinleri, hücresel düzeyde yaşamsal fonksiyonların düzenlenmesinde rol alır (35). Kanonikal olarak bilinen Wnt 1 sınıfı proteinlerin görevli olduğu sinyal oluşturma yolunun aktivasyonu, β-kateninin stabilizasyonuna ve translokasyonuna yol açar. Β-katenin çok fonksiyonlu bir proteindir; zonula aderens bağlantı kompleksindeki fonkiyonu ile yara iyileşmesinde etkilidir ve bu sinyal yolunda oluşacak hasarlar kanser gelişimine yol açabilir.
Wnt ligandları Fzd reseptörlerinin ekstraselüler kısımlarına bağlanırlar. Bu bağlanma Wnt/β-katenin sinyal yolunu aktive eder. Wnt/β-katenin sinyal yolu aktive olduğunda; Wnt’nin Fzd reseptörüne bağlanması, sitoplazmada Dishevelled (DSH) proteininin aktif hale geçmesine ve aksin ile bağlanarak Glikojen Sentetaz Kinaz-3β’nin (GSK-3 β) inhibe olmasına neden olur. Böylece β-katenin fosforilasyonu gerçekleşemez, β-katenin sitoplazmada birikir. β-kateninin bir kısmı sitoplazmadan nükleusa taşınır. Burada TCF/LEF transkripsiyonel faktörüne bağlanıp hedef genlerin ( hücre siklusunu düzenleyen: cyc D1, c-myc; Ekstraselüler matriks bağlantılarının düzenlenmesinde görev alan: fibronektin, WISP 1; transkripsiyon faktörleri:TCF1, c-jun, fra-1, PPAr delta) eksprese edilmesini aktive eder.
Wnt/β-katenin sinyal yolu sadece Fzd reseptörleri ve koreseptörleri LRP5 ve LRP6 Wnt ligantları ile kompleks oluşturduğu zaman aktive olur. Wnt sinyal yolu aktif değilse DSH de aktif değildir. Kazein Kinaz1’in β-katenini serin 45 bölgesinden işaretlemesinin ardından GSK-3β; threonin 41, serin 35 ve serin 33’ü ardı ardına fosforile eder. Fosforilize β-katenin β TrCP (β transdusin tekrarları içeren protein) tarafından bağlanır. β TrCP, β-kateninin proteozom tarafından tanınmasını ve yıkılmasını sağlar. Β-kateninin yıkımı 76 aminoasitten oluşan ubikitin adı verilen bir polipeptidin β-katenine bağlanarak işaretlemesinin ardından proteozom tarafından gerçekleştirilir (36). Wnt sinyal yolunda bulunan β-katenin, APC, aksin ve TCF-1 gibi çeşitli proteinler, onkogen veya tümör baskılayıcı olarak önemli görevlere sahiptir.
Şekil 5. Wnt sinyal ileti mekanizması. β-katenin, sinyal yokluğunda yıkılmaktadır. β-katenin, sinyal varlığında nükleusta birikmektedir (37).
İnsanda pek çok kanser türünde β-kateninin hücrede birikmesine neden olan mutasyonun rol aldığı bildirilmiştir. β-katenini kodlayan CTNNB-1 geninin ekson 3 bölgesi insan tümörlerinde mutasyonların gelişim noktası olarak tanımlanmıştır. Bu bölgede oluşan bir mutasyon β-katenindeki ser/thr residülerinin GSK-3β tarafından
5. MATERYAL VE YÖNTEM
5.1. KULLANILAN KİMYASALLAR
1) Morinda Citrifolia (noni)2) Paklitaksel (Taxol)
3) NaCl, Atabay AT091-950
4) Na2HPO4, Riedel-de Häen 81890 5) Na2H2PO4, Riedel-de Häen 8210A 6) HCl, Merck K23226314 632 7) DMEM, Sigma D5546
8) Nutrient mixture F-12, Sigma N6658
9) L-Glutamin, Biological Industries 03-020-IC
10) Penisilin, Streptomisin, Biological Industries 03-031-1C 11) Fetal Sığır Serumu, Seromed S0115
12) Anti-β-katenin antikoru, Cell Signaling Technology, 9562 13) Anti-BrdU antikoru, Neomarkers MS-1058
14) Histostain Plus Kit, Zymed 85-8943
15) Aminoetilkarbazol (AEC), Lab Vision TA-060-HA 16) Metanol, Riedel-DC-Haen 24229
17) Tripsin EDTA, Biological Industries 243338 18) DMSO, Sigma D 2650
19) Borik Asit, Sigma B0252
5.2. KULLANILAN YÖNTEMLER
5.2.1. Hücre KültürüBu çalışmada İstanbul Bilim Üniversitesi Bilimsel Araştırma laboratuarında uzun zamandır dondurularak saklanıp, zaman zaman pasajları yapılan sıçan C6 glioma hücre soyu kullanıldı.C6 glioma hücreleri için besiyeri ortamı; inaktive edilmiş %10 fetal sığır serumu (FCS) ve antibiyotikler (0,2 mM glutamin, 100 ünite/ml penisilin G, 100 µg/ml streptomisin) içeren Dulbecco’nun modifiye edilmiş Eagle medyumu (DMEM) ile besleyici karışım Ham’s F12 medyumudur. C6 glioma hücreleri bu besiyeri (DMEM-F12) içerisinde 37ºC’ de %5 CO2 ve %95 hava içeren inkübatörde büyütüldü. Noninin etkilerini belirlemek için oluşturulan deney grubunda medyum içerisine 1 mg/ml, 3 mg/ml ve 10 mg/ml konsantrasyonlarında noni eklendi. Paklitakselin etkilerini belirlemek için oluşturulan deney grubuna 1 µg/ml, 3µg/ml ve 10 µg/ml konsantrasyonlarında paklitaksel eklendi. Paklitaksel ve noninin etkilerinin birlikte inceleneceği deney grubuna ise 1 mg/ml noni ve 1 µg/ml paklitaksel, 3 mg/ml noni ve 3µg/ml paklitaksel, 10 mg/ml noni ve 10 µg/ml paklitaksel birlikte uygulandı. Tüm çalışma gruplarında 24 saatlik inkübasyon sonrasında deney sonlandırıldı.
5.2.2. Hücre Proliferasyonunun Belirlenmesi 5.2.2.1. β-katenin İmmünositokimyası
β-kateninin immünositokimyasal incelemesi için lameller üzerine ekilmiş olan hücreler -20ºC de metanol ile fikse edildi. Spesifik olmayan boyanmaları engellemek için non-immün serumla (Histostain Plus Kit, Zymed) 20 dakika bloking işlemi uygulandı. Bloking işleminin ardından anti-β-katenin primer antikoru ile 3.5µl/ml dilüsyonda oda ısısında 1 saat inkübe edildi. Sonrasında biotinle işaretli sekonder antikor 20 dakika uygulandı. PBS ile yıkamanın ardından streptavidin ile 20 dakika inkübasyon gerçekleştirildi. Yıkamaları takiben AEC kromojeni uygulandı. Kromojen uygulaması sonucu ortaya çıkan spesifik kırmızı renk reaksiyonu Olympus BX 50 ışık mikroskobunda
5.2.2.2. Bromodeoksiuridin (BrdU) İmmünositokimyası
Hücreler lameller üzerinde ekildikten 2 gün sonra PBS ile yıkandı. Ardından 5 dakika -20ºC’de metanol ile fikse edildi. Proliferasyon indeksi belirlenmesi için S fazına özgü BrdU işaretlemesi kullanıldı. Anti-BrdU monoklonal antikoru ile boyama yapılacak hücreler fiksasyondan önce 5-bromo-2-deoksiuridin (1mM) ile 1 saat 37ºC’de inkübe edildi. PBS yıkamaları sonrasında hücrelerin DNA’sı 2N HCl ile 37ºC’de 30 dakika denature edildi. Borat tampon ile nötralize edildikten sonra PBS yıkamaları yapıldı. Sonrasında bloking işlemi yapıldı (Histostain Plus Kit, Zymed). Anti-BrdU Mouse monoklonal antikoru ile 1 saat oda ısısında inkübasyona bırakıldı. Streptavidin ve biotin-HRP bağlı sekonder antikorlarla 20’şer dakika inkübe edildi (Histostain Plus Kit, Zymed). AEC kromojeni uygulaması sonucu oluşan kırmızı renk reaksiyonu Olympus BX 50 ışık mikroskobunda değerlendirildi.
6. BULGULAR
6.1. MORİNDA CİTRİFOLİA VE PAKLİTAKSELİN C6 GLİOMA
HÜCRELERİNDE PROLİFERASYON ÜZERİNE ETKİLERİNİN
BROMODEOKSİÜRİDİN İLE GÖSTERİLMESİ
Morinda citrifolia ekstresi ve paklitakselin glioma C6 hücrelerinde proliferasyon
üzerine etkileri hücre siklusunda S fazındaki hücrelerin işaretlenmesi temeline dayanan BrdU immünositokimyası ile gösterildi.
Resim 1A, B: Kontrol grubu C6 glioma hücrelerinde BrdU işaretli S fazındaki hücreler (A). Noni ekstresi uygulanan C6 glioma hücrelerinde işaretli S faz hücreleri ve BrdU inkorporasyonunda azalma görülmekte (B). X600
Resim 1C, D: Noni ekstresi ve paklitaksel birlikte uygulanan C6 glioma hücrelerinde (C) ve sadece paklitaksel uygulanan C6 glioma hücrelerinde (D) BrdU inkorporasyonu izlenmedi. X600
Kontrol grubu hücrelerde saptanan BrdU işaretli S faz hücreleri oranı ile karşılaştırıldığında 24 saatlik noni ekstresi inkübasyonu sonrasında BrdU işaretli hücre oranında azalma saptandı. Sadece paklitaksel ve noni ektresi ile birlikte paklitaksel uygulanan deney grupları kontrol grubu ile karşılaştırıldığında deney gruplarında S fazında hiç hücre gözlenmedi (Resim 1 A,B,C,D).
6.2. MORİNDA CİTRİFOLİA VE PAKLİTAKSELİN C6 GLİOMA
HÜCRELERİNDE
β-KATENİN EKSPRESYONU ÜZERİNE
ETKİLERİ
Resim 2A, B, C, D: Kontrol grubunda (A), 1mg/ml noni ekstresi uygulanan grupta (B), 3mg/ml noni ekstresi uygulanan grupta (C), 10mg/ml noni ekstresi uygulanan grupta β-katenin ekspresyonu. X600
β-katenin ekspresyonu glioma hücrelerinde plazma membranının intraselüler sınırları boyunca izlendi. Noni ekstresi inkübasyonu sonrasında, hücrelerde β-katenin ekspresyonunda ve lokalizasyonunda bir değişiklik gözlenmedi. Ekspresyon kontrol grubu hücrelerdeki gibi plazma membranı seviyesinde izlendi (Resim 2A,B,C,D).
Resim 3A, B, C, D: Kontrol grubunda (A), 1µg/ml paklitaksel uygulanan grupta (B), 3µg/ml paklitaksel uygulanan grupta (C), 10µg/ml paklitaksel uygulanan grupta (D) β-katenin ekspresyonu. X600
Paklitaksel inkübasyonu sonrasında, 1µg ve 3µg uygulanan deney grubunda nükleus seviyesinde β-katenin ekspresyonu izlendi. (Resim 3B, 3C), 10µg uygulanan deney grubunda sadece sitoplazmada ve periferde β-katenin gözlendi (Resim 3D).
Resim 4A, B, C, D: Kontrol grubunda (A), 1µg/ml paklitaksel ve 1mg/ml noni ekstresi uygulanan grupta (B), 3µg/ml paklitaksel ve 3mg/ml noni ekstresi uygulanan grupta (C), 10µg/ml paklitaksel ve 10mg/ml noni ekstresi uygulanan grupta (D) β-katenin ekspresyonu. X600
Yalnızca paklitaksel uygulanan grupla karşılaştırıldığında, paklitaksel ve noni ekstresinin kombine uygulandığı deney grubunda β-katenin ekspresyon düzeylerinde ve lokalizasyonunda bir değişiklik meydana gelmedi (Resim 4A,B,C,D).
7. TARTIŞMA
Noni olarak da bilinen Morinda citrifolia birçok hastalığın tedavisinde ve ideal sağlık koşullarının oluşturulmasında kullanılan deniz seviyesinden yüksekteki ormanlık alanlarda bulunan bir ağaçtır. Paklitaksel ise genellikle akciğer, göğüs, baş-boyun bölgesi tümörlerinin kemoterapisinde kullanılan Porsuk ağacının kabuğundan elde edilmiş olan doğal bir alkoloidtir. Çalışmada in vitro C6 glioma hücre modelinde Morinda citrifolia (noni) ekstresi ve paklitakselin farklı konsantrasyonlarının β-katenin sinyal yolu ile hücre proliferasyonunda meydana getirdiği değişiklikler immünositokimyasal olarak incelendi. Çalışmamızın sonucunda plazma membranında bulunan adezyon molekülü β-katenin ekspresyonunun noni ekstresi uygulamasıyla değişmediği, düşük dozda paklitaksel uygulamasında nükleustaki β-katenin ekspresyonunun arttığı izlendi. Bu sonuç paklitakselin düşük dozlarında β-kateninin transkripsiyon faktörü olarak etkili olduğunu, paklitakselin yüksek dozlarının ise Wnt sinyal yolu üzerinde etkili olmadığını düşündürür.
Ishikawa hücreleriyle yapılan bir çalışmada Tian Long adlı tıbbi bitkinin suda çözünen ekstresinin BrdU yöntemiyle proliferasyon üzerine olan etkileri gözlenmiştir. Bulunan sonuçların Tian Long ekstresinin uygulamasının endometrial karsinomda antitümör aktivitenin hangi mekanizma ile etkili olduğunun belirlenmesinin ardından daha ümit verici olacağı ileri sürülmektedir (38).
SW480 kolon kanseri hücre soylarında yapılan bir çalışmada Eleutherine palmifolia ekstresinin uygulanmasının ardında TCF/β-katenin transkripsiyonun inhibisyonunun doza bağımlı olduğu görülmüştür (39).
Litchi meyvesinin perikarpının ekstresinin insan meme kanseri hücre soylarına uygulanmasıyla yapılan çalışmada litchi ekstresinin zamana ve doza bağlı olarak hücre büyümesi ve BrdU inkorporasyonu üzerine inhibisyon etkisi yaptığı izlenmiştir (40).
Waldschager ve arkadaşları keten tohumundan izole edilen değişik molekülleri bir trofoblast tümörü olan Jeg3’de kullanarak BrdU yöntemiyle inhibitör etkisini göstermişlerdir (41).
Knöpfl- Sidler ve arkadaşları HELA-S3, MOLT-4, MFM-223, COR-L51, KPL-1 ve UM-CUB1 tümör hücrelerinde çeşitli Viscum album (ökseotu) fraksiyonlarını kullanarak, başta BrdU yöntemi olmak üzere farklı yöntemlerle tümör hücreleri üzerinde büyümeyi durdurucu etkisi olduğunu göstermişlerdir (42).
Santa Maria Margalef ve arkadaşları Psegeum africanumun insan prostat kanseri hücrelerindeki etkilerini araştırmışlar ve çalışma sonucunda Psegeum africanum’un epidermal büyüme faktörlerinin mitojenik etkisini inhibe ettiğini ve hücre siklusunda G1’den S fazına geçişi bloke ettiğini gözlemişlerdir (43).
Biz de çalışmamızda kontrol grubu hücrelerde saptanan BrdU işaretli S faz hücreleri oranı ile karşılaştırıldığında 24 saatlik noni ekstresi inkübasyonu sonrasında BrdU işaretli hücre oranında azalma gözledik. Sadece paklitaksel ve noni ektresi ile birlikte paklitaksel uygulanan deney grupları kontrol grubu ile karşılaştırıldığında deney gruplarında S fazında hiç hücre gözlenmedi.
Azoksimetanla uyarılmış kolon kanseri oluşturulmuş erkek F344 soyu sıçanlarla yapılan bir çalışmada PCNA işaretleme yöntemi kullanarak Terminalia catappa (hint bademi) bitkisinin etkileri incelenmiştir. Hint bademi bitkisinin kısa dönemde kolon karsinogenezis belirteçleri üzerinde etkili olduğu görülmüştür (44).
Misikangas ve arkadaşları barsak kanseri oluşturulmuş farelerle yaptıkları çalışmada 3 Nordic berry (Kuzey Avrupa yaban çileği) türünün β-katenin sinyal ileti yolu ve bazı moleküler mekanizmalar üzerindeki etkilerini izlemişler ve yabani ağaç çileğinin bir türüyle beslenen barsak kanserli farelerin hücrelerinde nükleer β-katenin seviyelerinde artış gözlemişlerdir (45).
Bizde çalışmamızda noninin ve paklitaselin etkilerini incelediğimizde, hücrelerde β-katenin ekspresyonunda ve lokalizasyonunda bir değişiklik olmadığını, düşük dozda paklitaksel uygulamasında plazma membranında lokalize β-kateninin nükleusa transfer olduğunu gözledik. Noni ekstresi ve paklitakselin kombine uygulanmasında ise paklitaselin, antitümöral ajan etkisinde olmadığını ve β-katenin ekspresyon ve lokalizasyonunda bir değişiklik oluşmadığını gözledik.
8. SONUÇ
Noni ekstresi tek başına verildiğinde BrdU ile işaretlenmiş S fazındaki hücrelerin azaldığını görmemiz; noni ekstresinin proliferasyonu azalttığını, paklitaksel ile kombine edildiğinde, tek paklitaksel uygulaması yapıldığındaki sonuçlarla yakın sonuçlar elde edildiğini gördük. Paklitaksel tek uygulandığında S fazındaki hücreleri tamamen ortadan kaldırması nedeniyle kombine kullanımda noni ekstresinin katkısının olup olmadığını yorumlayamıyoruz. Bu konuda paklitakselin daha düşük dozlarıyla noni ekstresi kombine uygulanırsa hücre proliferasyon inhibisyonunda noninin paklitaksele katkısı olup olmadığını yorumlayabiliriz.
Paklitaksel uyguladığımız hücrelerde inhibisyon beklenen bir sonuçtu. Noninin uygulandığı gruplarda kontrole göre bir fark bulmamamız onun β-katenin metabolizmasında etkisi olmadığını göstermektedir. Buna karşılık β-katenin metabolizmasını doza bağlı olarak inhibe eden paklitakselle kombine uygulanan noni ekstresinin paklitakselin inhibisyon etkisi üzerinde olumsuz rol oynadığı izlenmiştir. Dolayısıyla başka çalışmalar da bunu teyid ederse ikisinin birlikte antitümöral etki için kullanılmaması gerektiği anlaşılmaktadır.
9. TEŞEKKÜR
Yüksek Lisans çalışmamda bana yardımcı olan ve desteğini hiç esirgemeyen değerli danışman hocam Prof. Dr. Tuncay ALTUĞ’a teşekkür ederim. Çalışmam sırasında bilgilerini ve tecrübelerini benimle paylaşan değerli hocam Doç. Dr. Meral KOYUTÜRK’e teşekkür ederim. Çalışmamızda kullandığımız malzemelerin temininde yardımcı olan Dr. Elif İlkay TAŞKIN’a ve Msc. Bio. Ayşegül KAPUCU’ya teşekkür ederim. Deneylerim sırasında laboratuarda yardımlarını esirgemeyen sevgili arkadaşım Msc. Bio. Melike ERSÖZ’e, Enstitü Sekreterimiz sevgili arkadaşım İlknur
KARAOSMANOĞLU’na destekleri için teşekkür ederim.
Sevgili aileme ve tüm dostlarıma bana destek oldukları ve varlıklarını her zaman yanımda hissettirdikleri için teşekkür ederim.
10. KAYNAKLAR
1. Whistler WA. Traditional and herbal medicine in the cook islands. Ethnopharm J. 1985; 13: 239-280.
2. Grobben B, De Deyn PP, Slegers H. Rat C6 glioma as experimental model system for the study of glioblastoma growth and invasion. Cell Tissue Res. 2002; 310(3):257-270. 3. Kliehues P, Burger PC, Scheithauer BW. WHO International Histological Classification of Tumors: In Histological typing of tumours of the central Nervous System.
Springer-Verlag 1993.
4. Whistler W. Tongan herbal medicine. Isle Botanica, Honolulu, Hawaii, 1992; 89-90. 5. Wang MY, Brett JW, Jarakae CJ, Diane N, Su C, Afa KP, Gary . Morinda citrifolia (noni): A literature review and recent advances in noni research. Acta Pharmacol Sin. 2002;23 (12):1127-1141.
6. Levand O, Larson HO. Some chemical constituents of Morinda citrifolia. Planta Med. 1979; 36: 186-187.
7. Farine JP, Legal L, Moreteau B, Le Quere JL. Volatile components of ripe fruits of
Morinda citrifolia and their effects on Drosophila. Phytochemistry 1996; 41: 433-438.
8. Higa I, Fuyama Y. Genetics of food preference in Drosophila sechellia. Responses to food attractants. Genetica 1993; 88: 129-136.
9. Peerzada N, Renaud S, Ryan P. Vitamin C and elemental compos ition of some bushfruits. J Plant Nutr. 1990; 13: 787-793.
10. Budavari S, O’Neil MJ, Smith A, Heckelman PE. In: The Merck Index. An encyclopedia of chemicals, drugs , and biologicals. Merck & Co Inc, Rathway, 1989.
11. Moorthy NK, Reddy GS. Preliminary phytochemical and pharmacological study of
Morinda citrifolia, Linn. Antiseptic 1970; 67: 167-171.
12. Daulatabad CD, Mulla GM, Mirajikar AM. Riconoleic acid in Morinda citrifolia seed oil. Oil Technologists’ Association of India 1989; 21: 26-27.
13. Balakrishna S, Seshadri TR, Venkataramani B. Special chemical component of commercial woods and related plant materials: Part X-Heartwood of Morinda citrifolia Linn. J Sci Industrial Res 1961; 20B: 331-333.
14. Legal L, David JR, Jallon JM. Molecular basis of Morinda citrifolia (L.): toxicity on Drosophila. J Chem Ecolog 1994; 20: 1931-1943.
15. Singh J, Tiwari RD. Flavone glycosides from the flowers of Morinda citrifolia. J
Indian Chem Soc 1976; 53: 424.
16. Simonsen JL. Note on the constituents of Morinda citrifolia. J Chem Soc 1920; 117: 561-564.
17. Heinicke R. The pharmacologically active ingredient of Noni. Bulletin of the National
Tropical Botanical Garden, 1985.
18.Atkinson N. Antibacterial substances from flowering plants. Antibacterial activity of dried Australian plants by a rapid direct plate test. Australian J Exper Biol 1956; 34: 17-26. 19. Hirazumi A, Furusawa E, Chou SC, Hokama Y. Immunomodulation contributes to the anticancer activity of Morinda citrifolia (noni) fruit juice. Proc West Pharmacol Soc 1996; 39: 7-9.
20. Hokama Y. The effect of Noni fruit extract (Morinda citrifolia, Indian mulberry) on thymocytes of BALB/c mouse. FASEB J 1993; 7: A866.
21. Youngken HW, Jenkins H J, Butler CL. Studies on Morinda citrifolia L.
J Am Pharm Assoc 1960; 49: 271-273.
22. Schiff, P. B., Fant, J. ve Horwitz, S. B. Promotion of microtubule assembly in vitro by taxol, Nature,1979; 277, 665-667.
23.Rowinsky, E. K. The development and clinical utility of the taxane class of antimicro tubule chemotherapy agents, Annu Rev of Medicine.,1997;48: 353-374.
24. en.wikipedia.org/wiki/Portal:Organic_chemistry
25. Andrew CG Porter. Preventing DNA over-replication: a Cdk perspective. Cell Div 2008; 3: 1747-1028.
26. Vermeulen K, VanBockstaele DR, Berneman Z N. The cell cycle : a review of regulation, deregulation and therapeutic targets in cancer. Cell Prolif 2003; 36: 131-149. 27. Vermeulen K, Berneman ZN, vanBockstaele DR. Cell cycle and apoptosis. Cell Prolif 2003; 36: 165-175.
28. Foster I. Cancer: A cell cycle defect. Radiography 2008; 14: 144-149.
29. Kearns WG, Liu JM. Cell cycle checkpoint genes and aneuploidy:A short review. Curr.
Genomics 2001; 2:171-180.
30. Giacinti C, Giordano A. RB and cell cycle progression. Oncogene 2006; 25: 5220-5227.
31. Flatt PM, Pietenpol JA. Mechanisms of cell-cycle checkpoints: at the cross roads of carcinogenesis and drug discovery. Drug Metab Rev 2000; 32: 283-305.
32. Bellamy COC. p53 and apoptosis. Br Med Bull 1996; 53(3): 522-538.
33. Luu HH, Zhang R, Haydon RC, Rayburn E, Kang Q, Si W, et al. Wnt/B-catenin
signaling pathway as novel cancer drug targets. Curr Cancer Drug Targets 2004; 4: 653–671.
34. Nusse R and K Willert. (1998). Beta-catenin: a key mediator of Wnt signaling. Curr.
Opinion in Genetics & Dev.1998; 8:95-102.
35. Hagen T, Sethi JK, Foxwell N, Vidal-Puig A. Signalling activity of beta-catenin targeted to different subcellular compartments. Biochem J. 2004; 379: 471–477.
36.Amit, S., Hatzubai, A., Birman, Y., Andersen, J. S., Shushan, E., Mann, M., Ben-Neriah, Y., and Alkalay, I. Axin-mediated CKI phosphorylation of beta-catenin at Ser 45: a molecular switch for the Wnt pathway. Genes Dev.2002;16:1066–1076.
37. www.cellsignal.com/.../Wnt_beta_Catenin.html
38. Li ZL, Morishima S, Tang JT, Otsuki Y. Apoptotic effects of Tian- Long compound on endometrial adenocarsinoma cells in vitro. Med Mol Morphol J. 2009 ;42(1):32-39.
39. Li X, Ohtsuki T, Koyano T, Kowithayakorn T, İshibasi M. New Wnt/beta-catenin signaling inhibitors isolated from Eleutherine palmifolia. Chem Aian J, 2009;4(4):540-7 40. Wang X, Yuan S, Wang J, Lin P, Liu G, Lu Y, Zhang J, Wang W, Wei Y. Anticancer activity of litchi fruit pericarp extract against human breast cancer in vitro and in vivo.
Toxicol Appl Pharmacol. 2006; 215(2):168-178
41. Waldschlager J, Bergemann C, Ruth W, Effmert U, Jesche U, Richter DU, Kragl U, Piechulla B, Briese V. Flax-seed extracts with phtoestrogenic effects on a hormone receptor-positive tumor cell line. Anticanser Res. 2005;25 (3A):1817-22
42. Knöpfl-Sidler F, Viviani A, Rist L, Hensel A, Human cancer cells exhibit in vitro
individual receptiveness towards different mistletoe extracts. Pharmazie. 2005; 60 (6): 448-454.
43. Santa Maria Margalef A, Paciucci Barzanti R, Reventos Puigjaner J, Morote Robles J, Thomson Okatsu TM. Antimitogenic effect of Pygeum africanum extracts on human prostatic cancer cell lines and explants from being prostatic hyperplasia. Arch Esp Urol. 2003; 56(4):369-78
44. Morioka T, Suzui M, Nabandith V, Inamine V, Aniya Y, Nakayama T, Ichiba T, Yoshimi N. Eur J Cancer Prev. 2005; 14(2):101-105
45. Misikangas M, Pajari AM, Päivärinta E, Oikarinen SI, Rajakangas J, Marttinen M, Tanayama H, Törrönen R, Mutanen M. Three Nordic berries inhibit intestinal tumorigenesis in multiple intestinal neoplasia/+ mice by modulating beta-catenin signaling in the tumor and transcription in the mucosa. J Nutr.2007;137(10):2285-2290