AĞIZ DİŞ ÇENE HASTALIKLARI VE CERRAHİSİ ANABİLİM DALI
DOKTORA TEZİ
KALVARYAL KEMİK DEFEKTİ MODELLERİNDE
ZOLEDRONİK ASİT UYGULAMASININ FARKLI GREFT
MATERYALLERİ ÜZERİNE ETKİSİNİN DENEYSEL OLARAK
İNCELENMESİ
Dt. Mahmut KOPARAL
DANIŞMAN
Prof. Dr. Belgin GÜLSÜN
(Bu tez Dicle Üniversitesi Bilimsel Araştırma Projeleri Birimi tarafından 12-DH-79 proje numarası ile desteklenmiştir.)
TEŞEKKÜR
Bilgisine, disiplinine, mükemmeliyetçiliğine hayran kaldığım, Çene Cerrahisi'ni severek öğrenmemde büyük emekleri olan, öğrencilik yıllarımda ve doktora döneminde derslerine girmekten büyük keyif aldığım, eğitimim sırasında ve bu tez çalışmasının tüm aşamalarında bilgi ve deneyimlerinden sürekli yararlandığım, yönlendirmeleriyle eğitimimde çok emeği olan değerli Hocam Sayın Prof. Dr. Belgin GÜLSÜN'e,
Bölümümdeki diğer hocalarıma ve asistan arkadaşlarıma, tezimin histopatolojik değerlendirmesini gerçekleştiren Sayın Doç. Dr. Selver ÖZEKİNCİ'ye, tezimin istatistiksel değerlendirmelerini gerçekleştiren D.Ü. Tıp Fakültesi Biyoistatistik A.D. Başkanı Sayın Prof. Dr. Yusuf ÇELİK'e, her zaman yanımda olan ve bana güç veren Ailem'e teşekkür ederim.
İÇİNDEKİLER TEŞEKKÜR ………. İÇİNDEKİLER ……… ŞEKİLLER LİSTESİ ……….. TABLOLAR LİSTESİ ……… GRAFİKLER LİSTESİ ………... SİMGELER VE KISALTMALAR LİSTESİ ………... ÖZET ………...………... ABSTRACT ………...………... 1.GİRİŞ VE AMAÇ ………...……….. 2.GENEL BİLGİLER ………...………... 2.1.Kemik ………...………... 2.1.1. Kemiğin Yapısı ………...………... 2.1.2. Kemik Hücreleri ………...………... 2.1.3. Kemik Matriksi ………...………... 2.1.4. Periosteum ve Endosteum ……...………... 2.1.5. Kemiğin İyileşme Mekanizması ...………...
2.1.6. Kemik İyileşmesini Etkileyen Faktörler ………... 2.2. Biyomateryaller ………...………... 2.2.1. Tanımı ………...………... 2.2.2. Biyomateryallerin Taşıması Gereken Özellikler ………... 2.2.3. Biyomateryal Çeşitleri ………...…………... 2.2.3.1. Kemik Kaynaklı Biyomateryaller …...…………... 2.2.3.1.1. Otojen Greftler ………...…………... 2.2.3.1.2 Allogreft ………...…………... 2.2.3.1.3. Heterojen Kemik Grefti (Heterogreft, Ksenogreft) ... 2.2.3.1.4. Alloplastlar ... 2.2.4. Biyomateryallerin Klinik Uygulamaları ... 2.3. Bifosfonatlar ... 2.3.1. Genel Bilgiler ... 2.3.2. Kullanım Alanları ... 2.3.3. Bifosfonatların Yan Etkileri ... I II IV VI VII VIII X XI 1 3 3 3 4 8 10 12 14 16 16 16 17 17 17 19 19 20 21 22 22 24 28
3. GEREÇ VE YÖNTEM
...
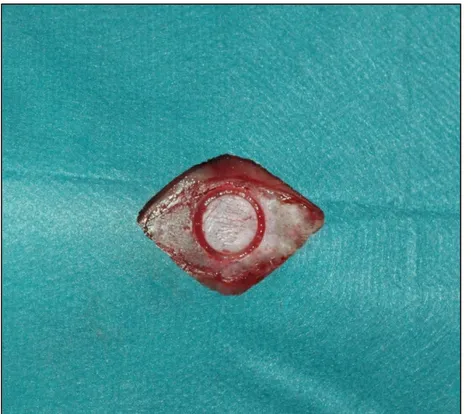
3.1. Gereç ... 3.2. Yöntem ... 3.2.1. Deney Hayvanları ve Grupları ... 3.2.2. Cerrahi Yöntem ... 3.2.3. Post-operatif Bakım ... 3.2.4. Histopatolojik İnceleme Yöntemi ... 3.2.5. İstatistiksel İnceleme Yöntemleri ... 4. BULGULAR ... 4.1. Histopatolojik Bulgular ... 4.2. İstatiksel Bulgular ... 5. TARTIŞMA ... 6. SONUÇ VE ÖNERİLER ... 7. KAYNAKLAR ... 8. EKLER ... 9. ÖZGEÇMİŞ ... 31 31 34 34 36 40 40 41 43 43 59 74 94 97 112 113
ŞEKİLLER LİSTESİ
Şekil 1: Kemik hücreleri... Şekil 2: Osteoblast... Şekil 3: Osteositler... Şekil 4: Periosteum, endosteum... Şekil 5: Osteon... Şekil 6: Pirofosfatların kimyasal yapısı... Şekil 7: Bifosfonatların kimyasal yapısı... Şekil 8: Osteoklast ve bifosfonat etkileşimi... Şekil 9: Bifosfonatların kemik rezorbsiyonunu inhibe etme yolları... Şekil 10: Deney hayvanların anestezisinde kullanılan anestezik maddeler... Şekil 11: Sentetik greft materyali... Şekil 12: Ksenogreft materyali... Şekil 13: Zoledronik asit... Şekil 14: Trefin frez, anguldurva... Şekil 15: Pre-operatif görünüm... Şekil 16: İnsizyon... Şekil 17: Diseksiyon... Şekil 18: Trefin frez ile defektin hazırlanması... Şekil 19: Sınırları belirlenen kritik boyut kemik defektinin görünümü... Şekil 20: Hazırlanan defekte greft materyalinin yerleştirilmesi... Şekil 21: Dikişler………... Şekil 22a: Kontrol grubu 6.hafta histopatolojik görünümü (H&E)... Şekil 22b: Kontrol grubu 6.hafta histopatolojik görünümü (M.T.)... Şekil 23a: Kontrol grubu 12.hafta histopatolojik görünümü(H&E)... Şekil 23b: Kontrol grubu 12.hafta histopatolojik görünümü (M.T.)... Şekil 24a: 1.deney grubu 6.hafta histopatolojik görünümü (H&E)... Şekil 24b: 1.deney grubu 6.hafta histopatolojik görünümü (M.T.)... Şekil 25a: 1.deney grubu 12.hafta histopatolojik görünümü (H&E)... Şekil 25b: 1.deney grubu 12.hafta histopatolojik görünümü (M.T.)... Şekil 26a: 2.deney grubu 6.hafta histopatolojik görünümü (H&E)... Şekil 26b: 2.deney grubu 6.hafta histopatolojik görünümü (M.T.)...
6 10 11 22 22 23 26 32 32 33 33 34 36 37 37 38 38 39 39 43 44 45 46 47 48 49 50 51 52 53
Şekil 27a: 2.deney grubu 12.hafta histopatolojik görünümü (H&E)... Şekil 27b: 2.deney grubu 12.hafta histopatolojik görünümü (M.T.)... Şekil 28a: 3.deney grubu 6.hafta histopatolojik görünümü (H&E)... Şekil 28b: 3.deney grubu 6.hafta histopatolojik görünümü (M.T.)... Şekil 29a: 3.deney grubu 12.hafta histopatolojik görünümü (H&E)... Şekil 29b: 3.deney grubu 12.hafta histopatolojik görünümü (M.T)...
56 57 58
TABLOLAR LİSTESİ
Tablo 1: Bifosfonatların kullanım alanları, içerikleri, dozajları ve kullanım yolları... Tablo 2: Histopatolojik değerlendirmelerde kullanılan kriterlerin tablosu …………... Tablo 3: İstatiksel analiz için kullanılan histopatolojik puanlandırma tablosu ………. Tablo 4: 6. hafta histopatolojik kriterlerin istatistiksel analizi …………...………... Tablo 5: 12. hafta histopatolojik kriterlerin istatistiksel analizi ………...………... Tablo 6: 6. ve 12. haftaların kontrol gruplarının histopatolojik kriterlerinin istatistiksel analizi... ……...……..……. Tablo 7: 6. ve 12. haftaların 1. deney gruplarının histopatolojik kriterlerinin istatistiksel analizi...………... Tablo 8: 6. ve 12. haftaların 2. deney gruplarının histopatolojik kriterlerinin istatistiksel analizi...………...………... Tablo 9: 6. ve 12. haftaların 3. deney gruplarının histopatolojik kriterlerinin istatistiksel analizi...………...………..……... 28 41 42 59 61 64 67 69 71
GRAFİKLER LİSTESİ
Grafik 1: 6. hafta KW testinin kemik iyileşme kriterlerine göre dağılım grafiği... Grafik 2: 12. hafta KW testinin kemik iyileşme kriterlerine göre dağılım grafiği... Grafik 3: 6. ve 12. hafta kontrol gruplarının karşılaştırılması ... Grafik 4: 6. ve 12. hafta 1.deney gruplarının karşılaştırılması... Grafik 5: 6. ve 12. hafta 2.deney gruplarının karşılaştırılması... Grafik 6: 6. ve 12. hafta 3.deney gruplarının karşılaştırılması...
60 62 65 67 69 71
SEMBOLLER / KISALTMALAR LİSTESİ
i.v. : Intravenous; damar yoluyla i.m. : Intramuscular; kas içine s.c. : Subcutaneous; cilt altına
H&E : Hematoxylin eosin stain; hematoksilen eosin histokimyasal boyası
N-BP : Nitrojen içeren bifosfonatlar non N-BP : Nitrojen içermeyen bifosfonatlar
ATP : Adenozin trifosfat
FPPS : Farnesyl difosfat sentaz
MMP (Major metalloproteinaz): Kemik rezorbsiyonunu başlatan ve kemik iliği stromal hücreleri tarafından salgılanan enzim
GGPP : Geranildifosfat
ONJ : Jaw osteonecroz (çene osteonekrozu)
YKO : Yeni kemik oluşumu
Kİ : Kemik iliği
pH : Power of hydrojen
PPi : İnorganik pirofosfat
BP : Bifosfonat
CSD : Critical size defect: Kritik büyüklükteki kemik defekti R1,R2 : Pirofosfatlarda bulunmayıp sadece bifosfonatlarda bulunan
yan zincirlerin adları.
Ras, Rho, Rac : Osteoklast fonksiyonunu düzenleyici proteinler
OP-1 : Osteogenetic protein-1
BMP : Bone morphogenetic protein: kemik morfogenetik proteini
FDA : Food and Drug Administration
W.S.R.T. : Wilcoxon Signed Ranks Test
F : Fibrozis
KL : Kollajen lif
D :Damar
KW : Kruskall-Wallis
M : Medyan
P : Olasılık
ZA : Zoledronik asit
MT : Masson trikrom
P.O. : Per os; ağız yoluyla
ÖZET
Cerrahi işlemler, konjenital nedenler veya travma sonucu maksillofasiyal bölgede meydana gelebilen kemik defektleri, estetik ve fonksiyonel bozukluklara neden olabilir. Bu nedenle meydana gelen deformitelerin kemik greftleriyle rekonstrükte edilmesi gerekir. Bu amaçla günümüzde farklı greft materyalleri kullanılmaktadır. Kemik greftlerinin kritik sorunlarından biri de, greft materyalinin istenilenden erken rezorbe olmasıdır. Bunu önlemek için de bifosfonatlardan yararlanmak gündeme gelmiştir. Bu deneysel çalışmada kullanılan zoledronik asidin osteoklast aktivitesini ve sayısını azaltarak, kemik rezorbsiyonunu inhibe ettiği bilinmektedir. Çalışmamızda, osteoklastları inaktive ederek osteogenezise olumlu etkisi olduğu bildirilen bifosfonat grubu ilaçlardan zoledronik asitin sistemik uygulandığı ratlarda; kritik boyut kemik defektlerine uygulanacak olan farklı greft materyalleri üzerine etkisinin histopatolojik olarak değerlendirilmesi hedeflenmiştir. Osteoklastların inaktive olması ile uygulanan greftin bölgede daha uzun süre kalmasını ve böylece daha iyi bir ossöz yapının oluşmasını hedefledik. Bu çalışmada 80 adet Spraque Dawley rat randomize her biri on hayvan içeren 8 gruba ayrılmıştır. Bu gruplarda yer alan tüm hayvanların kalvaryumuna 8 mm çapında kritik boyut kemik defekti açıldı. kontrol grubuna post-operatif birinci hafta sonunda intravenöz olarak 0.1mg/kg tek doz serum fizyolojik uygulandı, 1. deney grubuna post-operatif birinci hafta sonunda intravenöz olarak 0.1mg/kg tek doz zoledronik asit uygulandı, 2.deney grubuna açılan defekt bölgesine sentetik greft uygulandı ve takiben birinci hafta sonunda intravenöz olarak 0.1mg/kg tek doz zoledronik asit uygulandı, 3. deney grubuna ise açılan defekt bölgesine ksenogreft uygulandı ve takiben birinci hafta sonunda intravenöz olarak 0.1mg/kg tek doz zoledronik asit uygulandı. Kontrol ve deney gruplarının birer grubu 6. haftada, birer grubu ise 12. haftada sakrifiye edildi. Sakrifikasyon sonrası elde edilen kalvaryumun histopatolojik incelemesi yapıldı. Çalışmamızın histopatolojik ve istatistiksel incelemeleri sonucunda, tüm deney gruplarında osteoklastların inaktive oldukları, böylelikle zoledronik asitin yeni kemik oluşumuna olumlu etki sağladığı ve meydana gelen osteogenezisin defekt bölgesine uygulanan greft materyallerinden sentetik greft materyaline kıyasla ksenogreft uygulanan grupta daha yüksek bir seviyede oluştuğu
saptanmıştır. Anahtar Kelimeler: 1. Zoledronik Asit 2. Kemik greftleri 3. Deneysel 4. Osteogenezis 5.Kritik boyut kemik defekti
ABSTRACT
Surgical operations, congenital causes or bone defects in maxillofacial area due to trauma, may lead to esthetic and functional disorders. Therefore, the deformities that occur are required to be reconstructed with bone graft. For such purpose, various graft materials are used today. One of the critical problems of bone grafts is that they absorbe earlier than required. To prevent this, use of bisphosphonates has been brought forward. It is known that the zoledronic acid used in this experimental study inhibits bone resorption by reducing osteoclast activity and number. In this study, we aimed to conduct a histopathologic assessment of the effects of zoledronic acid, which is one of the bisphosphonate group medicines known to have a positive effect for osteogenesis by inactivating osteoclasts when used with systematically way on rats, on the various graft materials to be applied to critical size bone defects. By inactivating osteoclasts, our aim is to ensure that the graft applied remains in the area for a longer period of time and thus, a better osseous structure is created. In this study, 80 Spraque Dawley Rats were randomly categorized in 8 groups, each consisting of ten animals. Critical size bone defect of 8 mm on calvaria of all animals in these groups was opened. Serum physiologic was applied to the control group with 0.1 mg/kg dosage as intravenous at the end of the first week after the operation, the first trial group zoledronic acid was applied 0.1 mg/kg dosage as intravenous at the end of the first week after the operation.In the second trial group, synthetic graft was placed in the defect area on the operation and zoledronic acid was applied 0.1mg/kg dosage as intravenous at the of the first week after the operation. In the third trial group xenograft was placed in the defect area on the operation and zoledronic acid was applied 0.1mg/kg dosage as intravenous at the of the first week after the operation. One control and trial study group was sacrificed in the sixth week and another group was sacrificed in the twelfth week. Histopathologic specimen of the calvarium obtained after the sacrification was done. It was found as a result of histopathologic and statistical reviews in our study that osteoclasts inactivated in all trial groups and thus, zoledronic acid makes a positive effect to the development of new bone and has a higher effect on the xenograft, which is one of the graft materials applied to the defect area.
Keywords: 1. Zoledronic Acid 2. Bone graft 3. Experimental 4. Osteogenesis, 5. Critical size bone defect, ,,,,,
1.GİRİŞ VE AMAÇ
Maksillofasiyal cerrahide kemiğe yönelik cerrahi girişimler geniş bir yer tutmaktadır. Travma, enfeksiyon, kemik tümörleri veya kistleri ve ortognatik cerrahi girişimler sonrasında kemik defektleri ortaya çıkabilmektedir. Kemikte oluşan küçük defektler kemiğin kendini tamir edebilme yeteneği ile onarılabilirken, büyük defektlerin tedavisinde ise çeşitli greft ve implant materyallerine ihtiyaç duyulmaktadır (1). Bu defektlerin tedavisinde kullanılan greft ve implant materyallerinin yanısıra, tedavi süresini kısaltmaya ve iyileşmeyi pekiştirmeye yönelik ek bazı yöntemler de önerilmektedir. Bunlar; progenitör hücrelerin transplantasyonu, çeşitli hormonlar, büyüme faktörlerinin verilmesi, demineralize kemik matriksinin kullanılması, kalsiyum sülfat ve elektrofizyolojik araçların kullanımı olarak özetlenebilir (2,3). Son yıllarda, kemik rezorbsiyonunu inhibe etme özelliğinden faydalanılan bifosfonat grubu ajanların da, osteoklastların fonksiyonunu engelleyerek rezorbsiyonu geciktirdiği ve böylece kemik greftlemesi sonrasındaki kemik oluşumunu arttırdığı belirtilmiştir (4). Son on yılı aşkın bir süredir bifosfonatlar, osteoklastik aktivite üzerinde inhibitör etkileri ve antianjiojenik özellikleri nedeniyle kemik metastazlarıyla seyreden meme, prostat, akciğer kanserleri, multiple myeloma gibi malignitelerin, osteoporöz, osteopeni, paget hastalığı, osteogenezis imperfekta gibi sistemik sağlık sorunlarının standart tedavisinde kullanılmaktadır (5). Bifosfonatlar; nitrojen içeriklerine göre alkilbifosfonatlar ve aminobifosfonatlar olmak üzere başlıca iki gruptan oluşmaktadır. Alkilbifosfonatlar birinci kuşak bifosfonatlar olup, bu grupta etidronat, tiludronat, klodronat bulunmaktadır. Aminobifosfonatlar ise ikinci ve üçüncü kuşak olup; ikinci kuşak bifosfonatlar arasında alendronat ve pamidronat yer alırken, üçüncü kuşak bifosfonatlar ise rizedronat, ibandronat ve zolendronat olarak sınıflandırılmıştır (6). Nitrojen içerikli bifosfonatlar, hidrolize karşı oldukça dirençlidirler ve yarılanma ömürleri uzundur. Bu grup içinde zoledronik asit, en geniş kullanım alanı bulan ve günümüzdeki en etkili bifosfonat olarak bildirilmiştir (4,7). Kemik grefti üzerine etkilerini inceleyen literatürlerin sayısı da henüz az olmakla birlikte, son yıllarda bir artış göstermiştir (8). Yapılan literatür araştırmasında, zoledronik asitin kemik grefti üzerine etkilerinin incelendiği görülmüş (8-10), ancak farklı greft materyallerinin osteogenezisi üzerine etkisini inceleyen bir çalışmaya rastlanmamıştır. Çalışmamızın amacı, son jenerasyon
nitrojen içerikli bifosfonatlardan olan zoledronik asitin, kritik boyut kemik defektlerinde farklı greft materyalleri üzerine etkilerini deneysel olarak incelemek ve farklı grupları birbirleri ile kıyaslamaktır.
2.GENEL BİLGİLER 2.1.KEMİK
Kemik, vücudun iskelet yapısını oluşturarak istemli fiziksel aktivitelere direnç ve destek sağlayan, yaşamsal önem taşıyan organları koruyan, kemik iliği içeren, ekstrasellüler matriksin mineralleşme süreci sonunda kalsiyum ve fosfat tuzlarıyla satüre olduğu bir bağ dokusudur (11,12).
2.1.1. Kemiğin Yapısı Kemik, vücudun yumuşak dokularını taşımak üzere iskelet sistemini oluşturan bir yapıdır. Hassas dokuları korumak, eklemlere destek sağlamak, ayrıca fosfor, kalsiyum, sodyum ve magnezyum gibi iyonları depolamak görevleri arasındadır. Kemikler organik ve inorganik bölümlerden oluşmuştur (13).
Organik Bölüm
Bu yapının büyük bölümü kollajen liflerden (Tip I), protein ve glikozaminoglikanlar'dan oluşan temel maddeden (amorf madde) yapılmıştır. Gelişmiş bir kemik dokuda lifler paralel ve belirli aralıklarla porlar bırakacak şekilde yerleşmiş olup, aralarında hidroksilapatit kristalleri lokalizedir. Kemik matriksi genel olarak asidofildir. Doku kollajenlerden zengin olduğundan, bu liflere uygun boyalarla gayet iyi boyanırlar. Histolojik incelemede, dokuya eğer dekalsifikasyon uygulanırsa inorganik tuzların ortadan kalkmasıyla kemik demineralize olur ve yumuşar, ancak mikroskobik yapısını, şeklini ve sağlamlığını korur. Bunun yanısıra histolojik teknik organik elemanların ortadan kaldırılmasına yönelik ise (maserasyon gibi), kemiğin sağlamlığı ve esnekliği bozulur, kolay kırılır hale gelir. Başka bir anlatımla, kemiğin organizmadaki gerekli işlevlerini tam olarak yerine getirebilmesi, ancak dokudaki organik, inorganik elemanların ve matriksin uyumlu birlikteliğine bağlıdır (14).
İnorganik Bölüm
İnorganiklerin başında kalsiyum, fosfat, sitrat, magnezyum gibi maddeler gelir. Kalsiyum ve fosfat, hidroksilapatit kristalleri şeklindedir ve kemik kollajenlerinin yanında amorf madde ile birlikte iç içe organize olmuşlardır. Hidroksilapatit kristallerinin kemikteki önemi, kollajenlerle beraber kemik sertliğini
ve dayanıklılığını sağlamasıdır. İnorganik maddeler, kemiğin kuru ağırlığının yaklaşık % 50'sini oluşturmaktadırlar (15).
2.1.2. Kemik Hücreleri
Kemiğin hücresel elemanları; osteoklastlar, osteoblastlar, osteositler, kemik yüzeyini döşeyen hücreler, kemik iliği hücreleri ile kemiğin büyüme ve gelişimini düzenleyen immün hücrelerden oluşur. Ayrıca osteoprogenitör hücreler adı verilen, periost ile endostta bulunan ve ancak aktive olduklarında ayırt edilebilen, osteoblastlara dönüşebilme özelliği olan mezenkimal hücreler de bulunmaktadır (16).
Kemik dokusunun başlıca 4 tip hücresi bulunur (Şekil 1) ; I. Osteoprogenitör hücreler
II. Osteoblastlar III. Osteositler IV. Osteoklastlar
Şekil 1: Kemik hücreleri (17)
Bu hücreler, embriyonal mezenkimden kaynaklanan stromal hücrelerin farklılaşması sonucu oluşurlar. Periost, endost ve büyümekte olan kemiklerin epifiz kıkırdaklarında bulunurlar. Osteoprogenitör hücreler, kemiğin normal büyüme sürecinde aktiftirler. Yetişkinlerde kemiğin yeniden şekillenmesinde veya kırık iyileşmesinde ve diğer yaralanmalardaki tamirde aktive olurlar. Bu durumlardan herhangi biri olduğunda, sayıca artıp osteoblastlara ya da osteoklastlara dönüşebilen öncü hücrelerdir (18). Osteoprogenitör hücreler iki tiptir;
a) Direkt kemik yapımı ile ilgili olan yapıcı osteoprogenitör hücreler; bunlar önce osteoblastlara, daha sonra da osteositlere dönüşürler (14).
b) Bağ dokusunun diğer tiplerinde görünen osteoprogenitör hücreler; bunlar herhangi bir bağ dokusu hücresine differansiye olabilirler (örn: fibroblast, yağ hücreleri) (13).
II) Osteoblastlar
Bazofil boyanan 20-30 µ genişliğindeki, kübik şekilli hücrelerdir (19). Osteoblastların çok sayıda girintili çıkıntılı endoplazmik retikulumları, bol serbest ribozom ve poliribozomları olduğu görülmüştür. Golgi bölgesi gelişmiştir ve mitokondriler çok sayıdadır. Geniş ovoid çekirdek, dış merkezli olarak yerleşmiştir. Hücre yüzeyinde az miktarda kısa mikrovilluslar vardır. Osteoblast, kemik hücresinin öncülü olan olgunlaşmamış hücre çeşididir. Çoğalarak, olgunlaşmamış kemik hücresine dönüşür. Böylece kemiklerin oluşumunda ve yenilenmesinde rol oynar. Osteoblastların kemik yapımı, kişiden kişiye değişiklik gösterir ve ortalama 120 gün sürer (20) (Şekil-2).
Osteoblastlar kemik yapan genç hücrelerdir,
Şekillenmekte olan kemik dokunun yüzeyinde tek sıra halinde dizilirler, Prizmatik, kübik ya da yassı şekilli olabilirler,
Yüksek metabolik aktivite gösterirler,
Osteoblastlar kemik dokunun kollajen liflerini, proteoglikanlarını ve glikoproteinlerini sentezlerler,
Üretilen bu temel madde henüz kireçleşme göstermez, bu yapıya "osteoid" denir,
Osteoid içerisine gömülen osteoblastlar, aktivitelerini azaltarak birer osteosite dönüşürler.
Şekil 2: Osteoblast (21)
III) Osteositler
Osteoblastlar, mineral matriks ile çevrelenmeleri sonucu osteositlere dönüşürler. Osteositler en çok bulunan kemik hücreleridir ve dentritik uzantılar yoluyla birbirleriyle ve kemik yüzeyindeki hücrelerle bağlantı kurarlar. Bölünme yetenekleri olmayan osteositler, bulundukları matriksin devamlılığını sağlar, kan kalsiyum (Ca) düzeyini dengede tutar ve fonksiyonlarını kaybettikleri zaman kemik rezorbsiyonunu başlatırlar (22) (Şekil 3).
IV) Osteoklastlar
Hematopoetik mononükleer/fagositik seri hücrelerinden gelişen prekürsör hücreler, kemik yüzeyinde füzyona uğrayarak çok çekirdekli (2-5 çekirdek/hücre veya daha fazla) dev bir hücre (20-100um) olan osteoklastları oluştururlar. Kemik yüzeylerinde yer alan rezorbsiyon kaviteleri ya da howship lakünleri adı verilen boşluklarda bulunurlar (21). Osteoklastlar, osteoblastlarla birlikte kemiğin mekanik etkenlere bağlı olarak şekillenmesini kontrol ederler (11).
Osteoblasta etki ederek osteoklast gelişimini uyaran hormon ve faktörler; kalsitriol, PTH, transforming büyüme faktörü beta (TGF-β), prostaglandin E-2 (PGE2), interlökin-1,11 ve 6' (IL-1,11 ve 6) dır. Baskılayanlar ise; IL-4, 13 ve interferon gama'dır (12). Çok sayıdaki kalsitonin reseptörleri sonucunda, kalsitonin, preosteoklastlara ve osteoklastlara doğrudan etki ile kemik yıkımını ve kalsiyumun açığa çıkışını azaltır (12). Osteoklastların kemik yüzeyine yakın olan kısımlarında, hücre duvarı çok sayıda katlanma yaparak yüzeyi arttırır. Bu kısımlar, mineralize yüzeye tutunarak rezorbsiyon bölgesini belirlerler. Bu özellikleriyle osteoklastlar, kemik matriksinin hem organik hem de inorganik kısımlarının çözünmesini sağlarlar (17,21).
Osteoklastların kemik yıkımı bölgesini nasıl seçtikleri bilinmemekle beraber, kemik yüzey hücrelerinin, kontrakte olarak açtıkları ve osteoklastların rastgele açık kemik yüzeyine yapıştıkları ve kemik yıkımını başlattıkları kabul edilmektedir (23). Osteoklastlar, kemik mineral yapısını çözerek kalsiyumun açığa çıkmasını sağlarlar. Osteoklastların etkileri bifosfonatların, kalsitonin ve östrojen hormonlarının etkileriyle azalır; paratiroid, tiroksin hormonları ve D vitamini ile artar (22). Osteoklastların yaşam süreleri 3-4 hafta olup, olgun osteoklastlar; östrojen ve TGF-β' nın apoptozisi uyarmasıyla yerlerini, yeni osteoklastlara bırakırlar (24).
Kemik yüzeyini döşeyen hücreler
Endosteal ve trabeküler yüzeyler, bir hücre tabakası ile kaplıdır. Bu tabakada yassı inaktif hücreler bulunur. Bu hücreler inaktiftirler ancak, aktif osteoblastlara dönüşebilirler. Yüzeyi kaplayarak osteoklast rezorbsiyonunu engellerler. Kemik yüzeyinde düzleşmiş ve uzamış halde bulunan ve kemik yapımına katılmayan osteoblastlar, "kemik yüzeyini döşeyen hücreler" olarak adlandırılırlar. Erişkin iskeletinin büyük bir kısmını örterler, kemik ve ekstrasellüler sıvı kompartmanı
arasında bariyer oluşturdukları ve kemikte yeni kemik oluşumunun veya rezorbsiyonunun hangi bölgede gerçekleşeceğini düzenledikleri tahmin edilir (25).
2.1.3. Kemik Matriksi
Hücreler arası doku, organik ve inorganik yapılardan meydana gelir. Kemik matriksin % 10-29'unu su, kemik kuru ağırlığının % 60-70'ini inorganik yapı ve % 30-40'ını ise organik yapı oluşturur. Organik yapının % 90-96'sı bağ dokusunun da ana bileşeni olan ve tüm vücut proteinlerinin 1/3 'ünü oluşturan kollajendir (25).
I) Organik matriks a) Kollajen
b) Esas maddeden meydana gelir
a) Kollajen
Kollajen; 1000 aminoasidi kapsayan üç polipeptit zincirin üçlü sarmal şeklini alarak, hidrojenle birbirlerine bağlanması sonucu oluşan, uç uca kollajen birimlerinden meydana gelen bir yapıdır. Kollajenin kapsadığı aminoasitlerin %13'ü glisindir. Bunun dışında; %21-23 oranında protein ve hidroksiprolin ile az miktarda hidroksilizini içerir. Beş farklı tipi bulunan kollajen yapının bileşimi dokudan dokuya göre değişebileceği gibi, bir doku içinde birden fazla tipi de bulunabilir (18). Şimdiye kadar onsekiz çeşit kollajen tespit edilmiştir (25). Dokularda en çok görülen kollajen tipleri şunlardır;
Tip I: Kemik omurga diskleri ve tendonlarda bulunur. Tip II: Kıkırdak dokularda bulunur.
TipIII: Kıkırdaktan daha yumuşak ve daha kolay eğilebilen dokularda bulunur.
Tip IV: Genelde bazal membranda bulunur.
Tip V: Kemik kıkırdak ve bazal membranda bulunur.
Kemik kollajeni, aynı özelliklere sahip olmamasına karşın derideki kollajene benzer, ancak kemik kollajeni daha yoğun, daha az çözünür ve mekanik kuvvetlere karşı daha dirençli bir yapıya sahiptir. Kemik kollajeni, galaktoz monosakkarid, glutamik asit, aspartik asit ve fosfat aminoasitleri bakımından yumuşak doku kollajeninden daha zengindir. Kollajen, kemik mineralinin atipik fazının oluşumunda
çekirdekleştirici bir etki yapar. Kollajen liflerin sentezi, mezenkimal kökenli osteoblastlar tarafından meydana getirilir (13).
b) Esas madde
Kollajen fibriller ve kemik kristalleri etrafındaki değişik makromoleküler yapılardır. Çeşitli glikozaminoglikanlar, gliko ve mukoproteinler ile fosfolipidlerden oluşur. Biyokimyasal olarak incelendiğinde, yapısında glikozaminoglikan olarak kondroitin sülfat A ve C, hyalüronik asit ve keratosülfat bulunur.
Glikoproteinler, sialoprotein yapısındadırlar. Bu yapının yarısı proteinler, yarısı da karbonhidratlardan meydana gelmiştir. Bu protein yapıya "osteomukoid" de denilmektedir. Osteokalsin, osteoblastlar tarafından sentezlenen bir glikoproteindir. Bu madde karaciğerde üretilen 2-HS-glikoprotein ile birlikte, kemikteki kalsiyum depozisyonunda rol oynar. Osteoblastlar tarafından salgılanan bir glikoproteindir. Kollajen lifler; kemik kristalleri ve osteositler arasında adhezyonu sağlarlar. Fosfolipidler, glikozaminoglikanlar, fosfoproteinler kemiğin diğer organik maddeleridir. Bu maddeler, özellikle kemiğin erken mineralizasyonunda ve kalsiyum tuzlarının olgunlaşmış kemikte korunmasını sağlarlar (15).
II) İnorganik yapı (Kemik tuzları)
Kemik ağırlığının % 60-70'ini kemik tuzları oluşturur. Bu yapı, kemik dokusunun direncinde ve sertliğinde önemli bir rol oynar. Kemik dokusunun ana iyonları kalsiyum, fosfat, hidroksil ve karbonattır. Bunun yanında, daha az olarak sitratlar, magnezyum, sodyum, potasyum, flor, klor, demir, çinko, alüminyum, stronsiyum gibi iyonlar da mevcuttur. Kemik mineralleri asitte çözünürler, bu da kemiğin mineral matriksi demineralize edildikten sonra histolojik olarak incelenmesini sağlar. Kemik mineral matriksinde iki tip kristal gözlenir. Çok miktarda olanı hidroksilapatit, az miktarda olanı da amorf kalsiyum fosfattır. Organik matriks oluştuktan kısa bir süre sonra mineral matriksin % 90'ı tamamlanır, geri kalan % 10'luk kısım devamlı değişkenlik gösterir. Yaşlanma ile mineral matriksin iyon oranları değişir, kemikteki iyonik kalsiyum ve karbonat oranı artar; fosfat, iyonik magnezyum, su oranı ve buna paralel olarak da kemik direnci azalır (26).
2.1.4. Periosteum ve Endosteum
Kemiğin dış ve iç yüzeyleri, kemiği oluşturan hücrelerden ve bağ dokusundan oluşan tabakalarla örtülüdür. Dıştakine periosteum, içtekine de endosteum denir. Periosteum'un dış tabakası kollajen lifler ve fibroblastlardan oluşmuştur. Demetler halinde periostal kollajen liflerden oluşan Sharpey lifleri, matriks içine girerek periostu kemiğe bağlar. Hücreden daha zengin olan periosteumun iç tabakası ise, bölünüp farklılaşarak osteoblastları oluşturabilme potansiyeline sahip olan yassı hücrelere dönüşür (13) (Şekil 4).
Şekil 4: Periosteum, endosteum (23)
2.1.5 Kemik Tipleri
Kemiğin mikroskobik olarak incelenmesi sonucu 2 farklı tip kemik bulunduğu ortaya konmuştur. Primer, olgunlaşmamış ya da kaba lifli kemik ve sekonder, olgun ya da lameller kemik. Primer kemik, embriyolojik gelişim sürecinde kırık ve diğer nedenlerle ilişkili onarım işlemlerinde ilk ortaya çıkan kemik türüdür. Sekonder kemiğin lameller halinde organize olmuş kollajen lif dağılımının aksine, primer kemik, rastgele ve değişik dağılmış ince kollajen lifleri ile özellik kazanmaktadır. Enine kesilmiş kemik kesitleri kabaca incelendiğinde; boşluksuz yoğun sahalar kompakt kemiği, çok sayıda birbirleri ile ilişkili boşluklardan oluşan alanlar ise süngerimsi kemiği oluştururlar (17).
Primer kemik, ilk ortaya çıkan kemik dokusudur, geçicidir ve kafadaki yassı kemik eklemleri, diş alveolleri ve tendonların kemiğe tutunduğu alanlar dışında yerini sekonder kemiğe bırakır. Sekonder kemik dokusu genellikle yetişkinlerde bulunur, primer kemikten daha fazla mineral içerir ve primer kemiğe göre daha az oranda osteosit bulundurur (13).
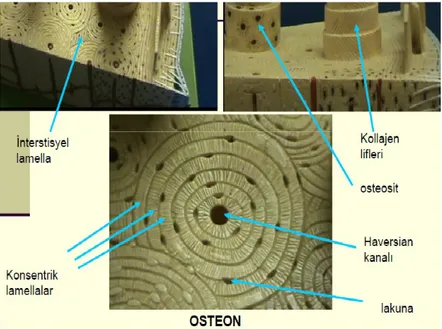
Kan damarlarını, sinirleri ve gevşek bağ dokusunu içeren kanalı saran dairesel lamellerin meydana getirdiği bütünlüğe "havers sistemi" ya da "osteon" denir. Osteositleri içeren lakünalar, lamellerin arasında ve nadiren de içinde bulunur. Havers kanalları, yatay ya da oblik seyreden volkman kanalları aracılığı ile kemik iliği boşlukları, periosteum ve kendi aralarında iletişim kurmaktadır (Şekil 5). Büyüme sırasında ve hatta yetişkin kemikte havers sistemleri sürekli yıkılarak yeniden yapıldığı için, çoğu zaman oldukça büyük bir merkezi kanal ve bir iki lamelden ibaret sistemler görülebilir (27).
Şekil 5: Osteon (17)
Nonlameller (Retiküler) Kemik
Embriyonik dönemde, kırık iyileşme sürecinde (kallus oluşumu) ve hiperparatiroidizm ile Paget hastalığı gibi patololojik süreçlerde, bu tip kemikle karşılaşılır. Tesadüfi dizili kollajen lifler ve osteoblastlar ile döşeli, düzensiz vasküler boşluklardan oluşur. Kafadaki yassı kemik eklemleri, diş alveolleri ve tendonların kemiğe tutunduğu yerler gibi birkaç yerin dışında, yerini sekonder kemiğe bırakır (13).
Kompakt Kemik
Homojen, sıkı ve kompakt bir yapıdır. Kompakt kemik, kortikal veya lameller kemik olarak da adlandırılır. Nonlameller kemikten yeniden yapılanma sonucu oluşur. Yassı kemiklerin iç ve dış tabakalarını, uzun kemiklerin dış yüzünü oluşturur.
Kortikal kemiğin ana yapısı "Havers sistemi" olarak da adlandırılan osteondur. Osteon, uzunlamasına dizili vasküler kanalları (Havers kanalları) saran silindirik şekilli vasküler kemikten oluşur. Horizontal dizilimli kanallar (Volkman kanalları) komşu osteonları birleştirir. Volkman kanalları sayesinde, havers kanalları kemik iliği ve periosteumla bağlantı kurar. Bu kanallara besleyici kanallar denir. Erişkin insan iskeletinin yaklaşık olarak % 80'i kompakt kemikten oluşur (13). Sert bir matrikse sahip olan kemik dokusunda diffüzyon olanağı olmadığından, kanal ve kanaliküllerle kemiğin dışından içine kadar ilişki kurulur ve bu şekilde metabolizma için gerekli maddeler damar ve kanaliküllerle hücrelere kadar ulaşır. Kortikal kemiğin mekanik gücü, osteonların sıkı dizilimine bağlıdır (18).
Spongioz (Süngerimsi) Kemik
Kemik trabeküllerinin birbiriyle anastomozlaşarak oluşturduğu süngerimsi bir yapıdır. Kansellöz kemik (trabeküler kemik) kortikal kemik yüzleri arasında, bal peteği görünümlü, boşluklarında hematopoetik elemanlar içeren, 1 mm kalınlığında trabeküllerden oluşur. Spongioz kemiğin trabekülleri arasında birbirleriyle bağlantılı irili ufaklı boşluklar bulunur ki, bunların içi de kemik iliği ile doludur . Spongioz kemik mekanik etkilere karşı zayıftır ve kolaylıkla kırılır. Vücut kemiklerinin hacimsel olarak % 20'sini teşkil eder (14).
Kortikal kemiğe göre daha gevşek yapıda olmasına rağmen, özellikle femur başında ve vertebralarda trabeküllerin kortekse dik yerleşimli dizilimi sayesinde dış yüklenmeye yapısal karşı koyma gücüne sahiptir (12).
2.1.5. Kemiğin İyileşme Mekanizması
Kemik iyileşmesi, orijinal kemik yapı ve fonksiyonunu geri kazandırabilmek için kompleks rejeneratif proçesler barındıran fizyolojik olaylar dizisidir. Kemik yapılanması iki ayrı mekanizmayla gerçekleşir: Endokondral ve membranöz kemik yapımları (15).
Endokondral kemikleşme uzun kemiklerin epifizyal yüzeyi ve mandibulanın kondil başında meydana gelir ve kemik uzamasında rol oynar (14). Endokondral kemikleşme sırasında mezenkim doku, kemiğin hyalin kıkırdak modelini oluşturur ve bu kıkırdak model rezorbe olarak, yerini yeni kemiğe bırakır. Bu olay doğum öncesi başlar ve büyüme tamamlanıncaya kadar devam eder (20,23). Membranöz
kemik formasyonu ya da primer kemik iyileşmesi ise, mezenkimal hücrelerin osteoidi üreten osteoblastlara diferansiasyonu ile gerçekleşir. Bu osteoid, daha sonra kemik formu oluşturmak üzere mineralize olur (28).
Kemik dokusunda bir defekt meydana geldiği zaman, çevredeki yumuşak dokuda ve kemik içinde kanama olur. Defekt bölgesi kanla dolar, bu kanın pıhtılaşması ile kemik iyileşmesi başlamış olur. İltihap safhasında, çevre damarların hasarına bağlı olarak defekt bölgesi kanla dolar. Defekt bölgesi hipoksik ve asidik ph' ya sahiptir. Bu bölgede lizozomal enzimler salgılanır ve osteojenik aktivite bozularak, doku nekrozu meydana gelir. Defekt bölgesi mast hücreleri, polimorf nüveli lökositler ve makrofajlar bakımından zengindir. Ayrıca, yara iyileşmesinde salgılanan bazı mediatörler, reparatif hücre proliferasyonunu stimüle ederler. Bu ortama osteoblastlar, endotelyal hücreler ve kondroblastlar dağılır. Mast hücreleri, bazı makrofajlar ve reparatif hücreler, kaynağını çevre dokudan alırlar. Polimorf nüveli lökositler ve kalan makrofajlar ise kan dokusundan gelirler. Yine bu sahada, osteoklastlar ve makrofajlar, defekt bölgesindeki nekrotik kemiği ve doku kalıntılarını yok etmeye başlarlar (11). Yapılan yeni araştırmalar, makrofajların bazı mediatör ve salgılarla kollajen sentezini ve yara iyileşmesindeki anjiogenezisi stimüle ettiğini göstermiştir. Bu olayın, kemik defektinin iyileşmesinde de etkili olduğu düşünülmektedir (28).
İltihap safhasından sonra organizasyon safhası başlar. Bu safhada, periosteum ve endosteumdaki kemik dokusundan hematom içine kapillerler ve mezenkim hücreleri girer, böylece granülasyon dokusu oluşumu başlar. Granülasyon dokusu "yumuşak kallus" olarak da adlandırılır. Yumuşak kallus; kollajen ve glikoproteinlerden oluşan matriks içine gömülmüş, fibroblast, osteoblast, kondroblast ve gelişen kapiller damarları kapsar. Yumuşak kallus eksternal ve internal kallus olmak üzere iki kısımda görüldüğü gibi, bazı araştırıcılar bunlara ek olarak bir de intermediate kallus olduğunu belirtmektedirler. Eksternal kallus, periostun osteojenik tabakası içindeki osteoblastların proliferasyonundan meydana gelir. İnternal kallus ise endosteal hücrelerden meydana gelir (25).
Defekt oluşumundan itibaren ilk üç ile dört hafta içinde bu olaylar sonuçlanır ve sert kallus oluşumu yani "rejenerasyon dönemi" başlar. Rejenerasyon olayı iyileşmenin ikinci, üçüncü ayına kadar devam eder, internal ve eksternal kalluslar derece derece demet kemiğine dönüşür ve artık düzensiz kemik yapımı başlar. Hücre
sayısındaki artış ve damarlanma devam eder, dönem ilerledikçe devaskülarizasyon gelişir, osteoblastlar osteoid maddeyi üretirler, ortamın pH 'si yükselmeye başlar, pH yükselmesini takip eden onuncu günden itibaren osteoblastlar alkalen fosfataz üretirler ve osteoid madde üzerine kireç çökelir. Düzensiz olan bu kemik yapısı zamanla osteoklastlar tarafından rezorbe edilerek, düzenli kemik yapımı sağlanır. Bu dönem "yeniden şekillenme (remodeling)" olarak adlandırılır. Eksternal kallus rezorbe olurken, intermedial kallus havers sistemi içeren lameller kemiğe dönüşür, internal kallus ise kansellöz kemiği oluşturur. Yeniden şekillenme sahasında vaskülarizasyonun normale dönmesi ile birlikte, dokudaki oksijenlenme de normalleşir ve bu safha birkaç yıl sürer (15).
2.1.6. Kemik İyileşmesini Etkileyen Faktörler
Kemik iyileşmesi; yara bölgesinin durumu, yara bölgesinin damarlanması, kemiğin tipi, immobilizasyon derecesi, lokal nekroz, yumuşak doku hasarının miktarı, enfeksiyon varlığı gibi lokal faktörlerden; yaş, diabet, anemi, tüberküloz gibi sistemik hastalıklardan; paratiroid hormonu, kalsitonin, insülin, büyüme hormonu gibi hormonlardan ve A, C ile D vitaminlerinden, kondroitin sülfattan ve egzersizler gibi genel faktörlerden etkilenmektedir (29).
Lokal Faktörler
Travmanın şiddeti iyileşmeyi geciktirir. Kemik ve yumuşak doku kaybı olabilir, bu da kemik iyileşmesi üzerine olumsuz etki yapar (30).
Karşılıklı gelen kansellöz kemik uçları, kortikal kemiğe oranla daha hızlı kaynar, çünkü kan ile hücreden zengindir ve birim alana düşen kemik temas yüzeyi daha fazladır. Kortikal kemikte ise, birim temas yüzeyi daha az ve kanlanma daha zayıftır (31).
Defekt bölgesindeki kallusun beslenmesi, granülasyon dokusu ve defekt bölgesine gelen kan damarlarıyla olur. Uçların birbirinden uzak kalması sonucu bu dolaşımının bozulması, kemik iyileşmesini birinci derecede bozan nedendir (32). Defekt bölgesinde cilt veya mukoza da yaralanmışsa; bu tür yaralanmalarda kallus ve defekt bölgesinin iyileşmesi için osteoblastik faaliyetle yatak görevi yapacak olan hematom ortadan kalkar ve dış ortamdan gelen bakteriler sonucu enfeksiyon gelişebilir, iyileşme gecikebilir veya tamamen bozulabilir (33).
Enfeksiyon gelişirse, bölgedeki granülasyon ve kemikleşme dönemindeki dokular harap olur, fibröz doku ve nedbe dokusu gelişerek iyileşme bozulur. Defekt bölgesinde yumuşak doku yaralanması meydana geldiğinde damarlarla beslenme de bozulur, bu da kemik iyileşmesini olumsuz etkiler (34).
Günde yaklaşık iki saat, 2-3 atmosfer basınç altında oksijen uygulamasının kemik yaralanmalarının iyileşmesine yardım ettiği gözlenirken, günde altı saatlik dozda uygulamaların iyileşmeyi geciktirdiği izlenmiştir. Deneysel ve klinik araştırmalar düşük şiddette ses dalgalarının ise, iyileşmeyi hızlandırdığını göstermiştir (35).
Genel Faktörler
Kemik iyileşmesi döneminde en kritik dönem, enflamasyonun ve neovaskülarizasyonun oluştuğu ilk iki haftadır. Bu dönemlerde kemik iyileşmesi, çeşitli sistemik faktörler ve hormonlar tarafından olumsuz yönde çok daha kolay etkilenir.
İyileşmeyi Etkileyen Sistemik Faktörler İyileşmeyi etkileyen sistemik faktörler şunlardır; Sigara kullanımı,
Malnütrisyon, Diabet,
Romatoid artrit ve Osteoporöz
İyileşmenin ilk haftası içinde steroid kullanımı, sitotoksik ajanların kullanımı, nonsteroid antienflamatuar ajanlar engelleyici etki göstermektedir. Yine ilk 2 hafta içinde radyoterapi uygulaması ile hücre proliferasyonunda önemli engellemeler olur (36).
İyileşmeyi Etkileyen Sistemik Hormonlar İyileşmeyi etkileyen sistemik hormonlar şunlardır; Östrojenler
Glukokortikoidler
Kalsitonin (37).
2.2. BİYOMATERYALLER 2.2.1. Tanımı
Canlı organizmada, herhangi bir etken sonucu meydana gelen eksikliğin giderilmesinde ve fonksiyona dönebilmesinde ya da bu eksikliğin organizma tarafından düzenli ve hızlı bir şekilde tamamlanmasına yardımcı olan tüm maddelere 'Biyomateryal' adı verilir. Biyomateryal ayrıca biyolojik sistemler ile etkileşmesi amaçlanan tıbbi bir araçta kullanılan cansız bir materyal olarak da tanımlanır (15).
İdeal bir biyomateryali elde etmek için uzun yıllar çalışmalar yapılmış ve henüz kaybedilen dokuların tekrar elde edilmesi veya kemik defektlerinin tamamen dolmasını sağlayabilecek özelliklere sahip bir materyal bulunamamıştır (38).
Greft materyalleri biyouyumluluklarına göre 3 sınıfa ayrılır; Biyotolere materyaller, Biyoinert materyaller ve Biyoaktif materyaller. Biyotolere materyaller, kollajenden zengin ana tabakanın formasyonu ve öncül hücrelerin osteoblastlara yeterli farklılaşmasıyla konakçı doku etrafında irritasyona sebep olur. Biyoinert materyaller, hücresel cevap düzeyinde çevre dokularda hiçbir yan etki göstermez. Sonuç olarak hiçbir enzim reaksiyonu görülmez ve biyomateryal bireyin immün sistemine karşı kamufle edilir, hiçbir yabancı cisim reaksiyonu meydana gelmez ve kontakt osteogenezisi oluşur. Biyoaktif materyallerde ise çevredeki kemikten başlayarak, kollajen ve hidroksilapatitin implant yüzeyine apozisyonu meydana gelir ve kimyasal bir birleşme yaparlar (39).
2.2.2. Biyomateryallerin Taşıması Gereken Özellikler
Biyomateryal olarak kullanılacak maddelerin, bir takım temel özellikler taşıması gerekir. Bu niteliklerden fazlasını taşıyan materyal, en uygun ve en fazla kullanılabilir materyal olacaktır.
Biyolojik uygunluk; Uygulanan biyomateryal doku tarafından kabul edilebilir olmalıdır. Spesifik ve non-spesifik immün mekanizmaları harekete geçirmeyecek, immün sistem tarafından mümkün olduğu kadar tolere edilebilen bir madde olmalıdır.
Biyoinert, biyouyumlu olmalıdır.
Osteokondüktif veya osteojenik olmalıdır. Toksik olmamalıdır.
Kimyasal olarak bozulmadan sterilize edilebilmelidir. Enfeksiyona karşı dirençli olmalıdır.
Çevre dokuları etkileyebilecek renk özellikleri olmamalıdır.
Uygulaması kolay olmalı, uygulama esnasında minimum travmaya neden olmalıdır.
Bazı özel uygulamalarda materyale önceden form verilmiş blok halinde olmalı ve uygulama sırasında kesilip şekillendirilebilmelidir.
Rezorbsiyona dirençli olmalıdır.
Uygulama hasta tarafından kabul edilebilir olmalıdır. Uygulaması kesin sonuçlar vermelidir.
Başarısızlık durumunda kolaylıkla çıkartılabilmeli veya kesilebilmelidir. Saklanması ve depolanması kolay olmalıdır.
Ucuz olmalı ve elde edilmesi kolay olmalıdır (15). 2.2.3. Biyomateryal Çeşitleri
Biyomateryaller elde edildikleri dokulara göre sınıflandırılmışlardır, 2.2.3.1. Kemik Kaynaklı Biyomateryaller
Fasiyal iskelet onarımında, yüz yıldan beri çeşitli kemiksel biyomateryaller kullanılmaktadır. Bu materyaller bir travma sonucu oluşan defektlerin tedavisinde, konjenital deformitelerin, tümör cerrahisi sonucu oluşan kemik defektlerinin tedavisinde kullanılır. Destrüksiyona uğrayan bir dokunun tedavisi için yerleştirilen maddeler "greft" olarak adlandırılır. Organ veya doku grefti uygulamalarında transplante edilen materyaller, immunolojik orijinlerine göre sınıflandırılmaktadır. Günümüzde oral ve maksillofasiyal cerrahide, otojen kemik greftleri (otogreft), homojen kemik greftleri (allogreftler), heterojen kemik greftleri (ksenogreftler) ve alloplastik materyaller kullanılmaktadır (40).
2.2.3.1.1. Otojen Greftler
Hem donör, hem de alıcının aynı kişi olduğu materyallerdir. Kemik parçası aynı hastada uzak bir sahaya transplante edilebilir (heterotopik) veya aynı bölgede kullanılabilir (ortotopik). Otogreftler en sık olarak; kalvaryumdan, iliak kemikten ve
kostalardan; ağız içinden ise simfizden, ramustan, tüber bölgesinden, ekzostozlardan, iyileşme durumundaki diş çekim soketinden ve interseptal alveol kemiğinden elde edilir. Otojen kemik grefti kullanımının konakçı reddi, enfeksiyona gösterdiği direnç, kemik gelişimi için sahip oldukları potansiyel ve rekonstrükte ettikleri alanı taklit edebilme özelliği veya hastalık transferi komplikasyonlarını ortadan kaldırma gibi avantajları vardır (41- 43).
Kortikal greftler form sağlayıp, dayanıklı ve sert bir yapı oluştururken, osteogenezisi artırıcı yetenekleri yoktur. Kansellöz kemik ve kemik iliğinin primer avantajı ise, belirgin şekilde osteogenezisi artırma yetenekleridir. Bu yetenekleri, osteojeniteyi indükleme kapasitesine ve osteoblastlara dönüşebilen canlı hücrelere sahip olmalarına bağlıdır. Bu greftlerin bilinen tek dezavantajı; mekanik dayanıklılığı sağlayamamalarıdır (43).
Kortikokansellöz kemik greftleri ise, hem kortikal hem de kansellöz kemiklerin kuvvetli özelliklerini aynı derecede kombine etmemektedir. Kortikokansellöz kemik, kansellöz kemik kadar osteogenezisi artırıcı özelliğe sahip değildir çünkü, daha nonpöröz bir yapısı olan kortikal kemik tabakasına da sahiptir. Kortikokansellöz greftlerin avantajı; kortikal greftler gibi mekanik sağlamlık ve form kazandırmak, bir miktar da osteogeneziste artma elde etmektir (41, 44, 45).
İntraoral olarak otojen kemik grefti sağlamak amacıyla başta simfizis bölgesi, ramusun ön yüzü, tüber çıkıntısı, torus bölgeleri olmak üzere ağız içindeki uygun alanlar kullanılabilir. Literatürde kısıtlı miktarda otojen kemik grefti gereken durumlarda, yeni bir donör alan olarak zigomatik buttres'in kullanılabileceğini rapor edilmiştir. Greftlerin alınmasında frezler, testereler, lazerler ve ultrasonik enstrümanlar kullanılabilir (40).
Ağız Dışında Otojen Kemik Grefti Sağlanan Bölgeler
İnsan vücudunda ağız içi haricinde başta kraniyal kemikler, kaburgalar, iliak kemik, tibial kemik olmak üzere uygun bölgeler kullanılabilir. Ağız dışı bölgelerden otojen kemik grefti alınmasının, hastane şartlarında yapılması önerilmektedir. Diğer yandan hastane şartlarına gereksinim olmaksızın, klinik koşullarda da iliak bölgeden otojen kemik grefti alınabileceğini rapor eden çalışmalar da mevcuttur (43).
2.2.3.1.2 Allogreft:
Allogreft, aynı türden fakat genetik olarak alıcıyla hiç bir benzerliği olmayan canlılardan alınan dokulardır. Kemik allogreftleri, değişik genetik tipte farklı kadavralardan çıkarılan kemiklerden elde edilir ve çeşitli işlemlere tabi tutularak kemik bankalarında muhafaza edilirler (43).
Homojen kemik greftleri (Allogreftler) immünolojik potansiyelleri sebebiyle II. dünya savaşına kadar popülarite kazanamamış, ancak savaş sırasında kemik bankalarında muhafaza edilebilmeleri için, yeni metodların geliştirilmesiyle daha sık kullanılmaya başlanmıştır. Kemik allogreftleri en çok dondurulmuş, dondurulmuş-kurutulmuş, demineralize dondurulmuş-kurutulmuş ve radyasyona tabi tutulmuş formlarında kullanılırlar. Allogreftler, osteojenik olmadığı için kemik şekillenmesi daha uzun zaman alır ve otojen kemiklerle elde edilen kemik hacminden daha az hacimde kemik meydana gelir (46-48).
Allogreftlerin, immunolojik komplikasyonlarını ve hastalık taşıma potansiyellerini ortadan kaldırmak için hazırlanmalarındaki son teknikler, dondurma, dondurup kurutma gibi metodlar ya da radyasyona tabi tutulmalarıdır. Kemik kaynaklı biyomateryallerde vericiden alıcıya geçebilecek HIV, Jakob-Creutzfeldt hastalığı (CJD) ve hepatit gibi önemli virütik hastalıklar vardır (43).
2.2.3.1.3. Heterojen Kemik Grefti (Heterogreft, Ksenogreft)
Farklı bir türde vericiden alınan greftlere "Ksenojenik greft (Ksenogreftler veya heterojen kemik greftler)" denir. Heterojen kemik greftleri çenelerdeki küçük defektleri doldurmak için önerilmiş ve birçok klinisyen bu greftlerin herhangi bir osteojenik potansiyel sağlamadıklarını, bunun yerine kemik oluşumu için matriks oluşturduklarını belirtmişlerdir. Bazı organik çözücüler ile hazırlanan ve bu sırada immünojenitesinin çoğunu kaybeden sığır kemiği, en genel heterojen greft kaynağıdır. Bu kemik, etilen diaminde 24 saat bekletilip organik komponentlerinden ayrıldıktan sonra, kalsiyum matriks sterilize edilerek greft kullanımına hazır hale getirilir. Bu şekilde hazırlanan greft, alıcıda herhangi bir immün reaksiyona sebep olmaz. Kemik düşük derecedeki sıcaklıklarda prepare edildiği için, ksenogreftler daha küçük kristaller içerir. Daha iyi bir osteointegrasyon sağladığı için bu özellik
tercih edilir. Ayrıca ksenogreftler alloplastik hidroksilapatitlerden daha fazla rezorbe olurlar. Anorganik sığır kemiği ile yapılan çalışmalarda greftin osteotomi alanlarında başarılı sonuçlar verdiği ancak, posttravmatik deformite ve hipoplastik alan düzeltmelerinde yetersiz kaldığı görülmüştür (31).
2.2.3.1.4. Alloplastlar
Otogreftlerin sınırlı miktarda elde edilmesi, allogreft ve ksenogreftlerin hastalık transfer riski gibi istenmeyen özelliklerinden dolayı, günümüzde araştırmacılar sentetik yolla üretilmiş greft materyallerine yönlenmişlerdir. Bu nedenle de birçok sentetik materyal, kemik defektlerinde kullanılmak üzere üretilmiştir. Bu konuda birçok materyalin bulunması, bu materyallerin iyi bir şekilde araştırılmasını zorunlu kılar. Alloplastlar, son yıllarda maksillofasiyal iskeletin onarımında kullanılan gerekli bir materyal haline gelmiştir (48).
İdeal bir alloplast şu özellikleri taşımalıdır:
Sitotoksik, karsinojen, irritan olmamalı, alerji yapmamalı, spesifik ve non-spesifik immün sistem mekanizmalarını harekete geçirmemeli, Mekanik basınçlarla fiziksel değişikliklere uğramamalı, kırılma ve
bükülmeye karşı dirençli olmalı,
Uygulandıktan sonra özelliklerinde ve yapısında herhangi bir değişiklik olmamalı,
Kullanımı ve depolanması kolay olmalı, Enfeksiyona dirençli olmalı,
Ucuz ve elde edilmesi kolay olmalı,
Osteokondüktif ve osteoindüktif özellikte olmalı, Minimal düzeyde fibrotik reaksiyon göstermeli, Kolayca şekillendirilmeli,
Hidrofilik yapıda olmalı ve
İmplante edildiği dokuya fiziksel olarak benzemelidir (15).
Otojen kemik greftleriyle karşılaştırıldığında, alloplastik implantların bazı avantajları göze çarpmaktadır. En göze çarpan avantajı, donör sahaya ihtiyaç duyulmamasıdır. Ek bir operasyon alanı ve ilave anestezi süresi oluşmaz. Ayrıca istenilen miktarda ve büyüklükte elde edilebilmektedirler. Alloplastların çoğu sadece
osteointegrasyon ve osteokondüksiyon özelliklerini taşımaktadır. Bazen yabancı cisim ve enflamasyon reaksiyonuna da neden olabilmektedir. Enflamasyon alanında greftin rezorbe olma ihtimali, dezavantajlarındandır (48).
Alloplastik materyallerin başarı veya başarısızlığı; kimyasal birleşimi, biostabilitesi, fiziksel formu ve mekanik özellikleri gibi birçok etkene bağlıdır. Vücutta genel olarak bulunan maddelerin, alloplastların kimyasal yapısında bulunması başarı oranını arttırır. İskelet sistemi primer olarak kalsiyum, yumuşak dokularda da hidrokarbondan oluşur. Genelde alloplastlar bu iki yapının temel taşı olan karbon ve kalsiyumdan elde edilmişlerdir. Genel olarak alloplast materyallerin elemental özellikleri kalsiyum ve karbona yaklaştıkça, uzun dönem başarısı artmaktadır (36).
2.2.4. Biyomateryallerin Klinik Uygulamaları
Deformitelerin düzeltilmesinde, ogmantasyonda dikkat edilmesi gerekli ilk konu, implante edilecek materyallerin üzerini tam ve gerilimsiz örtebilecek epitelin varlığıdır. Deformitenin yaygın, doku kayıplarının büyük olduğu durumlarda biyomateryalin uygulamasından önce, cilt ve yumuşak doku transplantasyonu gerekebilir. Eğer kemik dokusundaki defekt çok genişse mutlaka greft düşünülmeli, alıcı bölgedeki fonksiyonel stres, yük ve greft üzerine gelecek olan travma dikkate alınmalıdır. Hazırlık safhasındaki planlamada; hastanın röntgen filmleri, fotoğrafları, yüz mulajı (balmumu veya alçı ile yüz kalıbının oluşturulması) ve hatta üç boyutlu hologramı olmalıdır. Her cerrah hazırlanan plan doğrultusunda kullanacağı tekniği, biyomateryali belirlemeli ve model üzerinde uygulamalıdır. Ameliyat sırasında mümkün olduğu kadar atravmatik çalışılmalı, kullanılan materyalin defekt kontürlerine uygunluğu ve stabilizasyonu sağlanmalı, hastanın estetiği düşünülmeli, ameliyat sırasında biyomateryalde yapılacak şekillenmelerde uygun aletler kullanılmalı ve materyal keskin veya düzensiz kenarlar oluşturmayacak şekilde manüple edilmelidir. Stabilizasyon dikiş, tel ve çivilerle sağlanır.
İnsizyonun iyi kapatılması, postoperatif dönemde önemlidir. Ameliyat sonrası, uygun antibiyotiklerle hasta postoperatif bakıma alınır. Her safhasının dikkatle değerlendirilmesi, sonuçta başarıyı getirir (15).
2.3. BİFOSFONATLAR 2.3.1. Genel Bilgiler
Bifosfonatlar, pirofosfat (PPi) molekülünün sentetik analoglarıdır. Pirofosfat molekülündeki P-O-P santral yapısının yerine, santral P-C-P yapısına sahiplerdir (Şekil 6 ve 7) ve pirofosfat molekülüne göre daha stabil, osteoklastlardaki enzimatik hidrolize karşı daha dirençlidirler. Santral yapıya karbon atomu aracılığı ile bağlanan iki yan zincir yapısına (R1 ve R2) sahiptirler (49).
Şekil 6: Pirofosfatların kimyasal yapısı Şekil 7: Bifosfonatların kimyasal yapısı
Bifosfonatlar, 1990'lı yılların başında yapılan sınıflamaya göre başlıca 3 gruba ayrılmaktadır. Birinci jenerasyonu, alkil derivativleri olan etidronatın temsil ettiği grup, ikinci jenerasyonu ise alendronat ve pamidronat gibi terminal gruba sahip aminobifosfonatların temsil ettiği grup oluşturur. Üçüncü jenerasyon ise, zoledronat, risedronat, ibandronat gibi nitrojen içerikli bifosfonatlardan oluşmaktadır (50).
Bifosfonatların etki mekanizması "osteoklastlara etki ederek kemik rezorbsiyonunun azaltılması" olarak özetlenebilir. Bu bileşikler, kemik yüzeylerindeki mineral yapıya yüksek afinite gösterirler. Bu nedenle vücuda
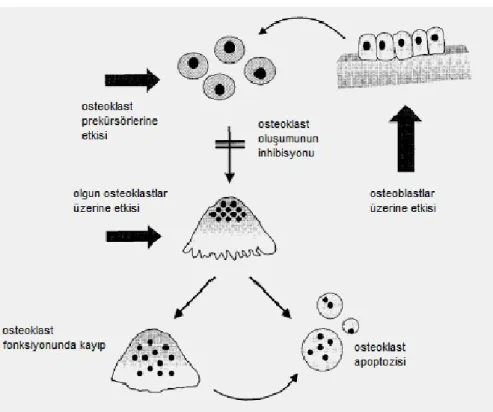
alındıklarında kemik yüzeylerine tutunurlar. Tekrarlanan dozlarda da kemik yüzeylerinde tabakalar halinde birikirler. Kemik rezorbsiyonunda rol alan hücrelerin başında gelen osteoklastlar da, kemik yüzeyine tutunduktan sonra kemiği rezorbe ederken orada bulunan bifosfonat moleküllerini de hücre içine alırlar. Hücre içine alınan bifosfonat bileşiği, bir dizi enzimatik reaksiyon sonucunda aktif osteoklastın yüzeyindeki girintili çıkıntılı yapıyı bozarak, kemik yüzeyine tutunmuş olan aktif osteoklastın buradan kopmasına ve sonuçta hücrenin fonksiyon görememesine yol açar (Şekil 8). Kemik yüzeyinden ayrılan osteoklastlar zamanla apoptoza uğrar ve kemik rezorbsiyonu engellenmiş olur (51,52).
Şekil 8: Osteoklast ve Bifosfonat etkileşimi (50)
Kemikte rezorbsiyonu inhibe ederek etki gösteren bifosfonatların, aynı zamanda antianjiojenik ve antineoplastik etkileri de bildirilmiştir (52). Yapılan çalışmalarda hem nitrojen içeren bifosfonatlar (N-BP) hem de nitrojen içermeyen bifosfonatlar (non-N-BP)' ların osteoklastlarda apoptozu indükledikleri gösterilmiştir (50). Her iki grup da apoptozu, caspase-3/caspase-3 benzeri proteolitik enzimler aracılığı ile uyarmaktadır. Uygulandıklarından sonra bifosfonatlar kemik mineral dokusuna bağlanmakta ve rezorbsiyon esnasında osteoklastlar tarafından hücre içine alınmaktadırlar. Non-N-BP'lardan olan etidronat, klodronat veya tiludronat molekülleri, esansiyel ATP-bağımlı hücre içi enzimleri inhibe ederek, hücre içi sitotoksik ATP-analoglarının birikmesine yol açmaktadırlar (51). Nitrojen-içeren BP'lar (pamidronat, risedronat, alendronat, ibandronat ve zoledronik asit) ise, mevalonat yolağını inhibe ederek, osteoklast apoptozuna yol açarlar (53,54). N-BP'lar arasında zoledronik asit, R2 yan zincirini oluşturan iki nitrojenli imidazol halkası sebebi ile FPPS (farnesyl difosfat sentaz)'ı en etkin inhibe eden moleküldür (55). Bu inhibisyon, farnesil ve geranilgeranil difosfat düzeylerinde azalmaya yol açarak, osteoklast fonksiyonu için gerekli olan GTP (Guanosine trifosfat)' azların
(Ras, Rho ve Rac gibi) prenilasyonunun bozulmasına sebep olmaktadır. Osteoklastlardaki FPPS inhibisyonu, aynı zamanda kaspaz-bağımlı apoptozu uyarmakta ve MMP (major metalloproteinaz; kemik rezorbsiyonunu başlatan ve kemik iliği tarafından salgılanan enzim) aktivitesini inhibe etmektedir (51).
2.3.2. Kullanım Alanları
Bifosfonatların ilk sentezi 1865 yılında Almanya'da gerçekleştirilmiştir (56). Tekstilde ve endüstri alanında antikoroziv ajan olarak kullanılan bifosfonatlar (57), ayrıca su yumuşatıcısı olarak yağ endüstrisinde ve sanayinin birçok alanında sıkça kullanılmaktadır (53). Metal yüzeylerde kullanımı:
Alüminyum, demir, bakır ve alaşımlarını korozyondan korumada,
Cilanın daha etkili olması için alüminyumun ön işleme tabi tutulmasında, Metal yüzeyleri galvanik etkileşime karşı korumak için, ön işleme tabi
tutulmasında kullanılmaktadır (55,58).
Kristal yüzeylerde kullanımı ise, kireç taşı oluşumunun önlenmesi amacını taşır. Ayrıca cam eşyaların temizlenmesinde ve maddelerin su geçirmez hale getirilmesinde de bifosfonatlar kullanılmaktadır. Çözeltilerde kullanımı:
Yüzey aktif maddelerde,
Suyun sertliğini azaltan maddelerde, Tekstil boyalarında,
Pamuğun yumuşatılmasında, Sentetik deterjanlarda ve
Sabun çözeltilerinde kullanılmaktadır.
Sentetik madde endüstrisinde, yapay gübre komponentlerinde ve üretim aşamasında istenmeyen çökelmenin önlenmesi amaçlarıyla kullanım alanı bulan bifosfonatlar; polimer endüstrisinde ise stabilizatör, yapıştırıcı ve reçine olarak da kullanılmaktadır. Günlük yaşamda ise kozmetikte ve fotoğrafçılıkta kullanılan bu bileşikler, gıda sanayisinde besin maddelerinin pastörize/sterilize edilmesinde; inşaat sanayisinde ise izolasyon materyallerinde ve beton ile seramiklerde inceltici olarak kullanılmaktadır. Görüldüğü üzere çok geniş bir spektrumda kullanılabilen bifosfonatlar, yangın söndürücülerde bile kullanım alanı bulmaktadır (59).
Bifosfonatlar, kemik rezorbsiyon inhibitörleri olarak kullanılmaya başlanmadan önce, ilk olarak kalsifikasyon inhibitörleri olarak keşfedilmiştir. Bu konuda yapılan ilk çalışmalar bifosfonatların, pirofosfatlar gibi hidroksilapatit kristallerine bağlandığını ve kristal gelişimini inhibe ettiğini göstermiştir (53). Bifosfonatlar, fizyolojik dozlarda verildiğinde, kemiğe yüksek afiniteleri nedeniyle kemik matriksine kolaylıkla bağlanırlar (60). Osteoklastik aktivitenin potansiyel inhibitörleridir. Kemik metabolizmasına, osteoklastların hem aktivitesini hem de sayısını azaltarak etki etmektedirler. Bifosfonatların kemikteki etkileri doku düzeyinde, hücresel ve moleküler düzeylerde incelenebilir (61).
Moleküler düzeyde, alkil zincirlerindeki nitrojen atomu, osteoklastlar üzerinde toksik etki yaratır veya osteoklastlardaki spesifik hücre içi mekanizmalara zarar verir (62). Klodronat ve etidronat gibi nitrojen içermeyen bifosfonatlar, osteoklastlar tarafından metabolize edilerek, nonhidrolize ATP analoglarına dönüşür. Sitotoksik olan bu metabolitlerin hücre içinde birikimi sonucunda, osteoklast fonksiyonu inhibe edilir ve osteoklast apoptozisi gerçekleşir (57).
Pamidronat, alendronat ve risedronat gibi nitrojen içeren bifosfonatlar ise, nitrojen içermeyen bifosfonatların aksine metabolize edilemez. Bu grup bifosfonatlar kolesterol, izopentenildifosfat, farnesildifosfat (FPP) ve geranildifosfat (GGPP) gibi izoprenoid lipidlerin sentezinden sorumlu olan, dolayısıyla osteoklast fonksiyonunda önemli olan mevalonat mekanizmasını inhibe ederek etki gösterirler (63). FPP ve GGPP, osteoklast fonksiyonundaki düzenleyici proteinler olan Ras, Rho ve Rac gibi proteinlerin (guanosine triphosphate-binding proteins) prenilasyonu için gerekmektedir. Nitrojen içeren bifosfonatların mevalonat mekanizmasındaki inhibisyonu sonucu hücre proliferasyonu, hayatta kalma süresi ve iskeletsel organizasyondan sorumlu olan bu sinyal moleküllerin prenilasyonu gerçekleşemediğinden, osteoklast fonksiyonu engellenmekte ve osteoklastların apoptozu meydana gelmektedir (63).
Bifosfonatlar başlıca, kemik metastazlarının önlenmesi ve tedavisinde (64-66), orta ve şiddetli malign hastalıklara bağlı artmış kan kalsiyum seviyesinin düzenlenmesinde (65-67), kemik kanserlerinde ağrının azaltılmasında (60, 65, 68), multipl myeloma olgularında (60, 66), Paget hastalığı ile osteoporözün tedavisinde kullanılmaktadır (60, 65, 66, 69).
Osteoklastlarda apoptoza yol açan bifosfonatların tümör hücreleri üzerine de direkt apoptotik etkileri bulunmaktadır. Oral klodronat, intravenöz pamidronat ve zoledronik asit, kemik metastazlarında sıklıkla kullanılan bifosfonatlardır (70). Klinik kullanımda en etkin bifosfonat olan zoledronik asitin, metastatik meme kanseri, multipl myeloma, maligniteye bağlı hiperkalsemi, Paget hastalığı ve solid tümörlerin kemik metastazlarında etkinliği kanıtlanmıştır. Pamidronat ile karşılaştırıldığında, maligniteye bağlı hiperkalsemi ve iskeletsel komplikasyonların azaltılmasında da zoledronik asitin daha etkin olduğu saptanmıştır (71).
Şekil 9. Bifosfonatların kemik rezorbsiyonunu inhibe etme yolları (53)
Paget hastalığı, bisfosfonatların kullanımıyla, doza bağımlı olarak kemik rezorbsiyonunun inhibe edilebildiği ilk klinik hastalıktır. Paget hastalığının patogenezi kısaca, artan osteoklast sayısı ve aktivitesi olarak açıklanabilir. Tedavisinde önce etidronat kullanılmış, daha sonraları da endikasyonu sadece Paget hastalığı ile sınırlı olan tiludronat kullanılmaya başlanmıştır. Uzun yıllar boyunca intravenöz olarak pamidronat da etkin bir şekilde kullanıldıysa da, son yıllarda daha uzun etki süreli zoledronat bu bileşik yerine daha çok tercih edilir hale gelmiştir (72). Osteoporöz, özellikle post-menopozal dönemdeki kadınlarda karşılaşılan önemli bir problemdir. Bifosfonatların klinik uygulamalarıyla, son 15 yılda
osteoporöz tedavisinde oral bifosfonat kullanımında hızlı bir gelişim olmuştur. Alendronat, risedronat, etidronat, ve ibandronat birçok ülkede post-menopozal osteoporöz tedavisinde anti-rezorbtif özellikleri nedeniyle sık kullanılan bifosfonatlar olarak bildirilmiştir (51, 52). Oral bifosfonatlar tedavide genellikle günlük dozlar şeklinde uygulanmaktadır. Bununla birlikte, alendronat ve risedronat gibi bifosfonatların haftalık doz uygulamaları da geliştirilmiştir. Günümüzde en sık olarak kullanılan bifosfonat çeşitleri ve kullanım alanlarını kısaca özetlemek gerekirse:
Etidronat, kemik yaralanmalarından sonra oluşan hipertrofik kalsifikasyonların tedavisinde ve Paget hastalığı tedavisinde oral yolla kullanılan ve nitrojen içermeyen bir bifosfonattır. Sınıfının etki gücü en az olan bifosfonat çeşididir (73).
Alendronat, oral yolla alınan ve osteoporöz ile osteopenide en sık tercih edilen nitrojen içerikli bifosfonattır. Yarılanma ömrü 10 yıldan uzundur (73).
Risedronat, azot içerikli diğer bir bifosfonattır. Alendronattan sonra osteoporöz ve osteopenide en sık kullanılan ikinci bifosfonattır. Yarılanma ömrü de, alendronat gibi 10 yıldan uzundur (73).
İbandronat, nitrojen içerikli bir bifosfonattır ve yarılanma ömrü 10 yıldan uzundur, osteoporöz için alınan diğer ilaçların aksine ayda bir kez 150 mg dozunda ya da 2,5 mg'lık günlük dozlar halinde kullanılabilmektedir (73).
Pamidronat; multipl myelom, metastatik meme kanseri, metastatik prostat kanseri, maligniteye bağlı hiperkalsemi olgularında kullanılır, 3-4 haftada bir, 90 mg dozunda infüzyonla verilir (74).
Zolendronat, günümüzde bilinen en güçlü bifosfonattır. 3-4 haftada 1 defa 15 dakikalık infüzyon şeklinde 4 mg olarak uygulanır. Pamidronat 90 mg ve zoledronat 4 mg dozlarının, etidronattan 10.000 kat daha etkili olduğu bulunmuştur (73). Yarılanma ömrü pamidronat gibi 10 yıldan fazla, hatta ömür boyudur (74).
Tablo-1'de günümüzde en sık kullanılan bifosfonatlara ait bilgiler özetlenmiştir: