T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
ÇOCUK SAĞLIĞI VE HASTALIKLARI ANABİLİM DALI
PROF. DR. R. KAAN KAVAKLI
DİREKT ANTİGLOBULİN TESTİN FETÜS VE
YENİDOĞANIN HEMOLİTİK HASTALIĞINI TANIMLAMA
VE ŞİDDETİNİ TAHMİNDE KLİNİK DEĞERİ
UZMANLIK TEZİ
Dr. Mehmet ATEŞ
Tez Danışmanı Prof. Dr. Yeşim AYDINOK
ii ÖNSÖZ VE TEŞEKKÜR
Uzmanlık eğitimim boyunca bilgi ve deneyimleri ile eğitimime katkıda bulunan, başta kliniğimiz Anabilim Dalı Başkanı Prof. Dr. Kaan KAVAKLI olmak üzere, tüm Çocuk Sağlığı ve Hastalıkları Öğretim Üyelerine,
Akademik anlamda örnek temsil eden, tez sürecinde kendisinden bilimsel ve hayata dair çok şey öğrendiğim Prof. Dr. Yeşim AYDINOK’a sabrı ve özverisi için,
Yardımlarını ve desteklerini esirgemeyen EÜTF Kan Merkezi Çalışanlarına,
Eğitimim boyunca, ekip olarak Çocukların sağlığı uğruna canla başla Çalışan tüm Çocuk Sağlığı ve Hastalıkları Ana Bilim Dalı uzman, asistan, hemşire ve personel ekibine,
Çalışma hayatında birlikte olduğum, desteklerini hiçbir zaman benden esirgemeyen sevgili eşkıdemlerime,
İyi bir insan ve doktor olmam için ellerinden gelen desteği ve özveriyi veren sevgili annem Cahide ve babam Murat’a,
Bir insanın sahip olabileceği en mükemmel dost olan kardeşim Ümmühan’a ve eşi Ahmet Emre ile hayatımızın neşe kaynağı olan yeğenim Aras’a,
Bilim dünyasına duyduğu ilgisine hayran olduğum ve örnek aldığım, bilgi birikimini benimle paylaşarak öğrenimime katkı sağlayan, desteğini her zaman yanımda hissettiğim, yol arkdaşım, sevgili eşim Dr. Şebnem Uysal Ateş’e teşekkürlerimi sunarım.
Dr. Mehmet ATEŞ İZMİR, 2019
iii İÇİNDEKİLER ÖZET ... v ABSTRACT ... vii TABLOLAR LİSTESİ ... ix ŞEKİLLER LİSTESİ ... x KISALTMALAR LİSTESİ ... xi 1. GİRİŞ ve AMAÇ ... 1 2.GENEL BİLGİLER ... 2
2.1.Direkt Antiglobulin Testinin Tanımı ... 2
2.2.Fetus Ve Yenidoğanın Hemolitik Hastalığının Tanımı ... 4
2.2.1. FYHH Epidemiyolojisi ve Tarihçesi ... 4
2.2.2.FYHH Patofizyolojisi ... 5
2.2.3.FYHH Farklı Eritrosit Alloantikorlarının Özellikleri ... 7
2.3.FYHH Klinik Bulguları ... 9
2.3.1.Anemi ... 9
2.3.2. Sarılık ... 9
2.3.3. Hepatosplenomegali ... 10
2.3.4. Peteşi ... 10
2.3.5. Hidrops Fetalis ... 10
2.4.FYHH Tanı Yöntemleri ... 10
2.4.1.Prenatal Tanı Yöntemleri ... 11
2.4.2.Postnatal Tanı Yöntemleri ... 11
2.5.FYHH Korunma ve Tedavi Yöntemleri ... 14
2.5.1.Antenatal Korunma ve İmmunoprofilaksi ... 14
2.5.2.Prenatal Tedavi ve Yönetim ... 15
2.5.3.Postnatal Tedavi ve Yönetim ... 16
iv
2.5.3.2.Fototerapi ... 17
2.5.3.3.Sıvı Desteği / Hidrasyon ... 19
2.5.3.4. Kan Değişim Transfüzyonu ... 19
2.5.3.5. İntravenöz İmmünoglobulin ... 20
2.5.3.6.Antenatal Kortikosteroidler ... 20
2.6.FYHH Uzun Dönem İzlem ... 21
3. GEREÇ VE YÖNTEMLER ... 22
3.1. Çalışmaya Alınma Kriterleri ... 22
3.2. Çalışma Dışı Bırakılma Kriterleri ... 22
3.3. Hastaların Değerlendirilmesi ... 22
3.4.İstatistiksel Yöntemler ... 23
4. BULGULAR ... 24
4.1.Yendioğanlara Ait Demografik Özellikler ... 24
4.2.ABO ve ABO Dışı FYHH Olgularının Değerlendirilmesi ... 26
4.3.FYHH’nin Önlenmesinde ve Tanısında Gebelik/Fetus İzlem Algoritmalarının Uygunluğunun Değerlendirilmesi 4.4. Perinatal DAT Pozitifliği İle FYHH İlişkisinin Değerlendirilmesi ... 33
4.5.Perinatal FYHH’nın Tanısında ve Yönetiminde Laboratuvar Algoritmalarının Değerlendirilmesi ... 36
5. TARTIŞMA ... 38
6. SONUÇ ... 43
7. KAYNAKLAR ... 45
EKLER Ek 1. Etik Kurul Onayı ... 56
Ek 2. Bilgilendirilmiş Olur Formu ... 59
v ÖZET
Fetus ve Yenidoğanın Hemolitik Hastalığı (FYHH) son yıllarda sıklığında azalma olmakla beraber yüksek mortalite oranları ve uzun dönem morbiditesi nedeniyle önemini halen korumaktadır.
Amaç: Bu çalışma ile Ege Üniversitesi Tıp Fakültesi Hastanesinde (EÜTFH) doğan bebeklerde, ABO ve ABO dışı FYHH sıklığını saptamayı ve Direkt Antiglobulin Test (DAT) pozitifliğinin FYHH’nı ve şiddetini öngörmedeki değerini incelemeyi ve FYHH tanısındaki diğer immun-hematolojik test algoritmalarını gözden geçirmeyi planladık.
Gereç ve Yöntem: EÜTFH’de 1 Ocak 2018 – 31 Aralık 2018 tarihleri arasında doğan ve kan merkezimize DAT çalışılmak üzere kan örneği gönderilmiş olan 1737 yenidoğan ve anneleri çalışmaya dahil edildi. Perinatal döneme ait ABO, Rh(D) kan grubu, DAT sonucu, hastaneye yatış durumu, fototerapi gereksinimi, bilirubin ve hematokrit seviyeleri, intrauterin hastalık durumu, intrauterin gelişme geriliği (İUGG), antikor tarama ve antikor tanımlama çalışmaları kayıt altına alındı. Yenidoğanların annelerine ait gestasyon haftası, önceki gebelikler, Rh(D) ve ABO kan grubu, indirekt antiglobulin test (İAT), antikor tarama sonuçları, gereklilik halinde yapılan İAT titrasyonu ve antikor tanımlama özelikleri incelendi. Rh D negatif annelere yapılan anti D immunglobulin ile FYHH ilişkisi incelendi. Bu bilgilere KHD (Kadın Hastalıkları ve Doğum Anabilim Dalı) hastaneye yatış dosyaları, Yenidoğan Bilim Dalı hastaneye yatış epikrizleri ve doğum kayıt dosyalarından ulaşıldı.
Bulgular: Çalışmaya alınan 1737 yenidoğanın 95 (%5,4)’inde DAT pozitif saptanırken bu grupta fototerapi alma oranları, fototerapi süresi, maksimum bilirubin ortalaması, İUGG varlığı istatistiksel olarak anlamlı derecede yüksek saptandı. ABO uygunsuzluğu olan grupta fototerapi alma oranı, ABO uygunsuzluğu olmayan gruba göre istatistiksel olarak anlamlı yüksek iken (p=0,018), Rh(D) uygunsuzluğu olan ve olmayan yenidoğanlar arasında fototerapi alma oranı açısından istatistiksel anlamlı bir fark yoktu. Gebelerin 820 (%47,2)’sine antikor tarama yapılmış ve 50’inde (%60) pozitif saptanmıştı. Antikor taraması pozitif olan bu gebelerin 43’üne (%86) antikor tanımlama yapılmıştı. En sık D (%69)’ ye karşı antikor mevcut olup bunu %11 ile Kell’e karşı antikor varlığı izlemekteydi. RhD ilişkili FYHH önlenmesinde en etkin yol olan Rh(D) immunglobulin uygulamasının 172 gebeden 104’üne (%60,5) yapıldığı, yapılmayan 68 gebeden de 52’sine yapılmama nedeninin bebeğin Rh(D) negatif saptanması olduğu belirlendi. DAT pozitif saptanan 95 bebeğin sadece bir tanesinde antikor tarama yapıldığı belirlendi. DAT pozitifliği bulunmayan 31 yenidoğana antikor tarama yapılmış olup bunlardan hiçbiri fototerapi almamıştı.
vi DAT pozitif olguların fototerapi alma oranı (%9.4), DAT negatif olgulara (%1.8) göre anlamlı olarak yüksek bulundu. DAT<2 pozitif olan hiçbir yenidoğan fototerapi almamıştı. Buna karşın DAT ≥2+ olan ve fototerapi alan 9 hastanın 8’i ABO uygunsuzluğu olan yenidoğanlardı. Rh D uygunsuzluğu bulunan 116 yenidoğanın sadece 20’inde zayıf DAT pozitifliği (<2+) mevcuttu ve hiçbirinin fototerapi gereksinimi olmamıştı.
Sonuç: Zayıf (<2+) DAT pozitifliğinin olgu grubumuzda hemoliz ile ilişkili klinik bir anlam taşımadığı görüldü. Anlamlı DAT ≥2+ pozitifliğine klinik hemolizin eşlik etme olasılığı da güçlü değildi. Yenidoğanlarda DAT pozitifliğinin ve DAT negatif ancak fototerapi gereksinimi olan bebeklerin immun hemoliz açısından incelenmesinde uygun immun-hematolojik algoritmin izlenmediği görüldü. Buna karşın, allo-immunizasyon gelişiminin izlemi ve yönetimi bakımından maternal izlem yeterli ve uygun bulundu.
vii ABSTRACT
Hemolytic disease of fetus and newborn (HDFN) is still important because of its high mortality and long-term morbidity although its incidence has been decreasing in recent years.
Aim: In this study, we aimed to determine the incidence of ABO and non-ABO HDN (Hemolytic disease of newborn) and to investigate the value of Direct Antiglobulin Test (DAT) positivity in detecting FHM (Hemolytic disease of fetus). Since prenatal treatment options are available, immunohematological tests and algorithms have been developed to identify HDFN during pregnancy. We aimed to review the algorithms that have been developed to prevent alloimmunization and to ensure proper management if developed. We purposed to investigate the use of immunohematological laboratory tests in detection and management of perinatal HDFN.
Materials and Methods: 1737 newborns who were born in Ege University Medical School Hospital between January 1, 2018 and December 31, 2018 and whose blood samples were sent to our blood center to study DAT and their mothers are included. ABO, Rh blood group, DAT result, hospitalization, phototherapy requirement, bilirubin and hematocrit levels, intrauterine disease status, presence of IUGR, antibody screening and antibody identification studies of were recorded to detect the presence of perinatal HDFN. Gestational week, gravida, Rh and ABO blood group, indirect antiglobulin (IAT), antibody screening results, IAT titration and antibody identification performed if needed of the pregnant women are recorded. The relationship between HDFN and anti-D immunoglobulin administered to Rh D negative mothers was examined. This information was obtained from Department of Obstetrics and Gynecology hospitalization files, hospitalization epicrisis of the Newborn Department and birth registry files.
The rate of phototherapy (9.4%) in DAT positive cases was significantly higher than in DAT negative cases (1.8%). No newborn phototherapy with DAT <2 was positive. In contrast, 8 of 9 patients with DAT ≥2 + who received phototherapy were newborns with ABO incompatibility. Only 20 out of 116 newborns with Rh D incompatibility had weak DAT positivity (<2+) and none required phototherapy.
Results: 95(5.4%) of 1737 newborns in this study was detected DAT positive and phototherapy receiving rates, duration of phototherapy, mean maximum bilirubin and IUGR presence in this group was statistically significantly higher. While the rate of receiving phototherapy was statistically significant in the ABO incompatibility group (p = 0.018), there was no statistically significant difference in the rate of receiving phototherapy in newborns with Rh D incompatibility. Antibody screening was performed in 820 (47.2%) of the pregnant
viii women and 50 of them were positive. Antibodies were identified in 43 (86%) of these pregnant women with positive antibody screening. Antibodies against D (69%) were the most common, followed by the presence of antibodies against Kell 11%. Rh D immunoglobulin, which is the most effective way to prevent HDFN, was performed to 104 (60.5%) of 172 pregnant women and not in 52 of 68 pregnant women because newborn was Rh D negative. Only one of the 95 DAT positive patients had antibody screening. A total of 31 newborns underwent antibody screening and none of them received phototherapy.
Conclusion: Weak (<+2) DAT positivity was not found to have a clinical significance associated with hemolysis in our case group. The possibility of clinical hemolysis to be associated with significant DAT ≥+2 positivity was also not strong. In neonates, DAT positivity and DAT negative infants who needed phototherapy were not examined for immune hemolysis. On the other hand, maternal follow-up was adequate and appropriate for monitoring and management of allo-immunization development.
ix TABLOLAR LİSTESİ
Tablo 1. Demografik Verilerin Dağılımı ve DAT ile İlişkisi ... 25
Tablo 2. ABO Uygunsuzluğu Olan Grupta DAT ve Fototerapi ilişkisi ... 26
Tablo 3. Rh D Uygunsuzluğu Olan Grupta DAT ve Fototerapi ilişkisi ... 27
Tablo 4. Rh D Uygunsuzluğu Olmayan Grupta DAT ve Fototerapi ilişkisi ... 27
Tablo 5. Annelere Ait Gebelik Özellikleri ve DAT ile ilişkisi ... 28
Tablo 6. Annelere Ait Demografik Veriler ve DAT ile ilişkisi ... 29
Tablo 7. Rh D Negatif Annelere Anti-D Uygulanma ve Antikor Tarama Sıklığı ... 31
Tablo 8. Billirubin ve Hematokrit Değerleri, Fototerapi Süresi ile DAT ilişkisi ... 35
x ŞEKİLLER LİSTESİ
Şekil 1. DAT ... 2
Şekil 2. DAT Yöntemleri ... 3
Şekil 3. FYHH’nin Patogenezi ... 5
Şekil 4. FYHH’e Yol Açan Maternal Alloimmünizasyon Hastalık Modeli, Laboratuvar Testleri ve Yüksek Riskli Vakaların Saptanması ... 6
Şekil 5. Eritrosit Antikor Spesifitesine FYHH İndükleme Riski Açısından Genel Bir Bakış ... 8
Şekil 6. RADDP Uygulamasında Anahtar Noktalar ... 15
Şekil 7. Fetusa Ait İntrauterin Patolojiler ... 26
Şekil 8. Antikor Tanımlama Yapılan Annelerin Sonuçlarının Dağılımı ... 30
Şekil 9. Gebelikte Eşlik Eden Hastalıkların Dağılımı ... 32
Şekil 10. Gebelikte İlaç Kullanımı ... 33
xi KISALTMALAR LİSTESİ
FYHH : Fetus ve Yenidoğanın Hemolitik Hastalığı DAT : Direkt Antiglobulin testi
İAT : İndirekt Antiglobulin Testi GTT : Geleneksel tüp testi
AHG : Anti-Human Globulin
G6PD : Glukoz-6-Fosfat Dehidrogenaz FMK : Fetomaternal Kanama
USG : Ultrasonografi
IUT : İntrauterin transfüzyon IUGG : İntrauterin Gelişme Geriliği
MCA-PSV : Orta Serebral Arter Pik Sistolik hız RADDP : Rutin Antenatal Anti Rh-D proflaksisi
BIND : Billirubin ile indüklenen Nörolojik Fonksiyon Bozukluğu AAP : American Pediatri Akademisi
LED : Işık Yayan Diyot
IVIG : İntravenöz İmmunoglobulin NEK : Nekrotizan Enterokolit
1 1. GİRİŞ ve AMAÇ
Maternal alloimmunizasyon, transfüzyonlar veya önceki gebelikler sırasında annenin kendi eritrositlerinde bulunmayan eritrosit antijenleri ile karşılaşmış olmasının sonucu olarak gelişir. Annenin alloimmunize olduğu eritrosit antijeninin, baba kaynaklı olarak, fetal eritrositlerin yüzeyinde bulunuyor olması, fetal yaşamda ve/veya doğumdan sonra bebek eritrositlerinin yıkımına neden olarak fetüs ve yenidoğanın hemolitik hastalığının (FYHH) gelişmesine neden olur (1,2).
O grubu annenin A ve B antijenlerine karşı doğal olarak plazmalarında bulunan isoaglütininleri ve 50’den fazla ABO-dışı eritrosit antijenlerine karşı alloantikorlar FYHH’dan sorumludur. FYHH’dan sorumlu alloantikorlar en sıklıkla Rh, Kell, Duffy, Kidd, and MNS sistemine aittirler. Şiddetli YDHH’nın dünyadaki en sık nedeni Rh kan grup sistemi antijenlerine karşı gelişen alloantikorlar olmakla beraber, özellikle anti-Rh(D) immunglobulinin (RhIg) immunprofilaksi amacıyla yaygın olarak kullanıldığı coğrafyalarda ise Kell antijenine yönelik alloimmunizasyon ön plana çıkmaktadır (3–5).
Maternal alloimmunizasyon hem gebelik sürecinin yönetiminde ve hem de postnatal dönemde yenidoğanın yönetiminde hekimler için güçlüğünü korumaktadır. Son 50 yılda, RhIg profilaksisi, RhD alloimmunizasyon ve bununla ilişkili fetal morbidite ve mortaliteyi dünya genelinde sadece %50 kadar azaltabilmiş olup her yıl 160.000 perinatal ölüm ve 100.000 sekelin sorumlusu olmayı sürdürmektedir (6).
Bu çalışmanın amacı, üçüncü basamak bir referans merkez olan Ege Üniversitesi Tıp Fakültesi Hastanesinde;
1. Bir yıl süresince doğan bebeklerin ABO ve ABO dışı FYHH görülme sıklığını incelemek 2. Perinatal DAT pozitifliğinin FYHH’nı öngörmedeki değerini ortaya koymak
3. Gebelik/fetüs izleminde, alloimmunizasyon gelişiminin önlenmesi, izlenmesi ve yönetimi bakımından immun hematolojik test algoritmalarının uygunluğu ve yeterliliğini gözden geçirmek
4. Perinatal FYHH’nın değerlendirilmesi ve yönetiminde immunhematoloji laboratuvarının kullanılma algoritmalarını irdelemektir.
2 2.GENEL BİLGİLER
2.1.Direkt Antiglobulin Testinin Tanımı
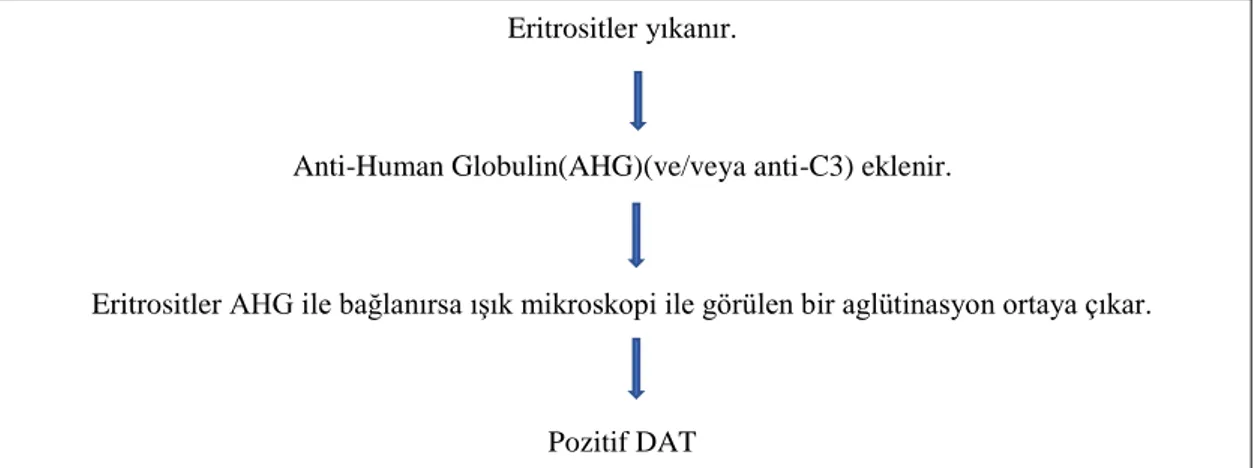
DAT, eritrosit membranına bağlı immünglobulin, kompleman veya her ikisinin varlığını tespit eder (7). Tarihsel olarak "Coombs testi" olarak adlandırılan test ilk kez 1945 yılında Cambridge immünoloji uzmanı Robin Coombs tarafından tanımlanmıştır (8,9). Coombs, Mourant ve Race, 1945 yılında aglütine edici olmayan eritrosit antikorlarını (dolaylı antiglobulin testi (IAT) veya "antikor ekranı") veya duyarlanmış eritrositleri (doğrudan antiglobulin testi) tespit etmek için antiglobulin testini geliştirdiler (10). Bir hastadan veya kan vericisinden yıkanmış eritrositler, anti-human globulin (AHG) ve anti-kompleman (anti-C3d) ile karıştırılır, daha sonra santrifüj edilir ve aglütinasyon için gözlenir. Pozitif bir DAT, eritrositlerin IgG ve / veya kompleman bileşenleri ile in vivo duyarlılığını ve yenidoğan eritrositlerinde maternal IgG varlığını gösterir. Maternal serum, fetal eritrosit antijenine karşı bir IgG sınıfı immünglobulin içeriyorsa, bu antikorun transplasental geçişi, eritrositin antikor ile kaplanması ve pozitif bir yenidoğan DAT'ı ile sonuçlanacaktır (10).
Dikkat edilmesi gereken önemli bir nokta, pozitif bir DAT'ın hemolizin kesin kanıtı olmadığıdır. DAT, IgG'ye karşı antikorları ve tamamlayıcının C3d bileşenini içeren polispesifik antiglobulin reaktifi ile gerçekleştirilir (Şekil 1). Kordon kanı veya doğrudan yenidoğandan alınan bir numune, monospesifik anti-IgG reaktifiyle test edilir, çünkü yenidoğan bebekte beklenen tek eritrosite bağlanan proteindir. Yenidoğan eritrositlerini duyarlaştıran protein maternal IgG olduğundan, kompleman proteinleri ile test yapılması şüpheli FYHH'de gerekli değildir (10).
Şekil 1: DAT Eritrositler yıkanır.
Anti-Human Globulin(AHG)(ve/veya anti-C3) eklenir.
Eritrositler AHG ile bağlanırsa ışık mikroskopi ile görülen bir aglütinasyon ortaya çıkar.
3 Geleneksel test tüpü (GTT) yöntemi ve daha hassas jel teknolojisi yöntemi olmak üzere DAT için çeşitli yöntemler mevcuttur (Şekil 2). GTT yönteminde, immunglobulin ve komplemanı ortamdan uzaklaştırmak için hastanın eritrositleri salinle yıkanır, AHG eklenir ve eritrosit süspansiyonu santrifüjlenir. Eritrosit pelleti hafifçe vurarak yerinden çıkarılır ve aglütinasyon için incelenir (9). 0 (aglütinasyon yok) ile 4 arasında aglütinasyona işaret eden bir ölçekte derecelendirilir. Jel mikrokolon yönteminde, eritrositler AHG reaktifleri ile karıştırılmış jelatinimsi bir matriks içinden süzülür. Jel, aglütine edilmiş eritrositleri hapseder ve aglütine edilmemiş eritrositler kolondan geçer (9).
a b
Şekil 2: (a) Tüp Yöntemi, (b) Jel Teknolojisi Yöntemi (11)
DAT için EDTA’lı tüpe alınmış örnek kullanılır. EDTA, C1 aktivasyonu için ihtiyaç duyulan kalsiyumu şelatlayarak tamamlayıcı maddenin in vitro fiksasyonunu önler. Pıhtılaşmış bir örnek kullanılırsa, tamamlayıcı maddenin eritrositlere in vitro spesifik olarak bağlanmaması nedeniyle yanlış pozitif sonuç elde edilebilir. Test için kordon kanı kullanırken, Wharton jölesiyle kontaminasyon, spesifik olmayan aglütinasyona ve yanlış pozitif sonuçlara neden olabilir (12,13).
DAT, yenidoğanda anemi ve hiperbilirubinemi varlığında, retikülosit ve laktat dehidrogenaz yüksekliğinde, FYHH düşünülen durumlarda, otoimmün hemolitik anemide, ilaca bağlı eritrosit sensitizasyonu veya transfüzyon ilişkili hemoliz varlığında bakılabilir (2,14–16).
4 DAT’ın birtakım kısıtlamaları bulunmaktadır. Tarama ile pozitif DAT saptanan yenidoğanların yalnızca %23'ünde hiperbilirubinemi geliştiğini bildiren bazı yayınlar mevcuttur. Bu çalışmalara göre ABO uygunsuzluğundaki FYHH için kötü bir öngörü değerine sahiptir (11). Pozitif DAT ABO HH’yi ispat etmezken, negatif DAT sonucu da ABO HH’yi ekarte ettirmez. Ayrıca negatif DAT, klinik olarak anlamlı düzeyde bir hiperbilirubineminin altında yatabilecek non-immün hemolitik etiyolojileri dışlatmaz. Bu durumda ayırıcı tanıda; G6PD eksikliği, sepsis, herediter sferositoz ve özellikle anlamlı hiperbilirubinemisi olan bir yenidoğanda piruvat kinaz eksikliği düşünülmelidir. Önemli derecede sarılık ve hiperbilirubinemisi olan ABO HH ile uyumlu DAT negatif yenidoğanlarda izoimmünizasyon dışında bir neden araştırılmalıdır (14,15,17).
2.2.Fetus Ve Yenidoğanın Hemolitik Hastalığının Tanımı
FYHH, tedavi edilmez ise perinatal mortalite ve morbiditeye yol açabilen, uzun dönemde sekellerle sonuçlanabilen bir hastalıktır (18). FYHH, plasenta aracılığıyla geçen ve ilgili antijeni taşıyan fetal eritrositleri harap eden IgG alloantikorlarından kaynaklanır. Hastaların büyük bir kısmında RhD antijenine karşı alloimmünizasyon bulunur. Anti-D immunglobulin proflaksisinin başlangıcı ile D antikorlarının ve Anti-D aracılı FYHH’nin prevelansı dramatik olarak azalmıştır (19,20). Ciddi hastalık gelişme riski düşük olmasına rağmen Anti-D uygulanmayan gebeliklerde eritrosit antikorlarının FYHH’ye yol açma potansiyeli yaklaşık 1/500 gebelik olarak belirtilmektedir (21–23).
2.2.1. FYHH Epidemiyolojisi Ve Tarihçesi
FYHH ilk olarak 1609 yılında Fransız bir ebe tarafından ikiz bebeklerde tanımlanmıştır. İkizlerden birisi ödemle doğup doğum sonrası hızla kaybedilmiş, diğer bebekse sarılık geliştirmiş ve günler sonra kaybedilmiştir. 1950’li yıllara kadar FYHH’nın altta yatan nedeni açıklanamamıştır (24). Amerika’da FYHH sıklığının 3/100.000-80/100.000 vaka/yıl olduğu tahmin edilmektedir (2). Eritrosit sensitizasyonu prevalansını araştıran çok sayıda çalışma bulunmaktadır. 22,102 kadını içeren geniş serili bir çalışmada kadınların %1.15’inin (254 kadın) eritrosit alloantikorlarına sahip olduğu belirlenmiştir. Bunların %18’i birden fazla alloantikora sahiptir (2).
5 2.2.2.FYHH Patofizyolojisi
Maternal alloimmünizasyon, önceki uygunsuz kan transfüzyonları ve önceki ya da mevcut hamilelikteki fetomaternal kanama (FMK) ile tetiklenebilir. Yalnızca IgG sınıfı antikorlar aktif olarak plasenta aracılığıyla taşınır.
Şekil 3: FYHH’nın Patogenezi (2)
Fetus ilgili eritrosit antijeni bakımından pozitifse, fetal eritrositler maternal alloantikorlar ile bağlanır. Fetal eritrositlerin antikorlar ile bağlanması, dalakta eritrosit yıkımına neden olup anemi ile sonuçlanabilir (Şekil 3) (2,4,14,15,17). Fetal anemi sonucunda eritropoez indüklenir, ancak bu, anemiyi düzeltmek için yetersiz kalabilir. Kell sisteminin antijenlerine ve ayrıca MNSs sistemine karşı oluşan eritrosit alloantikorları, eritroblast artışı olmaksızın fetal eritrositlerin ve eritroid progenitör hücrelerin yıkımına ve erken aneminin ortaya çıkmasına neden olur (14,25). Aneminin kompanzasyonu sırasında, fetal deride ve
6 seröz boşluklarda sıvı toplanması şeklinde prezente olan, fetusta kardiyomegaliye ve sonunda fetal hidropsa yol açan hiperdinamik dolaşım ortaya çıkar.
Fetal eritrositlerin hemolizi, bilirubin seviyelerinin yükselmesine neden olur. Bilirubin, hamilelik boyunca plasenta ve maternal dolaşım yoluyla elimine edilir. Doğumdan sonra, hemolitik süreç devam eder; ancak yenidoğanın nispeten olgunlaşmamış karaciğeri, fazla miktardaki bu bilirubini konjuge edemez. Bu, şiddetli hiperbilirubinemiye ve tedavi edilmediği takdirde merkezi sinir sistemine geri dönüşümsüz zarar veren kernikterusa neden olabilir. Kernikterus, bazal gangliyonlarda ve beyin sapı çekirdeğinde bilirubin birikimi ile karakterize olup şiddetli atetoid serebral palsi, işitme problemleri ve psikomotor gerilik gibi uzun süreli morbidite ile ilişkilidir. Gebelikte eritrosit alloantikorların varlığı saptanmadığı takdirde, FYHH'nin hamilelik sırasındaki spesifik olmayan ve öngörülemeyen klinik özellikleri; fetal hareketlerin azalması veya ani ölüm olabilir. Doğum sonrası ise erken dönemde yenidoğan sarılığı ortaya çıkabilir. Maternal alloantikorların varlığı tarama ile tespit edildiğinde, fetal anemi açısından tekrarlayan laboratuvar testleri ve klinik izlem planlanmalıdır. Bu durumda hidrops fetalis ve asfiksi gelişimini önlemek için intrauterin kan transfüzyonları uygulanabilir. Kernikterus gelişimini önlemek için fototerapi ile tedaviye erken dönemde başlanmalı, gerekirse doğum sonrası exchange transfüzyon yapılmalıdır. Bu nedenle tarama programı, intrauterin tedaviye ihtiyaç duyan fetüslerin ve şiddetli hemolitik hastalık gelişme riskini azaltmak için doğumun erken gerçekleştirilmesi gereken gebeliklerin saptanmasını amaçlamaktadır (Şekil 4) (2). Tarama programı olmaksızın tedavi gecikebilir.
Şekil 4: FYHH’ye Yol Açan Maternal Alloimmunizasyonun Hastalık Modeli, Laboratuvar Testleri ve Yüksek Riskli Vakaların Saptanması (17) (IUT: intrauterin transfüzyon. Tx: transfüzyon USG: ultrasonagrofi)
7 2.2.3.FYHH Farklı Eritrosit Alloantikorlarının Özellikleri
Şiddetli FYHH gelişme riski; immunglobulinlerin sınıfı, eritrosit alloantikorlarının özgüllüğü ve ilgili kan grubu antijeninin fetal eritrosit ve diğer dokulardaki ekspresyon seviyesi gibi faktörlere bağlıdır (17).
Anti-D fetal mortalite ve morbidite riski ile doğru orantılıdır (26,27). Şiddetli FYHH gelişme riski diğer maternal eritrosit alloantikorları ile komplike olmuş gebeliklerde çok daha düşüktür (anti-K hariç) (Şekil 5). Hollanda'da yapılan prospektif bir kohort çalışmasına göre anti-D dışı antikorların neden olduğu FYHH gelişen 298.000 gebe kadında, ciddi FYHH meydana gelen risk altındaki gebeliklerin (antijen pozitif fetus) %26'sında K antikorları, %10'unda c antikorları, %2'sinde E antikorları ve %5'inde başka bir Rh antijenine yönelik antikorlar saptanmıştır (4,5,17). K antikorları ile komplike olan gebeliklerin %42'sinde, c antikorları ile komplike olan gebeliklerin %33'ünde, E antikorları ile komplike olan gebeliklerin %19'unda ve Rh kan grubu sisteminin diğer antijenlerine karşı antikorlar saptanan gebeliklerin %20'sinde fototerapi gerekli olmuştur (2).
Tek merkezli başka bazı çalışmalarda da benzer oranlar elde edilmiştir(28). Nadir de olsa Duffy antijenlerine (örneğin Fya) karşı antikorların, intrauterin kan transfüzyonu gerektiren ciddi FYHH’na neden olabildiği bildirilmiştir(21). Bir başka çalışmada antijen pozitifliği olan 42 fetusun hiçbirinde şiddetli FYHH gözlemlenmemiş; ancak %14'ünün fototerapi ihtiyacı olmuştur. Bu oran kontrol grubunda (antikor olmayan veya antijen negatif fetus) %4 olarak saptanmıştır(2). Literatürde şiddetli FYHH'na neden olan çok çeşitli eritrosit alloantikorları bildirilmiştir. Çalışılan popülasyonun etnik kökenine göre değişebilmekle birlikte bu antikorlar nadiren şiddetli FYHH'nın nedeni olarak rapor edilmektedir. Örneğin, Asya popülasyonunda anti-GPMur şiddetli FYHH'ye neden olabilmekte, Hispanic toplumlarda ise geç başlangıçlı hemoliz ve hiperbilirubinemi ile FYHH'den sorumlu anti-Ge3'ün saptandığı bildirilmektedir (29–31).
8 Şekil 5: Eritrosit Antikor Spesifisitesine FYHH İndükleme Riski Açısından Genel Bir Bakış (17)
(28)(21)(2)(29–31)
Anti-M, hamile kadınlarda doğal olarak oluşan IgM sınıfı bir antikordur (immunizasyon öyküsü olmaksızın). Bununla birlikte IgG sınıfına ait Anti-M, MNS kan grubu sisteminin antijenlerine karşı meydana gelen diğer antikorlar gibi ciddi FYHH'ye neden olabilir (32). IgM sınıf anti-M'si pozitif olan 69 hamile kadında, IgG'ye dönüşümünü araştırmak için gebeliğin 24, 30 ve 36. haftalarında testler yapıldığında dönüşümün olmadığı tespit edilmiştir. Bu antikorun IgG'ye dönüşmesi ve ciddi FYHH’nı indüklemesi muhtemel değildir. Bu nedenle gebeliğin erken döneminde IgM sınıfının anti-M'si tespit edilmesi halinde testlerin tekrarlanması gerekli değildir (33).
Anne ve fetus arasında ABO uygunsuzluğu yüksek sıklıkta görülmesine rağmen yenidoğanlarda anti-A veya anti-B oluşumu nedeniyle klinik olarak anlamlı hemoliz ortaya çıkma sıklığı nispeten düşüktür; meydana gelse bile hafif bir klinik seyir gösterir. A ve B grup antijenleri plasental dokuda eksprese edilir ve maternal alloantikorları bir dereceye kadar bağlayabilirler. Ayrıca, A ve B kan grubu antijenlerinin fetal eritrositler üzerinde ekspresyonu tam olarak gelişmemiştir. Anti-A ve anti-B ağırlıklı olarak IgM sınıfındadır, oysa anti-AB, O grup kadınlarda genellikle IgG sınıfındadır. Hamilelik sırasında, IgG sınıfının anti-A, anti-B
9 ve anti-AB titrelerinin oluşması kuvvetle artabilir. ABO aracılı FYHH insidansında popülasyonlar arası nedeni henüz anlaşılamamış çarpıcı bir fark vardır. Görülme sıklığı, beyaz popülasyonda %0,3-0,8 civarında iken, siyah ırk ve Asya popülasyonunda %3–5 arasındadır ve bu grupta daha ciddi bir klinik seyir izlenmektedir (34).
Bazı kan grubu antijenlerinin ekspresyonu (örn. Lub, Yta) fetal eritrositlerde çok düşüktür ve bu nedenle ciddi bir hemoliz izlenmez.
2.3.FYHH Klinik Bulguları
FYHH’nın klinik presentasyonu kendini sınırlayan hafif hemolitik hastalıktan (hiperbilirubinemi ve anemi) hayatı tehdit eden ciddi anemiye kadar (hidrops fetalis) değişken derecelerde olabilmektedir.
2.3.1.Anemi
Anemi maternal IgG antikorlarının fetal eritrositlere bağlanarak hemolize neden olmasıyla ortaya çıkar. Hafif anemiden hayatı tehdit eden ciddi anemiye kadar değişen derecelerde görülebilir. Erken anemi FYHH’da postnatal ilk 7 günde görülürken sık görülen geç anemi postanatal 7.günden sonra ortaya çıkar (34). Erken anemi antikor bağımlı eritrosit hemolizi sonucu meydana gelir. Geç başlangıçlı anemi inefektif eritropoez ile ortaya çıkan “geç hiporejeneratif anemi” ile aktif kemik iliği ve artmış retikülosit sayısı ile ortaya çıkan “hemolitik hastalığın geç anemisi” olarak iki gruba ayrılabilir. Bir çalışmada FYHH gelişen term ve geç preterm infantlarda geç anemi insidansı (Hb<8 g/dl) %83 olarak saptanmıştır (34).
2.3.2. Sarılık
FYHH’da sarılık genellikle postanatal ilk 24 saatte ortaya çıkar. Hızlı yükselen unkonjuge hiperbilirubinemi düzeyleri ile kernikterusa yol açacak kadar ciddi olabilir. Prematürite, hipoproteinemi, metabolik asidoz, hipoglisemi, ilaç kullanımı (kafein, sodyum benzoat vb.) gibi predispozan faktörlerin varlığında daha düşük bilirubin seviyeleri ile de kernikterus gelişebilir. Exchange transfüzyon ihtiyacı ortaya çıkabilir (35,36).
10 2.3.3. Hepatosplenomegali
Hepatosplenomegali, Rh immünizasyonuna bağlı FYHH’da daha sık saptanmakta iken ABO immünizasyonuna bağlı FYHH’da daha nadirdir. Hastalığın şiddetine göre ciddiyeti değişiklik gösterebilmektedir (34,37).
2.3.4. Peteşi
Daha çok ciddi FYHH varlığında görülmektedir. Hiporejeneratif trombositopeni şeklinde yaşamın ilk haftalarından itibaren ortaya çıkabilir (38).
2.3.5. Hidrops Fetalis
Hayatı tehdit edecek derecede ciddi anemisi olan infantlarda ciltte ödem, plevral efüzyon, perikardiyal efüzyon ve asit ile prezente olur. Ölü doğum, fetus maserasyonu veya ciddi hidrops fetalis kliniği ile doğum görülebilmektedir. Doğum salonunda kardiyojenik şok tablosu izlenebilir. 0 Rh (-) eritrosit süspansiyonu ile acil transfüzyon ve şok stabilizasyonu ihtiyacı ortaya çıkabilir. Ciddi ödem nedeniyle acil parasentez ve torasentez gerekebilir (20). RhD ve Kell gibi bazı minör kan grup uyuşmazlığı durumlarında özellikle antenatal takipsiz gebeliklerde risk artmaktadır. ABO nedeniyle oluşan FYHH’nda risk daha düşüktür ancak literatürde vakalar bildirilmiştir (39–41).
2.4.FYHH Tanı Yöntemleri
Tüm gebelere kan grubu (ABO ve Rh) ve IgG antikorlarını saptamaya yönelik İAT bakılması önerilmektedir (42). Eritrosit sensitizasyonu olan hastalar için antikor spesifitesi belirlenir ve öncelikli risk sınıflaması yapılır. Klinik olarak önemli (D, E, c, K vb.) eritrosit antikorları ile sensitize olan kadınlarda tanısal testler ve monitörizasyon daha dikkatli yapılmalıdır (42). Tekrarlayan antikor titrelerinin ölçümü devam eden sensitizasyonu saptamada kullanılan geleneksel yöntemdir.
11 2.4.1.Prenatal Tanı Yöntemleri
Geçmişte fetal aneminin ciddiyetini değerlendirmek için kullanılan standart test, amniyosentez ile amniyotik sıvıda bilirubin seviyelerinin ölçülmesiydi. Amniyosentez, spontan düşük ve amniyotik sıvı kaçağı dahil komplikasyonları olan invaziv bir işlemdir ve doppler ultrasonografideki gelişmeler, erken fetal aneminin non-invaziv olarak saptanabilmesine olanak sağlamıştır (43,44). Günümüzde fetal aneminin saptanmasında orta serebral arterin pik sistolik hız (MCA-PSV) ölçümünün kullanılabileceği bildirilmiştir (45). Çok merkezli uluslararası bir çalışmada alloimmünize vakalarda ağır fetal aneminin saptanmasında MCA-PSV-Doppler ultrasonografinin tanısal doğruluğu %85, duyarlılığı %88, özgüllüğü %82 olarak bildirilmiştir (46–51). Bu nedenle, doppler ultrasonografi günümüzde ağırlıklı olarak yüksek riskli gebelerde fetal anemili olguları tanımlamak için kullanılmaktadır. Gebeliğin 16-24. haftaları arasında veya kritik antikor titresi saptandığında fetal anemi takibi için MCA doppler akım ölçümü 2 hafta ara ile yapılmalıdır (51,52). Ek olarak haftalık fetal monitörizasyon ve fetal kalp atışı takibi önerilmektedir. Dopplere göre fetal aneminin ciddiyetinde artış saptanması kordosentez ile fetal hematokrit tayinini gerektirir. Fetus kabul edilebilir gestasyon haftasından daha küçük ve fetal hematokrit <%30 ise genellikle intrauterin transfüzyon gereksinimi mevcuttur (15).
Maternal plazmadan elde edilen fetal DNA ile fetal kan grubu tespiti yapılabilmektedir. İnvaziv olmayan bu yöntemde son on yıldır önemli anlamda gelişme kaydedilmiştir. Ağır FYHH'ye neden olabilen antikorlar açısından birçok laboratuvarda gebelikte tarama yapılmaktadır. Fetal DNA, maternal plazmada toplam serbest hücre DNA'sının sadece bir kısmını temsil eder ve çok düşük konsantrasyonlarda bulunur. Bu nedenle kantitatif PCR ile yüksek verimli DNA ekstraksiyonu ve hassas algılama teknolojisine ihtiyaç duyulmaktadır. Literatürde, gebeliğin ilk üç ayında D, C, c, E ve K antijenlerinin güvenilir genotiplemesi ve sonuca yönelik tedavi başlanması ile ilişkili çalışmalar bulunmaktadır (15,53). Bu analizlerde, fetal antijen-negatif fenotip doğrudan tespit edilmez, antijen spesifik PCR'ın negatif olmasına dayandırılır. Bu nedenle, paternal geçişli diğer DNA dizileri (örneğin SRY) veya evrensel bir fetal DNA işaretleyicisi (örneğin, metillenmiş RASSF1a) ile fetal DNA'nın varlığını teyit etmek, bazı laboratuvarlar tarafından tek bir deneyde kesin sonuçlar bildirmek amaçlı kullanılır (1). Bunun yerine yeterli miktarda fetal DNA varlığını sağlamak için tetkik hamilelikte daha sonra tekrarlanabilir. Ciddi FYHH gelişimi için risk taşıyan vakalara laboratuvar ve klinik izlem için non-invaziv bir yöntem olan fetal genotiplemenin güvenilir bir şekilde kullanılabileceği sonucuna varılır.
12 İmmünize olmayan RhD negatif, immünize olan RhD pozitif ve RhD negatif gebelerde veya FYHH pozitif bir geçirilmiş gebelik varlığında birinci basamak yaklaşım FYHH açısından fetal riskin ortaya konulmasıdır. Paternal zigositenin saptanması alloimmünize bir gebeye yaklaşımda optimal seçenektir. Çünkü kanıtlanmış antijen bakımından homozigot babanın varlığı fetüsü FYHH için %100 riskli kılar (1).
Pek çok ülkede, şiddetli FYHH riski yüksek olan vakalar IAT ile belirlenen eritrosit alloantikorlarının titrelerine dayanılarak ayırt edilir. Kan örneği, eşik veya sınır değeri (kritik titre) aşılıncaya kadar düzenli aralıklarla tekrar test edilir. Kritik değerin aşılması şiddetli FYHH için artmış risk anlamına gelir. Bazı ülkelerde, sadece anti-D, anti c veya anti K pozitif olan hamile kadınlar düzenli olarak tekrar test edilir. Diğer eritrosit antikorları olanlar ise nadir görülen bir durum olan yüksek antikor titresine sahip riskli vakaları tespit etmek amacıyla sadece 28. Gebelik haftasında yeniden test edilir. Moise, anti-D laboratuvarlarının çoğunda, 8 ile 32 arasında kritik bir titrenin kullanıldığı sonucuna varmaktadır (54). Genel olarak, anti-K hariç, D-dışı alloantikorlar için 32, cut off değer olarak kullanılır (55). Hidrops fetalis tanısında ultrasonografi ile fetusta asit, plevral efüzyon, perikardiyal efüzyon, deri altı ödemi ve polihidramnioz görülebilir.
2.4.2.Postnatal Tanı Yöntemleri
Antenatal tanı almamış kan uygunsuzluğu olan anne ve bebeklerin saptanabilmesi için kan grubu tayini yapılmış olmalıdır. RhD negatif anneden doğan RhD pozitif yenidoğanlar ile O kan grubu anneden doğan A veya B kan grubu yenidoğanlar ve hemoliz bulguları (periferik kan örneğinde eritrosit sayısında azalma, retikülositoz, makrositoz, polikromazi) olan yenidoğanlarda FYHH’den klinik olarak şüphelenilmelidir. FYHH’den şüphelenildiğinde antikor aracılı hemolizin gösterilmesi ile tanı konulur. Bu hastalarda hemolizle beraber hiperbilirubinemi riski artmaktadır. Yenidoğan hemoglobin/hematokrit düzeyleri bakılmalı, periferik yayma yapılmalı ve DAT, İAT ve bilirubin düzeyleri gönderilmelidir. Rh uygunsuzluğu mevcut iste genellikle anemi ortaya çıkarken, ABO uygunsuzluklarında anemi sıklıkla beklenmez. O kan gurubu anne bebeklerinde rutin olarak kan gurubu tayini ve DAT gönderilmesi önerilmektedir (10).
FYHH şüphesi bulunan bebekte, immun eritrosit yıkımını incelemek için DAT yapılmalıdır. DAT’de eritrosit yüzeyine nonspesifik bağlanmaların uzaklaştırılması amacıyla, eritrositler yıkanır ve polispesifik ve/veya monospesifik (IgG, C3d) antihuman globülin ile test edilir (56).
13 DAT’ın negatif olması FYHH’nı dışlatmaz; ancak pozitif DAT yenidoğanın eritrositlerine karşı maternal antikor varlığı için güçlü bir işarettir. ABO’ya bağlı FYHH’nda DAT sensitize eritrositleri saptayamayabilir. Çünkü A ve B antijenleri yenidoğan eritrositlerinde, çocuk ve erişkinlere göre daha az gelişmiştir (56). DAT pozitif yenidoğanda, ABO uygunsuzluğu varsa, yenidoğan eritrositlerinde elusyon çalışması yapılır ve elde olunan elüat, A1 ve B hücreleri ile test edilir. Böylece, DAT pozitifliğinin maternal isoaglütininler ile ilişkisi doğrulanır. ABO uygunsuzluğunda DAT negatif ancak hiperbilirubinemi ve/veya hemoliz varsa, bebek plazması A1 ve B hücrelerle test edilerek anti-A ve anti-B varlığı incelenebilir. DAT pozitif olgularda bebek veya maternal IAT pozitif ise doğrudan antikor tanımlama gerçekleştirilir. Bu durumda elüsyon çalışmasının yeni bir bilgiye ulaştırma beklentisi olmadığından elüsyon yapılma gereği yoktur (57) İntrauterin transfüzyon uygulanmış olan Rh HH’da DAT negatif saptanabilir. Çünkü donörün Rh negatif eritrositleri aglütinasyonu zorlaştırır. Buna karşın İAT güçlü pozitif çıkar. Kord kanı DAT ve bebek kan grubu belirlenmesinde sıklıkla kullanılırken, wharton jeli ile kontamine olmuş kord kanı örneğinde DAT’in yanlış pozitif saptanabileceği akılda tutulmalıdır (58–60).
Hiperbilirubinemi ve/veya hemoliz bulguları taşıyan bir yenidoğanda DAT ve İAT negatif saptanır ve ABO uygunsuzluğu da dışlanırsa, non-immun hematolojik nedenlerin (Glikoz-6P-dehidrogenaz enzim eksikliği, pirüvat kinaz eksikliği, Gilbert sendromu, herediter sferositoz gibi) ve hematolojik olmayan nedenlerin araştırılması uygun olur (61). ABO HH saptanan yenidoğanlarda bilirubin yüksekliği persiste eder ise yine diğer risk faktörleri araştırılmalıdır (62).
Şiddetli FYHH'da eritropoezin baskılanması nedeniyle diğer hücre serilerinin de baskılandığı ve potansiyel olarak lökopeni ve trombositopeniye yol açabileceği düşünülmektedir (63). Tek merkezli retrospektif bir çalışmada, Rh D HH için İUT ile tedavi edilen yenidoğanlarda %26 oranında trombositopeni (trombosit sayısı <150 x 109 / L) görülmüştür. Trombositopeninin ortaya çıkışı perinatal mortalite için bağımsız bir risk faktörü olarak değerlendirilmiştir (64). Aynı zamanda retrospektif bir çalışmada da FYHH olan tüm yenidoğanlarda doğumda %26 oranında trombositopeni saptanmıştır. FYHH'daki trombositopeni genellikle kendi kendini sınırlar ancak trombosit sayısı transfüzyon eşiğinin altına düşerse trombosit transfüzyonu ile tedavi gerekebilir.
14 2.5.FYHH Korunma Ve Tedavi Yöntemleri
FYHH’nin yönetimi hem doğum öncesi hem de doğum sonrası stratejileri ile iki yönlü olmalıdır. Tüm gebelerin geçmişte ölü doğum, hidropik fetal kayıp, eski alloimmünizasyon açısından öyküleri sorgulanmalıdır.
2.5.1.Antenatal Korunma ve İmmunoprofilaksi
Maternal RhD izoimmünizasyonu ile RhD aracılı FYHH’na bağlı yüksek mortalite ve morbidite, anti-D immünoglobülini kullanarak rutin antenatal anti-RhD profilaksisi (RAADP) yoluyla önlenmeye çalışılmaktadır (Şekil 7). RAADP programı, FYHH nedeniyle bildirilen ölüm oranlarında 1970’de 1.2/1000 iken 1990’da 0.2/1000’e düşüş sağlaması ile tıp tarihinin en başarılı korunma öykülerinden biridir (65).
İngiliz Hematolojide Standartlar Komitesi (BCSH) kılavuzları, tüm gebelere ABO ve RhD tiplendirmesi yanı sıra hamileliğin erken dönemlerinde ve ayrıca 28. gebelik haftasında alloantikorların taranmasını önermektedir (66). Hamile kadınların yaklaşık %1'inde klinik olarak anlamlı eritrosit antikorları bulunur ve antikorların düzey ve tipleri araştırılmalıdır. Bu sonuçlar fetüs ve yenidoğan için önemli hemoliz riskini öngörmede yardımcı olur. Yalnızca üçüncü trimesterde tespit edilen antikorların FYHH'na neden olmadığına dair kanıtlar vardır (3,67,68).
Anti-RhD immünoglobulin, donör insan kanından, fraksiyonlama veya anyon değiştirme kromatografısiyle ekstrakte edilir. Lokalize veya sistemik alerjik reaksiyonlar ve kanla bulaşan enfeksiyonlar için risk diğer havuzlanmış kan ürünleri ile benzerdir ve düşüktür. Birleşik Krallık'taki RAADP programı genellikle topluluk ebeleri veya doğum öncesi kliniklerinde uygulanır ve tüm RhD negatif primigravidalara ve hassaslaştırılmamış multigravidalara sunulur. RAADP genellikle 28. ve 34.gestasyonel haftalarda her biri 500 IU'lik iki doz anti-D immünoglobulin olarak uygulanır. Başka bazı merkezler, uyumu arttırmak için 28 ile 30.gestasyonel hafta arasında tek bir 1500 IU doz uygulamaktadır. Anti-D, uygulama sonrası 8-12 haftaya kadar antikor taramada tespit edilebilir. Antikor taraması için alınan rutin kan örneğinin 28. haftada anti-D uygulamasından önce alınması gerekir. Eğer anti-D tespit edilirse, doğum notlarında immunizasyon öyküsü gözden geçirilmelidir. Tipik olarak, pasif anti-D, immün anti-D'den (nadiren 1 IU / ml'yi aşan) daha düşük bir seviyede bulunur ve seviye genellikle zamanla düşer. Pasif anti-D plasentayı geçebilir ve fetüs RhD pozitifse düşük bir hemoliz seviyesine neden olabilir, ancak önemli anemi veya hiperbilirubinemiye neden olmaz (69,70). RAADP'yi takiben transplasental olarak edinilen
15 pasif anti-D, RhD pozitif bir bebekte DAT pozitifliğinin yaygın bir nedenidir. RAADP uygulanmış olan RhD negatif kadınlardan doğan RhD pozitif bebeklerin yaklaşık %15’inde DAT pozitif olabilir (71). Her ne kadar kanın mikroskopik olarak incelenmesi ile pasif ve immün anti-D’nin DAT pozitifliği nedeni olarak ayırt etmeye yardımcı olsa da bunun yenidoğan kan hücresi morfolojisinde deneyimli biri tarafından yapılması gerekir.
Şekil 6: RADDP Uygulamasında Anahtar Noktalar (72)
2.5.2.Prenatal Tedavi Ve Yönetim
Şiddetli fetal anemi varlığında, hidrops fetalis ve fetal ölümü önlemek için FYHH'nin antenatal olarak tedavi edilmesi esastır. FYHH'nin doğum öncesi bakımında en başarılı adım, 1968'de RhD immünoprofilaksisinin ortaya çıkmasıdır (40). İmmunoprofilaksi uygulanabilir hale gelmeden önce, FYHH dünyadaki tüm yenidoğanların %1'ini etkilemekte ve %50’si mortalite ile sonuçlanmaktaydı (73–75). Gelişmiş ülkelerde RhD negatif kadınlarda Rh HH insidansı günümüzde yaklaşık %0,5'tir (70,76,77). Bununla birlikte, yeterli RhD immünoprofilaksisine rağmen, 1000 RhD negatif kadının 1 ila 3’ünde anti-D antikorları gelişir (78).
Doğum öncesi bakım sadece immünoprofilaksiyi değil, aynı zamanda fetal anemiyi saptamak için yüksek riskli vakaların laboratuvar testleri ve ultrason tabanlı tekniklerle izlenmesini de içerir. Gerekirse, şiddetli fetal anemi fetal hidropsları önlemek veya tedavi
16 etmek için IUT ile tedavi edilir. FYHH antenatal tedavisinde örneğin MCA-PSV> 1,5 MoM ise IUT göz önünde bulundurulmalıdır. IUT ile tedavi edilen olgu serilerine ait çoğu çalışmada perinatal sağkalım oranı %90 civarında bildirilmektedir (79). Ayrıca bir çalışmada IUT ile tedavi sonrası nörogelişimsel olarak takip edilen 291 çocuğun %95'inden fazlasında gelişimin normal olduğu gösterilmiştir (80). IUT, Rh ve K antijenleri için bilinen önleyici etkisine karşın, annelerin %25'inde alloimmunizasyonun artışına da yol açabilir (79). İntrauterin kan transfüzyonu %1-3 oranında enfeksiyon veya membran rüptürü gibi fetal yan etki risklerini beraberinde getirir ve özellikle 2.trimester erken döneminde sonuçlar daha kötü seyirlidir (79,81).
Plazmaferez yapılmış olsun veya olmasın alloimmünize kadınların intravenöz immünoglobulin (IVIG) ile tedavisi ise yalnızca üç küçük vaka serisi ile açıklanmıştır, ancak bu deneysel tedavilerin etkinliği henüz kanıtlanmamıştır (79).
2.5.3.Postnatal Tedavi Ve Yönetim
FYHH yönetiminde eşit derecede önemli bir diğer basamak doğum sonrası bakımdır. Doğum sonrası bakım öncelikle hasta ve sıklıkla prematüre yenidoğanın yönetimi ve stabilizasyonunu içerir (33). Bununla beraber yoğun fototerapi ve kan değişimi transfüzyonları ile hiperbilirubinemi tedavisi ve kernikterusun önlenmesi de esastır. Doğumda maternal dolaşım ile temas sonrası yenidoğan karaciğerinin immatüritesi nedeniyle hiperbilirubinemi hızla ve ciddi düzeylerde ortaya çıkar. Yenidoğanlarda sarılıkların çoğunun prognozu iyi seyirli olmasına karşın bilirubin aracılı ensefalopati riskinden dolayı yenidoğan sarılıkları iyi yönetilmelidi (33,82). Etkilenen infantlarda unkonjuge bilirubinin uzaklaştırılması için fototerapi veya kan değişimi gerekebilir. Ciddi hiperbilirubinemide, konjuge olmayan bilirubin kan-beyin bariyerini geçer ve bilirubin nörotoksisitesine neden olabilir. Billuribin ile indüklenen nörolojik fonksiyon bozukluğu (BIND) olarak tanımlanan bir durum ortaya çıkar. Kernikterus veya kronik bilirubin ensefalopatisi bu tablonun en şiddetli ve irreversibl klinik bulguları olarak bilinir (83). BIND'in akut semptomları arasında uyuşukluk, hipotoni ve beslenme problemleri yer alır. Tedavi edilmediği takdirde hiperbilirubinemi ateş, yüksek sesli ağlama ve tonus artışına neden olabilir ve sonuç olarak apne, koma, nöbet ve ölüme yol açabilir. Kernikterusta, en çok etkilenen beyin dokuları bazal ganglionlar, serebellum ve çeşitli beyin sapı çekirdekleridir. Hayatta kalan bebeklerde uzun süreli morbidite; atetoid serebral palsi, işitme kaybı ve zihinsel sakatlığı içerir (83–85). Standart hiperbilirubinemi yönetiminde yoğun fototerapi ve kan değişim transfüzyonları yer alır. Bu tedavilerin iyileştirilmesi, FYHH'de hiperbilirubineminin etkisini azaltan
17 farmakoterapötik ajanlar gibi alternatif tedavilerin araştırmasına devam edilmektedir. Yenidoğan hiperbilirubinemisinde olası tedavi seçenekleri olarak birkaç farmakoterapötik madde çalışılmıştır. Temel odak noktası albümin, fenobarbital, metaloprofirinler, çinko, klofibrat ve prebiyotiklerdir. Bu ajanların hiçbiri şu anda hiperbilirubinemide standart bakım olarak önerilmemektedir (86,87).
Hiperbilirubinemi dışında, FYHH'nin erken ve geç anemi gibi diğer postnatal komplikasyonları ve tedavileri araştırılmış ve bunlara ait veriler de rapor edilmiştir. Ancak trombositopeni, aşırı demir yükü ve kolestaz gibi komplikasyonlara çok daha az dikkat çekilmiştir. Uzun vadeli nörogelişimsel sonuç ancak son zamanlarda büyük kohortlarda incelenmiştir. Devam eden FYHH ilişkili araştırmalarda, son gelişmeleri vurgulamak, özetlemek ve gelecek için çözüm bekleyen zorluklara dikkat çekmek önemlidir.
2.5.3.1.Anemi Tedavisi
Fetal eritrositlerin maternal alloantikorlarla hemolizi anemiye neden olur. Bu alloantikorlar doğumdan sonra birkaç ay yenidoğan dolaşımında kalır ve uzun süreli anemiye neden olabilir. Hemolitik hastalıktaki anemi erken anemi (doğum ile 7. gün arasında başlayan) ve geç anemi (7.günden sonra ortaya çıkan) olarak iki gruba ayrılmaktadır. Geç anemi, FYHH olan 35 hafta ve üzerinde gebelik haftasında doğan yenidoğanların %83'ünde görülür ve ayrıca “geç hiporejeneratif anemi” ve “hemolitik hastalığın geç anemisi” olarak sınıflandırılır (33,88). Geç hiporejeneratif anemiye, baskılanmış eritropoezis neden olur ve düşük retikülosit sayısı ile karakterizedir. Altta yatan mekanizmalar şu şekilde sayılabilir; eritrosit öncüllerinin intramedüller yıkımı, intrauterin ve postnatal transfüzyonlar ile kemik iliği baskılanması, eritropoietin eksikliği. Hemolitik hastalığın geç anemisi ise kısalmış eritrosit ömrünü kompanze etmek için ortaya çıkan aktif bir kemik iliği varlığı ve dolayısıyla yaşa uygun veya yaşa göre yüksek retikülosit sayılarıyla karakterizedir. Bu geç anemi formunun, halen var olan antikorlar ile devam etmekte olan hemolizin sonucu olarak, transfekte eritrositlerin sağkalımının kısalmasına sekonder hemoglobin seviyesinin doğal düşüşünün ve büyüyen yenidoğanın genişleyen intravasküler hacminin bir sonucu olduğu düşünülmektedir (89).
Geç anemi IUT uygulamaları öncesinde tanımlanmış olmasına rağmen, IUT'lar postnatal anemi riskini arttırıyor gibi görünmektedir. Patofizyolojik mekanizma tam olarak anlaşılmamıştır, ancak tekrarlayan IUT'ların eritropoezi baskılaması nedeniyle kalıcı anemi ortaya çıkmaktadır (33,83,84). Postnatal anemi tedavisinin temelinde destekleyici eritrosit transfüzyonları yer alır. IUT ile tedavi edilen yenidoğanlarda, postnatal destek transfüzyon
18 ihtiyacı IUT'larla tedavi edilmeyen yenidoğanlara göre (%27-67) anlamlı derecede yüksektir (%77-89) (89). Bu fark eritropoez baskılanması ile açıklanabilir (90,91). Geç anemi genellikle yaşamın üçüncü ayında düzelir, o zamana kadar eritrosit transfüzyonları doğum sonrası anemiyi tedavi etmek için gerekli olabilir (92–95). FYHH’da ilk transfüzyonu ihtiyacı postnatal 1ile 34.günler arasında, ortalama 18.günde ortaya çıkar (79). FYHH olan yenidoğanların %68 ila %83'ünde en az bir transfüzyonun gerekli olduğu bildirilmiştir (79,95). Bazı yenidoğanlarda yaşamın ilk üç ayı içinde 6 defaya kadar transfüzyon ihtiyacı bildirilmişti (79,96). Transfüzyon ihtiyaçlarındaki bu değişiklikler, transfüzyon kılavuzlarının farklılıkları ve transfüzyonlar için kabul edilen eşik değer başta olmak üzere birçok faktör ile açıklanabilmektedir.
Ek olarak gecikmiş kord klemplenmesi uygulaması doğumda bebeğe plasental kan transfüzyonuna izin verir. Bu transfüzyon, toplam yenidoğan kan hacminin dörtte birinden üçte birine kadarını içerebilir (97). Eritrosit alloimmünizasyonuna sekonder gelişen anemide, kayda değer bir yan etkisi olmayan bu uygulama ile doğum sırasında hemoglobin düzeylerinde anlamlı bir artış olu. Buna sekonder doğum ile ilk transfüzyon ihtiyacı arasında daha uzun bir süre geçmesi ve exchange nakil ihtiyacında azalma sağlanır (98). FYHH'da aneminin birincil tedavisi eritrosit transfüzyonlarının uygulanmasıdır; ancak eritropoezi indüklemeye yönelik eritropoietin, folat, demir ve E vitamini gibi bazı farmakolojik ajanlar da kullanılabilmektedir (92,94).
2.5.3.2.Fototerapi
Tedavi stratejisi olarak kullanılmaya başlandığı 1970'li yıllardan bu yana fototerapi, yenidoğan hiperbilirubinemisinin ana tedavisi olmuştur. Fototerapi, derideki bilirubinin böbrekler tarafından atılabilen, suda çözünen izomerlere dönüşmesini ve karaciğer aracılığıyla dışkı ile uzaklaştırılmasını sağlamaktadır. Fototerapinin etkinliği, kullanılan ışığın dalga boyu, ışık kaynağının yoğunluğu, toplam ışık dozu (fototerapi süresi ve maruz kalan cildin miktarı) ve / veya fototerapinin başlandığı eşik değer gibi birçok faktöre bağlıdır (99,100). Işık yayan diyotlar (LED'ler) en yaygın kullanılan fototerapi lambalarıdır, fakat aynı zamanda halojen lambalar, biliblanketler gibi fiberoptik sistemler de kullanılmaktadır (101). Fototerapi, serum bilirubin düzeyleri Amerikan Pediatri Akademisi (AAP) tarafından oluşturulmuş olan tedavi endikasyonu doğuran risk faktörlerine göre değişen eşik değerlere ulaştığında uygulanmalıdır (102,103). FYHH'da yoğun fototerapi kullanılması önerilir. Fototerapi genellikle güvenli bir prosedür olarak kabul edilir. Belirgin toksisite raporları son derece nadirdir ve çoğunlukla vaka raporları ile sınırlıdır (104–106).
19 2.5.3.3.Sıvı Desteği / Hidrasyon
Fototerapi sırasında sıvı desteği, hem idrar ve safra yoluyla fototerapi ürünlerinin atılmasına hem de artmış dengesiz su kaybının üstesinden gelinmesine yardımcı olabilmektedir (104,106). Ancak güncel LED ışıkların düşük miktarda ısı ortaya çıkarması ve dolayısıyla daha az sıvı kaybına yol açması nedeniyle fototerapi başlanan yenidoğanlarda dehidratasyon olmaksızın sıvı takviyesinin başlanmasının yararı sorgulanmaya başlanmıştır (104). Dehidratasyonu olmayan sağlıklı yenidoğanlarda intravenöz sıvı desteğinin serum bilirubinini azaltma ve fototerapi süresini kısaltma etkisi bulunamamıştır (79).
2.5.3.4. Kan Değiim Transfüzyonu
Kan değişimi uygulamaları ilk olarak 1940'lı yıllarda Rh HH’na bağlı neonatal hiperbilirubineminin spesifik tedavisi olarak kullanılmaya başlanmıştır (79,107). Değişim transfüzyonları serum bilirubin seviyesini düşürür ve antikor kaplı yenidoğan eritrositleri ile dolaşımdaki maternal antikorları uzaklaştırarak eritrosit yıkımını azaltır. Işınlanmış donör kanı kullanılarak çift hacimli değişim yöntemiyle yenidoğan toplam kan hacminin yaklaşık %85'i değiştirilir (83,107). Exchange transfüzyon uygulaması, bazı riskleri de beraberinde getirir. Bu riskler; kardiyolojik komplikasyonlar, solunum instabilitesi, apne, kateter ilişkili komplikasyonlar, trombositopeni ve enfeksiyonları içerir (103). Güncel yayınlarda yenidoğanlarda mortalite oranları %0,3'ten azdır; ancak erken yenidoğanlarda % 10'un üzerinde mortalite görülmektedir (108). Exchange transfüzyonlarının uygulanma sıklığı çalışmalar arasında büyük farklılıklar gösterir. Fototerapinin yaygın kullanımı, RhD immünoprofilaksisinin geliştirilmesi ve hiperbilirubineminin yakın izlemi ile bakım önerilerinin iyileştirilmesinin sonucu olarak uygulanma ihtiyacında genel olarak keskin bir azalma mevcuttur (109). Günümüzde yoğun fototerapiye rağmen bilirubin seviyeleri exchange transfüzyon eşiklerinin üzerinde kalıyorsa veya akut bilirubin ensefalopatisi belirtileri mevcut ise değişim transfüzyonları önerilmektedir (79,109). AAP tarafından yayınlanan kılavuzda exchange transfüzyon için yapılan klinik değerlendirmede gebelik yaşı, doğum ağırlığı ve hiperbilirubineminin etiyolojisi gibi bilirubin düzeyi dışındaki faktörlerin de dikkate alınması gerektiği belirtilmiştir. FYHH'da exchange transfüzyon oranı, AAP tarafından önerilere bağlı kısıtlamalar sonrası yaklaşık %20'ye düşmüştür (107,110). Tek merkezli bir çalışmada FYHH'da exchange transfüzyon kullanımının 2005 yılı öncesi dönemde %70 kadar olup yeni yaklaşımlar ile %15'lere gerilediği bildirilmiştir (111). Exchange transfüzyonlar FYHH’da bilirubin klirensi üzerinde olumlu etki yaratmakla kalmaz,
20 ayrıca yenidoğan kanının immünolojik olarak uyumlu donör kanı ile değiştirilmesi sayesinde plazma ferritin ve demir seviyelerini düşürmesiyle de anemi tedavisinde yer bulmaktadır (112,113).
2.5.3.5. İntravenöz İmmünoglobulin
İmmünoglobulinler, Fc reseptörlerini makrofajlarda bloke ederek antikor kaplı eritrositlerin parçalanmasını azaltır ve dolaşımdaki konjuge olmayan bilirubin seviyelerini düşürür (114). Bazı çalışmalar IVIG kullanımının exchange transfüzyon ihtiyacını azalttığını belirtmektedir (115). Yoğun fototerapiye rağmen total serum bilirubini yükseliyorsa veya bilirubin seviyesi exchange transfüzyon sınırının 2 ila 3 mg / dL (34-51 μmol / L) üzerinde ise IVIG (0.5-1 g/ kg) uygulanması AAP tarafından halen önerilmektedir. Gerekli görülürse 12 saat içinde tekrarlanan bir doz daha verilebilir (116). Mevcut önerilere rağmen bazı çalışmalarda FYHH'da IVIG etkinliği desteklenmemektedir (117–119). IVIG uygulamasının güvenli bir tedavi olduğu kabul edilmesine rağmen, transfüzyon ile bulaşan hastalıklar, anafilaksi/aşırı duyarlılık, tromboz, pulmoner emboli ve böbrek yetmezliği de dahil olmak üzere nadir ancak ciddi yan etkiler de bildirilmiştir (120). IVIG ile tedavi edilen Rh HH olan bebeklerle IVIG almamış kontrol grubunu karşılaştıran yakın dönem retrospektif bir çalışmada nekrotizan enterokolit (NEK) ile IVIG arasında olası bir ilişkiden bahsedilmektedir (117). Yakın tarihli sistematik bir derlemede de FYHH'nın IVIG ile tedavisi hakkında kesin bir tavsiyede bulunulmamıştır (121,122).
2.5.3.6.Antenatal Kortikosteroidler
Antenatal kortikosteroid tedavisinin, erken doğmuş bebeklerde akciğer olgunlaşmasını hızlandırdığı ve özellikle 34. gebelik haftasından önce doğmuş olanlarda solunum bozuklukları risklerini azalttığı bilinmektedir (123). 34. gebelik haftasından sonra verilen antenatal betametazonun solunum yolu hastalıkları riskini azalttığı gösterilmese de, son zamanlarda yapılan çalışmalar betametazonun muhtemelen karaciğer olgunlaşmasını hızlandırmasından dolayı fototerapi gerektiren yenidoğan sarılığı riskini azalttığını ortaya koymaktadır (123). Antenatal steroidleri konvansiyonel tedaviyle karşılaştıran randomize kontrollü bir çalışma yoktur.
21 2.6.FYHH Uzun Dönem İzlem
Geçmiş yıllar boyunca doğum öncesi ve yenidoğan dönemi yönetimindeki gelişmeler ile FYHH'da sağ kalım belirgin şekilde artmıştır. Ölüm oranları düştükçe, hayatta kalan yenidoğanlarda uzun vadeli sonuçlara ve morbiditelere dikkat çekilmektedir. Bozulmuş fetal beslenme ve büyüme gibi olumsuz doğum öncesi koşulların, yaşam boyu fiziksel ve zihinsel sağlık üzerinde derin ve kalıcı bir etkisi olabilir. Kardiyovasküler hastalık, nöropsikolojik bozukluklar ve metabolik hastalık riski artar. Fetusta immün hemolizin neden olduğu kronik anemi, kardiyak outputun artmasına neden olur ve miyokard hipertrofisine yol açabilir. Sınırlı sayıda çalışma, IUT ile tedavi edilen FYHH'nın çocukluk çağında daha az miyokard kitlesine yol açabileceğini göstermekte ancak yetişkin yaşamında uzun vadeli kardiyovasküler sonuçlar henüz bilinmemektedir.
Bütün bunların yanısıra Rh HH olan yenidoğanlarda aşırı demir yükü olma eğilimi vardır. Bu durum uzun süreli hemoliz, çoklu IUT'lar ve postnatal eritrosit transfüzyonları ile ilişkilidir. Her ne kadar beyin erken gelişiminde ve fonksiyonunda demir gerekli olsa da aşırı demir yükünün de zararlı etkileri olabilir. Karaciğer, kalp ve endokrin organlar zarar görebilir, immun sistem etkilenir ve enfeksiyona yatkınlık artar. Yaşamın ilk 3 ayında demir eksikliği, FYHH'da çok nadirdir ve postnatal transfüzyon uygulanan yenidoğanlarda ortaya çıkmaz. Aşırı demir yükü, doğumda FYHH olan yenidoğanların %70'inde, 1 aylık iken %50’sinde ve 3 aylık iken %18'inde görülür. IUT uygulanan FYHH'lı yenidoğanlarda ferritin düzeyleri doğumdaki kontrollere göre iki kat daha yüksek saptanmıştır. Şiddetli FYHH olan yenidoğanlarda, yaşamın ilk 3 ayında demir desteğinin kullanılması, özellikle IUT'lardan sonra önerilmez.
Şiddetli fetal ve neonatal aneminin, hiperbilirubineminin ve girişimsel prosedürlerin ve tedavilerin FYHH olan fetüs ve yenidoğanlara etkisi henüz net olarak bilinmemektedir ve mevcut veriler sınırlı olduğu için uzun süreli takip içeren çalışmalara ihtiyaç duyulmaktadır (123).
22 3. GEREÇ VE YÖNTEMLER
3.1. Çalışmaya Alınma Kriterleri
Bu çalışmaya, 1 Ocak 2018 ile 31 Aralık 2018 tarihleri arasında Ege Üniversitesi Tıp Fakültesi (EÜTF) Hastanesi Kadın Hastalıkları ve Doğum AB’da doğum yapan kadınlar ve bebekleri alındı.
3.2. Çalışma Dışı Bırakılma Kriterleri
EÜTF Hastanesinde doğmayan ve Kan Merkezine DAT için kan örneği gitmemiş olan bebekler çalışma dışı bırakıldı.
3.3. Hastaların Değerlendirilmesi
EÜTF Kadın Hastalıkları ve Doğum AD doğum defteri ve anne yatış özetleri, bebeklerin varsa EÜTF Çocuk Sağlığı ve Hastalıkları, Neonotoloji BD yatış epikrizleri ve arşiv dosyaları ve EÜTF Hastanesi, Kan Merkezinde gerçekleştirilen immun-hematoloji laboratuvar incelemeleri incelendi.
Yenidoğanların antenatal özellikleri, intrauterin transfüzyon öyküleri, gestasyonel yaşları, doğum haftası, doğum şekli, hiperbilirubinemi / hemoliz varlığı ve başlangıç zamanı (ilk 24 saat veya daha sonra), fototerapi ihtiyacı, İVİG-kan transfüzyonu ve kan değişim transfüzyon gerekip gerekmediği, enfeksiyon olup olmadığı, hiperbilirubineminin ortaya çıkış zamanı ve tedavi yöntemi, doğumdaki ve en düşük saptanan hematokrit değeri ile EÜTF Hastanesi, Kan Merkezinde gerçekleştirilen DAT ve diğer immun-hematolojik verileri kaydedildi.
EÜTF Kadın Hastalıkları ve Doğum AD’da doğan bebeklerin annelerinin kan grubu, gebelik sayısı, anti-D uygulanma öyküleri, hamilelikte veya daha öncesinde geçirilmiş hastalık öyküsü, kullandığı ilaçlar ve EÜTF Hastanesi, Kan Merkezinde gerçekleştirilen immun-hematoloji laboratuvar incelemeleri dikkate alındı.
23 3.4.İstatistiksel Yöntemler
Değişkenlerin analizinde SPSS 25.0 (IBM Corparation, Armonk, New York, United States) programı kullanıldı. Verilerin normal dağılıma uygunluğu Lilliefors düzeltmeli Kolmogorov-Smirnov testi ile değerlendirildi. Bağımsız iki grubun nicel verilere göre birbiri ile karşılaştırılmasında Mann-Whitney U testi Monte Carlo sonuçlarıyla birlikte kullanıldı. Kategorik değişkenlerin birbiri ile karşılaştırılmasında ise Fisher Exact testi Exact sonuçlarıyla, Pearson Chi-Square testi Exact ve Monte Carlo sonuçlarıyla, Fisher-Freeman-Holton testi Monte Carlo Simülasyon tekniği ile test edildi ve sütun oranların birbiri ile karşılaştırılıp Benjamini-Hochberg düzeltmeli p değeri sonuçlarına göre ifade edildi. Bir risk etkenine sahip olanların, olmayanlara göre kaç kat daha fazla olduğunu göstermek için odds ratio %95 güven aralıklarıyla birlikte kullanıldı. Nicel değişkenler tablolarda ortalama ± std.(standart sapma) ve medyan Range(Minimum/ Maximum) şeklinde gösterilirken kategorik değişkenler ise n(%) olarak gösterildi. Değişkenler %95 güven düzeyinde incelenmiş olup p değeri 0,05 ten küçük anlamlı kabul edildi.
24 4-BULGULAR
4.1.Yendioğanlara Ait Demografik Özellikler
Çalışma kriterlerini karşılayan 1737 yenidoğan çalışmaya dahil edildi. Bu hastaların 847’si (%48,8) kız ve 890’ı (%51,2) erkekti. DAT 95 (%5,4) yenidoğanda pozitif, 1642 (%94,5) yenidoğanda negatif saptandı. Yenidoğanların kan grubu dağılımları; O kan grubu 551 (%33,0), A kan grubu 688 (%41,2), B kan grubu 316 (%18,9) ve AB kan grubu 114 (%6,8) olarak saptandı. Eritrosit RhD antijeni yenidoğanların 1575’de (%90,7) pozitif ve 161’de (%0,3) negatif idi. 1717 (%98,5) yenidoğan doğum haftasına göre normal gelişme gösterirken, 26’da (%1,5) IUGG saptandı.
Yenidoğanların 84’ünün (%4,8) değişik nedenlerle EÜTF Hastanesi, Yenidoğan BD’a yatırılarak tetkik ve tedavi edildiği saptandı. Yenidoğana yatışları yapılan 84 bebeğin 38’inde (%45) hiperbilirubinemi mevcuttu. Fototeapi uygulanan bu yenidoğanlarda, hiperbilirubinemi ortaya çıkış zamanları, 4 bebekte (%10,5) <24 saat, 11 (%28,9) bebekte 24-48 saat arası 14 yenidoğanda (36,8), 48-72 saat arası ve 9 (%23,6) bebekte >72 saatten sonra olarak kayıt edilmişti (Tablo1). İntrauterin incelemede 1689 (%97,2) fetüs normal olarak değerlendirilmiş, 48 (%2,8)’inde, en sıklıkla, kardiyopati, nöral tüp defekti ve uterin arterde direnç artışı görülmüş, fetal hiperekojen odak, ikizden ikize transfüzyon, koroid pleksus kisti, tek umblikal arter, unilateral renal agenezi bunları takip etmiştir (Şekil 7).
25 Tablo 1: Demografik Verilerin Dağılımı ve DAT İle İlişkisi
Total Direkt Antiglobulin Test
P Negatif Pozitif (n=1642) (n=95) n (%) n (%) n (%) Cinsiyet 1737 Kız 847 (48.8) 794 (48.4) 53 (55.8) 0.096 pe Erkek 890 (51.2) 848 (51.6) 42 (44.2) Forward Rh(D) 1736 Negatif 161 (9.3) 157 (9.6) 4 (4.2) 0.099 pe Pozitif 1575 (90.7) 1484 (90.4) 91 (95.8) Forward grup 1569 0 551 (33.0) 540 (34.2) B 11 (12.2) <0.001 pm A 688 (41.2) 633 (40.1) 55 (61.1) A AB 114 (6.8) 108 (6.8) 6 (6.7) B 316 (18.9) 298 (18.9) 18 (20.0) Hiperbilirubinemi (saat) 38 <24 4 (10,5) 2 (6.9) 2 (22.2) 0.276 ff 24-48 11 (28,9) 7 (24,1) 4 (44.4) 48-72 14 (36,8) 12 (41,3) 2 (22.2) >72 9 (23,6) 8 (27,5) 1 (11.1) Yatış durumu 1737 Yok 1653 (95.2) 1570 (95.6) B 83 (87.4) 0.002 f Var 84 (4.8) 72 (4.4) 12 (12.6) A 3.15 (1.65-6.04)or Fototerapi öyküsü 1737 Yok 1696 (97.8) 1612 (98.2) B 86 (90.5) <0.001 f Var 38 (2.2) 29 (1.8) 9 (9.4) A 5.96 (2.73-12.98)or İUGR 1737 Yok 1711 (98.5) 1620 (98.7) B 91 (95.8) 0.049 f Var 26 (1.5) 22 (1.3) 4 (4.2) A 3.24 (1.1-9.59) or
İU hastalık öyküsü 1737
Yok 1689 (97.2) 1600 (97.4) B 89 (93.7) 0.044 f
Var 48 (2.8) 42 (2.6) 6 (6.3) A 2.57
(1.1-6.2) or
p Pearson Chi-Square test(e Exact, m Monte Carlo), u Mann Whitney U test(Monte Carlo), f Fisher Exact test(Exact), ff Fisher Freeman Halton Test(Monte Carlo), or : Odss ratio (%95 Güven aralığı), A Direkt Antiglobulin Testi Negatif olan gruba göre anlamlı, B Direkt Antiglobulin Testi Pozitif olan gruba göre anlamlı, Min.:Mnimum, Max.:Maximum. Hb: Hiperbilirubinemi. IUGR: intrauterin gelişme geriliği. İu: intrauterin