T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ RADYOLOJİ ANABİLİM DALI
PROSTAT KANSERİNİ SAPTAMADA 3 TESLA
MULTİPARAMETRİK MR İNCELEMENİN YERİ
UZMANLIK TEZİ
Dr. Erman KURT
TEZ DANIŞMANI
Prof. Dr. Mustafa HARMAN
İZMİR 2014
I
İÇİNDEKİLER
KISALTMALAR ... III TABLOLAR ... IV RESİMLER ... V I. GİRİŞ VE AMAÇ ... 1II. GENEL BİLGİLER ... 3
2.1. PROSTAT BEZİNİN MORFOLOJİSİ ... 3
2.1.1. Prostat Bezinin Anatomisi ... 3
2.1.2. Prostat Bezinin Fizyolojisi ve Histolojisi ... 6
2.2. PROSTAT KANSERİ ... 7
2.2.1. Prostat kanseri patolojik sınıflaması ... 7
2.2.2. Prostat kanseri epidemiyolojisi ... 8
2.2.3. Prostat kanseri etiyolojisi ... 8
2.2.4. Prostat kanserinde klinik bulgular ... 9
2.3. PROSTAT KANSERİNDE TANI YÖNTEMLERİ ... 10
2.3.1. Parmakla Rektal Muayene ... 10
2.3.2. Prostat Spesifik Antijen(PSA) ... 10
2.3.3. Prostat Biyopsisi ... 12
2.4. PROSTAT KANSERİNDE GLEASON SKORLAMASI ... 13
2.5. PROSTAT KANSERİNDE GÖRÜNTÜLEME YÖNTEMLERİ ... 14
2.5.1. Transrektal Ultrasonografi ... 14
2.5.2. Bilgisayarlı Tomografi ... 15
2.5.3. MANYETİK REZONANS GÖRÜNTÜLEME ... 15
2.5.3.1. Manyetik Rezonans Fiziği ... 15
2.5.3.2. Prostat kanserinde MRG ... 19
2.5.3.3. Konvansiyonel Manyetik Rezonans Görüntüleme ... 20
2.5.3.4. Dinamik Manyetik Rezonans Görüntüleme ... 22
2.5.3.5. Difüzyon Manyetik Rezonans Görüntüleme ... 23
2.5.3.5.1. Difüzyon Ağırlıklı İnceleme Tekniği ... 23
2.5.3.5.2. Prostat Kanserinde Diffüzyon MRG ... 25
2.5.3.6. Spektroskopik Manyetik Rezonans Görüntüleme ... 25
II
2.5.3.6.2. MRS’de ana metabolitler ve klinik önemleri ... 27
2.5.3.6.3. Prostat kanserinde MR Spektroskopi ... 28
III. GEREÇ VE YÖNTEM ... 30
3.1. MR Görüntüleme Tekniği ... 30
3.2. Radyolojik Değerlendirme ... 31
3.3. Histopatolojik Değerlendirme ve Radyolojik Korelasyon ... 33
3.4. İstatistiksel Analiz ... 35
3.5. Etik Açıklamalar ... 35
IV. BULGULAR ... 36
V. TARTIŞMA ... 44
VI. SONUÇ ... 53
VII. ÖRNEK OLGULAR ... 54
VIII. ÖZET ... 59
IX. SUMMARY ... 60
III
KISALTMALAR
ADC : Apparent Diffusion Coefficient (Görünürdeki Difüzyon Katsayısı) B0 : Dış manyetik alan
BW : Bandwidth (bant genişliği) BPH : Benign Prostat Hiperplazisi BT : Bilgisayarlı Tomografi
Ca : Karsinom
DAG : Difüzyon Ağırlıklı Görüntüleme
EPI : Ecoplanar imaging (Eko-planar Görüntüleme ) FOV : Görüntüleme alanı (Field of View)
C+ : Kontrastlı
MR : Manyetik Rezonans
MRG : Manyetik Rezonans Görüntüleme MRS : Manyetik Rezonans Spektroskopi
NEX : Number of excitation (veri toplama sayısı) p : Olasılık (probability)
PET : Pozitron Emisyon Tomografisi Pka : Prostat kanseri
PIN : Prostatik İntraepitelyal Neoplazi PSA : Prostat Spesifik Antijen
RF : Radyofrekans
ROI : Region of interest (ilgi alanı) PRM : Parmakla Rektal Muayene
SE : Spin Eko
sn : Saniye
SNR : Sinyal gürültü oranı (Signal to Noise Ratio)
T : Tesla
T1A : T1 Ağırlıklı T2A : T2 Ağırlıklı
TE : Echo Time (eko zamanı)
TR : Repetition Time (tekrarlama zamanı) TRUS : Transrektal ultrasonografi
IV
TABLOLAR
Tablo 1: Prostat kanserinin patolojik sınıflaması ... 7
Tablo 2: Prostate Cancer Prevention Trial (PCPT) çalışmasında PSA değerlerine göre kanser saptanma oranları ... 12
Tablo 3: Gleason skoru ile hastalık riski ilişkisi ... 14
Tablo 4: Larmor denklemi ... 17
Tablo 5: Kullanılan sekanslar ve parametreler ... 31
Tablo 6: Lezyonların radyolojik puanlaması ... 33
Tablo 7: Multiparametrik puanlama... 33
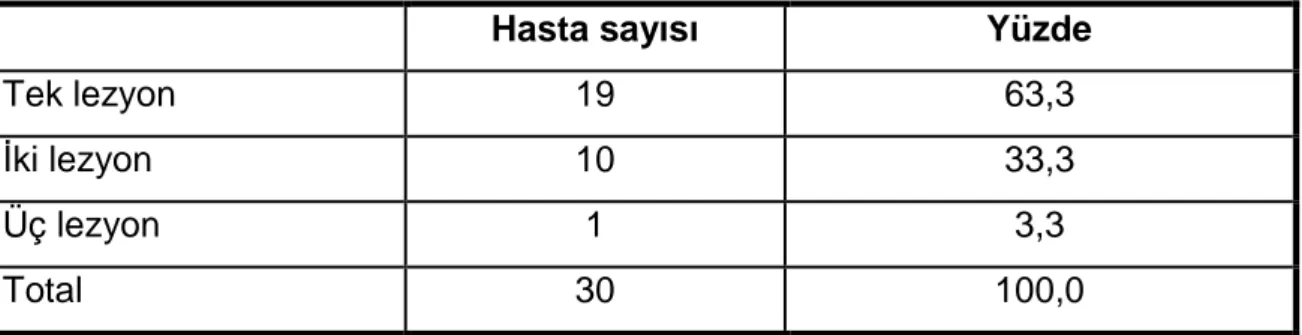
Tablo 8: Olgulardaki lezyon sayısı ... 36
Tablo 9: Periferal bez T2 sinyalleri ve patoloji sonuçları ... 37
Tablo 10: Morfolojik özellikler ve patoloji sonuçları ... 37
Tablo 11: MR spektroskopi bulguları ve patoloji sonuçları ... 38
Tablo 12 : Dinamik MRG bulguları ve patoloji sonuçları ... 38
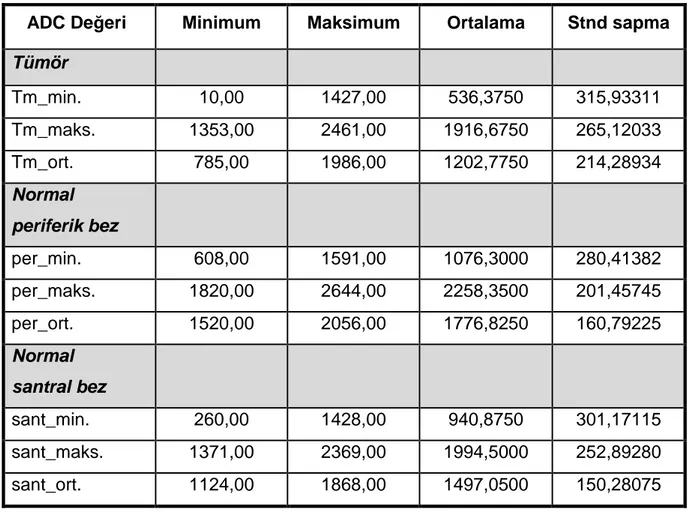
Tablo 13: Periferik zon tümörlerinin ve normal prostat periferik / santral bezin minimum, maksimum ve ortalama ADC değerleri ... 40
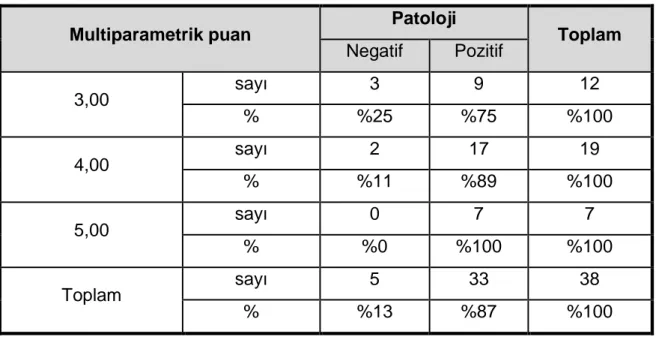
Tablo 14: Multiparametrik puan ile patolojinin karşılaştırılması ... 41
Tablo 15: Tümörlerin Gleason skoru ve risk sınıflamasına göre dağılımı ... 41
Tablo 16: Multiparametrik puanın Gleason skoru ile karşılaştırması ... 41
Tablo 17: Dinamik MRG’de kontrast tutuluş paterninin Gleason skoru ile karşılaştırılması . 42 Tablo 18: Radyolojik ve patolojik olarak ekstraprostatik uzanımın karşılaştırılması... 42
Tablo 19: Literatürdeki farklı b değeri ve manyetik alan gücünde yüzeyel koil ile yapılan çalışmalarda malign ve benign dokuların ADC değerleri ... 50
V
RESİMLER
Resim 1 : Prostat bezi zonal anatomisi ... 6
Resim 2: Manyetik alan içerisindeki spinlerin presesyon hareketleri ... 16
Resim 3 : RF pulsunun protonlara etkisi ... 18
Resim 4 : Radikal prostatektomi materyalinin taze makroskobik görüntüsü ... 34
Resim 5 : Prostatın bazal cerrahi sınırı ve veziküla seminalislerinin ayrılması ve apikalden itibaren prostatın ... 34
Resim 6 : Tespit sonrası prostatın bazal cerrahi sınırı ayrıldıktan sonra lambolara ayrılmış şekli ile posterior- anterior ve sağ-sol parçalara ayrılması ... 35
1
BÖLÜM I
GİRİŞ ve AMAÇ
Prostat kanseri, ırklara ve dünya coğrafyasına göre değişen oranlarda insidansa sahip olmakla beraber erkeklerde en sık görülen malignitelerin başında gelmektedir. Kanser ölümlerinde ise akciğerden sonra ikinci sıradadır. Prostat kanserinde erken tanı, hastalığın seyrini büyük ölçüde değiştirir. Hastalığın erken tanı ve tedavisi sayesinde son yıllarda prostat kanserinin mortalite oranı düşmüştür (1).
Tarama için ilk basamak; parmakla rektal muayenene (PRM) ve serum prostat spesifik antijen (PSA) düzeyinin ölçümüdür (2). Tanı transrektal USG eşliğinde alınan biyopsi ile konulmaktadır. Bu yaklaşım ile birlikte prostat kanseri insidansı artmıştır. PRM; özellikle PSA üretmeyen tümörlerin tespitinde önemli olmak ile birlikte geç döneme dek bulgu vermemesi önemli bir dezavantajdır. Serumda bulunan biyokimyasal bir belirteç olan PSA; prostat kanseri tanısında ve takibinde kullanılan en önemli belirteç konumundadır. Ancak prostat kanserine spesifik bir belirteç değildir.
Manyetik rezonans görüntüleme ise son yıllarda prostat kanserinin tanı, tedavi planlaması ve tedavi sonrası takibinde kullanılan noninvaziv yöntemler arasında en hızlı gelişen modalitedir. Konvansiyonel MR incelemeler (özellikle T2 ağırlıklı inceleme) prostat kanserini saptamada temel yöntem olmakla birlikte yüksek sensitiviteye ancak düşük spesifiteye sahiptir. Difüzyon ağırlıklı MR, dinamik MRG, MR Spektroskopi gibi gelişen ileri MR görüntüleme yöntemleri ile birlikte sensitivite ve spesifite artmaktadır.
Difüzyon ağırlıklı manyetik rezonans görüntüleme (DAG) biyolojik dokulardaki Brownian hareket de denilen sıvıların her yöne ve serbest hareketini ölçer (3, 65). Tümörlerde artmış selülarite suyun difüzyonunu kısıtlar. Apparent Diffusion Coefficient (ADC), difüzyon değerlerinden hesaplanan kantitatif bir parametredir ve difüzyon kısıtlılığını sayısal bir değer olarak ölçmeye yarar. Prostat kanseri tanılı olgularda yapılan difüzyon ağırlıklı çalışmalarda, kanserli dokularda saptanan ADC değerlerinin normal dokuya göre daha düşük olduğu gösterilmiştir (3).
2
Dinamik MRG ile prostat kanserinin kontrastlanma paterni incelenir. Prostat kanserinin dinamik MRG ile kontrastlanma paternini araştıran önceki çalışmalar kanser dokusunun, normal beze oranla erken fazda kontrastlandığını, erken fazda kontrastı bıraktığını göstermiştir (4).
MR spektroskopi (MRS), sinyalin alındığı esas doku volümü olan bir vokselin içindeki sitrat, kreatin, kolin gibi metabolitlerin dokudaki konsantrasyonunu bir spektrumda gösteren tanı yöntemidir. Prostat kanserinde; prostatta eser miktarda bulunan kolin miktarı artarken en fazla bulunan temel metabolit olan sitrat ise azalır (5).
Biz çalışmamızda prostat kanseri tanılı olgularda; multiparametrik 3 Tesla MRG ile elde ettiğimiz bulguları histopatoloji ile korele ederek kolay, noninvazif olan bu yöntemlerin prostat kanseri tanısındaki rolünü saptamayı amaçladık.
3
BÖLÜM II
GENEL BİLGİLER
2.1.PROSTAT BEZİNİN MORFOLOJİSİ 2.1.1.PROSTAT BEZİNİN ANATOMİSİ
Prostat erkek üreme sisteminin en büyük aksesuar bezidir. Prostat kemik pelvis içerisinde tabanı yukarıda ters çevrilmiş konik bir yapı olarak erkek üretrasını sarar. Prostat fibröz bir kapsül ile sarılıdır. Kapsülün dışında pelvik fasyanın visseral katı olan fibröz bir kılıf bulunur. Prostat 2,5×3×4 cm boyutlarında, yaklaşık 20 gr ağırlığındadır. Fibromusküler (%30) ve glandüler (%70) dokudan oluşur. Glandüler doku; sayıları 16-32’yi bulan kanal ile verumontanumun iki yanından prostatik üretraya açılır.
Prostatın tabanı üst komşuluğunda yer alan mesane boyunu ile devam eder, düz kas lifleri herhangi bir kesintiye uğramadan bir organdan diğerine geçiş yapar. Alt komşuluğunda prostat apeksi ürogenital diyafram üzerine oturur. Üretra, prostatı ön yüzden ve apeksin hemen üstünden terkeder. Posterior yüz, ampulla rektiden septum rektovezikale (Denonvillier fasyası) ile ayrılır. Ön komşuluğunda yer alan simfizis pubis ile retropubik boşluktaki (Retzius aralığı) ekstraperitoneal yağ dokusu ile ayrılır. Prostatın fibröz kılıfı puboprostatik ligamentler aracılığıyla pubik kemiklerin arka yüzleri ile bağlantılıdır. Lateral yüzleri levator ani kası ile komşudur (6).
Prostatın temel kan akımı hipogastrik arterin anterior dalının bir parçası olan inferior vezikal arterden sağlanır. İnternal pudental arter ile a. rektalis media da prostatın arteriyel beslenmesine katkıda bulunur. Prostat venleri, prostatın kapsülü ve fibröz kılıf arasında zengin pleksuslar oluşturur. Bu pleksuslar presakral vertebral pleksusla (Batson venleri) anastomoz yapar. Bu durum prostat kanserinin erken vertebral yayılımını açıklar. Prostatik pleksus derin dorsal penis venlerini toplayarak internal iliak vene drene olur. Prostatın primer lenfatik akımı; obturator, internal ve eksternal iliak ven gruplarına doğru olur.
İnferior hipogastrik pleksustan gelen sinir lifleri prostatın çevresinde prostatik pleksusu meydana getirir (6). Sempatikler presakral sinirlerden (T10-L2) köken alır ve
4
muhtemelen tümüyle sekretuardır. Parasempatikler ise spinal kordun sakral segmentlerinden (S2-S4) kaynaklanarak prostatın musküler stromasında dağılırlar ve direkt olarak mesane kasları ile devam eder, bu sayede preprostatik üretra için esas üriner sfinkterik fonksiyonu sağlarlar. Posterolateralde yerleşen iki nörovasküler demet (NVD), superior ve inferior pedikülleri oluşturur. Prostat, seminal veziküller, üretra, ejakulatuar kanallar, kavernöz cisim ve spongioz cismi innerve eden bu nöral yapılar prostat cerrahisi sırasında hasar görürse impotans gelişimine neden olur (83).
McNeal ve arkadaşları prostatın glandüler bölümünü anatomik, histolojik, fonksiyonel ve prostatik üretraya göre konumuna göre 4 ayrı zona ayırmıştır (7). Bu bölgeler periferik zon, transizyonel zon, periüretral zon, santral zondur. Bu bölgelere prostatın ön yüzünde yerleşen anterior fibromusküler stroma da eklendiğinde prostat 5 temel zona ayrılır.
1.Anterior fibromusküler stroma:
Prostat anteriorunu kaplayan elastin, kollajen, düz kas ve çizgili kastan oluşan konnektif bir dokudur. Prostat hacminin üçte birini oluşturur ve glandüler yapı içermez. Detrusör kasından orijin alıp mesane boynundan başlayarak prostatik üretranın ön yarısını sarar. Apekste, bu düz kaslar dış sfinktere uzanır. Bu tabaka prostatik üretranın ön yüzünde bir sfinkter oluşturur. Bu bölüm retrograd ejakulasyonun önlenmesinde de görev alır. Anterior fibromusküler stroma prostatik kapsül, anterior visseral fasya ve periprostatik sfinkterin ön kısmı ile devamlılık gösterir (8, 9).
2. Periferik zon:
Prostatın apikal, lateral ve posterior kısımlarını saran en büyük parçasıdır. Total glandüler dokunun %70’i burada bulunur. Karsinomların neredeyse tamamına yakını bu zondan çıkmaktadır. Kronik prostatitten en fazla bu zon etkilenir. Periferal zonun glandüler kanalları verumontanumun distalinde prostatik üretraya açılır. Periferik zon apeks hizasında üretrayı çepeçevre sarar. Prostat apeksi kapsülün bu bölgede ince olması nedeni ile prostat kanserlerinin yayılımı açısından zayıf bir anatomik bölgedir (8).
5 3.Santral zon:
Glandüler prostat dokusunun %25’lik bölümünü oluşturur (14). Bu zon arka kesiminde yer alan periferik zon tarafından çevrelenir. Karsinom ve diğer hastalıklara karşı dirençli bir zondur (10). Prostat kanserinin yaklaşık %5’i bu zondan kaynaklanır.
Santral zon içerisinden geçen ejakulatuar kanalları çepeçevre sarar. Ejakulatuar kanallar ile santral zon glandüler elemanları arasında periprostatik dokunun prostata uzanımından oluşan gevşek bir bağ dokusu vardır ve bu alan prostat karsinomunun periprostatik yayılımını kolaylaştıran anatomik bir yol oluşturur. Santral zonun kanalları ejakulatuar kanalların açılma bölgesinin komşuluğunda prostatik üretraya açılır.
Seminal vezikül ve vas deferenslerin santral zona girdiği bölgede prostat kapsülünün kesintiye uğraması buranın anatomik olarak zayıf bir bölge olmasına neden olur. Ayrıca santral zon ile periferal zon arasında sadece ince bir bağ dokusu bandı bulunması (psödokapsül) periferal zondaki bir karsinomun rahatlıkla santral zona yayılım göstermesine neden olur.
4.Periüretral zon:
Verumontanumun üst köşesinden devamındaki üretranın ön tarafını sarar. Glandüler ve nonglandüler elemanlar içerir. Ana komponenti preprostatik üretrayı saran, retrograd ejakulasyonu önleyen düz kas sfinkteridir. Üretra ile arasında çok ince periüretral glandlar vardır (8).
5.Transizyonel zon:
Proksimal ve distal üretranın birleştiği bölgede küçük bir grup bezden oluşur ve tüm prostatın %5’inden azını oluşturur. Artan yaş ile prostatta kapladığı hacim artar. Benign Prostat Hiperplazisi ’nin (BPH) tümü bu zondan çıkar. Prostat kanserinin yaklaşık %10 - 20’si transizyonel zondan kaynaklanır. Komşuluğundaki santral ve periferik zonlardan cerrahi kapsül adı verilen ve TRUS ile de görülebilen fibromusküler bir doku ile ayrılır. Transizyonel zona ait bez kanalları üretra lateral ve posterior yüzlerine açılır (8, 10).
6
Resim 1: Prostat bezi zonal anatomisi
2.1.2.PROSTAT BEZİNİN FİZYOLOJİSİ VE HİSTOLOJİSİ
Prostat dokusu bağ ve kas dokusundan oluşan fibromusküler stroma ve bu yapı ile iç içe geçmiş olan epitelyal glandüler elemanlardan oluşur. Tubuloalveolar yapıdaki bez dokusu histolojik olarak bölgeleşme gösterir. Prostatın epitelyal glandüler yapısının içinde 4 temel hücre grubu vardır. Bu hücreler prostatik sekretuar hücreler, bazal hücreler, transizyonel epitel, endokrin-parakrin hücrelerdir. Bunlardan en önemlisi sekretuar hücrelerdir. Sekretuar hücreler, prostatik asit fosfataz (PAP) ve prostat spesifik antijenin sentezlendiği hücreler olup androjen reseptörleri içerir. Bu hücreler seminal sıvı salgılar.
7
Prostat bezi içeriğinde sitrat, çinko, kalsiyum, kolesterol, spermin, asit fosfataz ve başka bazı proteazlar içeren sütsü, alkali bir sıvı salgılar. Prostat salgısının bu yapısı fertilizasyonda önemli rol oynar. Prostat salgısındaki elemanlardan prostatik asit fosfataz (PAP)’ın semendeki görevi net olarak bilinmemekle beraber metastatik prostat kanseri hücreleri bu enzimi kana salgıladıkları için klinik önemi vardır. Prostat Spesifik Antijen (PSA) ise ejakulatın seminal plazmasında bulunan bir proteazdır. PSA’nın işlevi ejakulat pıhtısını eritmekse de bunun fertilizasyondaki etkisi tam bilinmemektedir. Ancak günümüzde prostat kanseri tanı, tedavi ve takibinde kullanılan çok önemli bir belirteçtir. Prostat bezi androjen metabolizmasında da önemli rolü olan bir organdır. Plazmadaki serbest testosteron prostatik enzimler aracılığı ile diğer steroidlere metabolize olur. Testosteronun önemli bir kısmı 5 alfa redüktaz enzimi ile en önemli prostatik androjen olan dihidrotestesterona (DHT) çevrilir. DHT erkek dış genital organlarının farklılaşmasını sağlar.
2.2.PROSTAT KANSERİ
2.2.1.PROSTAT KANSERİ PATOLOJİK SINIFLAMASI
Prostat kanserlerinin histolojik tiplerinin %95’ini adenokarsinomlar oluşturmaktadır. İkinci en sık primer prostat tümörü ise %3’lük oranla periüretral prostatik kanallardan köken alan transizyonel hücreli karsinomdur.
Tablo 1: Prostat kanserlerinin patolojik sınıflaması
Epitelyal tümörler Stromal Tümörler Sekonder Tümörler
Adenokarsinom Leiyomyosarkom Mesane veya
Kolon Ca invazyonu Transizyonel hücreli Ca. Rabdomyosarkom Lenfoma
Nöroendokrin Ca. Metastaz
Müsinöz Saf duktal
8 2.2.2.PROSTAT KANSERİ EPİDEMİYOLOJİSİ
Prostat kanseri insidansı, mortalitesi ırklara ve ülkeden ülkeye belirgin farklılıklar göstermekle birlikte ileri yaş erkeklerde en sık tanı konan kanserlerin başında gelmektedir. Prostat kanseri dünya genelinde erkeklerde en yaygın ikinci sıklıktaki kanserdir (12). Ülkemizde de Sağlık Bakanlığı verilerine göre yüzbinde 37,6 insidans ile erkeklerde en sık görülen ikinci kanser konumundadır. ProstaTURK çalışmasında Türkiye’de insidansı yüzbinde 35 olarak saptanmıştır (66,67). Amerikan Kanser Derneği’nin verilerine göre prostat kanseri Amerika Birleşik Devletleri’nde erkeklerde en sık tanı alan kanser olup akciğer kanserinden sonra en sık ikinci ölüm sebebidir.
Dünyanın farklı bölgelerinde otopsi ile saptanan prostat kanseri insidansı yaklaşık aynıdır (11). Bu bulgu, çeşitli coğrafi bölgelerde farklılıklar gösteren klinik prostat kanseri görülme sıklığı ile belirgin zıtlıklar oluşturur. Hastalığın görülme sıklığı en yüksek oranda sırasıyla Avustralya / Yeni Zelanda, Kuzeybatı Avrupa ve Kuzey Amerika’da iken, en az oranda Güney Asya ve Kuzey Afrika’da görülmektedir (12). Bu da dış faktörlerin sözde latent olan prostat kanserinin klinik prostat kanserine ilerlemesini etkilediğini göstermektedir. Tarama yöntemlerinin yaygın olarak uygulanması erken evrede teşhise olanak sağlamıştır. Hastalığın erken tanı ve tedavisi sayesinde son yıllarda prostat kanserinin mortalite oranı düşmüştür (1).
2.2.3. PROSTAT KANSERİ ETİYOLOJİSİ
Prostat kanserinin nedenleri henüz tam olarak bilinmemekle birlikte, bazı risk faktörlerinin hastalıkla bağlantılı olduğu bilinmektedir. Amerikan Kanser Derneği’ne göre;
Yaş: Artan yaş, prostat kanseri gelişimi için en önemli risk faktörüdür. Yeni prostat kanseri tanısı konulmuş erkeklerin büyük çoğunluğu (%75) 65 yaşın üzerindedir (13).
Irk: Prostat kanseri Afro-Amerikan erkeklerde, diğer ırkların erkeklerine oranla daha sık görülürken bu ırksal ve etnik farklılıkların nedenleri açık değildir.
9
Coğrafya: Prostat kanseri yukarıda da bahsedildiği üzere Avustralya, Kuzey Amerika, Kuzeybatı Avrupa’da daha sık görülür. Güney Asya ve Kuzey Afrika’da ise daha az görülür. Bunun nedeni açık değildir.
Aile Öyküsü: Prostat kanserine yakalanan yakın aile üyeleri (baba veya erkek kardeş) bulunan erkeklerde, özellikle de yakınları bu hastalığa genç yaşta yakalanmış ise risk artmaktadır.
Genler: Bazı kalıtsal genlerin prostat kanseri riskini arttırdığını ortaya konulsa da bunlar muhtemelen genel vakaların yalnızca küçük bir bölümünü oluşturmaktadır.
Beslenme Şekli: Prostat kanserinde beslenme şeklinin kesin rolü açık değildir. Kırmızı et veya yağlı süt ürünlerini çok tüketenlerde prostat kanserine yakalanma olasılığı daha yüksek görünmektedir (14).
2.2.4.PROSTAT KANSERİNDE KLİNİK BULGULAR
Prostat kanseri erken dönemde çoğunlukla hiçbir semptoma yol açmaz. Semptomların varlığı sıklıkla lokal ileri ya da metastatik hastalığa işaret eder. Kanserlerin %75 - 80 oranında periferik zondan, %15 - 20 oranında transizyonel zondan geliştiği göz önünde bulundurulduğunda kansere bağlı obstrüksiyon bulgularının erken evrede görülmesi beklenmez.
BPH, prostatit gibi hastalıklarda tanımlanan ve prostatizm olarak bilinen dizüri, artmış idrar sıklığı, düşük idrar kalibrasyonu ve idrar retansiyonu ile karakterize mesane çıkış obstrüksiyonuna bağlı semptomlar en sık bulgudur. Hematüri, ateş, hematospermi ise lokal invazyonu ve uzak metastazları işaret eden daha nadir bulgulardır. En sık metastaz iskelet sistemine olmakla birlikte özellikle ileri evrede akciğer, karaciğer ve böbrek metastazı da görülür (62).
10 2.3. PROSTAT KANSERİNDE TANI YÖNTEMLERİ
Parmakla rektal muayene, serum PSA seviyesi ölçümü ve transrektal USG prostat kanserinin değerlendirilmesinde ilk basamağı oluşturmaktadır (15). Ancak bu yöntemler yeterli duyarlılık ve özgüllükte değildir. Tanı TRUS eşliğinde elde olunan prostat biyopsisinde veya cerrahi örneklerde karsinomun gösterilmesi ile konur.
2.3.1. Parmakla Rektal Muayene (Rektal Tuşe):
Tanıda ilk basamaktır ve mutlaka yapılmalıdır. Bu yöntem ile prostat bezinin büyüklüğü, şekli, sertliği kontrol edilir. PRM; özellikle kanserlerin büyük oranda periferik zondan kaynaklandığı düşünüldüğünde kanserlerin tanısında önemli yer tutar. PRM ile şüpheli bir sertlik hissedilmesi, nodül bulunması, yüzey düzensizlikleri, prostatın normal şeklinde bozulma ve asimetri olması prostat kanserinden şüphelendiren değişikliklerdir. Bu bulgular saptanan olgularda PSA değeri dikkate alınmaksızın biyopsi yapılmalıdır (16). Çünkü prostat kanseri saptanan hastalarda %20 - 25’e varan oranda serum total PSA değeri <4 ng/ml olarak saptanmıştır (17, 27). Parmakla rektal muayenenin duyarlılığını sınırlayan en önemli özelliği küçük boyutlu ve özellikle transizyonel zonda yerleşen tümörlerdir.
2.3.2.Prostat Spesifik Antijen (PSA):
Prostat kanserinin taraması, tedaviye cevabın belirlenmesi ve hastalığın izleminde kullanılan en yararlı serum tümör belirleyicisidir. Test ucuz olup kolay uygulanabilir ve belirli derecede standardize edilmiştir. Prostat spesifik antijen (PSA) 19. kromozomun kısa kolunda lokalize (19q13,4) insan doku kallikrein ailesinden bir serin proteazdır. PSA (hK-3) androjen regülasyonu altında primer olarak prostat asiner hücreleri ve duktal epitelinden eksprese olmaktadır (18, 19). Fizyolojik görevi seminal koagulumun likefaksiyonudur (20). Semende serumdan yaklaşık 100 kat daha fazla bulunur (18, 19).
11
Serum PSA yükselmesi prostatik doku bütünlüğünün bozulması sonucu prostattan kana karışan PSA nedeniyle gerçekleşmektedir. Bu durum prostat kanserinde ve diğer prostat patolojilerinde (prostatit, BPH) görülebileceği gibi çeşitli prostat manüplasyonları da bu duruma sebep olabilir (21). PSA ile ilgili en önemli sorun kanser spesifik değil, organ spesifik olmasıdır. Özgüllüğü yetersizdir (22).
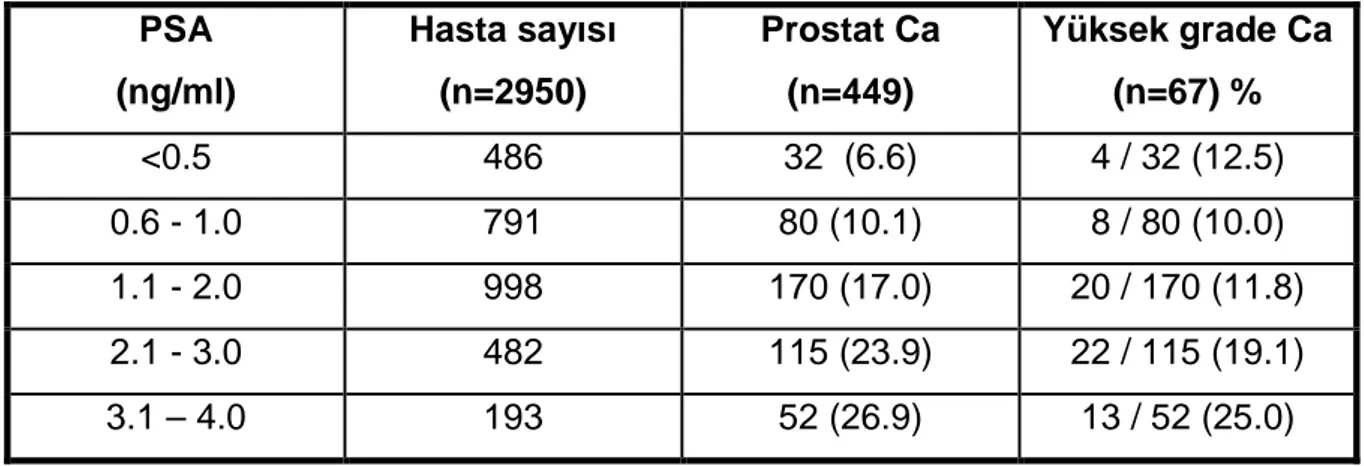
PSA ilk kez 1980’lerin sonunda prostat kanseri tanısında kullanılmaya başlanmıştır (23, 24). PSA prostat kanseri izleminde kullanım için Amerikan Gıda ve İlaç Dairesi (FDA) onayını 1986 yılında almıştır. 1990‘lı yılların başında prostat kanseri tanısı icin 4 ng/ml değeri sınır değer olarak kabul görmeye başlamış ve bu değer aynı zamanda parmakla rektal muayenesi normal olan erkeklerde prostat biyopsi endikasyonu içinde sınır olarak değerlendirilmiştir (25, 26). Ancak daha sonra PSA eşik değerinin düşürülmesi ile çalışmalar yayınlanmaya başlamıştır. Catalona ve arkadaşları PSA değeri 2,6 - 4,0 ng/ml olan ve parmakla rektal muayene bulguları tamamen normal olan hastalarda %22 oranında kanser saptamışlardır (27). Bu konuda gündem yaratan çalışmalardan en önemlisi Prostate Cancer Prevention Trial (PCPT) olup bu çalışmada 0,5 ng/ml’den düşük değerlerde bile kanser prevalansının %6,6 olduğu, 4 ng/ml değerinin altında ise %15,2 oranında klinik önemli kanser saptanabileceği gösterilmiştir (28). Saptanan kanserlerin patolojik özelliklerine bakıldığında çoğu düşük dereceli olmakla birlikte azımsanmayacak oranda yüksek dereceli kanser varlığı da saptanmıştır (28). PCPT ile ilgili vurgulanması gereken en önemli nokta bir hastada prostat kanseri yok denecek eşik PSA değerinin olmadığı ancak PSA değeri arttıkça kanser saptama (özellikle de yüksek dereceli kanser) oranının arttığıdır (28, 29).
12
Tablo 2: Prostate Cancer Prevention Trial (PCPT) çalışmasında PSA değerlerine göre kanser saptama oranları.
Prostat biyopsisi için PSA eşik değerinin düşürülmesi ile ilgili en önemli eleştiri hastalarda fazladan tanı ve tedavi yapıldığı şeklindedir (30). Bu konuda çok sayıda karşıt
görüş de bulunmaktadır (31, 32). Prostat kanseri tanısında PSA eşik değerinin düşürülmesine ve bunun getireceği sonuçlara yönelik tartışmalar devam etmekle birlikle henüz bir görüş birliğine varılamamıştır. Günümüzde özellikle ara PSA değerlerinde (genellikle 4-10 ng/ml) PSA testinin güvenilirliğini desteklemek için yaşa özgü PSA, PSA dansitesi, yıllık PSA artış hızı, serbest PSA ve kompleks PSA ölçümü gibi bazı modifikasyonlar tanımlanmıştır. Fikir birliğine ulaşılmamakla birlikte bazı merkezlerde bu uygulamalar günlük kullanımda yer almaktadır.
2.3.3. Prostat Biyopsisi
Ultrason eşliğinde alınan biyopsi örneklerinin histopatolojik değerlendirilmesi prostat kanseri tanısında altın standart yöntemdir. Antibiyotik profilaksisi ile komplikasyon riskini düşürerek çok sayıda örnek almak mümkündür. Hodge ve arkadaşlarının tanımladığı ilk standart yöntem, parasagittal düzlemin her iki tarafından sırasıyla taban, orta ve apeks bölgelerinden altılı biyopsi (sektant) alınmasıdır (36).
Daha sonraları prostat kanserlerinin çoğunun periferik zonun (PZ) posterolateral bölümünde, özellikle ‘ön boynuz’ denilen periferik zon ventro-lateral bölümünde ve
PSA (ng/ml) Hasta sayısı (n=2950) Prostat Ca (n=449) Yüksek grade Ca (n=67) % <0.5 486 32 (6.6) 4 / 32 (12.5) 0.6 - 1.0 791 80 (10.1) 8 / 80 (10.0) 1.1 - 2.0 998 170 (17.0) 20 / 170 (11.8) 2.1 - 3.0 482 115 (23.9) 22 / 115 (19.1) 3.1 – 4.0 193 52 (26.9) 13 / 52 (25.0)
13
apekste orta hatta yakın yerleşimli olduğu ortaya konulmuştur (37, 38). Bu çalışmalarda ayrıca transizyonel zon (TZ) kanserlerinin genellikle küçük hacimli olduğu (<0,5 cm3), orta hatta ve en uzak anterior bölge yerleşimli oldukları gösterilmiştir. Bu nedenle laterale yönlendirilen biyopsiler ile yanlış negatiflik oranı azalacaktır. Prospektif randomize çalışmalarda standart altı kadranlı protokole lateral periferik biyopsilerin eklenmesi ile tanı başarısı %14 -35 oranında artmaktadır (39).
Prostat kanserini yakalamak için ideal biyopsi kor sayısı tartışmalıdır. Presti ve arkadaşları 12 kadran biyopsiyi altın standart (%100 kanseri yakaladığını) kabul edip, klasik sektant biyopsi ile %78, laterale kaydırılmış sekiz kadran biyopsi ile %92, 10 kadran biyopsi ile %96 oranında kanser saptandığını ve ideal protokolun en az 10 kor olması gerektiğini belirtmişler (40)
Eskew ve arkadaşları 13 ile 18 biyopsi aldıkları yöntem ile standart altı odaklı biyopsilere göre %35 daha fazla kanser yakalamıştır (41). 12’den fazla kor sayısının belirgin tanısal katkı sağladığının gösterilemediğini belirten yayınlar da mevcuttur (42). Alınması gereken kor sayısını belirlemede prostat volümü de göz önünde bulundurulmalıdır. Ayrıca kanserlerin büyük çoğunluğunun da yanlamasına altı odaklı biyopsilerde yer alan mid bez uzak / yan bölgesinde saptanması da biyopsilerin yönünün de en az örneklenen odak sayısı kadar önemli olduğunu göstermektedir.
Sonuç olarak; prostatın lateral bölgelerine yoğunlaşan ve 10-12 kor alınan biyopsi protokolleri günümüzde kabul gören yaklaşımdır. İlk biyopsinin kanser açısından negatif gelmesi ve kanser şüphesinin devamı durumunda tekrar biyopsi yapmak gerekli olabilir. İlk biyopsisi negatif olanlarda ikinci biyopsilerinde %10-35 oranında kanser yakalanabilir (43, 44).
2.4. PROSTAT KANSERİNDE GLEASON SKORLAMASI
Prostat adenokarsinomunun değerlendirilmesinde en sık kullanılan sistem Gleason dereceleme sistemidir. Günümüzde prostat kanseri seyrini ön görmede en fazla kabul gören ölçüttür ve güvenilir bir evreleme sistemi olduğunu kanıtlamıştır (45, 46). Bu sistem diğer tümör patolojik evreleme sistemlerinden farklı olarak tümörün sitolojik özellikleri
14
yerine prostat dokusu içinde tümöre ait yapıların mikroskopik incelemesindeki yapısal düzenini temel almıştır.
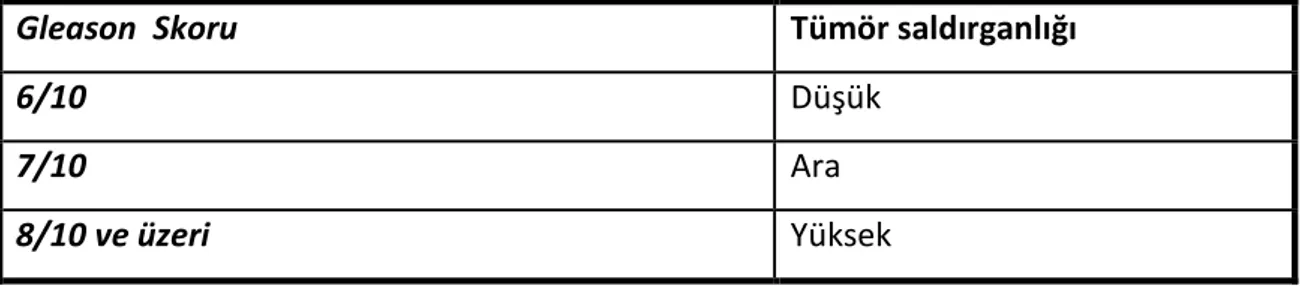
Bu sistemde tümör farklılaşması en iyiden en kötüye doğru 1’den 5‘e kadar derecelenmiştir. En iyi diferansiyasyonu 1, en kötü diferansiyasyonu 5 gösterir. Yapısal düzenlenmeye dayalı bu dereceleme sisteminde kendi içinde histolojik farklılıklar gösteren tümörlerde baskın ya da primer patern yanında ikinci sık görülen patern de kaydedilmektedir. Bulunan iki sayı toplanarak Gleason skoru elde edilir. Eğer tek patern izleniyorsa izlenen patern kendisi ile toplanır. Gleason skoru, 2’den (1+1), 10’a kadar (5+5) değişir. Skor 2’den 10’a doğru ilerledikçe tümör saldırganlığı ve beraberinde hastalığın prognozu kötüleşir.
Tablo 3: Gleason skoru ile hastalık riski ilişkisi
Gleason Skoru Tümör saldırganlığı
6/10 Düşük
7/10 Ara
8/10 ve üzeri Yüksek
2.5. PROSTAT KANSERİNDE GÖRÜNTÜLEME YÖNTEMLERİ 2.5.1. TRANSREKTAL ULTRASONOGRAFİ (TRUS)
Prostatın anatomik yapısının değerlendirilmesinde TRUS önemli bir görüntüleme yöntemidir. İnceleme seminal vezikülleri, mesane tabanını, periprostatik alanı ve rektum duvarını da kapsamalıdır. Avrupa Üroonkoloji Derneği’nin prostat kanseri klavuzuna göre TRUS’un prostat kanseri tanısındaki asıl rolü; malignite şüpheli odakları belirleyerek prostat biyopsinin doğruluğunu arttırmaktır. Bunların yanı sıra prostat volümünün hesaplanmasına yardımcı olarak obstrüktif semptomların tedavisinin planlanmasında rol alır (33). TRUS ayrıca ekstrakapsüler yayılım konusunda da bilgi verebilir.
Kanser ultrasonografide hipoekoik alan şeklinde belirir. Ancak bu prostat kanserine spesifik değildir. Bu görünüm BPH, prostatit gibi patolojilerde gözükebilir. Akın ve arkadaşları %40’dan fazla oranda izoekoik alanlarda da prostat kanseri yakalamıştır (34).
15
Lezyon boyutu küçüldükçe tümörü tespit etme başarısı iyiden iyiye düşmektedir (35). Tüm bu sebeplerden dolayı TRUS’un tümörün saptanmasındaki esas rolü örnekleme yapmak için biyopsiye önderlik etmektir.
2.5.2. BİLGİSAYARLI TOMOGRAFİ (BT)
Gelişen BT teknolojisine rağmen, BT yetersiz yumuşak doku ve kontrast çözünürlüğü nedeniyle hala prostat kanseri tespitinde etkisizdir. Prostatın komşu dokularla ilişkisini belirlemede de yetersizdir. Reaktif ya da metastatik ayırım etkinliği sınırlı kalmak ile birlikte komşu lenf nodları yanı sıra uzak organ metastazlarını tespit etmedeki yüksek başarısı nedeniyle çoğunlukla bu amaçla kullanılır.
2.5.3. MANYETİK REZONANS GÖRÜNTÜLEME (MRG) 2.5.3.1. Manyetik Rezonans Fiziği
Manyetik rezonans görüntülemenin kullandığı enerji radyo dalgalarıdır. Radyofrekans (RF) olarak isimlendirilen bu enerji, elektromanyetik radyasyon yelpazesi içerisinde yer alır. Veri kaynağı hücre sıvısı ve lipidler içerisindeki hidrojen çekirdeğidir (protonlar). Maddenin en küçük yapı taşı olarak kabul edilen atom, pozitif yüklü proton ve yüksüz nötronlardan oluşan bir çekirdek ile bunun etrafında dönen elektronlardan oluşur. Elektronlar çekirdek etrafında dönerken protonlar da kendi aksları etraflarında dönme (spin hareketi) yapar. Protonların bu hareketi vektörsel olarak tanımlanabilen yönü ve gücü olan belirgin bir manyetik alan oluşturur.
Günümüzde kullanılan MRG cihazlarında hidrojen atomu hedef alınır. Hidrojen atomu, çekirdeğinin tek protondan ibaret olması nedeniyle güçlü manyetik alana sahiptir. Ayrıca insan vücudunda çok miktarda bulunur (Vücuttaki en önemli hidrojen kaynakları su ve yağdır).
Protonlar, dokularda normalde birbirinin etkisini ortadan kaldıracak şekilde rastlantısal olarak dizilirler. Bu nedenle vücudun net manyetizasyonu sıfırdır. İncelenecek
vücut kesimi güçlü bir manyetik alan içerisine konduğunda protonları paralel ve anti
seviyesindeki) dizilen protonların sayıları, anti
protonlara göre daha fazladır. İşte bu paralel dizilim lehine olan ufak fark sayesinde dokunun net manyetik vektörü
çok az olmakla birlikte, vücudumuzda bulunan proton sayısı düşünüldüğünde paralel dizilen protonların oluşturduğu fark yine de çok fazladır. Bu fark manyetik alanımızın gücü ile orantılı olarak da artmaktadır. Böylece gücü yüksek magnetler
Güçlü manyetik alanın protonlar üzerine ikinci etkisi ise salınım hareketi yaptırmasıdır. Tek bir protonu ele alacak olursak; proton kendi etrafında dönmekle birlikte, manyetik alan vektörü (Bo) çevresinde de topacın salınm
şekilde bir hareket (presesyon) yapmaktadır (Resim 2). Protonların presesyonlarının frekansı, manyetik alanın gücü ile doğru orantılıdır.
temelidir. Protonları etkileyebilmek için önce onları manyet
presesyon yaptırmak gerekir. Ancak bu durumdaki protonlar dışarıdan gönderilen presesyon frekansındaki bir radyo dalgasıyla (RF) rezonansa girebilir.
Resim 2: Manyetik alan içerisindeki spinlerin presesyon hareketleri
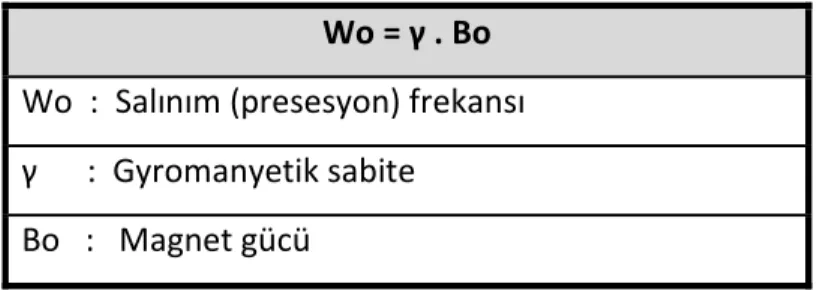
Atomların manyetik alan içerisinde salınımları Larmor (Wo) denklemiyle belirlenir (Tablo 4). Larmor denklemindeki
her atom çeşidi için farklılık göstermektedir. vücuttaki diğer atomlardan yüksektir.
16
vücut kesimi güçlü bir manyetik alan içerisine konduğunda manyetik alanın protonları paralel ve anti-paralel olarak düzene sokmasıdır. Paralel (düş
seviyesindeki) dizilen protonların sayıları, anti-paralel (yüksek enerji seviyesindeki) protonlara göre daha fazladır. İşte bu paralel dizilim lehine olan ufak fark sayesinde dokunun net manyetik vektörü (longitudinal manyetizasyon) oluşmaktadır.
çok az olmakla birlikte, vücudumuzda bulunan proton sayısı düşünüldüğünde paralel dizilen protonların oluşturduğu fark yine de çok fazladır. Bu fark manyetik alanımızın gücü ile orantılı olarak da artmaktadır. Böylece gücü yüksek magnetlerde daha iyi sinyal elde edilir.
Güçlü manyetik alanın protonlar üzerine ikinci etkisi ise salınım hareketi yaptırmasıdır. Tek bir protonu ele alacak olursak; proton kendi etrafında dönmekle birlikte, manyetik alan vektörü (Bo) çevresinde de topacın salınma hareketine benzer şekilde bir hareket (presesyon) yapmaktadır (Resim 2). Protonların presesyonlarının frekansı, manyetik alanın gücü ile doğru orantılıdır. Presesyon, manyetik rezonans olayının temelidir. Protonları etkileyebilmek için önce onları manyetik alan içerisine koyarak presesyon yaptırmak gerekir. Ancak bu durumdaki protonlar dışarıdan gönderilen presesyon frekansındaki bir radyo dalgasıyla (RF) rezonansa girebilir.
Manyetik alan içerisindeki spinlerin presesyon hareketleri
Atomların manyetik alan içerisinde salınımları Larmor (Wo) denklemiyle belirlenir (Tablo 4). Larmor denklemindeki γ (gyromanyetik sabite) değeri; vücudumuzda bulunan her atom çeşidi için farklılık göstermektedir. H1 atomunun gyromanyetik sabiti ise
ki diğer atomlardan yüksektir.
manyetik alanın ilk etkisi paralel olarak düzene sokmasıdır. Paralel (düşük enerji paralel (yüksek enerji seviyesindeki) protonlara göre daha fazladır. İşte bu paralel dizilim lehine olan ufak fark sayesinde longitudinal manyetizasyon) oluşmaktadır. Bu fark aslında çok az olmakla birlikte, vücudumuzda bulunan proton sayısı düşünüldüğünde paralel dizilen protonların oluşturduğu fark yine de çok fazladır. Bu fark manyetik alanımızın gücü ile de daha iyi sinyal elde edilir.
Güçlü manyetik alanın protonlar üzerine ikinci etkisi ise salınım hareketi yaptırmasıdır. Tek bir protonu ele alacak olursak; proton kendi etrafında dönmekle a hareketine benzer şekilde bir hareket (presesyon) yapmaktadır (Resim 2). Protonların presesyonlarının Presesyon, manyetik rezonans olayının ik alan içerisine koyarak presesyon yaptırmak gerekir. Ancak bu durumdaki protonlar dışarıdan gönderilen
Manyetik alan içerisindeki spinlerin presesyon hareketleri
Atomların manyetik alan içerisinde salınımları Larmor (Wo) denklemiyle belirlenir (gyromanyetik sabite) değeri; vücudumuzda bulunan H1 atomunun gyromanyetik sabiti ise
17
Tablo 4: Larmor denklemi
Wo = γ . Bo Wo : Salınım (presesyon) frekansı γ : Gyromanyetik sabite
Bo : Magnet gücü
Magnetin etkisi altında protonların yaptıkları salınım hareketi belli bir düzen göstermez yani aynı anda vektör uçları salınım çemberinin değişik noktalarındadır. Protonların salınım frekanslarının belli bir düzen göstermediği bu konuma ‘out-of-phase’ denmektedir. Aslında longitudinal manyetizasyonun oluşması protonların ‘out-of-phase’ konumu ile ilişkilidir.
Magnet içine koyduğumuz ve net manyetik vektörü olan dokuya RF dalgası (puls) uyguladığımızda protonlara enerji transferi olur; buna bağlı olarak bazı protonlar paralel konumdan anti-paralel konuma yer değiştirir. Aynı zamanda düzensiz biçimde salınım hareketi yapan protonlar ‘in-phase’ konumuna ulaşır. Bunun anlamı ise; protonların vektör uçlarının aynı anda, salınım çemberinin aynı noktasında olmasıdır. Burada esas dikkat edilmesi gereken nokta; daha önce dokunun net manyetik vektörü Bo vektörüne paralel iken (longitidunal manyetizasyon - Z düzlemi), RF pulsu uygulanmasından sonra net manyetik vektör (örneğin 90°) yön değiştirmektedir. Bu yeni oluşan manyetik vektöre ‘transvers manyetizasyon’ denir. Protonlar ‘in-phase’ konumunda salınım hareketine devam ettiklerine göre, dokuda yeni oluşmuş bu manyetik vektör (transvers manyetizasyon) artik X-Y düzleminde dönmektedir (Resim 3).
Resim 3:
RF pulsu ile konum değiştiren protonların eski konumlarına ulaşmasına relaksasyon denir. Bunun için ise X
(transvers manyetizasyon) ortadan kaybolması ve Bo ile paralel eski man (longitudinal manyetizasyon) tekrar oluşması gerekir. X
manyetik vektörün zamanla azalarak kaybolmasına ‘transvers relaksasyon veya T2’ denir. Transvers manyetizasyonu oluşturan esas etken, RF pulsu etkisi ile p
konumuna ulaşmalarıdır. RF pulsu kesildiğinde protonların arasındaki mevcut uyum zamanla kaybolur. Protonlar arasındaki uyum bozulduğunda (out
manyetizasyon ortadan kalkar.
Transvers manyetizasyon oluşturmak iç
mevcut longitudinal manyetizasyon tamamen ortadan kalkmaktadır. Longitudinal manyetizasyonun tekrar oluşması için anti
konumlarına geri dönmeleri gerekmektedir. Protonlar yük
enerji seviyesine geçerlerken ortama enerji verirler. Bu olay longitudinal relaksasyon ya da Spin-Lattice relaksasyon olarak bilinir.
18
Resim 3: RF pulsunun protonlara etkisi
RF pulsu ile konum değiştiren protonların eski konumlarına ulaşmasına relaksasyon denir. Bunun için ise X - Y düzleminde dönmekte olan manyetik vektörün (transvers manyetizasyon) ortadan kaybolması ve Bo ile paralel eski man
(longitudinal manyetizasyon) tekrar oluşması gerekir. X - Y düzleminde dönmekte olan manyetik vektörün zamanla azalarak kaybolmasına ‘transvers relaksasyon veya T2’ denir. Transvers manyetizasyonu oluşturan esas etken, RF pulsu etkisi ile protonların ‘in
konumuna ulaşmalarıdır. RF pulsu kesildiğinde protonların arasındaki mevcut uyum zamanla kaybolur. Protonlar arasındaki uyum bozulduğunda (out-of phase) ise transvers manyetizasyon ortadan kalkar.
Transvers manyetizasyon oluşturmak için 90° RF pulsu uyguladığımızda ortamda mevcut longitudinal manyetizasyon tamamen ortadan kalkmaktadır. Longitudinal manyetizasyonun tekrar oluşması için anti-paralel hale geçmiş olan protonların eski konumlarına geri dönmeleri gerekmektedir. Protonlar yüksek enerji seviyesinden düşük enerji seviyesine geçerlerken ortama enerji verirler. Bu olay longitudinal relaksasyon
Lattice relaksasyon olarak bilinir.
RF pulsu ile konum değiştiren protonların eski konumlarına ulaşmasına Y düzleminde dönmekte olan manyetik vektörün (transvers manyetizasyon) ortadan kaybolması ve Bo ile paralel eski manyetik vektörün Y düzleminde dönmekte olan manyetik vektörün zamanla azalarak kaybolmasına ‘transvers relaksasyon veya T2’ denir. rotonların ‘in-phase’ konumuna ulaşmalarıdır. RF pulsu kesildiğinde protonların arasındaki mevcut uyum of phase) ise transvers
in 90° RF pulsu uyguladığımızda ortamda mevcut longitudinal manyetizasyon tamamen ortadan kalkmaktadır. Longitudinal paralel hale geçmiş olan protonların eski sek enerji seviyesinden düşük enerji seviyesine geçerlerken ortama enerji verirler. Bu olay longitudinal relaksasyon - T1
19
T1 hemen her zaman için T2’den daha uzundur. T1 zamanı longitudinal relaksasyon zamanının tümünü kapsamayıp, 0 noktasından başlayarak %63 kadar longitudinal manyetizasyonun oluştuğu an arasındaki süreyi temsil etmektedir. Bunun gibi T2 de 90° RF pulsu sonrası oluşan maksimum güçteki transvers manyetizasyon anı ile bu gücün %63 oranında azaldığı an arasındaki zamanı temsil etmektedir.
Bir kesit görüntüsü elde edebilmek için dokudan çok sayıda sinyal elde etmek gerekir. Alınan tek sinyal ile kesit görüntüsü oluşturulamaz. Bir plan dâhilinde belli zaman aralıkları ve şiddette uygulanan RF pulsu demetlerine “puls sekansları” denmektedir.
Bir MR görüntüsünün elde edilişi şu şekilde özetlenebilir:
• Güçlü bir manyetik alan içerisine yerleştirilen veri kaynağımız olan protonlar manyetik alana uygun şekilde dizilir ve RF pulsu ile uyarılmaya hazır hale gelirler.
• Kesit alınacak bölgeye RF enerjisi gönderilir. Protonlar bu enerjiyi alır ve enerjinin miktarına göre konumlarından sapar.
• RF enerjisi kesilir. Protonlar eski konumlarına döner (rezonans). Bu dönüş sürecinde aldıkları enerjiyi bir sinyal şeklinde yayar. Güçlü manyetik alan etkisiyle protonlar, sinyal alan ve yayan antenler gibi davranır. MR görüntüleri işte bu sinyallerden oluşturulur.
2.5.3.2. Prostat Kanserinde MRG
Önceleri prostat kanserini şüphesi durumunda kullanılan görüntüleme yöntemlerinin başında gelen transrektal USG giderek artan oranda sadece biyopsiye önderlik etmek amacı ile kullanılmaktadır. MRG ise yüksek yumuşak doku kontrastı sayesinde prostat bezinin içyapısını ortaya çıkarmada en başarılı radyolojik yöntemdir. Anatomik ayrıntıyı ve patolojik sinyal özelliklerini göstermedeki başarısı ile MR görüntüleme prostat kanserini saptamanın yanı sıra evrelemeye de yardımcı olmaktadır. MRG son yıllarda prostat kanserinin tanısında kullanılan noninvaziv yöntemler arasında en
20
hızlı gelişen modalitedir. Dinamik MRG, difüzyon ağırlıklı inceleme, MR spektroskopi gibi farklı görüntüleme yöntemlerinin kombinasyonu ile giderek artan sıklıkta kullanılmaktadır.
MRG ayrıca PSA düzeyi yüksek, tekrarlayan negatif biyopsi sonuçları bulunan ve prostat kanseri klinik şüphesi olan olgularda tümörün anatomik lokalizasyonunu ortaya koyarak yapılacak biyopsiler ve cerrahi için yol haritası görevi görür. Fokal radyoterapik yaklaşıma da olanak tanır (96).
Son zamanlarda, MRG uyumlu düzenek ve ataçmanlar ile MRG rehberliğinde prostat biyopsisi de yapılabilmektedir; ancak MRG uyumlu sistemlerin maliyeti oldukça yüksektir. Anastasiadis ve arkadaşları tekrarlayan negatif biyopsili 27 hasta üzerinde yaptıkları çalışmada bu hastaların 15’inde prostat kanseri yaklamış; MRG rehberliğinde biyopsinin kanser saptanabilirliğini potansiyel olarak düzelttiğini saptamışlardır (97).
Prostat görüntülemede en az 1.5T gücüne sahip bir magnet gereklidir. Vücut koili ile yapılan 1.5 Tesla görüntüleme genellikle yeterli olmayıp ancak endorektail koille birlikte kullanıldığında sinyal gürültü oranları (SNR) arttırılarak yüksek rezolüsyonlu görüntüler elde edilir (47). Ancak yöntemin nispeten konforsuz, pahalı oluşu ve daha çok zaman gerektirmesi kullanımda dezavantaj oluşturmaktadır. Ayrıca ağır hemoroid varlığı, inflamatuar barsak hastalığı, geçirilmiş rektum cerrahisi rölatif kontrendikasyon oluşturmaktadır. 3T MRG ile SNR artışı sayesinde vücut koili ile inceleme gerçekleştirilebilir. 3T ile yapılan bazı çalışmalarda pelvik sarmal ile endorektal sarmal kullanımının duyarlılık ve özgüllük değerlerinde birbirine yakın sonuçlar bildirilmiştir (98, 99). Ancak Hejimink ve arkadaşlarının 3T, Fütterer ve arkadaşlarının 1.5T MRG ile pelvik sarmal ve endorektal sarmal kullanarak yaptıkları karşılaştırmalı çalışmada prostat kanserinin lokalizasyonunu saptama performansı ve imaj kalitesi, endorektal sarmal ile daha yüksek bulunmuştur (100, 101).
2.5.3.3. Konvansiyonel Manyetik Rezonans Görüntüleme
Prostatın konvansiyonel MR görüntülemesi T1 ve T2 ağırlıklı sekanslardan oluşur. T1 ağırlıklı görüntülerde, prostat homojen hafif düşük veya izointens sinyallerden oluşur
21
ve zonal anatomi ayırdedilemez. Hemorajinin kendisi tümörü taklit edebilir. Ancak bu durumda T1A görüntülerdeki yüksek sinyaller bize yardımcı olur. Biyopsi ile oluşan hemoraji konvansiyonel sekansların yanı sıra dinamik MRG ve MR spektroskopi serilerini de olumsuz etkileyerek tümör tespitini zorlaştıran artefaktlara yol açabilir. Tüm bu nedenlerden dolayı biyopsi ile MR görüntüleme arasında en az 6-8 hafta süre olması önerilmektedir (55).
T2A serilerde prostatın zonal anotomisi en iyi şekilde görülmektedir. Tümörün belirlenmesi, lokalizasyonu ve lokal yayılımının tespitinde temel olarak T2A seriler kullanılmaktadır (48). T2A seriler periferal zonda yerleşen düşük sinyal alanlarının ve ekstrakapsüler uzanımın belirlenmesinde de kullanılır. T2A görüntülerde normal periferal zon; zengin sıvı içeriği nedeniyle yüksek sinyal intensitesindedir. Santral ve transizyonel zonu içeren santral bez stromadan zengin içeriği nedeni ile düşük sinyalli olarak izlenir. Santral bez periferik zondan cerrahi kapsül adıyla da anılan hipointens bir psödokapsül ile ayrılır. Anterior fibromusküler stroma düşük sinyal intensitesindedir. Periferal zon ise periferal zonu periprostatik dokulardan ayıranince hipointens bir rim şeklinde izlenen 2 - 3 mm kalınlığında fibromusküler bir tabaka olan gerçek kapsül ile çevrilidir.
Aksiyel imajlarda gerçek kapsülün posterolateralinde saat beş ve yedi yönlerinde yerleşen düşük sinyal intensitesinde korpus kavernozayı innerve eden sinirlerden ve Santorini venöz pleksusunun dallarından oluşan nörovasküler demet bulunur. Prostatın üzerinde yer alan veziküla seminalisler sıvıyla eş sinyal intensitesinde, simetrik tubüler yapılar olarak izlenir. Duvarları T1A ve T2A’da düşük sinyal özelliği gösteren multipl lobüllerden oluşmuştur. Duktus deferensin ampullası seminal veziküllerin medial kısmından geçen 3-4 mm kalınlığında bir çift tubüler oluşumdur. Vas deferens prostatik üretraya boşalan ejakülatuar kanalları oluşturmak için veziküla seminalisle birleşir.
T2A serilerde periferal zon kanserleri genellikle yuvarlak, düzensiz sınırlı, düşük sinyalli alanlar olarak göze çarpmaktadır. Ancak prostatit, hemoraji, BPH, tedavi sonrası değişiklikler de kanseri taklit edebilir. Hemorajiyi ayırdetmek için T1A görüntüler yardımcıdır. Santral bezin tümörlerinde ise durum daha karmaşıktır. Normal veya hipertrofik santral bezin sinyal intensitesinin tümörler ile örtüşmesi nedeniyle santral bez tümörlerin saptanması zorlaşmaktadır. Santral bez yerleşimli tümörler de sıklıkla homojen
22
hipointens sinyallerden oluşmaktadır. Sıklıkla psödokapsülü içine alır ve anterior fibromusküler stromaya doğru uzanım gösterir (49).
T2A serilerde kanserin periprostatik yağ dokusuna uzanımının ortaya konması ile kapsül dışına uzanım da tespit edilebilir (50). Nörovasküler demet asimetrisi, irregüler bez sınırları, kapsül çekintileri kapsül dışına uzanımın sekonder bulguları olarak sayılabilir (51). Seminal veziküller de tümör invazyonu açısından dikkatle incelenmelidir (52).
2.5.3.4. Dinamik Manyetik Rezonans Görüntüleme
Dinamik kontrastlı MRG inceleme, tümör anjiyogenezisini araştırmaya yönelik bir görüntüleme metodudur. Veriler doku perfüzyonunu, mikrovasküler geçirgenlik ve ekstraselüler sızıntıyı yansıtır. Neoplastik lezyonun damarlanması vasküler yatağa ve kapiller geçirgenliğe bağlıdır. Kontrast maddesinin hızlı bir şekilde uygulanmasını takiben hızlı MR tarama sekansları ile birlikte peşpeşe T1 ağırlıklı görüntüler elde edilerek yapılır. 1.5T dinamik MRG zamansal ve uzaysal çözünürlük sınırlaması nedeniyle daha başarısızdır. 3T MRG kullanımı zamansal çözünürlük artışı ile daha doğru verilerin elde edilmesini sağlar (112).
Prostatın periferal zonu intravenöz gadolinyum sonrası alınan kesitlerde homojen kontrast tutulumu gösterirken santral zonu glandüler içeriği nedeni ile heterojen kontrast tutar. Tümör ile normal doku arasındaki kanlanma farkı sayesinde tümör ise normal dokuya göre daha hızlı ve erken boyanmaktadır. Geç faz imajlarda ise hızlı kontrast yıkanması nedeniyle hipointens görünüm almaktadır (10). Bu şekilde tümör damarlanması hakkında kantitatif kintetik parametreler de elde edilebilir. Yüksek dereceli tümörlerde bu patern daha belirgin iken, küçük boyutlu ve iyi diferansiye tümörlerde kanlanma farkının azlığı nedeniyle tümörü tespit etmek bu yöntemle zorlaşmaktadır (47). Bu kontrastlanma paternleri tümörlerin yanısıra benign prostat hiperplazisinde de görülebildiğinden santral bezin değerlendirilmesini güçleştirmektedir (56). Kanser dışında periferik zonda heterojen kontrast artışına sebep olan durumlar; geçirilmiş prostatite sekonder fibrozis ve biyopsiye bağlı hemorajidir (53).
23 2.5.3.5. Difüzyon Manyetik Rezonans Görüntüleme
Moleküllerin kinetik enerjilerine bağlı olarak rastgele ve her yönde oluşan hareketlerine difüzyon denir. Temelde Brownian hareket olarak adlandırılan difüzyon, su moleküllerinin üç boyutlu ortamda yaptıkları ısı bağımlı serbest devinimdir. Su moleküllerinin hareketlerini engellemeyen ortamlarda, difüzyon her yöne eşit olur ki buna izotropik difüzyon denir. Herhangi bir kısıtlama söz konusu ise buna anizotropik difüzyon denir. Örneğin beyinde beyaz cevherde myelin kılıflar nedeni ile difüzyon sinir liflerine dik doğrultuda kısıtlanır (57).
Konvansiyonel MRG’de suyun moleküler hareketi görüntü üzerine son derece küçük bir katkıda bulunmakta iken difüzyon ağırlıklı görüntülemede güçlü manyetik gradiyentler ile hızlı sekanslar kullanılması ile görüntünün suyun difüzyonuna bağlı olması sağlanmaktadır (58). Beyinde enfarkt alanlarında oluşan sitotoksik ödem ve tümör dokularında artmış hücre yoğunluğu, su moleküllerinin diffüzyon kabiliyetini kısıtlar ve alınan sinyaller normal dokudan farklılaşır. Bu durum diffüzyon ağırlıklı görüntülemenin temel prensibini oluşturmaktadır.
2.5.3.5.1. Difüzyon Ağırlıklı İnceleme Tekniği
Difüzyon ağırlıklı görüntüler elde etmek için çok hızlı sekanslar kullanmak gerekir. Bu amaçla EPI (Echo planar imaging) ya da çok hızlı GRE (Gradient echo) sekanslar kullanılır. Kullanılacak sekansa, pulsun önüne ve arkasına olmak üzere güçleri eşit, iki adet difüzyona hassas gradient eklenir. Eksite edilen protonlar birinci gradient ile defaze, ikinci gradient ile refaze edilir. Bu süreçte protonlar hareket etmemişse defaze ve refaze olan miktar aynı olduğundan güçlü bir sinyal elde edilir. İki gradient arasında ortamdaki protonlar, hareket nedeni ile faz farkları oluşturmuşsa refaze olan miktarda azalma olur ve sinyal azalır. Difüzyonun neden olduğu sinyal kaybı şu şekilde ifade edilebilir.
Sinyal (S) = So x eksp (-bD)
24
So = difüzyon gradiyentleri olmaksızın elde edilen sinyal.
b = dokunun ağırlık faktörü. (Difüzyon duyarlılığı oluşturan gradientin gücünü, uygulama aralığını ve süresini ifade eder. )
D = dokunun difüzyon katsayısı. (Moleküllerin fiziksel özellikleri ve ısıya bağlıdır. Su gibi küçük moleküllerde yüksek iken, protein gibi büyük moleküllerde düşüktür. )
Difüzyon ağırlıklı bir görüntü elde edebilmek için uygulanan gradientler yüksek amplitüdlü olmalı ve uygulama süresi kısa olmalıdır. b değeri gradiyentin gücü ve süresini yansıtan s/mm2 cinsinden bir parametredir. b değeri arttıkça hareketli protonlardaki faz kayması ve beraberinde sinyal kaybı artar. Dolayısı ile görüntünün difüzyon duyarlılığı arttırılmak isteniyorsa b değeri arttırılmalıdır.
Klinik uygulamada genel olarak minimum b=0 mm2/sn ve maksimum b= 800-1200(genellikle 1000 mm2/sn) gibi olacak şekilde iki adet b değeri kullanılır. b=0 değerli difüzyon görüntüsü sadece T2 ağırlıklı bilgi sağlarken, b=1000 değerlerinde daha fazla difüzyon etkisi görülür (63, 64).
Dokularda ölçülen sinyal kaybı in vitro ortamdan farklı olarak yalnızca su difüzyonuna değil, intravasküler akım ve kardiyak pulsasyon gibi nedenlere bağımlıdır. Ayrıca zar ve büyük moleküller de bu hareketi kısıtladığından görünürdeki difüzyon katsayısı (ADC=Apparent Diffusion Coefficient) haritaları kullanılır. ADC’nin hesaplanabilmesi için belirli b değerlerinin (b=800-1000 s/mm2) yanında b değerinin sıfır olduğu ölçümler alınır. ADC her bir b değerine karşılık gelen sinyal oranlarının negatif logaritmasıdır (62). ADC haritası ölçülen difüzyonun mutlak değerini saptamaktadır (75, 94). Sonuçta kısıtlanmış difüzyon, ADC haritasında ise düşük sinyalli alanlar şeklinde görülmektedir.
Difüzyon görüntülerinde izlenen yüksek sinyaller hem invivo suyun difüzyonuna hem de sekansın T2 relaksasyon zamanına bağlıdır. Bu olaya T2 parlama etkisi denir. Tanımlanan sinyal artışlarının ADC haritası ile birlikte değerlendirilmesi ile bu etki saf dışı bırakılır. ADC haritası T2A etkisinden arındırılmış olup difüzyon kısıtlanması ile T2 parlama etkisini ayırt etmektedir.
25 2.5.3.5.2. Prostat Kanserinde Diffüzyon MRG
Yapılan çalışmalar prostat kanseri tanısında diffüzyon ağırlıklı görüntülemenin oldukça başarılı olduğu belirtmektedir (59, 60, 61). DAG’ın bir avantajı intravenöz kontrast madde gerektirmeyen basit uygulanabilir bir yöntem olmasıdır. Uygulanabilmesi için MRS’den daha kısa süre ve daha az teknolojik eğitim gerektirmesi yine DAG’ı diğer yöntemlere göre avantajlı kılmaktadır.
Prostat kanserinde tümörün selülaritesindeki artış hem doku içi sıvı miktarında azalmaya hem de suyun ekstraselüler ortamda ve hücre membranları arasında serbestçe dolaşımında kısıtlanmaya neden olur. Bu durum difüzyon ağırlıklı görüntülemenin temel prensibini oluşturmaktadır. ADC haritaları eşliğinde difüzyon kısıtlılığının miktarı sayısal olarak ifade edilebilir. Ancak DAG’ın da bazı limitasyonları vardır. Kullanılan (EPİ) sekansların manyetik duyarlılıktan etkilenmesi sonucu uzaysal distorsiyon ve sinyal kaybı oluşabilmektedir.
Manenti ve arkadaşları; difüzyonun her yerde eşit olmaması prensibinden yola çıkan (anizotropik difüzyon) bir görüntüleme yöntemi olan difüzyon tensör görüntüleme ile 3T MRG’de yaptıkları çalışmada kanserin uzanımı ile prostat anatomisi arasındaki ilişkiyi iyi bir şekilde göstermeyi başarmıştır (110). Ancak bu konuda daha doğru verilere sahip olmak için gelecek çalışmalara ihtiyaç vardır.
2.5.3.6. Spektroskopik Manyetik Rezonans Görüntüleme
Dokunun kimyasal bileşenlerinin kantitatif analizini sağlayan noninvaziv bir görüntüleme yöntemidir. Anatomik ve metabolik bilginin kombinasyonu birçok hastalık ve süreç hakkında bilgi sahibi olmamızı sağlar. Spektroskopik görüntülemede protonlar arasındaki ‘kimyasal şift’ etkisi kullanılarak, protonların mikroskobik çevreleri hakkında bilgi edinilmektedir (68). Bilindiği gibi nukleuslar Larmor denklemi ile tanımlanan bir frekans ile salınım hareketi yaparlar. Bir nukleusun salınım frekansı, aynı zamanda bu nukleusun kimyasal ortamına bağlıdır ve bu ortam çekirdeğin Larmor rezonans frekansında küçük bir değişiklik oluşturur. Şöyle ki; protonların çevrelerinde belli
26
seviyelerde hareket halinde bulunan negatif yüklü elektronlar protonlar üzerine “shielding” (gölgeleme) etkisi göstermekte olup, magnetin proton üzerine olan etkisini kısmen değiştirmektedir. Kabaca su ve yağ dokusunda bulunan protonlar farklı kimyasal ilişkiler içinde olduklarından, farklı ‘shielding’ etkiye maruz kalacaklar ve salınım frekansları farklı olacaktır. Bu farklılık kimyasal şift olarak bilinir. MRS’de protonlar arasındaki kimyasal şift etkisi kullanılarak, protonların mikroskobik çevreleri hakkında bilgi edinilmektedir (68, 69). Spektroskopi için kullanımı en pratik olan atom hidrojendir. Çünkü vücutta farklı kimyasal çevrelerde çok fazla miktarda bulunmaktadır ve en yüksek MR sensitivitesine sahiptir (68).
2.5.3.6.1. MR spektroskopi tekniği:
MRS dokunun biyokimyasal bileşenlerini ve bu bileşenlerin mutlak ya da göreceli miktarını x ve y eksenli bir grafik (spektrum) üzerinde göstermektedir. Bu grafiğe milyonda bir parça anlamında parts per millon (ppm) skalası denir. Spektrumdaki her yükselti bir metabolitin varlığını ve bu metabolitin ne oranda olduğu gösterir. MRS’de su ve yağ dışındaki metabolitlerin sinyallerini ölçmek amaçlanır. Bir manyetik alana RF dalgası gönderildikten sonra, protonların sinyalleri toplanırken metabolitlerin oluşturduğu farklı Larmor frekansları ve relaksasyon süreleri saptanmaktadır. Spektral grafikte su yüksek frekansta (sağda), yağ düşük frekansta (solda) olup, metabolitler ise bunların arasında yer alır.
Yükseltinin yeri metabolitin kendine özgü kimyasal ortamının MR frekansı ile farkını (kimyasal kaymayı) gösterir. Spektrumda yatay doğru Larmor frekanslarındaki değişiklikleri yani kimyasal kaymaları ppm halinde, dikey doğru ise metabolitlerin görece sinyal büyüklüğünü göstermektedir (70).Gürültü ve çözülemeyen metabolitler baz hattını oluşturur. Metabolitlerin çözünür hale gelebilmeleri ve diğer metabolitlerden ayrılabilmeleri için zemin gürültüsünden en az beş kat daha sinyal gücüne sahip olmaları gerekir. MRS’de N-asetil aspartat (NAA), kreatin / fosfokreatin (Cr/PCr), kolin (Cho), glukoz (Glu), miyoinozitol (mI), laktat (Lac), alanin (Ala), glutamat ve glutamin (Glx), sitrat ve etanol gibi biyokimyasal metabolitler spektrumda izlenebilir.
27
Manyetik alanın homojenitesi ve ana manyetik alanın gücü ne kadar fazla olursa spektrumun çözünürlüğü o kadar artar (70). Bu nedenle klinik uygulamalarda 3T cihazlarda spektrum, 1.5T cihazlara göre daha iyi olmaktadır.
MRS'de sinyaller yüksek konsantrasyonları nedeniyle başlıca su ve yağdan gelir. Eğer vokselde su ve yağ baskılanmaz ise, su ve yağ piklerinden çok daha küçük olan metabolitlere ait pikler izlenemez (Suyun konsantrasyonu diğer metabolitlerin konsantrasyonundan yaklaşık 100.000 kat fazladır). Sudan gelebilecek sinyallerin baskılanmasında en sık kullanılan yöntem CHESS (chemical shift selective excitation) yöntemidir (70, 71). Aynı yöntem yağın baskılanmasında da uygulanabilir. Yağ baskılaması ayrıca değişik yöntemler ile de sağlanabilir.
Spektrum veya spektroskopik görüntüden faydalı bilgi elde etmek için anatomik lokalizasyonun belirlenmesi gereklidir. Bu amaçla birden çok teknik tek başına ya da kombine edilerek kullanılır (3). Bunlardan en çok STEAM (Stimulated Echo Acquisition Method) ve PRESS (Point Resolved Surface Coil Spectroscopy) kullanılmaktadır (71, 72).
MRS iki şekilde elde olunabilir;
Tek voksel görüntüleme: Lokalize bir bölgede ve homojen lezyonu olan hastalara önerilir. PRESS ve STEAM, bu teknikte kullanılan sekanslardır.
Multi voksel görüntüleme: Multivoksel spektroskopi olarak bilinen CSI tekniğinde tek vokselden spektrum elde etmek için gerekli zaman diliminde birden fazla komşu vokselden de spektrum elde edilebilmektedir. Tüm bu avantajlarına karşılık CSI tekniği, çok daha fazla veriyi işlemek zorunda olması nedeni ile daha fazla süreye ve seçilmiş alan üzerinde daha homojen statik manyetik alana ihtiyaç göstermektedir.
2.5.3.6.2. MRS’de ana metabolitler ve klinik önemleri:
N-asetilaspartat (NAA): 2.02 ppm’de izlenen en belirgin piktir. NAA santral sinir sisteminde akson, nöron ve dendritlerde bulunur. NAA azalması nöronal kayıp ve aksonal hasarlanmayı gösterir (70, 72).
28
Kolin (Cho): Kolin piki 3.22 ppm'de izlenir. Hücre membran fosfolipidinin metabolizmasına katılmaktadır. Hücre sayısında, membran sentezinde ve membran yıkımında artış olduğunda kolin artar (70, 72). Aktif demiyelinizan lezyonlarda, tümörlerde, bebeklerde aktif miyelinizasyon sırasında kolinin arttığı görülür. Hepatik ensefalopatilerde ise azalır (70).
Kreatin (Cr): Kreatin piki 3.02 ppm’de görülür. Sabit bir metabolittir. Bu nedenle karşılaştırma için kullanılır.
Laktat (Lac): Spektrumda 1.33 ppm ve 4.1 ppm’de ortaya çıkmaktadır. İkinci pik su pikine çok yakın olduğundan genellikle su piki ile birlikte baskılanır. Laktat varlığı anaerobik glikozun başladığını gösterir. Normalde yoktur. İskemi, tümör ve enflamasyonda ayrıca mitokondriyal hastalıklarda laktat piki izlenir (72).
2.5.3.6.3. Prostat kanserinde MR Spektroskopi
Prostat normalde düşük miktarda kolin ve yüksek miktarda sitrat içerir. Sitrat üretimi sadece prostatik glandüler dokularla ilişkilidir ve bunun büyük kısmı periferal zondadır. Santral glandın glandüler içeriği az olduğundan, periferal zona oranla sitrat oranı düşüktür. Artan yaşla birlikte periferal zonun sitrat ve kolin içeriğinde önemli bir değişiklik gözlenmez. Ancak BPH olgularında; stromal nodüllerin sitrat seviyesi glandüler nodüllerden düşüktür ki bu bazen kafa karıştırıcı olabilmektedir (105)
Normalde prostat epitel hücreleri yüksek miktarda çinko (vücutta en yüksek düzeyde) içerir. Çinko; sitrat okside edici enzim olan akonitaz’ı inhibe eder ve sitrat birikimine neden olur. Prostat kanseri hücrelerinde ise çinko düzeyi düşük olduğundan artmış akonitaz aktivitesi ile sitrat düşer. Prostat kanserinde diğer kanserlerde olduğu gibi artmış hücre döngüsü ile ilişkili olarak kolin konsantrasyonu artarken, sitrat konsantrasyonu azalmakta, ancak kreatin düzeyinde değişiklik görülmemektedir (104). 1.5T sisteminde kolin ile kreatin piki ayırt edilemediğinden, ölçülen oran gerçekte kolin ve kreatininin sitrata oranıdır (cho+cre/cit). 3T ve daha yüksek magnetlerde elde olunan spektroskopik incelemeler ile SNR ve uzaysal çözünürlükte artış sağlanır. Böylece daha küçük voksel boyutları elde edilebilir ve metabolit pikleri daha doğru ayrılır (81). Ayrıca
29
kolin, sitrat ve kreatin dışında prostat kanserinde düşük seviye izlenen poliaminler gibi diğer metabolitlerin de değerlendirilmesine olanak sağlar. Yapılan çalışmalar MRS’nin MR görüntülemeye dâhil edilmesinin tümör tespit oranlarını arttırdığını göstermektedir (73, 75). Ayrıca ekstrakapsüler uzanım ve radyoterapi sonrası olası nüks tahmininde yardımcı olabilir (77, 80).
MRS’de akut prostatit; prostat kanseri ile benzer bulguları verebilir. Ayrıca santral bez yerleşimli kanserlerin tespiti; artan yaş ile birlikte santral bezin metabolik olarak daha heterojen hale gelmesi nedeniyle zorlaşır (76, 105). Bu açıdan da dikkatli olmak gereklidir.
30
BÖLÜM III
GEREÇ VE YÖNTEM
Ağustos 2012 ile Temmuz 2014 arasında Ege Üniversitesi Tıp Fakültesi Radyoloji Anabilim Dalı’nda prostata yönelik multiparametrik MR görüntüleme yapılan yaşları 52 ile 71 arasında değişen prostat kanseri tanısı almış 30 olgunun radyolojik bulguları retrospektif olarak değerlendirildi. Radikal prostatektomi ile elde edilen histopatolojik sonuçlar radyolojik bulgular ile karşılaştırıldı. Biyopsi sonrası oluşan hemorajiler radyolojik değerlendirmede karışıklığa yol açtığından olgulara en az 6 hafta önce biyopsi yapılmış olması göz önünde bulunduruldu.
3.1. MR Görüntüleme Tekniği
Multiparametrik MRG incelemeleri 3T MR sistemi (Verio, Siemens Healthcare, Erlangen, Almanya) ile gerçekleştirildi. Görüntüleme öncesi olgulara rektal yoldan hastaların kendi kendine uygulayabildiği lavman (Libalaks lavman 10 g tüp) tetkikten yaklaşık iki saat önce uygulandı. Prostat ve seminal veziküllerin değerlendirmesini zorlaştırdığından olguların mesanesinin aşırı dolu olmamasına dikkat edildi. İnceleme endorektal koil kullanılmadan 8 kanallı faz dizilimli yüzey koili ile yapıldı. Tetkik başlangıcında ve ortasında toplamda 2 kez antiperistaltik ajan (Buscopan ampul 20 mg/ml, Boehringer Ingelheim, Almanya) uygulandı.
T2 aksiyel – koronal - sagittal içeren konvansiyonel sekanslardan sonra incelemelere difüzyon ağırlıklı görüntüleme, MR spektroskopi, Dinamik MRG serileri eklendi. Difüzyon ağırlıklı görüntülemeler 3 farklı b değeri kullanılarak (b=0 - 100 - 800 s/mm2) toplamda 3 adet aksiyal plan eko-planar görüntüleme (EPI) ile MR spektroskopi ise multivoksel tekniği ile elde olundu. Dinamik prostat görüntülemesi; antekubital ven yoluyla 0.15 mL/kg kontrast maddenin, otomatik enjektör yardımıyla bolus enjeksiyonu sonrası gerçekleştirildi.