T.C.
DİCLE ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ
DOKSORUBİSİN KARDİOTOKSİSİTESİ ÜZERİNE
NECROSTATİN-1’İN KORUYUCU ETKİLERİNİN
ARAŞTIRILMASI
DOKTORA TEZİ
Uz.Ecz. ZEYNEP ERDOĞMUŞ ÖZGEN
DANIŞMAN
PROF. DR. MERAL ERDİNÇ
TIBBİ FARMAKOLOJİ ANABİLİM DALI DİYARBAKIR 2015
T.C.
DİCLE ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ
DOKSORUBİSİN KARDİOTOKSİSİTESİ ÜZERİNE
NECROSTATİN-1’İN KORUYUCU ETKİLERİNİN
ARAŞTIRILMASI
DOKTORA TEZİ
Uz.Ecz. ZEYNEP ERDOĞMUŞ ÖZGEN
DANIŞMAN
PROF. DR. MERAL ERDİNÇ
TIBBİ FARMAKOLOJİ ANABİLİM DALI DİYARBAKIR 2015
Bu tez, Dicle Üniversitesi Bilimsel Araştırma Projeleri komisyonu tarafından 13 TF- 65 nolu Doktora proje numarası ile desteklenmiştir.
i
DİCLE ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ
" Doksorubisin Kardiotoksisitesi Üzerine Necrostatin-1’in Koruyucu Etkilerinin araştırılması" isimli doktora tezi 14/12/2015 tarihinde tarafımızdan değerlendirilerek başarılı bulunmuştur.
Tez Danışmanı: Prof. Dr. Meral Erdinç Tezi Teslim Eden: Uz.Ecz. Zeynep Erdoğmuş Özgen
Jüri Üyesinin
3
Başkan: Prof. Dr. Meral ERDİNÇ Dicle Ü. Tıp Fakültesi
Üye: Prof. Dr. Nuri İhsan KALYONCU Üye: Doç. Dr. Hasan AKKOÇ
Üye: Doç. Dr. Cahit NACİTARHAN Üye: Yrd. Doç. Dr. İlker KELLE
Karadeniz Teknik Ü. Tıp Fakültesi Dicle Ü. Tıp Fakültesi
Akdeniz Ü.Tıp Fakültesi Dicle Ü.Tıp Fakültesi
5
Yukarıdaki imzalar tasdik olunur.
/ /2015
Prof. Dr.Ali CEYLAN
vi
TEŞEKKÜR
Doktora eğitimim süresince bilgisini ve ilgisini esirgemeyen, her konuda destek olan değerli hocam Sayın Prof. Dr. Meral Erdinç' e,
Tez çalışmamın deneysel ve istatistiksel değerlendirme aşamasındaki yardımlarından ve desteğinden dolayı Sayın Doç. Dr. Hasan Akkoç'a ve Yrd. Doç. Dr. İlker Kelle'ye,
Tez çalışmamın özellikle genetik analiz kısmında yardımını ve desteğini esirgemeyen arkadaşım Arş. Gör. Meryem Şeyda Kaya'ya, destek ve yardımını aldığım arkadaşım Uz. Ecz. Emre Uyar'a,
Çalışmama maddi destek sunan Dicle Üniversitesi Bilimsel Araştırma Projeleri Koordinatörlüğü'ne,
Ve her zaman yanımda olan canım aileme ve eşime sonsuz teşekkürlerimi sunarım.
vii
İÇİNDEKİLER DİZİNİ
1. Ön Sayfalar Sayfa Sayfa
1.1. Kapak 1.2. İç Kapak 1.3. Onay Sayfası...i 1.4.Teşekkür Sayfası...ii 1.5. İçindekiler Dizini...iii 1.6. Şekiller Dizini...v 1.7. Tablolar Dizini...vii
1.8. Simgeler ve Kısaltmalar Dizini...viii
2. Özet Sayfalar Türkçe Özet...ix İngilizce Özet...xi 3. Tez Metni 3.1. Giriş ve Amaç...1 3.2. Genel Bilgiler...3 3.2.1. Hücre Ölümü...3 3.2.1.1. Apoptozis...3
3.2.1.1.1. Apoptozis Görülen Durumlar...4
3.2.1.1.2. Apoptozisin Düzenlenmesi...4
3.2.1.1.3. Apoptozis Mekanizması...6
3.2.1.2. Nekroz...………...9
3.2.1.2.1 Nekroz Mekanizması...10
3.2.1.2.2. Apoptozis ve Nekroz Arasındaki Farklar...12
3.2.1.3. Nekroptozis...13
3.2.1.3.1. Nekroptozis Mekanizması...13
3.2.2. Antrasiklinler...15
3.2.2.1. Antrasiklin Kardiotoksisitesinin Patogenezi...…………15
3.2.3. Doksorubisin...17
3.2.3.1. Doksorubisin Kardiotoksisitesi...………18
viii
3.2.3.2.Doksorubisin'e Bağlı Kardiyomiyopatinin
Moleküler Mekanizması...………...19
3.2.4. Antrasiklin Kardiotoksisitesinin Önlenmesi...……….23
3.2.4.1. Necrostatin-1...24
3.3. Gereç ve Yöntem...26
3.3.1. Gereç...26
3.3.1.1. Kullanılan Araç ve Gereçler... 26
3.3.1.2. Kullanılan Deney Hayvanları...26
3.3.1.3. Kullanılan Kimyasal Maddeler………...26
3.3.2. Yöntem……….27 3.3.2.1. Farmakolojik İnceleme………...27 3.3.2.2. Histopatolojik İnceleme………..30 3.3.2.3. Biyokimyasal İnceleme………...30 3.3.2.4. Genetik İnceleme………...30 3.3.3. İstatistiksel Değerlendirme………...31 3.4. Bulgular………32
3.4.1. Farmakolojik ve Biyokimyasal Bulgular………...32
3.4.2. Histopatolojik Bulgular………..36 3.4.3. Genetik Bulgular………....41 3.5. Tartışma………...43 3.6. Sonuç ve Öneriler……….48 3.7. Kaynaklar ………...49 3.8. Özgeçmiş……….58
ix
ŞEKİLLER DİZİNİ
Sayfa
Şekil 1: Apoptozisin gerçekleşme yolları………..7
Şekil 2: Apoptozis Aktivasyonu-İnstrinsik yol………...8
Şekil 3: Apoptozis Ativasyonu -Ekstrinsik yol………...9
Şekil 4: Nekroz Sinyal Yolakları………..11
Şekil 5: Nekrotik Yolağın Sinyal Bileşenleri………11
Şekil 6: Apoptozis-Nekroptozis………14
Şekil 7: Antrasiklin türevi bileşiklerin yapısında bulunan kinon gruplanın semikinon radikaline indirgenmesi………..19
Şekil 8:Kardiyomiyositlerde Doksorubisin ile çeşitli apoptik yolaklar arasındaki etkileşim………23
Şekil 9: Necrostatin-1'in Etki Mekanizması………...25
Şekil 10: Langendorff Sistemi………..29
Şekil 11:Bütün gruplarda, Kalp Atım Hızı (atım/dk)………...33
Şekil 12: Bütün gruplarda, Perfüzyon basıncı (mmHg)………33
Şekil 13: Bütün gruplarda, Sol Ventrikül Gelişen Basıncı (mmHg)…….34
Şekil 14: Bütün gruplarda ölçülen sol ventrikül kasılma hızı (mmHg/sn) ……….34
Şekil 15: Bütün gruplarda ölçülen sol ventrikül gevşeme hızı (mmHg/sn) ……….35
Şekil 16: Bütün gruplarda ölçülen Malondialdehit(MDA) miktarı (nmol/gram doku)………..35
Şekil 17: Kontrol grubu miyokardiyal kas lifleri arasında kapiller ve interstisyel bağ dokusu ………....37
Şekil 18: Kontrol grubu; Oval, ökromatik ve santral yerleşimli nukleus, striasyon gösteren miyokardiyal kas lifleri………...37
Şekil 19: Dox grubu; miyokardiumda yaygın hemoraji ve ödem……… 38
Şekil 20: Dox grubu; Kas liflerinde hyalinizasyon, fokal ödem ve farklı şekiller gösteren kas hücre çekirdekleri………...38
x
Şekil 21: Dox grubu: miyokardta oluşan fibrozis………. 39 Şekil 22:Nec-1 grubu; Miyokardiumun longitudinal kesitinde santral
yerleşimli oval ökromatik nukleus ve normal histolojik yapıda interkalat diskler………39
Şekil 23:Nec-1 grubu; Miyokard kas lifleri arasında normal kapiller
görünüm……….40
Şekil 24:Dox+nec-1 grubu; Miyokard enine kesitinde fokal interstisyel
ödem, piknotik nukleus ve küçük vakuolümsü yapılar……….40
Şekil 25: Dox+Nec-1 grubu; Hafif interstisyel ödem dışında normal
histolojik yapı………41
Şekil 26: bcl-2, bax, casp-3,nox-2 genlerinin (%aktin cinsinden)
xi
TABLOLAR DİZİNİ
Sayfa Tablo 1: Apoptozis ve Nekroz Arasındaki Farklar………..12 Tablo 2: Gruplara (n=8)ait perfüzyon basıncı, Kalp Atım Hızı (KAH),
LV(dP/dtmax) ve LV(dP/dtmin) verileri………...32
Tablo 3: Gruplara (n=8) ait bcl-2, bax, caspase-3 ve
xii
SİMGELER VE KISALTMALAR DİZİNİ AIF: Apoptozis İndükleyici Faktör
Ca++ : Kalsiyum İyonu
cIAPs: Hücresel Apoptozis Proteinleri İnhibitörü
DNA: Deoksi Ribo Nükleik Asit
Dox: Doksorubisin
H2O2: Hidrojen Peroksit
i.p: İntraperitoneal
i.v: İntravenöz
KAH: Kalp Atım Hızı
LV(dP/dt)max: Sol Ventrikül Kasılma Hızı
LV(dP/dt)min: Sol Ventrikül Gevşeme Hızı
LVDP: Sol Ventrikül Gelişen Basıncı
MDA: Malondialdehit
MLKL: Mixed Lineage Kinase Domain-like (Karışık Lineaj Kinaz Benzeri Protein)
MPTP: Mitokondriyel Transfer Poru
NADPH: Nikotinamid Adenin Dinükleotit Fosfat
Nec-1: Nekrostatin-1
O2-: Süperoksit Anyon Radikali
OH. : Hidroksil Radikali
PARP: Poli-ADP-Riboz Proteaz
PB: Perfüzyon Basıncı
RIP: Reseptör Etkileşimli Protein
RIPK: Reseptör Etkileşimli Protein Kinaz
RNA: Ribo Nükleik Asit
ROS: Reaktif Oksijen Türleri
Sit-c: Sitokrom-c
SOD: Süperoksit Dismutaz
TNF: Tümör Nekroz Faktör
TNFR-1: Tümör Nekroz Faktör Reseptörü-1
xiii
ÖZET
Antineoplastik ilaç olan Doksorubisin’in klinik kullanımını kısıtlayan kardiotoksik yan etkisi bulunmaktadır. Bu etkiden, serbest radikallere bağlı gelişen direkt hücresel hasarın ve apoptozisin sorumlu olduğu gösterilmiştir. Son yıllarda bir başka programlı hücre ölüm yolağı olan nekroptozisin, hücre hasarı ile sonuçlanan çeşitli patolojik durumlarda rolü olduğu ortaya konulmuştur. Apoptozis ve nekroptozis oluşumunu tetikleyen başlangıç sinyalleri ortak olmakla beraber bu yollardan hangisinin aktive olacağı, bazı düzenleyici moleküllerin varlığı ve kaspaz enzimlerinin inhibisyonu ile belirlenmektedir.
Bu çalışmada nekroptozis inhibitörü olan Necrostatin-1 (Nec-1)'in doksorubisin kardiotoksisitesi üzerine koruyucu etkisi araştırıldı. Ayrıca bu toksisitede rolü olduğu bilinen apoptozis yolağındaki caspase-3, bcl-2, bax, ve nox-2 gibi proteinlerin gen ekspresyon düzeylerinin Nec-1 ile nasıl etkilendiği incelendi.
Bu amaçla kullanılan erkek Sprague-Dawley ratlar dört gruba ayrıldı. Gruplar; 1-Kontrol, 2-Dox: Doksorubisin (10 mg/kg, i,p, tek doz), 3-Necrostatin-1 (1,65 mg/kg, i.p 7gün)+Doksorubisin (tek doz 10 mg/kg, i.p), 4-sadece Necrostatin-1 (1,65 mg/kg, i.p, 7gün) olarak tanımlandı. Bütün gruplarda izole edilen kalpler Langendorff sisteminde perfüze edilerek, perfüzyon basıncı (PB), kalp atım hızı (KAH) ve sol ventrikül gelişen basıncı (LVDP) kaydedildi. Ayrıca kalbin kontraksiyon gücünü gösteren sol ventrikül kasılma hızı ve gevşeme hızını ifade eden LV(dP/dt)max ve LV(dP/dt)min kaydedildi. Tek doz Dox verilen grupta kontrol grubuna göre PB’nın istatistiksel olarak anlamlı şekilde arttığı (p<0.001); KAH, LVDP, LV(dP/dt)max ve LV(dP/dt)min değerlerinin ise anlamlı olarak azaldığı (p<0.001) görüldü. Buna karşılık Dox+Nec-1 grubunda ise Dox grubuna göre PB değerlerinin istatistiksel olarak anlamlı şekilde azaldığı (p<0.05); KAH, LVDP, LV(dP/dt)max ve LV(dP/dt)min değerlerinin ise anlamlı olarak arttığı (p<0.05) görüldü.
xiv
Ayrıca oksidatif stresin göstergesi olarak Malondialdehit (MDA) konsantrasyonu ölçüldü ve Dox grubunda kontrol grubuna göre anlamlı olarak arttığı (p< 0.001), artan MDA değerinin Dox+Nec-1 grubunda Dox grubuna göre anlamlı olarak azaldığı gözlendi (p< 0.05). Histolojik deneyler sonucunda; kalp dokusunda Dox ile oluşan hasarın Nec-1 ile korunduğu gözlendi. Genetik analiz amacıyla dokularda caspase-3, bax, bcl-2, Nox-2’nin gen ekspresyon seviyeleri ölçüldüğünde; Bcl-2 seviyesi, Dox grubunda kontrol grubuna göre anlamlı olarak azalırken (p<0.001), Dox grubundaki azalmanın Dox+Nec-1 grubunda anlamlı olarak arttığı görüldü (p<0.001). Bax, casp-3 ve Nox-2 seviyeleri ise Dox grubunda kontrol grubuna göre anlamlı olarak artarken (p<0.001), Dox grubundaki artışın Dox+Nec-1 grubunda anlamlı olarak azaldığı görüldü (bax; p<0.05, casp-3 ve Nox-2: p<0.001).
Sonuç olarak doksorubisin ile oluşan kardiotoksisitede Nec-1’in koruyucu etkilerinin olduğu görülmüştür.
Anahtar kelimeler: Doksorubisin, Kardiotoksisite, Nekroptozis,
Necrostatin-1, Apoptozis, casp-3, bax, bcl-2, Nox-2
xv
The clinical use of doxorubicin-an antineoplastic drug- is limited by its cardiotoxic side effects. It is shown that free oxgen radicals induced direct cellular injury and apoptosis are responsible for this toxic side effects. Recently another programmed cell death pathway, named necroptosis is also reported to be cause of cellular injury resulted in several pathological conditions. The upstream signaling elements that are triggered by death receptors are shared by both apoptotic and necroptotic pathways. Presence of some regulatory molecules and inhibition of caspases determine the route which will be activated.
This study was performed to investigate the protective effects of necrostatin-1 (Nec-1) -an inhibitor of necrosis- on doxorubicin induced cardiotoxicity and also on expression levels of genes casp-3, bcl-2, bax, Nox-2 which are involved in apoptotic pathway.
Male Sprague-Dawley rats were divided into four groups. Groups were defined as; 1:control, 2:Dox: Doxorubicin (a single dose of 10 mg/kg, i,p), 3:Doxorubicin (a single dose of 10 mg/kg, i,p) + Necrostatin-1 (1,65 mg/kg, i.p, for seven days), 4:only Nec-1 (1,65 mg/kg, i.p, 7 days) injected group. In all groups, isolated hearts were perfused by Langendorff system. Perfusion pressure (PP), left ventricular developed pressure (LVDP) and heart rate per minute (HR), LV( dP/dt)max and LV( dP/dt)min which shows systole and diastole rate were recorded. PP significantly increased (p<0.001) in Dox group according to control group; HR, LVDP, LV(dP/dt)max and LV (dP/dt)min significantly decreased (p<0.001). However in Dox+Nec-1 group according to Dox group; perfusion pressure significantly decreased (p<0.05). HR, LVDP, LV(dP/dt)max and LV(dP/dt)min values are significantly increased (p<0.05).
As an indicator of oxidative stres malondialdehide's (MDA) levels were measured and in Dox group according to control group MDA values were significantly increased (p< 0.001), in Dox+Nec-1 group according to Dox group MDA values were significantly decreased (p< 0.05). In histological analysis; in cardiac tissue of rats Nec-1 reduced the cellular injury induced by doxorubicin. Expression level of bcl-2 was significantly
xvi
decreased in Dox group according to control group (p<0.001), in Dox+Nec-1 group according to Dox group was significantly increased (p< 0.001).
Expression levels of Bax, casp-3 and Nox-2 in Dox group according to control group were significantly increased (p<0.001), in Dox+Nec-1 group according to Dox group were significantly decreased (bax; p<0.05, casp-3 and Nox-2: p<0.001).
It is concluded that Nec-1 has protective effects on cardiotoxicity induced by doxorubicin.
Keywords: Doxorubicin, Cardiotoxicity, Necroptosis, Necrostatin-1, Apoptosis, casp-3, bax, bcl-2, Nox-2
1. GİRİŞ VE AMAÇ
Güçlü etkili antineoplastik ilaç olan Doksorubisin’in klinik kullanımını kısıtlayan kardiotoksik yan etki mekanizması tam olarak bilinmemekle beraber günümüzde bu etkiden sorumlu başlıca mekanizmanın serbest radikallere bağlı gelişen hücre hasarı olduğu gösterilmiştir. Bu nedenle çeşitli antioksidan etkili ajanların Doksorubisin kardiotoksisitesi üzerine koruyucu etki gösterdiği çok sayıda araştırmada bildirilmiştir. Ayrıca son yıllarda yapılan çalışmalarda Doksorubisin ile oluşan oksidatif stresin apoptotik sinyallerin aktivasyonuna ve kardiyomiyositlerde apoptozise yol açtığı ve bunun da oluşan kardiyotoksisitede önemli rolü olduğu ortaya konulmuştur.
Günümüzde nekrozis ve apoptozis dışında bir başka programlı hücre ölümü yolu olarak nekroptozis tanımlanmakta ve bu konuda gittikçe artan sayıda çalışmalar yapılmaktadır. Apoptozisten farklı olarak kaspazlardan bağımsız olan nekroptozis, moleküler düzeyde TNFR1 gibi ölüm reseptörlerinin uyarılmasına bağlı RIPK1/RIPK3/MLKL nekroptozom kompleksinin oluşumu sonucu meydana gelmektedir. TNFR1 ile tetiklenen bu yolun başlangıcındaki bir kısım sinyal molekülleri hem apoptozis hem de nekroptozis yolağı için ortak olmakla beraber hangi yolun işleyeceği bazı regulatör moleküllerin düzeyi ile ve kaspaz inhibisyonu varlığında belirlenir. Kaspaz 8’in inhibisyonu ve apoptozis proteinleri hücresel inhibitörü (cIAPs) (cellular inhibitor of apoptosis proteins) deplesyonu durumunda apoptozisin baskılanırken nekroptozisin aktive olduğu gösterilmiştir.
Yapılan çalışmalarda miyokard infarktüsü, inme, iskemi/reperfüzyon hasarı gibi birçok patolojik durumda nekroptozisin önemli rolü olduğu ve nekroptozis inhibisyonu ile belli oranda korunma sağlandığı bildirilmiştir.
Yaptığımız PubMed araştırmasında Doksorubisin kardiotoksisitesinde nekroptozisin rolü üzerine bir çalışmaya rastlanılmamıştır. Bu çalışmamızda nekroptozis inhibitörü olan Necrostatin-1'in (Nec-1) doksorubisin ile oluşturulan kardiotoksisite üzerine koruyucu etkilerinin ve doksorubisin kardiyotoksisitesinde rolü olduğu bilinen apoptozis yolağındaki caspase-3,
bcl-2, bax ve nox-2 gibi proteinlerin gen ekspresyon düzeyleri üzerine olası etkilerinin araştırılması amaçlanmıştır.
2.GENEL BİLGİLER
2.1. HÜCRE ÖLÜMÜ
Prokaryot ve ökaryot organizmalarda yeni hücreler oluşurken mevcut olanların bir kısmı da hücre ölümü ile yok olur ve sonuçta sabit denge korunur. Hücreler programlanmış hücre ölümü apoptozis ve patolojik hücre ölümü nekrozis ile yok olmaktadır (1,2). Ayrıca günümüzde nekrozis ve apoptozis dışında bir başka programlı hücre ölümü yolu olarak nekroptozis de tanımlanmaktadır.
2.1.1. APOPTOZİS
Apoptozis, yunanca bir terimdir ve ağaçtan düşen yaprak veya çiçekten ayrılan petal anlamına gelir. Apoptozis terimi ilk defa 1972’de Avusturalyalı patolog J.F.K. Kerrtarafından tanımlanmıştır (3).
Apoptozisde hücre kendisini yok etmek için bazı metabolik ve fizyolojik olayları devreye sokar. Apoptozis uyarısı ile hücre bulunduğu ortamdan uzaklaşır, komşu hücrelerle bağlantısını koparır, hücreler su kaybederek küçülür, şekilleri bozulur ve komşu hücrelerle bağlantılarını kaybederler. Sitoplazma yoğunlaşır ve organeller birbirine yakınlaşır. Organeller genelde sağlamdır ve hücre membranı apoptozisin geç evrelerine kadar bütünlüğünü korur. En önemli değişiklikler hücre çekirdeğinde meydana gelir. Kromatin, çekirdek zarına yakın bir bölgede yoğunlaşır. Çekirdek büzülür, yoğunlaşır ve bazen zarla sarılı birkaç parçaya ayrılabilir. Apoptozis süreci ilerledikçe, tomurcuklanmalar ve sitoplazmik çıkıntılar oluşur. Daha sonra hücre organelleri, sitoplazma ve çekirdek parçalarını içeren “apoptotik cisimcik”lere parçalanır (4). Bu parçalar komşu hücreler ve makrofajlar tarafından fagosite edilerek dokudan uzaklaştırılır. Böylece herhangi bir doku reaksiyonunun oluşması engellenir (5).
2.1.1.1. APOPTOZİS GÖRÜLEN DURUMLAR
Embriyonik dönemde; memelilerin el ve ayak parmakları arasındaki dokunun yok olması, merkezi sinir sisteminin oluşması, damarların sayısının azaltılması ve fetusun cinsel gelişiminde duktus sisteminin gerilemesi olayları apoptozis ile gerçekleşir (6). Ayrıca gözdeki lens hücrelerinin gelişiminin ileri aşamalarında apoptozisle ölür ve içleri şeffaf kristallin proteini ile dolar (7).
Postnatal hayatta ise; İmmün sisteminde önemli olan T lenfositlerin etkisiz halde olanları ya da kendi dokularına karşı reaksiyon verme potansiyeli olanlar dolaşıma alınmadan apoptozisle ölürler. Endometriyumun fonksiyonel tabakasının menstruasyon sırasında dökülmesi ve sonrasında korpus luteumun involusyonu apoptozis ile gerçekleşir (8). Sütten kesilen dişilerin meme bezlerinde ve kastrasyon yapılan erkeklerin prostat bezlerinde de apoptozis görülür (9).
Ayrıca Parkinson, Alzheimer, Diyabet, bağışıklık sistemi hastalıkları, viral enfeksiyonlar, foliküler atrezi, tümör oluşumu, kanser, AIDS, aterosklerozis, miyokard infarktüsü, oksidatif stres, organ transplantasyonları, alkol bağımlılığı ve radyasyon canlılarda apoptozise yol açar (10,11).
2.1.1.2.APOPTOZİSİN DÜZENLENMESİ
Apoptozisin düzenlenmesinde, bazı iyonlar (kalsiyum iyonu), proteinler (bcl-2 ailesi, p53, kaspazlar, sitokrom-c) ve organel olarak mitokondri görev alır.
a) Bcl-2 Ailesi
Bcl-2 ailesi proapoptotik ve antiapoptotik proteinler içeren iki gruptan oluşur. Proapoptotik proteinler hücrede fazla miktarda ise hücre apoptozise eğilimlidir. Antiapoptotik proteinlerin miktarı fazla ise apoptozise daha az eğilimlidir (12).
Proapoptotik proteinler; Bad, Bax, Bid, Bcl-Xs, Bak, Bim, Puma ve Noxa’dır. Bu proteinler sitozolde bulunurlar, sit-c ve apoptozis indükleyici faktör (AIF) salınımını artırarak apoptozisi indüklerler.
Antiapoptotik proteinler ise; Bcl-2, Bcl-xL ve Mcl-1’dir. Mitokondriyon dış membranında, endoplazmik retikülümde ve sitoplazmada yer alırlar. Sit-c ve AIF gibi maddelerin mitokondriyal membrandan geçişini artırırlar ve özellikle hücredeki Ca++ oranını kontrol ederler (12,13).
b) p53
p53, DNA hasarı hücrede meydana geldiğinde hücre siklusunu G1 fazında durdurarak DNA onarımı için hücreye zaman veren transkripsiyon faktörüdür. Meydana gelen hasar onarılamayacak durumda ise Bax, Apaf-1 ve Fas yapımını artırarak Bcl-2 ve Bcl-xL proteinlerini baskılar ve apoptozisi indükler(14).
c) Fas (APO-1 veya CD95)
Fas, tümör nekroz faktör (TNF) reseptör ailesinin en iyi tanımlanmış 24 üyesinden biridir. Lenfoid hücrelerde ve bazı tümör hücrelerinde, hepatositlerde, akciğerlerde vehatta miyokardda bulunur. Fas’ın ilgili ligandı FasL'dir.
d) Kaspazlar
Kaspazlar, aspartik asitten sonraki peptid bağını kıran sistein proteazdır. Ekstrinsik ve intrinsik apoptozis yolaklarının her ikisinde de rol alırlar. Hücrede inaktif halde bulunurlar ve proteolitik olarak birbirlerini aktifleştirirler. Hedef proteini keserek apoptozise neden olurlar. DNA onarımı ve replikasyonu için gerekli enzimleri inaktive ederler. Hücre iskeleti proteinlerini keserek hücre zarının tomurcuklanmasına neden olurlar (15). 3 tiptirler:
I- Başlatıcı kaspazlar; (Kaspaz 2,8,9,10), II- Efektör kaspazlar (Kaspaz 3,6,7),
III- İnflamatuar kaspazlar (Kaspaz 1,4,5,11,12,13,14).
e) Kalsiyum
Apoptotik süreçte hücreye devamlı kalsiyum girişi olur. Kalsiyum iyonları; proteaz, endonükleaz ve doku transglutaminaz aktivasyonunda, hücre iskeleti organizasyonunda ve gen regulasyonunda rol alabilirler. Ancak
apoptozisin gerçekleşmesi için hücre içine kalsiyum girişinin olması şart değildir (16).
f) Sitokrom-c
Elektron transport zincirinin proteini olan sit-c mitokondri iç membranında bulunur. Son yıllarda öneminin anlaşılması ile apoptozisde önemli bir konuma gelmiştir. Sit-c’nin mitokondriden sitoplazmaya salınması hücrede geri dönüşü olmayan bir döneme girildiğini gösterir ve apoptozis gerçekleşir (13).
g) Mitokondri
Mitokondriyel transfer (MPT) porları, dış membranında bulunan voltaj-duyarlı anyon kanalı (VDAC) ve iç membranda bulunan adenin nükleotit translokaz (ANT) ve matriksinde yer alan peptidyl-prolyl izomeraz Cyclophilin-D’den (CypD) oluşur. Porun açılmasını kalsiyum ve fosfat konsantrasyonunun artması, adenin nükleotitlerin tükenmesi, oksidatif stres indükler. Ayrıca aşırı ROS üretimine ve mitokondri matriksinde aşırı Ca+2’un yüklenmesine bağlı olarak açılır. Yapılan çalışmalarda, MPT porlarının nekrotik ve apoptotik hücre ölümlerine katkıda bulunduğunu göstermiştir (17).
2.1.1.3. APOPTOZİS MEKANİZMASI
Apoptozis, hücre ölüm reseptörlerü Fas’ın (diğer isimleriyle APO-1, CD95) ve tümör nekroz faktör reseptörü-1’in (TNFR-1) ligandları ile etkileşime girmesi ile indüklenir ve kaspaz kaskat içeren spesifik sınıf bileşenleri ile düzenlenir (18).
Apoptozis hücre ölüm uyarılarına bağlı olarak iki yolla gerçekleşir;
I- İnstrinsik yol (Mitokondri/sitokrom-c aracılı apoptozis) II- Ekstrinsik yol(Ölüm Reseptörleri yolu ile)
a- Direkt mekanizma b- Dolaylı mekanizma
Apoptozisi indükleyen hücre içi sinyaller; DNA hasarı, hücre içi Ca++ miktarı artışı, metabolik ve/veya hücre siklus bozuklukları, pH azalışı, hipoksi ve serbest radikallerden dolayı oluşan oksidatif hasardır. Hücre dışı sinyaller ise büyüme ve üreme faktörlerinin yetersizliği, ölüm reseptörlerinin aktivasyonu (FAS – FAS ligand aracılığı ile apoptozis, TNF aracılığı ile apoptozis), sitotoksik T lenfosittir. Hücre içi sinyaller instrinsik apoptozis yolu ile apoptozisi indüklerken, hücre dışı sinyaller ise ekstrinsik yol ile (19) indükler (Şekil 1).
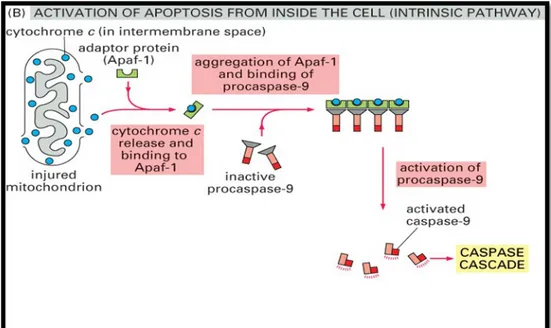
Şekil 1: Apoptozisin gerçekleşme yolları
a) İnstrinsik yol
Hücre içi sinyaller aracılığla apoptotik uyarı alınmasından sonra proapoptotik protein olan Bid; antiapoptotik protein bcl-2‘yi inaktive eder, bax ve bak’ı aktif hale getirir. Aktifleşen bax ve bak mitokondriyon zar potansiyelini değiştirir (15). Zar potansiyelinin değişimi mitokondriyal transfer porlarından mitokondriyal permeabilite proteinleri olan sit-c; Smac(Second Mitochondrial Activator of Caspase), Endonukleaz-G
(Endo-G), Ca++ ve AIF salınımını uyarır. Smac, AIF'ı inhibe ederek apoptozisi hızlandırır, AIF ise çekirdeğe transloke olur ve onu parçalara ayırır. ENDO-G ise tek sarmallı DNA’yı parçalar. Sit-c, oksidatif fosforilasyon için elektron taşır ve mitokondriden AIF ile birlikte sitoplazmaya salınır (20). Mitokondriyal transfer porlarından salınan sit-c sitoplazmik protein olan Apaf-1’e (Apoptotik proteaz aktive eden faktör) bağlanarak Apaf-1’i aktive eder, daha sonra ATP’nin katılımıyla apoptozom adı verilen kompleks oluşur. Oluşan kompleks inaktif olan prokaspaz-9’u aktif kaspaz-9 haline dönüştürür (Şekil 2). Aktif kaspaz-9 ise efektör kaspazlardan prokaspaz 3’ü aktive eder. Aktif kaspaz-3, kaspazla-aktifleşen deoksiribonükleaz inhibitörü olan ICAD’ı (inhibitor of caspase-activated deoxyribonuclease”) kaspazla-aktifleşen-deoksiribonükleaz (CAD) haline dönüştürür ve kaspaza bağlı apoptozis olayı başlar. Bu da apoptozisin önemli bulgularından olan kromatin kondensasyonuna ve oligonükleozomal DNA fragmantasyonuna yol açar (13,21).
Şekil 2: Apoptozis Aktivasyonu-İnstrinsik yol
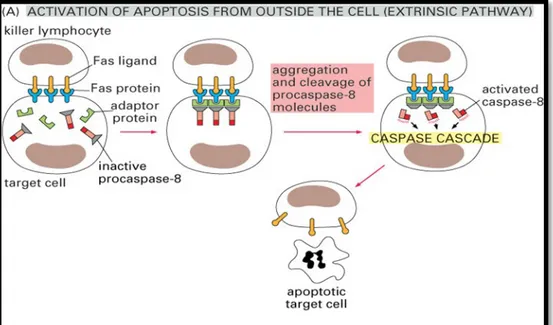
b) Ekstrinsik yol
Hücre yüzeyinde bulunan ölüm reseptörlerine (Fas, TNFR, DR5) ölüm sinyallerinin (FasL, TNF-alfa, TRAİL) bağlanmasıyla reseptör adaptör
molekülleri trimerik yapı kazanır ve prokaspazla birleşerek ölüm uyaran sinyalizasyon kompleksi olarak adlandırılan DISC’i (Death inducing singnaling complex) oluşturur. DISC daha sonra inaktif durumdaki prokaspaz-8’i aktif kaspaz-8 haline dönüştürür (Şekil 3). Aktif kaspaz-8 doğrudan kaspaz-3’ü aktive eder veya dolaylı olarak Bid’i keserek instrinsik mekanizmada kaspaz-9’u aktive ettikten sonra kaspaz-3’ü aktive eder (15,22).
Şekil 3: Apoptozis Aktivasyonu -Ekstrinsik yol
2.1.2. NEKROZ
Nekroz, programlanmış hücre ölümü olan apoptozis aksine genelde rastgele gelişir ve genler tarafından kontrol edilemeyen düzensiz bir süreçtir. Ancak yapılan çalışmalarda düzenlenmiş mekanizmalarla da nekrozun gerçekleşebileceği gösterilmiştir (23).
Nekroz olayında, fiziksel ve kimyasal uyarılara maruz kalan hücrenin iyon dengesi bozulur. DNA tamirinden sorumlu olan Poli ADP-riboz polimeraz (PARP) enzimi NAD+’ı ikiye bölerek NAD kaybına neden olur. Bu aşamada oluşan ATP eksikliği, iyon pompası yetersizliğine neden olur. Böylece hücrenin sıvı alması ile organeller şişer. Plasma membranın bütünlüğü bozulur ve sonuçta osmotik basıncın artması ile hücre patlar. Hücre ölümü ile hücre içeriği hücreler arası boşluğa salınır ve enflamasyon olayına sebep olur. Makrofaj ve nötrofillerin nekrotik dokuya göç etmesi bu olayın
karakteristik özelliğidir. Nekrotik doku göç eden hücreler tarafından fagosite edilir ve oluşan enflamasyon nekrozun önemli bir göstergesidir (24,25).
Nekroz oluşumunun en yaygın nedeni hipoksidir. Nekroz sırasında mitokondriyal reaktif oksijen türlerinin (ROS) üretimi artar, ATP üretimi azalır ve Ca++ kanalları açılır, nonapoptotik proteazlar aktive olur, (24).
2.1.2.1. NEKROZ MEKANİZMASI
Nekroz mekanizması iki farkli sinyal yolağı ile gerçekleşir. Birinci yolak hücre zarındaki ölüm reseptörlerinin (TNFR1) aktivasyonu ile gerçekleşir. TNF sinyal yolağı oldukça komplike bir yolaktır ve gelen uyarının içeriğine göre; apoptozis, nekroz yada hücre canlılığına neden olabilir. Eğer Fas ve TNF reseptörlerinin aktivasyonu ile kompleks-1’in ardından kompleks-2 meydana gelirse nekroz yolağı aktive olmuş demektir (26).
İkinci yolak ise mitokondriyel transfer porunun (MPTP) mitokondri iç zarında açılması ile gerçekleşir (26,27). Pordan mitokondri içine sitoplazmik moleküller ve suyun girmesi ile mitokondride şişme meydana gelir. Bu olay nekrozun en önemli göstergesidir. Yapılan çalışmalarda uzun yıllar MPT porlarının hem nekrotik hem de apoptotik hücre ölümlerine katkıda bulunduğu gösterilmiştir. Ancak son zamanlarda özellikle Cyp-D-eksik farelerde yapılan çalışmalarda MPT porlarının etkisinin pronekrotik ölümlerde pro-apoptotik ölümlere göre daha fazla olduğunu gösterilmiştir (28). Ayrıca yapılan bir diğer çalışmada MPT porlarının farmakolojik olarak inhibisyonu ile hücrenin nekrotik sendromlara karşı korunduğu gösterilmiştir (29) (Şekil 4).
Hücresel stres sonucu hücre zarındaki ölüm reseptörlerinin (TNFR1) aktivasyonu ile Reseptör Etkileşimli Proteinler(RIP) RIP1 ve RIP3 aktive olur. RIP1 ve RIP3 mitokondriyi doğrudan veya NADPH oksidazların (Nox) oluşturduğu ROS ile dolaylı yoldan etkileyerek nekrozu indükler. Nekrotik uyarının alımı aktive olan PARP1, kalpaini veya RIP kinazları aktive ederek, ya da PAR polimerazlar aracılığıyla nekroza neden olur. Kalpain, kaspaz proteaz ailesi üyesidir. Ca++ ile aktive olan kalpain lizozomal enzim salınımına neden olarak kathepsin aktivasyonuna katkıda bulunur. PAR
polimeraz ve kalpain, AIF salınımını sağlayarak nekrotik hücreleri indükler (Şekil 5). Susin ve arkadaşları PARP1’in indüklediği nekrozisin kalpain aktivasyonuna bağlı olduğunu ve sonrasında mitokondriyi etkilediğini belirtmişlerdir (30).
Şekil 4: Nekroz Sinyal Yolakları
Şekil 5: Nekrotik yolağın sinyal bileşenleri
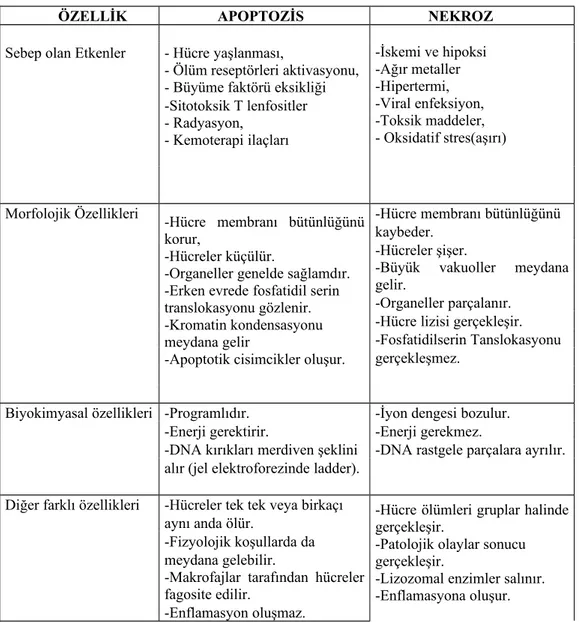
ÖZELLİK APOPTOZİS NEKROZ
Sebep olan Etkenler - Hücre yaşlanması, -İskemi ve hipoksi -Ağır metaller -Hipertermi, -Viral enfeksiyon, -Toksik maddeler, - Oksidatif stres(aşırı) - Ölüm reseptörleri aktivasyonu,
- Büyüme faktörü eksikliği -Sitotoksik T lenfositler - Radyasyon,
- Kemoterapi ilaçları
Morfolojik Özellikleri -Hücre membranı bütünlüğünü korur,
-Hücreler küçülür.
-Organeller genelde sağlamdır. -Erken evrede fosfatidil serin translokasyonu gözlenir. -Kromatin kondensasyonu meydana gelir
-Apoptotik cisimcikler oluşur.
-Hücre membranı bütünlüğünü kaybeder.
-Hücreler şişer.
-Büyük vakuoller meydana gelir.
-Organeller parçalanır. -Hücre lizisi gerçekleşir. -Fosfatidilserin Tanslokasyonu gerçekleşmez.
Biyokimyasal özellikleri -Programlıdır. -İyon dengesi bozulur. -Enerji gerektirir. -Enerji gerekmez.
-DNA kırıkları merdiven şeklini -DNA rastgele parçalara ayrılır. alır (jel elektroforezinde ladder).
Diğer farklı özellikleri -Hücreler tek tek veya birkaçı -Hücre ölümleri gruplar halinde gerçekleşir.
-Patolojik olaylar sonucu gerçekleşir.
-Lizozomal enzimler salınır. -Enflamasyona oluşur. aynı anda ölür.
-Fizyolojik koşullarda da meydana gelebilir.
-Makrofajlar tarafından hücreler fagosite edilir.
-Enflamasyon oluşmaz.
Tablo 1: Apoptozis ve Nekroz Arasındaki Farklar
Apoptozisden farklı olarak programlanmış hücresel nekroz mekanizması nekroptozis olarak adlandırılır. Nekroptozis kaspaz bağımlı
apoptik hücre ölümünden farklı olarak tümör nekroz faktörü alfa (TNF-α) ve/veya Fas tarafından başlatılan programlanmış nekrozis olayıdır (31).
Nekroptozisin immun sistemin düzenlenmesinde, doku hasarında, kanserin gelişiminde, T hücrelerinin çoğalmasında (32,33) ve makrofajların sağ kalımları üzerinde etkisi vardır (34).
2.1.3.1. NEKROPTOZİS MEKANİZMASI
Nekroptozis nekroz özelliklerini göstermekle beraber RIP1 ve RIP3 katılımını gerektiren özel bir sinyal yolağı taşır (18,35). Degterev ve arkadaşları nekroptozisde RIP1’in serin/threonin kinaz aktivitesinde önemli rol oynadığını belirtmişlerdir. Yakın zamana kadar, ölüm reseptörlerinin sadece apoptozisi uyardığı kabul edilirdi ancak son zamanlarda yapılan çalışmalarda RIP1 tutulumu ile apoptotik yolak bloke olduğunda nekroptozise yol açtığı gösterilmiştir (36).
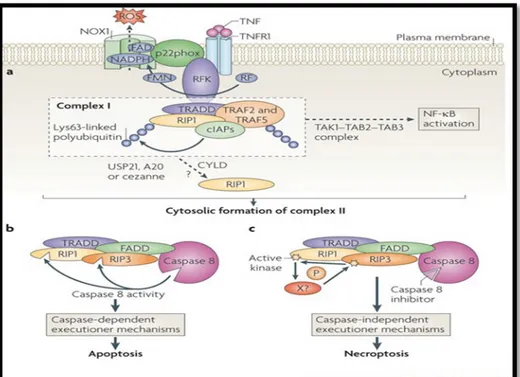
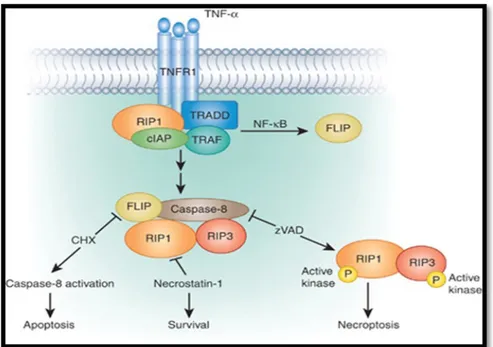
Nekroptozis; TNFR1, TNFR2 ve Fas ölüm reseptörlerini içeren reseptör sınıf ile uyarılır. Nekroptotik mediyatörler arasında en yoğun olarak incelenen TNF-α/ TNFR-kaynaklı olanlardır (37). TNF-α ilk zamanlar tümör hücre nekrozuna neden olan ajan olarak tanımlanmıştır (38). Ancak son zamanlarda yapılan çalışmalar TNF-α'nin programlanmış nekrozu indüklediğini göstermiştir. TNFR1, TNF-α aracılı aktivasyonda önemli rol oynar ve hücre içi bir dizi olayı tetikler. TNF-α, TNFR1'in hücre dışına bağlanır ve hücre içinde allosterik değişimlere neden olur (39). Enzim, protein ve ölüm alanları susturucu (SODD) etkisiyle kompleks-1 oluşur. Ubikitinasyon sonrasında RIP-1 kompleks-1'den sitoplazmaya salınır ve kompleks-2 oluşur. Kompleks-2 ölüm uyaran sinyalizasyon kompleksi (DISC) olarak da bilinir ve TRADD, FADD, RIP1 ve caspase-8'den oluşur. Kaspaz-8 inhibe edildiğinde RIP-1 ve RIP-3 fosforilasyona uğrar, nekrozom kompleksi oluşur. Nekrozom RIP1 ve RIP3'den oluşur ve belirgin olarak nekroptozisi artırır (40). RIP3, RIP1'in nekrozoma alımını hızlandırır ve nekrozom oluşumunda her iki proteininde kinaz aktivitesi gereklidir (41).
Kaspaz-8 aktive edildiğinde ise RIP-3 aktivitesi bölünme ile azalır. FAD ve RIP-1 ile kompleks-2 oluşarak apoptozis meydana gelir (Şekil 6).
Apoptozis ile nekroptozis arasındaki geçişi etkileyen faktörler; uyarıcının yapısı, hücre tipi ve kaspaz aktivitesidir. Sadece belirli türdeki uyaranlar nekroptozisi indükleyebilir ve her hücrenin ölümü nekroptozis ile gerçekleşmez. Yapılan çalışmalarda nekroptozise uğrayan hücrelerde ortak özelliklerin olmadığı gözlemlenmiştir. Nekroptozis ve nekroz arasında ki dönüşüm farklı uyaranlar ve durumlara göre aynı hücrelerde gözlemlenmiştir (42). Bazı koşullarda hem nekroptozis hemde nekroz aynı hücrede meydana gelebilir (18).
Şekil 6 :Apoptozis-Nekroptozis
Antrasiklinler yüksek antineoplastik etkileri nedeniyle kanser tedavisinde en sık kullanılan kemoterapötik ajanlardandır. Meme, akciğer, tiroid gibi solid tümörlerin ve akut lösemi, malign lenfoma gibi hematolojik kanser tedavilerinde kullanılır (43).
Antrasiklinlerin antineoplastik etkileri şu mekanizmalarla ortaya çıkar (44) ; 1) DNA’nın yapısına girerek makromoleküllerin sentezini inhibe eder, 2) Serbest radikal oluşumuna neden olarak DNA hasarı oluşturur, 3) DNA hasarı ve p53 geninin aktivasyonu ile apoptozisi uyarır, 4) Doğrudan hücre zarına toksik etkiler gösterir,
5) Topoizomeraz II enzim inhibisyonu yapar.
Tedavide sık kullanılmalarına rağmen antrasiklinlerin kullanımı kardiotoksik yan etkileri nedeniyle sınırlanmaktadır. Antikanser tedavinin potansiyel komplikasyonu kısa ve uzun dönem kardiyovasküler toksisitedir. Kardiyovasküler sistem üzerine etki eden kemoterapötiklerin en önemlileri antrasiklinler, mitoksantron, siklofosfamid, ifosfamid, paklitakseldir (45).
2.2.1. ANTRASİKLİN KARDİOTOKSİSİTESİNİN PATOGENEZİ a- Serbest Radikal Hipotezi
Antrasiklin grubu kemoterapötikler redoks siklusunu etkileyerek serbest radikallerin oluşumuna yol açarlar (46). Serbest radikaller; hücre zarı lipidlerin oksidasyonuna, mitokondriyal respiratuvar siklusda defekt oluşumuna, DNA yıkımına, sülfidril grubu içeren enzimlerde ve kollajen ile hiyalurinik asit fonksiyonlarında bozulmaya neden olur (47). Kalp diğer organlara göre serbest radikalleri detoksifiye eden enzimleri daha az miktarda içerdiğinden hasara daha çok duyarlıdır(48).
b- Aşırı Ca++ Yükü Hipotezi
Hücre içinde Ca++ artışına neden olan antrasiklinler mitokondrilerde fonksiyon bozukluğuna, yüksek enerjili fosfatların tüketimine, kasılma fonksiyonlarında bozukluğa ve hücre ölümüne neden olur (49).
c- Prostaglandin ve Trombosit Aktive Edici Faktör (TAF) Hipotezi
prostaglandin (PG) E2, F2 alfa ve tromboksan A2 (TxA2) düzeylerinin artmasına neden olur (50). Ancak PG'ler ve TxA2'nin kardiotoksisiteye nasıl neden oldukları tam olarak bilinmiyor. TAF ise bronkokonstrüksiyona neden olur, hipoksemiyi artırır, pulmoner vasküler direnci yükseltir, sağ ventrikül yetersizliğine neden olabilir, periferik vazodilatasyon, hipotansiyon ve koroner vazospazm oluşturarak kardiyak iskemiye neden olur (51).
d- Histamin Hipotezi
Hücre içine Ca++ girişi histamin-2 (H
2) reseptörleri aracılığıyla artar ve H1 reseptörleri aracılığıyla da ritim bozukluğuna neden olabilir (52). Bristow ve ark. doksorubisin alımının histamin salınımını artırdığını ve miyokardda histamin infüzyonunun doksorubisine benzer etkiler oluşturduğunu belirtmişlerdir (51).
e- Metabolit Hipotezi
Doksorubisin, daunorubisin ve epirubisini katalize eden sitoplazmik antrasiklin redüktazlar doksorubisinol, daunorubisinol ve epirubisinol gibi alkol metabolitlerinin oluşmasına neden olurlar. Doksorubisinol doksorubisine göre daha fazla toksiktir. Doksorubisinol, iyon bağımlı pompaları (Ca-Mg ATPaz gibi) ve ATP oluşumunu inhibe ederek Ca++ ’un sarkoplazmik retikulum içine alımını önler (53).
f- İmmün Sistemin Rolü
Antrasiklinlere bağlı gelişen kardiotoksisitenin bir diğer mekanizması oksidatif stres sonrası oluşan immünojenik reaksiyonun olaya katılımıdır. Yapılan çalışmalarda, doksorubisinin miyositlerin plazma membranında hasar oluşturduğu ve bunun sonucunda artmış immün cevaba neden olduğu öne sürülmüştür (48).
2.3.DOKSORUBİSİN
(8S-cis)-10-[(3-Amino-2,3 6-trideoxy-alpha-L-lyxohexopyranosyl)oxy]-
7,8,9,10-tetrahydro-6,8,11-trihydroxy-8-(hydroxyacetyl)-1-methoxynaphthacene- 5,12-dione hydrochloride
Çalışmamızda Streptomyces peucetius'dan elde edilen antrasiklin türevi antibiyotik olan doksorubisin kullanılmıştır. Doksorubisin; solid tümörler, lösemi, lenfoma, akciğer kanseri gibi birçok pediatrik ve yetişkin kanser türlerinde kullanılır.
Doksorubisin, Deoksi Ribo Nükleik Asit (DNA) çift zincirinde interkalasyon yaparak DNA replikasyonunu ve Ribo Nükleik Asit (RNA) transkripsiyonunu bozarak ve topoizomeraz II enzimine bağlanarak DNA hasarı oluşturur (54). Doksorubisin DNA yapısındaki şeker-fosfat bağ yapısına bağlanarak DNA ve RNA sentezini engeller. Doksorubisin tarafından Topoizomeraz II enziminin katalizlediği DNA zincirinin kırılması ve tekrar farklı noktalardan birleştirilmesi işlemi engellenir ve DNA zincirinde onarılmayan kırılmalara neden olur.
Birçok kanser türünün tedavisinde kullanılmasına rağmen doksorubisinin klinik kullanımını kısıtlayan hematopoetik supresyon, mide bulantısı kusma, alopesi gibi yan etkileri vardır (55). Lipid peroksidasyonu sonucu oluşan ve serbest radikallere bağlı ortaya çıkan kardiotoksisite en önemli ve ciddi yan etkisidir (56,57). Doksorubisinin oluşturduğu kardiyak toksisite genelde miyofibril bozulma, intrasellüler kalsiyum disregülasyonu ile ilişkilidir. Doksorubisin kardiotoksisitesinde sadece kardiyomiyositler
hedef alınmaz ayrıca endotel hücrelerde etkilenir. Kaspaz aktivasyonu ve intranükleozomal DNA bozulması bunun göstergesidir. Doksorubisin kardiotoksik etkisinden dolayı deneysel çalışmalarda kardiotoksisite modeli olarak kullanılmaktadır. Yapılan birçok çalışmada bu kardiotoksik etkinin mekanizmaları araştırılmıştır.
2.3.1. DOKSORUBİSİN KARDİOTOKSİSİTESİ
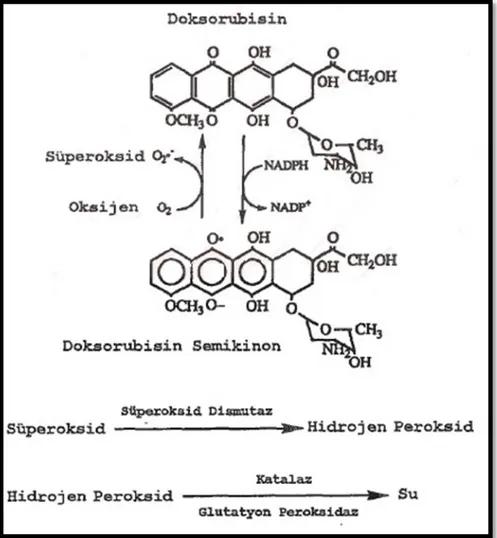
Doksorubisinin kardiotoksik etkilerin araştırılmasında birçok araştırmacı yapısında bulunan tetrasiklik halkasındaki kinon ve hidrokinon kromofor grupları üzerinde yoğunlaşmıştır (58). Doksorubisin bir amino şekerin bağlı olduğu tetrasiklik aglikon yapısındadır. Yapısında bulunan kinon halkası, sitokrom P450 redüktaz ve ksantin oksidaz enzimleri tarafından semikinon radikaline indirgenir (Şekil 7) (59,60). Oluşan radikaller, oksijen molekülünü indirgeyerek süperoksit anyon radikalini (O2-) ve hidrojen peroksiti (H2O2) oluşturur. H2O2 ve O2- endojen glutatyon peroksidaz gibi serbest radikallerin temizlenmesini sağlayan antioksidan enzim düzeylerinin azalmasına neden olarak oksidatif stresi artırır ve lipid peroksidasyonu neden olur (61). Kardiyomiyopati sonucu konjestif kalp yetmezliği oluşumunu kolaylaşır. Kardiyomiyopatide anormal elektrokardiografi, miyofibril kaybı, sol ventrikül disfonksiyonu, sitoplazmik vakuolizasyon, miyosit atrofisi ve fibrosis gibi değişimler gözlenmiştir.
Şekil 7: Antrasiklin türevi bileşiklerin yapısında bulunan kinon gruplanın
semikinon radikaline indirgenmesi
2.3.2. DOKSORUBİSİN'E BAĞLI KARDİYOMİYOPATİNİN MOLEKÜLER MEKANİZMASI
Doksorubisine bağlı gelişen kardiyomiyopatinin moleküler mekanizmasında aşagıdaki mekanizmalar sorumludur (62-64);
1) Oksidatif stres
a) Mitokondriyal bağımlı ROS b) NOS bağımlı ROS
c) NAD(P)H bağımlı ROS d) Fe-Dox kompleksi 2) Apoptozis
1. Oksidatif Stres
Doksorubisinin miyokardiumda oluşturduğu major mekanizma serbest radikal oluşumun indüklenmesidir (62-64). Kardiyomiyopati güçlü bir şekilde kardiyak oksidatif stresle ilişkilidir ve kanıt olarak reaktif oksijen türlerinin oluşturduğu lipid peroksidasyonu ve azalmış antioksidan, sülfidril grup seviyesi gösterilir.
a)Mitokondriyal Bağımlı ROS
Mitokondri çoğunlukla subsellüler organel olarak kardiotoksisiteden etkilenir. Nedeni ise katyonik ilaç olan doksorubisin mitokondri iç membranında tutunarak kardiolipin ile irreversible kompleks oluşturur (65). Elektron taşıma sistemi proteinleri kardiolipinin işlevine uygun olarak bağlanarak doksorubisin- kardiolipin arayüz protein bağlanmasını bozar böylece daha fazla süperoksit oluşur (66). Dox-kardiyolipin kompleksi elektron transferi yoluyla serbest hidroksil radikalleri ve hidrojen peroksit oluşmasına sebeb olarak mitokondriyal membranda hasarın ve lipid peroksidasyonunun artmasına neden olur. Mitokondri fonksiyonlarının bozulması ile kardiyomiyositler tarafından kullanılan ATPden %90dan fazla ATP gerekir (67,68).Bu fonksiyonel bozulma mitokondri şişmesine, miyelin figürlü mitokondri oluşması gibi patolojik değişimlere yol açar.
Yapılan çalışmalar doksorubisinin oluşturduğu miyokardial disfonksiyonun sıklıkla supraklinik doksorubisin dozunda uygulandığında görüldüğünü gösterir (44,69). Ancak klinik dozda doksorubisin uygulanması doğrudan mitokondri fonksiyonlarını etkiler fakat etkileri ise daha azdır. Kronik doz doksorubisin uygulanmış kardiyomiyopatili rat modelinde, uzun zincirli yağ asitlerin oksidasyonu kardiyak mitokondrilerde anlamlı şekilde azalırken glukoz metabolizması tüm aerobik ve anaerobik basamaklarda artar (70).
Doksorubisinin oluşturduğu oksidatif stres, uzun zincirli yağ asitlerin metabolizmasından glukoza kadar transkriptional genlerin baskılanması durumunda sinyal mekanizmalarında değişikliğe neden olur. Suliman ve ark. doksorubisin tedavisinin mitokondriyal gen ekspresyonlarını değiştirdiğini
ifade etmişlerdir. Çalışmalarında apoptozis sonucunda mitokondriyal metabolizmanın doksorubisin tarafından baskılandığını göstermek için transgenetik mitokondriyal farelerini kullanmışlardır (71).
b)NOS Bağımlı ROS
Vasquez-
vivar ve ark.doksorubisinin endotelyal nitrik oksit sentetaz (eNOS) redüktaz enzimine bağlanması sonucu O2- oluştuğunu göstermişlerdir (72). eNOS tarafından bir elektronun redüklenmesi ile doksorubisin semikinon radikali oluşur ve oksijen O2- dönüşür. Bu reaksiyon Ca++ bağlı değildir ve L-NAME ile inhibe edilmez. Etkisi Nikotinamid adenin dinükleotid fosfat (NADPH) inhibitörleri ile zayıflatılır. Düşük konsantrasyonda doksorubisin redüksiyonunda eNOS ana kaynaktır ve eNOS inhibisyonu kardiotoksisite oluşumuna kadar sonuçlar doğurur. Doksorubisin apoptozisi indükler. eNOS bağımlı ROS doksorubisinin oluşturduğu mitokondriyal disfonksiyonda rol alır (73). Neilan ve ark. eNOS transkripsiyonunun genetik bozulmasının doksorubisinin oluşturduğu kardiyak disfonksiyonu önlediğini göstermişlerdir (74).c)NADPH Bağımlı ROS
NADPH birçok oksidoredüksiyon reaksiyonlarında dehidrojenazların koenzimi görevini yapar. Hücrenin enerji metabolizmasında bu enzimler oldukça önemlidir (75). Redükte NADPH'ın, NADPH oksidazlar (Nox) tarafından okside edildiği reaksiyonda oksijen, superoksit iyonuna redükte edilir. NADPH oksidazlar TNF-α'nın indüklediği nekroptozisde ROS'ların üretimine katkıda bulunur. NADPH oksidaz enzimi, membran yerleşimli proteinler (gp91phox ve p22phox) ve sitoplazmik proteinlerden (p47phox, p67phox, p40phox, rac) oluşur. Nox1'den Nox5'e kadar beş farklı Nox isoformu belirlenmiştir (76).Nox'un major kardiyak isoformları olan Nox-2 ve Nox-4; daha çok kardiyomiyositlerde, fibroblast ve endotel hücrelerinde bulunur. Deneysel ve klinik kalp rahatsızlıklarında NADPH oksidazların aktivitelerinin arttığı gözlenmiştir (77,78).
Dox'un oluşturduğu kardiyomiyopatide NADPHın önemi in vitro farmakolojik çalışmalarda gösterilmiştir (79). Ayrıca Dox'un miyakardiyal NADPH oksidaz aktivitesini invivo artırarak etki gösterdiği yapılan
çalışmalarda da gösterilmiştir (80).Deng ve ark. doksorubisin ve NADPH' ın enzimatik aktivite yokloğunda O2- oluşturduğunu göstermişlerdir (81).
d)Fe-Dox Kompleksi
Antrasiklinler ile demir iyonları arasındaki ilişki kardiyomiyosit hasarında anahtar rol oynar. Fe+++ iyonları hem hidrojen radikallerinin üretiminde katalizör görevi görür hem de doğrudan DNA ve hücre zarı lipidleri üzerine yıkıcı etkileri vardır.
Dox-Fe kompleks oluşumu 1980’den beri bilinmektedir. Doksorubisinin Fe' e karşı affinitesi yüksektir (82).Demir kompleksi negatif yüklü membran ile etkileşerek lipid peroksidasyonuna neden olur (83). Doksorubisinin redüksiyonu ile serbest demir varlığında serbest radikal oluşum döngüsüne katılır oluşan doksorubisinol proteinlerin tiyol gruplarına bağlanarak hücrelere zarar verir (84). Ancak serbest demir içeren birçok hücrede kardiyomiyosit azdır. Fizyolojik koşullarda dox ile kompleks oluşturacak yeterince serbest demir olmadığı için kardiyomiyopati oluşturacak ve ölçülecek düzeyde değildir (44).
2. Apoptozis
Doksorubisin tarafından oluşturulan oksidatif stres apoptotik sinyallerin aktivasyonuna kardiyomiyosit apoptozisine yol açar (85) ve ekstrinsik, intrinsik yolakların her ikisini de içerir (86). Kaspaz aktivitesi doksorubisin tarafından etkilenmektedir ve invivo olarak doksorubisin alımı ile kaspaz-3 aktivasyonu apoptozis ile ilişkilidir (87,88).
Şekil 8:Kardiyomiyositlerde Doksorubisin ile çeşitli apoptik yolaklar arasındaki etkileşim.
(Dox: doksorubisin, Doxol: doksorubisinol, Doxq: doksorubisin semikinonin, ROS: reaktif oksijen türleri, SE: sarkoplazmik retikulum,CytC: sitokrom-C ve Casp3: kaspaz 3.)
Şekil 8'de gösterildiği gibi Dox, ROS üretimini artırarak NOS’un monomerlere dağılmasını sağlar. Ayrıca Dox mitokondriye girerek sit-c salınımına neden olur ve sarkoplazmik retikulumda Ca++ kanallarının açılma süresini uzatarak kalsineurin aktivitesini sağlar. Akt fosforilasyonu Bad aktivasyonunu inhibe eder.
2.4. ANTRASİKLİN KARDİOTOKSİSİTESİNİN ÖNLENMESİ
Yapılan çalışmalar sonucunda antrasiklinlerin oluşturduğu kardiotoksisitenin çeşitli metodlarla kısmen önlenebildiği gösterilmiştir. Bu amaçla; antrasiklin analogları kullanılabilir, formülasyonda (lipozomal sistem kullanımı), antrasiklin dozu ve uygulama sıklığında değişiklikler yapılabilir ya da kardiyoprotektif ajanlar ile beraber kullanılabilir. Ayrıca serbest radikallerin ve antioksidan enzimlerin kardiotoksisitenin patogenezinde rol oynadığının belirlenmesi antioksidan tedavi denemelerini gündeme getirmiştir (56).
2.4.1. NECROSTATİN-1
5-(1H-Indol-3-ylmethyl)-3-methyl-2-thioxo-4-Imidazolidinone, 5-(Indol-3-ylmethyl)-3-methyl-2-thio-Hydantoin, MTH-DL-Tryptophan
Nec-1; Aleksey Degretev ve Junying Yuan tarafından 2005 yılında sentez edilmiştir. Yaptıkları çalışmada Nec-1’in insan ve murin hücrelerindeki nekrotik hücre ölümünü bloke ettiğini ve iskemik beyin hasarına karşı koruyucu etkinliğinin olduğunu saptamışlardır.
Nekroptozis, farmakolojik veya genetik olarak kaspazın inhibe edildiği durumlarda Tümör Nekroz Faktörü alfa’nın (TNF-a) aktive edilmesi ile oluşan kontrollü nekrotik hücre ölüm yolağıdır. TNF-α ve/veya Fas tarafından nekroptozisin başlatılması sonrasında (31,41) TNFN-α, TNFR-1 ve RIP-1 kompleks-1’i oluşturur ve ardından kompleks-1 stoplazmaya salınır. Kompleks-1’e RIP3 ve casp-8’in katılımıyla kompleks-2 meydana gelir. Kompleks-2’nin oluşumundan sonra casp-8’in inhibe edilmesi durumunda RIP1 ve RIP3 fosforilasyona uğrayarak MLKL ile birleşip nekroptozom oluşturur ve nekroptozis artar (Şekil 9). Nec-1, RIP1’in kinaz aktivitesini inhibe ederek etki gösterir (89,90). Nec-1'in nekroptozis inhibitör aktivitesi için RIP1'in hücresel hedef olduğu çalışmalarda gösterilmiştir. RIP1 serin/treonin kinaz ailesinin üyesi olan bir enzimdir ve kendisinin homoloğu olan RIP3 ile fiziksel ve fonksiyonel etkileşim kurarak, pronekrotik sinyalleri iletir ve nekroptozisi başlatır (91). RIP1 ve RIP3’ün kinaz kısımları %33 oranında benzerlik göstermesine rağmen Nec-1, RIP1’ i inhibe ederken RIP3 ile etkileşim göstermez (35,41).
Önceki çalışmalar RIP1'in nükleer faktör kappa β’yı (NF-κβ) aktive etmek ve ROS üretmek için önemli olduğunu göstermiştir (92). Ayrıca NF-κβ ve ROS'un apoptozis sinyalinde önemli role sahip olduğu da bilinmektedir.
Yapılan bir diğer çalışmada ise kaspaz-bağımlı apoptozise karşı koruyucu olmadığı gösterilmiştir (93).
3. GEREÇ VE YÖNTEM
3. 1. Gereç
3.1.1 Kullanılan Araç ve Gereçler:
Langendorff Cihazı ( MAY 0702)
MP 30 B Amplifikatör (Biopac System. Inc. Santa Barbara, CA, USA) FDT-10A, Basınç transduseri ( Commat iletişim Co. Ankara, Türkiye) MAY WBC 3044 Organ Banyosu için su sirkülatör cihazı
MAY PRS 9508 PeristaltikPump Cihazı Hassas terazi (Sartorius BP 1215) Cerrahi alet seti
Santrifüj Cihazı (Thermo)
Magna Lyser Homogenizatör (Roche) Vortex (Thermo)
Multiskan UV Absorbans Cihazı (Thermo) Isıl Döngüleyici (Thermo)
Light Cycler Real Time PCR Cihazı (Roche) Pipet Seti (Ependrof)
Bilgisayar
3.1.2.Kullanılan Deney Hayvanları:
07.06.2013 tarihli 19 nolu etik kurul onayı ile Dicle Üniversitesi Sağlık Bilimleri Uygulama ve Araştırma Merkezi’nden (DÜSAM) temin edilen ortalama 300 gram ağırlığında 64 adet erkek Sprague-Dawley ratlar çalışmada kullanıldı. Çalışma süresince 'Hayvan Haklarının Korunması’ hususundaki esaslara özenle uyuldu.
3.1.3.Kullanılan Kimyasal Maddeler
Necrostatin-1 (Sigma-Aldrich)
Ketamin HCL (Ketalar 50 mg/ml, 10 ml flakon, Pfizer) Ksilazin (Rompun %2, Bayer)
Heparin (Liquemine flakon 25.000 IU, Roche) Krebs-Henseleit Solüsyonu
RNA High Pure Doku İzolasyon Kiti (Roche)
Magna Lyser Green Beads Homojenizatör Boncukları (Roche) Transcriptor First Strand cDNA Sentez Kiti (Roche)
Fast Start Essential Probe Master Real Time PCR Kiti (Roche)
Real Time Ready Catalog Assay Kitleri (Roche) (β-actin, Bcl-2, Bax, Casp3, Nox-2 genleri için)
Etanol (%99.8 saflıkta) Distle su
3.2. Yöntem
Çalışma her biri 16 rattan oluşan 4 grupta gerçekleştirildi. Gruplarda deney protokolu sonucunda izole edilen rat kalplerinden sekizi Langendorff cihazında invitro olarak perfüze edildi diğer yarısı ise gen ekspresyonları ve histopatolojik incelemeler için kullanıldı.
1. Kontrol Grubu; 1 ml (i.p) steril saline enjeksiyonu yapıldı.
2. Doksorubisin (Dox) Grubu; Tek doz, 10 mg/kg (i.p) Dox
enjeksiyonu yapıldı. 7. günün sonunda kalp izole edildi.
3. Dox+ Nekrostatin-1 (Dox+Nec-1) Grubu; Tek doz, 10 mg/kg (i.p)
Dox enjeksiyonu yapıldı. Ayrıca 7 gün süresince günde 1 defa olmak üzere her gün aynı saatte 1,65 mg/kg i.p Nec-1 enjeksiyonu yapıldı.
4. Nekrostatin-1 (Nec-1) Grubu; 7 gün süresince her gün aynı saatte
olmak üzere 1,65 mg/kg i.p Nec-1 enjeksiyonu yapıldı.
3.2.1 Farmakolojik İnceleme
Çalışmamızda bütün gruplara 100 mg/kg Ketamin +15 mg/kg Ksilazin anestezik amaçlı intramusküler (i.m) olarak uygulandı. Anestezi altında ve cerrahi işlemler sırasında oluşabilecek bir koagülasyonu önlemek amacı ile
femoral venden 500 IU/kg heparin uygulandı. Daha sonra ratlarda sternotomi ile toraks açıldı, kalpte herhangi bir mekanik hasar oluşturmamaya özen göstererek assendan aort ve diğer damarlar kesilerek kalp izole edildi. Buzlu krebs solüsyonu içerisine bırakılan ve kısa bir kanül ile aortadan kanüle edilen kalpler Langendorff sistemine takıldı (Şekil 10). Krebs solüsyonu ile (%5 CO2 ve % 95 O2 karşımı ile havalandırılarak) sabit akımla peristaltik pompa yardımı ile perfüzyon yapıldı. Kalpte perfüzyon basıncı (PB) aortik infüzyon kanülüne bağlı olan basınç transdüseri ile ölçüldü. Bir polietilen katetere bağlanan lateks balon sol atriumda mitral kapaktan sol ventrikül içine yerleştirildi. Diğer ucunda ikinci bir basınç transdüseri bulunan kateter distile su ile dolduruldu ve kateter ucundaki lateks balon distile su ile şişirilerek 5-6 mmHg'lık basınç oluşturuldu. Maksimum kardiyak fonksiyon değerlerine ulaşmak için gerekli olan 30-45 dakikalık stabilizasyon süresinden sonra lateks balonun bulunduğu sol ventrikülde, Sol Ventrikül Gelişen Basıncı (Left Ventricular Developed Pressure) (LVDP) ölçüldü. Ayrıca kalbin kontraksiyon gücünün göstergesi olan sol ventrikül kasılma ve gevşeme hızlarını ifade eden LV ( dP/dt)max ve LV( dP/dt)min kaydedildi.
Bunların yanı sıra kalplere takılan elektrotlar yardımı ile kalbin dakikadaki atım sayısı olan kalp atım hızı (KAH) kaydedildi. Bütün gruplarda, Biopac MP 30 Amplifikatör ile alınan kayıtlar bilgisayar ortamında analiz edildi.
Yapılan bu farmakolojik deneylere ilave olarak aynı deney protokolu ile her dört grupta oluşturulan kardiotoksisitenin değerlendirilmesine katkıda bulunan histopatolojik inceleme ve biyokimyasal analizler perfüze edilmeden alınan kalp dokularında yapıldı. Ayrıca bütün gruplarda kalp dokuları genetik olarak incelenerek dokularda ki caspase-3, bcl-2, bax, Nox-2 genlerinin transkripsiyonları Real Time PCR tekniği kullanılarak ölçüldü.
3.2.2 Histopatolojik İnceleme
Histopatolojik inceleme için izole edilen rat kalplerinin sol tarafı %10'luk nötral formalin içine alınarak histoloji araştırma laboratuvarına gönderildi. Fiksasyonu takiben akarsuda yıkanarak farklı konsantrasyonda alkollerle dehidrate edildi. Daha sonra ksilolde şeffaflaştırılıp parafin içinde bloklandı. Rotary mikrotomuyla alınan 4-5 µm kalınlığındaki parafin kesitleri Hemotoksilen-Eozin, Azan ve Masson trikrom boyalarıyla boyandı. Elde edilen kalp preparatları Nikon Eclipse 80i mikroskobunda (Nikon, Japonya) incelenerek mikrografları alındı.
3.2.3. Biyokimyasal İnceleme
Doksorubisin kardiotoksisitesinde major etkisi olduğu gösterilen oksidatif stresin göstergesi, lipid peroksidasyonun son ürünü olan Malondialdehit (MDA) ölçümü dört grup için perfüze edilmeden alınan kalp dokularında tiobarbitürik asit yöntemi (94) ile yapıldı.
3.2.4. Genetik İnceleme
Bütün gruplarda perfüze edilmeden alınan kalp doku örnekleri genetik olarak inceleme yapılana kadar parafin içinde ve -80oC'de saklandı. Örnekler hassas terazi ile 40-50 mg arasında tartıldı ve içerisinde Magna Lyser Green Beads bulunan tüplere konuldu. Tüplerin üzerine 500 µl High Pure RNA doku izolasyon kitinin içerisinde bulunan lysis/binding bufferdan eklendi. Magna Lyser cihazında 7000 devirde 70 saniye döndürüldükten sonra ivedilikle soğuk çelik bloğun üzerine alındı. Yaklaşık bir saat bekletildikten sonra homojenatın hepsi yeni bir eppendorfa aktarıldı ve üzerine içerisinde bulunan sıvının yarısı kadar (yaklaşık 250 µl) saf etanol eklendi. Daha sonra bu karışım vortekslendi ve kolonlu eppendorf tüplere aktarıldı. Bundan sonraki işlemler High Pure RNA doku izolasyon kitinin prosedürüne uygun olarak yapıldı ve MultiScan UV absorbans cihazı ile 260 nm dalga boyunda total RNA miktarları tespit edildi.
Elde edilen total RNA 'lardan cDNA yapmak amacıyla Transcriptor First Strand DNA sentez kiti kullanıldı. Bütün işlemler kitin prosedürüne
uygun olarak yapıldıktan sonra; ısıl döngüleyici (Thermo Thermal Cycler) kullanılarak 10 dk. 25 oC; 60 dk. 55 oC; ve 5 dk. 85 oC profilinde çalıştırıldı ve yapılan cDNA 'ler bir sonraki işleme kadar -20 oC 'de bekletildi.
Bir önceki işlemde elde edilen cDNA'lar çözündükten sonra 1/5 oranında sulandırıldı. Fast Start Essential Probe Real Time PCR Master kiti içerisindeki solüsyonlar prosedüre uygun bir biçimde kullanılarak master mix solüsyonları β-actin ve casp-3, bcl-2, bax, Nox-2 genleri için ayrı ayrı hazırlandı ve real time PCR plate kuyucuklarına yüklendi. Daha sonra 5 µl sulandırılmış örneklerden alınarak kuyucuklara eklendi ve Light Cycler 480 cihazına konularak real time PCR işlemi için göreceli kuantifikasyon modunda profil belirlendi; Denatürasyon: 95 oC’de 10 dk’ya 1 döngü olarak; Amplifikasyon: 95 oC’de 5 sn; 54 oC’de 20 sn; 72 oC’de 1 sn; 55 döngü olarak; Soğuma: 40 oC’de 30 saniye 1 döngü olarak ayarlandı ve cihaz çalıştırıldı. Real Time PCR analizi ile gruplar arası bcl-2, bax, casp-3, Nox-2 genlerinin β-actin genine göre ekspresyon seviyeleri sonuçları kaydedildi.
3.3. İstatistiksel Değerlendirme
Çalışmamızda elde edilen veriler aritmetik ortalama standart sapma olarak ifade edildi. İstatistiksel analizler SPSS 11.0 (Chicago, ill., USA) programı kullanılarak yapıldı. Gruplar arası karşılaştırma tek yönlü varyans analizi (ANOVA) ve post hoc Tukey testi kullanılarak yapıldı. Tüm istatistiksel analizlerde anlamlılık düzeyi p0.05 olarak kabul edildi.
4. BULGULAR
4.1.Farmakolojik ve Biyokimyasal Bulgular
Çalışmamızda bütün gruplarda ölçtüğümüz perfüzyon basıncı ve LVDP mmHg cinsinden, KAH atım/dk, LV(dP/dt)max ve LV(dP/dt)min
değerleri ise mmHg/sn olarak hesaplanmıştır. Tüm gruplara ait elde edilen veriler Tablo 2’ de gösterilmiştir. Gruplara ait PP, KAH, LVDP, LV(dP/dt)max
ve LV(dP/dt)min değerleri şekil (11, 12, 13, 14, 15) de gösterilmiştir. MDA
sonuçları ise şekil 16’da gösterilmiştir.
Tablo 2. Gruplara (n=8)ait perfüzyon basıncı, kalp atım hızı (KAH),
LV(dP/dt)max, LV(dP/dt)min ve MDA verileri aritmetik ortalama ± standart sapma olarak verilmiştir. a p<0.001 kontrol grubu ile karşılaştırıldığında, b p<0.05 Dox grubu ile karşılaştırıldığında
Kontrol Dox Dox+Nec Nec
Perfüzyon basıncı (mmHg) 79,23±10,54 121,75±30,25a 92,12±18,66b 78,48±9,90 KAH (Atım/dk) 135,12±28,04 89,50±15,40a 116,12±8,60b 128,12±17,77 LVDP (mmHg) 57,12±19,27 28,87±4,01a 47,62±12,20b 60,37±15,36 LV(dP/dt) max (mmHg/sn) 952,50±98,46 257,38±138,64a 456,88±182,20b 977,88±67,18 LV(dP/dt) min (mmHg/sn) 1475,6±202,1 280,12±100,64a 532,75±112,54b 1323,3±252,35
Şekil 11:Bütün gruplarda, Kalp Atım Hızı (atım/dk) (n=8) ( a p<0.001 kontrol grubu ile
karşılaştırıldığında, b p<0.05 Dox grubu ile karşılaştırıldığında)
Şekil 12: Bütün gruplarda, Perfüzyon basıncı (mmHg) (n=8) ( a p<0.001 kontrol grubu ile
Şekil 13: Bütün gruplarda, Sol Ventrikül Gelişen Basıncı (mmHg) (n=8) ( a p<0.001 kontrol
grubu ile karşılaştırıldığında, b p<0.05 Dox grubu ile karşılaştırıldığında)
Şekil 14: Bütün gruplarda ölçülen sol ventrikül kasılma hızı (mmHg/sn) (n=8)
Şekil 15: Bütün gruplarda ölçülen sol ventrikül gevşeme hızı (mmHg/sn) (n=8)
( a p<0.001 kontrol grubu ile karşılaştırıldığında, b p<0.05 Dox grubu ile karşılaştırıldığında)
Şekil 16: Bütün gruplarda ölçülen Malondialdehit(MDA) miktarı (nmol/gram doku) (n=8)
( a p<0.001 kontrol grubu ile karşılaştırıldığında, b p<0.05 Dox grubu ile karşılaştırıldığında)
Gruplar arası karşılaştırma yapıldığında; perfüzyon basınçlarının Dox grubunda kontrol grubuna göre anlamlı olarak arttığı görüldü (p< 0.001). Artan perfüzyon basıncının Dox+Nec-1 grubunda Dox grubuna göre anlamlı
olarak azaldığı gözlendi (p< 0.05). Tek başına Nec-1 verilen grupta kontrol grubuna göre perfüzyon basınçlarında anlamlı bir fark görülmedi (p>0.05).
Kalp atım hızları Dox grubunda kontrol grubuna göre anlamlı olarak azalırken (p< 0.001), Dox+Nec-1 grubunda Dox grubuna göre anlamlı olarak arttığı gözlendi (p< 0.05).
LVDP yanıtlarına bakıldığında, Dox grubunda kontrol grubuna göre anlamlı bir azalma olduğu görüldü (p< 0.001). Dox grubundaki bu azalmanın Dox+ Nec-1 grubunda anlamlı olarak arttığı görüldü (p< 0.05). Tek başına Nec-1 verilen grupta kontrol grubuna göre anlamlı bir fark görülmedi (p> 0.05).
LV(dP/dt)max yanıtlarına bakıldığında, Dox grubunda kontrol grubuna göre anlamlı bir azalma olduğu (p< 0.001) gözlendi. Dox grubundaki bu azalmanın Dox+Nec-1 grubunda anlamlı olarak arttığı görüldü (p< 0.05). LVDP yanıtlarına benzer olarak tek başına Nec-1 verilen grupta kontrol grubuna göre anlamlı bir fark görülmedi (p> 0.05).
LV(dP/dt)min yanıtlarına bakıldığında, Dox grubunda kontrol grubuna göre anlamlı bir azalma olduğu (p< 0.001) gözlendi. Dox grubundaki bu azalmanın Dox+ Nec-1 grubunda anlamlı olarak arttığı (p< 0.05), tek başına Nec-1 verilen grupta ise kontrol grubuna göre anlamlı bir fark görülmedi (p> 0.05).
Lipid peroksidasyonun son ürünü olan MDA sonuçlarına bakıldığında ise; Dox grubunda kontrol grubuna göre anlamlı olarak arttığı (p< 0.001) gözlendi. Artan MDA değerinin Dox+Nec-1 grubunda Dox grubuna göre anlamlı olarak azaldığı gözlendi (p< 0.05).
4.2.Histopatolojik Bulgular
Kontrol Grubu: Normal histolojik yapı izlendi. Kas liflerinde enine
striasyonlar belirgin olarak izlenirken aralarında küçük kapiller yapılar ve endomisyum izlendi (Şekil 17). Bazofilik boyanmış oval ökromatik çekirdeklerin yanı sıra interkalat disklerle birbirine bağlanmış miyokardiyal kalp kası hücreleri gözlendi (Şekil 18).
Şekil 17: Kontrol grubu: Miyokardiyal kas lifleri arasında kapiller( ) ve
interstisyel bağ dokusu (*) (Azan, Bar:50 µm)
Şekil 18: Kontrol grubu: Oval, ökromatik ve santral yerleşimli nukleus (N),
striasyon gösteren miyokardiyal kas lifleri (H-E,Bar:20 µm)
Doksorubisin Grubu: Kas liflerinde tekli veya gruplar şeklinde
vakuolümsü yapılar ve yaygın hemorajiler izlendi (Şekil 19). Bazı kesitlerde fokal ödem yanısıra kas liflerinde hyalinizasyon gözlendi (Şekil 20). Aynı grubun diğer bir kesitinde ise interstitiel ödem ve fibrozis izlendi (Şekil 21).
Şekil 19: Doksorubisin grubu: miyokardiumda yaygın hemoraji (H-E, Bar:50 µm)
Şekil 20: Doksorubisin grubu: Kas liflerinde hyalinizasyon (H), fokal ödem ( )
Şekil 21: Doksorubisin grubu: miyokartta oluşan fibrozis
tablosu (F) ve ödem ( ) (Azan, Bar:20 µm)
Nekrostatin-1 Grubu: Kalp kesitlerinde normal kapiller görünüm,
sitrasyon ve interkalat diskler ile santral yerleşim gösteren oval ve ökromatik nukleusa sahip kalp kası hücreleri izlendi (Şekil 22,23).
Şekil 22: Nec-1 grubu: Miyokardiumun longitudinal kesitinde santral yerleşimli
oval ökromatik nukleus (N) ve normal histolojik yapıda interkalat diskler ( ) (H-E, Bar:50 µm)