SATIŞA SUNULAN BAZI BİTKİ TÜRLERİNİN BİYOLOJİK ÖZELLİKLERİNİN BELİRLENMESİ
Gülsüm NARİN YEŞİLYAPRAK Yüksek Lisans Tezi Biyoloji Anabilim Dalı
SATIŞA SUNULAN BAZI BİTKİ TÜRLERİNİN BİYOLOJİK ÖZELLİKLERİNİN BELİRLENMESİ
Gülsüm NARİN YEŞİLYAPRAK
Dumlupınar Üniversitesi
Lisansüstü Eğitim Öğretim ve Sınav Yönetmeliği Uyarınca Fen Bilimleri Enstitüsü Biyoloji Anabilim Dalında
YÜKSEK LİSANS TEZİ Olarak Hazırlanmıştır.
Danışman: Doç.Dr. Ferdağ ÇOLAK
KABUL VE ONAY SAYFASI
Gülsüm NARİN YEŞİLYAPRAK’ın YÜKSEK LİSANS tezi olarak hazırladığı “SATIŞA SUNULAN BAZI BİTKİ TÜRLERİNİN BİYOLOJİK ÖZELLİKLERİNİN BELİRLENMESİ” başlıklı bu çalışma, jürimizce Dumlupınar Üniversitesi Lisansüstü Eğitim Öğretim ve Sınav Yönetmeliğinin ilgili maddeleri uyarınca değerlendirilerek kabul edilmiştir.
26/10/2017
Üye: Doç. Dr. Ferdağ ÇOLAK (Danışman)
Üye: Prof. Dr. Asım OLGUN
Üye: Doç. Dr. Tuba İÇA
Fen Bilimleri Enstitüsü Yönetim Kurulu'nun .../.../... gün ve ... sayılı kararıyla onaylanmıştır.
Prof. Dr. Hasan GÖÇMEZ Fen Bilimleri Enstitüsü Müdürü
ETİK İLKE VE KURALLARA UYGUNLUK BEYANI
Bu tezin hazırlanmasında Akademik kurallara riayet ettiğimizi, özgün bir çalışma olduğunu ve yapılan tez çalışmasının bilimsel etik ilke ve kurallara uygun olduğunu, çalışma kapsamında teze ait olmayan veriler için kaynak gösterildiğini ve kaynaklar dizininde belirtildiğini, Yüksek Öğretim Kurulu tarafından kullanılmak üzere önerilen ve Dumlupınar Üniversitesi tarafından kullanılan İntihal Programı ile tarandığını ve benzerlik oranının %24 çıktığını beyan ederiz. Aykırı bir durum ortaya çıktığı takdirde tüm hukuki sonuçlara razı olduğumuzu taahhüt ederiz.
SATIŞA SUNULAN BAZI BİTKİ TÜRLERİNİN BİYOLOJİK ÖZELLİKLERİNİN BELİRLENMESİ
Gülsüm NARİN YEŞİLYAPRAK Biyoloji, Yüksek Lisans Tezi, 2017 Tez Danışmanı: Doç.Dr. Ferdağ ÇOLAK
ÖZET
Bu çalışmada yeşil kahve (Coffee arabica)’nin, menengiç kahvesi(Pistacia spp.)’nin çekirdekleri, şerbetçi otu (Humulus spp. )’nun ve yeşil çay (Camellia sinensis)’ ın kurutulmuş yaprakları kullanılmış olup bitki örnekleri çeşitli aktarlardan temin edilmiştir. İncelenen bitki kısımlarının su, kloroform, etil asetat, aseton, etanol ve metanolekstraktları hazırlanmıştır. Elde edilen ekstraktlarınantimikrobiyal aktiviteleri mikrodilüsyon yöntemi Minimal İnhibisyon Konsantrasyonu (MİK) ile belirlenmiştir.
Antimikrobiyal aktivite çalışmasında test edilen mikroorganizmalar gram pozitif mikroorganizmalardan Staphylococcus epidermidis, Bacilluspumilus ve Enterococcus faecalis gram negatif mikroorganizmalardan Escherichia coli, Enterobacter aerogenes, maya olan
Candida albicans, küf olan Aspergillus fumigatus kullanılmıştır. Antimikrobiyal aktivite
testinde kullanılmak üzere çalışmada, Kütahya ilinde bulunan (Yolcalı ve Gediz mevkinden) doğal ortam sularından toplam 50 adet su örneği (2016 yılı Mayıs – Eylül aylarında) toplanmıştır. Su örnekleri filtrasyon işleminden sonra inkübasyonabırakılmıştır. İnkübasyon işleminden sonra şüpheli koloniler Lateks aglütinasyon test kiti ile serogrupları belirlenmiştir. Su örneklerinden 1 adet Legionella spp. izole edilmiştir. Elde edilen bu izolat, bitkilerin antimikrobiyal aktivite çalışmasında kullanılmıştır. Çalışılan bitkilerden yeşil kahvenin genel olarak su, kloroform etilasetat ve aseton ekstrelerinde test edilen mikroorganizmaların tümüne karşı iyi ve orta derecede aktivite gösterdiği görülmüştür. Yeşil çayın elde edilen su ekstresinde hariç diğer ekstrelerde tüm test edilen mikroorganizmalara karşı iyi ve orta derecede antimikrobiyal aktivite belirlenmiştir. Menengiç kahvesinin çekirdeklerinin etanol, kloroform aseton ekstresinde denenen tüm mikroorganizmalara karşı iyi ve orta seviyede antimikrobiyal etkinlik gözlemlenmiştir. Şerbetçi otu bitkisinin yapraklarının etanol ekstresi hariç denenen tüm ekstraktların test edilen tüm mikroorganizmalara karşı iyi ve orta derecede antimikrobiyal aktivite belirlenmiştir.
Anahtar Kelimeler: Antimikrobiyal aktivite, Legionella spp., Menengiç kahvesi, MİK, Şerbetçi otu, Yeşil çay, Yeşil kahve.
DETERMINATION OF BİOLOGICAL PROPERTIES OF SOMECOMEREALLY AVAILEBLE PLANT SPECIES
Gülsüm NARİN YEŞİLYAPRAK
Deparment of Biology, Post Graduate Thesis, 2017 Thesis Supervisor: Assoc. Prof. Ferdağ ÇOLAK
SUMMARY
In this study, the dried leaves of green coffee (Coffee arabica), menengic coffee (Pistacia spp.), Hops (Humulus spp.) and Green tea (Camellia sinensis) were used and the samples were obtained from various sources. Water, chloroform, ethyl acetate, acetone, ethanol and methanol extracts of investi gated plant parts were prepared. Theantimicrobialactivities of the obtained extracts were determined by microdilution methodas Minimal Inhibition Concentration (MIC) unit. Microorganisms tested in antimicrobial activity studies were chosen
Staphylococcus epidermidis, Bacillus pumilus and Enterococcus faecalisas gram positive
microorganisms and Escherichia coli and Enterobacter aerogenes as gram negative microorganisms, Candida albicans as yeast, Aspergillus fumigatus as mold. A total of 50 watersamples (from the months of May to September 2016) were collected from the natural local waters in Kütahya province (from Yoncalı and Gediz sites) in order to be used in the antimicrobialactivity test.
The water samples were left forin cubation after filtration process. After incubation process, serogroups of suspected colonies were determined with the latex agglutination test kit. One Legionella spp. was isolated from water samples. This obtaine disolate was used to study the antimicrobial activity of our plant species. Out of thein vestigated plants, gren coffee generally showed good and moderate activity againstall of the microorganisms tested in water, chloroform, ethylacetate and aceton eextracts. Antimicrobial activity was well and modestly determined against all tested microorganisms in other extract sexcept in gren tea water extract. Good and intermediate antimicrobial activity was observed against all microorganisms tested in ethanol, chloroform and acetone extracts of menengic coffee seeds. Good and moderate antimicrobial activity was determined against all microorganisms tested in all extracts tested except the ethanol extract of the leaves of the hops was determined.
Keywords: Antimicrobial activity, Green coffee, Green tea, Hops, Legionella spp., Menengic coffee, MIC.
TEŞEKKÜR
Çalışmam sırasında benden yardımlarını esirgemeyen, tez konumun seçimiminde veyapım aşamasında her türlü desteği bana sağlayan ve her konuda sonsuz sabır gösteren sevgili danışman hocam Sayın Doç. Dr. Ferdağ ÇOLAK’a teşekkürlerimi bir borç bilirim.
Çalışmam boyunca bana her türlü maddi ve manevi desteği gösteren sevgili aileme ne kadar teşekkür etsem azdır. Her zaman beni destekleyen ve moral veren babam Mehmet NARİN’e annem Hatice NARİN’e ve kardeşlerime ayrıca çalışmalarım da bana destek veren Eşim Ferhat YEŞİLYAPRAK’a teşekkür ederim.
Deneysel çalışmalarımda bana yardımcı olan Yüksek lisans Öğrenci arkadaşlarıma teşekkür ederim.
İÇİNDEKİLER Sayfa ÖZET ... v SUMMARY ... vi ŞEKİLLER DİZİNİ ... x ÇİZELGELER DİZİNİ ... xi
SİMGELER VE KISALTMALAR DİZİNİ ... xii
1. GİRİŞ ... 1
1.1.Yeşil Kahve (Caffe Arabica) ... 2
1.2. Menengiç Kahvesi (Pistacia spp.) ... 3
1.3. Şerbetçi Otu (Humulus spp.) ... 4
1.4. Yeşil Çay (Camellia sinensis) ... 4
1.5. Gram Pozitif Mikroorganizmalar ... 5
1.6. Gram Negatif Mikroorganizmalar ... 6
1.7. Maya ve Küf ... 8
1.8. Antimikrobiyal Aktivitenin Belirlenmesinde Kullanılan Yöntemler ... 10
1.8.1. Dilüsyon yöntemi ... 10
1.8.1.1. Broth dilüsyon yöntemi ... 10
1.8.2. Difüzyon yöntemi ...11
1.8.2.1. Agar difüzyon yöntemi ... 11
1.8.2.2. Kâğıt disk agar difüzyon yöntemi ... 11
1.8.2.3. Agar kuyucuk difüzyon yöntemi ... 12
1.9. Araştırmanın Amacı ve Önemi ... 12
2. MATERYAL VE METOD ... 13
2.1. Materyal ... 13
2.1.1. Biyolojik metaryaller ... 13
2.1.1.1. Antimikrobiyal aktivite belirlenmesinde kullanılan bitkiler ... 13
2.1.1.2. Antimikrobiyal aktivite belirlenmesinde kullanılan mikroorganizmalar .... 13
2.1.2. Kimyasal materyaller ... 14
İÇİNDEKİLER (devam)
Sayfa
2.1.4. Legionella spp. izolasyonunda kullanılan besiyerleri ... 15
2.1.5. Kullanılan çözeltiler ... 16
2.1.6. Kullanılan boyalar ... 16
2.2. Metod ... 17
2.2.1. Bitki ekstratların hazırlanışı ... 17
2.2.2. Legionella spp. örneklerin toplanması, Legionella izolasyonu, serotip düzeyinde tanımlanması ... 17
2.2.3. Antimikrobial aktivite deneyin yapılışı ... 19
3. BULGULAR ... 20
4. TARTIŞMA VE SONUÇ ... 32
ŞEKİLLER DİZİNİ
Şekil Sayfa
ÇİZELGELER DİZİNİ
Çizelge Sayfa
2.1. Antimikrobiyal aktivite testinde kullanılan mikroorganizmalar. ... 13 3.1. Yeşil kahveçekirdeği verim hesabı. ... 20 3.2. Yeşil kahve (Caffe arabica)’nin kullanılan test mikroorganizmalarına karşı gösterdikleri
MİK (mg/mL) değerleri... 21 3.3. Menengiç kahvesi çekirdeği verim hesabı. ... 23 3.4. Menengiç kahvesi(Pistacia spp.) ’nin kullanılan test mikroorganizmalarına karşı
gösterdikleri MİK (mg/mL) değeri. ... 24 3.5.Şerbetçi otu yaprağının verim hesabı. ... 25 3.6. Şerbetçi otu (Humulus spp.)’nun kullanılan test mikroorganizmalarına karşı gösterdikleri
MİK (mg/L) değerleri. ... 27 3.7.Yeşil çay yapraklarının verim hesabı. ... 28 3.8. Yeşil çay (Camellia sinensis)’ın kullanılan test mikroorganizmalarına karşı gösterdikleri
SİMGELER VE KISALTMALAR DİZİNİ Simge Açıklama °C Santigrad Derece µg Mikrogram µL Mikrolitre µm Mikrometre µM Mikromolarite Kısaltma Açıklama
ARS Zirai Araştırma Kurumu
ATCC Amerikan Kültür Koleksiyonu
BCYE Buffered Charcoal Yeast Extrac (Tamponlu Kömür Maya Ekstraktı)
cm Santimetre cm3 Santimetreküp g Gram GSH Redükte glutatyon türü H2O2 Hidrojen Peroksit HCl Hidroklorik Asit MDA Malondialdehit
MHB Müller Hilton Broth Agar Besi yeri MİK Minimum İnhibisyon Konsantrasyonu
mL Mililitre
MRSA Metisiline Dirençli Staphylococcus aureus NA Nütrient Agar Besi yeri
NaOH Sodyum Hidroksit
NCCLS Ulusal Klinik Laboratuvarı Standartları Komisyonu
nm Nanometre
PHB Polihidroksi bütirat
SOD Süperoksit dismutaz
VRE Vankomisine Dirençli Enterokok
1. GİRİŞ
Dünyanın birçok farklı bölgelerinde tıbbi özelliğe sahip bitkilerin antimikrobiyal özelliklerinin kullanılması artış göstermektedir. Dünya Sağlık örgürtünün tahminine göre bitki ekstrakları veya bitkilerin aktif bileşenleri dünya nüfusunun %80’i tarafından geleneksel tedavilerde kullanılmaktadır. Tıbbi ve Aromatik Bitkiler, artan sağlık sorunları ve güvenli gıda talebi nedeniyle son yıllarda ilgi odağı haline dönüşmüştür (Pezikoğlu ve Tınmaz, 2014). Ülkemiz zengin florasıyla (belirli bir bölge veya ülkede yetişen bitki çeşidi) çok sayıda tıbbi ve aromatik bitkiyi bünyesinde barındırmaktadır. Bitkiler, insan yaşamının devam edebilmesi için gerekli olan oksijen ve besinleri sağlarlar. Bitkilerin tedavide kullanımları insanlık tarihiyle birlikte başlamıştır. Binlerce yıl önce insan, bitkilerin tedavi edici gücünü keşfetmiş ve sağlıklı yaşayabilmek için bitkilerden yararlanmaya başlamıştır.Halk hekimliği uygulamalarına yaygın olarak rastlanan Anadolu’dahalk ilaçları, uzun tecrübeler sonunda günümüze kadar gelmiş çözüm yollarındadandır (Adıgüzel vd., 2005; Faydaoğlu, 2011).
Yurdumuzda oldukça farklı iklimlerden vecoğrafi bölgelerden dolayı 9000’e yakın doğal bitki türü ile dünyanın en önemli florastik merkezlerindendir. Dünya Sağlık Örgütünün 91 ülkenin tıbbi bitkiler üzerine yapılmış yayınlarına dayanarak hazırladığı bir araştırmaya göre tedavi için kullanılan tıbbi bitkiler 20.000 civarındadır(Ersoy,2014). Bitkilerin mikroorganizmaları öldürücü ve insan sağlığı için önemli olan özellikleri 1926’dan bu yana laboratuvarlarda araştırılmaktadır (Erdoğrul ve Çakıroğlu, 2002).
Modern tıpta kullanılan pek çok ilaç da bitkilerden elde edilmektedir (Castro, 2005).Ülkemizde bitkisel zenginlik; üç fitocoğrafik bölgenin kesiştiği bölgede bulunması, Güney Avrupa ileGüney batı Asya floraları arasında köprü görevi görmesi, pek çok cins ve seksiyonun farklılaşım merkezi olmasından kaynaklanmaktadır. Buna rağmen bu bitki zenginliğinden yeterince faydalanılmadığı düşünülmektedir. Tüm dünyada olduğu gibi ülkemizde de doğal florada bulunan bitkilerin tedavi amaçlı, gıda, baharat, çay, boya, hayvan hastalıklarının tedavisi, insektisit, reçine, zamk, uçucu ağlarından faydalanma, meşrubat ve kozmetik sanayinde kullanımı uzun yıllardan beri süregelen geleneksel kültürel zenginliğimizin bir parçası olmuştur (Tarakçı, 2006).
Dünyada gelişmiş ülkelerde bu bilincin farkında olup aşırı kimyasal madde (hormon ilaç gübre v.s.) kullanımından kaçınılmakta, belirli bir standardı taşımayan ürünlerin ithal veya ihraç imkânıbulunmamaktadır. Ancak, bakterilerde antibiyotik dirençliliğinin artmasına karşılık antimikrobiyal özellik gösteren bitkilere ve bitkisel ürünlere karşı direnç kazandığı görülmemektedir (Toroğlu ve Çenet, 2006). Bitkisel droglarda etkili saf bileşiklere oranla, letal
doz ile efektif doz arasındaki mesafe oldukça geniştir. Bu nedenle bitkisel droglar ile zehirlenerek ölüm ihtimali saf etkili maddelere oranla çok daha azdır. Bu da halk arasında bitkilerin tedavi amaçlı kullanımını arttırmaktadır (Baytop, 1999).
1.1. Yeşil Kahve (Caffee arabica)
Yeşil kahve çekirdekleri klorojenik asidin doğada önemli bir kaynağıdır ve tüketimleri, antihipertansif etki, insan vazo-reaktivitesinde düzelme, yağ birikimi ve vücut ağırlığı üzerindeki engelleyici etkileri farelerde ve insanlarda denenmiştir (Ersoy, 2014). Yeşil kahveçekirdeklerinin kavurma işlemi, bazı klorojenik asit izomerleri miktarlarını azaltır. Yeşil kahve’nin temel kimyasal bileşimi öncelikle genetik özelliklere ve olgunlaşma derecesi gibi fizyolojik özelliklere bağlıdır. Kabuksuz kahve çekirdeğinin zayıf uçucu fraksiyonu onlara zayıf ama karakteristik bir aroma verir. Yeşil kahve özellikle tropikal bölgelerde yetişen bununla birlikte sıcak bölge iklimini seven bir türdür. Yeşil kahvetohumlarında yaklaşık 100 farklı uçucu bileşik belirlenmiştir. Kavrulmuş kahve içerisindeki uçucu bileşiklerin çeşitliliği ve konsantrasyonları, ham tohumlarda ve kavurma koşullarındaki uçucu olmayan bileşiklerin bileşimine bağlıdır. Bu nedenle, genetik, toprak, tarım uygulamaları, iklim ve olgunlaşma derecesi gibi faktörler, kavrulmuş kahvenin uçucu fraksiyonunun son kompozisyonunu etkiler. Kavurma işleminden sonra, farklı kahve türlerinde, başlangıçlarına, kavurma derecelerine ve kullanılan analitik yöntemlere bağlı olarak 950'den fazla bileşik tespit edilmiştir (Stevens ve Deinzer, 1997).Yeşil kahveyi diğer kahvelerden ayıran en büyük özellik ise diğer kahveler gibi işlem görmemesidir. İşlem görmediği için klorojenik asit yönünden zengindir. Kavrulmadığı için ise kafein oranı da diğer kahvelere göre daha düşüktür (Korkmaz, 2016).
Yeşil kahveçekirdeğinin, kan şekeri düzeyini kontrol etmeye yardım ettiği ve bu şekilde şeker hastalığını azaltabileceğine dair çalışmalar mevcuttur. İçeriğindekiklorojenik asit ve kafein sayesinde, belli seviyede yağ yakımını hızlandırdığıbilinmektedir. Bazal metabolizmayı hızlandırarak kilo verme ayrıca kilo korumaya yardımcı olduğu düşünülmektedir.
Yüksek antioksidan etkiye sahip olduğu için hücrede oluşan hasarları önleyerek yaşlanma belirtilerinin azalmasına yardımcı olur (www.pharmetic.org/fitoterapi/yesil-kahve).
Klorojenik asitler, sinamik asit olarak bilinen fenolik bileşikler ve quinic asit arasında oluşan esterler sınıfına girerler. Benzen halkası içeren organik maddeler genel olarak fenolik bileşikler olarak tanımlanırlar. Fenol adıyla bilinen hidroksibenzen bir başka değişle bir adet hidroksil grubu içeren benzen, fenolik bileşiklerin en basit şeklidir. Kahvede en çok bulunan klorojenik asit 5- O -caffeoylquinic asittir ki; bu, caffeic asitler ve quinic arasındaki ester oluşumudur, yukarıda şekildegösterilmiştir (Söylemezoğlu, 2003).
1.2. Menengiç Kahvesi (Pistacia spp.)
Koyu pembemsi-mor renginde minik meyveler veren, makimsi bir ağaçtır.Pistacia spp., sakızağacıgiller familyasından Akdeniz bölgesinde bulunan yaprak döken bir çalı türüdür.Akdeniz bölgesinin yanı sıra menengiç kahvesi Güneydoğu Anadolu bölgesinde de fazlaca yetiştirilmektedir. Alkali topraklarda yetiştirilmesi daha kolay olmaktadır.6-9 m' ye kadar boyları uzar. Karşılıklı dizilmiş olarak görünenbileşik yapraklar 5-11 parlak yapraktanoluşur ve yoğun reçine kokusu verir. Pembe-mor renkli çiçekleri İlkbahar da görülür. Meyveleri küçük, yuvarlakbiçiminde olup olgunlaşma döneminde kahverengiye dönüşür (Ersoy, 2014).TohumlarSonbaharda olgunlaşır. Drenajı iyi, kuru ve sıcak toprakları daha fazla tercih eder.
Menengiç kahvesi Türkiye'de menengiç ağacı, kıyı kesimlerdeki tepelik ve kayalık yerlerde daha çok Toros dağlarındaki çam ormanlarında, yaklaşık 1600 m yükseklikte yetişmektedir (Deinzer, 1997). Dünyanın değişik yerlerinde menengiç ağacının farklı kısımlarından çokyönlü yararlanılmaktadır. Türkiye'de, arkeolojik bulgular menengiçin eskiçağlardan beri gıda kaynağı olarak kullanıldığını göstermiştir. Taze sürgün vemeyveleri beslenme ağırlıklı kullanılmaktadır. Meyvelerininiştah açıcı aynı zamanda özel köy ekmeklerinde, kahve ve çay şeklinde tüketilmektedir. Aynı zamanda karın ağrısı, romatizma ve öksürükte kullanılmaktadır. Menengiç ağacının meyvelerinden menengiç kahvesi, menengiç sabunu ve bıttım sabunu üretilir (Deinzer, 1997).
1.3. Şerbetçi Otu (Humulus spp.)
Yer altı kök kaynağının kök sapından her bahar yeniden büyüyen çok yıllık bir bitkidir. Sarmaşık şeklinde dalları ile her yıl ince uzun, tırmanıcı, 6-9 m’ye kadar uzayan bir bitki olarak tanımlanmıştır (Baytop, 1984).Yaprakları koyu-yeşil renkli, uzun saplı, 3-5 lobluyürek şekilli, keskin dişe benzer çıkıntılıdır ve pürüzlü yüzeye sahiptir. Dal üzerinde biri diğerinin karşısında yerini alır, ancak bazen üst yapraklar dal üzerinde tek tek düzenlenir. Dişi ve erkek çiçekleri ile dioik (iki evcikli; üreme organları ayrı canlılara ait) bir bitkidir. Dişi çiçekleri Ağustos-Eylül aylarında olgunlaştığında, renkleri parlak yeşilimsi-sarıdan, sarı-kahveye döndüğünde toplanır.
Humulus spp. bira endüstrisinde ham materyal olarak dünya’nın her yerinde kullanılan, tanınmış
bir bitkidir (Stevens, 2000).
19.yüzyılın başlarında bitkinin özütlenmesi ilk olarak su ve etanol içinde denenmiştir ama genellikle buhar ve karbondisülfür’ün kullanımı gibi diğeryöntemler rapor edilmiştir. Şerbetçi otu özütlerinin üretimi reçinebileşenlerinin reaktifliği vekimyasal yapısının aydınlatılmasıyla son yüzyılda geliştirilmiştir. Lipofilik yapısından dolayı reçine bileşenlerini çözmek için kloroform, aseton, hekzan ve alkolleri içeren etkili çözücülerin geniş bir aralığı kullanılmıştır. Son zamanda yapılan çalışmalarda potansiyel kanserkemoterapötik etkinlikleri incelendi ve bitkiden eldeedilen bazı etken bileşiklerin çok ilgi gösterdiği kabul edildi. Bunlar arasında, ksantohumol, kanser engelleyici mekanizmaların kan spektrumuna sahip bileşik olarak kanıtlanmıştır (Zanoli ve Zavatti, 2008).Cleemput ve ark. (2009)’ları, sert asitlerin biyolojik ve farmakolojik özelliklerininyanı sıra her bir fotokimyasal yönünü içerenşerbetçi otu sert asitlerini özetlemişlerdir. Kanser, diyabet, kemik ve buna yakın eklemin iltihabı, osteoporoz ve kardiyovaskülerhastalıkları içeren birçok insan hastalıklarının engellenmesi ve tedavisi için şerbetçi otu sert asitleri gösterilmiştir.
1.4. Yeşil Çay (Camellia sinensis)
Theanine, doğal olarak Camellia sinensis yapraklarında bulunan bir aminoasittir.
Camellia sinensisiçerdiği bu madde, çayı tüketenler için büyük fayda, rahatlatma ve
sakinleştirme gibi etkiler sağlamaktadır. Dünyada üretilen üç milyon ton çayın yedi yüz bin tonunu yeşil çay oluşturmaktadır. Yeşil çay üretimi, özellik ve işlenme yönünden siyah çaya benzememektedir. Fabrikalara gelen yeşil çay yaprakları yüksek sıcaklıkta şok soldurma sistemiyle yükseltgenme enzimlerini inaktif hale geçmelerini sağlamaktadır. Bu işlemler sonucunda yeşil çay yaprakları renklerini yeşil olarak korumaktadır (www.yeşil.çay). Bu bitkinin içersinde bulunan vitamin, mineral ve bileşenlerin gripten kansere kadar birçok hastalığı tedavi edici gücü olduğu tespit edilmiştir.Bunların yanında yeşil çayın birçok bulaşıcı
ve yaygın hastalıktan korunmaya karşı etkili bir bitki olduğu bilinmektedir. Ayrıca yeşil çayın güneşten kaynaklanan bazı cilt sorunlarında da tedavisinde kullanıldığı bilinmektedir (Balentine, 1997; McKay, 2002).
1.5. Gram Pozitif Mikroorganizmalar
Gram reaksiyonuna göre bakteriler 2 grupta incelenir. Bunlar; Gram pozitif ve gram negatif bakterilerdir. Bakterilerin hücre duvar yapılarından kaynaklanan farklılıktan dolayı mikroskobik bakıda bakterilerin farklı renkte göründüğü bilinmektedir (Yücel, 1987).
Staphylococcus epidermidis; Gram-pozitif ve salkım halinde bulunan bir bakteri
çeşididir. Koagülaz-negatifve katalaz-pozitifözellikte olup zaman zaman insan ve hayvan cildindekimukoz membranlarında görülebilir. Kontaminasyona bağlı olarak, Staphylococcus
epidermidislaboratuvar testlerinde en fazla görülen türdür. Bu bakteri genellikle patojen olmasa
da, immün sistemi yetersiz çalışan hastalar ve sürekli kateter takılı olan hastalar için büyük bir sorundur. Birçoğu ince bir salgı oluştururarak tıbbi protezlerin yüzeyine de yerleşir.
Staphylococcus epidermidis sık sık penisilin ve metisilini de içeren geniş bir antibiyotikgrubuna
direnç gösterir. Streptokoklar %10 CO2’li ortamda inkübasyonla, daha belirgin hemolitik
aktivite gösterirler. Streptokokların hemolitik aktivitelerinde, suşlara göre farklılıklar görülebilmektedir. Streptokoklar %6.5 NaCl ortamında üreme göstermezler. Streptokokların antijenik yapıları oldukça komplekstir. Karbonhidrat ve protein yapısında antijenler yanında, bazı strepkoklarda hyaluronik asit yapısında kapsül antijeni de bulunur. Fagasitozu önleyerek, virulans arttırıcı etki gösterebilen kapsül N-acetyl-D glycuronic asit ünitelerinden meydana gelmiştir. Streptokok hücre duvarı M,T,R protein antijenlerini, gruba özgül karbonhidratları ve peptidoglikan kapsar. Kapsülden lipoteichoic asit ve tip spesifik M proteini taşıyan pililer çıkmaktadır (Cengiz, 1999). Kolonileri bir gecelik inkübasyon süresinden sonra tipik olarak beyaz, küçük veya bej renkli olabilir. Buorganizma desferrioksamine duyarlıdır ve bu test onu diğer stafilokoklardan ayırmak için kullanılır (Lodder,1979; Yücel, 1987).
Bacillus pumilus; Yaygınolarak toprakta bulunan bir gram-pozitif, aerobik, spor
oluşturan bakteridir. Bacillus pumilus UV ışığına maruz, kuruma ve hidrojen peroksit gibi oksitleyiciler mevcudiyetinde dâhil olmak üzere çevresel stresler, karşı yüksek direnç gösterir (Lodder, 1979; Yücel, 1987). Bacillus türü, aerob, sporlu basiller ailesinde bulunurlar ve özellikle taze kültürleri, gram pozitif boyanırlar. Vejetatif formları düz, kenarları biribirine paralel, ucu yuvarlak veya künt biten 0.5-1.2 µm eninde 2.5-10 µm boyunda basillerdir. Tek, tek veya uzun zincirler şeklinde görülürler. Endosporları silindirik, oval, yuvarlak veya böbrek şeklinde olup, türlere göre santral, terminal veya subterminal konumda bulunurlar.
Bacillustürleri kanlı agar veya nutrient agar gibi üretim besiyerlerinde 18-24 saatlik inkübasyon süresinde ürerler. Agarda genellikle R tipi, gri renk, kuru mat, kenarları düzensiz ve granüllü yüzeyli koloniler yaparlar. Mikroskopta ise saç görünümünde ve uzun ipliksi yapıda görünürler. Basillus türlerinin morfolojileri birbirinden farklıdır. Bazılarında sporanjium düzgündür, sporlar elipsoid veya silindiriktir. Bazılarında ise sporanjium şiş, sporlar elipsoid olup merkezi veya terminaldir (Gerçeker, 1999).
Enterococcus faecalis; Enterococcus faecalis sporsuz formlu bir bakteri olup
fermantatif, oksijenin yokluğunda veya varlığında büyüme kabiliyetine sahip fakültatif anaerobiktir. Enterococcus faecalis hücreleri oval, 0.5-1µm çapındadır. Tek başına, çiftler halinde veya küçük zincirler halinde bulunur. Sıklıkla zincir yönünde uzarlar (Endod, 2004).
Enterococcusfaecalis, karbonhidrat, gliserin, laktat, malt, sitrat, arginin, agmantin birçok α
keto asit içeren değişik enerji kaynaklarını katabolize ederler (Mickel, 2003). Karbonhidratları asitlere dönüştürürler. Ortamın pH’ını 4.1-4.6’ya kadar düşürebilirler. Enterokoklar, dayanıklı mikroorganizma oldukları için yüksek alkali pH ve tuz konsantrasyonu içeren sert ortamlarda bile hayatta kalabilirler. Safra tuzlarına, deterjana, ağır metallere, etanol, azite ve kurutmaya karşı direnç gösterirler (Endod, 2003). 10°C’ den 45°C’ye kadar gelişim gösterebilirler aynı zamanda 60°C’ de 30 dakika canlı kalabilirler (Endod 2001). İnsan vücudunda dişeti, oral kavitede, gastrointestinal bölge ve vajinal bölgede bulunurlar (Tendolkar, 2003).
1.6. Gram Negatif Mikroorganizmalar
Gram-negatif bakteriler gram boyama sırasında kristal viyole boyasını tutmayıp akıtan bakteri türleridir. Gram-pozitifbakteriler, alkolle muamele edildikten sonra mavi rengi tutmaya devam ederlerken Gram-negatif bakteriler mavi rengi kaybederler. Gram boyama testinde kristal viyoleden sonra bir karşı boya eklemek gerekmektedir. Bu boya gram-negatif bakterileri kırmızı-pembe renge boyar. Bu test, hücre duvarlarının türüne göre çok farklı olan iki bakteri tipini ayırmakta kullanılır. Gram-negatif bakterilerin pek çoğu patojenolarak bilinir. Yani insanlarda hastalık yapma özelliğine sahiplerdir. Bu hastalık özelliği ise Gram-negatif hücre duvarının içeriğinde bulunan lipopolisakkarittenLPS (lipopolisakkarit) kaynaklanmaktadır. LPS'lerin endotoksinözelliği vardır(Phongpaichit, 1987; Hellstein, 1993).
Escherichiacoli; Memeli hayvanların kalın bağırsağında yaşayan bakteri türüdür.
Normalde bağırsakta yaşadığı için, Escherichiacoli'nin çevresel sularda varlığı dışkı kirlenmesinin bir belirtisidir. İnsanınvucuduna dışkı yoluyla geçtiği anda Escherichiacolibakteri sayısını 100 milyar ila 10 trilyon arasında arttırır. Dışkıyı oluşturan bakteriler başlıca anerobik bakterilerdir, seçmeli anerobik Escherichia coli hücrelerinin sayısı diğer bakteri türlerinin binde
biri dolayındadır. Başka hayvanlarda etkisiz olan bazı Escherichiacolitipleri insana bulaştıklarında hastalık yapma özelliği vardır.
Escherichia coli normal bağırsak florasına aittir, biyolojik sınıflandırmada da
bağırsaklarda yaşayan bakterilerden oluşan enterik bakterilerailesinde yer alır. Bakteri çubuk şeklinde olup, boyutları 1-2µm uzunluğunda ve 0.1-0.5µm çapındadır (Küssner, 1995; Sullivan 1996).Escherichia coli gram-negatif bir bakteri olduğundan endospor oluşturamaz bu yüzden pastörizasyon veya kaynatma ile ölür. Memeli hayvanların bağırsaklarında büyümeye adapte olduğu için en iyi vücut sıcaklığında çoğalabilirler(Sullivan,1996).
Enterobacter aerogenes; Enterobacteriaceae familya üyesi diğer bakteriler gibi
doğada, su insan ve hayvan dışkısında doğal olarak bulunur. İnsanlarda enfeksiyonlarının fırsatçı patojen olarak bulunabilme özelliğiyle oluşturur. Bu bakteriler peritrik kirpikleriyle hareketli sporsuz genelde kapsülsüz, gram negatif, fakültatif anaerop 0.6-1µm en 1.2- 3.0µm boyda basillerdir. Entorebacterlerde O ve H bazılarında K antijeni bulunur. Fırsatçı patojen olarak idrar yolu, üst solunum yolu, yara yanık, menenjit sepsis enfeksiyonları yapabilir (Sullivan, 1996). Enterobakter ailesindeki çoğu bakteriler, gram negatif, sporsuz bakteridir. Aynı zamanda pepton veya etözlü besiyerinde NaCl ve bir başka madde ilavesi olmadan ürerler. Aerop veya anaerop ortamların her ikisinde de üreyebilirler. Bu bakteri glikozdan fermentasyonla asit oluşturur ve bunun yanısıra gaz üretirler. Hücre duvarı çok tabakalı bir yapı gösterir ve hücre duvarını oluşturan peptidoglikan, lipoprotein, fosfolipit, protein ve lipopolisakkaritler (LPS) tabakalar halinde bulunur. Peptidoglikan ve lipoprotein tabakası hücre duvarının yaklaşık %20’sini oluşturur. Peptidoglikan organizmaya sertliğini şeklini veren çaprazbağlanmış polimerlerdir. Kalan %80’ lik bölümde lipopolisakkarit transportta görevli olan mültimerik porin proteinleri ve iki katlı fosfolipit tabakadan oluşmaktadır. Lipopolisakkaritler taşıdıkları özel polisakkarit yan zincirlerle çeşitli cinslerin antijenisini belirler aynı zaman da hücrenin endotoksik aktiviteden sorumlu kısmıdır (Erdem, 1999).
Legionella spp.;Akuatik, saprofit mikroorganizmalardır. Bu bakterilerin doğada
çoğalma ve canlılıklarını sürdürmelerinde çevresel protozoonların önemi büyüktür. Amipler, kamçılı protozoonlar ve mavi-yeşil alglerde, hücre içinde çoğalırlar ve belirli bir olgunluğa ulaşınca, hücrelerde lizise neden olurlar (Serter, 2000).Doğal sularda düşük konsantrasyonlarda bulunan bakterilerin çok az bir kısmı şebeke suyuna geçer. Ancak binaların su sitemlerinde, suyun durgun olduğu alanlarda üremeye uygun ortam bularak çoğalırlar. Klora yüksek oranda dirençli olmaları nedeni ile özellikle su depolarının dip çöküntüsünde, kommensal flora ile simbiyotik yaşam gösterirler. Su sistemi içindeki mikroorganizmaların saldığı polimerik
maddeler ve farklı mikroorganizmalardan oluşan biyofilm tabakalarının Legionella bakterilerinin çoğalması ve canlı kalmasında önemli bir etken olduğu ortaya konulmuştur (Tuğrul, 2009).
Legionella bakterileri fakültatif hücre içi parazitidir. İnsan hücreleri (fibroblast,
makrofaj, mononükleer hücreler) içinde çoğalabilmektedir (Tuğrul 2000). Bakterinin konak organizmaya girişi solunum yolları ile olmaktadır. Solunum yolu ile alınan bakterilerin ilk karşılaşacakları engel solunum epitel hücreleri üzerindeki sillerdir. Bakteriler fimbriyaları vasıtası ile solunum epitel hücrelerine adhere olurlar. Bu adhezyonun ardından solunum epitel hücreleri içinde çoğalmaya başlarlar. Konak savunmasından sorumlu birincil komponent, alveoler makrofajlardır. Spesifik antikor opsonizasyon mekanizmasının ardından Legionella’lar alveolar makrofajlar tarafından fagosite edilir (Mandel,2000).Bugüne kadar 40‘ın üzerinde
Legionella türü tanımlanmış olup, bazı türlere ait serogruplar ile birlikte Legionellaceae ailesi
60‘dan fazla üyeye sahip olduğu bilinmektedir. Bunların sadece bir kısmı insanda hastalık ile ilgilidir. En sık etken Legionella pneumophila olup, türlerin çoğunda görülmeyen çeşitli invazyon ve virülans faktörlerine sahiptir. Legionella pneumophila Sg1 vakaların %75-80‘inden, Sg2 ve Sg6 %10‘undan sorumlu tutulmuştur. Bunları Legionella micdadei, Legionella
bozemanii, Legionella dumoffii ve diğer türler takip eder. Legionella’lar üreme şartlarına göre
kokobasilden filamentöz formlara değişebilen sporsuz, kapsülsüz, hareketli, biraz düzensiz gram negatif çomak bakterilerdir. Diğer gram negatiflerden farklı aynı zamanda daha karışık bir hücre duvar yapısına sahip oldukları için boyama işlemleri biraz daha zordur. Bazı türlerin de (Legionella micdadei) aside dirençli boyanma özelliğine sahip olduğu gözlenmiştir.
Legionella’ların üremeleri oldukça zordurdolayısıyla özel ortamlara ihtiyaç duyarlar. Temel
besiyeri BCYE agar olup demir tuzları, L sistein -ketoglutarat gibi gelişme faktörleri, pH‘ı düzenleyen bir tampon veαve toksik radikallerin nötralizasyonu için aktif karbon içerir. En uygun üreme sıcaklığı 35°C‘dir; ancak 25-42°C gibi geniş bir sıcaklıkta da üreyebilirler (Pasculle, 2007).
1.7. Maya ve Küf
Candida albicans; İnsan ağzı ve sindirim sistemi içinde yaşayan pek çok organizmadan
biridir. Sağlıklı yetişkinlerin %40'ının ağzında, sağlıklı kadınların %20-25'inin vajinasında varlığı gösterilebilir. Candida albicans sindirim sistemindeki varlığıyla başka patojen bakterilerin çoğalmasını inhibe eder. Vücudun bağışıklık sistemi ve diğer zararsız bakteriler normal şartlarda Candida’yı kontrol altında tutarlar. Ancak, diğer bakterilerin sayısı Candida
zayıflamışsa veya mayanın çoğalmasına sağlayan başka şartlar mevcutsa (yüksek şeker, yüksek pH) Candida albicans zararsız olan tek hücreli biçiminden, çok hücreli, istilacı, küf gibi ipliksi biçimine dönüşür (Mikrobiyoloji Dergisi TR, 2008).
Candida türleri tek hücreli, hücre duvarında kitin ve selüloz içeren ökaryotik
kemoheterotrof organizmalardır. Tomurcuklanma(blastospor) veya ortadan ikiye bölünme ile çoğalır. Bu türlerde oluşan blastokonidiyumlar ana hücreden ayrılmadan peşi sıra uzayarak yalancı hif (psödohif), hücre duvarları birbirine paralel gerçek hif ve bir hifin ucunda veya arada bulunan tek hücreli, kalın duvarlı, oval geniş yapı olan klamidospor oluşturabilirler. Üreaz ve nitrat negatif, glikoz, maltoz, sukroz (değişken), galaktoz, ksiloz, trehalozu asimile etme özellikleri vardır (Warren vd., 1999).
Aspergillusfunigatus; Aspergillus fumigatussporları çok küçük olduğundan (ortalama
2- 3µm çapında), uzun süre havada asılı kalabilir ve solunum halinde alveollere kolaylıkla ulaşan bir mikroorganizmadır. Gerçekte solunansporların olumsuz etkileri immun sistem tarafından bertaraf edilebilmektedir. Ancak son 10-20 yılda immun baskılı tedavilerin uygulanmasındaki artış ve immun sistemi baskılanan hastaların sayısının artması, Aspergillus
fumigatusnedeniyle oluşan fungal infeksiyonların sayısında da büyük bir yükselmeye neden
olmuştur. Aspergillus fumigatus yaygın hava kaynaklı fungal patojen olarak immun yetmez konaklarda güçlü, genellikle ölümcül invazivinfeksiyonların nedenidir. 20g ağırlığında immun yeterli bir fareAspergillus fumigatus sporları solursa hayatta kalabilmesine rağmen, 20kg ağırlığında kemik iliğinakli geçirmiş birinsan Aspergillus fumigatus sporu soluduğu zaman yüksek invaziv aspergillozis (IA) riski altında olduğu bildirilmektedir. Yapılan birçok çalışmada da, klinik suşların, çevreden izole edilen suşlara göre elastaz aktivitesi farklılıkları nedeniyle daha virulan olduğu gösterilmiştir. Bu da bize patojenitenin sadece konağın bağışıklık durumuna bağlı olmadığınıgöstermektedir (Mikrobiyoloji Dergisi TR, 2008).
Aspergillus fumigatus, doğada yaygın olarak bulunan bir saprotrofik filamentli mantar
çeşididir. Dünyadaki en önemli hava kaynaklı mantar patojendir (Latgé, 1999). Havadaki conidia (aseksüel sporlar) sürekli varlığı, insanlar tarafından alerjik, pulmoner hastalıklara teneffüs edilmesine yol açmaktadır (Chung ve Sugui, 2013).Bu mikroorganizma enfeksiyonunun klinik görünümü, konukçunun bağışıklık durumuna bağlıdır. Çeşitli akciğer hastalıklarından alerjenik bronkopulmoner aspergilloz ve kronik pulmoner aspergilloz genellikle immünkompetan bireyde görülürken, invaziv akciğer aspergillozisi immün sistemi baskılanmış konukçuda ortaya çıkar (Agarwal vd., 2013).
1.8. Antimikrobiyal Aktivitenin Belirlenmesinde Kullanılan Yöntemler
Antimikrobiyal aktivitenin belirlenmesinde uygulanan testlerin teknik ve yöntemleri çeşitlilik göstermektedir (Davidson ve Parish, 1989). Antimikrobiyal maddelere (AMM) duyarlı olduğu bilinen mikroorganizma suşlarından yararlanılır. Spesifik ve duyarlı test mikroorganizmasının seçimi kullanımı bu testlerin ilk ve en önemli aşamasıdır. Bu testlerle bir AMM’nin belli bir test mikroorganizması üzerinde etkisi “Minimal İnhibisyon Konsantrasyonu” (MİK) veya “Minimal Letal Konsantrasyon”(MLK) şeklinde belirlendiği gibi, söz konusu herhangi bir mikroorganizma suşunun belli bir ortamdaki antimikrobiyal madde etkinliğinin varlığı da nitel veya nicel olarak ortaya konulabilmiştir(Temiz, 2000). AMM etkinliğinin test edilmesinde birçok yöntemden yararlanıldığı bilinmektedir. Ancak “tüp dilisyon” ve “agar difüzyon” yöntemi bu amaçla kullanılan en yaygın yöntemdir.
1.8.1. Dilüsyon yöntemi
Bu yöntemle daha çok antimikrobiyal maddelerin MİK ve MLK değerleri belirlenmeye çalışılmıştır. MİK değeri; denenen test mikroorganizma süspansiyonunda (belli sayıda canlı organizma içeren kültür sıvısı) test koşullarında üremeyi (mevcut canlı hücre sayısının artışını) inhibe eden (engelleyen) en düşük antibikrobiyal madde konsantrasyonudur (Temiz, 2000). Dilüsyon yöntemleri kantitatif sonuçlar verir. Testlerin sonuçlarını ise inokulumun yoğunluğu, inkübasyon süresi ve sıcaklığı, besiyeri ve antimikrobiyal maddenin stabilitesi etkilemektedir (Rios ve vd., 1988; Ötük, 1992).
Üremenin varlığı ya da yokluğu bulanıklık tayiniyle yapılmakta ve üremeninolmadığı en düşük konsantrasyon değeri Minimum İnhibisyon Konsantrasyonu (MİK) olarak tanımlanmakta iken, başlangıçta inoküle edilenin %99.9’u veya daha çoğunuöldüren konsantrasyon ya da yeni besiyerine alındıktan sonra gelişmeningözlenmediği en düşük konsantrasyon Minimum Bakterisidal Konsantrasyon (MBK) değeri olarak tanımlanmaktadır. MBK, MİK testinden sonra uygulanır (Burt, 2004; Altuner, 2008).
Dilüsyon yöntemi, broth dilüsyon ve agar dilüsyon yöntemi olmak üzere iki farklı şekilde yapılabilmektedir.
1.8.1.1. Broth dilüsyon yöntemi
Broth dilüsyon yöntemi makrodilüsyon ve mikrodilüsyon olmak üzere iki şekilde yapılabilir. Her iki yöntemin de prensibi aynıdır. Daha az miktarlarda çalışıldığı içinmikrodilüsyon yöntemi, makrodilüsyon yöntemine göre daha ekonomiktir. Mikrodilüsyonyönteminde 96 kuyucuklu plaklar kullanılmaktadır. Makrodilüsyon yönteminde
isesteril tüpler kullanılarak, hazırlanan farklı konsantrasyonda antimikrobiyal madde dilüsyonlarının, belirli konsantrasyondaki mikroorganizmaya karşı etkisi incelenmektedir. Kullanılan mikroorganizmaya karşı antmikrobiyal maddenin etkili konsantrasyonları ile; MİK ve MBK değerleri üremenin varlığına veyayokluğuna göre belirlenmektedir (İşcan ve vd., 2002; Çelik, 2007).
1.8.2. Difüzyon yöntemi
Teknik olarak basit bir yöntemdir ama analiz yapılırken analizin sonucunu etkileyecek şu noktalara dikkat edilmelidir. Besiyeri saf hazırlanmalı, kullanılan agarın tipi ve konsantrasyonu aynı zamanda petri kutusundaki kalınlığı eşit olmalı ve standart ve çalışılacak diğer suşların sıvı besiyerindeki süspansiyonununbulanıklığı/konsantrasyonu standart olmalıdır. Aynı zamanda diskler/kuyucuklar mikroorganizma ekiminden sonraki 15 dk içinde yerleştirilmeli/açılmalı, petri kutuları hemen inkübe edilmelidir (Ötük, 1992).
1.8.2.1. Agar difüzyon yöntemi
Agar dilüsyon yöntemindeAMM’nin (özellikle antibiyotik ve dezenfektanların) etkinliği bu yöntemle kolay ve kısa sürede ortaya konulabilir. Bu yöntemden yararlanılarak test edilecek mikroorganizmanın AMM/AMM’lere duyarlılığı veya herhangi bir ortamdaki bir AMM’nin varlığı belirlenebilmektedir. Yöntem; test mikroorganizması aşılanmış Petri kutusundaki uygun bir agarlı besi yerine uygun bir şekilde eklenen AMM’nin (ya da AMM içerdiğinden şüphelenilen örneğin), besiyerinde difüze olması ve difüze olduğu alanda test mikroorganizmasının gelişimini engelleyip engellemediğinin belirlenmesi prensibine dayanmaktadır (Temiz, 2000).
1.8.2.2. Kâğıt diskagar difüzyon yöntemi
Bu yöntemin ilk aşamasında, seçilen test mikroorganizmasının daha önceden hazırlanan taze sıvı kültürü (18-24 saatlik) dökme plak yöntemi ya da yüzüye yayma yöntemiyle uygun bir agarlı besi yerine aşılanır. Bu amaçla daha çok yüzeye yayma yöntemiyle aşılama tercih edilmektedir. Yüzeye yayma yönteminde; steril boş bir petri kutusuna dökülmüş ve katılaşması sağlanmış steril agarlı besi yerinin kuru yüzeyine sıvı kültürden steril pipetle 0.1 mL örnek aktarılır ve alevde sterilize edilmiş bir Drigalski özesi ile agar yüzeyine yayma yapılır. Yüzeye yayma, sıvı kültüre daldırılan steril eküvyonla direkt olarak da gerçeklestirilebilir. Petri kutusundaki agarlı besi yerinin yüzeyine, uygun aralıklarla en fazla 5-7 disk yerleştirilmelidir. Aksi takdirde, agarlı besiyeri yüzeyinde disklerden diffüze olacak farklı çözeltilerin biribirine karışma sorunu yaşanabilir ve bu durum yanlış test sonuçları alınmasına neden olabilir.
Yöntemin son aşamasında ise, petri kutusu düz bir şekilde etüve yerleştirilir ve test mikroorganizmasına uygun koşullarda inkibasyonu(örneğin 37o
C’ de 24-48 saat) sağlanır. Petri kutusu, inkübasyon sonrasında disklerin çevresinde oluşacak inhibisyon zonları yönünden incelemeye alınır (Temiz, 2000).
1.8.2.3. Agar kuyucuk difüzyon yöntemi
Bu yöntemle de aynı kâğıt disk ve agar difüzyon yönteminde olduğu gibi hareket edilmektedir. Ancak delik agar difüzyon yönteminde test mikroorganizmasıyla aşılanmış agarlı besi yeri yüzeyine AMM emdirilmiş kağıt diskler yerleştirilmemekte, bunun yerine besiyerinde uygun aralıklarla ve belli sayıda delikler açılarak bu deliklerin her birine denenecek AMM çözeltisi dökülmektedir. Petri kutusundaki agarlı besiyerinde en fazla 5-7 delik açılmalıdır. Deliklerin her birine denenecek steril damıtık su dökülür. Döküm işlemleri küçük hacimli steril pipetlerden (örneğin 0.1 mL’lik) veya pastör pipetlerinden yararlanılır. Yöntemin son aşamasında ise, petri kutusu düz bir şekilde etüve yerleştirilir ve test mikroorganizmasına uygun koşullarda inkibasyonu(örneğin 37 oC’ de 48 saat) sağlanır. Petri kutusu, inkübasyon sonrasında
deliklerin çevresinde oluşacak inhibisyon zonları yönünden incelemeye alınarak antimikrobiyal aktivite belirlenir (Temiz, 2000).
1.9. Araştırmanın Amacı ve Önemi
Yeşil çay (Camellia sinensis), şerbetçi otu (Humulus spp.)’nun yaprakları yeşil kahve (Caffee arabica) ve menengiç kahvesi (Pistacia spp.) bitkilerinin çekirdeklerinin biyolojik aktiviteleri araştırılmaya çalışılmıştır. Ekstrasyon için 6 farklı çözücü (su, etanol, kloroform, etilasetat, aseton ve metanol)kullanılmıştır. Bu bitkilerin antimikrobiyal aktivitesinin belirlenmesinde kullanılmak üzere Kütahya bölgesinin doğal sularından (Yoncalı ve Gediz mevkisinden) Legionella spp. bakterisi izole edilmiştir. Bu çalışma da kullanılan bitki ekstratlarının çevresel izolata (anti-Legionella ) ve koleksiyon suşlarınına etkisi mikrodilisyon yöntemiyle incelenmiştir.
2. MATERYAL VE METOD
2.1. Materyal
2.1.1. Biyolojik metaryaller
2.1.1.1. Antimikrobiyal aktivite belirlenmesinde kullanılan bitkiler
Bu çalışmada Theaceae familyasına ait yeşil çay (Camellia sinensis), Cannabaceae familyasına ait şerbetçi otu (Humulus spp.) Rubsaceae familyasına ait yeşil kahve (Caffee
arabica), Anacardiaceae familyasına ait menengiç kahvesi (Pistacia spp.)bitkileri
kullanılmıştır. Çalışılan bitkilerden Pistacia spp. ve Caffee arabica bitkilerinin çekirdekleri, diğer bitkilerin ise yaprakları kullanılmıştır. Kullanılan bu çekirdekler ve yapraklar aktardan alınmıştır. Bitki örnekleri çalışma yapılacağı zamana kadar güneş görmeyen serin kapalı yerde muhafaza edilmiştir.
2.1.1.2. Antimikrobiyal aktivite belirlenmesinde kullanılan mikroorganizmalar
Elde edilen bitki ekstratlarının, antimikrobiyal aktivitesinin belirlenmesinde kullanılan mikroorganizmalar Çizelge 2.1’de verilmiştir.
Çizelge 2.1. Antimikrobiyal aktivite testinde kullanılan mikroorganizmalar. Mikroorganizma ismi Kodu Kaynağı
Gram pozitif bakteri
Staphylococcus epidermidis ATCC 12228 Amerikan Kültür Koleksiyonu
Bacillus pumilus NRLL B – 200 ARS Kültür Koleksiyonu
Enterococcus faecalis ATCC 29112 Amerikan Kültür Koleksiyonu
Gram negatif bakteri
Escherichia coli NRLL 3704 ARS Kültür Koleksiyonu
Enterobacter aerogenes ATCC 13048 Amerikan Kültür Koleksiyonu
Legionella spp. (çalışma sırasında, doğal ortam suyundan elde
edilen izolat) Küf ve Mayalar
Candida albicans NRLL 12923 ARS Kültür Koleksiyonu
2.1.2. Kimyasal materyaller
Çalışma sırasında kullanılan çözücüler aşağıda verilmiştir. Kloroform: Kimyasal yapısı CHCl3dür. -62
oC’de katılaşır, 61o
C’de kaynar. Triklorometan olarak da bilinir. Anestezik ve çözücü olarak kullanılan renksiz, saydam, alevlenmeyen bir çözücüdür (Uyar, 1992).
Etilasetat: Pratik olarak suda çözünmez ama hem alkol hem de eterde çözünebilir. Formülü CH3COOC2H5olan ve 77
o
C’de kaynayan bir soy gazdır (Uyar, 1992).
Aseton: Kimyasal formülü CH3COCH3olan bir bileşiktir. Su, etanol ve eterde her
oranda karışır. Kimya sanayisinin temel ürünlerinden biridir.56o
C’de kaynar, -94oC’de katılaşır. Özellikle selüloz esterleri için çok kullanılan bir çözücüdür. Parafinin saflaştırılmasında, dokuların sertleştirilmesinde ve suyun alınmasında kullanılır (Uyar, 1992).
Etanol: Kimyasal formülü CH3CH2OH olan bir bileşiktir. Glikozun mayalanmasından
oluşur. Suyla karıştığında ısı açığa çıkar ve hacimce büzülür.78.4o
C’de kaynar ve suyla her oranda karışabilir. Tıpta kullanılan araçların sterilizasyonunda kullanılmasının yanı sıra organik bileşikler için iyi bir çözücüdür (Uyar, 1992).
Metanol: CH3OH (Metil alkol, metanol, karbinol) en basit yapılı alkoldür. Metanol tüm
canlılar için bir tehdit oluşturur yapısında fazlaca zehir bulunmaktadır. Bütün organik çözücülerde her oranda çözünür (Uyar, 1992).
Dimetil sülfoksit (DMSO): Organik sülfürlü, formülü (CH3)2SO olan bir bileşiktir. Bu
renksiz sıvı hem polar hem nonpolar bileşimleri çözebilen ve su ile geniş oranda karışabilen önemli bir polar aprotik çözücüdür (www.Dimethyl_sulfoxide).
2.1.3. Antimikrobiyal aktivite belirlenmesinde kullanılan besiyerleri 1. Mueller Hilton Broth (Merck)
Ticari olarak bulunan besiyeri otoklavda 1.1 atmosfer basınç altında 121°C’de 15 dakika süre ile steril edilmiştir. Yukarda bahsedilen besiyeri tek kuvvette olup besiyeri
Et ekstrakt 2.0 g Kazein Hidrolizatı 17.5 g
Nişasta 1.5 g
bileşimine giren maddelerin iki katı oranında tartılması ile çift kuvvetli olarak hazırlanmış olup antimikrobiyal aktivite testinde kullanılmıştır.
2.1.4. Legionella spp. izolasyonunda kullanılan besiyerleri 1.Buffered Charcoal Yeast Extract (BCYE) Agar
Maya Ekstraktı 10.0g L-Sistein HCl 0.4g Ferrik Pirofosfat 0.25g ACES Tamponu 10.0g Kömür, Aktif 2.0g Alfa-ketoglutarat 1.0g Agar 15.0g pH 6.9 ± 0.1 Saf su 1000mL
BCYE Agar Legionella bakterisinin izolasyonu için zenginleştirilmiş bir besiyeridir. 2. Kanlı agar Proteoz pepton 15.0g Karaciğer özeti 2.5g Maya özü 5.0g Sodyum klorit 5.0g Agar 12.0g pH 12.0g Saf su 1000mL
Legionella dışı bakterilerin üretilmesi için kullanılan bir besiyeridir. Bu besiyeri
L-sistein içermemesi nedeniyle Legionella besi yerlerinde üreyen şüpheli kolonilerin pasajını yapmak amacıyla kullanılmıştır.
3.Nutrient Agar Et ekstrakt 1.0 g Maya ekstraktı 2.0 g Pepton 5.0 g Sodyum klorür 5.0 g Agar 15.0 g Saf su 1000mL
2.1.5. Kullanılan çözeltiler
Çözelti 1. Fizyolojik tuz çözeltisi
NaCl 8.5 g Saf su 1000mL
Otoklavda 121°C’de 15 dakika süre ile steril edilmiştir. Mikroorganizmaların istenen yoğunluktaki süspansiyonlarını elde etmek amacıyla kullanılmıştır.
Çözelti 2.Mc Farland Standardı
BaCl2(%1.175, 0.048 M) 0.5 mL
H2SO4(%1, 0.18 M) 99.5mL
BaCl2 ve H2SO4 karıştırılmış olup elde edilen çözelti 625 nm dalga boyunda
spektrofotometre de okutulmuştur. Okutulan karışım dalga boyunda absorbans değeri 0.08-0.10 aralığına denk gelmiştir. Bu değer 0.5 Mc Farland standardı olarak kabul edilmiştir. 0.5 Mc Farland standardı mL’de 107
bakteri varlığı tespit edilmiştir. Test mikroorganizma süspansiyonlarının bulanıklılığı ile standardın bulanıklılığı çıplak göz ile karşılaştırılarak ayarlama işlemi yapılmıştır (NCCLS, 1990).
Çözelti 3.Lugol Boyası
Potasyum iyodür 10g Distile su 100mL
Iyot kristalleri 5g 2.1.6. Kullanılan boyalar
1. Kristal Viyole Boyası
Kristal viyole 2.0 g Etil alkol (%95) 20.0 mL
2.Safranin Boyası
Safranin( %95’lik etenolde %2.5’luk çözelti) 10 mL Saf su 100 mL
2.2. Metod
2.2.1. Bitki ekstratların hazırlanışı
Aktardan alınan bitki örnekleri 40’ar g tartılarak, filtre kâğıdının içine düzgün bir şekilde yerleştirilip kenarlarından sıkı bir şekilde kapatılarak, içinde bitki olan zarf biçimi elde edilmiştir. Elde edilen zarf sistemi daha sonra düzgün bir şekilde 500mL lik cam bir kavanozun içine konulmuştur. Kavanozun içine 100mL kloroform, metanol, etanol, su, etilasetat ve aseton çözücüleri ilave edilmiştir. Her çözücü için bu sistem ayrı ayrı hazırlanmıştır. Kavanozlar çalkalamalı etüve yerleştirilerek 150rpm’de 45o
C’de 4 saat süreyle çalkalama yöntemiyle bitkilerin ekstraksiyon işlemi gerçekleştirilmiştir (Nair ve Chanda; 2005). Kavanoz içerisinden kartuş sistemi çıkarılarak, elde edilen ekstratlar 45 o
C‘de 24 saat süreyle çalkalanarak organik çözücünün ortamdan ayrılması sağlanmıştır. Kalan kuru kısım önceden darası alınmış olan flakonlara aktarılmıştır. Verim hesabı yapıldıktan sonra 5 mL DMSO’da çözdürme işlemi yapılıp ağzı sıkı bir şekilde kapatılıp buzdolabında muhafaza edilmiştir.
2.2.2. Legionella spp. örneklerin toplanması, Legionella izolasyonu, serotipdüzeyinde tanımlanması
Kütahya ilinin Yoncalı ve Gedizmevkindebulunan doğal su ortamlarından (2016 yılının Mayıs-Haziran aylarında) 50 adet su örneği toplanmıştır. Legionellabakterileri doğada tüm sucul ekosistemlerde ve nemli ortamlarda yaygın olarak bulunurlar (Fliermans, 1981). Toplanan su örnekleri steril edilmiş kaplar içerisine 100mL alınıp laboratuara getirilmiştir. Alınan su örneklerinin Legionellaspp. bakterisi izole edilebilmesi için filtrasyon işlemi uygulanmıştır. Bu yöntemin amacı su içerinde bulunan mikroorganizmaları tutabilen por çapına sahip bir membran filtreden vakum sistemi kullanılarak süzülmesidir. Bu işlem için üçlü manifold düzeneği kurulmuştur. Düzeneğin çelik parçaları otoklavda steril edilmiştir. Su örnekleriselülozdan yapılmış, porları 0.45μm ve çapı 47mm olan siyah renkli filtre membran kağıtları kullanılarak sistemden geçirilmiştir. Her bir örneğin süzülme işlemi bittikten sonra düzeneğin içerisinden kaynar su ile steril edilmiştir. Daha sonra düzenek steril saf sudan geçirilmiştir (Bartie, 2003). Düzeneğin hareketli kısımları filtrasyon işlemi bittikten sonra otoklavda steril edilerek bir sonraki kulanım için saklanmıştır. Membran filtreler daha sonra BCYEagar besiyeri üzerine yerleştirilmiştir. Petriler 370C’ de nemli ortamda 3 ile 10 gün arasında etüvde bekletilip günlük
koloni takibi yapılmıştır. İnkübasyon sonrasında yüzeyleri düzgün, hafif bombeli, gri-beyaz renkli, camsı görünümde ve mukoid yapıdaki koloniler şüpheli olarak belirlenmiştir. Şüpheli olarak belirlenen kolonilerden öze yardımıyla kanlı agara ve aynı zamandanutrient agara ekimleri yapılmış ve inkübasyona bırakılmıştır. 37°C de 24-48 saat sonunda nutrient agarda
üreme gösterip kanlı agarda üreme göstermeyen örnekler Legionella cinsi şüphelisi olarak belirlenmiş ve bu örneklere gram boyama yöntemi uygulanmıştır. Gram boyama işleminin sonunda belirlenen örneklere lateks aglitünasyon testi uygulanarak tür ve serogrubu belirlenmiştir.
Gram boyama işlemi; preparat hazırlanıp kurutma işlemi yapıldıktan sonra alevden geçirilmiştir. Üzerine kristal viyole eklenip 2 dk bekletilip su ile yıkanmıştır. Preparata lügol çözeltisi eklenip 1 dk bekletilme işleminden sonra alkol ile dekolarizasyon işlemi yapılmıştır. Daha sonra 3 dk safranin ile boyanan preparat yıkanarak incelenmiştir. (Klasik gram boyama işleminde safraninle boyama için 30 saniye tutulmaktadır). Gramboyama sonucu, zayıf Gram negatif, çomak şeklinde bakterilerin görülmesi durumunda kültürlerindeki şüpheli kolonilerden diğer özel besiyerlerine pasajları yapılmıştır. Bu pasajlama işlemi; mikrobiyolojik analizlerde kullanılan süt tozunun antibiyotik içermeyen sütlerden yapılmış ve yağı ayrılmış olması gerekmektedir. Dehidre Skim Milk (yağsız süt tozu) %10 konsantrasyonda olacak şekilde hazırlanmıştır. Standart hazırlama şeklinde 10g dehidre besiyeri 100mL damıtık suda tam olarak çözülür, uygun kaplara dağıtılıp, otoklavda 115oC'da 10 dakika sterilize edilmiştir (www.mikrobiyoloji.org).
Muhafaza: Elde edilen izolatlar +4oC’de BCYE agar veya Nutrient Agar’da ve -20oC’ de %10’luk Slim milk besi yeri içerisinde ependorf tüplerinde Legionella spp.’nin muhafaza edilmiştir.
Lateks aglütinasyon test kitinin uygun boşlukları numaralandırılmıştır. Kit üzerinde yer alan dairelerle sınırlandırılmış üç farklı bölmeden oluşan her bir yuvarlak bölmeye NaCl çözeltisinden birer damla damlatılmıştır. Şüpheli olan Legionellaspp. cinsi koloniden kit içerisinde bulunan çubuk yardımıyla kit kartlarının üzerindeki 3 dairenin her biri için; homojen bir süspansiyon elde edilmek suratiyle daire içerisine yayma işlemi yapılmıştır. Hemen arkasından birinci bölmeye serogrup 1 solüsyonundan damlatılıp dairesel hareketlerle karıştırılmıştır. Aynı işlem ikinci bölmeye serogrup 2-15 solüsyonu ve üçüncü daireye diğer serogrup solüsyonundan (spp) damlatılarak tekrarlanmıştır. Her biri için çökelmenin olup olmadığı gözlenmiştir. Yaklaşık olarak 1-3 dk sonra aglütünasyon gözle görülür hale gelmiş ve bakterinin kullanılan deney ayıracının tür ve serogrubundan olduğunu göstermiştir. Pozitif bakteri-lateks süspansiyonu ile karıştırılarak yapılan testte aglütinasyon oluşumun gözlenmesi pozitif sonuç olarak değerlendirilmiştir.
2.2.3. Antimikrobialaktivite deneyin yapılışı
Bitkilerden elde edilen ekstraktların antibakteriyel etkilerinin belirlenmesinde mikrodilüsyon yöntemi kullanılmıştır. Antibakteriyel testler için 96 adet “U” tipi kuyucuğa sahip olan steril mikrodilüsyon pleytleri kullanılmıştır. Bitki ekstraktlarının herbinin seri konsantrasyonları elde edilmiştir. Antimikrobiyal aktivite testinde kullanılacak olan test mikroorganizmalara Mc Farland Standardı hazırlanmıştır. Standardın bulanıklılığı ile test mikroorganizma süspansiyonlarının bulanıklılığı çıplak göz ile karşılaştırılmıştır.
Dahasonra hazırlanan çift kuvvetliMüller Hilton Broth besiyerinden kullanacağımız tüm kuyucuklara 150µl konulmuştur. Mikropleytlerin ilk kuyucuklarına hazırladığımız bitki ekstrelerinden de 150’şer µl ilave edilmiştir ilk kuyucukta bulunan 300 µL olan besiyeri- ekstre karışımından 150µl alınarak ikinci kuyucuğa konulmuş ve bu şekildeki seyreltme işlemi tüm kuyucularda yapılmıştır. Son kuyucuğa gelince 150 µl solüsyon mikropipetle alınıp atık olarak boş bir atık kutusuna boşaltılmıştır. En son olarak kuyucuklara 10µl test mikroorganizmalarının inokulumuilave edilerek 37oC 24 saat saat etüvde inkibasyona bırakılmıştır. 24 saat sonunda 20 µl TTC (Triphenyl tetrazolium chloride) eklenerek 15dk etüvde 37oC bekletilmiştir. Renk degişimi olanlar MİK değeri olarak kabul edilmiştir. TTC özellikle hücresel solunumu göstermek için biyokimyasal deneylerde yaygın olarak kullanılan bir redoks göstergesidir.
3. BULGULAR
Çalışmada yeşil kahve (Caffee arabica),menengiç kahvesi (Pistacia spp.),şerbetçi otu (Humulus spp.), yeşil çay (Camellia sinensis) bitkileri kullanılmıştır. Çalışılan bitkilerden menengiç kahvesive yeşil kahve bitkilerinde çekirdeği, yeşil çay ve şerbetçi otu’nunyaprakları kullanılmıştır. Aktardan alınan bitki örneklerinin çeşitli çözücülerle(su, etanol, kloroform, etilasetat, aseton ve metanol) ekstraksiyonu yapılmıştr. Elde edilen ekstraktların antimikrobiyal aktiviteleri mikrodilüsyon yöntemi ile Minimal İnhibisyon Konsantrasyonu (MİK) belirlenmiştir.
Antimikrobiyal aktivite çalışmasında test mikroorganizmaları olarak gram pozitif mikroorganizmalardan Staphylococcus epidermidis, Bacillus pumilus ve Enterococcus faecalis, gram negatif mikroorganizmalardan Escherichia coli, Enterobacter aerogenes veLegionellaspp. (çalışmamız sırasında izole edilen ) maya olan Candida albicans, küf olan Aspergillus
fumigatus mikroorganizmalarını kullanarak test edilmiştir.
Çizelge 3.1.Yeşil kahve çekirdeğiverim hesabı.
Verim tablosunda da görüldüğü gibi kullanılan yeşil kahvebitkisinde en yüksek verim etanol ekstresinde (%11.6) ile sağlanmış olup su, aseton, metanolekstratında (%6.2)olarak devam etmiştir. En düşük verimin ise kloroform ekstratında (%3.2) olduğu tespit edilmiştir.
Çalışmamız sırasında pozitif kontrol olarak bakteriler için Ampisilin ve maya ve funguslar içinde Nistatin antibiyotikleri kullanılmıştır. Bu antibiyotikler bütün test mikroorganizmalarına uygulanmamış olup Gram pozitif bakterilerden sadece S.epidermidis uygulanmış, MİK değerinin (0.008 mg/mL) olduğu, Gram negatif bakterilerden ise E. coli’ye uygulanmış olup MİK değerinin (0.064 mg/mL) olduğu tespit edilmiştir. Maya ve küflerden ise Nistatin antifungalı C. albicans’a karşı uygulanmış olup MİK değeri (0.008 mg/mL) olduğu tespit edilmiştir. Negatif kontrol olarak DMSO çözücüsü kullanılmıştır.
Çözgen Verim % Su 6.2 Etanol 11.6 Kloroform 3.2 Etilasetat 3.6 Aseton 6.2 Metanol 6.2
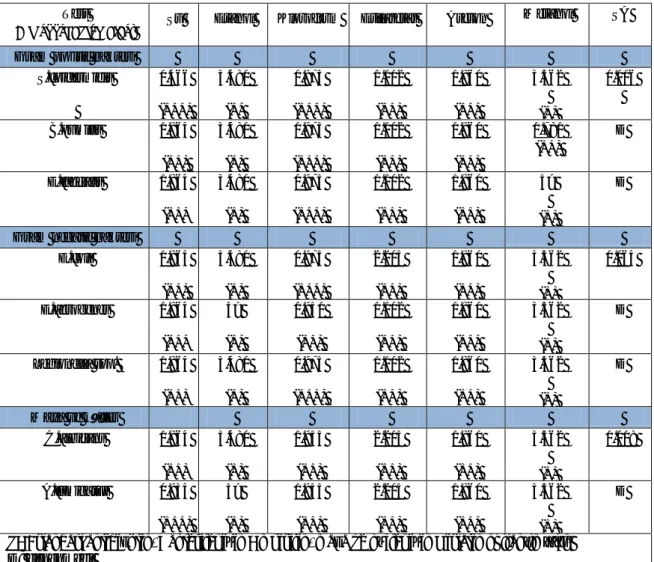
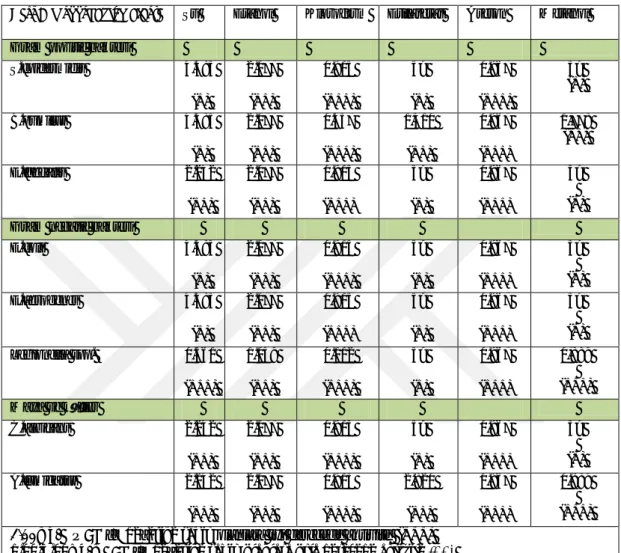
Çizelge 3.2. Yeşil kahve (Caffee arabica)’nin kullanılan test mikroorganizmalarına karşı gösterdikleri MİK (mg/mL) değerleri.
Test
Mikroorganizmaları Su Etanol Kloroform Etilasetat Aseton
Metanol SA
Gram pozitif bakteri
S.epidermidis 0.466 (+++) 3.480 (+) 0.975 (+++) 1.102 (++) 1.860 (++) 3.562 (+) 0.006 B.pumilis 1.864 (++) 3.480 (+) 0.975 (+++) 1.102 (++) 1.860 (++) 1.781 (++) D E.faecalis 1.864 (++) 3.480 (+) 0.975 (+++) 1.102 (++) 1.860 (++) 5> (+) D
Gram negatif bakteri
E.coli 1.864 (++) 3.480 (+) 0.975 (+++) 2.205 (++) 1.860 (++) 3.562 (+) 0.064 E.aerogenes 1.864 (++) 5> (+) 1.950 (++) 1.102 (++) 1.860 (++) 3.562 (+) D Legionella spp. 1.864 (++) 3.480 (+) 0.975 (+++) 1.102 (++) 1.860 (++) 3.562 (+) D Maya ve küfler C.albicans 1.864 (++) 3.480 (+) 1.955 (++) 2.205 (++) 1.860 (++) 3.562 (+) 0.008 A.fumigatus 0.934 (+++) 5> (+) 1.955 (++) 2.205 (++) 1.860 (++) 3.562 (+) D SA: standart antibiyotik, Bakteriler için Ampisilin, maya ve küfler için Nistatin kullanılmıştır.
D; denenmedi
1.00mg/L ≤ ; MİK değerine sahip olanlara iyi derecede aktivite (+++) 1.00-3.00 mg/mL; MİK değerine sahip olanlara orta derecede aktivite (++) 3 mg/L ≥; MİK değerine sahip olanlara zayıf derecede aktivite (+)
Çizelge 3.2’de görüldüğü üzereyeşil kahve çekirdeği 6 adet çözücü (su, etanol, kloroform, etilasetat, aseton ve metanol) kullanılarak 6 farklı ekstrakt elde edilmiştir.
Elde edilen ekstratlar içerisinde su ekstratında gram pozitif bakterilerden
Staphylococcus epidermidis’in en düşük MİK değeri 0.466mg/mL olduğu görülmüştür. Diğer
etkili olduğu test mikroorganizması ise küflerden Aspergillus fumigatusolupMİK değerinin 0.934mg/mL olduğu tesbit edilmiştir. Bu bitkinin su ekstratının diğer gram pozitif mikroorganizma olan Bacillus pumilusve Enterococcus faecalis, gram negatif mikroorganizmalardan Escherichia coli, Enterobacter aerogenes, Legionella spp.’ye ve maya
olan Candida albicans’a etkisi aynı antimikrobiyal aktiviteye sahip olupMİK değerinin 1.864 mg/mL olduğu görülmüştür. Çözücüler içerisinde en etkili antimikrobiyal aktiviteye sahip olanın su olduğu tespit edilmiştir.
Etanol ekstratındaise gram pozitif mikroorganizmalardan Staphylococcus epidermidis,
Bacillus pumilus ve Enterococcus faecalis gram negatif mikroorganizmalardan Escherichia coli,
Legionella spp.’ye maya olan Candida albicans’a karşı göstermiş olduğu MİK
değeri3.480mg/mL olup zayıf bir antimikrobiyal aktivite gösterdiği belirlenmiştir. Gram negatif bir bakteri olan Enterobacter aerogenes ve küf olan Aspergillus fumigatus’un MİK değeri 5 mg/mL’den büyük olduğu tespit edilmiştir. En zayıf antimikrobiyal aktiviteyi etanol çözücüsünde görülmektedir.
Kloroform ekstratındaise gram pozitif bakterilerinden Staphylococcus epidermidis,
Bacillus pumilis, Enterococcus faecalis, gram negatif bakterilerden ise Escherichia coli, Legionella spp.MİK değeri 0.975mg/mL olup aynı değerde antimikrobiyal etkinliğe sahip
olduğu tespit edilmiştir. Gram negatif mikroorganizmalardan Enterobacter aerogenes (1.950 mg/mL ) maya olan Candida albicans(1.955 mg/mL ) ve küfolan Aspergillus fumigatus (1.955 mg/mL ) orta derecede antimikrobiyal aktivite göstermiştir.
Aynı bitkinin etilasetatekstratında gram pozitif mikroorganizmalardan Staphylococcus
epidermidis, Bacillus pumilis, Enterococcus faecalis gram negatif mikroorganizmalardan ise Enterobacter aerogenes, Legionella spp. bakterilerine karşı 1.102 mg/mL olup aynı MİK
değerinde antimikrobiyal etkinlik göstermişlerdir. Gram negatif mikroorganizmalardan
Escherichia coli maya olan Candida albicans ve küf olan Aspergillus fumigatus ise 2.205
mg/mL MİK değerinde antimikrobiyal etkinlik gösterdiği tespit edilmiştir.
Aseton akstratında mikroorganizmalar arasında farklı bir değer gözlenmemiştir. Tüm test edilen mikroorganizmalara karşı MİK değeri 1.860 mg/mL (orta derecede) antimikrobiyal aktivite göstermiştir.
Metanol ekstratındagram pozitif mikroorganizmalardan en düşük MİK değeri Bacillus
pumilis, 1.781 mg/mL orta derecede antimikrobiyal aktivite göstermiştir. Gram pozitif
bakterilerden Staphylococcus epidermidis, gram negatif mikroorganizmalardan Escherichia
coli, Enterobacter aerogenes, Legionella spp. maya olan Candida albicans, küf olan Aspergillus fumigatus 3.562mg/mL MİK değerinde antimikrobiyal aktivite görülmüştür.
Yeşil kahve bitkisinin MİK sonuçlarına göre en iyi konsantrasyonu su ekstratında 0.466 mg/mL ile gram pozitif bakteri olan Staphylococcus epidermidis olduğu gözlenmiştir. Daha
sonra da onu takip eden küf olan Aspergillus fumigatus 0.934 mg/mL MİK de antimikrobiyal aktivite görülmüştür.
Çizelge 3.3. Menengiç kahvesiçekirdeği verim hesabı.
Çizelge 3.3’e balkıdığında kullanılan Menengiç kahvesi bitkisinde en yüksek verim metanol ekstratında%23.7 olduğu belirlenmiştir. Diğer taraftan en düşük verimi ise kloroform ekstresinde 3.0g olduğu tespit edilmiştir.
Çözgen Verim % Su 7.4 Etanol 6.9 Kloroform 3.0 Etilasetat 9.4 Aseton 3.2 Metanol 23.7
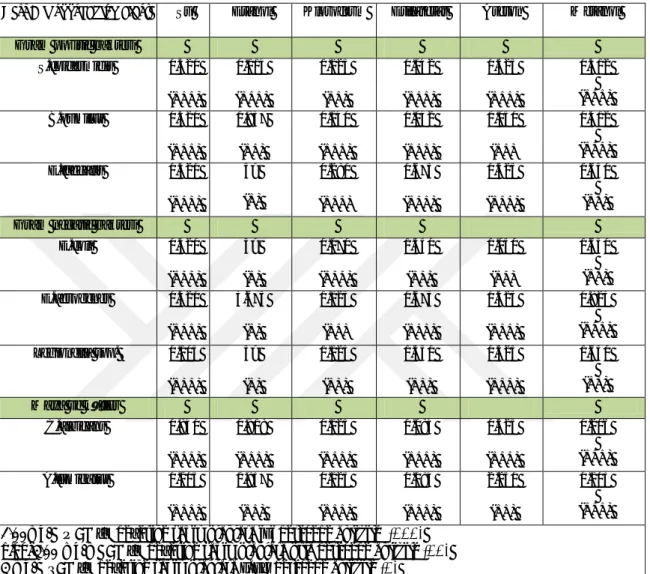
Çizelge 3.4. Menengiç kahvesi (Pistacia spp.)’nin kullanılan test mikroorganizmalarına karşı gösterdikleri MİK (mg/mL) değeri.
Test Mikroorganizmaları Su Etanol Kloroform Etilasetat Aseton Metanol Gram pozitif bakteri
S.epidermidis 4.485 (+) 2.077 (++) 0.915 (+++) 5> (+) 0.967 (+++) 5> (+) B.pumilus 4.485 (+) 2.077 (++) 0.457 (+++) 1,410 (++) 0.967 (+++) 1,778 (++) E.faecalis 2.242 (++) 2.077 (++) 0.915 (+++) 5> (+) 0.967 (+++) 5> (+) Gram negatif bakteri
E.coli 4.485 (+) 2.077 (++) 0.915 (+++) 5> (+) 0.967 (+++) 5> (+) E.aerogenes 4.485 (+) 2.077 (++) 0.915 (+++) 5> (+) 0.967 (+++) 5> (+) Legionella spp. 0.561 (+++) 1.039 (++) 0.112 (+++) 5> (+) 0.967 (+++) 0,889 (+++) Maya ve küfler C.albicans 2.242 (++) 2.077 (++) 0.915 (+++) 5> (+) 0.967 (+++) 5> (+) A.fumigatus 2.242 (++) 2.077 (++) 0.915 (+++) 2.820 (++) 0.967 (+++) 0.889 (+++) 1.00mg/L ≤ ; MİK değerine sahip olanlara iyi derecede aktivite (+++)
1.00-3.00mg/mL; MİK değerine sahip olanlara orta derecede aktivite (++) 3mg/L ≥; MİK değerine sahip olanlara zayıf derecede aktivite (+)
Çizelge 3.4. görüldüğü üzere menengiç kahvesinintohumları 6 adet çözücüde (su, etanol, kloroform, etilasetat, aseton, metanol), 6 farklı ekstratı elde edilmiştir. Elde edilen ekstraktlar içerisinde su ekstratında gram negatifbakterilerden Legionella spp.’nin en düşük MİK değeri 0.561 mg/mL ile en iyi antimikrobiyal etkinlik gösterdiği tespit edilmiştir. Su ekstraksiyonunda menengiç kahvesinin çekirdeklerinin özellikle gram negatif bir bakteri olan
Legionella spp.’ye karşı iyi bir aktiviteye sahip olduğu görülmüştür. Gram pozitif
mikroorganizmalardan Enterococcus faecalis, maya olan Candida albicans ve küf olan
Aspergillus fumigatus 2.242 mg/mL MİK değerinde antimikrobiyal aktivite göstermiştir. Test
edilen gram pozitif bakterilerden Staphylococcus epidermidis, Bacillus pumilis, gram negatif mikroorganizmalardan Escherichia coli, Enterobacter aerogenes 4.485 mg/mL MİK değerinde antimikrobiyal aktive gösterdiği tespit edilmiştir.