T.C.
D CLE ÜN VERS TES TIP FAKÜLTES
Ç HASTALIKLARI ANAB L M DALI
KRON K M YELO D LÖSEM L HASTALARIMIZDA
MAT N B MES LAT TEDAV S N N SONUÇLARI
(UZMANLIK TEZ )
Dan man: Prof. Dr. Ekrem MÜFTÜO LU
Dr. Süleyman SAYAR D YARBAKIR 2008
TE EKKÜR
ç hastal klar uzmanl e itimim süresince yeti memde büyük emekleri olan sayg de er hocalar m; Rektörümüz Say n Prof.Dr Fikri Canoruç a, ç Hastal klar Ana Bilim Dal Ba kan m z ve tez dan man m Say n Prof.Dr. Ekrem Müftüo lu na, Say n Prof.Dr Orhan Ayy ld z a, Say n Prof.Dr Vedat Göral a, Say n Prof.Dr.M.Emin Y lmaz a, Say n Prof.Dr Mithat Bahçeci ye, Say n Doç.Dr Abdurrahman I kdo an a, Say n Doç.Dr Mehmet Dursun a, Say n Doç.Dr. Kendal Yalç n a, Say n Doç.Dr erif Y lmaz a, Say n Doç.Dr Ali Kemal Kadiro lu na, , Say n Yrd.Doç.Dr. Dede it e, Say n Yrd.Doç.Dr. Abdullah Alt nta a, Say n Yrd.Doç.Dr. Ramazan Dan a, Say n Yrd. Doç.Dr. enay Ar kan a, Say n Yrd.Doç.Dr. Kadim Bayan a, Say n Yrd.Doç.Dr. ehmus Özmen e, Say n Yrd.Doç.Dr. Davut Ak n a, Say n Yrd.Doç.Dr. Yekta Tüzün e, Say n Yrd.Doç.Dr. Deniz Gökalp a, Say n Yrd.Doç.Dr. Timuçin Çil e, emekli ö retim üyelerimiz Say n Prof.Dr. Bünyamin I ko lu na, Say n Prof.Dr. Halil De ertekin e, Say n Prof.Dr. Orhan Yazanel e, te ekkür ederim.
Rotasyon e itimim s ras nda bilgilerinden yararland m Kardiyoloji Anabilim Dal ö retim üyelerine, Gö üs Hastal klar ve Tüberküloz Anabilim Dal ö retim üyelerine, Enfeksiyon Hastal klar ve klinik Mikrobiyoloji Anabilim Dal ö retim üyelerine ve Biyokimya Anabilim Dal ö retim üyelerine te ekkür ederim.
Tezimin haz rlanmas na katk da bulunan Hematoloji laboratuar ndan Kimyager Murat YURT a, Biolog Cahit LHAN a sa l k teknikerleri Emine BATUM ve Mahmut ESEN e te ekkür ederim.
Birlikte çal t m tüm asistan arkada lar ma, ç Hastal klar A.D. çal anlar na ve gerek e itimimin gerekse tezimin haz rlan n n her a amas nda deste ini esirgemeyen Say n Doç.Dr Alparslan Tuzcu ya, de erli arkada m Dr.Ergün PARMAKSIZ a, Uzm.Dr. Semir PA A ya, her zaman yan mda olduklar n bildi im ailem, sevgili e im ve en de erli varl m olan o lum Ali ye te ekkür ederim.
Ç NDEK LER
Sayfa TE EKKÜR. i Ç NDEK LER ii KISALTMALAR . iii EK LLER D Z N . iv TABLOLAR D Z N . .. iv ÖZET . v SUMMARY ... vi 1- G R VE AMAÇ .1 2- GENEL B LG LER ..22.1 Kronik Miyeloid Lösemi ....2 2.2 Kronik Miyeloid Lösemi Tedavisi 19
3- MATERYAL VE METOD . 31
4- BULGULAR .34
5- TARTI MA ..36
KISALTMALAR
AHKHN: Allojeneik hematopoietik kök hücre nakli ALL:Akut lenfoblastik lösemi
AML: Akut myeloblastik lösemi ELN :European leukemia net
F SH: Fluoresans in situ hibridizasyon HLA : nsan lökosit antijen
HU:Hidroksiüre IFN- : nterferon alfa
ISCN: International system for human cytogenetic nomenculature KML:Kronik myeloid lösemi
KMML:Kronik miyelomonositer lösemi KMPH :Kronik miyeloproliferatif hastal k LAP:Lenfadenopati
LAP Skoru :Lökosit alkalin fosfataz skoru MSY:Major sitogenetik yan t
MMY:Major moleküler yan t PAS:Peryodik asit shift
PCR:Polimeraz zincir reaksiyonu PCR : Polimeraz zincir reaksiyonu THY:Tam hematolojik yan t TMY:Tam moleküler yan t TSY:Tam sitogenetik yan t v-ABL:viral ABL
EK LLER D Z N
Sayfa
ekil 1. KML de Ph kromozomu 2
ekil 2. BCR/ABL füzyon geninin yap s .. 5
ekil-3 BCR /ABL Translokayonunun Moleküler Anatomisi .... 6
ekil-4.BCR/ABL Geni Taraf ndan Kontrol Edilen
MalignTransformasyon Mekanizmalar . 7
ekil-5. BCR/ABL füzyon geninin moleküler
yap s mitoz sinyal ileti yollar n n aktivasyonu ve etkisi 9
TABLOLAR D Z N
Tablo1. Miyeloproliferatif Hastal klar n S n fland r lmas ... 3
Tablo 2. KML Kronik Faz Ba lang ç Semptom Ve Bulgular .. 11
Tablo 3. Akselere Faz n Laboratuar ve Klinik Özellikleri ... 13
Tablo 4. Blastik Faz n Laboratuar Ve Klinik Özellikleri . 14
Tablo 5. KML de Prognozu Belirlemede Kullan lan Risk Skorlar . 19
Tablo 6. Önerilen KML Takip Plan 25
Tablo 7. KML de Yan t n De erlendirilmesi .. 25
Tablo 8. matinib Tedavisi: Optimum Yan t,
ÖZET
Dayanak ve amaç: KML tedavisinde hidroksiüre, busulfan, interferon, interferon +
cytarabine kullan lm , bir Bcr-Abl inhibitörü olan imatinib mesilat n bulunmas yla KML de tedavi tamamen de i mi tir. Bugün KML de ilk tedavi olarak imatinib mesilat kullan lmaktad r ancak imatinib mesilat tedavisine hematolojik ve sitogenetik rezistans olu abilmekte, vakalar n ço unda moleküler yan t elde edilememektedir. Bu çal mam zda imainib mesilat ile tedavi edilen 54 kronik faz KML vakas nda hematolojik, sitogenetik ve moleküler düzeyde cevab inceledik.
Materyal ve metod: Dicle Üniversitesi T p Fakültesi Hematoloji Bilim Dal nda
2003-2008 y lllar aras nda kronik faz KML tan s ile takip edilen 54 olgu çal maya al nd . Hastalarda Ph kromozomu ve Bcr-Abl kopyas pozitif idi. Hastalara 400 mg/gün imatinib mesilat tedavisi verildi. Hematolojik, sitogenetik ve moleküler yan tlar izlendi.
Bulgular: Tam hematolojik yan t üçüncü ayda %88 hastada (49/54 hasta) saptand .
Elde edilen Tam hematolojik yan t alt nc ayda %90, on ikinci ayda %93 ve on sekizinci ayda %95 olarak bulundu.
Düzenli sitogenetik inceleme ancak vakalar n %36 s nda (19 hasta) yap labildi. Majör sitogenetik yan t alt nc ayda %36, tam sitogenetik yan t %17 vakada tespit edildi. On ikinci ayda majör sitogenetik yan t oran %71, tam sitogenetik yan t %58 idi. On sekizinci ayda majör sitogenetik yan t %76, tam sitogenetik yan t %61 olarak saptand .
Alt nc ayda majör moleküler yan t %18, tam moleküler yan t %2, onikinci ayda majör moleküler yan t %32, tam moleküler yan t %6, On sekizinci ayda majör moleküler yan t %34, tam moleküler yan t %9 olarak bulundu.
Hastalar görülen yan etkiler aç s ndan de erlendirildi inde; 26 hastada (%48) bulant ve/veya kusma, 23 hastada (%43) yüzeyel ödem eklinde el, yüz ve ayak ödemi, 8 hastada (%15) doz azalt lmas ya da tedaviye ara verilmesini gerektirecek nötropeni ve/veya trombositopeni, 7 hastada (%13) yorgunluk, 6 hastada (% 11) kas ve kemik a r lar , 6 hastada (%11) ba a r s , 1 hastada (%2) karaci er enzim yüksekli i saptand .
Sonuç: Kronik faz KML de imatinib mesilat n tolere edilebilir etkin bir tedavi
yöntemi oldu u, ancak moleküler cevab n dü ük oranda bulunmas nedeniyle de i ik tirozin kinaz inhibitörleri dahil, ba ka tedavi yöntemleri üzerinde çal malar yap lmas gerekti i sonucuna var ld .
Anahtar kelimeler: KML, matinib mesilat
SUMMARY
Background and Aim: For the treatment CML, hydroxiürea, busulfan, interferon,
interferon + cytarabine were used earlier; however, through discovery of imatinib mesilate, a bcr- abl inhibitör, the treatment CML has changed entirely. Nowadays, imatinib mesilate is used as the initial treatment, but hematologic and cytogenetic resistance to imatinib mesilate treatment might occur, and molecular response cannot be achieved in most of the cases. n this study we investigated the hematologic, cytogenetic and molecular responses in 54 patients with cronic phase CML treated with imatinib mesylate.
Material and methods: A total of 54 cases with chronic phase CML, followed up at
the department of Hematology, Medical faculty, Dicle University, between 2003-2008 were enrolled into study. Ph chromosome and Bcr- Abl copy of the patients were positive. The patients were administered 400 mg/ day imatinib mesylate. Hematologic Cytogenetic and molecular responses were followed up.
Results: Complete haematologic response was 88% (49/54) at the 3rd month, was
90% at the 6th month, was 93% at the 12th month, and was 95% at the 18th month.
Regular cytogenetic evaluation was performed only in 36% (19/54) of the patients. Major cytogenetic response (MCR) was 36% and complete cytogenetic response (CCR) was 17% at the 6th month. MCR was 71% and CCR was 58% at the 12th month. MCR was 76% and CCR was 61% at the 18th month.
Major molecular response (MMR) was 18% and complete molecular response (CMR) was 2% at the 6th month. MMR was 32% and CMR was 6% at the 12th month. MMR was 34% and CMR was 9% at the 18th month.
Most common reported advers events were nausea and emesis (48%), superficial hand, foot and/or face edema (43%), severe neutropenia and/or trombocytopenia required dose adjustment or discontinuating of the treatment (15%), weakness (13%), fatigue (13%), muscle and bone ache (11%), headache (%11) and elevated liver function tests (2%).
Conclusion: t was concluded that imatinib mesylate is an effective and tolerable
treatment choice in chronic phase CML, but that further studies are required to be carried out on other teratment methods, including other tyrosine kinase inhibitors, since molecular response is achieved at low rate.
1
G R
AMAÇ
KML, farkl la man n bütün evrelerindeki miyeloid hücre elemanlar n n artm proliferasyonu ile karakterize klonal bir kök hücre hastal d r. ki ayr klinik faz ile karakterizedir. Kronik faz; tam bir olgunla ma evresi gösteren miyeloid hücrelerin proliferasyonu ile birliktedir. Genellikle, sonuçta miyeloid farl la mada azalma meydana gelir ve hastal k kötü prognozlu bir safhaya (akselere faz veya blastik kriz) girer.
KML ilk kez 19. yy da tan mland . 1960 da Nowel ve Hungerford, KML li hasta hücrelerinde anormal bir kromozomu belgelediler. Bir malign hastal kta gösterilmi bu ilk kromozom anomalisi bulundu u ehrin ad yla, Philadelphia (Ph) kromozomu olarak an lmaya ba land . 1970 lerde Ph kromozomunun asl nda 9 ve 22. kromozomlar aras nda bir translokasyon oldu u gösterildi. Ard ndan 1980 li y llarda Ph kromozomunun, 9. kromozomdaki ABL protoonkogeni ile 22. kromozomun üzerindeki BCR geninin füzyonu ile olu tu unu gösterdiler.(1)
KML tan sal i lemleri periferik kan yaymas , kemik ili i aspirasyonu ve biyopsisi incelemeleriyle ba lar. Karyotipik analizle Ph kromozomunun, ya da southern blot veya PCR teknikleri ile Ph kromozumu ürünü BCR-ABL nin moleküler olarak gösterilmesi kesin tan y koydurur.(34)
Tedavide önceleri hidroksiüre, busulfan, -interferon ve uygun hastalarda allojenik kemik ili i transplantasyonu kullan lmakta iken son y llarda BCR-ABL proteinini hedef alan bir tedavi olarak geli tirilen Imatinib bugün için en ekçin ve etkili tedavidir. Günlük 400 mg imatinib oral olarak kullan ld nda, hastalar n %95 inde THY, %70 inde MSY elde edilmektedir. 18 ayl k bir takipten sonra hastalar n %11 kadar nda ise akselere veya blastik faza do ru ilerleme oldu u gösterilmi tir(81,82). Bu hasta gruplar nda yüksek dozlar ile (600-800 mg/gün) yine ba ar l sonuçlar elde edilebilmi tir.
Biz bu çal mam zda yüksek ba ar ve uzun süreli ya am olana sa layan etkin bir tedavi olan imatinibin, 2003-2008 y llar aras nda Dicle Üniversitesi T p fakültesi Hematoloji Klini i taraf ndan takip ve tedavi edilen KML hastalar ndaki tedavi sonuçlar n ve ortaya ç kan yan etkileri incelemeyi amaçlad k.
2
GENEL B LG LER
2.1. KRON K M YELO D LÖSEM Tan m ve tarihçe
KML (Kronik Miyeloid Lösemi), kromozom 9 ile 22 nin kar l kl translokasyonu sonucu geli en, primitif pluripotent kök hücrenin miyeloid progenitör hücrelerde artm proliferasyon ve azalm apoptozu ile karakterize klonal bir hastal d r (1-4).
Kemik ikli inde a r myeloid hiperplazi, periferik kanda olgun myeloid hücrelerin art (yüksek lökosit say s ve özellikle bazofili) ve splenomegali ile karakterizedir. Akut lösemide varolan patolojik tablonun aksine, lösemi hücreleri farkl la ma yeteneklerini kaybetmemi lerdir. Üç farkl klinik evre ile karakterizedir: Kronik faz olarak adland r lan ilk fazda olgunla ma gösteren miyeloid hücrelerin art mevcut iken ard ndan gelen ikinci ve üçüncü fazlarda zamanla miyeloid olgunla ma azal r ve akselere faz ve/veya blastik faza geçi gözlenir (1).
KML ilk kez 19. yüzy lda tan mlanm t r ve yüzy l a k n bir süreden bu yana hastal n klinik ve morfolojik özelliklerine odakl ara t rmalar yap lmaktad r. 1960 da Nowel ve Hungerford, KML li hasta hücrelerinde anormal bir G kromozomu belgelediler ve bu kromozoma bulundu u ehrin ad olan Philadelphia (Ph) kromozomu ad n verdiler. 1970 lerde kromozomal eritlemenin (kromozomal banding) geli imiyle, Ph kromozomunun asl nda 9 ve 22 kromozomlar aras nda bir translokasyon oldu u kan tland . 1980 li y llarda bir dizi ara t rmac bu hastalarda kromozom 9 üzerinde ABL proto-onkogeni ve yan ndaki kromozom 22 üzerinde BCR geni aras ndaki kar l kl translokasyonun olu tu unu gösterdiler.
KML nsidans ve Di er Miyeloproliferatif Hastal klarla ili kisi
KML nin y ll k insidans 100.000 de 1,3 tür ve ya a göre insidans erkeklerde kad nlardan daha s kt r. E/K oran yakla k 1,7/1 dir. Ya la artan bir frekans mevcuttur ve pik insidans ya 53 tür. Çocuklarda yayg n de ildir ve çocukluk lösemierinin %5 inden daha az n olu turur. Eri kin lösemi olgular n n ise % 15-20 sini olu turmaktad r. Türkiye de s kl bilinmemektedir.
KML kronik miyeloproliferatif hastal klardan (KMPH) bir tanesidir. Miyeloproliferatif hastal klar n hepsinde neoplastik kök hücrelerin proliferatif kapasitesi kontrolsüzdür ve a r hemotopoesis meydana gelir. Neoplastik kök hücreler tam farkl lasma geçirme yeteneklerini korurlar ve sonuç olarak kanda kemik ili inde matür ve immatür hücre say s nda belirgin bir artma görülür.
KMPH, neoplastik kök hücrelerinin geçirdi i predominant farkl la ma türü ile birbirlerinden ay rt edilirler. Ayr ca KMPH ilerleyicidir ve iyi ekillenmi ve i levli hücrelerin a r üretildi i bir hastal ktan, kemik ili i yetmezli i veya akut lösemiye geçi in e lik etti i bir hastal a dönü me olas l ta rlar. Benzer hücre ve kaynak dokuya ra men bütün miyeloproliferatif hastal klar bir hastal k olarak grupland rmak ve tedavi etmek mümkün de ildir. En s k görülen KMPH: KML, esansiyel trombositemi, idyopatik miyelofiloroz ve polisitemia vera d r.
Tablo 1: Miyeloproliferatif Hastal klar n S n fland r lmas
Tipik Kronik Miyeloid Lösemi Morfolojik varyantlar :
Kronik eozinofilik lösemi Kronik bazofilik lösemi Kronik nötrofilik lösemi Esansiyel trombositemi
Polisitemia vera
diyopatik miyelofibrozis
Kronik miyelomonositik lösemi, proliferatif tip Atipik kronik miyeloid lösemi
Etyoloji
Genelde KML için etiyolojik bir ajan belirlenemez. yonize radyasyona maruz kalmak KML riskini artt r r. Japonyada 1945 y l nda patlayan atom bombas sonras hayatta kalanlarda KML insidans artm t r. Radyasyona ba l hastal k geli me riski en çok maruziyetten 5-12 y l sonra ve dozla ili kili olarak görülmektedir. Benzene maruz kal nmas , AML riskini artt r rken KML yi etkilemez. KML li hastalarda Cw3 ve Cw4 insan lökosit antijen (HLA) s kl artm t r. KML, di er kanser tedavisinde kullan lan radyoterapi ve alkilleyici ajanlara ba l geli en ikincil lösemilerin s k görülen bir türü de ildir.
Kronik Miyelositer Lösemi Geneti i
BCR ve ABL Genlerinin Hücresel Fonksiyonlar
ABL geni Abelson Murine Lösemi Virusunun ta d v-ABL (viral ABL) geni ile homolog bir yap gösterir. 9. kromozom üzerine yerle ik olan ABL geni, 145 kD a rl nda bir protein üretir. Bu protein ilk ekzonda olu an farkl alternatif splicing sonucu olu ur (5). ABL proteininin yap s nda farkl domainler bulunur ( ekil-2). 3 SRC homoloji domaini (SH1-SH3), proteinin NH2 ucunda yerle mi tir. SH1 domaini, tirozin kinaz fonksiyonuna sahip iken SH2 ve SH3 domainleri abl proteinlerinin di er proteinlerle olan etkile imini sa lar (6). Normal ABL proteini, hücre döngüsünü, programl hücre ölümlerini, hücre büyüme ve ço almas n ve hücrelerin stres ortam na verdi i yan t konrol eder.
22. kromozom üzerinde yerle ik olan BCR geni, sürekli ekspresse edilerek 160 kD a rl nda bir protein üretir.BCR proteinini NH2 ucundaki ilk ekzon, 14-3-3 protein ailesinin bir üyesi olan Bap-1 proteinini ve BCR proteinin kendisini hedefleyen serin treonin kinaz kodlar (5). BCR proteinin merkezindeki Rho Guanidin de i im (Exchange) faktörleri üzerinde, guanidin trifosfat (GTP) guanidin difosfata (GDP) çeviren dbl-like ve plekstrin homologi (PH) domainleri bulunur. Rho Guanidin de i im faktörleri, NFKB gibi transkripsiyon faktörlerini aktif hale getirir (7). BCR proteinin COOH ucu RAC-GTPaz aktivitesine sahiptir. BCR
tirozinden fosforlanabilmekte ve bu durum BCR nin RAS yola n n aktivitesini etkileyen GRB-2 proteinine ba lanmas n kolayla t rmaktad r (8) ( ekil -5).
BCR /ABL Translokayonunun Moleküler Anatomisi
ABL geni üzerindeki k r lma noktas 9q34 kromozomunda 300 kb l k bir bölgenin 5 ucundaki herhangi bir bölgede meydana gelebilir. K r lma noktas Ia veya Ib veya daha s kl kla iki ekzonun aras ndaki bir noktada olu abilir (9). K r lman n farkl noktalarda olu mas ABL geninin BCR geni ile translokasyonunda herhangi bir probleme neden olmaz. ABL geninin aksine BCR geni üzerindeki k r lmalar farkl noktalarda olu abilir.
Birçok KML vakas nda ve ALL hastalar n n 1/3 ünde k r lma noktas 5,8 kb uzunlu undaki 12. ve 16. ekzonlar aras nda meydana gelir. Bu bölge major BCR (M-BCR) olarak isimlendirilir. K r lman n bu bölgede meydana gelmesi ile 210 kD moleküler a rl nda BCR/ABL füzyon proteinini kodlayan, b2a2 veya b3a3 genleri olu ur. ALL hastalar n n 2/3 ünde ve nadiren KML hastalar nda k r lma noktas e2 ekzonunda olu makta ve 190 kD moleküler a rl nda BCR/ABL proteinini kodalayan e2a2 geni olu ur. e2 ekzon bölgesi üzerinde olu an k r lma noktas minör
(m-BCR) olarak isimlendirilir (7) ( ekil-3). Son dönemlerde 3. bir k r lma noktas , e19 ekzonu üzerinde tespit edilmi ve 230 kD moleküler a rl nda BCR/ABL proteinini kodlad belirlenmi tir ( ekil-3). Nadir görülen kronik nötrofilik lösemi hastalar nda tespit edilen bu k r lma noktas mikro-BCR olarak isimlendirilir. K r lma noktas n n ABL de sabit, BCR de ise de i ken olmas , ABL geninin sa l kl hücreleri transformasyona u ratarak kanser hücresine dönü mesini sa larken BCR geninin hastal n fenotipini etkiledi ini ortaya koymu tur. Nitekim baz ALL hastalar nda BCR/ABL füzyon proteininden farkl olarak olu an TEL/ABL füzyon genininde lösemiye neden oldu u gösterilmi tir(10).
ekil-3. BCR /ABL Translokayonunun Moleküler Anatomisi
BCR/ABL Geni Taraf ndan Kontrol Edilen Malign Transformasyon Mekanizmalar
I ABL Tirozin Kinaz Aktivitesinin Kontrolü
ABL tirozin kinaz aktivitesi normal artlarda çok s k bir ekilde kontrol edilir. SH3 domaini ABL proteinin aktivitesinin engellenmesinde önemli bir rol oynar. SH3 domaininin delasyonu veya de i imi tirozin kinaz aktif hale getirir. Avi-1 ve Avi-2 proteinleri SH3 domainine ba lanarak, SH3 ün inhibitör fonksiyonunu aktif hale getirir. Öte yandan aktif hale gelmi ABL proteinin, Avi-1 proteinlerinin y k m n sa layan proteozomlar n aktivasyonlar n artt rd gösterilmi tir (11). Alternatif olarak, SH3 domaini ABL proteinin prolince zengin bölgesine ba lanarak ABL kinaz n substratlar ile olan etkile imini engelliyecek yap sal de i ikliklere yol açabilmektedir (12).
ekil-4. BCR/ABL Geni Taraf ndan Kontrol Edilen Malign Transformasyon Mekanizmalar
BCR-ABL
ADHEZYON
DE
M
M TOJEN K
AKT VASYON
APOPTOZ S
NH B SYONU
MAL GN
FENOT P
II BCR/ABL Pozitif Hücrelerin Biolojik Özellkleri ve Aktif Sinyal leti Yollar
BCR/ABL füzyon proteini taraf ndan gerçekle tirilen malign tranformasyonun 4 temel mekanizmas vard r. Bu mekanizmalar hücrenin adhezyon özelliklerini kaybetmesi, mitotik bölünmeyi sa layan sinyal ileti yollar n n sürekli aktif tutulmas , apoptozun engellenmesi ve proteazomlarca ABL gen aktivitsini engelleyen protenlerin parçalanmas d r (7).
III-Bozulmu Adhezyon Özellikleri
KML progenitör hücreleri kemik ili i stroma hücrelerine ve ekstra sellüler matrikse dü ük adhezyon gösterirler. Beta- integrinlerin stroma ve progenitör hücreler aras ndaki etkile imde önemli rolleri vard r (13). KML hücreleri normal progenitör hücrede bulunmayan ve adhezyonu engelleyebilen farkl bir beta- integrin ekspresse eder. Öte yandan BCR/ABL taraf ndan transforme edilen hücrelerde bulunan Crkl proteini, hücrelerin hareketlili ini ve integrin taraf ndan kontrol edilen hücre adhezyonunu, paksilin, Fak, P130Cas ve Hef1 gibi adhezyon molekülleri ile etkile erek konrol alt nda tutar (7) ( ekil-5).
IV-Mitoz Sinyal leti Yollar n n Aktivasyonu
- Ras ve MAP kinaz
- JAK/STAT
- PI-3 kinaz
ekil-5. BCR/ABL füzyon geninin moleküler yap s Mitoz sinyal ileti yollar n n aktivasyonu ve etkisi
nsan model hücre hatlar nda BCR/ABL ekspresyonunun tirozin kinaz aktivitesi ve Ras onko geninin aktif hale getirilmesi ile büyüme faktörü eksikli inden kaynaklanan apoptozu engelledi i gösterilmi tir (14). Bunun yan s ra BCR/ABL pozitif hücre hatlar nda DNA da olu an zararlardan kaynaklanan apoptoza kar bir direnç geli ti i gösterilmi tir. BCR/ ABL füzyon proteini, mitokondriden stokrom c nin sal n m n engelleyip kaspazlar n aktivasyonunu engeller. Kaspazlar n aktivasyonu mitokondri membran potansiyeli ve dolay s ile Bcl-2 protein ailesi taraf ndan kontrol edilir. BCR/ABL füzyon proteini, Bcl-2 geninin ekspresyonunu Ras ve/veya PI-3 kinaz yolu ile kontrol eder. Bunun yan s ra BCR /ABL pozitif hücrelerde, Bcl-XL gen ekspresyonu STAT-5 yolu ile kontrol edilir (7).
BCR/ABL pro apoptotik Bad proteinini serin aminoasidinden fosforile ederekte apoptozu engeller. Akt nin yan s ra Raf-1 proteinini de serin aminoasidinden fosforile eder (15). BCR/ABL nin ba latt ve hücrelerin ço almas n tetiklerken apoptozu engelleyen kompleks sinyalleri tam anlam ile birbirinden ay rmak güçtür. BCR/ABL, hücre içi dengeyi hücrenin büyümesi yönüne
çeviriken apoptozuda engeller (7). Öte yandan BCR/ABL ile transfekte edilen hücrelerde BCR/ABL proteininin Fas reseptörü / Fas ligand sistemi ile apoptozu engelledi i gösterilmi tir (16).
Hastal n Tranformasyonunda Moleküler ve Hücresel De i imler
KML nin akselere fazdan blast faz na geçi lerde hastalar n %50-80 inde sitogenetik ve moleküler de i iklikler gözlenir. Minör de i imler 7, 17 ve Y kromozomlar nda gözlenen monozomiler, 7. ve 21. kromozomlarda gözlenen trizomiler ve t(3;21) (q26;q22) translokasyonudur. Major de i imler ise 8 ve 19. kromozomlarda trizomi, 17. kromozomda izokromozom i(17q) ve ekstra Ph kromozomudur (double Ph) (17).
Moleküler anormallikler sitogenetik de i ikliklere denktir. P53, RB1, c-MYC, p16NK4A ve RAS genlerindeki t(3;21) (q26;q22) translokasyonu ile olu an AML EVI-1 füzyon proteininde anormallikler bunlardan baz lar d r. P53 ün yap s nda meydana gelen delasyon, translokasyon ve nükleotit mutasyonu gibi bozukluklar myeloid transformasyon ile direkt ilgili olup blastik fazdaki KML hastalar n n %20-30 unda gözlenir (18). RBI geninin yap s nda meydana gelen bozukluklar ise lenfoid transformasyonda etkilidir. P53 ün yap s nda meydana gelen mutasyonlar KML hücrelerinin transformasyonu ve hücrelerin metilasyonu ile ilgilidir (19).
Klinik Prezentasyon
Kronik faz KML de ba lang ç semptomlar genellikle sinsidir. KML klinik bulgular de i kenlik gösterir. Tan s ras nda hastalar n yakla k %30 u asemptomatik olabilir. KML hastalar n n %10 u akselre fazda %10 uda blastik fazda te his edilmektedir. Kromozom anomalisinin gerçekle mesiyle klinik bulgular n ortaya ç kmas aras nda yakla k 6 y l vard r. Miyeloid hiperplazi ve splenomegali ile karakterize kronik faz hemen daima akselere ya da akut lösemi özelliklerini ta yan blastik faz izler. Agresif blastik faz s kl kla birkaç ay sürer ve hastan n ölümüyle sonuçlan r (20).
Görülebilen KML semptomlar ; anemi semptomlar (halsizlik, çabuk yorulma, efor intolerans , fonksiyonel kapasitede azalma gibi), splenomegaliye ba l semptomlar (kar nda i lik ve a r , dala n mideye bas s sonucu çabuk doyma), hipermetabolik duruma ba l semptomlar (ate , i tahs zl k, kilo kayb , gut), trombosit disfonksiyonuna ba l semptomlar (hemoraji, ekimoz, hematom, tromboembolik olaylar, retinal hemoraji), hiperlökositoz ve hipervizkoziteye ba l bulgular (tinnitus, stupor, görme bozuklu u, nefes darl , priapizm ve serobrovasküler olaylar) eklinde kendini gösterebilmektedir.
Sternal hassasiyet lökostaz varl nda görülebilir. Blastik fazda terleme kemik a r s ve kilo kayb vard r. KML hastalar n n fizik muayenelerinde %50-90 splenomegali, %10-20 hepatomegali vard r. Hastal n seyrinde ekstra meduller hematopoez odaklar , cilt alt lezyonlar, lenfadenopati geli imi nadirdir. Ancak ileri evrede veya lenfoblastik dönü ümde LAP görülebilir. Bunun yan s ra günümüzdeki daha iyi ve nitelikli sa l k hizmeti sunumu nedeniyle hastalarda herhangi bir semptom geli meden önce tan konulmas gittikçe daha fazla yayg nla maktad r.
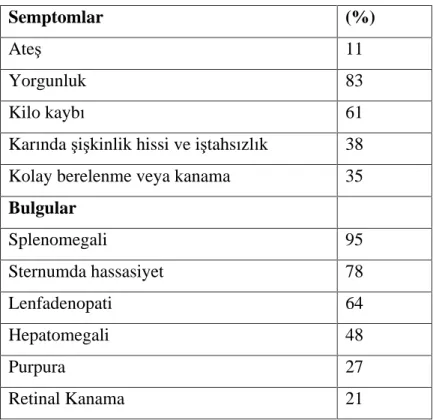
Tablo 2. KML Kronik Faz Ba lang ç Semptom Ve Bulgular
Semptomlar (%)
Ate 11
Yorgunluk 83
Kilo kayb 61
Kar nda i kinlik hissi ve i tahs zl k 38
Kolay berelenme veya kanama 35
Bulgular Splenomegali 95 Sternumda hassasiyet 78 Lenfadenopati 64 Hepatomegali 48 Purpura 27 Retinal Kanama 21
Yap lan gözlemler ba lang ç kromozom translokasyonundan hastalar n semptomatik olduklar a amaya kadar geçen sürenin üzerinden yakla k olarak 6 y l geçti ini göstermekte ve beyaz küre say s n n 100.000 eula mas yakla k olarak 19 ay sürmektedir. KML hastalar n n tan dan sonra ortalama ya am süreleri yakla k 4,5 y ld r. Bu nedenle tipik bir vakada, KML nin total sürecinin ba lang c ndan itibaren 10 y l kadar oldu u görülür.
Klinik Seyir
Kronik faz KML genellikle klinik komplikasyonlara öncülük etmeyen, artm beyaz küre say s (BK) ile birlikte, kemik ili i proliferasyonu ve maturasyonu ile karakterizedir. Genel olarak lökositozun acil tedavisi gerekli de ildir. Blast art olmadan çok yüksek BK say s n n yol açabildi i papil ödem, körlük, inme gibi lökostaz sekelleri yayg n de ildir (21). Bununla birlikte blastik krizde lökostatik sendromlar görülebilir ki bu durumda lökosit say s n n kontrolü zorunludur.
Kemik ili inin miyeloid hücrelerinin anormal proliferasyonunun kötü klinik sonuçlar kronik faz KML de genellikle görülmez (22).
Kronik faz KML hastalar nda bakteriyel ve fungal enfeksiyon s kl nda art yoktur. Trombosit disfonksiyonu s k görülür ve baz hastalarda hafif derecede kanama e ilimi görülebilir (23, 24). Trombosit say s n n belirgin olarak yüsek oldu u (özellikle 1.000.000 un üzerinde) durumlarda tedavi ile trombosit say s n n dü ürülmesini gerektiren trombozlar görülebilir (25).
Kronik faz KML hastalar nda özellikle BK say s kontrol alt nda iken ya am kalitesi ve performans statusu genellikle normaldir. Ne yaz k ki bu hastalar hastal n di er ileri fazlar na do ru geçi gösterirler. lk y l hastalar n %5 i, takip eden y llarda her y l hastalar n %20-25 i blastik faza girer (26).
Kronik fazdan akselere faza ve blastik faza geçi bir tak m klinik ve laboratuar özellikler ile karakterizedir (27). Antiproliferatif ajanlara ra men kemik ili i ve periferik kanda kontrol edilemeyen miyeloproliferasyon, organomegalide artma, ate , kemik a r s ve kilo kayb akselere faz n klinik özelliklerini yans t r.
Akselere faz n laboratuar özelliklerinde ise periferik kan yaymas ve kemik ili inde immatür hücre say s nda art , eozinofilive bazofilide art , Ph kromozomuna ek olarak di er kromozomal anomalilerin geli imi gibi bulgular
mevcuttur. Hastalar n tümü kronik fazdan akselere ve blastik faza sistematik bir biçimde geçmez. Blastik faz, mevcut bir uyar olmaks z n, oldukça beklenmedik bir ekilde meydana gelebilir. Akselere faza k yasla blastik faz daha kolay tan mlanmaktad r. Blastik fazda artm s kl kta santral sinir sistemi tutlumu, lenf nodu kloromalar gibi önceki fazlardan farkl klinik bulgular görülebilir. Yap lan çal malar KML ölümlerinin çok büyük k sm n n blastik kriz nedeni ile olu tu unu ortaya koymu tur (28).
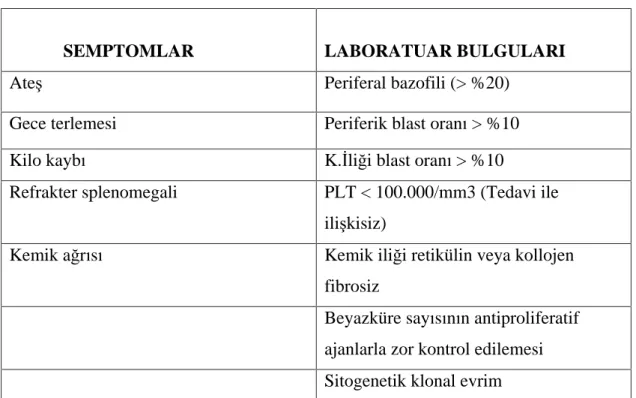
Tablo 3. Akselere Faz n Laboratuar ve Klinik Özellikleri
SEMPTOMLAR LABORATUAR BULGULARI
Ate Periferal bazofili (> %20)
Gece terlemesi Periferik blast oran > %10
Kilo kayb K. li i blast oran > %10
Refrakter splenomegali PLT < 100.000/mm3 (Tedavi ile ili kisiz)
Kemik a r s Kemik ili i retikülin veya kollojen
fibrosiz
Beyazküre say s n n antiproliferatif ajanlarla zor kontrol edilemesi Sitogenetik klonal evrim
Ölüm sebebi blastik kriz olmayan hastalarda ise ölümün en önemli sebebi ileri dönem miyelofibrosise benzer ekilde geli en kemik ili i yetmezli idir.
KML hastalar n n klini inde herhangi bir üpheli de i iklik blastik kriz için üphe uyand rmal d r. Kemik ili inde fibrosis varl kötü bir belirteçtir. KML, tedavi ile kontrol alt nda görünürken aç klanamayan ate blastik kriz habercisi olabilir. Bununla beraber hastal k tedavi edilmedi i zaman ate , kronik faz KML ye e lik edebilir. BK say s nda orant s z bir artma veya azalma, anemi veya splenomegali geli imi, beklenmeyen trombositoz veya trombositopeni geli imi de blastik kriz habercisi olabilir (29). Kemik ili i, dalak ve karaci erin yan s ra di er organlar n belirgin invazyonu, tipik kronik faz KML de nadirdir. Bu gibi invazyonlar n belirtisi olarak özellikle lenf nodlar nda saptanan büyüme ço u kez
blastik krizi i aret eder.
Hastalar n önemli bir k sm , kemik ili i ve kan yaymas henüz kronik evrede görünürken s n rland r lm bir alanda blastik kriz belirtisine sahiptir. Kemikte geli ebilmesine ve kemik veya di er dokular n y k m na e lik edebilmesine ra men s n rland r lm (lokalize) blastik kriz için en yayg n muhtemel alan lenf nodlar d r (30). Blastik faz, akut löseminin bütün belirtileriyle karakterizedir.
Tablo 4. Blastik Faz n Laboratuar Ve Klinik Özellikleri
SEMPTOMLAR LABORATUAR BULGULARI
Akselere fazda görülen semptomlar semptomlara ilave olarak Lenfadenopati
Periferik kan Blast oran > %20
Ekstra medüller Blastik Kloromalar K. li i blast oran > %20
Ekstra medüller Blastik Kloromalar
Baz hastalarda yeni kromozom anomalileri kemik ili inde olmay p lenf nodu veya dalak gibi ba ka organlarda meydana gelmektedir (31, 32).
Blastik krizde oldu u gibi KML hastalar nda Ph kromozomuna ek olarak di er kromozal anomaliler s k s k gözlenir (%60 - %90). Tart lan di er de i ikliklerin ço unda oldu u gibi ek kromozonal anomalilerin geli imi, blastik kriz için spesifik de ildir.
Bu gözlemler blastik kriz kolonlar n n dalakta, as l blast krizden önce meydana gelebildi i dü üncesine yol açm ve KML li hastalarda splenektomi gibi ba ar s z tedavi denemeleri için bir gerekçe olu turmu tur.
Hastalar, s ras yla nötropeni ve trombositoperinin neden oldu u birçok bakteriyel, fungal enfeksiyon ve hemorajiye maruz kal rlar. Bu komplikasyonlar 3-6 ay içinde hastalar n ölüme yol açabilir.
Tan
Kronik Faz
KML tan s periferik kan yaymas ve kemik ili i biyopsisi incelemelerine ile birlikte ya karyotipik analizle Ph kromozomunun, ya da southern blot veya polimeraz zincir reaksiyonu ile BCR-ABL ürününün saptanmas yla konulur.
Periferik Kan Bulgular
Periferik kanda en önemli bulgu nötrofilik lökositoz ve bazofildir. Azalm bir LAP (lökosit alkalen fosfataz) skoru hemen hemen vakalar n tümünde erken bir belirti olarak görülür (33). Lökositoz predominant olarak nötrofilik karakterdedir ve miyeloblasttan segmete nötrofile kadar tüm geli im basamaklar gözlenir. Segmente nötrofiller ve myelositler daha yüksek oranda görülür ve bütün nötrofilik prekürsörler elektron ve k mikroskobunda normal morfoloji sergiler. Hastal n geç dönemlerinde Pelger- Hüet anomalisi görülebilir. Miyeloblast say s genellikle total BK say s n n %3 ünü a maz.
Bazofili de i mez bulgu olarak mevcuttur ve kritik önem ta r. S kl kla tan dan y llar önce tespit edilebilir. Hastalarda eozinofili de bulunabilir ancak bazofili gibi prognostik özellik ta maz. Nadiren mikst basofil-eozinofil veya mikst bazofil-mast hücre granülasyonunun e lik etti i melez hücreler de bulunabilir (34).
KML de görülen lökositoz tipik olarak mutlak monositoz ile ili kili olmas na ra men rölatif olarak monositopeni gözlenir. Blastik krizde artmas na ra men genelde total BK say s n n %2 veya daha az n olu turur. Erken fazda monositoz olmamas KMML ile ay r c tan da kolayl k sa lar. Lenfositoz yag n olarak görülmesine ra men mutlak lenfositoz de i kendir.
Trombositoz hastalar n yar s ndan fazlas da görülür. S kl kla 1.000.000/mm3 ün üzerindedir. Nadir olarak 100.000/mm3 ün alt nda saptan r. Trombositler görünüm olarak de i kendir. Yakla k olarak vakalar n dörtte birinde periferik kanda megakaryositlere rastlan r. Hastalar n ço u tan esnas nda normokrom/normositik anemiye sahip olmas na ra men normal veya yükselmi hemoglobin düzeyleride kaydedilmi tir. Minimal anisositoz ve poikilositoz ile birlikte çekirdekli k rm z kan hücresine birçok vakada rastlan lmaktad r. Seyrek olarak rastlant sal bir hemolitik anemi bulunabilir. Morfolojik olarak k rm z kürelerde saptanan bozukluk blastik fazda veya eritroid seri hastal klar nda görülebilir.
Kemik li i Bulgular
Kemik ili i incelemesi KML yi di er KMPH ve reaktif proçeslerden ay rmaya yard mc olur. Kemik ili i belirgin hipersellülerdir ve miyeloblastlardan segmente nötrofillere kadar nötrofilik preküsörlerin proliferasyonu ile karakterizedir.
Morfololojik ve maturasyon aç s ndan tüm evreler normal görünmesine ra men myelosit yüzdesi periferik yamadada izlendi i gibi kemik ili inde de artm t r. Miyeloblast yüzdesi s kl kla %5 i a maz. Miyeloid prekürsörler normal kemik ili inde de görüldü ü gibi periosteal lokalizasyonda bulunur. Periferik kanda görüldü ü gibi artm say da bazofil, eozinofil, melez hücre öncülleri de mevcuttur. Megakaryositler tipik olarak artm say dad r ve nadiren üç veya daha fazla merkezi intertrabekuler bölgeden olu an gruplar bir arada toplanm t r. Megakaryosit kümelenmesi esansiyel trombositozda oldu u kadar belirgin de ildir. KML de megakaryositler önemsiz derecede normal megakaryositlerden daha küçüktür ve mikromegakaryositler mevcuttur. Hastalar n yakla k dörtte birinde kaba PAS (+), stoplazmik materyal içeren (pseudogaucher) makrofajlar görülebilir. Miyeloid/eritroid oran (M/E) de i mez biçimde artm t r (34).
Retikülin ve PAS ile boyanan ba doku birikimi hastalar n ço unda saptanmaz bununla birlikte baz vakalada idiopatik myelofibrosisi dü ündürecek ekilde kemik ili inde asellüler alanlar olu turabilen ba doku birikimleri saptan r. Bu birikimler s kl kla kan damarlar etraf nda ve megakaryositlerin çevresinde görülür. Ba doku birikimi ile beraber dalak boyutunda artma artm periferik blast yüzdesi ve Ph ilave ek genetik anomaliler ve azalm hemoglobin seviyeleri ile birlikte görülür. Birçok çal mada retikülin lif depozisyonunun kötü bir progroza e lik etti inin görülmesi a rt c de ildir.
Sitogenetik Bulgular
Karyotip analizi en iyi kemik ili inden yap lmas na ra men periferik kandan da yap labilir. Genelde kromozom 9 ve 22 aras ndaki basit veya kompleks transloksyon (t(9;22), (q34;q11)) tan y do rular. Vakalar n %5-10 u BCR genin yeniden düzenlenmesine yol açan farkl bir translokasyona sahiptir. Farkl ve klasik Ph üreten translokasyonlara sahip hastalar; klinik ve hematolojik olarak özde , ancak Ph (-) vakalardan farkl d rlar.
Tipik olarak; kronik faz n büyük bir bölümü süresince Ph kromozoma tek kromozomal anamali olarak kal r. Klinik ve morfolojik olarak KML özelli i gösteren vakalar n küçük bir bölümü bir t(9;22) veya baz farkl tipleri karyotipik analizlerle tan mlanmam olup Southern blot veya PCR gibi moleküler tekniklerle belirlenebilir. Farkl Ph kromozomlar iki alt gruba ayr l rlar; basit ve kompleks.
Basit tip translokasyonlarda 22q dan bir segment, 9 dan farkl bir kromozomla translokasyona u ramaktayken, kompleks translokasyonlarda 3 veya daha fazla kromozom yer almaktad r.
t(9;22) KML nin belirgin bir i areti olmas na ra men, KML için ay r c de ildir. ALL li yeti kin hastalar n %10-20 sinde ve çocukluk ça ALL hastalar n %2 ila 5 inde t(9;22) pozitifli i saptanabilir. Ek olarak t(9;22) lenfoma, de novo AML ve miyelomal vakalarda da nadiren görülebilir (34).
Moleküler Tan ve Klinik li ki
Sitogenetik analizlerle Ph pozitifli i gösterilmi KML hastalar BCR ve ABL genlerinin moleküler füzyonuna sahiptir. Bu kromozomal translokasyon ayn zamanda southern blot analizi ile saptanabilir veya füzyon ürününün mRNa s RT-PCR (revers transkriptaz) ile gösterilebilir. Southern blot ve RT-RT-PCR kompleks translokasyonlar tespit edememesine ra men sitogenetik olarak yanl negatiflik saptanan hastalar n küçük bir k sm nda southernblot ile translokasyon saptanabilir.
Sitogenetik ve moleküler teknikler kullan larak hastalar n takla k %99 unda Ph pozitifli i saptanabilir. Kalan %1 lik hasta gurubuna Ph(-) KML veya atipik KML ad verilir. Muhtemelen bu hastalar di er kronik myeloproliferatif hastal klarla birliktedir ve daha agresif seyir gösterir.
RT-PCR farkl uzunluklardaki (190 kd, 210 kd, 230 kd) BCR/ABL ürünlerini tespit edebilir. RT-PCR ile k r lma noktalar n n tesbiti ALL, KML, AML, kronik nötrofilik lösemiyi birbirinden ay rmaya yard mc d r. KML hastalar n n neredeyse tamam nda p210 füzyon proteini bulunur. Ph(+) ALL vakalar nda genellikle p190 proteini saptan rken. Daha nadir ve daha küçük füzyon proteinleri KML ve AML vakalar nda saptanabilir. p230 proteni daha çok kronik nötrofilik lösemide saptan r. p210 transkriptlerinin 2 türü mevcuttur. b2a2 ve b3a2 bu gruplar aras ndaki belirgin prognostik farklar tart mal olmas na kar n b3a2 transkriptli hastalar n daha yüksek trombosit say s na sahip olmalar olas d r. Ek olarak, b2a2 ve b3a2 nin frekans çocukluk ça KML ve yeti kin KML de farkl l k göstermektedir. Yeti kinlerin üçte ikisi b3a2 transkriptine sahipken; KML li çocuklar n büyük bir ço unlu unda b2a2 transkriptine rastlanmaktad r (34).
Yap sal Analizler ve mmunfenotipik Bulgular
Flow sitometri analizi kronik faz KML tan s nda önem te kil etmez çünkü KML hücrelerinin fenotipleri normal hücrelerle ayn d r. Olgun KML granülositlerin büyük ço unlu unun yap sal görünü ü normal gronülositlerle hiçbir farkl l k göstermez (34).
Extrameduller Hastal k
Kronik faz süresince, KML hücreleri dalak ve karaci eri infiltre eder. Miyelopoez oda sinüzoidlerde gözlenebilir. Bu bulgu muhtemelen ikincil ekstramedullar hematpoezi ba l d r. Hepatik sinüzoidleri infiltre eden lösemik hücre topluluklar na rastlamak mümkündür. Lenfodenopati, terminal faza geçi i dü ündüren kayg verici bir durumdur (34).
Terminal faza geçi (Blastik veya Akselere Faz)
KML genellikle 2-4 y ldan sonra daha agresif evreler olan akselere faz ve blast kriz olarak tan mlanan iki klinik görüntüye dönü ür. Bu geçi e histolojik, sitogenetik ve moleküler bulgular e lik eder (34).
Histopatoloji
Geçi i lemi de novo akut lösemiye benzeyen blast yüzdesindeki h zl bir art la ani olarak gerçekle ebilece i gibi (blastik kriz), kemik ili i yetmezli iyle sonuçlanan anemi ve trombositopeni ile birlikte daha yava ve daha ilerleyici bir
ekilde de (akselere faz) geli ebilir.
Belirgin ölüm nedeni olan blastik kriz, KML nin akut lösemiye e de er bir tabloya transformasyonudur. Akut lösemiye e de er bir ekilde periferik kanda ve kemik ili i yaymas nda % 20 den daha fazla blast bulunur. Kemik ili i biyopsisinde geni ölçüde blast y nlar n n milkroskopik tan mlanmas veya ekstramedüller tutulum alanlar ndan al nan biyopsiyle tan konulabilir.
Blastik transformasyondaki KML vakalar n n yakla k üçte ikisinde sitolojik yöntemlere ve immunofenotipik analizlere göre blastlar miyeloid özellikler ta r. Bu vakalar miyeloid (M1-2), miyelomonositik (M4-5), eritroblastik (M6) veya megakaryoblastik (M7) lösemilere benzerlik gösteren bir nonlenfositik lösemiler spektrumu sergileyebilir.
Dikkatle bak ld nda çok nadir auer çubuklar gözlenebilir. Sudan black ve miyeloperoksidaz belirgin bir ekilde azalm veya negatiftir ve negatif olmas akut
miyeloblastik lösemiyi ekarte ettirmez. Transformasyon vakalar n n üçte birinde blastlar, lenfablastlar n morfolojik , immunofenotipik ve yap sal özelliklerine sahiptir. Bu blastlar, en yayag n L1 veya L2 olmak üzere ALL nin tüm tiplerine sitolojik benzerlikler gösterebilirler. De novo ALL deki blastlara benzer olarak Sudan black, miyeloperoksidaz ve klorasetat esteraz negatiftirler. Bununla birlikte blastlar PAS pozitifli ine sahip olabilir. Lenfoid antijenler, özellikle B hücre yüzey antijenleri saptanabilir. Lenfoblastlar vakalar n büyük bir bölümünde terminal deoksinükleotid transferaz pozitiftir ve B hücre öncül lenfoblastlar n özelliklerine sahiptirler. Ço unluk CD10 (CALLA) ve yüzey immunuglobulinleri olmayan CD19 dur. Baz vakalarda sitoplazmik a r zincirler görülebilmektedir (34).
LAP (LÖKOS T ALKAL N FOSFATAZ)
KML, blastik kriz veya akselere faza geçerken LAP de erleri ço u zaman yüksektir. Bununla beraber LAP de erleri oldukça de i kendir ve e zamanl enfeksiyon gibi süreçlerden etkilenmektedir. Kationik lökosit antijen, eritrosit membran proteinleri ve fukozil transferaz gibi birçok serum ve idrar proteinlerinin terminal faz n ba lang c nda artt kaydedilmi tir (34).
Tablo 5. KML de Prognozu Belirlemede Kullan lan Risk Skorlar
Sokal ndeksi:
SI = EXP [0,0116 (ya
43,4) + 0,0345 (dalak büyüklugü* - 7,51) + 0,188 (trombosit say s /700] 2 0,563) + 0,0887 (periferik blast yüzdesi 2,10)] *Kot alt uzunluk
Yeni skorlama sistemi (Hasford):
Yeni skor: (0,6666 x ya [e er ya < 50 ise 0; aksi halde 1] + 0,420 x dalak büyüklü ü [cm kotalt ] + 0,0584 x blast [%] + 0,0413 x eozinofil [%] + 0,2039 x bazofil e er bazofil < 3% ise 0; aksi halde 1] + 1,0956 x trombosit say s [e er trombositler < 1500 x 109/L ise 0; aksi halde 1] ) x 1000
Dü ük risk: < 780; Orta risk: 781-1479; Yüksek risk: > 1480
2.2. KML de TEDAV
KML tedavisinde ba lang çta hastal n biyolojik seyrini de i tirmeyen hücre say s n azalt c sitotoksik tedaviler (ba ta hidroksiüre (HU) ve busulfan)
kullan lm t r. Sonraki dönemde biyolojik yan t düzenleyici ilaçlar (interferon ve interferon / ARA-C kombinasyonu) sitogenetik remisyon sa lama amaçl kullan lm t r (35).
Lökosit say s çok yüksek KML hastalar nda hipervizkozite sendromu bulgular varsa lökoferez uygulanabilir. Günümüzde HU, lökostatik komplikasyonlar önlemek amac yla myeloid hiperplaziyi azaltmak için ya da allojenik kök hücre nakli (AKHN) öncesi kullan lmaktad r. matinib öncesi dönemde IFN temelli rejimler 10 y ldan uzun bir süre ilk tedavi seçene i olmu tur. Randomize kontrollü çal malar IFN un konvansiyonel tedavi ile kar la t r ld nda sa kal m uzatt n göstermi tir. IFN, hastalar n %80 inde hematolojik, %50 sinde de sitogenetik cevab indüklemi tir. Sa kal mda önemli uzama sadece sitogenetik cevab olan hastalarlarda görülmü tür (36).
matinib öncesi dönemde, uygulanabilen hastalar için AKHN, uzun süreli moleküler remisyon sa lamas ve %50 ye varan kür oran ile önemli bir tedavi seçene i olmu tur. 1998 y l nda spesifik BCR/ABL tirozin kinaz inhibitörü imatinib mesilat (STI571) bir ilaç olarak klinik uygulamaya girdikten sonra KML tedavisinde imatinib dönemi ba lam t r. matinib, 400 mg/gün dozunda özellikle kronik fazda hematolojik, sitogenetik, hatta moleküler remisyon (BCR-ABL füzyon transkriptinin kaybolmas ) sa layabilmektedir. matinib, oral olarak çok iyi tolere edilir. Tedavi, mevcut verilere göre ya am boyu verilmelidir. Ödem, cilt döküntüleri, sitopeniler gibi yan etkileri vard r. Ancak di er KML tedavilerine göre bu yan etkiler çok daha iyi tolere edilir. laca ba l yan etkiler nedeniyle tedavinin sonland r lmas hastalar n %5 inden daha az nda görülmü tür. En s k gözlenen yan etkiler; kas iskelet ikayetleri ile ödemdir. Bulant , kusma, ishal, makülopapüler cilt döküntüsü, halsizlik ve ba a r s di er s k gözlenen yan etkilerdir. Doza ba ml hepatotoksisite ve miyelosupresyon görülebilir. Bu yan etkiler s kl kla tedavinin ilk 2-4 haftas içinde ortaya ç kar. S v retansiyonu tüm çal malar n ortak bulgusu olmu tur. Periorbital ve pretibial gibi vücudun herhangi bir bölgesinde subkutan ödem olarak kendini gösterebilir. Baz hastalarda plevral efüzyon, assit, kilo al m görülebilir. Karaci er fonksiyon testlerindeki bozukluk s kl kla hafif transaminaz yüksekli i eklinde görülür. Genellikle tedaviye 1-2 hafta ara verilmesi ile düzelir. Myelosupresyon kemik ili i toksisitesini gösterebilir ya da imatinibin antilösemik
etkisine ba l olabilir. Kronik fazdaki hastalarda dü ük kan de erleri tedaviye birkaç gün ara verildikten sonra s kl kla düzelir ancak ileri evre hastalarda düzelme daha uzun sürede olur. Bununla birlikte tedavi maliyeti oldukca yüksektir (37, 38).
nterferona dirençli KML hastalar nda imatinib ile yap lan Faz II cal malarda %95 THY, %65 MSY, %48 TSY elde edilmi tir(39).
Bu imatinib uygulanan hastalar n sa kal m %92 dolaylar ndad r. Randomize IRIS çal mas nda, imatinib mesilat ile interferon- / Ara-C kombinasyonu, yeni tan alan KML hastalar nda kar la t r lm t r. Bu çal maya al nan 1106 yeni tan l KML hastas nda, MSY oran ilk y l sonunda imatinib alan hastalarda % 83 olarak saptanm t r ve interferon- / Ara-C kombinasyonu ayn dönemde sadece %20 yan t sa lad ndan imatinib mesilat, KML tedavisinde standart hale gelmi tir. IRIS hastalar n n 60 ayl k izleminde, elde edilen sitogenetik yan tlar n sürekli oldu u gosterilmi tir. Bu süre sonunda imatinib alan hastalarda %92 major sitogenetik yan t, %87 tam sitogenetik yan t saptanm t r (40).
Sokal s n flama sistemine göre hastalar, dü ük, orta ve yüksek risk gruplar na göre ayr ld nda sitogenetik yan tlar nda anlaml fark bulunmu tur. Dü ük risk grubundaki hastalarda tam sitogenetik yan t oran %89, orta risk grubunda %82 ve yüksek risk grubunda %69 olarak saptanm t r. matinib kullanan hastalarda hesaplanan 5 y ll k sa kal m daha önce yap lm tüm prospektif çal malardan daha yüksektir. matinib ile tedavi edilen hastalar n hematolojik, sitogenetik ve moleküler olarak izlenmesinin önemi çok fazlad r. Sitogenetik izlem, konvasiyonel sitogenetik incelemeler, F SH, kalitatif ve/veya kantitatif PCR analizleri ile yap l r. ELN (European leukemia Net) tam hematolojik yan t elde edilinceye kadar 2 haftal k aralarla kan say m takibini, tam sitogenetik yan t elde edilene kadar 6 ayl k aralarla, daha sonra y lda bir sitogenetik de erlendirme ile takibi önermektedir. Moleküler testler (RT-PCR) ile de 3 ay arayla periferik kandan de erlendirme önermektedir. mkanlar dahilinde ilaca suboptimal yan t ya da yan ts zl k durumunda mutasyon analizleri de yap labilir (41).
matinib tedavisi alt nda relaps olan hastalar incelendi inde akkiz imatinib direncine neden olan mekanizman n esas olarak BCR-ABL nin kinaz domainindeki mutasyonlar oldu u görülmü tür (42).
net anla lmas yla geli tirilmi , daha potent yeni tirozin kinaz inhibitörü moleküllerdir. Her iki ilaçla yak n zamanda yap lm faz I çal malar yay nlanm t r (43).
matinibe resistan kronik KML hastalar nda, her iki ilaçta %92 oran nda hematolojik rmisyon sa lam , %35 oran nda da tam sitogenetik yan ta ula labilmi tir. Ancak bu ilaçlar T315I mutasyonuna etki gösterememektedir. Dasatinib yap lan faz II çal malar n yay nlanmas yla onay alm t r. Bu iki yeni ilaçla çal malar devam etmekte, üçüncü jenerasyon tirozin kinaz inhibitörleri de geli tirilme sürecindedir.
matinib Doz Uygulamas , Takibi Ve Yan t Kriterleri Doz uygulamas yla ilgili konular
Yap lan çal malarda matinibin etkinli i 300 mg/gün alan hastalardaki sonuçlar temelinde saptanm t r; bu hastalarda tam hematolojik yan t (THY) oran %98 olmu tur (44).Bildirilen advers olaylar n ço unlu u hafif-orta iddette olmu tur (1 veya 2. derece). Artan dozla birlikte yan etkilerin ço unun insidans nda art görülmü tür ve 600 1000 mg/gün dozlarda hastalar n yakla k 1/4 ünde derece 3 veya 4 miyelosupresyon (trombositopeni veya nötropeni) gözlenmi tir. Miyelosupresyon doz s n rlay c olmam t r ve doz azalt ld nda veya tedavi geçici olarak kesildi inde ortadan kalkm t r.
Tedaviye Yan t n Takibi
KML tedavisine yan t; hematolojik yan t, sitogenetik yan t ve moleküler yan t (gerçek zamanl kantitatif polimeraz zincir reaksiyonu ile veya alternatif olarak fluoresans in situ hibridizasyon ile saptan r) olarak incelenmektedir (45).
Çal ma ba lang c nda, kemik ili i biyopsisi ve sitogenetik analiz KML tan s n n do rulanmas için zorunludur. Bu de erlendirmeler ile kötü prognostik özellikler (blast hücreleri veya bazofil say s ndaki art veya sitogenetik klonal geli me) ve hastal n KML-kronik faz n ötesine ilerleyip ilerlemedi i, böylece farkl bir tedavi yakla m n n zorunlu olup olmad anla l r. matinibin neredeyse tüm yeni KML kronik faz tan s konan hastalarda THY indükleme yetene i önceki tedavilere göre anlaml bir ilerlemeyi temsil etmektedir. Bu özellik, bu yan t
kriterinin uzun dönemli tedavi etkinli inde prognostik gösterge olarak kullan lmas n k s tlamaktad r.
matinib tedavisi ile tam sitogenetik yan t (TSY) oran n n yüksek olmas da bunun prognostik de erini s n rland rmaktad r; ancak, imatinib tedavisinin 6, 12 ve 18, 24 ay de erlendirmelerinde TSY hala de erlidir.
Hematolojik ve sitogenetik yan t de erlendirmeleri tedavi stratejisinde de i iklik gerektiren, tedaviye yan ts zl n önemli erken prognostik belirteçleri olmaya devam etmektedir. matinib tedavisine yan t için konservatif beklentilerin tedaviye ba land ktan sonraki 3 ay içinde THY, 6 ay içinde sitogenetik yan t lehine kan t ve 12 ay a mayan bir süre içinde majör sitogenetik yan t (MSY) ve tedavinin ikinci y l içinde (18-24 ay) TSY oldu u belirtilmektedir (46).
matinib tedavisinin, klinik olaylar ve rutin takip ile etkinlik kayb , nüks ve/veya hastal k ilerlemesi oldu u anla lana kadar sürdürülece i varsay lmaktad r (47). Çal malarda imatinibi kesen hastalarda, bu hastalar 18 ay süre ile kan tlanm tam moleküler yan t (TMY) (RT-PCR ile BCR-ABL transkriptlerinin saptanamamas ) geli en hastalar olsa bile, nispeten daha h zl KML nüksünün gerçekle ti i gösterilmi tir. Bu hastalarda imatinibe yeniden ba land ktan sonra iyi yan tlar n yeniden gözlenmi olmas nüksün klonal evrim veya mutasyondan çok rezidüel Ph pozitif hücrelerin bir sonucu oldu unu göstermi tir. matinib tedavisi kesildikten sonra kalm olan sessiz bir Ph-pozitif hücre popülasyonunun hastal k reaktivasyonundan sorumlu oldu u dü ünülebilir (48, 49).
Yan t De erlendirme Kriterlerinin Prognostik De eri
Sitogenetik yan t n prognostik de eri ilk kez IFN- tedavisi ile ba lant l olarak anla lm t r (50, 51, 52). IFN- monoterapisi ve kombinasyon tedavisi ile yap lan yay nlanm klinik çal malar gözden geçirildi inde %13 TSY oran saptanm t r. IFN- ile TSY sa lanan hastalarda yap lan bir çal mada tam yan t n 5 y l kal c l k gösterme oran %58; 10 y ll k genel sa kal m oran %75 olmu tur. TSY kal c l ve genel sa kal m n Sokal risk skorlar ile hesaplanan hasta riskine güçlü biçimde ba l oldu u saptanm t r. Yap lan çal malarda imatinibin yüksek sitogenetik yan t oran sa lad gösterilmi tir. matinib ile tedavi edilen tan s yeni konmu KML hastalar nda 60 ayda kümülatif en iyi TSY oran %87 olmu tur (53).
12 ay ve hatta 24 ay imatinib tedavisinden sonra TSY a ula an hastalarda 60 ayda akselere veya blastik faza ilerleme oran %1 bulunmu tur. En son k lavuzlarda MMY tedavinin temel hedefi olarak gösterilmi tir ve kronik faz hastalarda kal c yan t n en yararl belirtecidir. Bu yan t de erlendirme yönteminin duyarl l n n art öngörürücülü ü sa lamaktad r (54).
Hasta örneklerinde BCR-ABL transkripti miktar belirlenmesi için tercih edilen yöntem RT-PCR dir. Yap lan çal malarda hasta örneklerindeki BCR-ABL transkript düzeyleri de erlendirilmi ve imatinib ile tedavi edilen hastalarda IFN- ve ARA-C tedavisi alanlara göre daha yüksek MMY oranlar na (al nan örnek havuzundan türetilen standardize çal ma ba lang c düzeyine göre mRNA transkript düzeylerinde >3 log azalma olmas olarak tan mlanm t r) ula ld saptanm t r (55).
12 ay tedaviden sonra, imatinib alan hastalar n %39 unda BCR-ABL transkriptlerinde 3 log azalma gerçekle irken, bu oran IFN- ve ARA-C alanlarda yaln zca %2 olmu tur. TSY a ula an imatinible tedavi edilen hastalarda zaman içinde BCR-ABL transkript düzeyi dü meyi sürdürmü tür.
matinib piyasaya ç kmadan önce, KML kronik faz hastalar nda prognostik risk de erlendirmesi risk s n fland rmas nda yayg n kullan lan 2 sisteme dayand r lmakta idi: Sokal skoru ve Hasford skoru. Bu sistemlerde hastan n ya , dalak büyüklü ü ve hasta riskini yans tabilecek bir dizi hematolojik de i ken kullan lmaktad r. matinib ile tedavi edilen hastalarda ilerleme riski Sokal riski ile biraz ili ki göstermesine kar n, bu ili ki IFN ile tedavi edilen hastalarla kar la t r ld nda biraz azalm t r (56). Yan t n n preterapötik risk faktörlerinden anlaml derecede daha önemli bir prognostik faktör oldu u öne sürülmü tür. Örne in, Sokal risk skorunun 12 ayl k imatinib tedavisinde sonra TSY sa lanan hastalarda hiçbir prognostik anlam olmad saptanm t r. Hastalar n risk faktörlerinin belirlenmesi hastal k iddetini ve hastan n genel durumunu daha iyi de erlendirmek için ilk tetkiklerde de erli olabilir ancak imatinib tedavisi alan hastalarda art k imatinibe yan t da bünyesinde bar nd ran yeni prognostik modeller gereki i ifade edilmektedir (57).
Tablo 6. Önerilen KML Takip Plan
Parametre Önerilen plan
Hematolojik Çal ma ba lang c nda ve THY a kadar her 2-4 haftada bir, daha sonra her 1-3 ayda bir.
Sitogenetik Çal ma ba lang c nda ve TSY do rulanana kadar her 3-6 ayda; daha sonra her 12-18 ayda bir.
Moleküler TSY ve MMY a kadar her 3 ayda bir; daha sonra her 3-6 ayda bir; RT-PCR de erlerinde art varsa daha s k.
Bireysel Hasta Yan t n n De erlendirilmesi
Hastalar n tedaviye yan t n n en iyi üç s n fa bölünebilece i belirtilmektedir: optimum, suboptimal ve ba ar s zl k. Bu kategoriler hematolojik, sitogenetik ve moleküler tedavi yan tlar n n tedavi ba lat ld ktan sonraki belli takip noktalar nda sa lan p sa lanmad temeline dayanmaktad r (Tablo 8). Hasta planlanan zamandaki optimum yan ta eri emezse klinisyen terapötik stratejiyi yeniden de erlendirmeli ve gerekli ise terapötik stratejiyi uyarlamal d r.
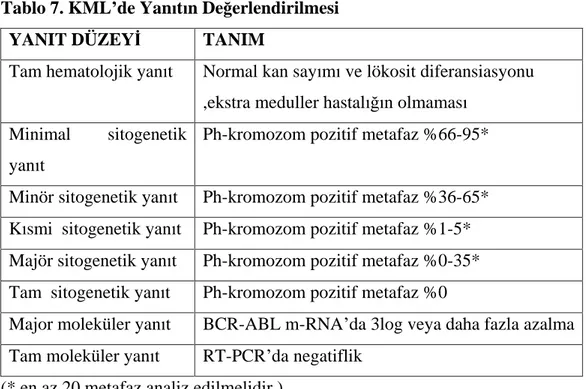
Tablo 7. KML de Yan t n De erlendirilmesi
YANIT DÜZEY TANIM
Tam hematolojik yan t Normal kan say m ve lökosit diferansiasyonu ,ekstra meduller hastal n olmamas
Minimal sitogenetik yan t
Ph-kromozom pozitif metafaz %66-95*
Minör sitogenetik yan t Ph-kromozom pozitif metafaz %36-65* K smi sitogenetik yan t Ph-kromozom pozitif metafaz %1-5* Majör sitogenetik yan t Ph-kromozom pozitif metafaz %0-35* Tam sitogenetik yan t Ph-kromozom pozitif metafaz %0
Major moleküler yan t BCR-ABL m-RNA da 3log veya daha fazla azalma Tam moleküler yan t RT-PCR da negatiflik
(* en az 20 metafaz analiz edilmelidir.)
Terapötik stratejide de i iklik imatinibe sekonder direnç geli mesi durumunda da zorunludur. Bu direnç sonunda daha önce ula lm bir hedef
(örn:THY veya TSY) kaybolabilir ve/veya hastal k ilerlemesi lehine kan t bulunabilir. Bu olaylar n haberi MMY kayb ile al nabilir, ancak MMY n tersine çevrilme kriterleri henüz tan mlanmam t r. Bir çal mada MMY sa lanan hastalarda tek RT-PCR ölçümünün BCR-ABL transkriptlerinde en az 2 kat art a yol açmas n n imatinib direncine yol açan BCR-ABL mutasyonlar n ortaya ç kaca n yüksek duyarl l kla belirteci oldu u bulunmu tur (58).
matinibe Direnç Tan m Ve Geli imi
Sekonder imatinib direncinin nedeni BCR-ABL mutasyonlar d r. matinibe sekonder direncin alt nda yatan primer mekanizma BCR-ABL geninin kinaz alan n kodlayan parças nda nokta mutasyonlar n ortaya ç kmas ile Ph-pozitif hücrelerin geli mesi ve daha sonra klonal yayg nla ma göstermesidir. matinibe BCR-ABL duyarl n etkileyen en az 50 BCR-ABL mutasyonu saptanm t r (59).
Nokta mutasyonlar n n dirence yol açma dereceleri de i ebilir (60). En yüksek derecede in vitro ve klinik direnç derecesi ile ili kili mutantlar Y253H, E255K, F317L ve T315I d r. Tümü de imatinib için moleküler temas yerleri ile ili kilidir. T315I mutant yal zca imatinibe de il ayr ca dasatinib ve nilotinib gibi yeni kinaz inhibitörlerine de mutlak direnç sa lar. T315I mutant n n direncinin üstesinden gelinmesi yeni bir terapötik u ra alan olabilir. matinibe direnç ba lang ç zaman na göre kategorize edilir. Birincil direnç (intrensek) imatinib ile tedavi ba lang c nda etkinlik eksikli i olarak tan mlan rken, ikincil (edinsel) direnç imatinibe maruz kalma sonras ilk yan t takiben etkinlik kayb olarak tan mlan r. Kullan lan klinik ve laboratuar ölçütlere göre direnç, hematolojik, sitogenetik ve moleküler direnç olarak alt guruplara ayr labilir. Ço u çal malarda hematolojik direnç; kronik faz hastada tam hematolojik yan t n olmamas , akut fazdaki hastalar n kronik faza geçmemesi veya blastik krizde ve ALL de k smi yan t olarak tan mlan r (61, 62).
Sitogenetik yan t belli zaman döneminde tedavi hedefi olan sitogenetik yan t düzeylerine göre tan mlan r (Tablo-7). Sitogenetik direnç major sitogenetik yan t ya da tam sitogenetik yan t eksikli i veya kayb d r. Moleküler direnç ise tam moleküler yan t kayb veya eksikli i olarak tan mlan r.
matinibe Kar Geli en Suboptimal Yan t Ve Dirence Yönelik Stratejiler Primer veya sekonder imatinib direnci olan hastalarda yüksek doz imatinibin yan tlar iyile tirme yetene i yeni KML tan s konanlarda tedaviye daha yüksek dozda ba lanmas gerekip gerekmedi i sorusunun sorulmas na neden olmu tur.
Daha önceki çal mada tedaviye dirençli olan ya da nüks gösteren hastalarda daha yüksek imatinib dozlar n n yan t ortaya ç karma yetene i doz art r m n n uygulanabilir bir ikinci basamak alternatif olabilece ini dü ündürmektedir. Yeni KML tan s konan hastalarda yüksek doz imatinibin de eri hala ucu aç k bir sorudur. Öte yandan, bu bulgular imatinibe daha yüksek dozda ba lanmas için kan t olu tursa da yüksek doz imatinibin sa kal m iyile tirip iyile tirmedi i henüz belli de ildir. Yüksek doz çal malar nda doz azaltma oran standart dozdan daha fazla olmu tur ve tedavi maliyeti iki kat na ç km t r. Bu nedenle, daha yüksek doz kullan m tolerabilite, maliyet ve etkinlik aras ndaki bir dengeyi içermektedir
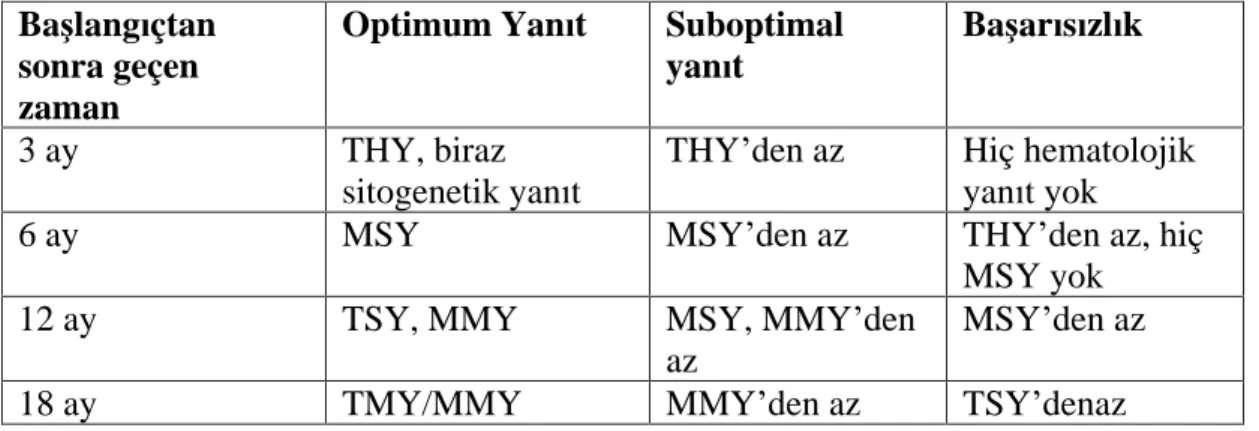
Tablo 8. matinib Tedavisi: Optimum Yan t, Suboptimal Yan t Ve Ba ar s zl k E ik De erleri
Ba lang çtan sonra geçen zaman
Optimum Yan t Suboptimal yan t
Ba ar s zl k
3 ay THY, biraz
sitogenetik yan t
THY den az Hiç hematolojik yan t yok
6 ay MSY MSY den az THY den az, hiç
MSY yok
12 ay TSY, MMY MSY, MMY den
az
MSY den az
18 ay TMY/MMY MMY den az TSY denaz
600 veya 800 mg/gün imatinib makul bir süre denendikten sonra hastalar tedaviye yan t vermez veya nüks gerçekle irse, önde gelen seçenekler AKHN veya yeni tirozin kinaz inhibitörlerinin uygulanmas d r. SRC ve ABL kinazlar n ikili inhibitörü olan dasatinib imatinibe dirençli veya imatinibe tolere edemeyen KML olgular nda kullan lmak üzere onaylanm t r. Preklinik de erlendirmelerde dasatinib imatinibe dirençli 19 BCR-ABL mutant ndan 18 ini eksprese eden hücrelere kar aktivite göstermi tir. Tek istisna T315I mutant n ta yan dizidir.
Faz 1 çal malar ile tutarl olarak, imatinib ba ar s zl ndan sonra akselere ve blastik faz hastalarda dasatinib uygulanan faz 2 çal malarda imatinibe dirençli KML-Blastik faza kar dasatinibin nispeten güçlü aktivite gösterdi i görülmü tür.
Tüm bu çal malar n toplu güvenlik analizi dasatinibin iyi tolere edildi ini göstermi tir. laçla ili kili ciddi yan etkilerin ço u ilaca ara verilmesi veya doz azalt lmas ile tedavi edilmi tir. laca ara verilmesi ve doz azalt lmas n en s k nedeni kemik ili i bask lanmas d r. KML-Kronik faz hastalar n n %50-%60 nda derece 3-4 trombositopeni, nötropeni ve anemi vard r. Hematolojik olmayan yan etkiler genellikle hafif orta iddettedir. Hastalar n %5-30 unda ve ço unlukla ilerlemi KML fazlar nda plevra effüzyonu görülmü tür. Effüzyon hastalar n %4-16 s nda
iddetlidir.
Nilotinib (AMN107), BCR-ABL için oldukça özgül bir protein tirozin kinaz inhibitörüdür ve güncel olarak imatinibe dirençli veya tolere edemeyen KML hastalar için geli tirilmektedir. Preklinik de erlendirmelerde nilotinib BCR-ABL otofosforilasyonunu inhibe etmek konusunda imatinibden anlaml derecede daha güçlü bulunmu tur. Nilotinib ayr ca imatinibe dirençli 33 BCR-ABL mutant ndan 32 sini eksperse eden hücrelerin büyüme ve proliferasyonunu inhibe etmi tir. Dasatinibde oldu u gibi BCR-ABL T315I mutantlar nilotinibe de dirençlidir. Nilotinib-ABL kinaz kompleksinin kristalografisi imatinib ile kar la t r ld nda nilotinibin gücünün daha fazla olmas n n nedeninin nilotinib ve kinaz ba lama bölgesi aras nda daha iyi uyum olmas oldu unu göstermi tir ve ayr ca özgül amino asit rezidüleri ile etkile imlerde de farkl l k vard r. Farelerde KML ksenograftlar ile yap lan in vivo deneylerde plasebo ile kar la t r lan nilotinib tedavisinin vah i tür BCR-ABL veya imatinibe dirençli BCR-ABL mutant (E255V) infüzyonu uygulanan farelerde sa kal m art rd gösterilmi tir (63).
Preklinik sonuçlar SKI-606 ve INNO-406 (daha önce NS-187) adl 2 yeni kinaz inhibitörü için de bildirilmi tir. SKI-606, SRC ve ABL kinazlar n ikili inhibitörüdür (64).
BCR-ABL aktivitesini inhibe etmeye ek olarak, SKI-606, SRC kinazlara (LYN ve HCK) kar da anlaml aktivite göstermi tir. Fare ksenograft deneylerinde, SKI-606 tedavisi KML tümörlerinin tam ve kal c gerilemesine yol açm t r. INNO-406 da ABL ve LYN tirozin kinazlar n ikili inhibitörüdür ve BCR-ABL kinazlar n
13 mutant ndan 12 sine kar in vitro aktivite göstermi tir (65).
Bugüne kadar incelenen di er kinazlarda oldu u gibi T315I mutant dirençli kalm t r. INNO-406 da imatinibe oldukça dirençli E255K mutant n eksprese eden hücre dizisinin büyümesini inhibe etmi tir ve KML hücrelerinin fare ksenograftlar dan ve E255K mutant n bar nd ran bir di er deneysel tümör modelinde in vivo aktivite göstermi tir.
BCR-ABL mutant T315I bu güne kadar klinik geli tirme a amas ndaki tüm kinaz inhibitörlerine direnç göstermi tir. Bir Aurora kinaz inhibitörü, MK0457 (daha önce VX-680), ve bir di er ABL kinaz mutant , H396P aras ndaki etkile imi analiz eden deneyler sonucunda T315I in arac l k etti i direnci önleyici potansiyel bir yakla m önerilmi tir. MK0457 yap sal olarak KML de de erlendirilmekte olan di er kinaz inhibitörlerinden yap sal olarak farkl d r. lk deneylerde, VX-680 hem izole T315I mutant ABL ye kar hem de bu mutant eksprese eden hücrelerin proliferasyonuna kar aktivite göstermi tir (66).
ON012380 ve BIRB796 dahil kinaz alan n n ATP-ba lay c k sm ndan ba ka bölgelerini hedefleyen di er bile ikler de T315I BCR-ABL kar aktivite göstermi tir.
SCT sonras nda lösemiye kar greft etkisinin gözlenmi olmas KML yi hedef alan immünoterapinin ara t rmaya de er bir yakla m oldu unu dü ündürmektedir. BCR-ABL füzyon proteini özgün bir tümöre özgül antijen oldu u için, BCR-ABL kav ak noktas temelli peptidler kullan larak a yap lmas yararl olabilir. Bu yarar özellikle imatinibe yan tta maksimum düzeye ula ld nda rezidüel hastal k düzeylerinin azalt lmas na yard mc olma eklinde ortaya ç kabilir (67).
BCR-ABL füzyon bölgesinden türetilen peptidler kullan larak uygulanan a ile ilgili k sa süre önce yap lan iki klinik çal mada hastalar n bu peptidlere kar i levsel bir ba kl k yan t geli tirdikleri görülmü tür (68, 69).
Allojeneik Hematopoietik Kök Hücre Nakli (AHKHN)
KML nin bilinen tek küratif tedavisi olarak otuz y ll k bir geçmi e sahiptir (70). Otolog nakil çok az say da yap lmaktad r. Doksanl y llarda, AHKHN nin en
s k endikasyonu KML olmakla birlikte, imatinib yan tlar n n görülmesinin ard ndan KML tan l transplantasyon say lar azalm t r (71).
matinib kolay tolere edilip ilk 5 y lda yüksek olas l kl yan t ve sa kal m vaat etmekte, fakat en yüksek ve sürekli moleküler yan tlar transplantasyonla elde edilmektedir. Buna kar l k transplantasyonun erken dönem morbidite ve mortalitesi tedavi seçiminde dezavantaj olarak ele al nmaktad r.
Transplantasyonun sonucuna etkili faktörler aras nda hasta ve hastal a ba l , transplantasyon tipine ve donöre ba l faktörler incelenmi ; hasta ya , hastal k evresi, tan -transplantasyon aras nda geçen süre, donör-hasta HLA uyumu ile akrabal k ve cinsiyet uyumu gibi faktörler önemli bulunmu ve Gratwohl (EBMT) risk skoru olarak adland r lan bir skorlama ile herhangi bir transplantasyon aday n n transplantasyondan sonraki ya am veya nüks olas l n n hesaplanabilece i gösterilmi tir (72).
Bu skorlama daha sonra ba ka çal ma gruplar nca da denenmi ve do rulu u desteklenmi tir (73). Son y llarda di er endikasyonlarla yap lan transplantasyonlarda oldu u gibi KML li olgularda da periferik kök hücre (PKH) nakilleri tercih edilmektedir. PKH nakilleri kemik ili i nakline göre daha fazla kronik graft versus host hastal ve daha dü ük nüks nedeni olabilmektedir (74).
KML tan l transplantasyonlarda seçilecek haz rl k rejimlerinden busulfan/siklofosfamid ile siklofosfamid/tüm beden nlamas aras nda sonuçlar aç s ndan fark olmad belirtilmektedir (75). Akraba olmayan donörlerden yap lan nakiller son y llarda giderek artmaktad r. Y llar öncesine k yasla mortalite riski azalm ve uzun süreli ya am ans artm t r. EBMT verilerine göre 1980-1990 döneminde KML tan l toplam 2628 nakilden 186 s , 2000-2003 y llar ndaki 3018 nakilden ise 1096 s akraba olmayan donörlerden yap lm t r. Bu iki dönemde yap lan nakillerde 2 y ll k toplam ya am olas l ise %28 den % 53 e ç km t r
(71). Seattle verilerine göre ise özellikle 50 ya ve alt ndaki grupta HLA(DRB1) uyumlu akraba d nakillerin tan dan sonraki ilk y l içinde yap lmalar durumunda be y ll k ya am ans %74 e ç kmaktad r. Ayn serinin 21 ya alt ndaki olgular nda 5 y ll k ya am olas l %80 civar nda gözlenmekte fakat sadece 50 ya s n r istatistiksel anlaml l kta farklar ortaya koymaktad r (76).