T.C.
SELÇUK ÜNĠVERSĠTESĠ FEN BĠLĠMLERĠ ENSTĠTÜSÜ
ZYGOPHYLLUM FABAGO L.’NUN LĠPĠD PEROKSĠDASYON, ANTĠOKSĠDAN ENZĠMLER VE PROLĠN ĠÇERĠĞĠ ÜZERĠNE
TUZ STRESĠNĠN ETKĠLERĠ Zeynep ÜLKÜ
DOKTORA TEZĠ
Biyoloji Bölümü Botanik Anabilim Dalı
Kasım - 2014 KONYA Her Hakkı Saklıdır
TEZ BĠLDĠRĠMĠ
Bu tezdeki bütün bilgilerin etik davranış ve akademik kurallar çerçevesinde elde edildiğini ve tez yazım kurallarına uygun olarak hazırlanan bu çalışmada bana ait olmayan her türlü ifade ve bilginin kaynağına eksiksiz atıf yapıldığını bildiririm.
DECLARATION PAGE
I hereby declare that all information in this document has been obtained and presented in accordance with academic rules and ethical conduct. I also declare that, as required by these rules and conduct, I have fully cited and referenced all material and results that are not original to this work.
Zeynep ÜLKÜ
iv ÖZET
DOKTORA TEZĠ
ZYGOPHYLLUM FABAGO L.’NUN LĠPĠD PEROKSĠDASYON, ANTĠOKSĠDAN ENZĠMLER VE PROLĠN ĠÇERĠĞĠ ÜZERĠNE TUZ STRESĠNĠN ETKĠLERĠ
Zeynep ÜLKÜ
Selçuk Üniversitesi Fen Bilimleri Enstitüsü Biyoloji Bölümü Botanik Anabilim Dalı DanıĢman: Prof. Dr. Mustafa KÜÇÜKÖDÜK
2014, 102 Sayfa Jüri
Prof.Dr. Mustafa KÜÇÜKÖDÜK Prof.Dr. Hüseyin DURAL
Prof.Dr. Yavuz BAĞCI Prof.Dr. Muhittin DĠNÇ Doç.Dr. E. EĢref HAKKI
Tuz stresi bitkilerin gelişimini, verimini ve dağılımını sınırlandıran en önemli abiyotik stres faktörlerinden birisidir. Bu çalışmada, tuzluluğun Zygophyllum fabago L.‘nun fizyolojik ve biyokimyasal özellikleri üzerine etkileri araştırılmıştır. Büyüme parametreleri, yaprak nisbi su içerikleri (NSİ), fotosentetik verimleri, iyon konsantrasyonları, lipid peroksidasyon seviyeleri, hidroksil (OH•) radikali süpürülme aktiviteleri, prolin içerikleri ve antioksidan sistem [süperoksit dismutaz (SOD), askorbat peroksidaz (APX), katalaz (CAT), glutasyon redüktaz (GR) ve peroksidaz (POX)] araştırılmıştır. 50 günlük Z. fabago fideleri 7 ve 14 gün süresince 0, 150 ve 300 mM NaCl‘ye maruz bırakılmıştır. Tuza toleranslı Z. fabago‘nun 7 gün 150 mM‘lık tuza maruz kalan fidelerinin büyüme parametreleri genellikle kontrole göre önemli bir değişim göstermemiştir. Kısa süreli (7 gün) tuz uygulamalarında fidelerin RWC oranı değişmemiş, RGR ise sadece 300 mM NaCl‘de azalmıştır. Uzun süreli (14 gün) tuz uygulamaları ise hem RWC hem de RGR‘yi önemli ölçüde azaltmıştır. Tüm deneme süresince yaprakların fotosentetik verimleri değişmemiştir. Yaprakların ozmotik potansiyelleri 7 gün 150 mM NaCl uygulanan grup hariç diğer tüm gruplarda azalmıştır. Tuzluluğun artan konsantrasyonu ve uygulanma süresi, Na+ ve Cl -içeriklerini önemli derecede artırmıştır. Yaprakların lipid peroksidasyon seviyeleri 7 gün 150 mM NaCl uygulanan grup hariç diğer tüm tuz uygulamalarında kontrole göre artmıştır. Tuz stresi altındaki fidelerin prolin içerikleri tüm deneme süresince artmıştır. SOD aktiviteleri ilk örnekleme zamanında genellikle artmış, deneme sonunda ise azalmıştır. CAT, POX, APX ve GR aktiviteleri tuz stresine bağlı olarak önemli oranda artış göstermiştir. Elde edilen bu sonuçlarla Z. fabago‘nun tuz toleransında SOD, CAT, POX, APX ve GR enzimlerinin aktiviteleri, tuzla (150 ve 300 mM NaCl) indüklenmiş oksidatif stresle meydana gelen radikallerin süpürülmesinde etkin bir şekilde görev aldığı söylenebilir.
v ABSTRACT
Ph.D THESIS
THE EFFECT OF SALT STRESS ON LĠPĠD PEROXĠDATĠON, ANTĠOXĠDATĠVE ENZYMES AND PROLĠNE CONTENT OF
ZYGOPHYLLUM FABAGO L. Zeynep ÜLKÜ
THE GRADUATE SCHOOL OF NATURAL AND APPLIED SCIENCE OF SELÇUK UNIVERSITY
THE DEGREE OF DOCTOR OF PHILOSOPHY IN BOTANY
Advisor: Prof. Dr. Mustafa KÜÇÜKÖDÜK 2014, 102 Pages
Jury
Prof.Dr. Mustafa KÜÇÜKÖDÜK Prof.Dr. Hüseyin DURAL
Prof.Dr. Yavuz BAĞCI Prof.Dr. Muhittin DĠNÇ Assoc.Prof.Dr. E. EĢref HAKKI
The salt stress is the one of major abiotic stress factor which impress growth, yield and distribution of plants. In this study the effects of salt stress were studied on physiological and biochemical characteristics of Zygophyllum fabago L. Physiological parameters, leaf relative water content (RWC), photosynthetic efficiencies, ion concentrations, lipid peroksidation levels, hydroxyl (OH•) radical scavenging activities, proline contents and antioksidant sysyems [superoxide dismutase (SOD), catalase (CAT), peroxidase (POX), ascorbate peroxidase (APX) and glutathione reductase (GR)] were investigated. . The 50 days old Z. fabago seedlings were subjected to 0, 150 and 300 mM NaCl for 7 and 14 days.When physiological parameters of salt tolerant Z. fabago seedlings under salt stress at 150 mM NaCl were compared with control group, significant changes have not been observed for 7 days generally. RWC rates of seedlings didn‘t change in short term (7 d) salt treatments, RGR decreased only 300 mM NaCl. However long term (14 d) salt treatments decreased even RWC and RGR significantly. Chlorophyll fluorescences unchanged during all treatments. Osmotic potentials of leaves decreased in all groups under salt stress except 7 day 150 mM NaCl. Na+ and Cl- contents increased significantly in a concentration/time-dependent manner. Lipid peroksidation of leaves increased under all salt treatments when compared with controls except 7 day 150 mM NaCl. Proline contents of seedlings increased under salt stress during all study. While SOD enzyme activities generally increased at first sampling day, decreased at second day of study. CAT, POX, APX and GR enzyme activities increased significantly depending on salt stress. With these results we can suggest that activities of SOD, CAT, POX, APX and GR enzymes take an impressive role on radicals scavenging produced by salt induced oxidative stress (150 and 300 mM) on salt tolerance of Z. fabago.
vi ÖNSÖZ
Doktora tez çalışmam süresince her zaman yanımda olan, tez konumun belirlenmesinden tezimin bitimine kadar benden hiçbir yardımı ve desteği esirgemeyen, bilgi ve tecrübeleriyle bana yol gösteren danışman hocam sayın Prof.Dr. Mustafa Küçüködük‘e; tez denemelerinin dizaynı, kurulması ve yürütülmesinde tecrübelerini benden esirgemeyen, bilgi ve tecrübelerini benimle paylaşan sayın hocam Dr. Evren Yıldıztugay‘a, tez izleme komitemde yer alan ve çalışmam süresince beni yönlendiren sayın hocalarım Prof.Dr. Hüseyin Dural ve Doç.Dr. E. Eşref Hakkı‘ya içtenlikle teşekkürlerimi sunarım. Laboratuar çalışmalarım süresince yardımlarını esirgemeyen Yağmur Duran, Betül Kara ve emeği geçen herkese teşekkür ederim.
Bana her zaman destek olan aileme, tez çalışmam süresince bana sabır ve anlayış gösteren, varlığı bana en büyük yaşam kaynağı olan sevgili kızım Elifsena‘ya en içten teşekkürlerimi sunarım.
Bu çalışmanın gerçekleştirilmesinde maddi destek sağlayan S.Ü. Bilimsel Araştırmalar Koordinatörlüğü‘ne (BAP-11201099) katkılarından dolayı teşekkür ederim.
.
Zeynep ÜLKÜ KONYA-2014
vii ĠÇĠNDEKĠLER ÖZET ... iv ABSTRACT ... v ÖNSÖZ ... vi ĠÇĠNDEKĠLER ... vii SĠMGELER VE KISALTMALAR ... ix 1. GĠRĠġ ... 1 2. KAYNAK ARAġTIRMASI ... 7 2.1. Tuz Stresi ... 7 2.1.1. Toprak tuzluluğu ... 7
2.1.2. Bitkiler tarafından sodyum ve klorürün alınımı, taşınımı ve birikimi ... 7
2.1.3. Tuzluluğun bitkiler üzerine etkileri ... 9
2.2. Bitkilerin Tuz Stresine Karşı Savunma Sistemleri ... 11
2.2.1. Tuz stresi altında hücrelerdeki ozmotik dengenin sağlanmasına yönelik mekanizmalar ... 12
2.2.2. Reaktif oksijen türleri ... 12
2.2.3. Reaktif oksijen türlerinin (ROS) üretim yerleri ... 14
2.2.4. Reaktif oksijen türlerine karşı savunma mekanizmaları ... 16
2.3. Tuz Stresi ile İlgili Literatür Araştırması ... 21
3. MATERYAL VE YÖNTEM ... 36
3.1. Bitki Materyalinin Genel Özellikleri ... 36
3.1.1. Zygophyllum fabago L. ... 36
3.2. Bitki Materyalinin Yetiştirilmesi ... 38
3.2.1. Tohum ekimi ... 38
3.3. Analiz Yöntemleri ... 40
3.3.1. Büyüme parametreleri ... 40
3.3.2. İyon konsantrasyonlarının belirlenmesi ... 41
3.3.3. Protein içeriklerinin belirlenmesi ... 41
3.3.4. Lipid peroksidasyon seviyelerinin belirlenmesi ... 42
3.3.5. Prolin miktarının belirlenmesi ... 42
3.4. Antioksidan Enzim Aktivitelerinin Belirlenmesi ... 42
3.4.1. Enzim ekstraktlarının hazırlanması ... 42
3.4.2. Süperoksit dismutaz (SOD; EC 1.15.1.1) aktivitesinin belirlenmesi ... 43
3.4.3. Katalaz (CAT; EC 1.11.1.6) aktivitesinin belirlenmesi ... 43
3.4.4. Peroksidaz (POX; EC 1.11.1.7) aktivitesinin belirlenmesi ... 43
3.4.5. Askorbat peroksidaz (APX; EC 1.11.1.11) aktivitesinin belirlenmesi ... 44
3.4.6. Glutasyon redüktaz (GR; EC 1.6.4.2) aktivitesinin belirlenmesi ... 44
3.5. İzozimlerin elektroforetik ayrımı ... 44
3.5.1. Süperoksit dismutaz (SOD) izozimlerinin elektroforetik ayrımı ... 45
viii
3.5.3. Peroksidaz (POX) izozimlerinin elektroforetik ayrımı ... 45
3.5.4. Askorbat peroksidaz (APX) izozimlerinin elektroforetik ayrımı ... 45
3.6. İstatistiksel Analizler ... 46
4. ARAġTIRMA SONUÇLARI VE TARTIġMA ... 47
4.1. Büyüme Parametreleri ... 47
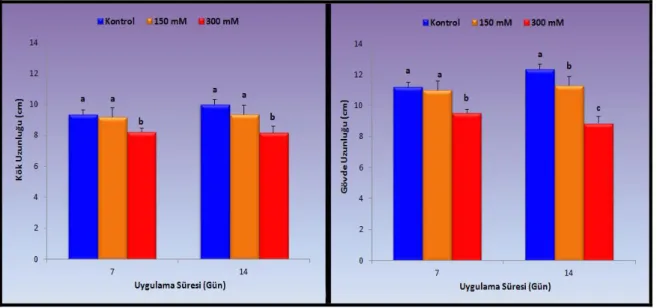
4.1.1. Kök ve gövde uzunlukları ... 47
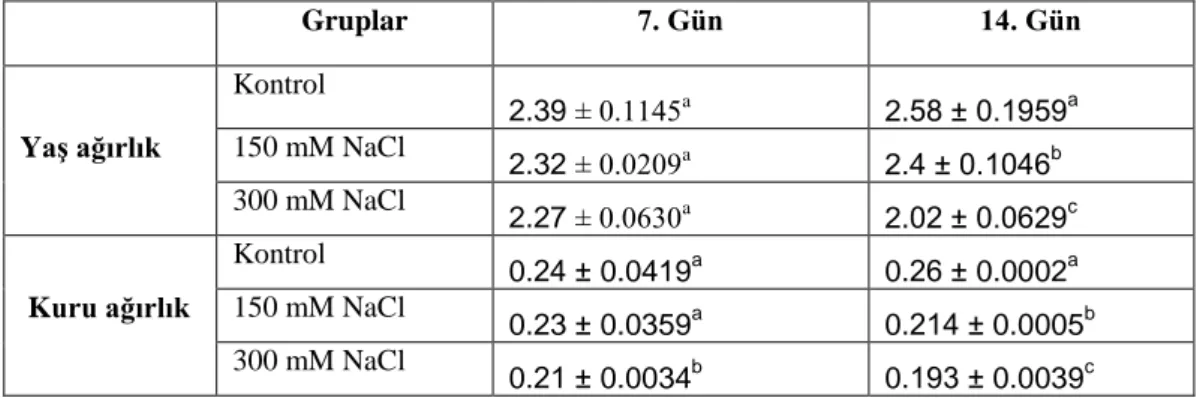
4.1.2. Kök yaş ve kuru ağırlıkları ... 49
4.1.3. Sürgün yaş ve kuru ağırlıkları ... 51
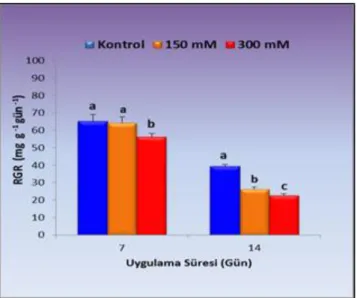
4.1.4. Sürgün bağıl büyüme oranı (RGR) ... 53
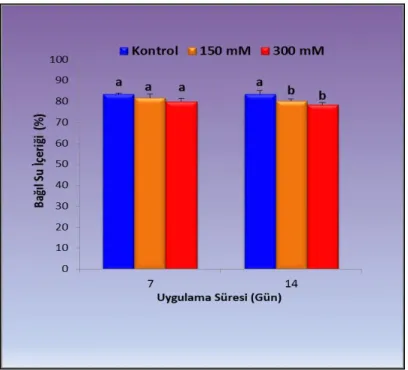
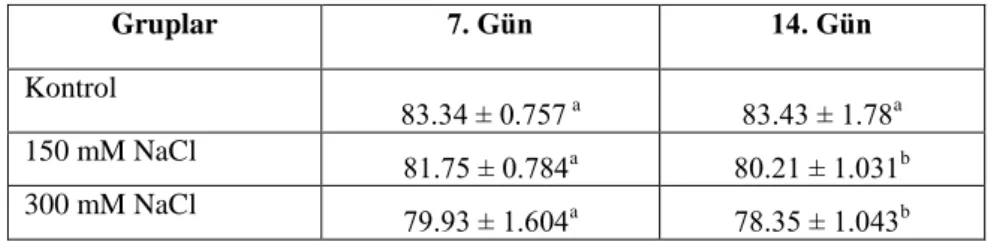
4.1.5. Yaprakların bağıl su içerikleri (RWC) ... 54
4.1.6. Yapraklardaki klorofil flüoresans ölçümleri ... 56
4.1.7. Ozmotik potansiyellerde meydana gelen değişimler ... 57
4.2. İyon İçeriklerinde Meydana Gelen Değişimler ... 58
4.3. Lipid Peroksidasyon Seviyelerinde Meydana Gelen Değişimler ... 61
4.4. Prolin İçeriklerinde Meydana Gelen Değişimler ... 63
4.5. Hidroksil (OH•) Radikali Süpürülme Aktiviteleri ... 64
4.6. Antioksidan Enzim Aktivite Sonuçları ... 65
4.6.1. Süperoksit dismutaz (SOD) aktivite sonuçları ... 65
4.6.2. Katalaz (CAT) aktivite sonuçları ... 68
4.6.3. Peroksidaz (POX) aktivite sonuçları ... 71
4.6.4. Askorbat peroksidaz (APX) aktivite sonuçları ... 74
4.6.7. Glutasyon redüktaz (GR) aktivite sonuçları ... 76
5. SONUÇLAR VE ÖNERĠLER ... 78
5.1 Sonuçlar ... 78
5.2 Öneriler ... 79
KAYNAKLAR ... 80
ix SĠMGELER VE KISALTMALAR Simgeler g Gram mg Miligram ml Mililitre μg Mikrogram μmol Mikromolar mM Milimolar % Yüzde Na Sodyum Cl Klor K Potasyum Zn Çinko kg Kilogram Fe Demir Cu Bakır Mn Mangan B Bor O2 Oksijen OH Hidroksit H2O2 Hidrojen peroksit KCN Potasyum siyanür Kısaltmalar CAT Katalaz GR Glutasyon redüktaz APX Askorbat peroksidaz MDA Malondialdehit SOD Süperoksit dismütaz POX Peroksidaz
K.A. Kuru ağırlık T.A. Taze ağırlık Y.A. Yaş ağırlık
TBA Tiobarbütirik asit TCA Trikloroasetik asit ROS Reaktif oksijen türleri NBT Nitro blue tetrazolim
1. GĠRĠġ
Bitkiler yaşamları boyunca, gelişimlerini kısıtlayıcı çeşitli olumsuz koşullara maruz kalmaktadırlar. Bitkilerde büyüme, gelişme ve metabolizmayı olumsuz yönde etkileyen bu durumlara stres adı verilmektedir (Gürel ve Avcıoğlu, 2001). Stres, önemli fizyolojik ve metabolik değişimlere yol açarak bitkilerde büyüme ve gelişmeyi olumsuz şekilde etkilerken, üründe nitelik ve nicelik kaybına (ürün kalitesinin ve miktarının azalmasına), bitkinin veya organlarının ölümüne yol açabilmektedir. Stres faktörleri, bitkiler üzerine etkilerini çoğunlukla, eş zamanlı ve kombine şekilde göstermektedirler (Kalefetoğlu ve Ekmekçi, 2005).
Stres faktörleri, orijinlerine göre abiyotik ve biyotik stres faktörleri olmak üzere iki grupta incelenebilmektedir. Abiyotik stres faktörleri soğuk, sıcak, kuraklık, tuzluluk, su fazlalığı, radyasyon, çeşitli kimyasallar, oksidatif stres, rüzgar ve toprakta besin yetersizliği gibi çevresel faktörlerdir. Biyotik stres faktörleri ise virüs, bakteri ve fungusları içeren patojenler, böcekler ve herbivorlardır (Mahajan ve Tuteja, 2005; Yılmaz ve ark., 2011).
Kurak ve yarı kurak bölgelerde bitkisel üretimi sınırlandıran en önemli abiyotik stres faktörlerinden birisi de tuz stresidir. Tuzluluk; özellikle kurak ve yarı kurak iklim bölgelerinde yıkanarak yeraltı suyuna karışan çözünebilir tuzların, yüksek taban suyuyla birlikte kapilarite yoluyla toprak yüzeyine çıkması ve buharlaşma sonucu suyun uçmasıyla toprak yüzeyinde birikmesi olayıdır.
Tuz stresi; değişik tuzların toprak ya da suda bitkinin büyümesini engelleyebilecek konsantrasyonlarda bulunması olarak tanımlanır ve geniş alanların tarım dışı kalmasına neden olur. Bu tuzlar genelde klorürler, sülfatlar, karbonatlar, bikarbonatlar ve boratlardır. Ancak doğada en çok rastlanılan tuz formu sodyum klorür (NaCl)‘dür. Bitkiler tuz stresinden iki şekilde etkilenmektedirler:
1- Ozmotik etki: Topraktaki tuz miktarının artışı ozmotik basıncı artırdığı ve su potansiyelini düşürdüğü için köklerin su alımını engelleyerek bir çeşit kuraklık stresine sebep olur. Dolayısıyla bu çeşit tuz stresi gerek belirtileri gerekse sonuçları itibariyle bir kuraklık stresidir.
2- Toksik etki: Tuz iyonlarının yüksek konsantrasyonlarda olması halinde bitkide toksik etkiler görülür. Özellikle sodyum iyonları bitkiye fazla alındığında halofit olmayan bitkilerde toksik etkiler oluşur. Mitoz bölünmenin engellenmesi, bazı
enzimlerin inaktivasyonu gibi toksik etkiler meydana gelir. Bu etkiler bitki gelişimi ve büyümesini önemli derecede sınırlandırır (Kocaçalışkan, 2003).
Ghassemi ve ark. (1995), dünyadaki sulanabilir alanların %20‘sinin tuzluluk sorunu ile karşı karşıya olduğunu belirtmiştir. Lopez ve Satti (1996), dünya yüzeyinde 1400 milyon km3 su bulunduğunu, bunun % 97.4‘ünün tuzlu su olduğunu ve 237 milyon hektarlık sulanabilir alanın 30 milyon hektarlık bölümünün tuzdan zarar gördüğünü belirtmişlerdir. Bu durumda tuzluluğun giderek yaygınlaşan ciddi bir stres faktörü olduğu görülmektedir.
Kuraklık ve tuzluluk dünyada tarımsal üretimi sınırlandıran en önemli abiyotik stres sorunları olarak karşımıza çıkmaktadır. Dünya tarım alanlarının yaklaşık olarak % 45‘i sürekli olarak kuraklık stresine maruz kalırken, dünya yüzeyinde bulunan alanların yaklaşık % 6‘sı tuzluluk sorunu ile karşı karşıyadır (Asraf ve Foolad, 2007). Tuzluluğun artışına bağlı olarak sürdürülebilir tarım alanlarının önümüzdeki 25 yıl içerisinde % 30‘unun, 21. yüzyılın ortalarında ise % 50‘sinin tahrip olabileceği bildirilmektedir (Munns, 2002; Bonilla ve ark., 2004; Ahmadi ve ark., 2009). Debauba ve ark. (2006), iklimsel değişikliklerin beraberinde getirdiği kalitesiz ve kontrolsüz su kullanımı nedeniyle, 1.5 milyar ha tarım alanının yaklaşık olarak % 5‘inin (77 milyon ha) tuzluluktan etkilendiğini ayrıca bu alanların dünya yiyecek ihtiyacının üçte birini karşıladığını belirtmektedirler. Ülkemiz topraklarının 1.5 milyon ha‘ı tuzluluk problemi ile karşı karşıyadır. Bu alanların % 60‘ı tuzlu, % 19.6‘sı orta derecede tuzlu, % 0.4‘ü orta derecede alkali, % 12‘si hafif tuzlu-alkali, % 8‘i ise orta derecede tuzlu-alkali olarak sınıflandırılmaktadır (Anonymous, 2008).
Kurak ve yarı kurak bölgelerde yetersiz yağıştan dolayı çözünebilir tuzlar derinlere taşınamamakta, özellikle sıcak ve yağışsız olan dönemlerde, tuzlu taban suları kılcal yükselme ile toprak yüzeyine kadar ulaşabilmektedir. Evaporasyonun yüksek oluşu nedeni ile sular toprak yüzeyinden kaybolurken beraberinde taşıdıkları tuzları toprak yüzeyinde veya yüzeye yakın kısımlarda bırakmaktadır. Diğer bir deyişle, bu bölgelerdeki tuzluluğun temel nedeni yağışların yetersiz, buna karşılık evaporasyonun yüksek olmasıdır (Saruhan ve ark., 2008).
Bitki köklerinin çevresinde bulunan suyun bir kısmı bitki tarafından kullanılırken bir kısmı da toprak yüzeyinden buharlaşarak veya derine sızarak kaybolmaktadır. Yıkama yapılmıyorsa tuzların küçük bir kısmı topraktan uzaklaşır, kalan kısmı ise zamanla bitki kök bölgesinde birikir. Ülkemizin kurak ve yarı kurak bölgelerinde drenaj koşullarının iyi olmadığı topraklarda sulama suları ile gelen tuzlar,
yağışlar ve sulama suları ile yeterli bir yıkama sağlanamadığı durumlarda, zamanla toprakların aşırı tuzlanmasına neden olmaktadır (Uygan ve ark., 2006).
Toprakta bulunan çözünebilir tuzların miktarı, bitkinin büyüme ve gelişmesi için gerekli olan miktarın üzerine çıktığında sorunlar ortaya çıkmaya başlar. Toprakta tuz içeriği arttıkça bitkinin su alımı kısıtlanır. Tuz konsantrasyonu, kullanılabilir su potansiyelini düşürmeye yetecek kadar olduğunda (0.5-1.0 bar) bitki strese girer (Levitt, 1980).
Tuzlu ortamda yetişen bir bitki için büyümeyi sınırlandırıcı faktörleri ise üç grupta toplamak mümkündür. Bunlar: a: su stresi, b: aşırı Na+
ve Cl- alımı ile ilişkili iyon toksisitesi, c: besin maddelerinin alınımı toprak üstü kısımlara taşınmasında stres nedeniyle oluşan dengesizlikler ve özellikle K+ ve kısmen Ca+2 eksikliklerinin ortaya çıkması şeklinde özetlenebilir (Marschner, 1995).
Toprak çözeltisindeki aşırı miktarda bulunan çözülebilir tuzlar, bitkilerin sudan yararlanabilirliliğini azaltmaktadır. Böyle durumlarda yaygın bir yanıt olan su potansiyelindeki azalma, turgor potansiyelinin devamı için çözünen madde içeriğinin arttırılması sonucu ozmotik potansiyeldeki artış ile dengelenebilmektedir. Tuzluluk artışı, bitkilerin su potansiyelini olumsuz yönde etkilemektedir (Mugdal ve ark., 2010). Köklenme bölgesindeki çözünmüş maddelerin sahip olduğu yüksek ozmotik potansiyel, toprağın su potansiyelini düşürmekte ve dolayısıyla bitkilerin genel su durumları etkilenmektedir. Topraktaki su kaybı ile bitki topraktan çok az su alabilmektedir ve bu nedenle su potansiyeli daha da düşmektedir (Bressan, 2008).
Stres şartları altında ozmotik dengenin sağlanması ve hücresel yapıların korunmasında ozmolitlerin rolü büyüktür. Bitkilerde bulunan düşük molekül ağırlıklı şekerler, organik asitler, polioller, çözünebilir proteinler (LEA proteinleri, dehidrin) ve azot içeren bileşikler başlıca ozmolitlerdir (Ashraf, 2004; Munns, 2005). Ozmolitlerin ana fonksiyonu, turgorun devamını sağlayarak dehidrasyona uğramış hücrelerde bulunan makromolekülleri korumaktır (Smirnoff, 1998). Ozmolitler, iki mekanizma ile fonksiyonlarını gerçekleştirirler. Bunlar; ozmotik dengelemede suyun hücrede tutulmasını, Na+‘un apoplastta veya vakuolde birikimini sağlamak ve hücresel yapılar
ile makromoleküllerin yapılarını stabilize etmektir (Parida ve Das, 2005).
Farklı bitki türlerinde tuzlulukla teşvik edilmiş çok sayıda protein belirlenmiştir. Bu proteinler, tuzluluk stresi şartlarında ozmotik düzenlemeye olanak sağlamaktadırlar. Ozmolitler içerisinde en fazla çalışılan prolin, kullanılabilir azot birikimini düzenler,
membran stabilitesini devam ettirir ve hücre membranının bozulmasını engellemektedir (Ashraf ve Haris, 2004).
Abiyotik stres faktörlerinin ilk işareti, spesifik membranların hasar görmesidir (Holmberg ve Bülow, 1998). Tuz uygulamasının plazma membranında bozulmalara ve kıvrılmalara neden olduğu; hücrelerin sitoplazmalarında membrana bağlı keseciklerin gözlendiği ifade edilmiştir (Gupta, 2007). Tuzdan ilk etkilenen kısım olan plazma membranı geçirgenliği, farklı genotiplere ait hücrelerde farklılık göstermektedir. Tuzluluk şartlarında, hücre zarı hasarının tuza duyarlı formlarda daha fazla olduğu tespit edilmiştir (Mansour ve Salama, 2004).
Hücre membranı üzerine serbest oksijen radikallerinin etkisi, lipid peroksidasyonu ile olmaktadır. Oksidantlar, çoklu doymamış yağ asitleriyle reaksiyona girerek lipid peroksidasyonu başlatırlar. Hücre membranının tahribatına yol açan lipid peroksidasyonu, birkaç reaksiyon basamağı sonucunda malondialdehit (MDA) ürününü üretmektedir. Oluşan MDA, hücre membranlarından iyon alışverişine etki ederek membrandaki bileşiklerin çapraz bağlanmasına yol açar ve iyon geçirgenliğinin ve enzim aktivitesinin değişimi gibi olumsuz sonuçlara neden olur (Niki, 1987). Tuza toleranslı genotiplerin, duyarlı genotiplere nazaran daha az miktarda ürettikleri MDA, doku ve iyon sızıntısını da beraberinde getirmektedir (Koyro, 2006).
Fotosentetik dokularda tuzluluğun artışı, bitişik grana membranlarında yığılmaya, tilakoidlerin büzülmesine ve klorofillerin parçalanmasına sebep olmaktadır. Tuzluluk, bitkilerde net fotosentez oranını, transpirasyon oranını ve stoma iletkenliğini azaltmakta, stoma direncini ise arttırmaktadır (Ashraf, 2004).
Tilakoidlerin pigment-protein analizleri, yüksek NaCl‘ün Fotosistem I (PS I) ve Fotosistem II (PS II) reaksiyon merkezlerini önemli derecede etkilediğini göstermiştir. Tilakoidlerdeki elektron taşıma sisteminin aktivitesi yüksek tuzlulukta azalmaktadır. Düşük tuzluluk klorofil içeriğini arttırırken yüksek tuzluluk klorofillerin moleküler yapısını bozmakta ve miktarını azaltmaktadır. Klorofil içeriğindeki azalma, klorofil sentezinin azalmasından ya da klorofil pigmentlerinin parçalanmasının artmasından kaynaklanabilmektedir. Özellikle klorofil parçalanması, klorofilaz enzim aktivitesindeki artış sonucunda ortaya çıkmaktadır (Yıldız ve ark., 2010).
Tuz stresi oldukça kompleks olup pek çok metabolik aktiviteyi etkilemektedir. Ozmotik etkiler sonucunda su eksikliği oluşmakta ve bitkiler su kaybını azaltmak için stomalarını kapatmakta; böylece CO2 gazının girişi de engellenmektedir. Karbondioksit
aktivasyonunda kullanılmaktadır. Su eksikliği süperoksit (O2•ˉ), hidrojen peroksit
(H2O2), hidroksil radikalleri (OH•) ve tekil oksijen (1O2) gibi çeşitli reaktif oksijen
türlerinin (ROS) oluşumuna neden olmaktadır (Parida ve Das, 2005). ROS, stres şartlarında kloroplast ve mitokondrilerde meydana gelen metabolik reaksiyonlar sonucu oluşmaktadır. Özellikle, kloroplast ve mitokondrilerdeki elektron taşıma sistemlerinden sızmış O2 ve elektronlar arasındaki etkileşim sonucunda aerobik metabolizma sürecinde
üretilmektedirler (Sultana ve ark., 1999). Ayrıca, endoplazmik retikulum ile nukleus membranında sitokrom oksidasyonu ve enzimlerin katalitik döngüleri esnasında da oluşmaktadırlar. ROS‘lardan O2•‾ radikali, hemen hemen tüm aerobik hücrelerde
moleküler oksijenin (O2) bir elektron (e-) alarak indirgenmesi ile oluşur. Bu radikal
direkt olarak zararlı olmamakla birlikte, H2O2 kaynağı olması ve geçiş metalleri
iyonlarının indirgeyicisi olması ile dolaylı etkilere sahiptir. H2O2, O2•‾‘in bir e- alması
veya O2‘nin iki e- alması sonucu oluşan peroksitin iki proton (H+) ile birleşmesinden
meydana gelmektedir. Biyolojik sistemlerdeki dismutasyon reaksiyonunda, iki O2•‾
molekülü, iki H+
alarak H2O2 ve O2 oluşturmaktadır. Stres altındaki bitkilerde artan
ROS hücrelere zarar vermekte, protein membran lipidleri, nükleik asitler ve klorofil gibi hücre bileşenlerinde zararlar meydana getirmektedir (Kuşvuran, 2010).
Tuz stresi sonucunda üretilen ROS‘ları zararsız bileşiklere dönüştüren antioksidan miktarları ve antioksidan enzim aktiviteleri bitkilerin oksidatif strese karşı en önemli dayanım mekanizmalarıdır. Bitkideki kloroplastlar, toksik oksijen türevlerine karşı antioksidan savunma sistemlerine sahip olup bunların başında vitamin E, vitamin C, glutasyon ve karotenoidler gelirken; süperoksit dismutaz (SOD, E.C.1.15.1.1), askorbat peroksidaz (APX, E.C.1.11.1.11), glutasyon redüktaz (GR, EC.1.6.4.2), peroksidaz (POX, EC.1.11.1.7) ve katalaz (CAT, EC. 1.11.1.6) gibi enzimler en etkin antioksidatif enzimler arasındadır (Kuşvuran, 2010).
Tuz ve kuraklık toleransının kazanılmasında enzimatik ve enzimatik olmayan antioksidanlar toksik oksijen türlerini ortadan kaldırmada önemli rol oynarlar. Bu savunmada süperoksit dismutaz (SOD) enzimi merkezi bir role sahiptir. Süperoksit radikalleri sitoplazma, mitokondri ve kloroplastlara yerleşmiş olan farklı SOD tiplerinin aktivitesi ile hidrojen peroksit (H2O2)‘e dönüştürülür. H2O2, katalaz (CAT), peroksidaz
(POX), askorbat peroksidaz (APX) ve glutasyon redüktaz (GR) tarafından ortadan kaldırılır. Bu enzimler oluşan H2O2‘i suya ve moleküler O2‘e dönüştürür. Bu reaktiflerin
zararsızlaştırılmasında enzimatik olmayan antioksidanlar da rol oynar. (Dionisio-Sese ve Tobita, 1998; Smirnoff, 1993).
Tuzluluğa toleranslı olan halofitlerin çoğunluğunun tuz biriktirici oldukları ve dokularındaki yüksek tuz miktarının zararlı etkilerine karşı kendilerini koruyabildikleri Flowers ve arkadaşları (1986) tarafından bildirilmiştir. Glikofit (tuza toleranslı olmayan) bitkilerin tuz toleransının geliştirilmesinde halofit bitkilerin genetik özelliklerinin ve ilgili olarak tuzluluğa karşı geliştirdikleri adaptasyon mekanizmalarının anlaşılması önemlidir. Yani, halofitlerin tuz mekanizmaları üzerine yapılan araştırma sonuçları, tuza dayanıklı glikofit bitkilerin yetiştirilmesi ile ilgili biyoteknolojik çalışmalar için büyük önem taşımaktadır (Furtana, 2010).
Tuzlu topraklar tarıma uygun olmayan verimsiz sahalardır. Son yıllarda çorak toprakların ıslahı yanında, bu alanlardan ıslah edilmeden yararlanabilme olanakları üzerinde çalışmalar yoğunlaşmış ve bu çalışmalarda tuzcul bitkiler (halofit) önem kazanmıştır (Pasternak, 1987; Pasternak ve Malach, 1987).
Sahip olduğu tuz rezervi, biyolojik çeşitlilik ve Önemli Bitki Alanları (ÖBA) gibi değerleri açısından ülkemiz için önemli bir doğal kaynak olan Tuz Gölü çevresinde yetişen Zygophyllum fabago L.‘nun habitatı, diğer birçok bitkinin büyüyüp neslini devam ettirmesine imkan vermeyen tuzlu ve kurak topraklar şeklindedir. Bu tür yüksek tuz oranına sahip topraklarda neslini devam ettirebilmesi için çeşitli fizyolojik, morfolojik, biyokimyasal ve ekolojik adaptasyon mekanizmalarına sahiptir. Ayrıca ağır metallerce (Cd, Ni vb.) kirletilmiş alanlarda bu bitkinin rahatça yaşayabildiği ve fitoremediasyon amaçlı kullanım potansiyeli olduğu da belirlenmiştir (Lefevre ve ark., 2005; Yan Lu ve ark., 2010).
Bu tez projesi kapsamında amacımız; Konya Tuzgölü civarından toplanan, tuz stresine dayanıklılığı ve tuza adaptasyon mekanizmaları tam olarak aydınlatılmamış Zygophyllum L. cinsine ait Zygophyllum fabago L.‘nun tuza tolerans mekanizmasının incelenmesi ve ayrıca antioksidatif savunma mekanizmalarının araştırılmasıdır.
2. KAYNAK ARAġTIRMASI
2.1. Tuz Stresi
2.1.1. Toprak tuzluluğu
Özellikle kurak ve yarı kurak bölgelerde ortaya çıkan tuzluluk, zirai üretimi sınırlandıran en önemli sorunlardan biridir (Asraf, 1999). Toprak tuzluluğu yağışın az olduğu alanlarda toprakta fazla miktarda NaCl birikimi olarak ifade edilirken, Yakupoğlu ve Özdemir (2007), bitkilere zarar verecek düzeyde çözünen tuz veya değişebilir sodyum ya da bunların ikisini birden içeren toprakları tuzlu toprak olarak isimlendirmiştir. Genel olarak saturasyon ekstraktında 4 mmhos cm‘den fazla tuz içeren toprak tuzlu olarak tanımlanmaktadır (Karanlık, 2001).
Sodyumun neden olduğu toprak alkaliliği tuzluluğun farklı bir şeklidir. Kil yüzeyindeki değişebilir sodyum yüzdesinin toplam katyon değişim kapasitesine oranı % 6‘yı geçtiği durumlarda toprak, alkali olarak nitelendirilmektedir. Dünyada sulanan alanların yaklaşık yarısı taban suyu, tuzluluk ve alkalilik etkisi altındadır (Szabolics, 1985).
Çözünebilir tuzlar, bitkiler tarafından kolayca alınabilirler. Bitki bünyesine giren tuz bileşikleri çeşidine ve miktarına göre belli bir konsantrasyonu aşınca bitkiye zararlı olmaktadırlar. Bitki üzerinde, beslenme ve metabolizmayı bozmak yoluyla zehirleyici etki yaparlar. Ayrıca toprakta tuz konsantrasyonunun artmasıyla, bitkinin topraktan su alımı güçleşmekte, toprağın yapısı bozularak bitki gelişimi yavaşlamakta, hatta durmaktadır (Köşkeroğlu, 2006).
Tuzlu topraklarda su ozmotik olarak kuvvetli bir şekilde bağlanmış olup, bu durum fizyolojik kuraklığa neden olmaktadır. Fizyolojik kuraklık durumunda, topraktaki su miktarı bitki için yeterli düzeyde olsa bile ozmotik olarak toprak çözeltisinde kuvvetli bağlanan su bitki tarafından alınamamaktadır (Jacoby, 1994).
2.1.2. Bitkiler tarafından sodyum ve klorürün alınımı, taĢınımı ve birikimi
Bitkiler genelde % 0.004 ile % 2 arasında Na+ içerirler (Bergman, 1992) ve Na+‘u, toprak çözeltisinde çözünmüş ve toprağın değişim komplekslerinde adsorbe edilmiş halde bulunan Na+
alım kapasitesi ve yeşil aksama transportu açısından büyük farklılıklar gösterdikleri bildirilmiştir. Bununla beraber, tür içindeki genotipler arasında da Na+ alımı ve yeşil
aksama transportu açısından farklılıklar görülmektedir (Shannon ve Grieve, 1999). Sodyumun kökler tarafından alımındaki genotipsel farklılıklar, Na+ salgılama
pompalarının aktiviteleri ve kök plazma membranlarının geçirgenlik kapasiteleri ile ilişkilidir (Schubert ve Lauchli, 1990).
Sodyumun fazlası toksik etki göstermesine rağmen çeşitli araştırmacılar tarafından belirlenen görevleri şöyle sıralanabilir:
a) Sodyum kimyasal yönden potasyuma (K) büyük özdeşlik göstermektedir (Tinker, 1967). Şeker pancarı, yulaf, lahana, şalgam, havuç, tahıl ve pamuk gibi bitkilerde Na+
kısmen K‘un görevlerini üstlenebilmektedir.
b) Pek çok bitki için Na+ vazgeçilmez bir besin maddesidir. Sürekli K+ kullanıyor olsa bile Na+‘un toprağa verilmesiyle ürün miktarında dikkate değer artışlar sağlanabilmektedir.
c) Sabahın çok erken saatlerinde yere düşen çiğden, atmosferde ve taban suyundan su absorbe edebilmesi nedeniyle Na, kurak dönemlerde bitkilerin solmalarını geriletir. d) Sodyum bitki özsuyunda donma noktasını düşürmek suretiyle, kışın ve erken ilkbaharda bitkilerin dondan zarar görmelerini büyük ölçüde azaltır.
e) Metalik bir katyon olarak Na+ toprakta kirecin yitirilmesini azaltarak, toprak çözeltisinde iyonik dengenin korunmasına yardım eder.
f) Sodyum toprakta çözünmez şekilde bulunan fosforun (P) çözünür hale geçmesine ve bu halde kalmasına yardımcı olur. Bu durum özellikle kireçli topraklarda önem taşımaktadır.
g) Sodyum lahana ve benzeri bitkilerin renk ve kokuları üzerine olumlu etki yapar. Bitkilerde kalite dikkate değer bir şekilde düzelirken hastalıklara karşı dayanıklılık artar (Leonard ve Bear, 1950).
Tuz stresinde Na+ iyonu yanında Cl- iyonu da bitkinin gereksindiği miktardan fazla alınır. Klor bitkiye toprak rezervleri, yağmurlar, gübreler ve hava kirliliği gibi birçok kaynak ile sağlandığından dolayı, bitkide noksanlığından çok toksisitesi dikkat çeker. Klor kapsamları bakımından bitkiler arasında önemli farklılıklar bulunduğu gibi, bir bitkinin değişik organlarında da Cl- miktarları farklıdır. Storey ve Walker (1987), tuz uygulanmış turunçgil bitkilerinde en yüksek Cl
konsantrasyonunun yaprak ayası ve yaprak sapında bulunduğunu, Na+
konsantrasyonunun ise köklerde yüksek olduğunu belirtmişlerdir.
2.1.3. Tuzluluğun bitkiler üzerine etkileri
Bitkiler tuzluluğa göstermiş oldukları tepkilere göre halofitler (tuzcul bitkiler) ve glikofitler (yüksek tuz yoğunluklarından zarar gören bitkiler) olmak üzere iki grupta toplanmaktadırlar. Halofitler iyonların birikimi ile düşük osmotik potansiyele sahip olan, böylece yüksek konsantrasyonlarında tuz içeren alanlarda yaşayabilme yeteneğine sahip olan bitkilerdir. Bunların aksine yüksek bitkilerin büyük bir çoğunluğu glikofit bitkiler içerisinde yer almakta ve bu bitkiler tuz stresi koşullarında ozmotik düzenlemeyi gerçekleştirememektedir (Levitt, 1980; Ellialtıoğlu ve Tıpırdamaz, 1998; Yaşar, 2003; Asraf, 2004; Kuşvuran, 2004).
Bitkilerin geliştiği tuz ortamı, düşük ozmotik potansiyel, spesifik iyon etkisi ve beslenme dengesizliği gibi nedenlerle birçok olumsuz etkiye neden olmaktadır. Tüm bu faktörler bitkiyi fizyolojik ve biyokimyasal seviyelerde etkilemekte, bitki gelişiminde olumsuzluklara yol açmaktadır.
Genel olarak tuz, daha küçük bitki boyutu, yaprak sayısında ve alanında azalmaya bağlı olarak ortaya çıkan büyümede yavaşlama şeklinde etkisini göstermektedir. Bunun yanı sıra, bitki yaş ve kuru ağırlıklarında azalma, klorofil miktarında azalma, meyve tat ve kalitesinde bozulma ve buna bağlı olarak verimde düşüş, tuz stresinin ortaya çıkardığı etkiler arasında yer almaktadır (Shannon ve Grieve, 1999; Asraf, 2004).
Yüksek tuz konsantrasyonları, bitki hücresinde birçok olumsuzlukları da beraberinde getirmektedir. Bu olumsuzluklar başlıca üç aşamada sıralanabilir (Marschner, 1995; Yaşar, 2003; Borsani ve ark., 2003; Xue ve Liu, 2008):
1. Su stresi,
2. Na+ ve Cl- iyonlarının yüksek konsantrasyonu nedeniyle oluşan iyon toksisitesinin hücrede meydana getirdiği zararlar,
3. Na+ ve Cl- birikimi sonucu Ca+2 ve K+ iyonlarının hücre içerisindeki dengesinin bozulması.
Toprakta bulunan tuz seviyesindeki artış ile su potansiyeli düşmekte, böylece bitki fizyolojik kuraklık stresine de maruz kalmaktadır (Levitt, 1980). Munns ve Termaat (1986), tuzluluk sonucu ortaya çıkan zararların ilk belirtisinin su eksiliği nedeniyle meydana geldiğini belirtmişlerdir. Araştırıcılar yüksek tuz konsantrasyonlarının su eksikliği nedeniyle bitki büyümesini sınırlandırdığını, bunun Na+ ve Cl- iyonlarının yapraklarda meydana getirdiği zarar ve devamında besin
maddelerinin taşınımı sırasında ortaya çıkan sorunlar nedeniyle olabileceğini bildirmişlerdir. Tuz stresine maruz kalan bitkilerde, hücre turgorunu kaybederek suyun kimyasal aktivitesi azalmakta, bu da kuraklık benzeri bir etkiye neden olmaktadır (Borsani ve ark., 2003).
Tuz stresi altındaki bitkiler, stomalarını kapatıp transpirasyonu azaltarak su kaybını önlemeye çalışmaktadır. Ayrıca yaprak alanının azalmasıyla birim alandaki CO2 fiksasyonu da azalır. Bu süre içerisinde respirasyon artar, bu durum birim yaprak
yüzey alanı başına düşen günlük net CO2 asimilasyonunda bir azalışa neden olur.
Yaşamak için yoğun enerji harcayan bitki, ihtiyacından daha az fotosentez yapmakta ve gerekli enerjiyi sağlayamamaktadır. Sonuç olarak büyüme ve gelişme gerilemektedir (Karanlık, 2001; Yaşar, 2003).
Yüksek tuz konsantrasyonlarında iyon birikimi ve stomaların açılıp kapanmasındaki düzensizlikler nedeniyle toplam klorofil miktarında azalmalar meydana gelmekte, bunun sonucu olarak fotosentez etkinliği azalarak bitkinin gelişiminde olumsuzluklar ortaya çıkmaktadır (Yaşar, 2003).
Yapraklarda artan Na+ konsantrasyonu fotosentez ve transpirasyonu olumsuz yönde etkilerken, Na+
ve K+ iyonlarının antagonistik etkisi nedeniyle K+ eksiklikleri ortaya çıkmaktadır (Romero ve ark., 1997). Genellikle Ca+2
ve K+ tuz stresi koşullarında olumsuz etkilenerek iyon konsantrasyonlarında azalma meydana gelmektedir (Khan, 1993; Al-Harbi, 1995). Diğer stres faktörlerinde olduğu gibi tuz ve kuraklık stresinde bitkiler su kaybını en az düzeye indirebilmek için stomalarını kapatmakta ve su kullanım aktivitesi sağlamaya çalışmaktadırlar. Ancak stomaların kapanması ile yeteri kadar CO2 fiksasyonu sağlanamamaktadır. CO2 indirgenmesinde
kullanılmayan elektronlar, O2‘nin indirgenmesinde rol oynamakta ve serbest oksijen
radikallerinin oluşumuna neden olmaktadır (Asada, 1994; Foyer ve ark., 1994; Makela ve ark., 1999).
Kloroplastlarda ve mitokondride elektron taşınımı sırasında elektronlar oksijen ile reaksiyona girerek süperoksit radikal (O2•‾) ve hidroksil radikal (OH•) gibi aktif
radikalleri oluştururken, durağan oksijenin enerjisiyle aktive olarak tekli oksijen gibi bir başka O2 türevini sentezlemektedir. Bu oksijen türevlerinin etkisi ile lipidler, proteinler
ve nükleik asitler oksidatif zarara uğramakta ve bunun sonucunda metabolizmada ciddi sorunlar meydana gelmektedir (Halliwell ve Gutteridge, 1985; Elstner, 1987).
2.2. Bitkilerin Tuz Stresine KarĢı Savunma Sistemleri
Abiyotik stres faktörlerden biri olan tuzluluk stresi karşısında bitkiler, kendilerini koruyabilmek için çeşitli savunma mekanizmaları geliştirmiştir. Özellikle kendilerine zarar verebilecek düzeyde Na+
ve Cl- iyonlarını farklı mekanizmalar kullanarak etkisiz hale getirmeye çalışmaktadırlar. Bu mekanizmalar, biyokimyasal stratejiler; seçici iyon birikimi veya dışlanması, köklerle alınan iyonların kontrolü ve yapraklara taşınımı, tüm hücre düzeyinde veya hücresel boyutta iyonların dağılımı, uyumlu bileşiklerin sentezi, fotosentetik yolun değişmesi, membran yapısındaki değişimler, antioksidan enzimlerin ve bitki hormonlarının indüksiyonu olarak sıralanabilirler (Seçkin, 2005).
Bitkiler kendileri için, stres oluşturabilecek düzeyde tuzlulukla karşılaştığında kök hücrelerindeki Na pompaları ile fazla Na+‘u ortama geri vermekte böylece
sitoplazmadaki Na+ konsantrasyonunu tolere edilebilir seviyede tutmaya çalışmaktadır (Schubert ve Lauchli, 1990; Yang ve ark., 1990).
Bitkinin Na+‘u vakuollerde biriktirerek kendine zarar vermesini önlemesi bir diğer önemli mekanizmadır. Munns (2002), tuza toleranslı olan bitkilerin, hassas olanlara göre bünyelerine daha az oranlarda Na+
ve Cl- iyonları aldıklarını, bu toksik iyonların vakuollerde biriktirilerek hücre duvarı ve sitoplazmada oluşabilecek yıkımların engellendiğini, böylece tuz toksisitesinden kendilerini koruduklarını bildirmiştir.
Tuz stresi altında bulunun bazı bitkiler, Na+
ve K+ iyonlarının geçişlerini engelleyerek kendilerini tuz stresine karşı koruma eğilimindedir. Tuza toleranlı olan bitkilerin tuzdan sakınımının ilk yeri kökler olup, yüksek tuz konsantrasyonunda bitki tuzları ya içeri almamakta ya da bünyesine giren tuzu, enerji kullanarak dışarı pompalayıp kurtulmaktadır (Cheeseman, 1988; Murata ve ark., 1994). Bitkilerin tuzdan sakınım amacıyla kullandıkları bir diğer mekanizmada hızlı büyüme göstererek birim hacimde alınan tuzun bünyede seyreltilmesidir. Hızlı büyüme sonucunda yapraklarda seyrelen tuz miktarı tolere edilebilir düzeylerde kalmaktadır (Tal, 1983).
2.2.1. Tuz stresi altında hücrelerdeki ozmotik dengenin sağlanmasına yönelik mekanizmalar
Strese maruz kalan bitkiler, ozmotik dengenin sağlanabilmesi için, sitoplazma ve organellerinde çeşitli çözünebilir maddeler biriktirmektedirler. Bu maddeler enzimler üzerinde pozitif bir etki sağlaması dışında, membran bütünlüğünü de sağlayarak stres altındaki bitkilerde ozmotik düzenlemenin sağlanmasında rol oynamaktadırlar. Birçok çalışma glisinbetain ve prolin gibi organik maddelerin sentezlenmesi ile strese tolerans arasında pozitif bir ilişki olduğunu göstermiştir (Asraf ve Foolad, 2007). Munns (2005), tuz stresi altındaki bitkilerin tuzluluk nedeniyle meydana gelen ozmotik ve iyonik stres karşısında çeşitli mekanizmalar geliştirdiklerini belirtirken, Hong- Bo ve ark. (2006), tuz stresine adaptasyonun genellikle potasyum, çözülebilir şeker, prolin ve betain gibi ozmoregülatörler ile sağlandığını bildirmişlerdir. Prolin genellikle stres koşullarında birikimi gerçekleşen, bitkinin dayanım yeteneğini sağlaması bakımından bir indikatör görevini yapan, suda çözünebilir bir aminoasittir (Bian ve ark., 1988). Ozmolit olarak görev yapmasının yanında, hücrelerin stabilizasyonu, sitosolik pH‘nın ayarlanması ve hidroksil radikallerinin düzenlenmesinde etkili bir organik maddedir (Matysik ve ark., 2002).
2.2.2. Reaktif oksijen türleri
Kloroplastlarda ve mitokondride elektron taşınımı sırasında elektronlar oksijen ile reaksiyona girerek süperoksit radikal (O2•‾) ve hidroksil radikal (OH•) gibi aktif
radikalleri oluştururken, durağan oksijenin enerjisiyle aktive olarak singlet oksijen gibi bir başka O2 türevini sentezlemektedir. Bu oksijen türevlerinin etkisi ile lipitler,
proteinler ve nükleik asitler oksidatif zarara uğramakta ve bunun sonucunda metabolizmada ciddi sorunlar meydana gelmektedir (Halliwell ve Gutteridge, 1985; Elstner, 1987).
2.2.2.1. Süperoksit radikali (O2 •‾
)
O2•‾, flavoprotein dehidrojenazlar tarafından enzimatik olarak oluşturulabilir.
Buna ek olarak daha da önemlisi ferrodoksinlerin, hidrokinonların, tiyollerin ve indirgenmiş hemoproteinlerin fotooksidasyonları tarafından enzimatik olmayan yolla da
üretilebilirler. Fotosistem I‘in indirgenme bölgesi üzerinde ferrodoksin ve diğer elektron taşıyıcılar oksijene bir elektron vermek için gerekli negatif elektrokimyasal potansiyele sahiptirler (Asada ve Takahashi, 1987). Süperoksit üretiminin çoğunluğu ferrodoksin (Furbank ve Badger, 1983) ve mehler reaksiyonu sayesinde olmaktadır.
O2•‾, lipid peroksidasyonuna, membran hasarına, hücresel toksisiteye ve DNA‘da
kırılmalara neden olabilmektedir. Süperoksit, Haber-Weiss reaksiyonunda hidrojen peroksitle reaksiyona girebilir ve buradan hidroksil radikali üretilir. Süperoksit aynı zamanda, NADPH ve epinefrin oksidasyonunda olduğu gibi katalazın ve glutasyon redüktazın inaktivasyonuna sebep olabilir (Fridovich, 1986). Bunlarla birlikte, biyotik ve abiyotik çevresel stres faktörlerinin çoğu bitkilerde oksidatif hasarlara yol açabilir (Acar, 1999). O2•‾, süperoksit dismütazla (SOD; EC 1.15.1.1) katalizlenen dismutasyon
reaksiyonu yoluyla hidrojen peroksite dönüştürülür.
H2O2 + O2•‾ OH‾ + O2 + OH•
Haber –Weiss Reaksiyonu (Acar, 1999)
2.2.2.2. Hidrojen peroksit ( H2O2 )
H2O2, peroksizomlarda glikolatın oksidasyonu boyunca üretilebilir. Daha da
önemlisi, süperoksitten süperoksit dismütaz tarafından üretilebilir. H2O2, reaktif oksijen
türlerinin en durağan olanıdır. Kuvvetli nükleofilik oksidanttır ancak gerçekte reaktif değildir. S-H bağlarının oksidasyonu sayesinde kelvin döngüsü enzimleri ve diğer enzimlerin inhibisyonundan sorumludur (Kaiser, 1979). Hidrojen peroksit ayrıca Fenton ve Haber-Weiss reaksiyonları yoluyla yıkıcı hidroksil radikaline dönüşebilir. H2O2,
peroksizomlarda CAT ve kloroplastlarda APX ile ortamdan temizlenir.
2.2.2.3. Hidroksil radikali
Hidroksil radikali (OH•) çok fazla reaktiftir, çoğu organik bileşiği okside eder. Yüksek reaktivitesinin gelişigüzel olmasından dolayı uygun olan ilk substratla tepkimeye girer. Bu nedenle, yüksek bir yıkıcı ve mutajenik potansiyele sahiptir. Hidroksil radikalleri kloroplast membranlarının hemen yakınında oluştuğundan
kloroplastlar hidroksil radikallerine özellikle duyarlıdırlar. OH•, metal katalizleyen Fenton reaksiyonu ve Haber-Weiss reaksiyonu sayesinde oluşmaktadır:
Fenton Reaksiyonu: Fe2+ + H2O2 = •OH + Fe3+ + OH
-Haber-Weiss reaksiyonu (1934): O2- + H2O2 = •OH + OH-+ O2
OH•‘e karşı savunmada α-tokoferol ve askorbat ile bunun etkisi sınırlı olarak bastırılmaktadır.
2.2.3. Reaktif oksijen türlerinin (ROS) üretim yerleri
2.2.3.1. Kloroplastlar
Elstner (1991)‘e göre kloroplast içinde ROS‘ların üretildiği en az 4 bölge vardır. (1) PSI, kloroplastlarda oksijen aktivasyonunun önemli bir mekanizması olan Mehler reaksiyonuyla oksijeni indirgeyebilir.
(2) Fotoaktive olmuş klorofil 1, normal olarak, uyarma enerjisini PS reaksiyon merkezlerine transfer eder, fakat elektron taşıma sistemlerinde kullanıldığından yakalanan ışık enerjisinin önlendiği koşullar altında bu enerji oksijeni uyararak, oksijenin triplet formdan singlet forma dönüşmesine neden olur.
(3) PS II‘nin okside olan yüzeyi PS II reaksiyon merkezine sudan 4 tekil elektronun transferini kolaylaştırmakta ve oksijeni triplet veya temel durağan seviyeye dönüştürmektedir.
(4) Fotorespirasyon, kloroplastlarda iyi bilinen oksijenasyon yoludur. Rubisco, fosfoglikolat ve fosfogliserat oluşumunda RuBP‘nin 2. karbonuna oksijen eklenmesini katalizler. Bu, kloroplastlarda aktif oksijen oluşturmadığı halde, peroksizomlarda glikolat metabolizmasını devamında aktif oksijen oluşturur.
2.2.3.2. Mitokondriler
Oksijenin büyük bölümü mitokondriyal elektron taşıma sistemindeki sitokrom oksidaz tarafından tüketilir ve oksijene ardışık olarak 4 elektron transfer edilir, sonuçta su meydana gelir. Bitki mitokondrisinde alternatif oksidazda, ilave bir oksijen indirgeme bölgesi vardır, siyanüre direnci sayesinde sitokrom oksidazdan ayrılır.
Bununla beraber, bu bölgelerden hiçbiri süperoksitin önemli miktarlarını üretmez (Rich ve Bonner,1978). Aynı zamanda, NADH varlığında mitokondride üretilen H2O2 ve O2•‾
izole edilmiştir (Loschen ve ark., 1974).
2.2.3.3. Endoplazmik retikulum
Granülsüz endoplazmik retikulumda; oksidasyon, hidroksilasyon, dealkilasyon, deaminasyon, dehalojenizasyon ve desaturasyonları içeren çeşitli oksidatif süreçler meydana gelmektedir. İşlevi karmaşıklaşmış oksijenazlar; bir elektron verici olarak NAD(P)H kullanarak bir organik substrata bir oksijen atomu ekleyen, bir hem kısmı içerir.
Sitokrom P450 tarafından katalizlenen genel reaksiyon şöyledir: RH + NADPH + H+ + O2 → ROH + NADP+ + H2O
Bitkilerde en iyi karakterize edilmiş sitokrom P450, flavonoid ve lignin biyosentezlerinde işlevsel olan sinnamat-4-hidroksilaz‘dır. Fakat işlevi karmaşıklaşmış diğer oksijenazlar, gibberellin ve sterol biyosentezleri içeren diğer biyokimyasal yollarda işlevseldirler. Bu sistemler tarafından oksijenin aktivasyonu, böyle kompleks metabolitlerin sentezinde, oksijen ekleme reaksiyonlarına gerekli bir şarttır. Süperoksit, sitokrom P450 içeren, mikrozomal NAD(P)H‘a bağlı elektron taşınımıyla üretilir (Winston ve Cederbaum, 1983).
Sitokrom P450 ilk olarak organik subtrat RH ile reaksiyona girer. Kompleks, eşleşmemiş bir elektrona sahip her bir triplet oksijenle kendiliğinden reaksiyona girebilen bir ara radikal oluşturmak için, bir flavoprotein tarafından indirgenir. Bu oksijenlenmiş kompleks sitokrom b tarafından indirgenebilir veya bazen bu kompleks süperoksit oluşturarak ayrışabilir.
2.2.3.4. Mikrobadiler
Peroksizomlar ve glioksizomlar tek zarlı organellerdir. Bunlar yağ asitlerinin β-oksidasyonu ve glikolik asit döngüsünde görevli olan glikolat oksidaz, katalaz ve çeşitli peroksidazlar gibi enzimleri içerirler. Glikolat oksidaz glikolattan oksijene iki elektron taşınmasında H2O2 üretir (Lindquist ve ark., 1991). Ksantin oksidaz, ürat oksidaz ve
NADH oksidaz, kendi substratlarının oksidasyonunun bir sonucu olarak süperoksit oluşturur. İn vitro da ksantin oksidaz reaksiyonu, ksantinin ürik aside dönmesi sırasında
bir mol süperoksit üreterek, süperoksit kaynağı olarak sık sık kullanılmıştır (Fridovich,1970).
2.2.3.5. Hücre duvarları
Tamamen açık olmamasına rağmen, hücre duvarları metabolizmanın ve aynı zamanda oksijen aktivasyonunun aktif bölgeleridir. Bu reaksiyonların bazıları patojenlere karşı savunma reaksiyonlarına dahil edilebilir. Diğerleri ksenobiyotik kimyasalların bölmelere ayrılması ve parçalanmasına dahil olabilir. Bununla beraber, yaygın reaksiyonların çoğu, biyosentetiktir (Gross ve Elstner, 1977).
2.2.4. Reaktif oksijen türlerine karĢı savunma mekanizmaları
ROS regülasyonu genel olarak metabolitlerin iki grubu ile gerçekleştirilmektedir. Bunlar; enzimatik ve enzimatik olmayan antioksidanlardır.
2.2.4.1. Enzimatik antioksidanlar
ROS düzenlenmesine dahil olan enzimler koruyucu enzimler olarak adlandırılmaktadır. Bitki hücresinde temel koruyucu enzimler süperoksit dismütaz, peroksidaz, katalaz, askorbat peroksidaz ve glutasyon redüktaz‘dır.
2.2.4.1.1. Süperoksit dismutaz (SOD; E.C.1.15.1.1)
Üretilen ROS‘lerine karşı yeterli bir korunma mekanizması olmadığı takdirde hücre duvarının yapısına ve fonksiyonlarına zarar verirler (Bennicelli ve ark., 1998). Süperoksit dismutaz (SOD), ilk defa McCord ve Fridovitch tarafından izole edilmiş ve yüksek derecede reaktif olan süperoksit anyon radikallerini (O2•‾) katalizleyerek
organizmalara oksijen varlığında hayatta kalma imkanını veren bir enzimdir. Bu reaksiyon oksijen metabolize eden tüm organizmalarda ve bazı anaerobik canlılarda gerçekleşir ve sonucunda moleküler oksijen (O2) ve hidrojen peroksit (H2O2) açığa
çıkar. Bu katalitik mekanizma metal iyonunun ardışık oksidasyon ve redüksiyonuna dayanır. SOD prostetik grup olarak demir, mangan veya bakır + çinkoyu taşıyan bir metalloproteindir. Bu metal iyonları süperoksit radikallerinin enzim aktif bölgesine elektrostatik olarak yönlendirilmesini sağlar. Bu enzim genelde aktif oksijen oluşturan
hücre kompartmanlarında bulunur. Cu-Zn içeren SOD birçok ökaryotik canlıdan izole edilmiştir. Ayrıca şaşırtıcı şekilde birkaç bakteride de rastlanmıştır. Mn-SOD prokaryotlarda ve ökaryotların mitekondrilerinde tespit edilmiştir. Fe-SOD ise birkaç prokaryotik organizmada bulunmuştur (Öztürk ve ark., 1999).
Prokaryotik Mn-SOD ve Fe-SOD ve ökaryotik Cu/Zn-SOD enzimleri dimer yapıdadır. Mitokondrilerdeki Mn-SOD ise tetramerik yapıdadır. SOD‘un tüm formları çekirdek tarafından kodlanır ve amino ucunun işaretlenmesi ile de gideceği hücre kompartmanı belirlenir (Creighton, 1999). SOD bir serbest radikal olan süperoksit anyonunun dismütasyonu olarak adlandırılan reaksiyonu katalizler:
O2•‾ ---(SOD)---> O2 + H2O2
Bu reaksiyon sayesinde SOD, hücrenin serbest radikal havuzunun düzenlenmesine dahil olmaktadır. Fe-SOD‘lar kloroplastlarda, Mn SOD‘lar mitokondrilerde ve peroksizomlarda, Cu-Zn SOD‘lar ise kloroplast, sitosol ve ekstraselüler yüzeylerde lokalize olmuşlardır. Reaksiyonun aktif oksijen ürünü olan H2O2, POX, CAT ve APX tarafından metabolize edilir.
2.2.4.1.2. Peroksidaz (POX; E.C.1.11.1.7)
Bir heme (Fe-porfirin) grubu içeren glikoproteindir. POX‘ın ilk hareketi bir elektron yakalayıcı olarak H2O2 kullanarak substratı okside etmesidir.
AH2 + H2O2 ---(POX)---> AH + H2O
POX‘ın heme kısmındaki Fe iyonu katalitik hareket için yanıt vericidir. Bu reaksiyon;
a) Hücre duvarında lignin ve süberin biyosentezleriyle sonuçlanan serbest fenollerin oksidatif polimerizasyonunu sağlar.
b) Hücre duvarı bileşenlerine, fenollerin oksidatif polimerazsyonla bağlanmasını sağlar. Örneğin; hücre duvarına çapraz bağlanma ve sağlamlıkla sonuçlanan fenoller (ferulik asit) ve hücre duvarındaki tirosin atıkların (uzantılar) hücre duvarı polisakkarit zincirlerine bağlanması.
2.2.4.1.3. Askorbat peroksidaz (APX; EC 1.11.1.11)
Askorbat peroksidaz hem peroksidaz enzim ailesinin bir üyesi olup mayadan insana kadar pek çok canlıda bulunur. Askorbat peroksidaz hidrojen perokside bağlı olarak farklı substratları katalizler. Fakat enzimin fizyolojik substratı askorbattır (vitamin C). Askorbatın dışında bazı aromatik substratların (AH2) da oksidasyonunu katalizler.
2 Askorbat + H2O2 2 monodehidroaskorbat radikali + 2 H2O
H2O2 + 2 AH2 2 H2O + 2 AH
Askorbata bağlı askorbat peroksidaz aktivitesi ilk olarak 1979 yılında bulundu. Bu enzim sınıf I peroksidaz enzim ailesine ait olup bitkilerde, alglerde ve sadece siyanobakterilerde hidrojen perokside bağlı askorbat oksidasyon reaksiyonunu katalizler (Sharp ve ark., 2003). Fizyolojik koşullar altında reaksiyonun ara ürünü monodehidroaskorbat radikali olup başka bir enzimce tekrar askorbata indirgenir. Askorbat peroksidaz sitosolde, kloroplastlarda, peroksizomlarda bulunur (Arora ve ark., 2002). Bütün askorbat peroksidaz enzimleri elektron vericisi olarak askorbata yüksek özgüllük gösterir. Fakat enzimin fizyolojik koşullarda bulunmayan substratları da okside etme yeteneği de vardır (Raven, 2003).
2.2.4.1.4.Katalaz (CAT; E.C.1.11.1.6)
Hidrojen peroksit (H2O2) hücreler tarafından yağ asitlerinin peroksizomlarda
β−oksidasyonu, fotorespirasyon ve pürin katabolizması gibi normal aerobik reaksiyonlarda oluşturulur ve farklı konsantrasyon seviyelerinde mitojenik büyümeden apoptozis kadar bir çok hücresel cevap mekanizmasında etkinlik gösterir. Katalaz çeşitli streslere karşı geliştirilen cevap mekanizmalarındandır.
Ayrıca H2O2 patojenlerin öldürülmesinde de savunma sistemi hücreleri
tarafından üretilir. Yüksek konsantrasyonlardaki H2O2 hücrelere zarar verir ve
hücrelerde birikimi protein, lipit ve DNA gibi hücresel hedeflerin oksidasyonuna yol açar. Bu durum ise mutasyonların oluşmasına ve/veya hücre ölümüne yol açar. Bu sebeple H2O2‘in hücreden uzaklaştırılması oksidatif hasardan korunmak için önemlidir
Hidroperoksidaz olarak da isimlendirilen katalaz bir sitokrom sistemine sahip tüm aerobik canlılarda bulunan ve H2O2‘in su ve oksijene parçalanmasını katalizleyen
özel bir proteindir. CAT, heme (Fe-porfirin) grubu içeren şu reaksiyonu katalizleyen enzimdir:
2 H2O2 ---(CAT)---> 2 H2O + 2 O2
Bunun sonucunda CAT aynı zamanda, H2O2 seviyesinin kontrolünü sağlar.
Hidrojen peroksitin (H2O2) bu şekilde uzaklaştırılması sayesinde daha reaktif olan
hidroksil radikallerinin oluşumu önlenmiş olur. Bu reaktif oksijen türlerinin uzaklaştırılması aerobik ortamda yaşamayı kolaylaştırır.
ROS‘lara karşı etkili olmasından dolayı, çoğu aerobik organizma üç temel enzim sınıfından birine ait katalaz enzimine sahiptir. Bu enzim sınıflarından en geniş olanına ait katalaz enzimi tipik tek fonksiyonlu özellikte olup hem grubu içerir ve 60 kDa veya 80 kDa alt ünitelere sahiptir. İkinci en geniş gruba üye katalazlar ise katalaz-peroksidaz şeklinde iki fonksiyona sahip hem-grubu içerirler, ancak sekans olarak bitki ve fungus peroksidazlarına benzerlik gösterirler. Üçüncü grup ise en küçük grubu oluşturur. Bu grubun üyesi katalazlar ise hem-grubu içermezler veya Mn içerirler.
Küçük alt üniteye sahip tek işlevli katalaz enzimi tüm ökaryot ve prokaryotlarda bulunmasına rağmen arkealarda tespit edilememiştir (Creighton, 1999). İnsanlarda katalaza en çok karaciğerde, böbrekte ve eritrositlerde rastlanmıştır. Ökaryotik katalazlar NADPH‘a bağlı olarak bulunurlar. Bu durum onların daha kararlı yapıda kalmasını sağlar ve normal katalitik döngü dışında ikinci tip bileşiklerin oluşmasını önler. Büyük alt üniteye sahip katalaza ise fungus ve bakterilerde rastlanmıştır. İki fonksiyonlu katalaz peroksidaz aktivitesi gösteren gruba ise prokaryotlarda ve arkealarda rastlanmıştır.
Hem-grubu içermeyen katalaza ise yalnızca bakterilerde rastlanmıştır. Katalaz ve peroksidaz enzimlerinin her ikisi de H2O2‘i parçalar. Ancak katalaz hem elektron
alıcısı hem de elektron vericisi olarak H2O2 kullanırken, peroksidazlar ise H2O2‘i
indirgemek için organik bir substrata (RH2) gereksinim duyarlar.
H2O2‘in parçalanmasını sağlayan reaksiyon iki aşamada gerçekleşir. İlk
aşamada H2O2, suya ve oksiferil türlerine (bileşik I) ayrılır.
Hem-Fe III + H2O2 hem-FeV = O (bileşik I) + H2O
Bileşik I bir diğer H2O2 molekülü ile reaksiyona girer ve sonuçta su ve
moleküler oksijen meydana gelir.
Hem-FeV = O + H2O2 hem-Fe III + O2 + H2O
2.2.4.1.5. Glutasyon redüktaz (GR; EC 1.6.4.2)
Glutasyon redüktaz, okside glutasyonun (GSSG) glutasyona (GSH) indirgenmesini katalizleyen bir enzimdir. Glutasyon redüktaz redoks döngüsünde önemli bir enzim olup, indirgenmiş hücresel GSH‘ın hücrede yeterli seviyede kalmasını sağlar. GSH antioksidan olarak görev yapar ve serbest radikal ve organik peroksitlerle reaksiyona girer, aminoasit taşınımında görev alır, organik peroksitlerin detoksifiyesinde ve zenobiyotiklerin metabolizmasında görevli glutasyon peroksidaz ve glutasyon S-transferaz enzimlerinin substratıdır.
Bu homodimerik enzim flavoprotein disülfit oksidoredüktaz enzim ailesinin bir üyesidir. Her bir alt ünite dört domaine sahiptir. Bunlar N-ucundan başlayarak: FAD bağlanma domaini, NADPH bağlayan domain, merkezi bir domain ve bir ara domain. Enzimin aktif bölgesi dimerik yüzde yer alır. GSSG bağlayan enzim bölgesi her iki alt ünitenin residülerinden oluşsa da sadece dimerik form aktiftir.
Okside glutasyonun indirgenmesi çok aşamalı bir reaksiyondur. Başlangıç olarak enzim NAHPH tarafından indirgenir. İndirgenmiş glutasyon redüktaz GSSG molekülü ile reaksiyona girer ve bu reaksiyon bir disülfit değişimi ile sonuçlanır.
Glutasyon Redüktaz
GSSG + NADPH + H+ ⎯⎯⎯⎯⎯→ 2 GSH + NADP+
Glutasyon redüktaz hayvanlarda, bitkilerde ve bakterilerde bulunur. Bu enzim askorbat-glutasyon reaksiyon döngüsünde görevli önemli bir enzimdir. Bu sistem sayesinde memeliler hemoglobin ve diğer proteinlerini peroksitlerin verebileceği zarardan korur. Endojen veya ekzojen nitrik oksit uygulaması GSH oluşumunu azalttığı
için hücresel dengeyi bozar. Bir stres meydana gelir ve enzimin inhibisyonu gerçekleşir. Glutasyon redüktaz mitokondrilerde ve peroksizomlarda bulunmuştur (Hou, 2004).
2.2.4.2. Enzimatik olmayan antioksidanlar
Antioksidanlar aktif oksijenin birikimini düşük redoks potansiyelle denetleyen molekülleri kapsamaktadır. Bunlar; fenoller, flavonoidler, tokoferoller, karotenoidler, poliaminler vb.‘dir. Bundan başka; bazı fenollerin (hidroksisinnamik asitler ve flavonoidler) aktif oksijene yanıtta serbest radikallerin etkili süpürücüleri olarak hareket ettikleri rapor edilmiştir. Mevcut güçlü hücre antioksidanları askorbik asit (Vitamin C) ve tiyollerdir (SH grubu içeren bileşikler).
2.3. Tuz Stresi ile Ġlgili Literatür AraĢtırması
Çakırlar ve Topçuoğlu (1987), Tuz gölü halofitlerinden Frankenia hirsuta L. (86.63 nmol prolin g-1 taze ağırlık), Artemisia herba-alba Asso (40.19 nmol prolin g-1 taze ağırlık) ve Zygophyllum fabago L. (37.29 nmol prolin g-1
taze ağırlık)‘da yüksek miktarlarda prolin tespit etmişlerdir. Ayrıca araştırmacılar, NaCl (50 ve 150 mM) ve Na2SO4 (33.5 ve 100 mM) tuzları ilave edilerek hazırlanmış izoosmotik kültür
çözeltilerinde yetiştirdikleri ayçiçeği bitkisinin yaprak dokularındaki prolin birikiminin artan NaCl ve Na2SO4 konsantrasyonları ile artış gösterdiğini belirtmişlerdir.
Çeltikte yapılan bir çalışmada, farklı tuz dozları (0, 30, 50 mM NaCl) altında yetiştirilen bitkilerde yapraklar genç ve yaşlı yaprak olarak ayrılmış ve bu organlarda protein, klorofil içeriği ile malondialdehit seviyeleri incelenmiştir. Sonuçta stres sonucu kontrol bitkilerine oranla yaprak sayısında bir farklılık meydana gelmemekle birlikte, stres koşullarında yetiştirilen bitkilerin daha küçük yaprak alanına sahip oldukları belirlenmiştir. Ayrıca 50 mM NaCl ilave edilmiş ortamda yetiştirilen bitkilerde protein içeriği azalırken, genç yaprakların yaşlı yapraklara oranla daha fazla protein içerdiği belirlenmiştir. Klorofil miktarı çalışmada kullanılan tüm çeşitlerde azalmış, ancak genç ve yaşlı yapraklar arasında bir fark bulunamamıştır. Tuz stresine hassas olan çeşitlerde hücre zararı ve malondialdehit üretimi yaşlı yapraklarda daha yüksek oranda gerçekleşmiştir (Lutts ve ark., 1996).
Hıyar bitkisinde tuz stresi altında antioksidatif enzim aktivitelerindeki değişimi inceleyen Lechno ve ark. (1997), CAT ve GR enzim aktivitesinin tuz uygulamasıyla
birlikte arttığını, SOD aktivitesinde ise herhangi bir farklılığın ortaya çıkmadığını belirtmektedirler.
Hernandez ve ark. (2000), bezelye (Pisum sativum L.) bitkisinde yapmış oldukları çalışma sonucunda uzun süreli tuz stresi uygulamasında bezelyelerin antioksidan savunma mekanizmalarından en az bir tane tolerans mekanizmasının olduğunu bildirmişlerdir.
Srivalli ve Khanna-Chopra (2001), Triticum aestivum L. bitkisinin yaprakları üzerine süperoksit dismutaz ve katalaz aktivitelerini araştırmışlardır. Bu çalışma sonucunda yaprak senesensi sırasında mitokondriyal Fe-SOD aktivitesindeki artış rapor edilmiştir.
Öncel ve Keleş (2002), iki buğday türüne ait 6 genotipe (T. aestivum ve T. durum), su kültürü ortamında 5 gün boyunca 200 mM NaCl uygulamışlar ve bitki boyu, RWC, klorofil içeriği ve prolin miktarını araştırmışlardır. Kök ve sürgün büyümesi 200 mM NaCl uygulamasıyla önemli ölçüde engellenmiştir. Kök büyümesindeki inhibisyon tuz stresine dayanıklı genotiplerde daha düşük düzeydedir. Sürgün büyümesi ise kontrol fidelerine göre % 27 ile % 10 arasında azalma göstermiştir. Tuzlu koşullarda yetişen fidelerde önemli ölçüde turgor kaybı gözlenmiştir. Tuz uygulaması altındaki fidelerin oransal su içeriği hassas genotiplerde % 21 oranında azalmıştır. Tuz stresi altında toplam klorofil içeriği önemli ölçüde azalmıştır. İncelenen tüm buğday genotipleri tuz stresi altında önemli miktarda prolin biriktirmiştir. Genotiplere göre değişmekle birlikte 200 mM NaCl konsantrasyonu fidelerin prolin içeriğini 10-20 katına kadar artırmıştır.
Hernandez ve Almansa (2002), Pisum sativum L. bitkisi ile yapmış oldukları çalışmada bezelye gelişimleri üzerine kısa periyotlarla tuz stresinin ve recoverinin (kurtarma mekanizması) etkilerini, bazı antioksidan enzimlerin su ile ilişkilerini araştırmışlardır. Yaprak gelişimi tuz ilavesiyle engellenmiş, ancak recoveri sırasında gelişimin tekrar düzenlendiğini tespit etmişlerdir.
Yaşar (2003) tarafından yapılan bir çalışmada 38 adet farklı patlıcan genotipinde tuza tolerans bakımından genotipler düzeyinde farklılıkların belirlenmesi, bu amaçla etkin seçim parametrelerin belirlenmesi ve patlıcanda antioksidan enzim aktiviteleri ile tuza tolerans yeteneği arasındaki ilişkiler incelenmiştir. Bitkilere 150 mM NaCl kullanılarak uygulanmıştır. Ön seçim aşamasında Na, K, Cl- iyon analizleri ile MDA ve klorofil ölçümleri sonucunda tuza toleranslı ve hassas genotipler belirlenerek in vivo ve in vitro koşullarda bitkiler SOD, CAT, GR ve APX enzim aktiviteleri bakımından
değerlendirilmiştir. Araştırma sonucunda enzim aktivitelerinin tuza tolerans üzerinde etkili olduğu, kallus dokularındaki, enzim aktivitelerinin in vivo koşullarda alınan sonuçlar ile uyumlu olduğu belirtilmiştir.
Cassia angustifolia (sinameki), fidelerine 0, 20, 50, 100 mM NaCl uygulaması 7 gün süreyle uygulanmış ve tuz stresinin büyüme parametreleri, hücre içi Na+
ve Cl -iyon konsantrasyonları, antioksidan sistem, lipid peroksidasyon, hidroksil ve prolin içeriği üzerine etkileri araştırılmıştır. Tuz uygulamaları bu parametrelerin tamamını etkilemiş ve bitki biyokütlesinde büyük bir azalmaya neden olmuştur. Kök ve gövde boyu, yaş ve kuru ağırlık, çimlenme yüzdesi NaCl uygulaması ile inhibe edilmiştir. Bu değişiklikler Na+
ve Cl- artışı, SOD, CAT, POX, polifenol oksidaz aktivitesindeki artıştan kaynaklanmaktadır. Enzim aktivitesinde artış gözlenirken H2O2 ve prolin içeriği
azalmıştır (Agarwal ve Pandley, 2004).
Pokkali ve IR-28 çeltik çeşitlerinin farklı tuz konsantrasyonları sonucu (0, 60, 120 mol /m-3) köklerinde meydana gelen enzim aktiviteleri (SOD, CAT, POX, APX, GR) ile prolin içeriği ve lipid peroksidasyon değişimlerinin incelendiği bir çalışmada, her iki çeşitte de artan tuz konsantrasyonu ile birlikte GR aktivitesinde azalma belirlenirken, toleranslı olan Pokkali çeşidinde CAT ve APX enzim aktivitelerinde artış meydana gelmiştir. POX aktivitesi toleranslı olan Pokkali çeşidinde azalma göstermiş ancak hassas olan IR-28 çeşidinde artan tuz konsantrasyonu ile birlikte artmıştır. Her iki çeşitte de SOD aktivitesi herhangi bir değişiklik göstermemiştir. Çalışmada MDA miktarının IR-28 çeşidinde daha yüksek olduğunu belirtirken, prolin miktarının da yine aynı çeşitte arttığı belirlenmiştir. Araştırıcılar, çeltikte antioksidatif sistemlerdeki artma kapasitesinin tuz stresine toleransı geliştirmede etkili olabileceğini ifade etmişlerdir (Demiral ve Türkan, 2004).
Azevedo Neto ve ark. (2006), tuza toleranslı BR5033 ve tuza hassas BR5011 mısır çeşitlerinin tuz stresinde yaprak ve köklerde antioksidatif enzim aktiviteleri ve lipid peroksidasyonunda meydana gelen değişimleri incelemişlerdir. Bitkiler tuz içermeyen kontrol ve 100 mM NaCl içeren tuz ortamlarında yetiştirilmiş, 25 gün süre ile tuz stresine maruz bırakılmıştır. Stres koşullarında her iki çeşide ait yaprak dokularında SOD, APX, GPX ve GR enzim aktivitelerinde kontrol bitkilerine göre artış meydana gelmiş, CAT enzim aktivitesinde meydana gelen değişim ise önemli bulunmamıştır. Ancak hassas BR5011 çeşidine ait bitkilerin yaprak dokularında CAT enzim aktivitesinde ilerleyen stres süresince azalma meydana gelmiştir. Çeşitlerin bitki