VARFARİN KULLANAN HASTALARDA
MEYDANA GELEN KOMPLİKASYONLARIN
DEMOGRAFİK ANALİZİ VE MORTALİTE
ÜZERİNE ETKİLİ FAKTÖRLER
(Retrospektif Çalışma)
Dr. Recep DURSUN (Uzmanlık Tezi)
Tez yöneticisi
Yrd. Doç Dr. Murat ORAK
İÇİNDEKİLER ÖNSÖZ SİMGELER VE KISALTMALAR 1. GİRİŞ VE AMAÇ 1 2. GENEL BİLGİLER 1-3 2.1. Hemostaz 3-5 2.1. 1 İntrensek yol 6-6 2.1. 2 Extrensek yol 6-7 2.1.3 Ortak yol 7-8 2.2. Antikuagülan ilaçlar 8-9 2.2.1. Heparin 9-11 2.2.2. Oral antikuagülanlar 11-12 2.3. Varfarin 12-13
2.3.1. Varfarin kullanım amaçları 13-14
2.3.2. Varfarinin etkileşim gösteren ilaçlar 14-15
2.3.3. Varfarin ile etkileşim gösteren besinler 15-16
2.3.4. Varfarinin kullanım şekli 16-17
2.3.5. Varfarinin kontreendikasyonları 17-18
2.3.6. Varfarinin yan etkileri 18-19
2.3.7. Varfarin yüksek dozunda tanı 19-20
2.3.8. PTZ INR etkileyen faktörler 20-23
2.3.9 Varfarin yüksek dozunda tedavi 23-27
2.4. Yeni oral antikuagülan ilaçlar 27-30
3. YÖNTEM VE GEREÇ 30-31 4. BULGULAR 31-38 5. MORTALİTE 38-42 6. TARTIŞMA 42-47 7. ÖZET 47-48 8. SUMMARY 48-49 9. KAYNAKLAR 49-55
ÖNSÖZ
“Acil Tıp Uzmanlığı” eğitimim süresince her türlü bilgi ve tecrübesinden yararlandığım, çalışmalarıma hoşgörülü, teşvik edici, eğitici ve öğretici kişiliği ile yön veren, hiçbir zaman
ilgi ve desteğini esirgemeyen, eğitimime önemli katkılar sağlayan Anabilim Dalı Başkanımız Sayın; Prof. Dr. Cahfer GÜLOĞLU’na, Sayın; Yrd. Doç.Dr. MuratORAK’a,
Sayın; Yrd. Doç.Dr. Mehmet ÜSTÜNDAĞ’a,
Acil kliniğinde birlikte çalıştığımız tüm asistan arkadaşlarıma, hemşire arkadaşlarıma ve diğer bütün klinik çalışanlarına,
Ayrıca beni bugünlere getiren sevgili Aileme, her zaman desteğini gördüğüm eşim Pınar ve kızım Ezgi Bahar’a,
Rotasyonlarım süresince bilgi ve tecrübelerini bizimle paylaşan değerli hocalarıma, diğer asistan arkadaşlarıma ve özellikle eğitimimde önemli katkıları bulunan hastalara teşekkür
ederim.
Dr. Recep DURSUN DĠYARBAKIR–2010
SİMGELER VE KISALTMALAR
DM: Diabetes mellitus ES: Eritrosit süspansiyonu GİS: Gastrointestinal sistem INR: International normalized ratio IV: Intravenöz
MCV: Mean corpuscular volum MI: Miyokard infarktüsü
PTZ: Protrombin zamanı SC: Subkütan
TDP: Taze donmuş plazma Vit KO: Vit K epoksite
VKA: Vitamin K antagonist ajan
P.C.C: Prothrombin complex concentrate İ.K.H:İskemik kalp hastalığı
SVO: Serebrovasküler olay PTE: Pulmoner tromboemboli DVT: Derin ven trombozu
KOAH: Kronik Obstriktif Akciğer Hastalığı KBY: Kronik Böbrek Yetmezliği
K.C.S:Karaciğer Sirozu İHD: İskemik Heart Disease VWF: von Willebrand faktörlerini OAT: Oral Antikoagülan tedavi
1.GİRİŞ VE AMAÇ
Varfarin tromboembolizm riskinin bulunduğu veya tromboembolik olayların meydana geldiği klinik durumlarda tedavi ve profilaksi amacıyla kullanılan antikoagülan bir ajandır (1). Başka ilaçlarla etkileşime girmesi, devamlı International Normalized Ratio düzeyi (INR) kontrolü ile doz ayarı gerektirmesi ve majör kanamalara neden olabilmesi Varfarinin kullanımını zorlaştırmaktadır (2).
Günümüzde en sık kullanılan oral antikoagülan olan varfarin, 1950‟li yıllarda klinik kullanıma girmiştir. Etkisini faktör 2, 7, 9, 10 üzerinden gösterir. Karaciğerde sentezlendiğinde inaktif olan bu faktörlerin aktif hale geçebilmeleri için glutamik asit rezidülerinin karboksillenmesi gerekir. Bu reaksiyonda K vitamini de kofaktördür. Epoksit redüktaz K vitaminini eski “redükte” haline dönüştürür (3). İyi planlanmış klinik çalışmalar, değişik klinik durumlar ve hastalıklarda antitrombotik etkinliğinin varolduğu gösterilen varfarin, etkisini epoksit redüktazı inhibe ederek gösterir (4).
Çalışmamızda amaç; Günümüzde en çok kullanılan oral antikoagülan olan varfarinin doz aşımı durumunda ciddi komplikasyonlar çıkmaktadır. Bu çalışmada. varfarin kullanan hastalarda meydana gelen komplikasyonların demografik analizi(varfarin yüksek dozuna bağlı kanamaların yaş, cinsiyet, başvuru şikâyeti, komorbit hastalık, eğitim düzeyi ile ilşkisi)ve mortalite üzerine etkili faktörler araştırılmıştır.
2.GENEL BİLGİLER
2.1.HEMOSTAZ
Hemostaz terimi yaralanmış bir damardan çıkan kanın durması için gerçekleşen olaylar dizisi sonucu kan kaybının önlenmesi anlamına gelir. Geçen yüzyılda Virchow tarafından tarif edilen hemostaz; vasküler sistemde kan akımı, hümoral faktörler ve hücresel elementler arasındaki dengenin sağlanması halidir (5).
Hemostazı primer ve sekonder olarak ikiye ayrılır.
Primer hemostaz; zedelenmeden sonra çok kısa süre içinde meydana gelir. Hasar gören damar duvarında trombositlerin aktivasyon, adhezyon ve agregasyonu ile trombosit tıkacının oluşumudur. Kapiller, arterioller ve venüller gibi ufak çaplı damarlardaki kanamanın durdurulmasında başrolü oynar.
Sekonder hemostaz ise; plazma koagülasyon sisteminin aktivasyonu ile başlar. Ardından pıhtılaşma faktörleri belirli bir sıra ile aktive olur, fibrin oluşumuyla da sona erer. Fibrin, primer hemostatik tıkacı güçlendirir ve damar çeperindeki defektin açılarak tekrar kanamasını önler. Bu reaksiyon büyük damarlar için önemlidir. Travmadan saatler ve günler sonra oluşabilecek kanamaları önlemede etkilidir (5,6).
Bir damar zedelendiğinde çeşitli mekanizmalarla hemostaz sağlanır. Bu mekanizmalar sırasıyla (5);
I. Damar spazmı
II. Trombosit tıkacı oluşumu
III. Kanın koagülasyonu sonucu pıhtı oluşumu
IV. Fibröz dokunun pıhtı içine büyümesi ile damardaki defektin kalıcı olarak kapatılmasıdır
Şekil1: Hemostaz mekanizması
Nature Clinical Practice Cardiovascular Medicine (2008) 5, 766-780. Damar Spazmı (Vazokontraksiyon)
Damar hasarından hemen sonra sinirsel refleksler, lokal miyojenik spazm ve hasarlanan dokular ile trombositlerden kaynaklanan lokal humoral faktörler sonucu damar duvarı kasılır. Ortaya çıkan bu lokal damar spazmı dakikalar ve hatta saatlerce sürebilir (5). Trombosit Tıkacı Oluşumu
Trombositler kemik iliğinde megakaryositlerin fragmantasyonu sonucu oluşan çekirdeksiz, disk şeklinde kan hücreleridir. Bu hücreler kontraktil olup birçok depo granül içerir. Alfa (α) granülleri; trombosit faktör 4, β tromboglobulin, PDGF (trombositten türeyen büyüme faktörü), fibrinojen, faktörV, von Willebrand faktörlerini(VWF) içerir. Dens granüller ise ATP, ADP ve serotonin içerir. Ayrıca trombositlerin lokal hormonlar olan ve bir çok damarsal ve diğer lokal doku reaksiyonlarını sağlayan prostaglandinleri sentezleyen enzim sistemleri de bulunur (5,7).
Trombositlerin hücre membranı da önemlidir. Trombosit yüzeyini kaplayan glikoprotein örtüsü, trombositlerin damar çeperinde hasarlanan alanlara ve açığa çıkan kollajene yapışmalarını sağlar (7).
I. Aktive edilen trombositlerin adezyonu II. Granül içeriklerinin salınması
III. Trombositlerin agregasyonu (6).
Normal koşullarda trombositler endoteldeki trombojenik olmayan etkenler nedeniyle damar duvarına yapışamazlar. Damarsal travma durumlarında antitrombotik devamlılık ortadan kalkar, trombositler subendotelyal dokularla temas ederek kollajen liflere yapışır ki bu da adhezyon olarak adlandırılır. Trombosit adhezyonu glikoprotein Ia ve IIa'dan oluşan kollajen reseptörler aracılığı ile olur. Adhezyonu takiben trombositler aktive olurak şekil değiştirir, pseudopod formasyonu oluşur. Ardından kontraktil proteinleri kasılarak çok sayıda aktif faktörler içeren granüllerin salınmasını sağlar. Trombosit granüllerindeki içerikler; trombositlerin aktivasyonu, agregasyonuna ve koagülasyon sisteminin aktivasyonuna yol açar. Bilinen birçok agregan ajan trombosit granüllerinin içeriklerinin salınmasına neden olur. Bunlar tromboksan A2, trombosit aktive edici faktör, serotonin, epinefrin, immün kompleksler ve fibrinojendir (5).
Trombosit membranı çeşitli reseptörler içerir. Bunlar trombin, 5 OH-triptamin, tromboksan A2 ve α adrenerjik reseptörlerdir. Ek olarak glikoproteinlerde reseptör gibi davranırlar. Örneğin; kollajen için GPIa/IIa, fibrinojen için GPIIb/IIIa, vWF için GPIb gibi (5). Adrenalin, kollajen, trombin kendilerine özgü reseptörleri aktive ederek fosfolipaz C ve fosfolipaz A2'yi uyarırlar (7). Fosfolipaz A2'nin etkisiyle araşidonik asit yapımı artar. Siklooksijenaz araşidonik asiti siklik endoperoksitlere (PGG2 ve PGH2'ye) ve tromboksan A2'ye çevirir. Bunlarda fosfonozitidazı aktive ederek hücre içi kalsiyum düzeyinin artmasına neden olurlar. Böylece protein kinaz C'yi aktive ederek bir dizi fosforilasyon reaksiyonu başlatırlar.
Membrandaki Ca kanallarından iyon girişini arttıran bazı faktörler de vardır. Kalsiyum kalmodülinle birleşir, bu komplekse bağımlı protein kinazı aktive eder. Trombosit içindeki aktomiyozin sistemi aktive olur, trombosit şeklini değiştirir ve granüller salınır (8). TXA2; trombositlerin aktivasyonu ve sekresyonunu stimüle eder. Araşidonik asitin metabolizması sonucu oluşan prostasiklin, cAMP düzeyini azaltarak trombosit aktivasyonunu inhibe eder (8). Trombositlerin aktivasyonunu takiben dens granüllerden kalsiyum, serotonin, ADP; α granüllerden ise çeşitli proteinler, vWF, fibronektin, trombospondin, PDGF, trombosit faktör 4 salınır. Salınan ADP aktive olduğunda GPIIb/IIIa kompleksi ile yakındaki trombositle hemostatik tıkaç oluşturmak için fibrinojen bağlanmasına neden olur (8,9).
Böylece, damarın zedelenen herhangi bir noktasında, hasara uğrayan damar duvarı gittikçe artan sayıda trombositin aktive olması ve bu aktiflenen trombositlerin de yeni trombositleri aktive etmesiyle gelişen bir kısır döngüyü başlatarak trombosit tıkacının oluşumunu sağlar ve primer hemostaz tamamlanmış olur (5).
Tablo1: Kanda pıhtılaşma reaksiyonlarının bileşenleri
Nature Clinical Practice Cardiovascular Medicine (2008) 5, 766-780.
Kan ve dokularda pıhtılaşmayı kolaylaştıran maddeler prokoagülan madde; pıhtılaşmayı inhibe edenler ise antikoagülan madde adı verilmektedir. Normal sağlıklı bir dolaşımda antikoagülan maddeler baskın olduğundan dolaşımda pıhtılaşma olayı görülmez. Ancak, bir damar zedelendiğinde hasarlanan alandaki prokoagülan maddeler aktive olarak antikoagülan maddeleri baskılar ve pıhtı oluşumunu sağlar (5).
Geçmişte pıhtılaşma mekanizmasının intrensek ve ekstrensek olmak üzere iki ayrı yol ile başladığı ve faktör Xa'nın oluşumu ile ortak bir yol izledikleri görüşü geçerli idi. Fakat son yıllarda bu iki yolun faktör Xa'nın oluşumundan önce birleştikleri görüşü kabul edilmiştir. Her iki yolda da bir seri plazma proteinleri önemli rol oynar. Bunlara pıhtılaşma faktörleri adı verilmiştir. Çoğunluğu proteolitik enzimlerin inaktif formlarıdır. Pıhtılaşma faktörlerinin önemli bir bölümü (F II, VII, IX, X, XI, XII ve prekallikrein) fonksiyonel bakımdan serin
proteazlarıdır. F V, F VIII ve doku faktörü enzimatik olmayan protein kofaktörüdür. F V trombosit içinde ve plazmada serbest olarak bulunur. Doku faktörü plazmada bulunmaz, damar çeperinde kan ile temas etmeyen subendotelyal hücrelerin membranı zedelendiğinde pıhtılaşmanın ilk tetikleyicisi olarak rol alır. Patolojik durumlarda endotoksin, TNF ve IL- 1'de doku faktörü üretimine neden olur (6,10).
2.1.1. İntrensek Yol
Koagülasyonun intrensek ya da kontak fazı; Hageman faktörü (FXII), yüksek moleküler ağırlıklı kininojen (HMWK) ve prekallikreinin kompleks oluşturmasıyla başlar (9,10). Bu kompleks laboratuar koşullarında cam ya da kaolin partikülleri ile oluşurken, fizyolojik ortamda kollajenden zengin subendotelyal dokuda oluşur (10). HMWK'nın etkisiyle Faktör XII yavaşça aktifleşir.
Aynı zamanda trombositler de kollajene yapışırlar ve trombosit faktör 3 denen lipoproteini içeren trombosit fosfolipidleri ortama salınırlar. F XIIa prekallikreini de kallikrine dönüştürür. Kallikrein de F XII'nin aktifleşmesinde rol oynar. FXIIa FXI'i enzimatik olarak aktive eder. Aktive faktör XI yine enzimatik etki ile faktör IX'u aktive eder. FXII, HMWK ve prekallikrein eksik bile olsa hemostaz gerçekleşmekte ve klinik olarak bir kanama olmaması FXI'in aktifleşmesi için alternatif bir mekanizmanın olduğunu göstermektedir (6,9).
2.1.2. Ekstrensek Yol
Bu yola doku faktörü fazı da denmektedir. Faktör VII'nin aktive edilmesiyle başlar. Travmatize dokudan doku faktörü ya da doku tromboplastini denen çeşitli maddeler salınır. Travmadan hemen sonra FVII, kalsiyum ve doku faktörü bir kompleks yapar. FVIIa faktör X'nu aktive eder.
Tablo2: Hemostaz mekanizması
Nature Clinical Practice Cardiovascular Medicine (2008) 5, 766-780.
2.1.3. Ortak Yol
Faktör X'nun aktivasyonu için ilk yol intrensek yolda kalsiyum ve lipid bağımlı kompleksin (FVIII, FIX ve FX'nu içerir) FIX'u FXIa yoluyla aktive etmesi ile başlar. Aktive faktör IX kofaktör VIII ile FX'nu aktive eder. İkinci yol yukarıda bahsedildiği gibi ekstrensek yoldaki doku faktörü-FVIIa kompleksinin FX'nu aktive etmesi şeklindedir. Üçüncü yol ise faktör IX ve faktör X'nun doku faktörü FVIIa kompleksi ile direk olarak aktive edilmesidir. Bu direkt aktivasyon intrensek ve ekstrensek koagülasyon yolları arasında önemli bir bağlantı sağlar (9,10).
Doku faktörü-Faktör VIIa kompleksinin faktör IX'u aktive ettiği son yıllarda kabul edilen bir görüş haline gelmiştir. Pıhtılaşma olayının devam ettirilmesinde bunun önemli olduğuna inanılmıştır (10). Faktör X'nun doku faktörü-faktör VIIa tarafından direkt
aktivasyonu koagülasyonun hızla başlamasına neden olur. Fakat hızlı başladığı gibi inhibitör enzimlerce de hızla inhibe edilirler (10). Aktive faktör IX ve doku faktörü-faktör VIIa trombin oluşumunu başlatırlar. Ortak yolda protrombin faktör X, kalsiyum ve fosfolipidler ile birlikte faktör V ile birleşerek protrombin aktivatörü denen bir kompleks oluşturur (5,10). Birkaç saniye içinde protrombin trombine parçalanır. Trombinin hemostazda önemli fonksiyonları vardır. En önemli özelliği fibrinojenin fibrine dönüşümünde rol oynamasıdır. Ayrıca faktör V, VIII ve XIII'ü aktive edebilir, trombosit agregasyonunu ve sekresyonunu stimüle edebilir. Yine trombomodüline bağlanarak antikoagülan protein C'yi aktive eder (10). Trombin proteolitik etkisiyle her bir fibrinojen molekülünden dört düşük molekül ağırlıklı peptidi ayırır ve diğer fibrin molekülleriyle kendiliğinden polimerize olma yeteneği taşıyan bir molekül olan fibrin monomeri oluşturur. Bunlar da fibrin iplikçiklerine polimerize olurlar. Polimerizasyonun ilk aşamasında fibrin monomer molekülleri zayıf nonkovalan hidrojen bağlarıyla bir arada tutulurlar. Bu yüzden oluşan pıhtı zayıftır ve kolayca çözünebilir. Fakat, pıhtı içinde tutulan trombositlerden salınan fibrin stabilize edici faktör adı verilen faktör XIII fibrin monomer molekülleri arasında kovalan bağlar ile komşu fibrin iplikçikleri arasında çapraz bağlar kurulmasını sağlar. Böylece fibrin ağının yapısı kuvvetlenir (5). Pıhtı lizisi ve damarın tamiri hemostatik tıkaç oluştuktan hemen sonra başlar. Fibrinolitik sistemin üç tane potansiyel aktivatörü vardır: Hageman faktör fragmanları, üriner plazminojen aktivatörü veya ürokinaz ve doku plazminojen aktivatörü. Doku plazminojen aktivatörü ve ürokinaz endotelyal hücrelerden diffüze olurlar ve plazminojeni plazmine çevirirler. Plazmin fibrin polimerlerini küçük parçalara ayırır. Bu parçalarda monositmakrofaj sistemi ile yok edilirler (5).
2.2.ANTİKOAGÜLAN İLAÇLAR
Bu grup ilaçlar heparin ve oral antikoagülanlar olarak iki grupta incelenebilir. 2.2.1.Heparin
Heparin 1916 yılında ilk kez karaciğerden elde edildiğinde bu ad verilmiştir. Kan pıhtılaşmasını in vivo ve in vitro olarak etkileyen bir maddedir. Organizmada hemen her organda bulunmakla birlikte en çok akciğerlerde bulunur. Sülfatlanmış polisakkarit karışımıdır. Mast hücrelerinin granülleri içinde oluşmaktadır. Bu hücrelerde heparin lipoprotein kompleksi halinde bulunmaktadır. Doğal preparatların kaynağı hayvan akciğer ve
Kimyasal yapısı kompleks polisakkarit olan heparinin molekül ağırlığı 5000 ile 30,000 Dalton arasında değişmektedir (kristalize halde). Yapısında çok sayıda sülfürik asit grupları bulundurur; bu nedenle güçlü asit özellikleri vardır ve elektriksel olarak negatif yüklü bir bileşiktir. Antikoagülan etkisinin bu özelliğinden kaynaklandığı düşünülmektedir.
Heparinin Etki Mekanizması
Heparin kanama zamanını değiştirmez ancak pıhtılaşma zamanını uzatır. Bu etkisini antitromboplastin aktivitesi ile gösterir(11). Antitrombin III (heparin ko-faktör) inaktif haldeyken, heparin etkisiyle aktifleşir ve hemen tüm pıhtılaşma faktörlerini inhibe ederek (özellikle faktör Xa) protrombinin trombine dönüşümünü engeller(12). Daha yüksek dozlarda trombini inaktive ederek fibrinojenin fibrine çevrilmesini de engeller. Heparinin trombin oluşumu üzerinde etkisi yoktur. Fibrin stabilize edici faktör olarak da bilinen faktör XIII‟ ün aktivasyonunu inhibe eder. Heparin fibrinolitik etkili değildir.
Heparinin Kullanım Endikasyonları
- Venöz trombozun, pulmoner tromboemboli ve periferik arteriyel embolinin profilaksi ve tedavisi
- Atriyal fibrilasyonda oluşan trombus, emboli ve inme tedavisi - Stabil olmayan angina ve akut miyokard infarktüsü (MI) - Protez kapaklar ve koroner arter cerrahisi
- Romatizmal kalp kapak hastalıkları - İskemik serebrovasküler hastalıklar
Heparinin Kullanılmaması Gereken Durumlar
- Heparine aşırı duyarlılık - Kontrol edilemeyen kanamalar - Ciddi trombositopenik olgular - Arteriyovenöz malformasyonlar - Malign tümörler
- Yakın zamanda geçirilmiş cerrahi, travma veya derin biyopsi - Kontrol edilemeyen hipertansiyon
- Aktif gastrointestinal sistem (GİS) ülserleri gibi kanama riski olan durumlar - Ağır böbrek ve karaciğer yetmezliği olan hastalarda kullanımı tartışmalıdır (12).
Heparinle tedavi gören hastalarda sık aralıklarla kanın pıhtılaşma süresi ölçülmektedir. Bu sürenin normal değerin üç katı kadar uzaması en uygun tedavi sınırıdır (11).
Heparinin önemli yan etkileri olmamasına karşın seyrek olarak cilt döküntüleri tarzında duyarlılık reaksiyonları bildirilmiştir. Heparin kullanımındaki başlıca tehlike yüksek dozdan kaynaklanabilecek kanamalardır (11). Özellikle kadınlar, yaşlı hastalar, aşırı alkol tüketenler, sürekli asetil salisilik asit (ASA) kullananlarda görülebilir. Bu durumun tedavisi için Toluidin Mavisi ve Protamin Sülfat kullanılabilir (11). Trombositopeniye yol açması, vazoplastik yanıt gelişmesi, aldosteron sentezini baskılayarak hiperkalemiye zemin hazırlaması {uzun tedavilerde potasyum (K+) takip edilmelidir}, daha çok intramüsküler (im) uygulamada izlenen, uygulama sonrası orta dereceli ağrı, hematom veya ülserasyon izlenmesi ve osteoporoz gibi yan etkileri de bulunmaktadır (12). Yüksek doz uygulamalarında osteoporoz gelişmektedir.
Heparinin antilipemik etkisi vardır. Damar endotelindeki protein lipazı aktive ederek (dolaşımdaki serbest yağ asitlerinin miktarını artırarak) lipoprotein düzeylerini azaltır; başka bir deyişle lipid seviyesini düşürür (11,12). Bir mililitre (ml) sitratlı koyun kanı üzerine % 1‟lik kalsiyum klorürden 0,2 mg eklendiğinde bir saatlik süre sonunda pıhtılaşmaya engel olan en küçük heparin miktarı “bir ünite heparin” olarak kabul edilir. Heparinin dozu tam kanda aktive edilmiş parsiyel tromboplastin zamanı ve aktive edilmiş pıhtılaşma zamanı ile takip edilmektedir.
Heparinin Emilimi, Metabolizma ve Atılımı
Heparin, gastrointestinal sistemde parçalandığından ağız yoluyla kullanılamamaktadır. im yoldan kullanıldığında emilim yavaş ve düzensizdir bu uygulamada kaslar arasında hematom oluşma riski söz konusudur ve bu uygulama kullanılmamaktadır. En iyi uygulanış yolu yan etki olasılığının düşük olması ve ilacı kontrol edebilme kolaylığı nedeniyle intravenöz (İV) yoldur (11). İv uygulamada etkisi hemen başlar ve doza bağımlı olarak sürer. Heparin dolaşıma katıldığında kan elemanları tarafından tutulmaz. Parenteral uygulama sonrası süratle damar endoteline ve retiküloendoteliyal sisteme (RES) geçer (11,12).
Heparin karaciğerdeki heparinaz aracılığıyla hidrolize edilerek etkisiz hale gelmektedir. Kanda heparinaz aktivitesi yoktur. Heparin, heparinaz ile üroheparine dönüşür ve idrarla atılır. Heparin yüksek dozda verildiğinde idrarda heparine rastlanmaktadır. Yüksek ateş, antihistaminik, tetrasiklin ve digital gibi ilaçların kullanımı heparinin antikoagülan etkisini azaltacağından bu durumlarda heparin dozunun artırılması gerekebilir. Heparin gebe
2.2.2.ORAL ANTİKOAGÜLANLAR
Tromboembolik olayların önlenmesi veya tedavisi için kullanılırlar. Ağızdan kullanım olanağı ve ucuz olmaları tercih nedenidir. Etkileri oral yoldan alındıktan 24 saat sonra ortaya çıktığı için acil yanıt beklendiğinde tercih edilmezler. Kumarin türevleri ve indandion türevleri olmak üzere iki grupta sınıflandırılır. Pıhtılaşma faktörlerinin fonksiyonlarını etkilemezler; ancak üretim basamaklarını bozarak gecikmeye sebep olurlar. Bu da etkilerinin ortaya çıkması için geçen süreyi açıklar (11,12).
İndandion Bileşikleri
Kimyasal yapıları kumarinden farklıdır ancak farmakolojik özellikleri benzerlik gösterir. Protrombin oluşumunu önleyerek etki gösterirler. K vitaminini antagonize ederler. Ağız yoluyla kullanılırlar. Bu bileşiklere karşı alerjik reaksiyonlar ve agranülositoz tarif edilmiştir. Fenindion, Difenadion, Anisidon bu bileşiklerdendir
Kumarin Türevleri
Kumarin bileşenleri arasında dikumarol, tromekzan, kumadin, siklokumarol sayılabilir. Sindirim sisteminden emilimleri yavaştır.
Kumarin Türevlerinin Farmakolojik Etkisi
Kumarin bileşikleri karaciğer hücresini etkileyerek, protrombin, faktör VII, faktör IX ve faktör X‟ un sentezini engelleyerek koagülasyonu önlerler(12,13). Kumarin bileşiklerinin etkileri protrombin zamanının değerlendirilmesiyle ölçülür. Etkisiyle hem protrombin zamanı hem aktive parsiyel tromboplastin zamanı uzamıştır. Ağızdan alınmasından 12 – 15 saat sonra protrombin zamanında uzama gözlenebilmektedir. Damar içi uygulama antikoagülan etkinin başlamasını hızlandırmaz.
Sistemik olarak kullanılan antikoagülanlar (12,13): 1- Acenocoumarol
2- Anisindione 3- Dicumarol 4- Varfarin
2.3.VARFARİN
Varfarin sodyumun kimyasal yapısı
Şekil2 : Kimyasal formülü C19 H15 NaO4 dir
Varfarin piyasada Coumadin®, Jantoven®, Marevan®,ve Waran® marka adlarıyla da bilinir. Kan pıhtısı oluşumunu, pıhtı şekillenmesini ve büyümesini engeller. Hidrokinonun aktif şeklinin oluşumundan sorumlu olan K vitamini epoksitinin redüksiyonunu, K vitamini epoksit redüktaz enzimini inhibe ederek engeller (11) Warfarinin etki süresi 2- 6 gün, yarılanma ömrü 37- 40 saattir. Ağızdan alındığında GİS‟ten süratle ve tam olarak emilir (11,12). Varfarin yaygın olarak kullanılmaktadır ve genellikle ömür boyu kullanımı söz konusudur.
2.3.1.Varfarin kullanım amaçları
Tablo3:Varfarin kullanım amaçları(4)
Varfarin kullanım amaçları
Atriyum fibrilasyonlu hastada rekürren sistemik embolizmin önlenimi
Kalp kapakçığı hastalığı olan hastalarda sistemik arteryel embolizmin önlenimi Venöz tromboembolizm primer ve sekonder profilaksisi(DVT,PTE)
Yüksek riskli hastalarda akut mıyokard infarktüsünün (MI) önlenimi Akut MI‟ lı hastada inme, rekürren MI, ve ölümleri azaltma
Tablo4:Oral antikoagülan endikasyonları ve hedef INR değerleri (14).
Endikasyon Hedef INR
Pulmoner emboli 2,5
Proksimal Derin Ven Trombozu 2,5
Ven trombozu ( baldır bölgesinde ) 2,5 Tekrarlayan Venöz Tromboemboli -
Varfarin kullanılmadığı sırada
2,5
Tekrarlayan Venöz Tromboemboli - Varfarin kullanımı sırasında
3,5
Semptomatik kalıtımsal trombofili 2,5
Antifosfolipid sendrom 2,5
Non-romatizmal atrial fibrilasyon 2,5 Romatizmal kalp hastalığı, konjenital kalp
hastalığı ve tirotoksikozis varlığında oluşan atrial fibrilasyon
2,5
Kardioversiyon 2,5 / 3,0
Mural trombus 2,5
Kardiyomyopati 2,5
Mekanik prostetik kalp kapağı – Aort 2,5 / 3,0 Mekanik prostetik kalp kapağı – Mitral 3,0 / 3,5
Biprostetik kapak Antikoagüle ise 2,5
Arteryal greft Antikoagüle ise 2,5
Koroner arter trombozu Antikoagüle ise 2,5
2.3.2.Varfarin ilaç etkileşimi
Tablo5: Varfarin ile etkileşen ilaçlardan bir kısım (15,16) A. Varfarin etkisini arttıran ilaçlar
Asetaminofen Flukonazol Kinidin Allopurinol Furosemid Kinin Amiodaron* Genfibrozil İtrakonazol Sulfonilure Sefalosiporinler (sefaklor*) Tetrasiklin Klofibrat Kinolonlar Amoksisilin* Kloksasilin* Prednizon* Anabolik steroidler İzoniazid Sulfinprezon Aspirin* (>1,5 g/G) Ketokonazol Tamoksifen Simetidin Metronidazol Tiroid hormonları Trisiklik antidepresanlar Disulfiram Propafenon Seratoninuptake inhibitorleri Ranitidin* Trimetop-sulfometaksazol* Heparin Eritromisin Propranolol Vitamin E Siklofosfamid Omeprazol Mikronase
B. Varfarin etkisini azaltan ilaçlar
Alkol Fenitoin* Rifampin Barbiturat Kolestiramin Sukralfat Karbamazepin* Griseofulvin Ostrojenler Vitamin K Fenobarbutal* Kortikositeroidler
2.3.3.Varfarin ile gıda etkileşimi (17)
Varfarin-gıda etkileşmesi üç değişik formda karşımıza çıkabilmektedir. Bunlar warfarin kullanan hastanın:
1. Çok yüksek oranda K vitamininden zengin diyetle beslenmesine bağlı gelişen kazanılmış, geçici warfarin rezistansı.
2. Yüksek oranda K vitamini diyetine bağlı düşük antikoagülan etki.
3. Düşük oranda K vitamini diyetine bağlı yüksek antikoagülan etki olarak sıralanabilir. Bu sınıflandırmada görüldüğü üzere varfarin gıda etkileşmesi tedavide ciddi sorunlar olarak karşımıza çıkabilir.
Koyu yeşil yapraklı bitkiler, örneğin; ıspanak, lahana, brokoli ve roka diyetle alınan K vitamininin temel kaynaklarıdır. Bu bitkilerin tazelikleri ve klorofil içerikleri K vitamini konsantrasyonları ile doğru orantılıdır. Ayrıca bitkinin yetiştiği bölgedeki yağış miktarı, güneş ışığı ve toprak yapısı bu oranları etkilemektedir. Buna karşın, bu doğal K vitamini kaynaklarını dondurmak, kaynatmak, buharda veya mikrodalgada pişirmek filakinon oranlarını değiştirmez(17).
Zeytin, soya fasülyesi ve kanola diğer doğal filakinon kaynaklarıdır. Bitkisel yağlardaki K vitamini güneş ışığı veya floresan ışıkta 48 saatte %50-95 oranında yıkıma uğrar. Salata sosları, margarinler ve mayonez gibi gıdalar eğer bunların yağlarından yapılmışlarsa bu gıdalarda filakinon açısından zenginleşebilir.(4) Buna karşın yer fıstığı, mısır, fındık, antep fıstığı ve ceviz filakinon içeriği açısından fakirdirler. Ayrıca patates, havuç, turp, soğan ve sarmısak gibi köklü bitkiler de filakinon oranları düşük gıdalardır.
Genel olarak süt ve süt ürünleri ile hayvansal gıdaların filakinon içerikleri azdır. Bunun yanı sıra K vitamininden zengin yağlarla işlem görmüş et ve yumurtalar (et terbiyesi, kızartma vs.) diyetle alınan K vitamini oranlarını artırabilirler(17).
2.3.4.Varfarin kullanım şekli
Başlangıç dozu 5- 10 mg dır (ilk iki gün için). Bu grup ilaçların farmakokinetik yanıtlarının çok değişken olması, dozun bireyselleştirilmesini gerektirir. Doz bireye özel olarak protrombin zamanı ve INR‟ ye bağlı olarak 2- 10 mg aralığında düzenlenir.
INR 8,0‟ in üzerindeyse yaygın kanamalar görülür. Spesifik antidotu fitomenadion (Vit K1 ), pıhtılaşma faktörleri (II, VII, IX, X) ve taze dondurulmuş plazmadır. Toksisitesi izlendiğinde varfarin tedavisi sonlandırılarak, vit K1 İV 0,5 mg (yavaş injeksiyon) veya
ağızdan 5 mg şeklinde uygulanır. Aynı zamanda yoğunlaştırılmış faktör II, VII, IX, X verilir. Titrasyon 50 IU/kg faktör IX olarak hazırlanır (IU=International Unit). Konsantre pıhtılaşma faktörleri hazırda olmadığında, taze dondurulmuş plazma infüzyonu yapılabilir. Sonuç alınamadığı durumda yüksek doz K vitamini önerilmektedir. Etkinin ortaya çıkması için birkaç saat geçmesi gerektiği ve yüksek doz K vitamininin antikoagülan etkiyi en az bir hafta önleyeceği unutulmamalıdır. Tedavi için uygun olan INR değerlerinde kanamalar izleniyorsa doz aşımı dışındaki nedenler araştırılmalıdır(12).
2.3.5.Varfarin kontre endikasyonları
Tablo 6:Varfarin kullanımının kontrendike olduğu durumlar(4)
Gebelik
Kanama eğilimi ve diskrazileri
Yeni operasyon veya yakın zamanda operasyona girecek olma - Santral sinir sistemi
- Göz
- Geniş yüzey açılımlı travmatik cerrahi
Kanamaya eğilim yapacak aktif ülser veya aşikâr kanama - Solunum sistemi, gastrointestinal, genitoüriner - Serebrovasküler hemoraji
- Anevrizma, diseksiyon
- Perikardit ve perikardial effüzyon - Bakteryal endokardit
Eklampsi / preeklampsi ile ilişkili düşük
Yaşlılık, alkolizm, psikoz ve benzeri nedenlerle gelişen bilinç durum değişikliği
Spinal ponksiyon ve diğer tanı – tedavi girişimleri Varfarin hassasiyeti
Kullanımının uygun olmadığı durumlar, arteriyel anevrizmalar, çeşitli organ ve sistemlerde yaygın kanamalar, yakın zamanda geçirilmiş operasyon ve karaciğer böbrek biyopsileri dahil olmak üzere ciddi yaralanmalar, ağır hipertansiyon, ağır peptik ülser, GİS ve üriner sistem tümörleri ile bakteriyel endokardit ve perikarditler olarak sayılabilir(12)
Tablo 7: Antikoagüle hastalarda spontan veya minimal travma ile oluşabilecek problemler (18)
Hemotoraks Hemoperitonyum
Kas hematomu, kompartman sendromuna da yol açabilir. Hemartroz
İzole ve multipl sinir palsileri -Karpal tünel sendromu
-Femoral sinir palsisi İntrakraniyal hematom Spinal ekstradural hematom Dalak rüptürü
2.3.6.VARFARİN YAN ETKİLERİ Varfarin sodyum potansiyel yan etkileri;
Ölümcül veya herhangi bir doku veya organ da nonfatal kanama. Bu antikoagülan etkisinin bir sonucudur. Semptomların şiddeti kanama bölgesine göre değişecektir. Hemorajik komplikasyonlar felç olarak ortaya çıkabilir; parestezi, baş ağrısı, göğüs, karın, eklem, kas veya diğer ağrı, baş dönmesi, nefes darlığı, zor nefes alma ve yutkunma; açıklanamayan şişme, halsizlik, hipotansiyon veya açıklanamayan şok. Bu nedenle kanama olasılığını açık bir tanı olduğu anlamına gelmez şikâyetleri ile herhangi antikoagüle hastanın durumuna değerlendirmede dikkate alınmalıdır(15).
Hematolojik
Gizli veya aşikâr kanama en sık görülen yan etkilerdir. Kanama komplikasyonu paralizi, parestezi, baş ağrısı, göğüs, karın, eklem, kas veya diğer ağrı, baş dönmesi, nefes darlığı, nefes darlığı ya da yutma olarak ortaya çıkabilir açıklanamayan şişlik, halsizlik, hipotansiyon, ya da açıklanamayan şok. Kanama hematom, melena, hematüri, ekimoz, burun kanaması da, neden olabilir ve hematemez. künt travma sonrası spontan intraspinal hematomlar, omurilik kanama, gastrointestinal kanama, intrakranial kanama, gözde kanama, batın içi kanama, hemopericardium, kompartman sendromu ve diğer ciddi kanama olayları rapor edilmiştir. Anemi nadiren bildirilmiştir. Hematolojik risk faktörleri inme öyküsü, ciddi bir komorbid durum, gastrointestinal kanama, atriyal fibrilasyon, ileri yaş öyküsü ve aspirinin birlikte kullanılması sayılabilir. Ayrıca, CYP450 2C9 genetik varyasyonlar ve VKORC1 enzimler olan hastalarda bu değişim olmayanlara göre kanama riski daha fazladır(12,16).
Dermatolojik
Deri ve diğer dokuların nekrozu gibi dermatolojik yan etkiler bildirilmiştir. Dermatit, ürtiker, alopesi, döküntü, büllöz döküntüler, kaşıntı ve solgunluk nadiren görülen diğer yanetkilerdir. Varfarin-deri nekrozu bağlı ağırlıklı olarak obez kadın (4 kat kadınlarda daha fazla görülmesi) ve etkiler genellikle tedavinin başlangıcında 10 gün içinde, ancak birkaç ay ya da tedaviye birkaç yıl sonra oluştu oluşur. Lezyonların çoğunluğu (% 80) uyluk, göğüsler, karın bölgesi, kalça gibi bol yağ olduğu bölgelerde meydana ve ekstremitelerde. Lezyonlar genellikle ağrılı, başlangıç, eritematöz, purpurik ani ve keskin sınırlıdır(8).
Kardiyovasküler
Kardiyovasküler yan etkileri belirti ve bulgular çeşitlidir. livedo reticularis mor ayak sendromu, döküntü, bacak, ayak ülseri, kas ağrısı ,hipertansiyon, serebral iskemi, omurilik enfarktüsü, pankreatit, belirtiler poliarteritis veya damar uzlaşma embolik tıkanıklığına bağlı diğer sekel simülasyonu. Hemopericardium ve kardiyak tamponadı da bildirilmiştir. Hipotansiyon,ödem, angina sendromu ve göğüs ağrısı nadiren bildirilmiştir(12). Karaciğer
Mide-bağırsak
En sık yan etkisi kanamadır. Özellikle aspirin veya antiplatelet tedavi alan hastalarda bu oran artmaktadır(4). Diğer GİS yan etkiler nadiren bildirilmiştir. Bulantı, ishal, karın kramp, kusma ve gaz / şişkinlik bildirilmiştir
Genitoüriner
Hematüri, renal hematom, diğer renal yan etkiler nadiren bildirilmiştir, akut böbrek yetmezliği interstisyel nefrit nedeniyle ve priapizm gibi semptomlar yapabilir(4).
Aşırı duyarlılık
anafilaktik reaksiyonlar dahil olmak üzere aşırı duyarlılık reaksiyonları nadiren bildirilmiştir. lökositoklastik kutanöz vaskülit olgusu bildirilmiştir(4).
Sinir sistemi
Sinir sistemi yan etkileri ender olarak bildirilmiştir. senkop, bilinç kaybı ve koma ateş, halsizlik, uyuşukluk, halsizlik, asteni, ağrı, baş ağrısı, baş dönmesi, tat almada, soğuk intoleransı, görülebilir (12).
Solunum
Solunum yan etkileri ender olarak bildirilmiştir. Hemoptizi, trakeal veya trakeobronşiyal duyarlılık yapabilir(12).
OkülerOküler yan etkiler subkonjonktival kanama ve retinal kanama, periorbital ekimoz görülebilir(12,16).
2.3.7.TANI
Varfarin yüksek dozunda tanı klinik ve laboratuar değerleri ile konur.Ancak çoğu hasta varfarin yüksek dozu olup herhangi bir klinik semptom vermeyebilir.Bu durumda laboratuar değerleri daha değerli olur
Labaratuvar değerleri
Varfarin yüksek dozunda en çok kullanılan test PTZ INR değerleridir.
Protrombin zamanı (PTZ) testi, koagülasyonun ekstrinsik yolunun incelenmesinde kullanılan bir testtir. Test, tek aşamalı Quick Metodu ile sitrat içeren plazma örneklerine tam doku tromboplastini (akciğer, beyin veya plasenta kaynaklı doku tromboplastini - fosfolipid
ekstraktı) ve kalsiyum eklenmesinden sonra, fibrin pıhtı oluşum süresinin ölçülmesi esasına dayanmaktadır. PZ, koagülasyon bozukluklarında, cerrahi girişim öncesi kanama riskinin belirlenmesinde ve bir karaciğer fonksiyon testi olarak kullanılmaktadır. Ayrıca, derin ven trombozu, kalp kapağı değişimi, pulmoner emboli, koroner tromboz veya diğer tromboembolik hastalıklarda ya da risk grubundaki hastalarda uygulanan oral antikoagülan tedavinin (OAT) takibinde sıklıkla kullanılmaktadır. Normal bir PZ, ekstrinsik yolda yer alan faktör II, V, VII, X ve fibrinojen düzeylerinin normal olduğunu gösterir. PZ, K vitaminine bağımlı 4 prokoagülandan 3‟üne (faktör II, VII, X) duyarlıdır. in vivo faktör VIIa-doku faktörü yolundaki önemli rolüne karşın, faktör IX düzeyi PZ test sonucunu etkilememektedir. Fibrinojen düzeyinin 100 mg/dL‟nin altında olduğu durumlarda ise PZ testi etkilenmektedir. Uygulanan oral antikoagülan ilacın etkin tedavi dozunu doğru belirlemek amacı ile tekrarlayan PZ ölçümleri gerçekleştirilmektedir. Bu nedenle, PZ testi üzerine etkili olan pek çok değişken, büyük önem taşımaktadır. Doğru sonuç, uygun örnek alımına, uygulanan test tekniklerine ve protokollerine bağlıdır(19).
PTZ testini etkileyen faktörler
PZ testini etkileyen en önemli değişken, reaktifte bulunan tromboplastindir. Ticari tromboplastinlerin varfarine olan duyarlılıkları farklı olduğundan, farklı tromboplastinler kullanılarak elde edilen sonuçların direkt karşılaştırılması karışıklığa neden olabilmektedir (19). Yüksek duyarlılıktaki tromboplastin reaktifleri (düşük International Sensitivity Index (ISI)‟li), düşük duyarlılıktakilere (yüksek ISI‟lı) oranla daha fazla bir uzamaya yol açarlar. Yani bir hasta, duyarlılığı düşük bir tromboplastin reaktifi ile 14 saniye ve duyarlılığı yüksek bir reaktifle 18 saniye gibi bir PZ değerine sahip olabilir. Bu nedenle düşük duyarlılıkta bir tromboplastinle izlenen bir hastaya, hatalı yoruma bağlı olarak, uygun PZ oranına ulaşmak için daha yüksek dozda warfarin uygulanacak olursa, kanama gibi istenmeyen sonuçlar ortaya çıkabilmektedir (20,21). Ancak, yakın zamanda geliştirilen rekombinant tromboplastinlerin duyarlılığı oldukça yüksek olup, PZ testinin doğruluğunu arttırmaktadırlar. Farklı tromboplastinler kullanılarak elde edilen PZ sonuçlarının karşılaştırılmasındaki güçlükler nedeni ile Dünya Sağlık Örgütü (WHO) 1977‟de tromboplastin için uluslararası bir referans preparatı (International Reference Preparation: IRP) oluşturmuştur. 1983 yılında ise, PZ standardizasyonu için Uluslararası Normalleştirilmiş Oran (International Normalized Ratio= INR) esasına dayanan bir model tanımlamıştır (22). Bu yöntemde PZ sonuçları INR olarak rapor edilmektedir. Teorik olarak INR, ISI değeri 1 olan WHO primer referans tromboplastini
yöntemle test tromboplastini ve uluslararası referans tromboplastin ile 60 stabil OAT gören hasta örneği ve 20 sağlıklı kontrol örneğinden elde edilen sonuçların karşılaştırılması ile belirlenmektedir (22). Sonuçların logaritmaları arasındaki lineer ilişkide eğim, test tromboplastininin ISI değeridir. INR değeri, aşağıdaki formül kullanılarak hesaplanabilir (21) INR = ( PZHasta / PZOrtalama Normal )
ISI Sonuçların INR şeklinde rapor edilmesi, farklı laboratuarlar, tromboplastinler ve cihazlar arasında karşılaştırılabilir hasta sonuçları elde edilebilmesini sağlamaktadır(23). ISI de_erleri 0.95 ile 3.0 arasında değişen tromboplastinler üretilse de hasta verileri hesaplanan INR değerleri aracılığıyla karşılaştırılabilmektedir. INR değerleri, OAT gören hastalarda dozun düzenlenmesinde önemlidir (22). INR sisteminde, özellikle ISI değerleri, yöntem, cihaz değişkenleri ve hesaplamadaki hatalar üzerinde durulmaktadır. ISI değerleri cihazlar tarafından belirgin şekilde değiştirilme potansiyeline sahiptir ve sonuç olarak geleneksel manuel yöntemle elde edilenlerle karşılaştırıldığında güvenilir olmayan INR değerleri ortaya çıkmaktadır (23,24). INR hesabında ISI değeri, üs olarak kullanıldığından bu değerdeki herhangi bir değişiklik veya hata, belirgin yanlış sonuçlara yol açabilmektedir. ISI değeri 1.0‟e ne kadar yakınsa INR değerleri o kadar doğrudur (25). Ayrıca, ISI değeri yükseldikçe, matematik olarak tekrarlanabilirliğin de o kadar kötü olacağı ileri sürülmektedir (26). ISI değeri 1.2‟nin altında olan tromboplastinlerle PZ ve PZ oranı aralığı geniş olduğundan, INR‟nin tekrarlanabilirliği iyidir. ISI değerleri belirgin olarak farklı olan reaktifler kullanıldığında farklı INR değerleri elde edilebildiğine ilişkin yayınlar bulunmaktadır( 27,28). Bu farklılıklar, OAT alan hastanın tedavisinde hatalara ve tromboz veya kanama gibi kötü sonuçlara yol açabilmektedir.
Sitrat Konsantrasyonu: Sitrat konsantrasyonu INR sonuçlarını etkilemekte olup, Farklı sitrat konsantrasyonlarına bağlı olarak PZ sonuçlarında ortaya çıkan farklılığın, anormal hasta sonuçlarında daha belirgin olduğu gösterilmiştir (29). Ayrıca, 1.0‟e yakın olan ISI değerlerinde, sitrat konsantrasyonuna cevabın arttığı bildirilmiştir (). Ancak, platelet agregometride, kriopresipitat kalite kontrolü gibi kan bankası testlerinde hala %3.8 sitrat kullanımı önerilmektedir (30).
Örnek Alımı: PZ için örnek alımı ve saklama koşulları hakkında henüz bir fikir birliği yoktur. Ancak alınan tüpün özelliği,saklama koşulları,santrifüj edilip edilmemesi sonucu etkilemektedir(31)
Cihaz Kullanımı
INR değerleri, kullanılan cihaza bağlı olarak da büyük oranda değişebilmektedir. Üretici firmaların cihaza özgü ISI değerleri ile ilgili rehberliği sınırlı olduğundan, her laboratuvar OAT etkisindeki INR değerlerini kendi belirlemelidir.
Cihaza özgü ISI değerlerini etkileyen değişkenler: sıcaklık, doğru pipetleme ve örneğe eklenen sitrat konsantrasyonudur (32). Birçok laboratuvar, farklı koagülasyon cihazlarının ISI değerlerini etkileyebileceğinin ve ISI değerlerindeki bu değişkenliğin OAT alan hastalarda klinik olarak anlamlı INR değişikliklerine yol açabileceğinin farkında değildir.
ISI’nın lokal kalibrasyonu:
Reaktif-cihaz test sistemleri arasındaki değişkenlik, her laboratuvarın kendi PZ/INR test sistemini kalibre etmesi gerekliliğini doğurmuştur. Kullanılan yöntemlerden biri, WHO protokolüdür(33).
Heparinin Etkisi:
Heparin, PZ/INR sonuçlarını olumsuz yönde etkilemektedir. Bu etki, tromboplastinin duyarlılığına, kullanılan reaktifte bir heparin nötralizanının varlığına ve konsantrasyonuna; ayrıca plazmadaki heparin konsantrasyonuna bağlıdır(34).
Lupus Antikoagülanının (LA) Etkisi:
LA, test sistemindeki fosfolipide bağlanarak, pıhtılaşma süresinde uzamaya yol açan bir antikordur (35). Serumlarında LA‟nı bulunan hastalar, venöz ve arteriyel tromboz gelişme riskine sahiptirler. Bu nedenle, bu hastaların çoğu varfarin ile tedavi edilmektedir ve OAT izlemi, seri PZ ölçümleri ile yapılmaktadır. Hematokrit düzeylerinin yüksek olduğu durumlarda, tüpteki antikoagülanın miktarı hematokrit değeri dikkate alınarak azaltılmalıdır. Bu şekilde bir düzenlemenin yapılmaması hatalı uzun PZ değerlerine yol açacaktır.
Sonuç olarak;
INR‟nin doğruluğu ve tekrarlanabilirliği PZ testine ve tromboplastinin ISI değerine bağlıdır. Cihazlar INR değerlerini büyük oranda etkilediğinden, reaktif/cihaz ikilisine özgü olmayan ISI değerleri hatalı sonuçlara neden olmaktadır. Bu nedenle üretici firmanın cihaza özgü ISI değerlerini sağlayamadığı durumlarda her laboratuvarın kendi lokal ISI kalibrasyonunu yapması büyük önem taşımaktadır. Ayrıca, sonuçların değerlendirilmesinde sitrat konsantrasyonu, örnek alımı ve saklama koşulları, heparin, LA, hastanın albumin ve
OAT‟nin PZ/INR sonuçları ile güvenilir izlemi için laboratuar uzmanlarına büyük sorumluluk düşmektedir.
2.3.8.VARFARİN YÜKSEK DOZUNDA TEDAVİ Vitamin-K
Pıhtılaşma faktörlerinden, Faktör (II, VII, IX, X) ve endojen antikoagülan protein C, S ve Z, karaciğerde, glutamat düzeyinde gama-karboksillenme ile fonksiyonel şekle dönüşür. İndirgenmiş K vitamini, bu dönüşümü sağlayan karboksilazın ko-enzimidir ve tepkime sonunda inaktif K vitamini epoksidine dönüşür. Bu inaktif form, epoksit redüktaz enzimiyle tekrar indirgenmiş K vitaminine dönüşerek aktive edilir(36,37,38). Kronik oral antikoagülan tedavi alan hastalarda, varfarinin metabolizması ve etki mekanizması nedeniyle diyetle alınan K vitamini önemlidir. Gıda içeriğindeki vitamin K oranına bağlı olarak INR seviyelerinde dalgalanmalar ortaya çıkabilmektedir. Daha da önemlisi, bu hastalarda hayatı tehdit edici kanama veya trombozlar görülebilmektedir.(38,39) Vitamin K1 olarak bilinen Phylloquinone‟un (filakinon) 1-10 mg/gün dozunda kullanımı varfarinin etkisini bloke eder
Şekil3: K vitamini siklusu ve beraberinde Vit K bağımlı koagülasyon proteinlerindeki glutamik asit rezidülerinin karboksilasyonu (39).
Genel olarak 2,0 – 3,0 aralığında tutulmaya çalışılan INR değerlerinin düzenli olarak takibi ile, tedavi komplikasyon riskini en aza indirmek uygun yaklaşım tarzıdır. Günümüzde, izlem sırasında saptanan yüksek INR değerlerine komplikasyonun riskine göre müdahale edilmekte
olup, doz atlama, tek başına ya da kombine olarak verilen K vitamini ve taze donmuş plazma tedavisi uygulanan yöntemlerdir (37).
Vitamin K1, vitamin K antagonist ajanın (VKA) etkisini geri döndürmek üzere de kullanılan sentetik ajan olup, subkütan (SC), intravenöz (IV), ya da oral olarak kullanımını sağlayan formları mevcuttur. Varfarin almakta iken, INR değeri olması gerekenden yüksek saptanan asemtomatik hastalarda; 1 mg‟ lık oral Vitamin K1, INR‟ yi 1 mg‟ lık subkütanöz uygulanan Vitamin K1‟ e göre daha hızlı düşürür. INR değeri 4,5 – 9 arası bulunan asemtomatik hastalarda kanama riskini düşürmek üzere 5 mg‟ lık oral Vitamin K1 önerilir (40,41). Gerileme, uygulama sonrası 16 saat içinde belirgindir. İkinci gün, terapötik düzeye kadar düşen INR düzeyi saptanır. Bununla beraber, subkütanöz uygulanan Vitamin K1 (1-2 mg), ölçülebilir değerlerdeki INR‟ yi sıklıkla 8 – 12 saat içinde geriletir (41). Ancak, gerek yapacağı etkinin önceden olanlarda yetersiz koagülasyon faktörü üretimi sebebiyle hem oral hemde parenteral uygulama etkinliği sağlamaz. Intravenöz Vitamin K1 ise, nadir fakat ciddi anafilâksi riski taşıdığından rutin uygulama yolu olarak önerilmez. Hayatı tehdit edici kanama varlığında tahmin edilememesi, gerekse bazen saptanan etki gecikmesi sebebiyle subkütan uygulanması önerilmez (40). Bunun yanında, biliyer tıkanıklığı olanlarda yetersiz emilim sebebiyle oral kullanılması tercih edilmezken, ciddi karaciğer yetmezliği veya INR değerinin çok yüksek olduğu durumlarda veyahut da intihar amaçlı olarak yüksek doz varfarin alındığı durumlarda tercih edilmelidir (40,41).
Tablo 8: VKA antidotu olarak Vitamin K1 tedavi önerisi (37).
INR KLİNİK DOZ TEK BAŞINA / İLAVE
>1,3 Hayati tehdit eden kanama
10 mg IV İlave tedavi
>1,3 Ciddi kanama 10 mg IV İlave tedavi
>9 Belirgin kanama yok 5-10 mg p.o Tek başına tedavi
Taze donmuş plazma
Taze donmuş plazma (TDP) bütün çözünür koagulasyon faktörleri ve plazma içerir. Yaklaşık hacmi 250 ml‟dir. Erimiş plazma 24 saat içinde transfüze edilmelidir. Genel başlangıç dozu 10–15 mL/kg. TDP‟nin klinik kullanım endikasyonları: (41)
1) Çok sayıda koagülasyon faktör eksikliği bulunan hastalarda kanama, operasyon öncesi veya massiv transfüzyon durumunda.
2) Varfarin tedavisi alan kanamalı veya invaziv girişim uygulanacak hastalara
3) Trombotik trombositopenik purpuralı hastalarda
4) Kojenital veya edinsel koagülasyon faktör eksikliklerinde faktör konsantrelerine ulaşılamıyorsa.
TDP volüm genişletmek, kardiyopulmoner baypas sonrası proflaksi veya nutrisyonel destek amaçlı verilmemelidir. Kriyopresipitat, tek ünite TDP‟nin +4 oC eritilmesi ile elde edilen kriyoglobulin fraksiyonudur. Kriyopresipitat fazla miktarda fibrinojen, von Willebrand Faktör (vWF), FVIII ve FXIII içerir. Sıklıkla hipofibrinojeneminin (< 100 mg/dL) düzeltilmesinde kullanılır. Plasma ürünlerinin transfüzyonu ABO uyumlu olmalıdır. Crossmatch ve Rh uygunluğu gerekmez. Kulanımdaki tek sıkıntı volüm yüklenmesi yapabileceğinden kalp yetmezliği ve hipertansiyonu olan hastalarda dikkatli olunmalıdır (16).
Yüksek INR değerlerini düşürmek, tekrar antikoagülasyon düşünülüyorsa, ya da hayatı tehdit edici kanama varken INR de hızlı ve güvenli düşüş isteniyorsa endikedir (22). TDP, tam kandan santrifüj yoluyla veya aferez yöntemiyle elde edilir. Plazma toplandıktan sonra 6- 8 saat içinde dondurulur. TDP, bütün çözünür koagulasyon faktörleri ve plazmayı içermekte olup, yaklaşık hacmi 250 ml‟dir. 24 saat içinde transfüze edilmesi gereken erimiş plazmanın genel başlangıç dozu 10-15 mL/kg‟dır. Acil servislerde varfarin yüksek dozuna bağlı kanamalarda vazgeçilmez olan ajan olan TDP, kan bankaların olmadığı yerlerde bulunması sıkıntı yaratmaktadır.
P.C.C (Prothrombin complex concentrate)
Her ne kadar son 10 yıda avrupa ülkelerinde sık kullanılan bir ajan olsa da ciddi trombotik etkilerinden dolayı Amerikada kullanımı sınırlıdır.donör plazmasından elde edilen pıhtılaşma faktörleri liyofilie edilerek ayrıştırılırak elde edilir.TDP aksine volüm yükleme riski,enfeksiyon bulaş riski daha azdır.içindeki komplekste ayrıca proteinC ve proteinS başta olmak üzere faktör 9-10 „dan zengindir (44).
Rekombinant faktör VIIa
Bu ajan tromboemboli yapma riski en fazla olan ajandır, doku faktörü trombini uyararak etki eder, trombini aktive eden tromboblastinin yüzeyindeki faktör X‟u aktifleştirir. Uygulaması 10-60 mcg/kg olup tek dozluk 1200 mcg formları vardır. Başta intrakraniyal kanama olmak üzere major kanamalarda tercih edilir (44).
Protamin Sülfat
Heparin antidotu olarak bilinir. 1mg protamin sülfat 100 ünite heparin etkisini antagonize eder. Yarılanma ömrü 2-3 saattir. Hipotansiyon yapabileceğinden parenteral yavaş infüzyon (5mg/dk) önerilir. Heparine bağlı kanamalarda önerilse de varfarine bağlı major kanamalarda ilaç yeni başlanmışsa tedaviye eklenebilir (44).
Tranexanic Asit (Transamin)
Daha çok fibrin pıhtı oluşumunu aktifler. antifibrinolitik etkilidir.özellikle ameliyat sonrası kanamalarda önerilir.major kanamalarda ek tedavi olarak kullanılabilir.(44).
Eritrosit ve trombosit süspansiyonu
Kanamalı hastalarda hemoglobin ve hematokrit değerleri düştüğünde eritrosit süspansiyonu; aspirin, clopidegrol, non steroid antienflamatuvar ilaçlara bağlı kanamalarda ise trombosit süspansiyonu önerilir.
2.4.YENİ ORAL ANTİKUAGÜLANLAR
İdeal bir antikoagülan ilacın hızlı etkili, potent, güvenli, kolay uygulanabilir, besin-ilaç etkileşimsiz ve uygun maliyetli olması ve tahmin edilebilir doz yanıt ilişkisi nedeniyle lab izlemi gerektirmemesi istenir. Olası bir kanama sorununda bir antidotunun bulunması arzu edilir. Günümüzde böyle bir ilaç mevcut değildir(45,46).
Varfarin oldukça potent bir ajan olmakla birlikte uygun dozun predikte edilememesi, sık INR izlemi gerekmesi, kanama riski ve hızlı etkili spesifik bir antidotun bulunmaması dezavantajlardır. Farmakogenomik çalışmalar daha uygun bir doz seçimini sağlayabilse de varfarin ile oral antikoagülasyon konusundaki sorunlar çoğunlukla devam etmektedir.
Yeni antikoagülan ilaçların geliştirilmesinde preklinik ve güvenlilik çalışmalarından sonra faz II ve III aşamalarda izlenen yol her zaman aşağıdaki gibi olmaktadır:
• Majör ortopedik cerrahilerde VTE önlenmesi
• Gelişmiş olan VTE‟nin tedavisi
• Atrial fibrillasyona bağlı arteriyel tromboembolizmin önlenmesi ve akut koroner sendromlarda kullanılması
Rivaroxiban
Direkt etkili, oral kullanılan faktör Xa inhibitörüdür. Hızlı etkili olduğundan, tedavi başlangıcında parenteral antikoagülan kullanmaya gerek yoktur. Yarı ömrü yaklaşık 6-9 saattir. Faz II çalışmalarda kalça ve diz cerrahisi geçirenlerde rivaroxaban en az enoxaparin kadar etkili bulunmuş ancak yüksek dozlarda daha fazla majör kanamalar izlenmiştir. Faz III RECORD çalışmalarında gene diz ve kalça cerrahisinde VTE proflaksisi için rivaroxaban enoxaparin ile kıyaslanmıştır. Her dört çalışmada rivaroxaban (cerrahiden sonra başlamak suretiyle günde bir kez oral yoldan) enoxaparin‟den daha etkili bulunmuş ve kanama riski kıyaslanabilir düzeyde saptanmıştır. VTE tedavisi ile ilgili faz II çalışmalarda rivaroxaban gene etkili bulunmuştur. Bu endikasyonda ve atrial fibrillasyona bağlı tromboembolizmin önlenmesinde rivaroxaban kullanımı ile ilgili faz III çalışmalar devam etmektedir(45).
Apixaban
Bir diğer direkt etkili oral faktör Xa inhibitörüdür. Ortopedik cerrahide VTE‟nin engellenmesi ile ilgili tamamlanmış olan faz III apixaban çalışmasının sonuçları olumludur. Hastanede yatan hastalarda VTE‟nin önlenmesi, VTE tedavisi ve atrial fibrillasyona bağlı inmenin engellenmesi ile ilgili devam eden faz III apixaban çalışmaları vardır (46).
Dabigatran
Direkt etkili oral trombin inhibitörüdür. Yüksek riskli ortopedik cerrahilerde VTE proflaksisi için etkili olduğunu gösteren faz II çalışmalardan sonra 3 faz III çalışma yapılmıştır. Sırasıyla diz ve kalça protezi cerrahilerinde VTE‟nin engellenmesi ile ilgili RE-MODEL ve RE-NOVATE çalışmalarında dabigatran enoxaparin kadar etkili ve kanama açısından güvenli bulunmuştur. Ancak diz replasmanı sırasında VTE‟nin engellenmesi ile ilgili, nispeten daha yüksek dozda enoxaparin kullanılan RE-MOBILIZE çalışmasında enoxaparin dabigatran‟dan üstün bulunmuştur. Atrial fibrillasyonda dabigatran kullanımı ile ilgili faz II çalışmalarda iyi sonuçlar elde edilmesini takiben RE-LY çalışması başlatılmıştır. VTE‟nin tedavisi ve sekonder proflaksisinde dabigatran ve varfarin‟i kıyaslayan RE-COVER ve RE-MEDY çalımaları planlanmıştır.(47)
Fondaparinux
Sentetik bir pentasakkarit olan ve haftada bir ciltaltı uygulanan idraparinux‟un VTE tedavisi, sekonder proflaksisi ve atrial fibrillasyonda etkili bir ajan olduğu gösterilmiş ancak varfarin‟den daha fazla kanama yaptığı görülmüştür. Bu nedenle biotinlenmiş (ve dolayısıyla kanama durumunda avidin ile nötralize edilebilecek) idraparinux ile çalışmalar devam etmektedir. Yeni antikoagülan ilaçlarla ilgili diğer sıkıntılar maliyet, uygun antidotlarının bulunmaması, terapötik aralıklarınhenüz belli olmaması ve hasta uyumunun izlemindeki zorluklar olacaktır (48).
Ximelogatran
Son birkaç yıl içinde sentetik bir oral trombin inhibitörü olan ximelogatran, tahmin edilebilir doz–etki ilişkisi olan ve buna bağlı olarak monitörizasyona gerek kalmaksızın sabit dozda verilebilen bir antikoagülan olarak geliştirilmiştir. Bu ajan yüksek riskli ortopedik cerrahilerde VTE proflaksisi için bazı Avrupa ülkelerinde ruhsatlanmış iken ve VTE tedavisi, sekonder proflaksisi ve atrial fibrillasyona bağlı arteriyel embolizmin Önlenmesinde varfarine alternatif olabileceği düşünülürken hepatik toksisite nedeniyle çalışmaları durdurulmuş ve piyasadan çekilmiştir(49).
Sonuç olarak, yakın gelecekte antikoagülan tedavi seçenekleri çeşitlenecektir. VTE proflaksisinde ve erken tedavisinde düşük molekül ağırlıklı heparin‟e alternatif yeni ilaçlar klinik kullanım için ruhsatlanmıştır. Ancak, antikoagülasyon ile ilgili karşılanamayan başlıca gereksinim olan uzun süreli antikoagülasyon için varfarin alternatifi ilaç geliştirme süreci henüz sonuçlanmamıştır(50). Bu konuda ileri faz klinik çalışmalar devam etmektedir. Varfarin alternatifi ilaçlar laboratuvar izlemi gerektirmeyecektir. Ancak kanama komplikasyonunun gene de izlenebilmesi ve maliyet sorunu başta olmak üzere bu ajanlar da kusursuz olmayacaklar
3.GEREÇ VE YÖNTEM
Çalışmamızda Eylül 2007- Eylül 2010 tarihleri arasında varfarin yüksek dozu nedeni ile Dicle Üniversitesi Tıp Fakültesi Hastanesi Acil servisimize başvuran hastalarımızın medikal kayıtları geriye dönük olarak incelendi. Çalışmaya alma kriterleri Tablo 9‟de belirtilmiştir. Çalışmaya dahil edilen olgular iki gruba ayrıldı. Grup 1,varfarin kullanımına bağlı INR değeri 3.5‟in üstü olup kanama komplikasyonu gelişen hastalar, Grup 2 ise varfarin kullanımına bağlı INR değeri 3.5‟in üstü olup herhangi bir kanama komplikasyonu gelişmeyen olarak belirlendi.
Tablo 9: Çalışmaya Alınma Kriterleri. 1- 18 yaş üstünde olma
2- Başvuru anına kadar varfarin kullanım öyküsü 3- INR değerinin > 3,5 olması
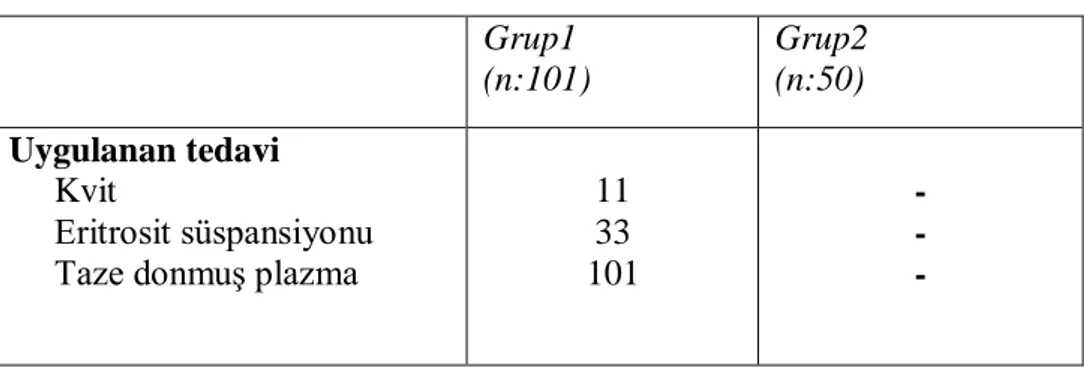
Çalışmaya alınan olguların hasta adı, dosya numarası, yaş, cinsiyet, şikayet, başvuru saati, başvuru mevsimi, varfarin kullanma nedeni, yandaş hastalık, hastanın eğitim düzeyi, laboratuar tetkikleri, hastanın yattığı klinik, yatış süresi, aldığı tedavi( eritrosit süspansiyonu (E.S.), Taze donmuş plazma(TDP) miktarı, K vitamini) ve sonuç önceden hazırlanan forma kaydedildi.
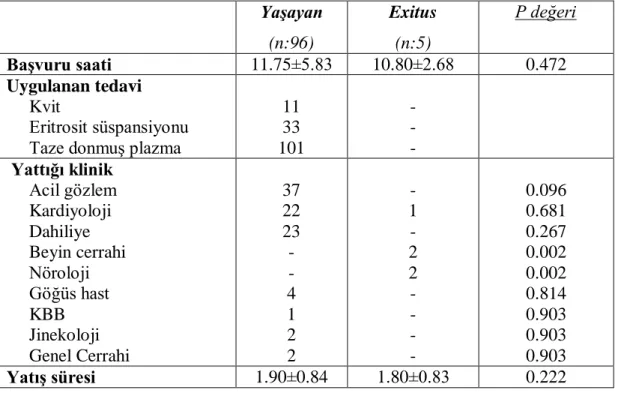
Grup 1‟deki hastalar ölen ve yaşayanlar diye istatistiksel olarak karşılaştırıldı.
Univariate analizler, kategorik değişkenler için ki-kare testi(χ2), sürekli değişkenler için student t testi kullanılarak yapıldı. Ortalama değerler Mean±Standart Deviation(SD) olarak hesaplandı. P<0,05 olması anlamlı kabul edildi. Çalışma değerlendirilmesi sürecinde “SPSS 11.5” programından destek alındı.
4.BULGULAR
Çalışmaya dâhil edilen 151 hastanın % 50.3 (n=76)‟sı erkek ve % 49.7 (n=75)‟i kadındı. Ortalama yaş tüm hastalar için 60.80±16.11.idi. Hastaların %66.89 Grup 1, %33.11 „i ise grup 2 idi. Grup 1‟in % 47.5 (n=48)‟i erkek, % 52.5 (n=53)‟i kadın ve ortalama yaş ise 59.97±16.13 idi. Grup 2‟nin ise %56 (n:28)‟sı erkek, %44 (n:22)‟ü kadın ve ortalama yaş ise 62.50±16.07 idi (Tablo 10). İstatistiksel olarak gruplar arasında cinsiyet ve yaş açısından anlamlı bir fark yoktu. Ortalama başvuru saati 11.75±5,34 bulundu. Bu oran, Grup1 için 11.70±5.71, Grup2 için 11.88±4.61 olarak belirlendi. Hastaların başvuru saati ile gruplar arasında istatistiksel olarak fark görülmedi
Tablo10:Hastaların yaş cinsiyet ve başvuru saatleri gösterilmektedir Grup1 (n:101) Grup2 (n:50) P değeri Yaş 59.97±16.13 62.50±16.07 0.803 Cinsiyet Erkek Kadın 48 28 53 22 0.210 Başvuru saati 11.70±5.71 11.88±4.61 0.030
Hastaların kronik hastalık mevcudiyetleri tablo11‟de gösterilmiştir. Varfarin yüksek dozu olarak takip edilen hastalarda en sık iskemik kalp hastalığı ek hastalık olarak görüldü. İskemik kalp hastalığı(İ.K.H) olan hastalar tüm hastaların%42.3(n:64)‟ünü oluştururken, grup1‟in %41.5 (n:42)‟i, grup2‟nin ise %44(n:22)‟ünü oluşturdu. Hastaların %18.5(n:24)‟nin herhangi bir ek hastalığı yoktu. Grup1‟in %20.7(n:21)‟si, Grup2‟nin ise%14(n:7)‟ünün ek hastalığı yoktu. Hipetansiyonu(HT) olan hastalar tüm hastaların %24.5(n:37)‟ini oluştururken, Grup1‟in %22.7(n:23)‟sinde, Grup2„nin ise %28(n:14)‟inde HT vardı. Serebrovasküler olay(SVO) geçirmiş hastalar tüm hastaların%1.3(n:2)‟ünü oluştururken, Grup1‟in %1.9(n:42)‟u SVO geçirmişken, Grup2 de ise SVO geçiren yoktu. Diabetes Melitus(DM) olan hastalar tüm hastaların%9.2(n:14)‟sini oluştururken, Grup1‟in%8.9(n:9)‟u, Grup2‟nin ise %0.1(n:5)‟i DM idi. Kronik böbrek yetmezliği(KBY) olan hastalar tüm hastaların %5.9(n:8)‟unu oluştururken, Grup1‟in %5.9(n:6)‟u Grup2‟nin ise %4(n:2)‟ü KBY idi. Kronik obstriktif akciğer hastalığı(KOAH) olan hastalar tüm hastaların %17.8(n:27)‟ini
oluştururken, Grup1‟in%15.8(n:16)‟i, Grup2‟nin ise %22 (n:11)‟si KOAH idi. Karaciğer sirozu(K.C.S) olan hastalar tüm hastaların %0.6(n:1)‟sını oluştururken Grup1‟in,%0.9(n:1)‟u K.C.S iken, Grup2 de ise K.C.S hastası yoktu. Malignitesi olan olan hastalar tüm hastaların %1.9(n:3)‟unu oluştururken, Grup1‟in %1.9(n:2)‟u, Grup2‟nin %2(n:1)‟sinin malignitesi vardı. Varfarin yüksek dozu nedeniyle komplikasyon gelişimi ile ek hastalık varlığı nedeni açısından istatistiksel olarak anlamlı bir fark bulunamadı.
.
Tablo11:Hastaların kronik hastalık mevcudiyeti göstermektedir Grup1 (n:101) % Grup2 (n:50) % P değeri Ek hastalık yok 21 20,7 7 14 0,378 I.K.H 42 41.5 22 44 0,861 KOAH 16 15,8 11 22 0,373 HT 23 22,7 14 28 0,548 DM 9 8,9 5 10 0,980 SVO 2 1,9 - 0 0,554 K.C.S 1 0,9 - 0 0,521 KBY 6 5,9 2 4 0,471 Malignite 2 1,9 1 2 0,704
Varfarin kullanım nedenleri tablo 11‟de gösterilmiştir. Hastaların en sık kullanım nedeni kapak replasmanı olup seçilen hastaların %35(n:53)‟ini oluşturuyordu. Grup1‟in %36.6(n:37)‟sı, Grup2‟nin ise %32(n:16)‟si kapak replasmanı nedeniyle varfarin kullanıyordu. Atriyal fibrilasyon(AF) olan hastalar tüm hastaların %28.4(n:43)‟ü idi. Grup1‟in %29.7 (n:43)‟si, Grup2‟nin %26(n:13)‟sı AF idi. Pulmoner tromboemboli ( PTE) olan hastalar tüm hastaların %19.8(n:30)‟i idi. Grup1‟in %16.8 (n:17)‟i, Grup2‟nin ise %26 (n:13)‟sı PTE idi. Derin ven trombozu(DVT) olan hastalar tüm hastaların %15.8 (n:24)‟i idi. Grup1‟in %16.8(n:17)‟i, Grup2‟nin ise %14(n:7)‟ü DVT idi. Serebrovasküler olay (SVO) geçiren hastalar tüm hastaların %3.3(n:5)‟ü idi. Grup1‟in %29(n:3)‟u, Grup2‟nin ise %4(n:2)‟ü SVO nedeniyle varfarin kullanıyordu. Varfarin kullanım nedenleri arasında
Tablo 12:Hastaların varfarin kullanma nedenleri görülmektedir Grup1 (n:101) Grup1 % Grup2 (n:50) Grup2 % P değeri Kapak Replasmanı 37 36.7 16 32 0.354 PTE 17 16,8 13 26 0.134 DVT 17 16,8 7 14 0.423 SVO 3 2,9 2 4 0.537 AF 30 29,8 13 26 0.392
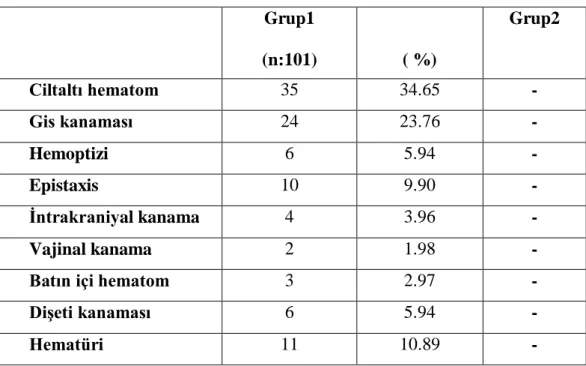
Hastaların başvuru anındaki şikâyetleri tablo13‟de gösterilmiştir. Olgular şikayetlere göre incelendiğinde; Grup2 de şikayet olmaz iken,Grup1 de en sık görülen şikayet cilt altı hematom olup tüm hastaların %23.1(n:35)‟i, kanamalı hastaların(Grup1) %34.6(n:35)‟sinde, ikinci sıklıkta gastrointestinal kanama(GİS) tüm hastaların %15,8(n:24)‟i olarak kanamalı hastaların(Grup1) %23.7 (n:24)‟sinde görüldü. Diğer şikayetler daha az olup kanamalı hastalar arasında; epistaxis %9.9(n:10)‟u, dişeti kanaması %5.9(n:6)‟u, hemoptizi %5.9(n:6)‟u intrakraniyal kanama %3.9(n:4)‟u, batın içi hematom %2.9(n:3)‟u, hematüri %10.8(n:11)‟i Grup1, vajinal kanama %1.9(n:2)‟u olarak görüldü.
.
Tablo 13: Hastaların başvuru şikâyeti görülmektedir. Grup1 (n:101) ( %) Grup2 Ciltaltı hematom 35 34.65 - Gis kanaması 24 23.76 - Hemoptizi 6 5.94 - Epistaxis 10 9.90 - İntrakraniyal kanama 4 3.96 - Vajinal kanama 2 1.98 -
Batın içi hematom 3 2.97 -
Dişeti kanaması 6 5.94 -
Hematüri 11 10.89 -
Kışın başvuran hastalar tüm hastaların %36.4(n:55)‟ü idi. Grup1‟in %29.7 (n:30)‟si, Grup2‟nin ise %50(n:25)‟si kışın başvurdu. İlkbaharda başvuran hastalar tüm hastaların %44.5(n:45)‟i iken, Grup1‟in %35.6(n:36)‟sı, Grup2‟nin ise %8.9(n:9)‟u ilkbaharda başvurdu. Yazın başvuran hastalar tüm hastaların %21.1(n:32)‟i iken, Grup1‟in %20.7(n:21)‟si, Grup2‟nin %22(n:11)‟si ise yazın başvurdu. Sonbaharda başvuran hastalar tüm hastaların %11.9(n:18)‟u iken, Grup1‟in%12.8(n:13)‟i, Grup2‟nin ise %10(n:5)‟u sonbaharda başvurdu. Grup1 de ilkbahar ve kış aylarında başvuru daha sık iken Grup2 de ise kış ve yaz aylarında daha sık olduğu tespit edildi. Ancak başvuru mevsimi açısından istatistiksel olarak fark yoktu
Tablo14: Olguların mevsimlere göre başvuru zamanları gösterilmiştir
Mevsim Grup1(n:101) % Grup2(50) % Genel(151) %
İlkbahar 36 35.8 9 8.9 45 29.8
Yaz 21 21.7 11 22 32 21.3
Sonbahar 13 12.8 5 10 18 12.4
Kış 30 29.7 25 50 55 36.5
Olguların Eğitim Düzeyi
Olgularımızın eğitim düzeyleri tablo 15‟da gösterilmiştir. Okuma yazma bilmeyen hastalar eğitimsiz grup olarak seçildi. Eğitimsiz olanlar tüm hastaların %60.9(n:92)‟u idi. Grup1‟in %61.5(n:62)‟i, Grup2‟nin ise %60(n:30)‟ı eğitimsiz idi. Sadece okuma yazma bilen ve okula gitmemiş hastalar okur yazar olarak seçildi. Okuryazar olan hastalar tüm hastaların %19.8(n:30)‟i idi.Grup1‟in %19.8(n:20)‟i, Grup2„nin ise %20(n:10)‟si okur yazar idi. İlkokul veya ortaokula gitmiş hastalar ilköğretim olarak seçildi. İlköğretim olanlar tüm hastaların %15.8(n:24)‟i idi. Grup1‟in %14.8(n:15)‟i, Grup2‟nin ise %18(n:9)‟i ilköğretim idi. Liseye gitmiş hastalar lise olarak seçildi. Lise grubundaki hastalalar tüm hastaların%3.3(n:5)‟ü idi. Grup1‟in %3.9(n:4)‟u, Grup2‟nin ise %2(n:1)‟si lise idi. Eğitim düzeyleri ve gruplar arasında istatistiksel bir fark görülmedi.
Tablo15:Hastalarımızın eğitim düzeyleri görülmektedir
Eğitim durumu Grup1
(n:101) % Grup2 (n:50) % P değeri Eğitimsiz 62 61.5 30 60 0.503 Okuryazar 20 19,8 10 20 0.569 İlköğretim 15 14,8 9 18 0.390 Lise 4 3,9 1 2 0.463