T.C.
SELÇUK ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ
YUMURTAYA VERİLEN BİSFENOL A ’NIN, TAVUKLARDA
TİMUSUN GELİŞİMİ VE PERİFER KAN ALFA NAFTİL
ASETAT ESTERAZ POZİTİF LENFOSİT ORANI ÜZERİNDEKİ
ETKİLERİNİN HİSTOLOJİK VE ENZİM HİSTOKİMYASAL
METODLARLA BELİRLENMESİ
Didem YILMAZ
YÜKSEK LİSANS TEZİ
HİSTOLOJİ VE EMBRİYOLOJİ (VET) ANABİLİM DALI
Danışman
Prof.Dr. Yasemin Öznurlu
T.C.
SELÇUK ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ
YUMURTAYA VERİLEN BİSFENOL A ’NIN, TAVUKLARDA
TİMUSUN GELİŞİMİ VE PERİFER KAN ALFA NAFTİL
ASETAT ESTERAZ POZİTİF LENFOSİT ORANI ÜZERİNDEKİ
ETKİLERİNİN HİSTOLOJİK VE ENZİM HİSTOKİMYASAL
METODLARLA BELİRLENMESİ
Didem YILMAZ
YÜKSEK LİSANS TEZİ
HİSTOLOJİ VE EMBRİYOLOJİ (VET) ANABİLİM DALI
Danışman
Prof.Dr. Yasemin Öznurlu
Bu araştırma Selçuk Üniversitesi Bilimsel Araştırma Projeleri Koordinatörlüğü tarafından 16202018proje numarası ile desteklenmiştir.
i ONAY
ii ÖNSÖZ
Sunulan bu çalışma ile dünyada yaygın olarak kullanılan endokrin bozucu kimyasallardan biri olan Bisfenol A' nınembriyonik dönemde kan ve timus dokusunda meydana getirdiği değişimlerin histolojik ve enzim histokimyasal yöntemler kullanılarak incelenmesi amaçlanmıştır.
Bu çalışma S.Ü. Veteriner Fakültesi Deney Hayvanları Üretim ve Araştırma Merkezi Etik Kurulu (SÜVDAMEK)' nun 29.01.2016 tarih ve 2016/10 sayılı etik kurul onayı alınarak gerçekleştirilmiştir
Çalışmanın gerçekleştirilmesinde ve yüksek lisans eğitimim boyunca, akademik bilgi ve deneyimleriyle büyük katkıları olan aynı zamanda değerli fikirleriyle bana yol gösteren ve her zaman destek olan Selçuk Üniversitesi Veteriner Fakültesi Histoloji ve Embriyoloji Öğretim Üyesi ve Danışmanım Prof. Dr. Yasemin Öznurlu’ya çok teşekkür ederim.
Yüksek lisans eğitimim süresince benden bilgi ve deneyimlerini esirgemeyen, tez çalışmam da bilgi ve deneyimlerinden faydalandığım başta Anabilim Dalı Başkanı Prof. Dr. Hasan Hüseyin DÖNMEZ olmak üzere, Anabilim Dalımız Öğretim Üyeleri Prof. Dr. İlhami ÇELİK, Prof. Dr. Emrah SUR, Prof. Dr. Murat BOYDAK, Doç. Dr. Tuğba ÖZAYDIN ve laboratuvar çalışmalarımda bana yardımcı olan Araş. Gör. İlknur ÜNDAĞ ile Araş. Gör. Banu KANDİL’e teşekkür ederim.
Eğitim hayatım boyunca benden maddi ve manevi desteklerini hiçbir zaman esirgemeyen değerli aileme çok teşekkür ederim.
iii İÇİNDEKİLER
SİMGELER VE KISALTMALAR ... iv
1.GİRİŞ ... 1
1.1.1.Bisfenol A’nın Fiziksel ve Kimyasal Özellikleri ... 2
1.1.2.Bisfenol A’nın Kullanım Alanları ... 3
1.1.4.Bisfenol A’nın Bozunma Mekanizması ... 5
1.1.5.BPA’nın Östrojenik Etkisi ... 5
1.1.6.BPA’nın İmmun Sistem Üzerine Etkileri ... 6
1.2.Kanatlılarda Timusun Histolojik Yapısı ve Embriyonal Gelişimi ... 7
1.2.1.Timusun Histolojik Yapısı ... 7
1.2.2.Timusun Embriyonik Gelişimi ... 10
1.2.3.Timusun İnvolüsyonu ... 10
1.3. Mast hücreleri ... 10
1.3.1. Timus Dokusunda Mast Hücreleri ... 12
1.4. Alfanaftil Asetat Esteraz (ANAE) Enzimi ... 13
2.MATERYAL METOT ... 14
2.1.Yumurtaya Enjekte Edilecek Solüsyonların Hazırlanması ... 14
2.1.1.Taşıt Maddenin Hazırlanması ... 14
2.1.2.Etken Maddenin Hazırlanması ... 14
2.1.3.Deney Gruplarının Oluşturulması ve Enjeksiyon İşlemleri ... 14
2.1.4.Yumurtaların Açılması ve Doku Örneklerinin Alınması ... 15
2.1.5.Enzimhistokimyasal Yöntemler ... 16
2.1.6.İstatistiki Analizler ... 17
3.BULGULAR ... 18
3.1.İnkübasyonun On Üçüncü Günü ... 18
3.2.İnkübasyonun On Sekizinci Günü ... 23
3.3.İnkübasyonun Yirmi Birinci Günü (Kuluçkadan Çıkış Günü) ... 27
3.4. Timus Dokusunda Mast Hücreleri ... 34
4.TARTIŞMA ... 39
5. SONUÇ VE ÖNERİLER ... 47
6.KAYNAKLAR ... 48
7. EKLER ... 58
EK-A: Etik Kurul Kararı ... 58
iv SİMGELER VE KISALTMALAR
ANAE: Alfa Naftil Asetat Esteraz BPA: Bisfenol A
CHEST: Tavuk Embriyotoksisitesi Belirleme Testi DMSO: Dimetilsülfoksid
ERα: Östrojen Reseptör alfa ERβ: Östrojen Reseptör beta g: gram
HCl: Hidro Klorik Asit IgE: Immünglobulin E kDa: kilodalton kg: kilogram L: litre mg: miligram μg: mikrogram μl: mikrolitre mL: mililitre
NaF: Sodyum Florid NaOH: Sodyum Hidroksit N: Normal
ng: Nanogram
PVC: Polivinil klorür TCR: T hücre reseptörü TNF: Tümör nekroz faktör
v ŞEKİLLER VE ÇİZELGELER LİSTESİ
Şekil 1.1.BPA’nın Fenol ve Asetondan Kondensasyonu Şekil 1. 2.Dünyada yıllık BPA üretimi
Şekil 1.3.Yaş gruplarına göre tahmini hesaplanan günlük BPA alımı
Şekil 3.1. İnkübasyonun on üçüncü gününde kontrol grubundan bir embriyoya ait timus dokusu kesiti.
Şekil 3.2.İnkübasyonun on üçüncü gününde kontrol grubundan bir embriyoya ait timus dokusu kesiti.
Şekil 3.3. İnkübasyonun on üçüncü gününde 50 µg/yumurta dozunda BPA' ya maruz bırakılan bir embriyoya ait timus dokusu kesiti.
Şekil 3.4. İnkübasyonun on üçüncü gününde 100 µg/yumurta dozunda BPA' ya maruz bırakılan bir embriyoya ait timus dokusu kesiti.
Şekil 3.5. İnkübasyonun on üçüncü gününde 250 µg/yumurta dozunda BPA' ya maruz bırakılan bir embriyoya ait timus dokusu kesiti
Şekil 3.6.İnkübasyonun on üçüncü gününde 50 µg/yumurta dozunda BPA' ya maruz bırakılan bir embriyoya ait timus dokusu kesiti.
Şekil 3.7. İnkübasyonun on üçüncü gününde kontrol grubundan bir embriyoya ait timus dokusu kesiti.
Şekil 3.8.İnkübasyonun on üçüncü gününde 50 µg/yumurta dozunda BPA’ya maruz bırakılan bir embriyoya ait timus dokusu kesiti
Şekil 3.9.İnkübasyonun on sekizinci gününde kontrol grubundan bir embriyoya ait timus dokusu kesiti.
Şekil 3.10.İnkübasyonun on sekizinci gününde 50 µg/yumurta dozunda BPA’ya maruz bırakılan bir embriyoya ait timus dokusu kesiti.
Şekil 3.11.İnkübasyonun on sekizinci gününde 100 µg/yumurta dozunda BPA’ya maruz bırakılan bir embriyoya ait timus dokusu kesiti.
Şekil 3.12.İnkübasyonun on sekizinci gününde 50 µg/yumurta dozunda BPA’ya maruz bırakılan bir embriyoya ait timus dokusu kesiti.
Şekil 3.13.İnkübasyonun on sekizinci gününde kontrol grubundan bir embriyoya ait timus dokusu kesiti.
Şekil 3.14.İnkübasyonun on sekizinci gününde 250 µg/yumurta dozunda BPA’ya maruz bırakılan bir embriyoya ait timus dokusu kesiti.
Şekil 3.15. Kuluçkadan çıkışın ilk gününde kontrol grubundan bir civcive ait timus dokusu kesiti.
vi Şekil 3.16.Kuluçkadan çıkışın ilk gününde 100 µg/yumurta dozunda BPA’ya maruz bırakılan bir embriyoya ait timus dokusu kesiti
Şekil 3.17. Kuluçkadan çıkışın ilk gününde 50 µg/yumurta dozunda BPA’ya maruz kalan bir civcive ait timus dokusu kesiti.
Şekil 3.18. Kuluçkadan çıkışın ilk gününde 100 µg/yumurta dozunda BPA’ya maruz bırakılan bir civcive ait timus dokusu kesiti.
Şekil 3.19. Kuluçkadan çıkışın ilk gününde 250 µg/yumurta dozunda BPA’ya maruz bırakılan bir civcive ait timus dokusu kesiti.
Şekil 3.20. Kuluçkadan çıkışın ilk gününde 250 µg/yumurta dozunda BPA’ya maruz bırakılan bir civcive ait timus dokusu kesiti.
Şekil 3.21.Kuluçkadan çıkışın ilk gününde kontrol grubundan bir civcive ait timus dokusu kesiti.
Şekil 3.22.Kuluçkadan çıkışın ilk gününde kontrol grubundan bir civcive ait timus dokusu kesiti.
Şekil 3.23. Kuluçkadan çıkışın ilk gününde 50 µg/yumurta dozunda BPA’ya maruz bırakılan bir civcive ait timus dokusu kesiti.
Şekil 3.24. Kuluçkadan çıkışın ilk gününde 100 µg/yumurta dozunda BPA’ya maruz bırakılan bir civcive ait timus dokusu kesiti.
Şekil 3.25.Kuluçkadan çıkışın ilk gününde 250 µg/yumurta dozunda BPA’ya maruz bırakılan bir civcive ait timus dokusu kesiti.
Şekil 3.26.Kuluçkadan çıkışın ilk gününde 250 µg/yumurta dozunda BPA’ya maruz bırakılan bir civcive ait timus dokusu kesiti.
Şekil 3.27.İnkübasyonun on üçüncü gününde 100 µg/yumurta dozunda BPA’ya maruz bırakılan bir civcive ait timus dokusu kesiti.
Şekil 3.28.Kuluçkadan çıkışın ilk gününde kontrol grubundan bir civcive ait timus dokusu kesiti.
Şekil 3.29. Kuluçkadan çıkışın ilk gününde taşıyıcı grubundan bir civcive ait timus dokusu kesiti.
Şekil 3.30. Kuluçkadan çıkışın ilk gününde taşıyıcı grubundan bir civcive ait timus dokusu kesiti.
Şekil 3.31. İnkübasyonun on sekizinci gününde 250 µg/yumurta dozunda BPA’ya maruz bırakılan bir civcive ait timus dokusu kesiti.
Şekil 3.32. Kuluçkadan çıkışın ilk gününde 50 µg/yumurta dozunda BPA’ya maruz bırakılan bir civcive ait timus dokusu kesiti.
Şekil 3.33. Kuluçkadan çıkışın ilk gününde 250 µg/yumurta dozunda BPA’ya maruz bırakılan bir civcive ait timus dokusu kesiti.
vii Çizelge 2.1. Çalışmada oluşturulan gruplar ve bu gruplardaki yumurtalara uygulanan işlemler.
Çizelge 3.1. Kuluçkadan çıkışın ilk günü (21. gün) kontrol grupları ve BPA verilen gruplarda ANAE pozitif lenfosit oranları (%).
Çizelge 3.2.Embriyonik dönemin on sekiz ve yirmi birinci günlerinde kontrol grupları ve deney gruplarına ait mast hücre sayısı.
viii ÖZET
T.C.
SELÇUK ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ
YUMURTAYA VERİLEN BİSFENOL A ’NIN, TAVUKLARDA TİMUSUN GELİŞİMİ VE PERİFER KAN ALFA NAFTİL ASETAT ESTERAZ POZİTİF LENFOSİT ORANI ÜZERİNDEKİ ETKİLERİNİN HİSTOLOJİK VE ENZİM
HİSTOKİMYASAL METODLARLA BELİRLENMESİ
Didem YILMAZ
Histoloji ve Embriyoloji (Vet) Anabilim Dalı YÜKSEK LİSANS TEZİ/ KONYA-2017
Bu çalışmanın amacı yumurtaya verilen Bisfenol A’nın, tavuklarda timusun gelişimi ve perifer kan alfa naftil asetat esteraz pozitif lenfosit oranı üzerindeki etkilerinin histolojik ve enzimhistokimyasal metodlar kullanarak belirlemektir.
Bu amaçla Isa Brown ırkı yumurtacı tavuklara ait 310 adet her biri 50-55 gr ağırlağında olan döllü yumurta kontrol, taşıyıcı kontrol, 50, 100, 250 μg/yumurta BPA olmak üzere 5 gruba ayrıldı. Test solüsyonları inkübasyondan önce yumurta sarısına enjekte edildi. Kuluçkanın 13, 18 ve 21. günlerinde her gruptan 10’ar adet yumurta açıldı ve elde edilen embriyolardan kan ve timus doku örnekleri alındı.
Kuluçkanın 13. 18. ve 21. günlerinde BPA uygulanan gruplarda kontrol grubuna göre timus dokusunun embriyonik gelişiminin geri olduğu tespit edildi. Aynı zamanda BPA verilen gruplarda lenfoid dokunun daha az hücre yoğunluğuna sahip olduğu ve ANAE pozitif lenfositlerin sayıca azaldığı dikkati çekti. Perifer kan ANAE pozitif lenfosit oranlarının da kontrol gruplarına göre BPA verilen gruplarda önemli oranda düştüğü tespit edildi (p<0.05). BPA'nın timus dokusundaki mast hücreleri üzerinde de olumsuz bir etkisinin olduğu, BPA verilen gruplarda mast hücre sayısında istatistiki açıdan önemli bir azalma olduğu dikkati çekti (p<0.05).
BPA' nın timusun embriyonik gelişimini baskıladığı, ANAE pozitif lenfosit oranında ve mast hücre sayısında düşüşlere yol açtığı tespit edilmiş ve bu nedenle etkilenen hayvanların immun sistem fonksiyonlarında önemli bozukluklara neden olabileceği, BPA kullanımı ile yapılacak yasal düzenlemelerin yeniden gözden geçirilmesi gerektiği sonucuna varılmıştır.
ix SUMMARY
REPUBLIC of TURKEY SELCUK UNIVERSITY HEALTH SCIENCES INSTITUTE
THE DETERMINATION OF EFFECTS OF IN OVO ADMINISTRATED BISPHENOL A ON THE DEVELOPMENT OF THYMUS AND
PROPORTION OF ALPHA-NAPHTHYL ACETATE ESTERASE ENZYME LYMPHOCYTE BY MEANS OF HISTOLOGICAL AND
ENZYMEHISTOCHEMICAL METHODS IN CHICKEN Didem YILMAZ
Department of Histology and Embryology (Vet)
MASTER THESIS/KONYA-2017
The aim of this study is to the determination of effects of in ovo administrated Bisphenol A on the development of thymus and proportion of alpha-naphthyl acetate esterase enzyme lymphocyte by means of histological and enzymehistochemical methods in chicken.
For this purpose, 310 fertile eggs of Isa Brown laying parent stock were divided into 5 groups as control, vehicle-vehicle-control, 50,100, and 250 μg/egg BPA. Test solutions were injected into yolk before incubation. At the 13th, 18th and 21th days of incubation, 10 eggs were opened from each group and blood and thymus tissue samples were taken from the obtained embryos.
On the 13th, 18th and 21th days of incubation, BPA-treated groups were found to be retarded embryonic development of thymus tissue compared to the control group. At the same time, in BPA-treated groups, lymphoid tissue had less cell density and the number of ANAE positive lymphocytes decreased. The percentage of peripheral blood ANAE positive lymphocytes was significantly lower in the BPA-treated groups than in the control groups (p <0.05). It was also noted that BPA had a negative effect on the mast cells in the thymus tissue and a significant decrease in mast cell count in the BPA-treated groups (p <0.05).
It has been found that BPA inhibits embryonic development of thymus, decreases ANAE positive lymphocyte rate and in mast cell counts. It was concluded that significant disturbances in the immune system function of the affected animals might be occured and regulation on the use of BPA should be revised.
Anahtar Sözcükler: ANAE, BPA, chicken embryo, thymus
1 1.GİRİŞ
Endokrin bozucu kimyasal maddeler spesifik reseptörlerle etkileşime girerek hormonların normal biyolojik aktivitelerini taklit eden ya da tam tersi etki gösteren doğal yada sentetik bileşiklerdir (Pisapia ve ark 2012, Liu ve ark 2014). Aynı zamanda bu kimyasal maddeler hormonların metabolizmasını etkileyebilecekleri gibi, hormon reseptör ekspresyonunu da değiştirebilmektedirler (Richter ve ark 2007). Endokrin bozucular, 1962’de biyolog Rachel Carson’un ‘Silent Spring’ isimli, pestisitlerin kuşlar üzerindeki zararlı etkilerini konu alan bir kitap yayınlamasıyla ilk olarak gündeme gelmiştir (Toker 2011).
Endokrin bozucu kimyasallara maruz kalma, mesleki maruziyetten anne karnındaki maruziyete kadar değişmektedir. Birçok endokrin bozucu kimyasal maddenin diğer birçok özellikleri yanında oldukça kararlı yapıları bu kimyasalları endüstri için uygun kılarken; son kullanımlarından yıllar sonra bile su, hava ve toprakta kalıntı bırakmalarına neden olmaktadır. Bu durumda canlıların bu maddelere maruz kalma süresi uzamaktadır (Clayton ve ark 2011). Bu kimyasal maddeler çoğunlukla gıda zincirine girmek suretiyle besinler yoluyla vücuda alınırlar. Kişisel bakım ürünleri, deterjanlar ve kozmetiklerin kullanımı sırasında deri yoluyla da bu maddelere maruz kalınabilmektedir. Ayrıca bu kimyasalların üretim endüstrisinde çalışan işçilerin bu bileşiklere maruz kalma riski çok daha yüksektir (Ergün 2013). Genel olarak bu bileşiklerin suda çözünebilirlikleri düşükken, yağda çözünebilirlikleri oldukça fazladır. Bu nedenle bu kimyasalların biyoakümülasyonu canlılarda yağ dokularında daha fazla olmaktadır (Sharpe 2001).
Endokrin bozucu kimyasal maddeye maruz kalınan dönem zararlı etkinin ortaya çıkışı açısından oldukça önemlidir. Bu kimyasal maddelere maruz kalan yetişkinlerde de önemli zararlı etkiler görülmekte birlikte, fötal dönemde ve yaşamın ilk yıllarındaki maruziyet canlının yaşamı boyunca çok daha ciddi etkilere yol açabilmektedir (Yeşilkaya 2008,Rogers ve ark 2013).
Endokrin bozucu maddelere maruz kalma durumunda erken veya geç ergenlik, sperm sayısında azalma, sperm kalitesinde azalma, üreme sistemi gelişim sorunları (kriptorşidizm, hipospadias), testesteron düzeyinde azalma, endometriyozis, vajen kanseri, meme kanseri, testis kanseri, prostat kanseri gibi hormonal ilişkili
2 kanserlerin görülme sıklığında artış olduğu belirtilmiştir. İntrauterin dönemde bu kimyasallara maruz kalmak, embriyo ve fetüs ölümlerine, düşük doğum ağırlığına ve çeşitli malformasyonlara yol açabilecektir. Ayrıca son yıllarda yapılan çalışmalara göre obezite, hiperaktivite ve öğrenme problemlerinin de günlük hayatta kullanımı oldukça artan endokrin bozucu kimyasal maddelerle ilişkili olabileceğini ifade etmektedir (Vos ve ark 2000, Çetinkaya 2009). Avrupa Birliği’nin 2002 yılında yayınladığı endokrin bozucular ile ilgili raporunda; bazı ilaçlar, dioksin ve dioksin benzeri bileşikler, poliklorlu bifeniller, bazı pestisitler, fitalatlar ve bisfenol A (BPA) gibi plastizer maddeleri de içeren 60 kimyasal maddenin çevre ve insan sağlığına zararı açık olarak belirtilmiştir (Durmaz ve Koçer Giray 2013).
1.1.Bisfenol A
Endokrin bozuculardan biri olan Bisfenol A (2,2-bis(4hydroxyphenly) propane, BPA), dünyada yaygın kullanım alanına sahip kimyasallardan biridir (Ballesteros-Gomez ve ark 2009). Üretim maliyeti düşük ve üretim süreci basit olan BPA 1950’li yıllardan itibaren polikarbonat plastik ve epoksi reçinelerin üretiminde kullanılmaktadır. BPA’nın toksik bir bileşik olduğu ve bebek biberonlarında kullanılmaması gerektiği ilk olarak 2010 yılında Kanada’da açıklanmış ve 2011 yılı itibariyle tüm Avrupa ülkelerinde BPA’nın bebek biberonlarında kullanımı yasaklanmıştır (Rogers ve ark 2013).Ülkemizde de Sağlık Bakanlığı Kararı ile 1 Haziran 2011 tarihinden itibaren BPA içeren bebek biberonlarının üretimi ve satışı yasaklanmıştır. Ancak halen birçok yiyecek ve içecek saklama kaplarının üretiminde bu kimyasal madde kullanılmaktadır (Durmaz ve Koçer Giray 2013).
1.1.1.Bisfenol A’nın Fiziksel ve Kimyasal Özellikleri
Bisfenol A ilk defa 1891’ de Rus kimyacı Aleksandr Dianin tarafından iki mol fenol ve bir mol asetonun düşük pH ve yüksek sıcaklıkta kondensasyonu ile sentezlenmiştir (Şişe 2011). 1930’lu yıllarda ise sentetik östrojen kaynağı araştırmalarında incelenmiştir (Krishnan ve ark 1993). Üretilen BPA’nın saflığı genel olarak %99-99,8 arasında olmaktadır (Prokop ve ark 2004).
3 Şekil 1.1. BPA’nın Fenol ve Asetondan Kondensasyonu (Ergün 2013).
BPA katı, fenolik kokulu, krem-beyaz renkte ve kristal yapıdadır. Etanol, aseton ve dimetilsülfoksid (DMSO) gibi çözücülerle iyi çözünmektedir. Sudaki çözünürlüğü 25 ’de 120 mg/L’dir. 25 ’deki yoğunluğu 1,1-1,2 g/L’dir (Tsai 2006).
1.1.2.Bisfenol A’nın Kullanım Alanları
Kullanım hacmi en yüksek olan kimyasallardan biri olan BPA’nın talep artışı sonucunda yıllık üretimi de giderek artmıştır (Gülnaz 2006, Dündar 2014). Bu kimyasalın dünyadaki üretim hacmi 1980’lerde yaklaşık bir milyon ton iken, 2009’da bu miktar 2,2 milyon tonun üzerine çıkmıştır (Taylor 2010). Bundan dolayı BPA’ya maruz kalma oranı da giderek artmıştır.
4 BPA'nın en fazla kullanıldığı alan %60’lık oranla polikarbonat plastik üretimidir. Bunu %26’lık oranla epoksi reçine üretimi takip etmektedir (Şişe 2011, Dündar 2014). Epoksi reçineler; yiyecek ve içecek kaplarının iç kaplamasında gıda ile temasının kesilmesi, bazı plastikleştirici maddelerde kimyasal antioksidan olarak, PVC’de ise katkı maddesi olarak kullanılırlar (Markey ve ark 2001,Lintelmann ve ark 2003).Paketleme uygulamalarında 7 çeşit plastik kullanılmaktadır. Geri dönüşüm kodu 1, 2, 4, 5 ve 6 olan plastikler polimerizasyon ya da paketleme formunda BPA içermemektedir. Geri dönüşüm kodu 3 olan plastiklerde BPA bulunabilir, geri dönüşüm kodu 7 olan plastikler “diğer” sınıf olarak adlandırılmış olup polikarbonat ve epoksi gibi malzemeleri içermektedir (Sevencan ve Vaizoğlu 2007).
1.1.3.BPA’nın Çevreyle Temas Yolları
BPA’nın yüksek üretim kapasitesi ve farklı kullanım alanlarına bakıldığında çevreye çok miktarda BPA yayılımı olduğu tahmin edilebilmektedir (Yıldız 2009). BPA’nın çevreye yayılması; üretim esnasında oluşan atıkların yeterince arıtılmadan yüzey suyuna verilmesi veya BPA depolarında meydana gelen kaçaklar ve taşımacılık sırasındaki kazalar sebebiyle gerçekleşmektedir (Staples ve ark 1998).Günümüzde endüstriyel, zirai veya başka amaçlarla kullanılan birçok organik kimyasal madde, işlevini gördükten sonra çoğunlukla kanalizasyon yoluyla su ortamlarına salınmaktadır (Şişe 2011). Plastik üreten endüstriyel fabrikalar ve çöp depolama alanlarından da önemli ölçüde BPA çevreye yayılmaktadır (Wang ve ark 2006).
BPA'ya maruz kalınan yollardan en önemlisi gıda yoluyla olmaktadır. Çünkü BPA kolaylıkla besin ambalajlarından besin içeriğine karışabilmektedir (Şise 2011).BPA normal koşullarda da polimerlerden gıdaya sızmakta ancak ısıtma, kaynatma gibi yüksek sıcaklığa maruz kalma durumunda gıdaya geçiş oranı büyük ölçüde artmaktadır (Braniste ve ark 2010). Ayrıca BPA’nın gıdaya geçiş oranı gıda ile ambalaj materyalinin temas yüzeyinin alanı ve süresi, ambalaj materyalinin fiziksel ve kimyasal özellikleri, gıda maddesinin agregat durumu, gıdanın yağlı, sulu, asitli olma durumu gibi özellikleri ve ürünün migragatlara olan ilgisi gibi faktörlere göre değişebilmektedir. BPA içeren kaplara mikrodalga ile pişirme gibi yüksek sıcaklık uygulandığında reçineler bozunmaya başlayarak ambalajdan gıdaya BPA geçişi daha yoğun ve hızlı olmaktadır (Dündar 2014). Kang ve ark (2003) yaptıkları
5 çalışmada konserve kutularına %5-10 sodyum klorid veya bitkisel yağ varlığında 121 ’de sıcaklık uygulandıklarında BPA geçişinin arttığını bildirmişlerdir (>10 ng/mL).
BPA plasenta bariyerini geçerek fötusa ulaşabilmektedir (Le Corre ve ark 2015). Bu nedenle canlılar intrauterin yaşamdan başlayarak ömürleri boyunca BPA ile karşılaşabilmektedirler (Chapin ve ark 2008).İnsanlarda oral yolla alınan BPA’nın emilim oranı konusunda çok az bilgi vardır. Fakat deri ile temas sonucunda %10’a yakın bir miktarda emilim olabileceği gösterilmiştir (Chapin ve ark 2008). Vücutta idrarda, kanda, yağ dokusunda, semende, anne sütünde, amniyotik sıvıda, plasenta ve fötusta, kolostrumda, umbikal kord kanında, tükürükte BPA bulanabileceği belirtilmiştir (Fernandez ve ark 2007,Chapin ve ark 2008, Li ve ark 2011).
Yaş grubu Günlük medyan BPA alımı
( g/kg/gün) Süt çocuğu (0-6 aylık) Mama Anne sütü 1-24 0.2-18 Süt çocuğu (6-12 ay) 1.65-13 Çocuk (1,5-6 yaş) 0.043-14,7 Yetişkin 0.008-1,5
Şekil 1.3.Yaş gruplarına göre tahmini hesaplanan günlük BPA alımı (Chapin ve ark 2008).
1.1.4.Bisfenol A’nın Bozunma Mekanizması
BPA biyodegradasyon ve fotodegradasyonla yıkıma uğramaktadır. Yüzeysel sularda, atık su arıtma tesislerinde ve biyolojik atık su sistemlerinde hızlı bir şekilde biyodegradasyona uğramakta iken sıvı çevrede fotooksidasyon veya fotoliz yoluyla bozunmaktadır. Saf suda fotodegradasyon daha yavaştır (Bahadır 2011).
1.1.5.BPA’nın Östrojenik Etkisi
Östrojenler steroid yapılı hormonlar olup, fonksiyonlarını dokularda bulunan iki reseptör ile yerine getirirler. Östrojen reseptörlerinin kemik dokusu, merkezi sinir
6 sistemi, kardiyovasküler sistem, immün sistem, ürogenital sistem, sindirim sistemi, böbrekler, karaciğer, akciğerler ve memede eksprese olduğu belirtilmiştir. Östrojen reseptörü alfa (ER α) daha çok uterus, meme dokusu ile embriyonik gelişimlerini devam ettiren dişi ve erkeklerin müller kanalında; östrojen reseptörü beta (ER β) ise immün sistem, merkezi sinir sistemi, sindirim sistemi, kardiyovasküler sistem, ürogenital sistem ve solunum sisteminin birçok doku ve organlarında eksprese edildiği bildirilmiştir (Meltzer ve Pfeiffer 2001).
Endokrin bozucu kimyasallar yapısal bakımdan hormonlarla benzerlik gösterdikleri için, hormon reseptörlerine bağlanabilmektedirler. Başka bir ifade ile yalancı bir hormon olarak faaliyet gösterebilmektedir. BPA östrojen reseptörleri için 17-beta estradiol’e göre daha düşük bir affiniteye sahiptir (Liu ve ark 2014). BPA hem ERα hem de ERβ’ya bağlanır fakat ERβ’ya 10 kat daha fazla affinite gösterdiği belirtilmektedir (Vandenberg ve ark 2010).
1.1.6.BPA’nın İmmun Sistem Üzerine Etkileri
Seks steroidlerinin immünomodulatör rolleri uzun süredir bilinmektedir. Seks hormonları timusta T lenfositlerin, kemik iliğinde B lenfositlerin farklılaşması ve maturasyonunu etkilemekte ve dalak ile timus ağırlığı, timik hormonların sekresyonu, sitokinlerin sekresyonu ve antikorların üretimi gibi çeşitli immün fonksiyonların homeostazına katılmaktadır (Sakazaki ve ark 2002). Endokrin sistem ve immün sistem arasındaki ilişki göz önüne alındığında BPA gibi endokrin bozucu kimyasal maddelerin immün sistem fonksiyonlarını da etkilemesi muhtemeldir (Clayton ve ark 2011). Nitekim endokrin bozucu kimyasalları içeren pestisistlere maruz kalan insanlarda CD4+CD8+lenfosit oranında artış, periferal kan mononükleer hücrelerin proliferasyonunda azalma, otoantikorların sıklığında artış gibi immünolojik değişiklikler gözlenmiştir (Rosenberg ve ark 1999, Straube ve ark 1999, Ahmed 2000, Clayton ve ark 2011).
Doğal östrojen’in timus ve kemik iliğinin morfolojisini bozduğu, T ve B lenfositler ile antijen sunan hücreleri apoptozisten koruduğu, doğal katil hücrelerin aktivitesini baskıladığı, serum ve dişi genital kanalda antikorların sentezini düzenlediği bildirilmiştir. BPA gibi östrojenik etkiye sahip endokrin bozucu kimyasalların benzer etkiler göstermesi muhtemeldir (Seaman ve ark 1978,Verthelyi ve Donner ve ark 1999, Ahmed 2000, Clayton ve ark 2011). Deney hayvanları ile
7 gerçekleştirilen laboratuvar çalışmaları göstermektedir ki BPA, IL-4 üretimi ve IgE düzeyinin artmasıyla alerji gelişimine yol açabilmektedir (Lee ve ark 2003, Chalubinski ve Kowalski 2006, Clayton ve ark 2011).
1.2.Kanatlılarda Timusun Histolojik Yapısı ve Embriyonal Gelişimi 1.2.1.Timusun Histolojik Yapısı
Timus, kanatlı ve memelilerde T-lenfositlerin olgunlaştığı primer bir lenfoid organdır. Kanatlılarda boyun bölgesinin her bir tarafında sulcus jugularis boyunca aralıklarla konumlanmış olan timus, oval şekilli yaklaşık 7-9 adet bağımsız lopdan oluşmaktadır. Boynun her iki tarafında da üçüncü boyun omuru hizasında başlar ve göğüs boşluğundaki tiroit bezinin yakınına kadar devam eder. Timus lopları, bağ dokudan oluşan bir kapsülle çevrilidir. Kapsülün dışı, gevşek bağ dokusu ile yağ dokusundan iç kısmı ise kollegen türdeki bağ doku iplikleri ve elastik ipliklerden oluşmaktadır (Hodges 1974). Kapsülden ayrılarak lopların içine giren ince bağ dokusu bölmeleri organı tam olmayan lopçuklara ayırır. Lopçuklar, kesitlerde koyu ve açık renkli olmak üzere iki farklı bölge olarak ayırt edilir. Koyu olan bölge korteks, açık renkli olan bölge ise organın medullasıdır (Tanyolaç 1999).
Kanatlılarda timus lopçuklarının medullalarında memelilerdeki gibi yuvarlak şekilli ve kornifiye durumdaki konsentrik lamellerden oluşan Hassal cisimciklerine oldukça az sayıda rastlanmaktadır (Sandıkçı ve Çelik 2000). Buna karşın kanatlılarda Hassal cisimciklerinin diffüz tipi olarak nitelendirilen ve retikulum hücrelerinin değişikliğe uğramalarıyla şekillenen kistik yapılar görülmektedir (Hodges 1974, Hoshimoto ve Sujimora 1976, Sandıkçı ve Çelik 2000). Bu yapıların oluşumu, medulladaki bazı retikulum hücrelerinin sitoplazmalarında küçük veziküllerin şekillenmesiyle başlamakta; birbirleriyle kaynaşan veziküller, hücrenin sitoplazmasını tamamen kaplayan iri ve yuvarlak vakuolleri oluşturmaktadır. Birkaç vakuolün birleşmesi sonucu oldukça iri vakuoller ve kistik yapılar oluşmaktadır. Bu yapıların lümenleri genellikle eozinofilik bir maddeyle dolu şekildedir. Kistlerin duvar yapısını ise epiteloid karakterdeki yassılaşmış ve uzamış retikulum hücreleri oluşturmaktadır. Bu morfolojik özellikleri sebebiyle kanatlı timusunun medulla kısımlarında çoğunlukla rastlanan ve diffüz Hassal cisimcikleri olarak da adlandırılan bu yapıların, dejenere olan retikulum hücrelerinden çok, lenfositlerin yıkımı esnasında şekillenen yapılar oldukları bildirilmektedir (Hodges 1974).
8 Organ kapsülünün altında, ektoderm kökenli, tek katlı ince bir epitel katmanı bulunur. Bu epitel, kapsülden timus parenşimine giren damarların etrafını dıştan sararak kan-timus bariyerini şekillendirir. Timustaki kapillar damarların çok kalın bazal laminası vardır özellikle proteinlerin geçişini önleyerek antijenlerin T lenfositlere ulaşmasını engeller. Kan-timus bariyeri gelişmekte olan lenfositleri antijen temasından koruyan fiziksel bir bariyerdir. T lenfositler ve kortikal kan damarlarının lümenleri arasındaki kan timus bariyeri komponentleri; damar duvarında endotel, bazal membran, perivasküler bağdoku; timus dokusuna ait olarak da Tip I retikulum hücreleri ve bu hücrelerin bazal membranından oluşmaktadır. Medulladaki kapillar damarlarda kan-timus bariyeri bulunmaz.
Kemik iliğinde bulunan bazı embriyonel pluripotent köken hücreler, bazı sitokinlerin uyarıcı etkisiyle gelişip, pre-T lenfosit haline farklılaşırlar (Diker 1994). Timusa gelen bu hücreler süratle çoğalıp gelişerek olgunlaşır (Diker 1994, Andersan 2001).Bu olgunlaşma timusun korteksinde başlar. Bu olgunlaşma aşamalarında bazı özelleşmiş yüzey molekülleri (TCR, CD) kazanarak antijenik uyarımlara cevap verebilecek bir özelliğe kavuşurlar. T lenfositler medullaya gelince özellikle CD’ler iki farklı özellik sergilerler. CD4+
,8- yapısını gösterenler yardımcı T lenfositleri CD4 -,8+ yapısını gösterenlerse baskılayıcı (sitotoksik) T lenfositleri oluştururlar (Akay 1994,Diker 1998). Bu farklılaşma antijenleri aynı zamanda bu iki lenfositi işlevsel olarak da birbirinden ayırır. T lenfositler timusta bu önemli özelliğin yanı sıra çok önemli bir fonksiyon daha kazanırlar. Bu özellik ise kendinden olan ile olmayan antijenik molekülleri ayırt edebilmeleridir.
Timusun korteksinde bulanan lenfositlerin (kortikal timositlerin) büyük kısmı küçük tip lenfositlerdir. Bununla birlikte kuluçkadan çıkışla birlikte ilk 5 hafta süresince CD4 (+) lenfositlerin korteks ve medullada aynı miktarda dağılım gösterdiği, 9. haftadan sonra bu hücrelerin korteksi terk edip çoğunlukla medullada yerleştikleri bildirilmektedir. CD8 (+) lenfositlerin ise kuluçkadan çıkıştan sonraki gelişim dönemlerinde genellikle çoğunlukla kortekste yerleştikleri ileri sürülmektedir (Khan ve ark 1988).
Hücresel homeostazis, self immünolojik toleransın sağlanması ve sitotoksik T hücrelerinin hedef hücreleri öldürmesinde apoptozis olayı görülmektedir. Self toleransın oluşması şu mekanizma ile sağlanır: embriyonel dönemde, immun
9 sistemin gelişmesi sırasında, T lenfositleri oluşturacak olan lenfoid sistem hücreleri ilk olarak kan yoluyla timusa gelirler. Bu hücrelerin proliferasyonu, diferensiyasyonları ve genlerinin regülasyonu timusta gerçekleşmektedir (Allen ve ark 1993). Timustaki gelişmesi sırasında lenfositler, spesifik bir yüzey antijeni olan TCR (T hücre reseptörü)’lerini rastgele gen düzenlemesi mekanizması ile kazanmaktadırlar. Bu rastgele düzenleme sonucunda, yabancı antijenlere spesifik T hücrelerinin yanında, hem self-MHC moleküllerini tanımayan T hücreleri, hem de self antijenlere spesifik T hücreleri oluşmaktadır. İmmun sisteme yararı açısından, yabancı antijenlere spesifik T hücrelerinin olgunlaştırılarak sekonder lenfoid organlara gönderilmesi gerekir. Ancak, self-MHC moleküllerini tanımayan, dolayısıyla vücuda hiçbir yararı olmayacak olan T hücreleri immun yanıtta kullanılmayacaktır. Diğer taraftan, self antijenlere spesifik lenfositler, eğer gelişirlerse, vücudun kendi antijenlerine karşı immun yanıt oluşturacaklar, bu da vücut için zararlı olacaktır (Abastado 1996). Bu nedenlerle vücuda yararlı olmayan ve zararlı olacak lenfositlerin ortadan kaldırılması gerekmektedir. Timusta böyle hücrelerin seçimi ve ortadan kaldırılması, ‘pozitif seleksiyon’ ve ‘negatif seleksiyon’ denen iki aşamalı bir işlemle gerçekleştirilmektedir.
Pozitif seleksiyon, timusa giren öncü T hücrelerinin self-MHC moleküllerini tanıyanlarının seleksiyonu ve bu hücrelerinin çoğalmalarının sağlanması işlemidir. Öncü T lenfositleri timusa girdikten sonra self-MHC moleküllerine sahip olan epitel hücreleriyle karşılaşırlar. Eğer öncü T hücreleri, epitel hücrelerinin self-MHC moleküllerini tanıyarak bunlara bağlanırlarsa, bu olay apoptozisin başlamasına engel olur. Böylece self-MHC moleküllerini tanıyan timositler gelişimlerini sürdürebilir (pozitif seleksiyon) (Kendal 1995, Klein ve ark 2011 ve 2014).
Negatif seleksiyon ise, pozitif seleksiyondan geçmiş ve TCR’leri oluşmuş timositlerin self antijenlere spesifik olanlarının seçilmesi işlemidir. Bunun için öncelikle, self antijenlerin timositlere sunulması gerekir. Bu işi de dendritik hücreler ve makrofajlar yapar. Vücudun tüm hücreleri için ortak olan self-antijenleri timusta bulunmaktadır. Vücudun timus dışındaki self antijenleri ise kan yoluyla timusa taşınır veya makrofajlar tarafından timusa getirilir. Antijen sunan hücreler self-antijenleri, MHC molekülleri ile birlikte timositlere sunarlar. Eğer rastgele genetik düzenleme sırasında bir T hücresi self-antijenlere spesifik TCR’lere sahip olursa; bu hücre self antijene bağlanır ve apoptozis mekanizması işlemeye başlar (negatif
10 seleksiyon). Timustaki seleksiyonlar sırasında seçilen hücrelerin apoptozisinde CD95’in önemli rolü vardır. Sonuçta olgunlaşan bir T hücresi, kendi MHC molekülleri yardımıyla sunulan antijenik şifreleri alırken; ait olduğu organizmanın kendi antijenlerine yanıt vermeyen hücre olarak kan yoluyla sekonder lenfoid organların belirli bölgelerine giderler (Kendal 1995, Öznurlu 1999, Klein ve ark 2011 ve 2014).
1.2.2.Timusun Embriyonik Gelişimi
Kanatlılarda timus taslağı 3. ve 4. yutak ceplerinin endoderminden gelişmektedir (Maskar 1976, Carlson 1981, Kelly ve ark 1984, Latshaw 1987). Endodermal epitelyum kökenli timus taslağına, lenfoid hücrelerin öncüllerini oluşturan iri bazofilik sitoplazmalı, pretimik kök hücreleri kan damarları aracılığıyla gelerek yerleşirler. Epitelyal hücreler, lenfoid hücrelerinin öncüllerinin diferensiye olmalarını sağlayacak şekilde bir araya gelerek bir ağ oluşturur (Bochman 1997). Kuluçkanın ilerleyen aşamalarında çoğalan hücre kümeleri boğumlanarak lopları şekillendirmeye başlar (Maskar 1976). Sandıkçı ve Çelik (2000) kuluçkanın 7. gününde organ taslağını oluşturan hücreler arasındaki iri bazofilik hücre sayısının arttığını, 10. günde küçük lopçukların oluşmaya başladığını, 13. günde ise korteks-medulla ayrımının yapılabildiğini bildirmişlerdir. Kuluçkanın 15 ile 18. günleri arasında ise kapsül bölgesinde ve lopçuklar arası bölgelerde hücresel ve ipliksel yapılarda artış olduğunu, organın gelişimini inkubasyonu takiben 9-11. günlerde tamamladığını bildirmişlerdir (Sandıkçı ve Çelik 2000, Sur ve Çelik 2005)
1.2.3.Timusun İnvolüsyonu
Kuluçkadan çıkışı takip eden ilk 17 hafta boyunca gelişimini sürdüren timus, ilerleyen haftalarda yavaş yavaş küçülmeye başlar. Dördüncü haftada medullada ortaya çıkan kistik yapılar da bu süreç içerisinde artarlar. On sekizinci haftada ise korteks hemen hemen tamamen ortadan kalkar ve devam eden sürede tamamıyla invole olarak yerinde küçük lenfoid doku odakları, yağ hücresi toplulukları ve dejenere retikulum hücresi toplulukları kalır (Hodges 1974, Sandıkçı ve Çelik 2000).
1.3. Mast hücreleri
Mast hücreleri, biyojenik aminler, nötr serin proteazlar ve sitokinler gibi mediatörler içeren çok sayıda büyük sitoplazmik granül ile karakterize, benzersiz
11
salgı hücreleridir ( Dvorak 1991,Crivellato ve ark 2005). Bu hücreler kan dolaşımına sahip bütün türlerde mevcut olan filogenetik olarak eski hücrelerdir. Mast hücreleri kemikiliğindekihematopoietik kök hücrelerinden farklılaşırlar, diferensiyasyonları ve olgunlaşmaları periferal dokularda gerçekleşmektedir. Bu olay büyüme faktörleri ve sitokinler gibi lokal mikro çevre faktörleri özellikle de c-kit ligand (kök hücre faktör) tarafından düzenlenmektedir (Gurish ve Austen 2001). Mast hücreleri hemen hemen vücudun tüm organ ve dokularında (memelilerde mineralize kemik, kıkırdak ve kornea gibi avasküler dokular hariç) özellikle kan damarları, lenfatik damarlar ve
sinirler gibi bağ doku yapılarıyla ilişkili olarak bulunmaktadır (Crivellato ve ark 2005). Bu stratejik yerleşiminden dolayı allerjen ve mikroorganizmalar gibi dış etkenli uyaranlara sıklıkla maruz kalırlar ve içerdikleri mediatörleri salgılarlar. Mast hücrelerinin doğal ve kazanılmış immunite, enfeksiyon, allerji, kardiyovasküler ve nöroljik hastalıklar, yara iyileşmesi ve otoimmun hastalıklarda önemli görevleri vardır (Benoist ve Mathis 2002, Erpek 2004). Mast hücrelerinde çeşitli uyaranlar ile açığa çıkan mediatörlerin bir kısmı (histamin, proteoglikan ve proteazlar) granüllerde daha önceden sentezlenip depolanmaktadırlar. Diğer bir kısmı ise IgE ve antijen gibi uyarımlar sonucunda sentezlenip hemen serbest bırakılırlar (araşidonik asit oksidasyon ürünleri). Üçüncü grup ise sitokin ve kimokinlerdir. Bu grupta bulunan TNF α hem önceden sentezlenip depolanır hem de aktive olan hücrelerde sentezlenir. Allerjik reaksiyonlar dışında otoimmun hastalıklar ve yangısel olaylarda mast hücresinin degranüle olması nadir olarak görülmektedir. Dvorakve ark (1994) mast hücrelerinin granül içeriklerinin granül membranlarının korunması suretiyle sitoplazmaya verdiklerini tespit etmişlerdir. Letourneau ve ark (2003) yaptıkları elektron mikroskopik bir çalışmada belirgin bir degranülasyon olmadan hücrenin granüllerinin elektron yoğun yapılarında belirgin değişiklikler olduğunu bildirmişlerdir. Bu şekildeki granülasyon"piecemealdegranülasyon" (PMD) olarak isimlendirilmiştir. Diğer bir granülasyon tipi "anafilaktikdegranülasyon"(AND) dur. Bu tip degranülasyonda ise granüller patlayarak içeriklerini boşaltmaktadırlar ( Erpek 2004, Crivellato ve ark 2005).
Mast hücrelerinin fenotipik olarak farklı alt populasyonlara sahip olduğu ve sadece türe özgü spesifiklik değil aynı zamanda bulunduğu bölgeye göre de heterojenite gösterdiği bilinmektedir. Rodentlerde, sekretorik granüllerinin boyanma özelliklerine göre mukozal (mucosal mast cell- MMC) ve bağ doku mast hücreleri
12
(connective tissue mast cell - CTMC) olmak üzere iki farklı fenotip tanımlanmıştır
(Enerback 1966). Benzer şekilde insanlarda mast hücreleri granüllerindeki proteaz içeriklerine göre sınıflandırılmıştır. MCT (Tryptase – pozitif, chymase- negatif)'
lertriptaz içerirler, solunum ve intestinal mukozada yerleşmişlerdir. MCTC (Tryptase – pozitif, chymase - pozitif)'ler ise hem triptaz hem de şimaz içermektedir. Bu hücreler çoğunlukla deri, mide ve bağırsak submukozası, miyokardium, lenf düğümü, konjktiva ve synovia gibi bağ doku bölgelerinde bulunmaktadır. Buradaki isimlendirme rodentlerdeki MMC ve CTMC’lerin analoğudur (Crivellato ve ark 2004 ve 2005, Karaca ve Yörük 2005).
Mast hücre granülleri içerdikleri glikozaminoglikanların asidik radikalleri nedeniyle toluidin mavisi, metilen mavisi, tiyonin vb.bazik boyalarla boyandıklarında boyaların renginde (mavi) değil de mor-kırmızı renkte (metakromazi) boyanırlar. Mast hücreleri ayrıca alcianblue, safranin, astrablue ve metilen mavisi ile de boyanmaktadır (Karaca ve Yörük 2005). Mast hücrelerinin boyanma özellikleri kullanılan tespit solusyonunun türüne göre değişmektedir. Tespit solüsyonu olarak Carnoy, Mota ve izotonik formol asetik asit (IFAA) kullanılmaktadır.
1.3.1. Timus Dokusunda Mast Hücreleri
Yapılan histokimyasal, immunositokimyasal ve ultrastrüktürel çalışmalar memelilerde, kanatlılarda ve amfibilerde timus dokusunda mast hücrelerinin varlığını göstermektedir (Bigaj ve ark 1991, Xu ve ark 1993, Crivellato ve ark 2005). Timustaki mast hücre lokalizasyonu türe göre organın gelişim evresi, organı etkileyen yaşlanma ve involüsyon süreçleri ve aynı zamanda patolojik durumlara bağlı olarak değişkenlik göstermektedir. Erişkin hayvanlarda mast hücreleri çoğunlukla kapsül ve interlobüler septumdaki bağ dokusunda lokalize iken (Kendal 1989), aynı zamanda da timik lobların içinde de yerleşim gösterdikleri bildirilmiştir. Bu bölgede mast hücrelerinin ya perivasküler alanlarda ya da lenfoid ve stromal hücreler arasında özellikle de peptiderjik sinirlere yakın olarak bulunduğu tespit edilmiştir (Lorton ve ark 1990, Muller ve Weihe 1991). Mast hücrelerinin timus dokusundaki yerleşimlerinin önemi üzerinde çok sayıda çalışma yapılmaktadır. Erişkin hayvanlarda intratimik mast hücrelerinin peptiderjik sinirlerle temasının nöroendokrin- immun bağlantı ile ilişkili olduğu ve nöroendokrin eksen üzerinde
13 manüplasyonları içeren deneysel çalışmaların organdaki mast hücre sayısındaki değişikliklere neden olduğu bildirilmiştir (Barbini ve ark 1981, Abou-Rabia ve Kendall 1994).
1.4. Alfanaftil Asetat Esteraz (ANAE) Enzimi
Lizozomal bir enzim olan ANAE, başta insan olmak üzere sığır, tavuk, köpek ve farede T lenfositlerin ayırımında kullanılmaktadır. Pratikte gerek doku kesitlerinde gerekse de perifer kan frotilerinde T lenfosit, B lenfosit ve monositlerin birbirinden ayırd edilmesinde kullanılan bu enzim, T lenfosit olgunlaşmasının ileri aşamalarında kazanılmaktadır ( Mueller ve ark 1975, Knowles ve Holck 1978, Sur ve Çelik 2005). ANAE pozitivitesi, lenfosit, monosit ve makrofajlarda farklı şekilde görülmektedir. İnsan perifer kan lenfositlerinde iki tip pozitivite tespit edilmiştir. İlki bir yada birkaç adet kırmızı-kahverengi granülden ibaret nokta tarzındaki T lenfositlere özgü olan pozitivite iken, ikincisi lenfosit morfolojisine sahip olan ve "NullCells" olarak da adlandırılan hücrelere ait ince granül tarzında pozitivitedir. Monosit ve maktofajlarda ise sitoplazmada diffüz ve güçlü bir pozitivite gözlenmektedir (Mueller ve ark 1975, Kajikawa ve ark 1983, Çelik ve ark 1991). Timus dokusunda yapılan çalışmalarda, timusun kortiko-medullar sınıra yakın bölgelerindeki medullar timositler pozitif reaksiyon verirken, kortekste lokalize olan timositlerin negatif reaksiyon verdiği tespit edilmiştir (Mueller ve ark 1975, Çelik ve Sur 2005).
Bu çalışmanın amacı döllü tavuk yumurtasına verilen üç farklı dozdaki BPA' nın embriyoların kan ve timus dokularının gelişimi üzerindeki olası etkilerinin histolojik ve enzim histokimyasal yöntemlerle belirlenmesidir.
14 2.MATERYAL METOT
Bu çalışma S.Ü. Veteriner Fakültesi Deney Hayvanları Üretim ve Araştırma Merkezi Etik Kurulu (SÜVDAMEK)' nun 29.01.2016 tarih ve 2016/10 sayılı etik kurul onayı alınarak gerçekleştirilmiştir (EK-A). Çalışmada Isa Brown ırkı yumurtacı tavuklara ait her biri 50-55 g ağırlığında olan 310 adet döllü tavuk yumurtası kullanılmıştır.
2.1.Yumurtaya Enjekte Edilecek Solüsyonların Hazırlanması 2.1.1.Taşıt Maddenin Hazırlanması
1gr lesitin (I.078.K.034.0010, Koza Gıda) 1.5mL diklormetilen (UN1593, VWR Chemicals) içerisinde çözdürülerek üzerine 10mL yerfıstığı yağı eklendikten sonra diklormetilenin uçmasını sağlamak için 60 ˚C' lik etüvde kapağı açık erlen içerisinde 1 gece bekletildi (Özaydın 2016).
2.1.2.Etken Maddenin Hazırlanması
Her bir doz grubu için kullanılacak olan Bisfenol A (MKBQ5209V, Sigma) hassas terazi ile tartılarak santrifüj tüpüne aktarıldı ve üzerine bir miktar ethanol eklenerek BPA' nın erimesi sağlandı. Ethanolde eritilen BPA' ların üzerine gruplardaki yumurta sayıları da dikkate alınarak 100 µl hacminde ve her bir yumurta için istenen miktarda BPA içerecek hacimde taşıt madde solüsyonu ilave edildi.
2.1.3.Deney Gruplarının Oluşturulması ve Enjeksiyon İşlemleri
Yumurtalar enjeksiyon işlemlerinden önce kapalı bir kabinde 21 g potasyum permanganat + 42 mL formaldehit/m3 karışımıyla elde edilen buharla 15 dakika dezenfekte edildi. Dezenfekte edilen yumurtalar rastgele seçilerek 5 gruba ayrıldı (Çizelge 2.1).
15 Çizelge 2.1. Çalışmada oluşturulan gruplar ve bu gruplardaki yumurtalara uygulanan işlemler.
Gruplar Yumurtalara uygulanan işlem Grup 1(Kontrol
grubu), n=45
Hiçbir işlem uygulanmadı.
Grup 2 (Taşıyıcı madde grubu), n=50
Propilen glikol, lesitin ve fıstık yağı karışımından oluşan 100 µl hacminde taşıyıcı solüsyon yumurta sarısına enjekte edildi.
Grup 3(50
µg/yumurta BPA), n=60
100 µl hacminde taşıyıcı madde içerisinde çözdürülmüş 50 µg/yumurta dozunda BPA yumurta sarısına enjekte edildi.
Grup 4(100 µg/yumurta BPA, n=70)
100 µl hacminde taşıyıcı madde içerisinde çözdürülmüş 100 µg/yumurta dozunda BPA yumurta sarısına enjekte edildi.
Grup 5(250
µg/yumurta BPA), n=85
100 µl hacminde taşıyıcı madde içerisinde çözdürülmüş 250 µg/yumurta dozunda BPA yumurta sarısına enjekte edildi.
Tüm enjeksiyonlar yumurta sarısına ve kuluçka başlangıcında gerçekleştirildi. Delikler özel yumurta delicisi ile yumurtanın yan tarafından açılarak steril insülin enjektörleri aracılığıyla test solüsyonları enjekte edildi ve takiben hemen sıvı parafinle kapatıldı.
Çalışmada BPA’nın düşük, orta ve yüksek (50, 100, 250 µg/yumurta) olmak üzere üç farklı dozu kullanılmıştır (Kandil 2016). Kuluçka işlemleri, S.Ü. Fen Fakültesi Biyoloji Bölümü Laboratuarında bulunan kuluçka makinesinde (Prodi HB 500S), optimal koşullarda (37.8ºC sıcaklık ve % 65 nispi nem) gerçekleştirildi.
2.1.4.Yumurtaların Açılması ve Doku Örneklerinin Alınması
Kuluçkanın 13, 18 ve 21.günlerinde her gruptan 10’ar adet yumurta açıldı ve elde edilen embriyolardan kan ve timus doku örnekleri alındı. Alınan kan örneklerinden 4 adet froti hazırlandı. Havada kurutulan frotiler ANAE enzimi demonstrasyonu ve May Grünwald-Giemza boyaması için -10 oC’deki
glutaraldehid-16 aseton tespit solüsyonunda (pH=4, 8) 3 dakika süreyle tespit edildi. Bu sürenin sonunda distile su ile 3 kez yıkanan frotilerden ikişer adedi, ANAE enzimi için hazırlanan inkübasyon solüsyonu içerisinde 37 oC’de 2 saat kontrollü bir şekilde
bekletildi ve ardından %1’lik methyl-green ile çekirdek boyası uygulandı. Kalan 2 froti ise May Grünwald-Giemza boyama metodu ile boyandı.
Timus dokusundan alınan örnekler 2 parçaya ayrıldı. Parçalardan birisi %10’luk tamponlu -formol salin (pH 7, 4) solüsyonunda tespit edilirken; ikinci parça ise ANAE enzim demonstrasyonu için 24 saat formol-sükroz (+4 o
C, pH 6,8) solüsyonunda tespit edildikten sonra 22 saat de Holt solüsyonunda (+4 o
C) bekletildi ve ANAE enzim demonstrasyonu yapıldı. %10 tamponlu formol salin solüsyonunda tespit edilen dokular rutin histolojik metotlarla takip edilerek parafinde bloklandı ve bloklardan alınan 6 μm kalınlığındaki kesitler ise Crossman’ın üçlü boyama metodu (Crossmon 1937) ve Toludun Blue boyama metodu (Demir 2001) ile boyandı.
2.1.5.Enzimhistokimyasal Yöntemler
Alfa naftil asetat esteraz (ANAE) enzimi demonstrasyonu için inkübasyon solüsyonunun hazırlanması: Bu amaçla pH’sı 5.0 olan tamponlu fosfat solüsyonunun 80 ml’sine 0.8 ml aseton (Merck) içerisinde eritilen 20 mg substrat (alpha-naphthyl acetate, N–8505-Sigma) yavaş bir şekilde damlatıldı. Ardından 2.4 ml %4’lük sodyum nitrit (S–3421, Merck) solüsyonu ile 2.4 ml pararozanilin (P– 3750, Merck) (1 gr pararozanilin, 20 ml distile su, 5 ml konsantre HCl) solüsyonunun 2 dakika süreyle bekletilmesi sonucunda elde edilen 4.8 ml hekzazotize edilmiş pararozanilin karışımı, substrat içeren tamponlu fosfat solüsyonuna eklendikten sonra hazırlanan solüsyonun pH’sı 1N NaOH solüsyonu ile 5.8’e ayarlandı. Hazırlanan inkübasyon solüsyonu içerisindeki preperatlarda oda sıcaklığında kontrollü bir şekilde bekletildi. Kırmızı-kahverengi granüllerin ortaya çıkmasının ardından birkaç kez distile su ile yıkanan preparatlara %1’lik methyl-green ile çekirdek boyası uygulandı.
Enzim demonstrasyonu yapılan kan preparatlarının her birinde toplam 200 adet lenfosit sayılarak ANAE (+) lenfosit oranları belirlenirken, timus dokusunda ise T lenfositlerin dokudaki yerleşimleri belirlendi.
17 Parafinde bloklanan kesitlerden hazırlanan preparatlarda ise organın embriyonik gelişimi histolojik yöntemlerle değerlendirildi. Mast hücre sayımı ise rastgele seçilen 10.000 µm2
'lik 10 farklı bölgede gerçekleştirildi. Tüm preparatlar DFC–320 model kamera ataçmanı olan Leica DM–2500 model ışık mikroskobu ile incelendi ve daha sonra gerekli bölgelerin dijital görüntüleri kaydedildi.
2.1.6.İstatistiki Analizler
Elde edilen veriler SPSS 10.0 programı yardımıyla analiz edildi. Kan sayımı sonuçları Açı (Arc Sinus) transformasyon metodu kullanılarak analiz edildikten sonra tek yönlü varyans analizi yapıldı. Mast hücre sayımları içinOne-Way Anova testi (tek yönlü varyans analizi) ve ardından çoklu karşılaştırma testlerinden DUNCAN testiyle analiz edilerek grupların ortalama değerleri arasındaki farkların önem dereceleri belirlendi.
18 3.BULGULAR
3.1.İnkübasyonun On Üçüncü Günü
İnkübasyonun 13.gününde timus dokusunun embriyonun boyun bölgesinin her iki tarafında sulcus jugularis boyunca vena jugularis’e paralel yerleşim gösterdiği görüldü. BPA verilen gruplardaki embriyolarda Hamburger Hamilton skalasına göre belirgin bir gelişme geriliği dikkati çekerken, timusun da bu gelişme geriliğine paralel olarak küçüldüğü tespit edildi.
Kontrol gruplarına ait embriyoların timus dokularından alınan histolojik kesitler üzerinde yapılan incelemelerde korteks-medulla ayrımının henüz belli olmadığı görüldü. Kapsülü oluşturan mezenkimal bağ dokunun organı tam olmayan lopçuklara ayırdığı tespit edildi. Lopçuklarda kan damarlarına rastlandı (Şekil 3.1 ve 3.2). 50,100 ve 250 µg/yumurta dozunda BPA' ya maruz bırakılan deney gruplarında lop gelişiminin kontrol gruplarına göre oldukça geride olduğu tespit edildi. Lopların merkezindeki vaskülarizasyonun zayıf olduğu dikkati çekti (Şekil 3.3, 3.4 ve 3.5). BPA verilen gruplarda lenfosit morfolojisi gösteren hücre yoğunluğunda azalma olduğu tespit edildi (Şekil 3.6).
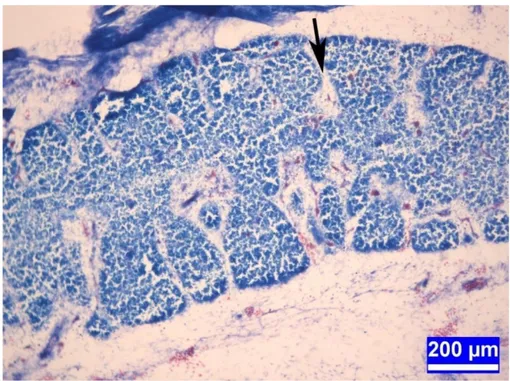
Şekil 3.1. İnkübasyonun on üçüncü gününde kontrol grubundan bir embriyoya ait timus dokusu kesiti. Oklar: İnterlobuler mezenşim. Üçlü boyama. Bar: 200µm.
19 Şekil 3.2.İnkübasyonun on üçüncü gününde kontrol grubundan bir
embriyoya ait timus dokusu kesiti. Ok: İnterlobuler mezenşim. Pappenheim’ın Panoptik Boyası. Bar: 200µm.
Şekil 3.3. İnkübasyonun on üçüncü gününde 50 µg/yumurta dozunda BPA' ya maruz bırakılan bir embriyoya ait timus dokusu kesiti. Üçlü boyama. Bar: 200µm.
20 Şekil 3.4. İnkübasyonun on üçüncü gününde 100 µg/yumurta dozunda
BPA' ya maruz bırakılan bir embriyoya ait timus dokusu kesiti. Üçlü boyama. Bar: 200µm.
Şekil 3.5. İnkübasyonun on üçüncü gününde 250 µg/yumurta dozunda BPA' ya maruz bırakılan bir embriyoya ait timus dokusu kesiti. Üçlü boyama. Bar: 200µm.
21 Şekil 3.6.İnkübasyonun on üçüncü gününde 50 µg/yumurta dozunda
BPA' ya maruz bırakılan bir embriyoya ait timus dokusu kesiti. Pappenheim’ın Panoptik Boyası. Bar: 100µm.
Bu dönemde kontrol ve deney gruplarında timus dokusunda alfa -naftil asetat esteraz (ANAE) pozitivitesi gösteren ve lenfosite ait morfolojik özelliklere sahip hücrelere rastlandı (Şekil 3.7).BPA verilen gruplarda ANAE pozitif hücre yoğunluğunun kontrol gruplarına göre daha az olduğu dikkati çekti (Şekil 3.8). Aynı dönemde alınan kan örneklerinde de ANAE pozitif lenfositlere rastlandı ancak sayıca çok az oldukları için sayım yapılamadı.
22 Şekil 3.7. İnkübasyonun on üçüncü gününde kontrol grubundan bir
embriyoya ait timus dokusu kesiti. Oklar: ANAE pozitif hücreler. ANAE demonstrasyonu. Bar: 50 µm.
Şekil 3.8.İnkübasyonun on üçüncü gününde 50 µg/yumurta dozunda BPA’ya maruz bırakılan bir embriyoya ait timus dokusu kesiti. Ok: ANAE pozitif hücre. ANAE demonstrasyonu. Bar: 50 µm.
23 3.2.İnkübasyonun On Sekizinci Günü
Bu dönemde timus dokusunun hem morfolojik hem de histolojik olarak gelişiminin ilerlediği görüldü. BPA verilen gruplardaki embriyolara ait timus dokusunda bu gelişimin kontrol gruplarına göre biraz geride olduğu dikkati çekti.
Timusun histolojik gelişiminin bu dönemde hemen hemen tamamlandığı, korteks ve medulla ayrımının belirgin olduğu tespit edildi (Şekil 3.9). Medullada dejenere retikulum hücrelerinin oluşturduğu Hassal cisimciklerinin oluşmaya başladığı, lopların interlobuler bağ dokusu bölmelerinin genişlediği, medulladaki vaskülarizasyonun artmış olduğu ve kistik yapıların irileşerek belirginleştiği görüldü. BPA verilen gruplarda, korteks ve medulla ayırımının çok belirgin olmadığı (Şekil 3.10 ve 3.11), özellikle de 250 µg/yumurta grubunda medullada lenfosit morfolojisine sahip hücre yoğunluğunun az olduğu dikkati çekti (Şekil 3.12).
.
Şekil 3.9.İnkübasyonun on sekizinci gününde kontrol grubundan bir embriyoya ait timus dokusu kesiti. Ok: İnterlobuler mezenşim. Üçlü Boyama. Bar: 200µm.
24 Şekil 3.10.İnkübasyonun on sekizinci gününde 50 µg/yumurta
dozunda BPA’ya maruz bırakılan bir embriyoya ait timus dokusu kesiti. Ok: İnterlobuler mezenşim Üçlü boyama. Bar:200µm.
Şekil 3.11.İnkübasyonun on sekizinci gününde 100µg/yumurta dozunda BPA’ya maruz bırakılan bir embriyoya ait timus dokusu kesiti. Ok: İnterlobuler mezenşim. Üçlü Boyama. Bar: 200µm.
25 Şekil 3.12.İnkübasyonun on sekizinci gününde 250 µg/yumurta
dozunda BPA’ya maruz bırakılan bir embriyoya ait timus dokusu kesiti. Oklar: Medullar kistler. Pappenheim’ın panoptik boyası. Bar 50 µm.
Bu dönemde kontrol gruplarına ait timus dokusu kesitlerinin medullasında ANAE pozitivitesi gösteren ve lenfosite ait morfolojik özelliklere sahip hücrelere bir önceki döneme göre daha sıklıkla rastlandı. BPA verilen gruplarda ANAE pozitif hücre yoğunluğunun kontrol gruplarına göre daha az olduğu dikkati çekti (Şekil 3.13 ve 3.14).
26 Şekil 3.13.İnkübasyonun on sekizinci gününde taşıyıcı grubundan bir
embriyoya ait timus dokusu kesiti. Oklar: ANAE pozitif hücreler. ANAE demonstrasyonu. Bar:100 µm.
Şekil 3.14.İnkübasyonun on sekizinci gününde 250 µg/yumurta dozunda BPA’ya maruz bırakılan bir embriyoya ait timus dokuskesiti. Oklar: ANAE pozitif hücreler. ANAE demonstrasyonu. Bar: 100 µm.
27 3.3.İnkübasyonun Yirmi Birinci Günü (Kuluçkadan Çıkış Günü)
Bu dönemde timus dokusunun hem morfolojik hem de histolojik olarak gelişimini tamamladığı ancak BPA verilen gruplarda timus dokusunun daha küçük olduğu dikkati çekti.
Histolojik gelişimini tamamlamış olan loplarda korteks ve medulla ayrımının iyice belirginleştiği, medulla bölgesindeki Hassal cisimcikleri ve kistik yapıların bir önceki döneme göre biraz daha genişlediği tespit edildi (Şekil 3.15). Bu dönemde apoptotik cisimcikleri fagosite etmiş olan makrofajlara (Tingible body macrophages, TBM) korteks bölgesinde sık olarak rastlandı. BPA verilen gruplarda ise kontrol gruplarına göre timus lop ve lopçuklarının oldukça küçülmüş olduğu, loplardaki lenfosit morfolojisine sahip hücre yoğunluğunun azaldığı medulla bölgesinde kistik yapılarda belirgin bir artış olduğu dikkati çekti (Şekil 3.16, 3.17, 3.18, 3.19 ve 3.20).
Şekil 3.15. Kuluçkadan çıkışın ilk gününde kontrol grubundan bir civcive ait timus dokusu kesiti. K:Korteks, M: Medulla, Üçlü boyama. Bar:100 µm.
28 Şekil 3.16.Kuluçkadan çıkışın ilk gününde 100 µg/yumurta dozunda
BPA’ya maruz bırakılan bir embriyoya ait timus dokusu kesiti. K:Korteks, M: Medulla. Ok: Medullar Kist. Üçlü boyama. Bar 200 µm.
Şekil 3.17. Kuluçkadan çıkışın ilk gününde 50 µg/yumurta dozunda BPA’ya maruz kalan bir civcive ait timus dokusu kesiti. K:Korteks, M:Medulla. Pappenheim’ın panoptik boyası. Bar 200 µm.
29
Şekil 3.18.Kuluçkadan çıkışın ilk gününde 100 µg/yumurta dozunda BPA’ya maruz bırakılan bir civcive ait timus dokusu kesiti. K:Korteks, M:Medulla, Ok: Medullar kistler, Pappenheim’ın Panoptik Boyası. Bar:200 µm.
Şekil 3.19. Kuluçkadan çıkışın ilk gününde 250 µg/yumurta dozunda BPA’ya maruz bırakılan bir civcive ait timus dokusu kesiti. Oklar: Medullar kistler. Pappenheim’ın Panoptik Boyası. Bar:200 µm.
30 Şekil 3.20. Kuluçkadan çıkışın ilk gününde 250 µg/yumurta dozunda
BPA’ya maruz bırakılan bir civcive ait timus dokusu kesiti. Ok: Medullar Kist, Pappenheim’ın Panoptik Boyası. Bar: 50 µm.
Bu dönemde kontrol gruplarına ait timus dokusu kesitlerinin medullasında ANAE pozitivitesi gösteren ve lenfosite ait morfolojik özelliklere sahip hücrelerin bir önceki dönemlere göre fazla olduğu dikkati çekti (Şekil 3.21, Şekil 3.22). Medullada sitoplazmalarında sodyum florid'e (NaF) duyarlı diffuz granüler ANAE pozitivitesi gösteren makrofaj ve retikulum hücreleri gözlendi. BPA verilen gruplarda ise ANAE pozitif hücre yoğunluğunun kontrol gruplarına göre daha az olduğu tespit edildi (Şekil 3.23, 3.24, 3.25 ve 3.26). Kan dokusunda da timus dokusundaki bulgulara benzer sonuçlar elde edildi (Çizelge 3.1.). Kontrol gruplarına göre BPA verilen gruplarda ANAE pozitiflenfosit sayısında istatistiki açıdan önemli bir azalma tespit edildi (p<0.05).
31 Şekil 3.21.Kuluçkadan çıkışın ilk gününde kontrol grubundan bir
civcive ait timus dokusu kesiti. Kalın Ok: Hassal cisimciği, Oklar: ANAE Pozitif Lenfositler. ANAE demonstrasyonu. Bar: 50 µm.
Şekil 3.22.Kuluçkadan çıkışın ilk gününde kontrol grubundan bir civcive ait timus kesiti. ANAE demonstrasyonu. Ok başları: ANAE pozitif lenfosit. NaF inhibisyonu. Bar: 100 µm.
32 Şekil 3.23. Kuluçkadan çıkışın ilk gününde 50 µg/yumurta dozunda
BPA’ya maruz bırakılan bir civcive ait timus dokusu kesiti. Oklar: ANAE Pozitif Lenfositler. ANAE demonstrasyonu. Bar: 100 µm.
Şekil 3.24. Kuluçkadan çıkışın ilk gününde 100 µg/yumurta dozunda BPA’ya maruz bırakılan bir civcive ait timus dokusu kesiti. Oklar: ANAE Pozitif Lenfositler. ANAE demonstrasyonu. Bar: 100 µm.
33 Şekil 3.25. Kuluçkadan çıkışın ilk gününde 250 µg/yumurta dozunda
BPA’ya maruz bırakılan bir civcive ait timus dokusu kesiti. Oklar: ANAE Pozitif lenfositler. ANAE demonstrasyonu NaF inhibisyonu. Bar: 50 µm.
Şekil 3.26. Kuluçkadan çıkışın ilk gününde 250 µg/yumurta dozunda BPA’ya maruz bırakılan bir civcive ait timus dokusu kesiti. Oklar: ANAE Pozitif lenfositler. ANAE demonstrasyonu NaF inhibisyonu. Bar: 50 µm.
34 Çizelge 3.1. Kuluçkadan çıkışın ilk günü (21. gün) kontrol grupları ve BPA verilen gruplarda ANAE pozitiflenfosit oranları (%).
a-b: Aynı sütunda farklı harfler taşıyan gruplar arasında istatistiksel açıdan önemvardır(p<0.05)
3.4. Timus Dokusunda Mast Hücreleri
Mast hücrelerine ilk olarak kuluçkanın on üçüncü gününde timus dokusunun medulla bölgesinde çok az sayıda rastlandı (Şekil 3.27). Bu hücrelerin özellikle medulla bölgesinde kan damarlarına yakın yerlerde lenfoid hücreler arasında lokalize olduğu ve sonraki dönemlerde sayıca arttığı dikkati çekti (Şekil 3.28, 3.29 ve 3.30). Korteks bölgesinde ise mast hücre yoğunluğunun çok az olduğu tespit edildi. Ayrıca interlobuler septumda ve timik lobuller arasında da bu hücrelere rastlandı. On sekiz ve yirmi birinci günlere ait mast hücre sayısı Çizelge 3.2 ‘de verilmiştir. Çizelgede de görüldüğü gibi kontrol gruplarına göre BPA verilen gruplarda mast hücre sayısında istatistiki açıdan önemli bir düşüş dikkati çekti (p<0.05, Şekil 3.31, 3.32 ve 3.33).
Gruplar (n=6) ANAE pozitif lenfositoranları x±SD
Kontrol 34,85±1,42a
Taşıyıcı 34,79±3,89a
50 µg/yumurta BPA 26,45±3,19b
100 µg/yumurta BPA 23,40±4,04b
35 Çizelge 3.2.Embriyonik dönemin on sekiz ve yirmi birinci günlerinde kontrol grupları ve deney gruplarına ait mast hücre sayısı.
Gruplar (n=6) 18. gün x±SD 21. gün x±SD Kontrol 4,06±0,53a 6,50±1,78a Taşıyıcı 3,78±0,47a 6,41±1,86a 50 µg/yumurta BPA 2,38±0,79b 4,09±1,02b 100 µg/yumurta BPA 2,59±0,80b 3,13±0,71b 250 µg/yumurta BPA 2,60±0,78b 3,18±0,46b
a-b: Aynı sütunda farklı harfler taşıyan gruplar arasında istatistiksel açıdan önem vardır(p<0.05)
Şekil 3.27.İnkübasyonun on üçüncü gününde 100µg/yumurta dozunda BPA’ya maruz bırakılan bir civcive ait timus dokusu kesiti. Pappenheim’ın Panoptik Boyası. Bar:50 µm.
36 Şekil 3.28. Kuluçkadan çıkışın ilk gününde kontrol grubundan bir
civcive ait timus dokusu kesiti. Oklar: Mast Hücreleri, Pappenheim’ın Panoptik Boyası. Bar:200 µm.
Şekil 3.29. Kuluçkadan çıkışın ilk gününde taşıyıcı grubundan bir civcive ait timus dokusu kesiti. İnce Oklar: Mast hücreleri, Kalın Oklar: Medullar Kistler. Pappenheim’ın Panoptik Boyası. Bar:50 µm.
37 Şekil 3.30. Kuluçkadan çıkışın ilk gününde taşıyıcı grubundan bir
civcive ait timus dokusu kesiti. Oklar: Mast hücreleri. Pappenheim’ın Panoptik Boyası. Bar:20 µm.
Şekil 3.31. İnkübasyonun onsekizinci gününde 250 µg/yumurta dozunda BPA’ya maruz bırakılan bir civcive ait timus dokusu kesiti. Oklar: Mast hücreleri, Pappenheim’ın Panoptik Boyası. Bar:50 µm.
38 Şekil 3.32. Kuluçkadan çıkışın ilk gününde 50 µg/yumurta dozunda
BPA’ya maruz bırakılan bir civcive ait timus dokusu kesiti. Oklar: Mast hücreleri. Pappenheim’ın Panoptik Boyası. Bar:200 µm.
Şekil 3.33. Kuluçkadan çıkışın ilk gününde 250 µg/yumurta dozunda BPA’ya maruz bırakılan bir civcive ait timus dokusu kesiti. Oklar: Mast hücreleri. Pappenheim’ın Panoptik Boyası. Bar:200 µm.
39 4.TARTIŞMA
Endokrin sistem büyüme, gelişme ve metabolizma ile ilgili hayati olayların düzenlenmesinin yanısıra embriyonik gelişim ve seksüel olgunlaşma gibi süreçler üzerinde de düzenleyici ve belirleyici etkisi olan bir sistemdir. Çevresel kirleticilerin çoğu bu sistemin etkisinden sorumlu hormonların hedef hücrelerdeki reseptörlere bağlanarak sözkonusu sistemin sorumlu olduğu süreçleri durdurmakta ya da tetiklemektedir (Colborn ve Clement 1992, McLachan 2001, Flint ve ark 2012). İmmün sistem ve endokrin sistem arasında karşılıklı olarak bir etkileşimin olduğu ve bu etkileşimde hormonlar ve sitokinlerin önemli bir rol aldığı bilinmektedir. Bu karşılıklı etkileşim özellikle BPA gibi östrojenik etkili endokrin bozucu kimyasal maddeler tarafından bozulabilmektedir (Ahmed 2000,Yoshino ve ark 2003, Özaydın ve ark 2016).
Yaygın kullanım alanına sahip BPA’nın çevresel konsantrasyonlarının ciddi sorunlara yol açtığı yapılan son çalışmalarla tespit edilmiştir (Allsop et al. 1997). BPA'nın plasentayı geçmesi ve yumurta sarısı ile atılmasından dolayı hem memeliler hem de kanatlılarda canlı embriyonik dönemden başlamak üzere bu maddelere maruz kalmaktadır (Ikezuki ve ark 2002, Berg ve ark 2004, Crain ve ark 2007, Flint ve ark 2012). Ikezuki ve ark (2002) yaptıkları çalışmada hamile kadınlardan farklı dönemlerde kan, kordon kanı, amniyotik sıvı örnekleri almışlar ve bu örneklerde BPA tespit etmişlerdir. Berg ve ark (2004), embriyonik dönemin erken evrelerinde östrojenik etkili maddelere maruz kalan tavuklarda yaptıkları araştırmada yumurta kabuklarının ince olduğunu ve kabuk kalitesinin de kötü olduğunu belirtmişlerdir.
BPA’nın östrojenik etkilerini ortaya koyabilmek amacıyla çok sayıda araştırma yapılmıştır. Östrojenin bağışıklık sisteminde önemli bir rol oynadığı, humoral bağışıklık üzerinde uyarıcı bir etki gösterirken, hücresel bağışıklık üzerinde baskılayıcı bir etkiye sahip olduğu bildirilmiştir (Ablin ve ark 1974, Seaman ve ark 1978, Paavone ve ark 1981, Holdstock ve ark 1982). Yoshino ve ark (2003) in vitro ve in vivo çalışmalarında BPA’nın immün sistem üzerinde önemli etkileri olabileceğini ve bu kimyasalın immün sistem üzerindeki etkisinin östrojen benzeri etkisiyle açıklanabileceğini ifade etmişlerdir. Östrojenin humoral immün yanıtı artırmak suretiyle otoimmün hastalıkların patogenezinde rol aldığı, ayrıca sitokin üretimi ve T lenfosit alt tiplerinin dağılımını etkilediği bilinmektedir (Nakamura ve