DĠYABET HASTALIĞININ ERKEN DÖNEMDE TEġHĠSĠNE YÖNELĠK KARBON BAZLI NANOBĠYOSENSÖRLERĠN SENTEZĠ, KARAKTERĠZASYONU VE UYGULAMALARI
Yağmur KOġKUN Yüksek Lisans Tezi Biyokimya Anabilim Dalı
Yağmur KOġKUN
Dumlupınar Üniversitesi
Lisansüstü Eğitim Öğretim Ve Sınav Yönetmenliği Uyarınca Fen Bilimleri Enstitüsü Biyokimya Anabilim Dalında
YÜKSEK LĠSANS TEZĠ Olarak HazırlanmıĢtır.
DanıĢman: Doç. Dr Fatih ġEN
KABUL VE ONAY SAYFASI
Yağmur KOġKUN‟un YÜKSEK LĠSANS/DOKTORA tezi olarak hazırladığı DĠYABET HASTALIĞININ ERKEN DÖNEMDE TEġHĠSĠNE YÖNELĠK KARBON BAZLI NANOBĠYOSENSÖRLERĠN SENTEZĠ, KARAKTERĠZASYONU VE UYGULAMALARI baĢlıklı bu çalıĢma, jürimizce Dumlupınar Üniversitesi Lisansüstü Eğitim Öğretim ve Sınav Yönetmeliğinin ilgili maddeleri uyarınca değerlendirilerek kabul edilmiĢtir.
06/10/2017
Üye : Doç. Dr. Fatih ġEN (DanıĢman)
Üye : Prof. Dr. Elif ġAHĠN
Üye : Prof. Dr. Cengiz YENĠKAYA
Fen Bilimleri Enstitüsü Yönetim Kurulu'nun .../.../... gün ve ... sayılı kararıyla onaylanmıĢtır.
Prof. Dr. Hasan GÖÇMEZ Fen Bilimleri Enstitüsü Müdürü
ETĠK ĠLKE VE KURALLARA UYGUNLUK BEYANI
Bu tezin hazırlanmasında akademik kurallara riayet ettiğimizi, özgün bir çalıĢma olduğunu ve yapılan tez çalıĢmasının bilimsel etik ilke ve kurallara uygun olduğunu, çalıĢma kapsamında teze ait olmayan veriler için kaynak gösterildiğini ve kaynaklar dizininde belirtildiğini, Yüksek Öğretim Kurulu tarafından kullanılmak üzere önerilen ve Dumlupınar Üniversitesi tarafından kullanılan Ġntihal Programı ile tarandığını ve benzerlik oranının %10 çıktığını beyan ederiz. Aykırı bir durum ortaya çıktığı takdirde tüm hukuki sonuçlara razı olduğumuzu taahhüt ederiz.
Doç. Dr. Fatih ġEN Yağmur KOġKUN
DĠYABET HASTALIĞININ ERKEN DÖNEMDE TEġHĠSĠNE YÖNELĠK KARBON BAZLI NANOBĠYOSENSÖRLERĠN SENTEZĠ, KARAKTERĠZASYONU VE
UYGULAMALARI Yağmur KOġKUN
Biyokimya Anabilim Dalı, Yüksek Lisans Tezi, 2017 Tez DanıĢmanı: Doç. Dr. Fatih ġen
ÖZET
Dünya nüfusunu etkileyen en yaygın hastalıklardan biri diyabet hastalığıdır. ġeker hastalığı dediğimiz Diabetes Mellitus, insülin hormonunun etkisizliği veya eksikliği sonucu oluĢan, kan dolaĢım sisteminde yüksek düzeyde glikoz (Ģeker) yapılanmasıyla görülen kronik bir hastalıktır. Diyabet hastalığından yılda üç yüz seksen iki milyon insan etkilenmektedir ve yine yılda 1,5 ila 5,1 milyon kiĢinin ölümüne neden olmaktadır. Dolayısıyla insan yaĢamını her anlamda etkileyen ve engelleyen diyabet hastalığının erken teĢhisi ve tedavisi oldukça önemlidir ve bunun için çeĢitli tayin yöntemleri kullanılmaktadır.
Hazırlanan tez çalıĢmasında, diyabet hastalığının erken teĢhisine yönelik karbon temelli nanoparçacıklar kullanılarak glikoz biyosensörü hazırlanmıĢtır. Biyosensörlerin optimum çalıĢma koĢullarını belirlemek amacı ile tekrarlanabilirliği, duyarlılığı, tayin aralığı ve tayin sınırı belirlenmiĢtir. Tasarlanan Aktif karbon destekli Nikel ve Paladyum (Ni-Pd@AK) elektrokimyasal nanobiyosensörün seçiciliği, aktivitesi ve uygulanabilirliği DönüĢümlü Voltametri (CV) ve Kronoamperometri (CA) ile ölçülmüĢtür. Karakterizasyon iĢlemleri ise Geçirimli Elektron Mikroskobu (TEM), X-IĢını Kırınımı (XRD), X-IĢını Fotoelektron Spektroskopisi (XPS) ve Raman Spektroskopisi ile incelenmiĢtir. Ni-Pd@AK nanokompozitler 0,014 µM tayin limiti, 0,01 mM ila 1 mM arasında geniĢ bir doğrusal aralık ve 90 mA mM-1 cm -2
yüksek hassasiyet göstermiĢtir. Ayrıca bu çalıĢmada, hazırlanan glikoz biyosensörü ile kan serumunda glikoz tayini yapılarak elde edilen sonuçlar standart yöntem ile karĢılaĢtırılmıĢtır.
Anahtar Kelimeler: Bimetalik alaĢım, Glikoz sensör, Nanosensör, Yüksek seçicilik ve hassasiyet.
SYNTHESIS, CHARACTERIZATION AND APPLICATIONS OF CARBON BASED NANOBIOSENSORS FOR DIAGNOSIS OF DIABETES 'PATIENCE IN THE EARLY
TIME Yağmur KOġKUN Biochemistry, M. S. Thesis, 2017 Thesis Supervisor: Assoc. Prof. Fatih ġEN
SUMMARY
One of the most common diseases affecting the global human population is diabetes. Diabetes Mellitus is a chronic disease caused by the ineffectiveness or lack of insulin hormone and the high level of glucose (sugar) in blood circulation system. Three hundred and eighty two million people are affected from diabetes mellitus every year, and diabetes cause about 1.5 to 5.1 million deaths per year. Therefore, early diagnosis and treatment of diabetes mellitus, which affects and inhibits human life in every sense, is very important and various methods of identification are used. Fort his purpose, in the thesis study, a glucose biosensor was prepared using activated carbon-based Nickel-Palladium (Ni-Pd@AK) nanoparticles for the early detection of diabetes mellitus.
The reproducibility, sensitivity, detection range and detection limit of the current biosensors were determined with the aim of determining optimum operating conditions. Characterization processes were investigated by Transmission Electron Microscopy (TEM), X-Ray Diffraction (XRD), X-X-Ray Photoelectron Spectroscopy (XPS) and Raman Spectroscopy. The selectivity, activity and applicability of the designed Ni-Pd@AK electrochemical biosensor were measured by the Cyclic Voltammetry (CV) and Chronoamperometry (CA). The Ni-Pd@AK nanocomposites showed a limit of 0.014 μM, a broad linear range of 0.01 mM to 1 mM and high sensitivity of 90 mAm-1 cm-2. Also, in this study, the results obtained by glucose determination in the blood serum with the prepared glucose biosensor were compared with the standard method.
TEġEKKÜR
Yüksek Lisans Tezi sürecinde sürdürdüğüm çalıĢmalarımda desteğini esirgemeyen, yaĢama dair önemli bilgi ve tecrübelerinden yararlandığım saygıdeğer hocam, danıĢmanım Dumlupınar Üniversitesi Fen Fakültesi Biyokimya Anabilim Dalı öğretim üyesi Doç. Dr. Fatih ġEN‟e en içten teĢekkürlerimi sunarım.
Deneysel çalıĢmalarım boyunca her konuda yardımcı olan en önemlisi dostluğunu esirgemeyen Aysun ġAVK ve Kubilay ARIKAN‟a ve diğer Sen AraĢtırma Grubu üyesi arkadaĢlarıma çok teĢekkür ederim.
Hayatım boyunca beni her konuda destekleyen, sevgilerini hep hissettiren Ģüphesiz bu günlere gelmemde en büyük pay sahibi olan annem AyĢe KOġKUN ve babam Ali KOġKUN‟a; bana hep destek olan kardeĢlerim Yakup ve ġevval KOġKUN‟a minnettarım.
Sayfa
ÖZET ... v
SUMMARY ... vi
ġEKĠLLER DĠZĠNĠ ... x
ÇĠZELGELER DĠZĠNĠ ... xii
SĠMGELER VE KISALTMALAR DĠZĠNĠ ... xiii
1. GĠRĠġ ... 1
2. KURAMSAL TEMELLER ... 2
2.1. Glikoz Tayininin Önemi ... 2
2.2. Glikoz Tayin Yöntemleri ... 3
2.2.1. Gıdalarda glikoz tayini ... 3
2.2.2. Kan Glikoz Tayin Yöntemleri ... 3
2.3. Biyosensörler ... 4
2.3.1. Biyosensörlerin yapısı ve fonksiyonları ... 4
2.3.2. Biyosensör çeĢitleri ... 5
2.3.3. Biyosensörlerin uygulama alanları ... 11
2.3.4. Hazırlanan Biyosensörün Performans Faktörleri ... 11
2.4. Nanoteknoloji ve Nanomateryaller ... 13
2.5. Nanosensörler ve Nanobiyosensörler ... 13
2.5.1. Nanobiyosensör Destek Malzemeleri ... 14
3. MATERYAL METOD ... 16
3.1. Materyal ... 16
3.1.1. Cihaz ve diğer ekipmanlar ... 16
3.1.2. Kimyasallar ... 16
3.2 . Metod ... 17
3.2.1. Ni@AK, Pd@AK ve Ni-Pd@AK Nanobiyosensörünün Sentezi ... 17
3.2.2. Elektrot Solüsyonlarının ve ÇalıĢma Elektrotlarının Hazırlanması ... 17
3.2.3. Elektrokimyasal Hücrenin Hazırlanması ... 18
3.2.4. Hazırlanan Nanosensörün Karakterizasyon Teknikleri ... 18
3.2.5. Hazırlanan Nanosensörün Elektrokimyasal Analiz Teknikleri ... 23
Sayfa
4.1. Sentezlenen Pd@AK, Ni@AK ve Ni-Pd@AK Nanosensörünün Karakterizasyonu ... 26
4.1.1. Nanosensörünün X-ıĢını kırınım sonuçları ve değerlendirmeleri... 26
4.1.2. Ni-Pd@AK tek dağılımlı nanosensörünün geçirimli elektron mikroskobu bulguları ve değerlendirmeleri ... 27
4.1.3. Ni-Pd@AK tek dağılımlı nanosensörünün X-ıĢını fotoelektron spektroskopisi bulguları ve değerlendirmeleri ... 28
4.1.4. Ni-Pd@AK tek dağılımlı nanosensörünün raman spektroskopisi bulguları ve değerlendirmeleri ... 29
4.2. Hazırlanan Pd@AK, Ni@AK ve Ni-Pd@AK NanosensörlerininElektrokimyasal Aktivitelerinin Belilenmesi ... 30
4.2.1. Ni-Pd@AK nanosensörün karĢılaĢtırma çalıĢmasına dair bulgular ... 30
4.2.2. Ni-Pd@AK elektrodun glikoza duyarlılığına deriĢimin etkisi ... 31
4.2.3 . Ni-Pd@AK elektrodun glikoza duyarlılığına tarama hızı etkisi ... 32
4.2.4. Ni-Pd@AK elektrot ile glikozun amperometrik olarak tespiti ... 34
4.2.5. Ni-Pd@AK elektroduna giriĢim yapan maddelere yanıtının incelenmesi ... 35
4.2.6. Ni-Pd@AK elektrodunun kararlılığının ve tekrarlanabilirliğinin incelenmesi .... 36
4.3. Biyolojik Sıvıda (kanda) Glikoz Tayini ... 37
5. SONUÇLAR ... 38
KAYNAKLAR DĠZĠNĠ ... 40 ÖZGEÇMĠġ
ġEKĠLLER DĠZĠNĠ
ġekil Sayfa
2.1. Biyosensörlerin yapısı ve çalıĢma prensibi ... 5
2.2. Biyosensör çeĢitleri. ... 6
2.3. Biyomalzemeler temek alınarak yapılan sensör örnekleri ... 7
2.4. Kütle hassas sensörün Ģematik gösterimi ... 7
2.5. Optik sensörün Ģematik gösterimi ... 8
2.6. Elektrokimyasal sensörün Ģematik gösterimi ... 9
2.7. Potansiyometrik sensörün Ģematik gösterimi ... 10
2.8. Amperometrik bir biyosensörün Ģematik gösterimi ... 11
2.9. Grafen, Tek Duvarlı KNT, Çok Duvarlı KNT ve Aktif Karbonun Ģematik gösterimi ... 15
2.10. AK (Aktif Karbon) ile desteklenen Ni-Pd nanoparçacıklarının gösterimi. ... 15
3.1. Ni-Pd nanoparçacıkların sentez aĢamaları. ... 17
3.2. Elektrokimyasal hücre düzeneği. ... 18
3.3. Geçirimli elektron mikroskobunun Ģematik diyagramı ... 19
3.4. Kristal düzlemde gerçekleĢen X-ıĢını kırınımının çalıĢma prensibi ... 21
3.5. X-ıĢını fotoelektron spektroskopisinin çalıĢma prensibi ... 22
3.6. Raman saçılım Ģeması ve iki atomlu bir molekülün olası titreĢimleri ... 23
3.7. Ġndirgenme ve yükseltgenme piklerinin gösterildiği tipik bir döngüsel voltametri görüntüsü ... 24
3.8. Potansiyel-zaman iliĢkisini gösteren grafik... 25
4.1. Pd@AK ve Ni-Pd@AKnanosensörüne ait XRD görüntüsü. ... 27
4.2. Ni-Pd@AK nanosensörünün a)TEM ve HRTEM görüntüsü ve b) parçacık boyutu histogramı. ... 28
4.3. (a) Ni-Pd@AK nanosensörünün Ni 2p XPS spektrumu ve Ni 2p'nin 3D görünümünün XPS spektrumları. (b) Ni-Pd@AK için Pd 2p'nin XPS spektrumları ve Pd 2p 3D görünümü XPS spektrumları. ... 29
4.4. AK ve Ni-Pd@AK ait Raman spektrumu. ... 30
4.5.AK, Pd@AK, Ni@AK ve Ni-Pd@AK elektrotlarının 0,1 M NaOH içerisinde 50 mV/starama hızında boĢ ve 0,3 mM glikoz ilavesinde alınan döngüsel voltamogram sonuçları ... .31
ġEKĠLLER DĠZĠNĠ (devam)
ġekil Sayfa
4.6. Ni-Pd@AK için 0,1 M NaOH‟da çeĢitli glikoz konsantrasyonlarındaki döngüsel voltamogramları aĢağıdan yukarıya doğru: (a) 0,1; (b) 0,2; (c) 0,3; (d) 0,4; (e) 0,5; (f) 0,6 ve (g) 0,7. Kalibrasyon grafiği de ek olarak Ģekil içerisinde gösterilmiĢtir ... 32 4.7. Ni-Pd@AK için 0,5 mM glikoz varlığında 0.1 M NaOH içerisinde farklı tarama
hızlarındaki (20 ila 140 mVs-1.) döngüsel voltamogramları. Ek olarak kalibrasyon grafiği de Ģekil içerisinde gösterilmiĢtir. ... 33 4.8. 0,1 M NaOH çözeltisi içindeki Ni-Pd (A) ve Ni-Pd@AK (B) modifiye edilmiĢ
elektrotlar için potansiyel tarama hızına karĢı döngüsel voltametrinin pik değerleri. ... 34 4.9. (a) 0,1 mM ardıĢık glikoz ilave edildiğinde tek dağılımlı Ni-Pd@AK elektrodunun
amperometrik yanıtları. (b).Ni-Pd@AK‟nin art arda 10 µM glikoz ilavesi ile elde edilen kronoamperometri eğrileri. Ek olarak glikoz saptama doğrusal kalibrasyon eğrileri ... 35 4.10. Ni-Pd@AK elektrodunun giriĢimcilerin (0.1 mM AA, DA, fruktoz, UA ve laktoz
ilaveleri) ve 1,0 mM ardıĢık glikozun amperometrik yanıtı üzerindeki etkisi. (0,1 M NaOH çözeltisi +0.5 V'de.) ... 36 4.11. (a) +0.50 V'da 1 mM glikoz ile 0,1 M NaOH kullanılarak çoklu döngü voltamogramı.
(b) +0.50 V'da 1 mM glikoz ile 0,1 M NaOH kullanılarak 30 günde optimum Ģartlar altında depolanan sensörün kararlılığı. ... 37
ÇĠZELGELER DĠZĠNĠ
Çizelge Sayfa
2.1. Sensör tasarımında önemli parametreler……….………...……...….14 4.1. Literatürde bulunan Ni ve Pd ile hazırlanmıĢ bazı sensörler ve Ni-Pd@AK‟nin
kıyaslan-ması………...……….………..……...37 4.2. Ni-Pd@AK camsı karbon elektrot kullanılarak insan kan serum numunesinden tayin edi-
SĠMGELER VE KISALTMALAR DĠZĠNĠ Simgeler Açıklama α Alfa Å Angstrom Β Beta Λ Dalga boyu 0 C Santigrat derece Θ Teta % Yüzde Kısaltmalar Açıklama Nm Nanometre Ml Mililitre µl Mikrolitre G Gram Mg µA µM µmol nM cm2 Miligram Mikroamper Mikromolar Mikromol Nanomolar Santimetre kare V BSS rad GO DMF DMAB THF Volt
Bağıl standart sapma Radyan
Grafen oksit Dimetilformamit Dimetilaminboran Tetrahidrofuran
SĠMGELER VE KISALTMALAR DĠZĠNĠ (devam) Kısaltmalar XRD RS XPS CV CA NP AK ÇDKNT TEM HRTEM Açıklama X-ıĢını kırınımı Raman spektroskopisi X-ıĢını fotoelektron spektroskopisi Döngüsel voltametri Kronoamperometri Nanoparçacık Aktif Karbon
Çok duvarlı karbon nanotüp Geçirimli elektron mikroskobu
1. GĠRĠġ
Küresel insan popülasyonunu etkileyen en yaygın hastalıklardan biri diyabet hastalığıdır. Diyabet (ġeker hastalığı) dediğimiz Diabetes Mellitus, insülin hormonunun etkisizliği veya eksikliği sonucu oluĢan, kan dolaĢım sisteminde yüksek seviyede glikoz (Ģeker) yapılanmasıyla görülen kronik bir hastalıktır (Yang vd. 2013). Ġnsülin, midenin altında bulunan pankreas bezindeki beta hücrelerinden salgılanan bir hormondur ve düzenli salgılanmadığında kandaki glikoz seviyesinin (Ģekerin) artmasına neden olur. Kandaki glikoz seviyesinin istenilen değerlerden (4,4 - 6,6 mM) yüksek olması sonucu ortaya çıkan rahatsızlığın adı diyabettir. (Wang, 2008).
Bununla birlikte; insülin üretiminin azalması Tip I diyabet ya da insülinin etkisine karĢı direnç geliĢmesiyle Tip II diyabet gözlenmektedir. Diyabet hastalığından yılda üç yüz seksen iki milyon insan etkilenmektedir ve yine yılda 1,5 ila 5,1 milyon kiĢinin ölümüne neden olmaktadır. Ayrıca dünyadaki hastalıklar arasında sekizinci ölüm nedenini oluĢturmaktadır. Bu rahatsızlık metabolik bozukluk, göz kusuru, kalp rahatsızlığı gibi hastalıklara neden olmaktadır (Nichols vd. 2013). Diabetes Mellitus; halk sağlığını yakından ilgilendiren, geleceğin en tehlikeli rahatsızlıkları arasında görülen insülin direnci gibi hastalıkları da tetikleyen ve ileri seviyelerde organlarda kalıcı hasara hatta ölüme neden olması sebebiyle glikozun sürekli takibini gerektirir. Dolayısıyla insan yaĢamını her anlamda etkileyen ve engelleyen diyabet hastalığının erken teĢhisi ve tedavisi oldukça önemlidir ve bunun için çeĢitli tayin yöntemleri kullanılmaktadır.
Son yıllarda, floresan, optik, yüzey plazmon rezonansı ve elektrokimyasal yöntemler gibi güvenilir glikoz algılama teknikleri keĢfetmek için çok çaba harcanmıĢtır. Biyolojik türlerin tayini, genellikle zaman alıcı, pahalı ve ön numune hazırlama iĢlemleri içeren spektroflorimetrik (Ymakoshi vd. 2006) ve spektrofotometrik (Louro vd. 2013) yöntemlerle yapılmaktadır. Aynı zamanda glikoz, kanda ve idrarda bulunan aktif elektrokimyasal bir bileĢiktir, bu nedenle elektrokimyasal (Wang 2008) yöntemlerle de tayin edilebilmektedir. Bu teknikler arasında elektrokimyasal yöntem sensör araĢtırması için en cazip yöntem haline gelmiĢtir. Yüksek duyarlılık, düĢük maliyet, küçük boyutlarda üretilebilme gibi avantajlarından dolayı biyosensörler bu yöntemlerle yapılan tayinler için oldukça önemli bir alternatiftir (Castillo vd. 2003). Glikozun tespitine yönelik ticari glikoz sensörleri ile elde edilen sonuçlar yetersiz kalmıĢ ve bilim insanları bunun sonucu olarak enzimli ve enzimsiz glikoz sensörleri çalıĢmalarına ağırlık vermiĢlerdir (Kong, 2010). Enzimatik sensörlerin tekrarlanabilir olmaması, enzimlerin yapılarının çabuk bozunması ve kararlılıklarının düĢük olması gibi olumsuz etkilerinden dolayı
diyabet hastalığının erken teĢhisine yönelik enzimatik olmayan glikoz sensörü tercih edilmektedir.
Sensör çeĢitlerinden biri olan elektrokimyasal glikoz sensörleri glikozun mikro ve nano molar mertebesinde tespit edilmesini sağlar. Sensörlerin daha iletken ve daha geniĢ yüzey alanına sahip olması için destek malzemeleri kullanılmaktadır. Karbon bazlı bu destek malzemelerden biri olan aktif karbon mekaniksel olarak güçlü olması, yüksek yüzey alanına sahip olması, mükemmel elektrik iletkenlik göstermesi ve yüksek kimyasal kararlılık gibi avantajlara sahiptir. Bu nedenle elektrokimyasal sensörler ve biyosensörlerde yaygın bir Ģekilde kullanılmaktadır. Aynı zamanda aktif karbon destek malzemesinin üzerine glikozu glikonolaktona dönüĢtürücü Ni, Co, In, Ru, Au ve Cu gibi geçiĢ metalleri; Co3O4, NiO (OH), RuO2 gibi metal oksitler ve Cu-Pd, Pt-Au, Ni-Cr gibi farklı metal kombinasyonları veya kompozitler glikozu saptamak için kullanılmaktadır ki karbonhidratlara ve özellikle glikoza karĢı elektroaktivitesinin iyi derecede olduğu görülmüĢtür. Fakat günlük hayatta kullanım için istenilen seviyeye ulaĢılamamıĢtır (Matsumoto vd.2003, Wang vd.1996).
Bu tez kapsamında literatürde ilk kez enzim kullanılmadan glikozun erken tespitine yönelik son derece aktif, güvenilir, kararlı ve yüksek hassasiyete sahip olabilecek AK bazlı Ni-Pd içeren nanokompozitler hazırlanmıĢtır. Bu nanokompozitlerin glikozun glikonolaktona dönüĢümünde oldukça etkin malzemeler olduğu gözlenmiĢtir. Sensörümüzde kullanılan AK‟nin oldukça iyi iletkenliğe ve geniĢ yüzey alanına sahip olması bunun yanında Ni-Pd nanokompozitlerinin glikozu yüksek derecede glikonolaktona dönüĢtürmesi tezin özgünlüğünü sağlamaktadır. Daha düĢük konsantrasyonlarda (mikro molar) bile hücre içi veya hücre dıĢı çalıĢmalarda Ni-Pd@AK nanobiyosensörü ile glikoz tayini yapılabileceği araĢtırılmıĢtır. Bunun yanında hazırlanan elektrot ile sensörün uygulanabilirliğini belirlemek amacı ile kan serumunda glikoz tayininin gerçekleĢtirilip gerçekleĢtirilemeyeceği incelendi ve sonuçlar standart yöntemle elde edilen veriler ile kıyaslandı.
2. KURAMSAL TEMELLER 2.1. Glikoz Tayininin Önemi
ġeker hastalığı (diyabet), pankreasın ihtiyaç duyulan seviyede insülin üretememesi ya da ürettiği insülinin etkili bir biçimde kullanılamaması halinde geliĢen ve ömür boyu süren kronik bir hastalıktır. Kandaki glikoz seviyesinin uzun süreli olarak artıĢ göstermesi hiperglisemi olarak adlandırılır ve diyabet hastalığına yol açar. Uzun vadede devam eden kalıcı hiperglisemi Ģiddetli olmasa bile böbrekleri, sinir sistemini, gözleri ve kalbi etkileyen yan etkilere sebep olabilir. Bu nedenle kan Ģekerinin olabildiğince normale (4,4 - 6,6 mM) yakın
seviyelerde tutulmasıyla bu yan etkiler ile karĢılaĢma riski en az seviyeye indirgenebilir. Buna bağlı olarak diyabetin erken teĢhis ve tedavisinde glikoz düzeylerinin sıkı takibi gerekmektedir (Wang, 2001).
2.2. Glikoz Tayin Yöntemleri 2.2.1. Gıdalarda glikoz tayini
Karbonhidratlar, karbon (C), hidrojen (H) ve oksijen (O) atomlarından oluĢan ve yeryüzünde bol miktarda bulunan temel besin kaynaklarından biridir. Bitkiler tarafından sentezlenen bu besin öğesi sebze-meyvelerde ve bunlardan üretilmiĢ çeĢitli gıda ürünlerinde glikoz, fruktoz ve sakkaroz olmak üzere baĢlıca üç tip olarak bulunmaktadır. Fruktoz ve glikoz 6 karbonlu monosakkarit çeĢitlerindendir. Sakkaroz ise 1 mol fruktoz ve 1 mol glikozun 1 mol su açığa çıkararak birleĢmesiyle oluĢmuĢ bir disakkarittir.
Monosakkaritler (glikoz, fruktoz) indirgen özellikte oldukları için Fehling çözeltileri ile doğrudan doğruya bakır (I) oksit oluĢur. Sakkaroz (disakkarit) ve niĢasta (polisakkarit) indirgen değildir. Bu nedenle önce indirgen maddelere yani monosakkaritlere dönüĢtürülür ve bu iĢleme inversiyon adı verilir. Ġnversiyon sonucu elde edilen glikoz, fruktoz karıĢımına ise invert Ģeker adı verilir. ġeker tayini, genellikle tüm sebze ve meyveler ile bunlardan üretilmiĢ çeĢitli gıdalara uygulanır.
Gıdalarda Ģeker tayinleri, aĢağıdaki nedenlerden dolayı yapılmaktadır:
Gıdaların bileĢiminde bulunan toplam Ģeker ve invert Ģeker miktarını belirlemek Üretimin iĢlemlerine kazanç sağlayıcı yön vermek
Sahip oldukları enerji miktarını saptamak
Ġstenilen standarda uygun olup olmadığını belirlemek ġeker tayininde genel olarak üç yöntem kullanılır. Bunlar:
Volumetrik yöntem Gravimetrik yöntem Enstrümental yöntemler
2.2.2. Kan Glikoz Tayin Yöntemleri
Kan glikoz ölçümlerinin baĢlıca iki amacı vardır. Bunlar ya hiperglisemiyi ya da hipoglisemiyi tespit etmektir. Ġki çeĢit tayin yöntemi vardır. Bunlar enzimatik yöntemler ve indirgeme yöntemleridir. Bu yöntemler kullanılarak hazırlanan ve son yıllarda oldukça ilerleme gösteren çalıĢmalardan biri de biyosensörlerdir. Boyutu, pratikliği ve diğer özellikleri sebebiyle sensörler hayatı kolaylaĢtıran cihazlardır.
2.3. Biyosensörler
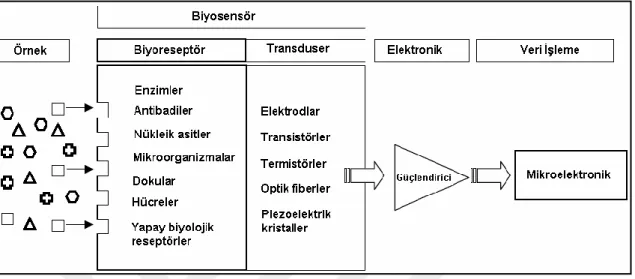
Biyosensörler, biyomateryal ve analit arasındaki reaksiyondan kaynaklanan sinyali, anlamlı bir sinyale dönüĢtüren bir dönüĢtürücüye bağlı biyolojik tanıma elemanı içeren bir algılama cihazı olarak tanımlanabilir (Gerard vd., 2012). Biyosensörlerin tarihi 1950-1960 yılları arasında C. Clark‟ın kandaki glikoz miktarını ölçmesiyle baĢlamıĢtır (Turner, 1985).Ana hedef, kısa süre içinde bir biyosensörden seçici, hassas, tekrarlanabilir ve anlamlı sinyal elde etmektir. Biyosensörler biyolojik tanıma elemanları ve dönüĢtürücüler olmak üzere iki kısımdan oluĢmaktadır. Biyosensörün kilit parçası olan tanıma elemanları, giriĢimleri önleyen spesifik analitlerle hassas etkileĢimi sağlar. Kullanılan biyomalzemeler, katalitik olanlar (enzimler, mikroorganizmalar, dokular vb.) ve katalitik olmayan maddeler (nükleik asitler, antikorlar, reseptörler vb.) olarak sınıflandırılır. Ġstenilen amaca göre, bu biyolojik unsurlar ilgili maddenin güvenilir Ģekilde tanınmasını sağlar.
2.3.1. Biyosensörlerin yapısı ve fonksiyonları
Ġdeal bir biyosensör sistemi ġekil 2.1.‟de de görüldüğü üzere iki temel kısımdan oluĢmaktadır. Bunlar;
1. Analiti tanımlayan (enzim substratı, tamamlayıcı DNA, antijen) immobilize edilmiĢ hassas bir biyolojik element (enzim, DNA probu, antikor) olan bir biyoreseptör. Antikorlar ve oligonükleotidler yaygın Ģekilde kullanılsa da enzimler, biyosensörlerde en çok kullanılan biyo-algılama elemanlarıdır.
Biyokomponentler, biyosensörlerin yapısında görev alırlar ve biyoreseptörler olarak da adlandırılırlar. Analizi yapılacak maddeyi dönüĢüme uğratırlar ve biyoreseptörler içinde en yaygın kullanılanlar antikorlar ve enzimlerdir (Wang, 1999).
2. Bir dönüĢtürücü, analitin biyoreseptör ile etkileĢiminden kaynaklanan (biyolojik) kimyasal sinyali elektronik bir sinyale dönüĢtürmek için kullanılır. OluĢturulan sinyalin yoğunluğu, analit konsantrasyonu ile doğru orantılı Ģekilde artmaktadır. Elektrokimyasal transdüserler genellikle biyosensörleri geliĢtirmek amacıyla kullanılmaktadır. Bu sistemler; maliyeti düĢürmesi, kolay tasarımı ve küçük boyutlar sunması ile cezbedici hale gelmektedir (Sassolas, 2011).
Biyokimyasal reaksiyon türüne göre transdüser seçilir. Elektrokimyasal transdüserler, düĢük maliyet ve kolay imalat avantajlarıyla yaygın olarak kullanılırlar. DönüĢtürücüler
elektrokimyasal biyosensörlerde istenilen amaca göre kolayca modifiye edilebilen elektrotlardır (Zhang vd., 1999).
ġekil 2.1. Biyosensörlerin yapısı ve çalıĢma prensibi (Sarkar vd.,1999). 2.3.2. Biyosensör çeĢitleri
Biyosensörler, biyoalgılayıcılar (reseptör) ile transdüserlerden oluĢurlar. Analizi yapılacak madde ile seçimli bir Ģekilde etkileĢime giren biyoaktif bir bileĢenin ortaya çıkan sinyali ileten bir iletici sisteme bağlanması ve bunların elektronik ölçüm sistemi ile bir bütünü oluĢturmasıdır. ġekil 2.2.‟de transdüser ve biyoalgılayıcı türlerine göre çeĢitlerine ayrılan biyosensörler tablo halinde gösterilmiĢtir (Vo-Dinh ve Cullum, 2000).
ġekil 2.2. Biyosensör çeĢitleri.
2.3.2.1. Biyoalgılama Materyalleri Temel Alınarak Yapılan Sınıflandırma
Biyosensörlerde kullanılan biyomalzemeler mekanizmalarına göre üç farklı gruba ayrılmaktadır. Bunlar biyoafinite, mikrop esaslı ve biyokatalitik biyoalgılama malzemeleridir. Bunlar kendi içerisinde ayrılmaktadır ve biyoafinite olarak adlandırılan grup, algılayıcılar nükleik asitler ve antikorlardan oluĢmaktadır. Biyokatalitik gruba, enzimler dâhildir ve mikrop esaslı gruba ise organeller, hücreler, mikroorganizmalar ve dokular dâhil olmaktadır (Parlett, 1990). ġekil 2.3.‟ de bazı biyomalzemeler esas alınarak yapılmıĢ biyosensörlerin iĢleyiĢi gösterilmektedir.
ġekil 2.3. Biyomalzemeler temek alınarak yapılan sensör örnekleri (Dinçkaya, 1999). 2.3.2.2. Kütle hassas sensörler
Kütle duyarlı sensörler, algılama için piezoelektrik kristaller kullanır. Piezoelektrik malzemeler, mekanik kuvvetlere tepki olarak bir elektrik sinyali üreten malzemelerdir. Sensörlerdeki yaygın olarak kullanılan piezoelektrik malzemeler kuvars kristalleridir. Bu sensörlerde kristallere, elektrik sinyali uygulanarak belirli bir frekansta titreĢim yapılır. Kristalin salınım frekansı uygulanan frekansa bağlıdır (Masoud, 2016). ġekil 2.4.‟de bir kütle hassas sensörün çalıĢma prensibi Ģematik olarak gösterilmiĢtir.
2.3.2.3. Optik sensörler
Optik yöntemler, kimyasal ve biyolojik analitlerin algılama teknikleri arasında en oturmuĢ tekniklerden biridir. Ġdeal bir optik biyosensör seçimli bir ıĢık kaynağı, belirli özelliklerde ıĢık demeti elde etmek için bir grup optik bileĢen ve bu ıĢığı yönlendirmek için bir prizma, bir dönüĢtürülmüĢ algılama baĢı ve bir ıĢık dedektöründen oluĢmaktadır (ġekil 2.5).
Optik biyosensörler hem katalitik hem afinite reaksiyonlarını ölçmektedir. Katalitik reaksiyonlarla üretilen ürünlerden kaynaklanan floresan veya emicilikteki değiĢimi ölçerler. Alternatif olarak, protein gibi dielektrik moleküllerin yüklenmesi nedeniyle (afinite reaksiyonları durumunda) biyosensör yüzeyin optik özelliklerinde indüklenen değiĢiklikleri ölçerler. Lüminesans içeren en umut verici biyolojik sensör, gıda veya klinik örneklerde bakteri tespiti için enzim olarak lusiferaz kullanır. Bakteriler, biyosensör tarafından ölçülen ıĢığı üretmek için O2 varlığında lusiferaz tarafından kullanılan ATP'yi serbest bırakmak için özel olarak parçalanır (Dinçkaya, 1999).
ġekil 2.5. Optik sensörün Ģematik gösterimi (Paddle, 1996).
2.3.2.4. Elektrokimyasal biyosensörler
Elektrokimyasal biyosensör basit bir cihazdır. Biyo-elektrotlar tarafından taĢınan elektronik akım, iyonik veya iletkenlik değiĢikliklerinin miktarını ölçerler. Bir elektrokimyasal sensörün temel bileĢenleri bir çalıĢma (veya algılama) elektrodu, bir karĢı elektrot ve genellikle bir referans elektrottur. Bu elektrotlar sıvı elektrolit ile temas halinde sensör gövdesine yerleĢtirilir. Analit ilave edildiğinde ve çalıĢma elektroduna ulaĢtığında bir elektrokimyasal reaksiyon meydana gelir ki bu reaksiyonlar indirgenme ve yükseltgenme reaksiyonlarıdır (ġekil
2.6) (Telefoncu, 1999). Elektrokimyasal sensörler 4 grupta incelenmektedir. Bunların içerisinde Potansiyometri Esaslı Biyosensörler ve Amperometri Esaslı Biyosensörler yaygın olarak kullanılan sensörlerdir.
Potansiyometri Esaslı Biyosensörler Amperometri Esaslı Biyosensörler Ġmpedimetrik Biyosensörler Kondüktometrik Biyosensörler
ġekil 2.6. Elektrokimyasal biyosensörün Ģematik gösterimi (Telefoncu, 1999). Potansiyometrik biyosensörler
Bu tür biyosensörlerde iyonik konsantrasyon değiĢimi iyon seçici elektrotlar tarafından belirlenir, bu pH elektrotları yaygın olarak kullanılan elektrotlardır. Bu nedenle, hidrojen iyonlarının serbest bırakılmasında büyük miktarda enzimatik reaksiyonlar söz konusudur (ġekil 2.7). Amonyak seçici ve karbondioksit seçici elektrotlar bazı diğer önemli elektrotlardır. Potansiyometrik elektrot ve referans elektrodu, potansiyel fark yardımı ile ölçülebilir ve doğrudan substrat konsantrasyonu ile orantılıdır. Potansiyometrik biyosensörler, enzimlerin H+ ve NH+4 gibi iyonik konsantrasyona duyarlılığıdır (Masoud, 2016).
ġekil 2.7. Potansiyometrik sensörün Ģematik gösterimi (Danielsson, 1990). Amperometrik biyosensörler
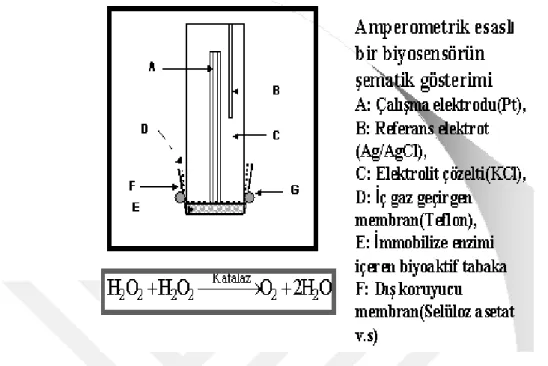
Bu biyosensörler, iki elektrot arasında potansiyel uygulandığında bir akım üretir; akım büyüklüğü, substrat konsantrasyonu ile doğru orantılıdır. En basit amperometrik biyosensörler, örnek (analit) çözeltisinde bulunan O2'nin azalmasını belirleyen Clark oksijen elektrodunu kullanır (ġekil 2.8). Bunlar ilk nesil biyosensörlerdir. Bu biyosensörler redoks reaksiyonlarını ölçmek için kullanılır, tipik bir örnek; glikoz oksidaz kullanılarak glikozun belirlenmesidir(Danielsson, 1990).
Bu tür biyosensörlerin en büyük problemi, analit solüsyonundaki çözünmüĢ O2 konsantrasyonuna bağımlı olmasıdır. Arabulucular kullanılarak bunun üstesinden gelinebilir; bu moleküller, analit solüsyonunda çözünmüĢ O2'nin azaltılması yerine reaksiyon tarafından üretilen elektronları doğrudan elektroda aktarır. Bunlara ayrıca ikinci nesil biyosensörler denir. Bununla birlikte günümüzde elektrotlar, indirgenmiĢ enzimlerin elektronlarını arabulucuların yardımı olmadan doğrudan çıkarır ve elektriksel olarak iletken organik tuzlarla kaplanır.
ġekil 2.8. Amperometrik bir biyosensörün Ģematik gösterimi (Danielsson, 1990).
2.3.3. Biyosensörlerin uygulama alanları
Biyosensörler, analitleri tespit etmek için kullanılan biyolojik bir element ve bir fizyokimyasal dedektör içeren cihazlardır. Bu enstrümanlar, klinikten çevreye ve tarıma kadar geniĢ bir uygulama yelpazesine sahiptir. Cihazlar aynı zamanda gıda endüstrisinde de kullanılmaktadır.
Biyosensör teknolojisini kullanan alanların bazı örnekleri Ģunları içerir: Genel sağlık denetimi
Hastalık taraması
Hastalığın klinik analizi ve teĢhisi Veterinerlik ve tarımsal uygulamalar Endüstriyel iĢleme ve izleme
Çevre kirliliği kontrolü (Telefoncu 1999). 2.3.4. Hazırlanan Biyosensörün Performans Faktörleri
Ġdeal bir biyosensör hazırlanırken hedeflenen amaçlar doğrultusunda uygulanabilir olması için sensörü etkileyen birçok performans faktörleri bulunmaktadır. Bunlar;
Seçicilik Kullanım ömrü
Kalibrasyon gereksinimi Tekrarlanabilirlik Kararlılık GeniĢ ölçüm aralığı Tayin sınırı Hızlı cevap zamanı
Basitlik ve ucuzluk olarak sıralanabilir.
Hazırlanan biyosensörün ideal tanımına uyması için bu faktörleri karĢılıyor olması gerekir.
Biyosensörün kalibrasyona hiç ihtiyaç duymaması ya da minimum seviyede gereksinmesi istenir. Fakat günümüzde teorik olarak istenilen bu özellik pratikte gerçekleĢtirilememektedir. Biyosensörün kullanım ömrü süresince belirli aralıklarla kalibre edilerek duyarlılıklarının ne seviyede olduğu araĢtırılır. Tasarlanan biyosensör sadece istenilen maddeye (glikoz) karĢı duyarlı olmalıdır. Duyarlılık, akım-deriĢim eğrisinin eğimi ile orantılıdır. Biyosensörlerin kullanılan madde dıĢında giriĢim yapan diğer maddelerden etkilenmemesi gerekir ki bu da seçici bir biyosensör olduğunu kanıtlar. Ġdeal bir biyosensör için elektrot kararlılığı oldukça önemlidir ve yüksek bir kararlılığa sahip olması istenir. Kararlılık, ısı, ortam, nem, kullanılan polimerin ya da destek malzemelerin kimyasal ve fiziksel karakteri gibi parametrelerden de etkilenmektedir.
Bir diğer faktör olan ölçüm aralığı, deneysel sonuçlarda elde edilen akım-deriĢim eğrilerinin lineer olduğu aralıktır. Biyosensör uygulamalarının tümünde çalıĢma ortamında belirli bir deriĢim miktarına ulaĢıldıktan sonra akım-deriĢim eğrilerinde lineerlikten sapma gözlenir. Bunun sebebi ölçülen akım değerlerindeki değiĢimin azalmasından dolayıdır ve bu durum ortamda bulunan analizlenecek madde miktarının fazlasıyla reaksiyona girmesi gereken nanoparçacığın bulunmamasından kaynaklıdır. Hazırlanan biyosensörün tayin sınırının belirli bir deriĢim miktarının altında olması gerekmektedir ve bu değer ne kadar düĢük miktarda ise sensör kullanım için o denli uygundur. Söz konusu olan bu tayin sınırı elektrot yüzeyinin büyüklüğü, kullanılan nanomalzeme tabakasının kalınlığı gibi parametrelerden etkilenmektedir.
Tekrarlanabilirlik ise zaman içerisindeki sensör kararlılığının bir ölçüsüdür. Biyosensör elektrodunun aynı deriĢim uygulamasıyla yapılan farklı deneylerde ya da benzer özelliklere sahip baĢka bir örneğe daldırıldığında aynı verilerin eldesi gerekmektedir ve sensörün tekrarlanabilirliği ne kadar iyi ise uygulanabilirliği de o denli iyi olur (Telefoncu 1999,
Thevenot vd. 2001). Biyosensör tasarımında nanoteknolojiden yararlanılarak nanobiyosensörler hazırlanmaktadır ve bu nanomalzemeler sensörün duyarlılığını artırmaktadır.
2.4. Nanoteknoloji ve Nanomateryaller
Nanoteknoloji, çeĢitli materyallerin nano boyutlu parçacıklarının mühendisliğini içeren çok önemli bir bilim alanıdır. Nanoteknolojinin amacı 100 nm„den daha küçük boyutlardaki cihaz ve sistemlerin hazırlanması, çalıĢması ve kullanımıdır. ABD Çevre Koruma Ajansı'na (EPA) göre nanoteknoloji "küçük boyutları nedeniyle yeni özelliklere ve iĢlevlere sahip yapıların, aygıtların ve sistemlerin oluĢturulması ve kullanılması" olarak tanımlanabilir (Kharevd., 2014). Nanoteknolojinin enerji üretimi ve depolanması, tıp, bilgi teknolojileri, imalat ve çevre uygulamaları gibi geniĢ bir yelpazede kullanılma potansiyeli vardır (Hyde, 2005).
Son on yılda, moleküler tanı için nanoteknoloji yöntemlerinin kullanılmasına yönelik pek çok geliĢme gözlenmiĢtir. Doğru, hassas ve seçici teĢhis sağlaması amacıyla biyosensör tasarımı için daha fazla çaba sarf edilmektedir. Bu nedenle ideal bir biyosensör hazırlanmasında nanoteknoloji oldukça önem taĢımaktadır. Ġdeal bir sensörün hassasiyet, seçicilik ve diğer özellikleri, nanomateryallerin kullanılmasıyla iyileĢtirilebilmektedir. Bu nedenle namomalzemeler; bazı avantajlarından dolayı sensör uygulamalarında sıkça kullanılmaktadır. Bu avantajlar:
Küçük boyut (1–100 nm) ve buna bağlı olarak yüzey/hacim oranının büyük olması, Boyut, kompozisyon ve Ģekille iliĢkilendirilen fiziksel özelliklerin kimyasal olarak
modifiye edilebilmesi,
Hedef molekülleri bağlama özelliklerinin farklı olması, Yapısal sağlamlık gibi özelliklerdir.
2.5. Nanosensörler ve Nanobiyosensörler
Nanosensör, kimyasal dönüĢümlerde merkezi bir rol oynar. Nanobiyosensör alanı (reaksiyonları katalize etmek için nanoparçacıkların kullanımı) son on yılda birçok alanda oldukça önemli geliĢmeler sağlamıĢtır. Metal nanopartiküller, yarı iletkenler, oksitler ve diğer bileĢikler bu alanda önemli kimyasal reaksiyonlar için yaygın olarak kullanılmaktadır.
Nanobiyosensör çalıĢmalarının temel amacı, % 100 seçicilik, son derece yüksek aktivite, düĢük enerji tüketimi ve uzun ömür ile sensör üretmektir. Nanosensör hazırlanmasında metaller ve destek malzemeler kullanılarak hazırlanan maddelere nanopartikül adı verilir. Ayrıca, nanopartiküller analitlerin elektrokimyasal tayininde sinyali artıran etkili
iĢaretleyicilerdir. Metal nanopartiküllerin iletkenlik özellikleri, kontrollü elektrokimyasal fonksiyonları ile biyomateryal yapılarının tasarlanmasına olanak sağlar (Telefoncu, 1997). Çizelge 2.1. Sensör tasarımında önemli parametreler.
Sensör tasarımında önemli
parametreler Örnekler Kaynaklar
Destek Maddeleri Karbon türleri Silika Alümina Titanyum dioksit Polimer destekler Lopez vd. Boudjahem vd. Balint vd. Konova vd. Greci vd. Kimyasal Reaksiyonlar Hidrojenasyonlar Ġndirgeme reaksiyonları Bozunmalar Fuel Cell Reaksiyonları
Dehalojenasyon Grunes vd. Ishiguro vd. Delpeux vd. Moore vd. Nutt vd.
2.5.1. Nanobiyosensör Destek Malzemeleri
Karbon, geniĢ yüzey alanı, yüksek gözeneklilik ve mükemmel elektron iletkenliği nedeniyle kimyasal ve enzimatik biyokütle transformasyon reaksiyonları için nanosensör veya nanosensör desteği olarak ikili rol oynamaktadır. Yeni aktivite kazandırmak veya geliĢtirmek için karbon, kimyasal olarak iĢlevselleĢtirilebilir ve/veya metalik nanopartiküller ve enzimler ile süslenebilir. Bu destek malzemelere birçok örnek verilebilir ancak bunlardan en yaygın kullanılanlar grafen, grafen oksit, tek duvarlı ve çok duvarlı karbon nanotüpler, indirgenmiĢ grafen oksit ve aktif karbondur. Karbon türlerinden bazıları ġekil 2.9.‟da gösterilmektedir (Lam ve Luong, 2014).
ġekil 2.9. Grafen, Tek Duvarlı KNT, Çok Duvarlı KNT ve Aktif Karbonun Ģematik gösterimi (Wang ve Yi Shi, 2014).
Bu tez çalıĢmasında ġekil 2.9.‟da yer alan karbon türlerinden Aktif Karbon destek maddesi kullanılmıĢ ve bunlar indirgeme reaksiyonunda kullanılmıĢtır.
3. MATERYAL METOD 3.1. Materyal
3.1.1. Cihaz ve diğer ekipmanlar
Ölçümlerde Gamry interface 3000 marka potansiyostat kullanılarak denemeler gerçekleĢtirilmiĢtir. Diğer ekipmanlar:
ISOLAB manyetik karıĢtırıcı SHIMADZU AY220 analitik terazi Mikro pipet
3.1.2. Kimyasallar
Deneysel çalıĢmalar için temin edilen kimyasallar: Platin tetraklorür (PtCl4) ( Sigma-Aldrich)
Nikel(II) asetat tetrahidrat (Ni(OCOCH3)2 · 4H2O) ( Sigma-Aldrich) Aktif karbon( Sigma-Aldrich)
Nafyon (%5‟lik) ( Sigma-Aldrich) Glikoz (C6H12O6) ( Sigma-Aldrich)
Sodyumhidroksit (NaOH) ( Sigma-Aldrich) Sodyum klorür(NaCl) (Sigma-Aldrich) Ürik asit (C5H4N4O3) ( Sigma-Aldrich) Dopamin hidroklorür( Sigma-Aldrich) Askorbik asit (C6H8O6 ) (Sigma-Aldrich)
Dimetil aminoboran ((CH3)2NH · BH3) ( Sigma-Aldrich) N,N-Dimetilformamid (DMF) ( Sigma-Aldrich)
Deneysel çalıĢmalarda kullanılan çözeltiler: 0,1 M glikoz çözeltisi
10 µM glikoz çözeltisi 1 M NaOH çözeltisi
3.2. Metod
3.2.1. Ni@AK, Pd@AK ve Ni-Pd@AK nanobiyosensörlerinin sentezi
Ni-Pd@AK nanobiyosensörlerin sentezinde; Ni(acac) (25 mL C2H5OH içinde 0,25 mmol) ve PdCl2 (25 mL C2H5OH içinde 0,25 mmol) çözeltileri 15 dakika manyetik karıĢtırıcı yardımıyla karıĢtırıldı, üzerine aktif karbon (2,5 mmol) ilave edildi ve tekrar 15 dakika karıĢtırıldı. Daha sonra, elde edilen karıĢım 90 °C'de 2 saat süreyle reflux yapıldı. Ġnert bir ortam sağlandı (azot atmosferi) ve üzerine 148 mg DMAB eklenerek 1 saat daha reflux yapıldı. Çözeltinin rengi ġekil 3.1.‟ de görüldüğü gibi açık kahverengiden siyaha dönüĢtü bu da bize Ni-Pd nanoparçacıklarının oluĢtuğunu gösterdi.
ġekil 3.1. Ni-Pd nanoparçacıkların sentez aĢamaları.
Ni-Pd@AK nanosensörü sentezlendikten sonra etanol ile yıkama iĢlemi ve son olarak kurutma iĢlemi yapıldı. Tüm bu aĢamalar Pd@AK ve Ni@AK sensörleri için de ayrı ayrı yapıldı ve sentezleri gerçekleĢtirildi.
3.2.2. Elektrot solüsyonlarının ve çalıĢma elektrotlarının hazırlanması
Sentezlenen nanosensörlerin (Ni@AK, Pd@AK ve Ni-Pd@AK) elektrot solüsyonları hazırlanırken 0,02 g tartıldı ve 3 ayrı flaska alındı. 75 µL Nafyon ve 150 µL DMF ve 1 ml distile su ilave edildi. Daha sonra flasklara gerekli etiketlendirmeler yapılarak maksimum homojenlikte bir karıĢım elde edilinceye kadar ultrasonik banyoda bekletildi. HazırlanmıĢ olan solüsyonlardan 10 µL mikro-pipet yardımıyla alınarak 3 mm çapı bulunan camsı karbon elektrot diskin üzerine damlatıldı ve etüvde kurumaya bırakıldı. Sonuç olarak çalıĢma elektrotları
elektrokimyasal analizler için hazır hale getirilmiĢ oldu. Ni@AK, Pd@AK ve Ni-Pd@AK nanobiyosensörlerinin her biri için aynı yöntem kullanıldı.
3.2.3. Elektrokimyasal hücrenin hazırlanması
Bu tez kapsamında kullanılan elektrokimyasal hücre sisteminde 3 temel elektrot bulunmaktadır. ÇalıĢma elektrodu olarak 3 mm çapında camsı karbon elektrot, karĢıt elektrot olarak Pt levha ve referans elektrot olarak ise Ag/AgCl tel kullanılmaktadır. ġekil 3.2.‟de hazırlanan elektrokimyasal hücre sistemi gösterilmiĢtir. Bu sistemde elektrolit olarak 0.1M NaOH kullanıldı. Son olarak inert bir ortam sağlanabilmesi için deneyler sırasında hücreden 3-5 dakika azot gazı geçirildi ve istenilen deneysel çalıĢmalar geçekleĢtirildi.
ġekil 3.2. Elektrokimyasal hücre düzeneği.
3.2.4. Hazırlanan nanosensörlerin karakterizasyon teknikleri
Nanosensörlerin, doku ve kimyasal yüzey gibi önemli parametreleri, katalitik aktivitelerini özelliklerine bağlayabilmek için belirleyicidir. Bu nedenle nanosensör karakterizasyonu, kataliz alanındaki herhangi bir çalıĢmada kilit nokta haline gelmektedir. 3.2.4.1. Geçirimli elektron mikroskobu (TEM)
TEM, nanokompozitlerin karakterizasyonunda yaygın olarak kullanılan, materyal bilimlerinde en güçlü tekniklerden biridir. Morfolojik çalıĢmalar için yüksek çözünürlük sağlayan ve bunu görüntüleme aralığını 0,3 μm ile 0,15 nm arasında geniĢleterek sağlayan
oldukça etkili bir tekniktir. Bu teknik nanokompozitlerin anatomik özelliklerini, boyutunu ve nanometre ölçeğine kadar olan çözünürlükteki kimyasal değiĢimlerini inceleme olanağı sağlar (Imelik vd., 1994). Ġleri tasarımlı modern TEM, kafes kusurlarını, atomları ve hatta hareketlerini dahi gözlemleyebilmektedir.
Ġlk pratik TEM, Albert Prebus ve James Hillier tarafından 1938'de Max Knoll ve Ernest Ruska tarafından daha önce geliĢtirilen kavramlar kullanılarak Toronto Üniversitesi'nde inĢa edilmiĢtir (Goodhew vd.2001). O zamandan bu yana, TEM önemli bir geliĢme kaydetmiĢ ve Ģimdi malzeme bilimi ve biyolojisinde çok yönlü karakterizasyon aracı haline gelmiĢtir. ġekil 3.3.'de gösterilen Ģematik diyagramına bakacak olursak eğer projeksiyon, objektif, yoğunlaĢtırıcı ve mercekleriyle geleneksel mikroskoplara benzemektedir.
ġekil 3.3. Geçirimli elektron mikroskobunun Ģematik diyagramı (Carter ve Williams, 2009). Yürütülen tez kapsamıında hazırlanan nanoparçacıkların TEM analizleri, ODTÜ Merkez Laboratuvarı‟nda yer alan JEOL 200 kV TEM cihazı kullanılarak yapılmıĢtır.
3.2.4.2. X-ıĢını kırınımı (XRD)
X-ıĢını kırınımı (XRD), kristal katıların karakterizasyonu ve yapısının belirlenmesi için katı haldeki kimyasallar için mineralojistlerin ve kimyagerlerin kullandığı baĢlıca tekniklerden biridir (ġekil 3.4). Tüm katı malzemelerin yaklaĢık % 95'i kristal olarak tanımlanabilir ve X-ıĢınları bir kristalin faz ile etkileĢime girdiğinde, olayın X-X-ıĢınları ile katı atomik mimarisi arasındaki etkileĢimin bir sonucu olarak bir difraksiyon paterni oluĢur (Cahn, 2005). Her kristal
katı, benzersiz bir atomik mimariye sahiptir ve dolayısıyla benzersiz bir karakteristik X-ıĢını desenine sahiptir. Bu kalıplar katı fazların tanımlanması için 'parmak izi' olarak kullanılabilir yani her birine ait spesifik pikler bulunmaktadır. Malzeme tanımlandıktan sonra X-ıĢını kristalografisi, yapısını, diğer bir deyiĢle atomların kristal halde nasıl paketlendiğini, birim hücrenin boyutunu ve Ģeklini belirlemek için kullanılabilir.
Bragg yasası olarak adlandırılan ve X-ıĢınlarının kristalin yüzeyinden saçıldığı açıyı açıklayan iliĢki W. Lawrence Bragg ve William H. Bragg tarafından keĢfedilmiĢtir. (Moudler vd., 1992). Bragg yasası aĢağıdaki eĢitlikle açıklanmıĢtır:
nλ = 2dsinθ Bragg yasasında;
n = Kırınım sabiti,
λ = X-ıĢınlarının dalga boyu
d = 2 atom katmanı arasındaki boĢluk
θ = gelen X-ıĢını ve atom katmanı arasındaki açıdır.
ġekil 3.4. Kristal düzlemde gerçekleĢen X-ıĢını kırınımının çalıĢma prensibi (He, 2009). Hazırlanan tez kapsamında XRD analizleri için, Dumlupınar Üniversitesi Ġleri Teknolojiler AraĢtırma Merkezi‟nde yer alan Ultima+teta-teta yüksek çözünürlüklü goniometre içeren Panalytical Emperian difraktometresi kullanılmıĢtır.
3.2.4.3. X-ıĢını fotoelektron spektroskopisi (XPS)
X-ıĢını fotoelektron spektroskopisi (XPS) ultra-yüksek vakum altında çalıĢan, yaygın olarak kullanılan hassas bir kimyasal yüzey analiz tekniğidir. Yüzey özelliklerinin belirlenmesinde, monokromatik X-ıĢınındaki fotonlar yüzeydeki atomlar tarafından adsorbe edildikten sonra saçılan ikincil elektronlar arasındaki enerji farkı ölçülür (Brandon ve Kaplan, 2008). Fotoelektronların kinetik enerjileri, yalnızca yayılımda bulunduğu atomların karakteristik değil, aynı zamanda bu atomların kimyasal durumları hakkında bilgi sağlayabilir. ġekil 3.5.‟de XPS‟in çalıĢma prensibi yer almaktadır (Crist vd. 2005).
X-ıĢınlarının enerjisi, bir elektronun değerlik yörüngesinden sürekliliğe uyarılması için gerekli olan enerjiyi, yüzey iĢlevi olarak bilinen kritik bir enerjiden daha büyük olduğunda, ıĢınlama sırasında elektronların yüzey atomlarından yayıldığı bulunmuĢtur. Alt yörüngelerden yayılan elektronlar için, elektronun bağlanma enerjisinin de üstesinden gelinmesi, böylece yayılan elektronun kinetik enerjisinin daha da azalması gerekir. Bu nedenle, çıkarılan bir elektronun kinetik enerjisi, X maddesinin iĢ fonksiyonundan eksi elektronun bağlanma enerjisini çıkaran enerjisine eĢit olacaktır. XPS'de, çıkarılan fotoelektronların kinetik enerjisi bir analizör ile ölçülür (Wagner vd., 1979). Kaydedilen kinetik enerji, bir elektronun spesifik atomik yörüngesinin bağlanma enerjisine dönüĢtürülür. Her bir element eĢsiz bir enerji seviyesi grubuna sahip olduğundan, her element aynı zamanda bu seviyelerde bulunan elektronlar için eĢsiz bir bağlama enerjileri setine sahiptir.
Bağlanma enerjisi aĢağıdaki denklemde açıklanmaktadır:
Burada;
EB = elektron bağlama enerjisi/eV; ES = elektron kinetik enerjisi/eV; h = Planck sabiti/eV.s;
= X ıĢınlarının olayı/s-1
frekansı;
= yüzey iĢlevi/eV; olarak tanımlanmıĢtır.
Tez çalıĢmasında hazırlanan nanoparçacıkların XPS analizleri için, ODTÜ Merkez Laboratuvarı‟nda yer alan Specs Scientific spektrofotometre kullanılmıĢtır.
ġekil 3.5. X-ıĢını fotoelektron spektroskopisinin çalıĢma prensibi (Cahn, 2005). 3.2.4.4. Raman spektroskopisi (RS)
Raman spektroskopisi, bir sistemdeki titreĢim, dönme ve diğer düĢük frekans modlarını incelemek için yoğunlaĢtırılmıĢ madde fiziği ve kimyasında kullanılan spektroskopik bir tekniktir (ġekil 3.6). Tek renk lazer ıĢığının elastik olmayan saçılması veya Raman saçılması üzerine dayanmaktadır. Lazer ıĢığı, sistemdeki fononlar veya diğer uyarılarla etkileĢime girer, böylece lazer fotonlarının enerjisi yukarı veya aĢağı kaydırılır (Gouadec vd., 2007). Enerji kayması, sistemdeki fonon modları hakkında bilgi verir. Raman etkisi, ıĢık bir molekül üzerine çarptığında, o molekülün bağlarının elektron bulutu ile etkileĢime girdiği zaman meydana gelir ve foton, elektronlardan birini sanal bir hale getirir. Eğer molekül zaten yüksek bir titreĢim enerjisi durumunda bulunuyorsa, Raman saçılması bu anti-stokes Raman saçılması olarak adlandırılır. Molekülün Raman etkisini göstermesi için titreĢim koordinatına göre elektron bulutunun deformasyon miktarı ya da moleküler polarizabilite değiĢimi gerekir. TitreĢim bilgisi moleküllerdeki kimyasal bağlar için çok spesifik olduğundan, Raman spektroskopisi kimyada yaygın olarak kullanılır. Bu nedenle, molekülün 500-2000 cm-1 aralığında tanımlanabileceği bir parmak izi sağlar (Eitan vd., 2006).
Tez kapsamında kullandığımız AK bir Raman aktif malzemedir bu nedenle Raman analizi yapılmıĢtır ve nanosensörlerin analizleri ODTÜ Merkez Laboratuvarı‟nda bulunan 514 nm‟lik lazer yayılımlı Raman mikroskobu kullanılarak yapılmıĢtır.
ġekil 3.6. Raman saçılım Ģeması ve iki atomlu bir molekülün olası titreĢimleri (Gouadec vd., 2007).
3.2.5. Hazırlanan Nanosensörlerin Elektrokimyasal Analiz Teknikleri 3.2.5.1. Döngüsel voltametri (CV) Tekniği
Döngüsel voltametri (CV) potansiyometrik elektrokimyasal ölçümün bir türüdür ve reaksiyonun indirgenme ve yükseltgenmesini ölçmek için kullanılan bir tekniktir. Döngüsel voltametri deneyinde, çalıĢma elektrodunun potansiyeli zamana göre lineer olarak tarama yapmaktadır. CV deneyinde ayarlanan potansiyele ulaĢıldıktan sonra, çalıĢma elektrodunun potansiyeli, baĢlangıç potansiyeline dönmek için ters yönde tarama yapmaktadır. Potansiyel taramaların bu döngüleri, gerektiği kadar tekrarlanabilir. Döngüsel voltametri genellikle çözeltideki bir analitin elektrokimyasal özelliklerini incelemek için kullanılır. ÇalıĢma elektrodu ile referans elektrot arasında potansiyel ölçülürken, akım çalıĢma elektrodu ve karĢıt elektrot arasında ölçülür. Bu veriler, uygulanan potansiyele (E, genellikle sadece 'potansiyel' olarak anılmaktadır) göre akım (i) olarak çizilir. ġekil 3.7.‟de tipik bir döngüsel voltametride anodik ve katodik tepe akımlarını gösteren görüntü verilmiĢtir (Scholz, 2002).
ġekil 3.7. Ġndirgenme ve yükseltgenme piklerinin gösterildiği tipik bir döngüsel voltametri görüntüsü.
3.2.5.2. Kronoamperometri (CA) Tekniği
Kronoamperometri (CA), çalıĢma elektrodunun göstermiĢ olduğu potansiyel değerinin faradaik bir reaksiyon olmasına yetmeyecek bir akım değerinden (E1), ani olarak E2 yani elektron aktarım hızının oldukça yüksek olduğu bir potansiyele değiĢtirilmesi ile durağan ortamda zamana karĢı akım iliĢkisinin incelenmesine dayanan bir elektrokimyasal tekniktir. Kullanılan bu teknikte zamana karĢı akım değiĢimi izlenmektedir ve kütle transferi yalnızca difüzyon etkisiyle gerçekleĢir. Kronoamperometri tekniği ile;
Reaksiyon mekanizması ve kinetiği hakkında bilgi sahibi olunabilir. Difüzyon katsayısı hesaplanabilir.
Elektron aktarım reaksiyonun hız sabiti bulunabilir. Reaksiyonda aktarılan elektron sayısı belirlenebilir. Elektrotta bir adsorbsiyon olup olmadığı belirlenebilir.
Tipik bir kronoamperometri grafiğindeki potansiyel-zaman iliĢkisi ġekil 3.8.‟de gösterilmektedir. Hazırlanan tez kapsamında sentezlenen nanoparçacıkların kronoamperometri (CA) ve döngüsel voltametri (CV) analizleri Sen Research Group Laboratuvarı‟nda yer alan Gamry Reference 3000 Potentiostat/Galvanostat/ZRA cihazı kullanılarak gerçekleĢtirilmiĢtir
4. BULGULAR VE TARTIġMA
4.1. Sentezlenen Pd@AK, Ni@AK ve Ni-Pd@AKNanosensörlerinin Karakterizasyonu Tez kapsamında sentezlenen Pd@AK, Ni@AK ve Ni-Pd@AK nanosensörlerinin fiziksel karakterizasyon iĢlemleri için Geçirimli Elektron Mikroskobu, X-IĢını Kırınımı, Raman Spektroskopisi ve X-IĢını Fotoelektron Spektroskopisi kullanılmıĢtır. Bunun yanında glikoz elektro-oksidasyonuna karĢı gösterdiği yanıtlar ise Döngüsel Voltametri ve Kronoamperometri kullanılarak ölçülmüĢtür. Elde edilen bulgular maddeler halinde aĢağıda verilmiĢtir.
4.1.1. Nanosensörlerin X-ıĢını kırınım sonuçları ve değerlendirmeleri
Bu tez çalıĢmasında, tek dağılımlı Ni-Pd@AK nanoparçacıkların kristal yapısını ve ortalama kristal boyutunu tanımlamak için XRD analizi yapılmıĢtır. Kristal yapılar ġekil 4.1.'de yüzey merkezli kübik yapı olarak görülmektedir. Difraksiyon pikleri daha yüksek 2θ değerlerine hafifçe kaydırılmıĢ (saf Pd değerlerine kıyasla) ġekil 4.1.'de görülebilir ve bu tek dağılımlı Ni-Pd@AK alaĢımı oluĢtuğunu gösterir. Ayrıca bu grafikte, yaklaĢık 25,5° lik derecede görülen AK'ye ait karbon piki gözlenmiĢtir. Ni-Pd için XRD modellerinde, Ni türünün kırınım piki, malzemelerin amorf yapısı ile iliĢkili olan Pd türleri için nispeten güçlü sinyaller nedeniyle saptanamamıĢtır. Bununla birlikte, tek dağılımlı Ni-Pd@AK NP eğrisinde zayıf bir Ni (111) kırınım piki vardır. ġekil 4.1.'de, 2θ = 40,3°, 46,4°, 68,4° ve 82,5° daki açılar sırasıyla Pd (111), (200), (220) ve (311) kristal düzlemlerine karĢılık gelmektedir. Ayrıca, ortalama kristal parçık boyutu, aĢağıda verilen Scherrer formülü yardımıyla 3.66 ± 0.42 nm olarak hesaplanmıĢtır;
( )
K, katsayı (0,9), λ kullanılan radyasyonun dalga boyu (1,54056 Ǻ), β rad cinsinden ilgili kırınım pikinin tam geniĢliğinin yarısıdır ve θ, pikteki konumdaki açıdır. XRD‟deki maksimum Pd (220) piki, kafes parametre değerlerini (αPd) hesaplamak için kullanılmıĢtır. Tek dağılımlı Ni-Pd@AK NP'ler için kafes parametre değeri, aĢağıdaki formülden yararlanılarak 3,88 Å olarak hesaplanmıĢtır. Bu bulgu saf Pd değeriyle (3,89 Å)ile karĢılaĢtırıldığında uyum sağladığı gözlenmiĢtir.
√
ġekil 4.1. Pd@AK ve Ni-Pd@AKnanosensörlerine ait XRD görüntüsü.
4.1.2. Ni-Pd@AK tek dağılımlı nanosensörün geçirimli elektron mikroskobu bulguları ve değerlendirmeleri
Ni-Pd@AK nanoparçacıklarının (NP) morfolojisi, topolojisi, boyutu ve bileĢimini belirlemek için TEM analizleri gerçekleĢtirilmiĢtir. Elde edilen sonuçlar ġekil 4.2.‟de gösterilmiĢtir. ġekilden de anlaĢılacağı üzere Ni-Pd nanoparçacıklarının aktif karbon destek malzemesi yüzeyine homojen dağıldığı görülmektetir. Parçacık boyutu ortalama olarak 3,72 ± 0,42 nm olarak ölçülmüĢtür. Nanoparçacıkların morfolojisini gösteren HRTEM sonuçları da ġekil 4.2.‟de görülebilir. Parçacıkların geometrik yapısının çoğunlukla küresel olduğu gözlenmiĢtir. AraĢtırma sonucunda bu sensörler için topaklanma gözlemlenmemiĢtir. Bu Ģekilde, tek dağılımlı Ni-Pd@AK nanosensörü için literatürdeki Pd (111) aralığı (0,21 nm) ile tamamen aynı olan bir 0,21 nm atomik örgü saçak parametresi gözlenmiĢtir.
ġekil 4.2. Ni-Pd@AK nanosensörünün a) TEM ve HRTEM görüntüsü, b) parçacık boyutu histogramı ve c) Ni ve Pd nanoparçacıklarının kırmızı çizgi boyunca görülen çizgi profili.
4.1.3. Ni-Pd@AK tek dağılımlı nanosensörünün X-ıĢını fotoelektron spektroskopisi bulguları ve değerlendirmeleri
X-ıĢını fotoelektron spektroskopisi (XPS), kimyasal dağılım koĢullarını ve tek dağılımlı Ni-Pd@AK NP'lerdeki Pd ve Ni'nin yüzey bileĢiklerini incelemek için kullanılmıĢtır. Bu araĢtırmada, spektrumun Pd 3d ve Ni 2p bölgesi Gauss-Lorentzian yöntemi ile incelendi. Türlerin nispi yoğunluğu, her pikin integralini hesaplayarak ve Shirley Ģeklindeki arka planı pürüzsüzleĢtirdikten ve çıkartıldıktan sonra değerlendirildi. Bağlanma enerjileri (± 0,3 eV), XPS spektrumunda 283,6 eV'de C1s piki referans alınarak belirlendi. XPS sonuçları ġekil 4.3.'de gösterilmiĢtir. Literatürdeki deneysel bağlanma enerjileri (Pd-3d5/2 334,8 eV ve Ni-2p3/2 856,9 eV) kıyaslandığında (Pd-3d5/2 334,8 eV ve Ni-2p3/2 856,2 eV), yüzeydeki Pd ve Ni'nin oksit olmadığı, metalik oldukları anlaĢıldı. Ni bağlanma enerjisi için, 2p3/2 pikinin daha düĢük enerjiye kayması, Ni-Pd'nin alaĢım olduğunu göstermektedir. Bu bulgular Ni ve Pd'nin O2 içeren oksit bileĢiklerinden ziyade bu çalıĢmada üretilen Ni-Pd@AK NP'lerde element olarak
var olduğunu gösterdi. Bunun nedeni, NP'ler sentezlendiğinde Pd(0) ve Ni(0) metallerin AK destek malzemesi üzerinde tutunmasıdır.
ġekil 4.3. (a) Ni-Pd@AK sensörünün Ni 2p XPS spektrumu ve Ni 2p'nin 3D görünümünün XPS spektrumları. (b) Ni-Pd@AK için Pd 2p'nin XPS spektrumları ve Pd 2p 3D görünümü XPS spektrumları.
4.1.4. Ni-Pd@AK nanobiyosensörünün raman spektroskopisi bulguları ve değerlendirmeleri Raman spektroskopisi, karbonlu malzemelerdeki düzenli ve düzensiz karbon yapılarını ayırt etmek için mevcut tez çalıĢmasında kullanılmıĢtır. ġekil 4.4.'te AK, Ni-Pd@AK'nin Raman spektrumu gösterilmiĢtir. 1349 cm-1
ve 1581 cm-1'deki pikler, bu Ģekildeki göze çarpan dağılma zirveleridir. ID / IG oranının D ile G bandının yoğunluk oranı olduğu bilinmektedir ve AK'deki modifikasyon derecelerini veya kusurlarını bulmak için kullanılabilir. Bu çalıĢmada AK ve tek dağılımlı Ni-Pd@AK'nin ID/IG değerleri sırasıyla 0,81 ve 1,00 olarak bulunmuĢtur; bu da, AK
ile Ni-Pd nanoparçacıkların birbirine bağlandığını ve yeni bir nanomalzeme sentezlendiğini göstermektedir.
ġekil 4.4. AKve Ni-Pd@AK ait Raman spektrumu.
4.2. Hazırlanan Pd@AK, Ni@AK ve Ni-Pd@AK Nanosensörlerinin Elektrokimyasal Aktivitelerinin Belilenmesi
Sentezlenen nanoparçacıkların gerekli karakterizasyon analizlerinin tamamlanmasının ardından glikoza karĢı elektrokimyasal aktivitesine bakmak için kronoamperometri ve döngüsel voltametri teknikleri ile çalıĢıldı.
4.2.1. Ni-Pd@AKsensör ile hazırlanan elektrodun karĢılaĢtırma çalıĢmasına dair bulgular KarĢılaĢtırma çalıĢması 0,1 M NaOH tampon çözeltisinde inert bir ortamda AK, Pd@AK, Ni@AK ve Ni-Pd@AK nanosensörleri için öncelikle glikoz ilavesi yapılmadan tarama iĢlemi CV çalıĢması ile gerçekleĢtirilmiĢtir. Daha sonra aynı iĢlem her bir elektrot için 0,3 mM glikoz ilavesi yapılarak ölçülmüĢtür. Ni(II)/ Ni(III) ve Pd(II)/Pd(III) anodik ve katodik pikleri 0,18 ve 0,4 V‟de gözlenmiĢtir. Her bir çevrimsel voltametri testi 50 mVs-1 tarama hızında (-0,2)-(0,8) V potansiyel aralığında yürütülmüĢtür. Sonuçlar ġekil 4.5.‟de gösterilmiĢtir.
Anodik ve katodik piklerde hem Ni@AK hem de Pd@AK modifiye elektrotlar için çok artıĢ olmamasına rağmen, Ni-Pd@AK modifiye edilmiĢ elektrottaki katodik ve anodik pik akımları önemli miktarda artıĢ göstermiĢtir. Bunun nedeni Ni ve Pd metalleri ile glikozun glikonolaktona elektro-oksidayonunun daha yüksek seviyede sağlanmıĢ olması ve AK ile yüzey alanında artıĢ olmasıdır.
ġekil 4.5. AK, Pd@AK, Ni@AK ve Ni-Pd@AK elektrotlarının 0,1 M NaOH içerisinde 50 mV/s tarama hızında boĢ ve 0,3 mM glikoz ilavesinde alınan döngüsel voltamogram sonuçları.
4.2.2. Ni-Pd@AK elektrodun glikoza duyarlılığına deriĢimin etkisi
Ni-Pd@AK camsı karbon elektrodun anodik tepe akımı üzerindeki glikoz miktarının etkisi döngüsel voltametri kullanımıyla incelendi. ġekil 4.6.‟da çeĢitli glikoz miktarları (0,1 M NaOH içinde 0,1 mM ila 0,7 mM arasında değiĢen) ile Ni-Pd@AK camsı karbon elektrot tarafından elde edilen döngüsel voltametri (CV) verileri gösterilmektedir. Bu Ģekilde glikoz miktarı ile oksidasyon pik yoğunluğu arasındaki iliĢki belirlenmiĢtir.
ġekil 4.6. Ni-Pd@AK için 0,1 M NaOH‟da çeĢitli glikoz konsantrasyonlarındaki döngüsel voltamogramları aĢağıdan yukarıya doğru: (a) 0,1; (b) 0,2; (c) 0,3; (d) 0,4; (e) 0,5; (f) 0,6 ve (g) 0,7. Kalibrasyon grafiği de ek olarak Ģeklin içerisinde gösterilmiĢtir.
4.2.3. Ni-Pd@AKelektrodun glikoza duyarlılığına tarama hızı etkisi
Ni-Pd@AK'nin elektrokimyasal tutumları 0,1 M NaOH'de çeĢitli tarama hızı değerinde 0,3 mM glikoz kullanılarak incelendi. ġekil 4.7.'deki grafikte görüldüğü gibi, glikozun yükseltgenme/indirgenme tepe akımı artan tarama hızı ile 20 mV/s'den 140 mV/s‟ye yükseltilmiĢtir. Sonuç olarak, Ni-Pd@AK modifıye elektrotunun redoks reaksiyonu için difüzyon kontrollü bir elektrokimyasal sensör olduğu belirlenmiĢtir.
ġekil 4.7 Ni-Pd@AK için 0.5 mM glikoz varlığında 0.1 M NaOH içerisinde farklı tarama hızlarındaki (20 ila 140 mVs-1.) döngüsel voltamogramları. Ek olarak kalibrasyon grafiği de Ģekil içerisinde gösterilmiĢtir.
Bu sonuç, elektrokatalitik glikoz oksidasyonunun, glikozun ve Ni-Pd@AK'nin yükseltgenme-indirgenme arasındaki reaksiyonlardaki yük transfer kinetik sınırlamaların arttığını düĢündürmektedir. Bu noktada, tüm elektrokimyasal araĢtırmalarda 0,1 M NaOH (yüksek konsantrasyonda güçlü bir destekleyici elektrolit) kullanıldığından, yüksek omik düĢüĢ nedeniyle potansiyel olarak daha pozitif değerlere kayma olasılığı önemsizdir. Bu sonucun nedeni aktif karbon varlığında oluĢan büyük elektrot yüzey alanıdır (ġekil 4.8).
ġekil 4.8. 0,1 M NaOH çözeltisi içindeki Ni-Pd (A) ve Ni-Pd@AK (B) modifiye edilmiĢ elektrotlar için potansiyel tarama hızına karĢı döngüsel voltametrinin pik değerleri.
4.2.4. Ni-Pd@AK elektrot ile glikozun amperometrik olarak tespiti
ġekil 4.9.‟da modifiye edilmiĢ Ni-Pd@AK elektrotunun 0,1 M NaOH solüsyonunda 0,55 V'de glikozun 0,1 mM ve 10 µM konsantrasyon miktarındaki artıĢla amperometrik yanıtlarını simgelemektedir (sırasıyla ġekil 4.9.(a) ve ġekil 4.9.(b)). Bu grafikte, glikoz ve ölçülen akım (I) arasındaki doğrusal denklem gösterilmiĢtir. Modifiye edilmiĢ elektrot, glikoz ilave edildiğinde hızlı tepki verdi ve 2-4 saniye sonra, akım sabit duruma geldi. Amperometrik sinyaller 10 μM ila 1 mM aralığında glikoz konsantrasyonu ile çok yüksek doğrusal korelasyon gösterdi. Amperometrik sonuçların doğrusal korelasyon katsayıları 0,9967 ve 0,9959 olarak belirlenmiĢtir. Önerilen elektrodun en düĢük tayin limiti 0.014 µM olarak hesaplanmıĢtır. (S/N=3).
ġekil 4.9. (a) 0,1 mM ardıĢık glikoz ilave edildiğinde tek dağılımlı Ni-Pd@AK elektrodunun amperometrik yanıtları. (b).Ni-Pd@AK‟nin art arda 10 µM glikoz ilavesi ile elde edilen kronoamperometri eğrileri. Ek olarak glikoz saptama doğrusal kalibrasyon eğrileri.
4.2.5. Ni-Pd@AK elektroduna giriĢim yapan maddelere yanıtının incelenmesi
Gerçek örneklerde, ÜA (ürik asit), DA (dopamin), AA (askorbik asit) ve diğer karbonhidrat türleri (fruktoz ve laktoz gibi) glikoz tayininde giriĢimde bulunurlar. Bu nedenle, biyosensörlerin seçiciliği oldukça önemlidir. Bu araĢtırma için +0,5 V potansiyelli 0,1 M NaOH solüsyonunda 1 mM glikoz ve 0,1 mM laktoz, fruktoz, NaCl, AA, DA ve ÜA'nın art arda eklenmesine yönelik amperometrik yanıtlar incelenmiĢtir. Bu amperometrik yanıtları ölçerek giriĢimi inceledik ve sonuçlar ġekil 4.10.'da verilmiĢtir. Sonuçlara bakıldığında glikoz eklendiğinde oldukça yüksek pik gözlenmiĢtir. Buna ek olarak, fruktoz, UA ve laktoza verilen mevcut tepki önemsizdir.
ġekil 4.10. Ni-Pd@AK camsı karbon elektrodunun giriĢimcilerin (0,1 mM AA, DA, fruktoz, UA ve laktoz ilaveleri) ve 1 mM ardıĢık glikozun amperometrik yanıtı üzerindeki etkisi. (0,1 M NaOH çözeltisi +0.5 V'de).
4.2.6. Ni-Pd@AK elektrodunun kararlılığının ve tekrarlanabilirliğinin incelenmesi
Sensörün uzun süreli istikrarı, 30 gün içinde glikoza cevabı ölçülerek değerlendirildi (ġekil 4.11). Burada, oda sıcaklığında optimum koĢullardaki elektrodun anodik tepe akımlarındaki değiĢimler ölçüldü. Ni-Pd@AK camsı karbon elektrot özgün tepkisinin neredeyse %88'ini 30 günden sonra korumuĢ ve mükemmel istikrar göstermiĢtir. Aynı zamanda kısa dönem kararlılığı da çoklu döngü alınarak 1000 döngü sonunda 5 mA‟lik düĢüĢ gözlenmiĢtir. Deneyler süresince Ni-Pd@AK elektrodu, kullanılmadığında buzdolabında tutulmuĢtur. Bütün bu veriler, Ni-Pd@AK modifiye edilmiĢ elektrodun uzun vadede kararlı ve depolamaya uygun olduğunu göstermektedir. Ayrıca, tek dağılımlı Ni-Pd@AK nanosensörü, Çizelge 4.1.'de gösterildiği gibi doğrusal aralık, hassasiyet ve LOD açısından diğer Ni, Pd ve Ni-Pd bazlı sensörler ile karĢılaĢtırılmıĢtır. Bu sonuçlar, enzimatik olmayan biyosensörün (Ni-Pd@AK) diğerlerine kıyasla çok ileri performanslara sahip olduğunu göstermiĢtir.
ġekil 4.11. (a) +0.50 V'da 1 mM glikoz ile 0,1 M NaOH kullanılarak çoklu döngü voltamogramı. (b) +0.50 V'da 1 mM glikoz ile 0,1 M NaOH kullanılarak 30 günde optimum Ģartlar altında depolanan sensörün kararlılığı.
Çizelge 4.1. Literatürde bulunan Ni ve Pd ile hazırlanmıĢ bazı sensörler veNi-Pd@AK‟nin kıyaslanması.
4.3. Biyolojik Sıvıda (kanda) Glikoz Tayini
Ni-Pd@AK camsı karbon elektrodunun rutin hayatta uygulanabilirliğini değerlendirmek için bir insan kan serum örneğindeki glikoz konsantrasyonunu saptamak için uygulanmıĢtır. Bu testlerde gerekli seyreltme iĢlemlerinin ardından her serum numunesinden 20 μL alınarak 10 mL 0,1 M NaOH çözeltisi ile karıĢtırıldı ve amperometrik ölçümle Ni-Pd@AK modifıye elektrot kullanılarak ölçüldü. Her numune için 3 paralel ölçüm yapıldı ve çalıĢmamızdan elde edilen deneysel sonuçlar Çizelge 4.2.'de sunulmuĢtur. Bu veriler, ticari bir glikoz sensörü kullanılarak
Sensör ÇeĢitleri Tayin sınırı (μM) Doğrusal Aralık (μM) Hassasiyet (μA mM−1 cm−2) Referanslar
Ni nanowire arrays 0.1 0.5–7 000 1043 (Lu et al.,2009)
Nano NiO 0.16 1–110 55.9 (Mu et al.,2011)
Ni-Rgo 1 1–110 813 (Wang et al.,2012)
PdNi/rGO 1.25 5–2500 - (Shen et al.,2016)
GO/NiO Nanofibers 0.77 2–600 1100 (Zhang et al.,2012)
nafion–graphene–Pd 1 10-5000 - (Li-Min et al.,2012.)
Pd–Ni/Si nanowire 2.88 - 190.72 (Zhang et al.,2012)
Pt/Ni Nanowire array 1.5 0,02–2 920 (Wang et al.,2008)