T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
ALLOJENİK KÖK HÜCRE NAKLİ DONÖRLERİNİN DEMOGRAFİK VE LABORATUVAR ÖZELLİKLERİNİN KÖK HÜCRE AFEREZİ
ÜZERİNDEKİ ETKİLERİ
İÇ HASTALIKLARI ANA BİLİM DALI
TIPTA UZMANLIK TEZİ
Dr. Ferid HACIYEV
TEZ DANIŞMANI Prof. Dr. Filiz VURAL
İZMİR 2018
TEŞEKKÜR
Uzmanlık eğitimim sürecinde bilgi ve deneyimleriyle bana yol gösteren, sabır ve anlayışla tecrübelerini aktaran, ilgi ve desteğini hiç esirgemeyen değerli hocam İç Hastalıkları Anabilim Dalı Başkanı Sayın Prof. Dr. Fehmi AKÇİÇEK’e,
Bu çalışmamın gerçekleşmesi için gerekli koşulları sağlayan, tezin planlanmasından, tamamlanmasına ve yazılmasına dek her aşamada, her türlü yardım ve desteğini esirgemeyen değerli tez danışmanım Sayın Prof. Dr. Filiz VURAL’a, teze katkı sağlayan Uzm.Dr. Nur Akad SOYER’e, asistanlık eğitim süresince birlikte olmaktan mutlu olduğum tüm araştırma görevlisi arkadaşlarıma,
İç Hastalıkları Uzmanlığı eğitimim sırasında kendilerinden her konuda bilgi ve deneyimlerinden istifade ettiğim, uzmanlık eğitimimde büyük katkıları olan, asistanlığım boyunca gösterdikleri sabır ve desteğini esirgemeyen tüm hocalarıma,
Verdikleri destekten dolayı Hematolojı Bilim Dalı sorumlu öğretim üyelerine ve aferez çalışanlarına,
Çalışma hayatım boyunca birlikte çalıştığım diğer hemşire arkadaşlarıma, yardımcı sağlık personeline ve tüm Ege Üniversitesi Tıp Fakültesi Hastanesi İç Hastalıkları ailesine,
Ve son olarak,
Eğitim hayatım boyunca her türlü fedakarlıkta bulunarak beni bugünlere getiren, her zaman yanımda olan ve destek olan değerli aileme ve eşime, zorlu asistanlık süreci boyunca desteğini hiçbir zaman eksiltmeyen arkadaşlarıma sonsuz teşekkür ederim.
İÇİNDEKİLER TEŞEKKÜR ... I İÇİNDEKİLER ... II TABLOLAR LİSTESİ ... IV ŞEKİLLER LİSTESİ ... IV KISALTMALAR LİSTESİ ... VI 1. GİRİŞ VE AMAÇ ... 1 2. GENEL BİLGİLER ... 2 2.1 Kök Hücreler ... 2 2.1.1 Kök Hücre Çeşitleri ... 2
2.1.2 Hematopoetik Kök Hücreler (HKH) ve HKH Mikroçevresi ... 4
2.1.3 HKH Kaynakları ... 7
2.1.3.1 Kemik İliği ... 7
2.1.3.2 Çevre Kanı ... 7
2.1.3.3 Umblikal Kord Kanı ... 8
2.2 Hematopoetik Kök Hücre Nakli (HKHN) ... 9
2.2.1 Tanım ... 9
2.2.2 HKHN Çeşitleri ... 9
2.3 Allojenik Kök Hücre Nakli (AKHN) ... 10
2.3.1 Uygun Kök Hücre Vericisinin Seçimi ... 11
2.3.1.1 Enfeksiyon Hastalıklar Açısından Değerlendirilmesi ... 12
2.3.2 Diğer Bulaşıcı Hastalıklar Açısından Değerlendirilmesi ... 14
2.3.3 Diğer Sistemlerin Değerlendirilmesi ... 14
2.3.4 Verici Açısından Donasyonun Değerlendirilmesi ... 15
2.3.5 Kök Hücre Kaynağının Seçimi ... 15
2.3.6 Sağlıklı Vericide Çevre Kanı Kök Hücresi Toplanması... 16
2.3.7 Aferez İşlemi ... 17
2.3.7.1 Geniş Hacimli Lökoferez (GHL) İle Toplama ... 18
2.3.8 G-CSF Etki Mekanizması ve Yeni Ajanlar ... 19
2.3.9 Mobilizasyon Dönemi İle İlişkili Komplikasyonlar ... 21
2.3.9.1 Aferez İşlemi İle İlgili Komplikasyonlar ... 22
2.4 Sağlıklı HKH Vericisinin Ürüne Etkisi ... 28
3.1 Kayda Alınan Parametreler Listesi ... 31
3.2 Bulgular ... 32
3.2.1 Çalışmaya Alınan Sağlıklı Donörlerin Özellikleri ... 32
3.2.1.1 Cinsiyet ... 32
3.2.1.2 Yaş ... 32
3.2.1.3 Antropometrik Özellikler ... 34
3.2.1.4 Hemogram değerlerine göre ... 36
3.2.1.4.1 Bazal Değerlendirme ... 36
3.2.1.4.2 Aferez Öncesi (AÖ) Değerlendirme ... 36
3.2.1.5 G-CSF ... 36
3.2.1.6 Aferez İle İlgili İstatistiksel Değerlendirme ... 37
4. TARTIŞMA ... 39
4.1 Cinsiyet ... 39
4.2 Yaş ... 40
4.3 Antropometrik Ölçümler ... 40
4.4 Bazal ve AÖ Hemogram Değerleri ... 41
4.5 G-CSF ... 42
4.6 Aferez ... 42
5. SONUÇLAR ... 44
TABLOLAR LİSTESİ
Tablo 1. Hematopoietik hücre nakli donörleri ve alıcıların enfeksiyon riski
açısından pretransplant değerlendirilmesi ... 13
Tablo 2. Hematopoetik kök hücre toplama yöntemlerinin olumlu ve olumsuz yönleri ... 16
Tablo 3. Sitrat toksisitesi ve hipokalsemi belirtileri ... 25
Tablo 4. Donörlerin antropometrik özellikleri ... 34
Tablo 5. Donörlerin bazal ve G-CSF tedavisi sonras (Aferez öncesi) hemogram değerleri ... 36
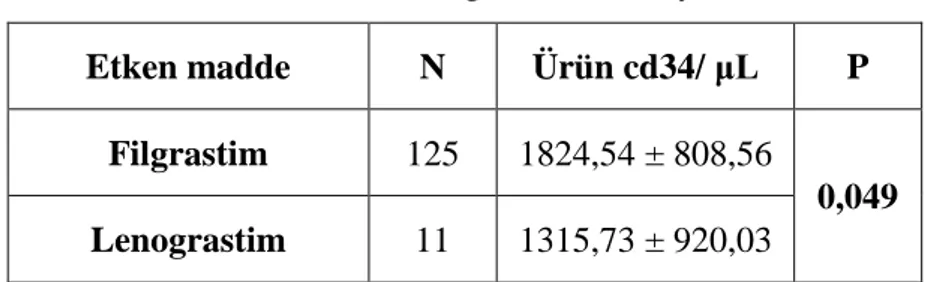
Tablo 6. Etken maddelere göre mobilizasyon sonucu ... 37
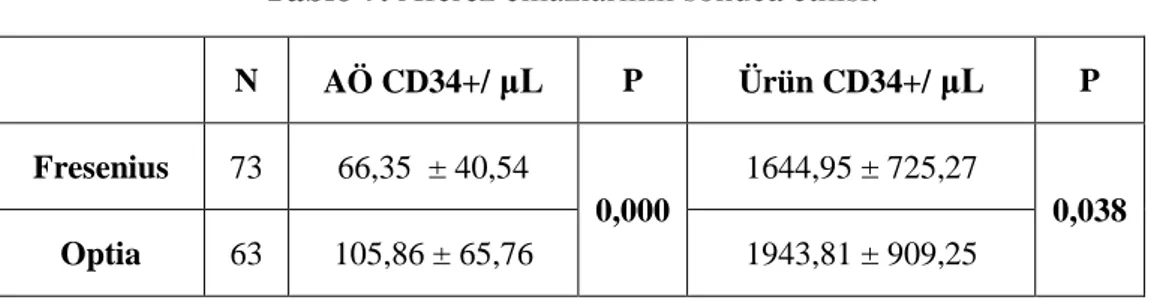
Tablo 7. Aferez cihazlarının sonuca etkisi ... 38
Tablo 8. Aferez seans sayısı ile cihazlar arasında ilişki... 38
ŞEKİLLER LİSTESİ Şekil 1. Kök hücre çeşitleri ... 3
Şekil 2. Stabil koşullarda HKH ve kemik iliği arasındaki etkileşimler ... 6
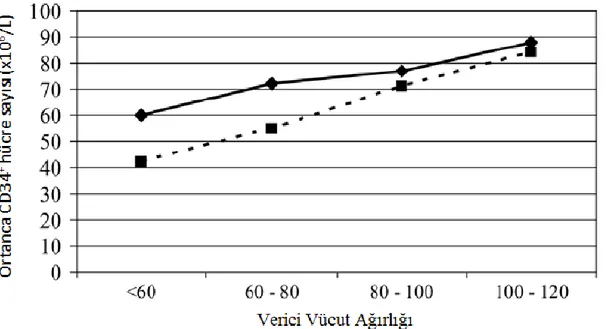
Şekil 3. Verici ağırlığı ve ortalama CD 34+ hücre sayısı arasındaki ilişki ... 29
Şekil 4. Yaşla ürün CD34 sayısı ilişkisi ... 33
KISALTMALAR LİSTESİ
AHKHN : Allojenik Hematopoetik Kök Hücre Nakli AKİT : Allojenik Kemik İliği Transplantasyonu ALL : Akut Lenfoblastik Lösemi
AMD3100 : pleriksafor
AML : Akut Mieloblastik Lösemi Ang-1 :Anjiopoetin -1
AÖ : Aferez Öncesi
ATG : Anti- timosit Globulin BM : kemik iliği
CMV : sitomegalovirus CRP : c-reaktif protein CXCL 12 : CXC ligand 12 EBV : Ebştein –Barr virüsü EKH : Embrionik Kök Hücre FDA : Gıda ve ilaç idaresi
G-CSF : granulosit stimuleedici faktör GHL : Geniş Hacimli Lökoforez
GM-CSF : Granulosit-Monosit koloni stimuleedici faktör GVHD : Graft-Versus-Host hastalığı
HES :Hidroksietil karbohidrat HGB : hemoglobin
HİV : insan immundefisit virüsü HKH : hematopoetik kök hücre HLA : insan Lökosit antijen HTC : hematokrit
HTLV : insan t-limfosit virüsü IL :interlökin
Kİ : kemik iliği
KİT : Kemik İliği Transplantasyonu KML : Kronik Mieloblastik lösemi KT : Kemoterapi
MAH : mieloablatif hazırlık MDS : mielodisplastik sendrom MKH : mezenkimal Kök hücre MM : Multipl Mielom MMP-9 : matriks metalloproteinaz -9 NHL : non-Hodgkin lenfoma NK : doğal öldürücü hücre NMAH : non-mieloablatif hazırlık
NMDP : Ulusal Kemik İliği Verici programı OKİT : Otolog kemik iliği transplantasyonu OPN : osteopontin
PCR : Polimeraz zincir reaksiyon PK : perferik kan
PKPH : periferik kan progenitör hücre PLT : trombosit
RT : radyoterapi SCF : Kök hücre faktörü SDF : stromal kaynaklı faktör
SKİT : sinjenik kemik iliği transplantasyonu TBC : tuberküloz
TPO : trombopoetin UKK : Umblikal Kord kanı
VCAM : Vaskuler hücre adezyon molekülü VKİ : vücut kitle indeksi
VRE : vankomisin rezistans enterekok WBC : Lökosit
1. GİRİŞ VE AMAÇ
Allojenik Hematopoetik Kök Hücre Nakli (AHKN) çok sayıda malign ve malign olmayan hematolojik hastalıklar için önemli ve potensial küratif bir tedavi seçeneğidir. Bu alandaki en önemli gelişmeler; hematopoetik kök hücre kaynakları, hazırlama rejimindeki yeni uygulamalar, monoklonal antikorların kullanımı ve nonmyeloablatif hazırlama rejimlerinin uygulanmasıdır. Bu gelişmeler, AHKN’e bağlı komplikasyonları ve ölüm oranını önemli derecede azaltmıştır.
AHKN için gereken kök hücreler 3 kaynaktan elde edilmektedir: Umblikal kord kanı (UKK) , periferik kan (PK) ve Kemik iliği (Kİ) (1). Erişkin hastalar için en sık kullanılan kaynak periferik kandır.
Periferik kanda kök hücrenin çoğaltılması ve toplanması işlemine mobilizasyon denir. Mobilizasyon öncesi başarılı mobilizasyon sağlanabilecek verici seçimi, verici ve alıcı ile ilgili riskleri, işleme bağlı gelişebilecek komplikasyonları azaltır. Bundan dolayı başarılı mobilizasyon ile ilişkili etkenleri tanımlamak önemlidir. Ek olarak, düşük yoğunluklu hazırlık rejimlerinde ve yarı uyumlu vericiden yapılan AKHN uygulamalarında daha yüksek miktarda HKH kullanılması da başarılı mobilizasyonun önceden bilinmesinin önemini arttırmıştır.
Allojenik vericilerde erkek cinsiyet ve genç erişkin yaş grubu başarılı mobilizasyonu öngören parametreler arasında sayılmaktadır. Allojenik vericide boy, kilo ve vücut kitle indeksi parametrelerinin kök hücre mobilizasyonuna etkisini gösteren az sayıda çalışma bulunmaktadır (2).
Bu tez çalışmasında HKH vericilerin aferez dosyalarını geriye dönük inceleyerek, vericilerin demografik verilerinin, boy, kilo, vücut kitle indeksi ölçümlerinin, aferez öncesi hemogram değerlerinin HKH ürünü miktarına etkisinin olup olmadığını araştırmayı amaçladık.
2. GENEL BİLGİLER
2.1 Kök Hücreler
Kök hücre (stem cell) kendini yenileme yeteneği (self renewal capacity) olan ve farklılaşarak yeni hücreleri oluşturabilen, yamalanma (engraftment) yapabilen klonal bir hücredir. İlk olarak hematopoietik sistemde tanımlansalar da, diğer birçok dokuda bulunabilirler. Kök hücreler başlıca 2 grupta toplanabilir: 1. Embriyonik kök hücre (EKH) 2. Erişkin tip kök hücre (3).
Kendini yenileme özelliği hücrelerin biyolojik olarak yaşlanmaksızın ve farklılaşma potansiyelini kaybetmeksizin çoğalabilmesinin göstergesidir. Kendini yenileme özelliği her zaman aynı hücreye bölüneceği anlamına gelmez, bölünme sonucu kendinden farklı hücreler de oluşabilir (4,5). Bir dokudan elde edilen kök hücrelerin, uygun uyarılarla ve uygun ortam şartlarında, farklı doku hücrelerine dönüşebilme yetenekleri olduğu bilinmektedir. Bu özellik plastisite (transdiferansiyasyon) olarak tanımlanır (6).
2.1.1 Kök Hücre Çeşitleri
Bölünme ve farklılaşma özelliklerine göre kök hücreler, üç çeşittir: totipotent, pluripotent ve multipotent (Şekil 1).
Memeliler için hayat zigot adı verilen tek hücreden başlar. Bu hücre totipotent bir hücredir ve yetişkin bir organizmanın meydana gelmesi için gereksinim duyulan bütün genleri taşımaktadır.
Bu özelliğini 16 blastomerli evreye (döllenmeden sonraki 5.gün) kadar sürdürür. Genlerin seçici aktivasyonu ve/veya inaktivasyonunun farklı gelişim potansiyelleri taşımalarına sebep olduğu bilinmektedir (7).
Şekil 1. Kök hücre çeşitleri.
Yaklaşık 5 gün sonrasında yani 2-3 bölünme sonrasında oluşan hücre kitlesine de blastosist denir ki bu kitle (iç hücre kitlesi) içindeki hücreler de vücuttaki tüm hücrelere dönüşebilme yeteneğine sahiptir. Ancak bu hücreler tek başlarına bir organizmayı oluşturamazlar. Bu nedenle bu hücrelere “puliripotent” hücre denir. Bu aşamadan sonra hücreler daha özel fonksiyonlara sahip olmakta ve erişkin kök hücreleri oluşturmaktadırlar. Biraz daha özelleşmiş olan bu kök hücrelere ise “multipotent” hücre denmektedir. Buna en iyi örnek hem çocukluk döneminde hem de erişkin dönemde kemik iliğinde bulunan hematopoetik kök hücrelerdir. İnsan vücudunda ancak birkaç hücre türüne dönüşebilen bu hücreler, laboratuvar koşullarında gerekli destekleyici ortam ve sinyaller sağlandığında çok daha fazla hücre türüne dönüşebilmektedir (7).
Erişkin kök hücreler, yaşamı boyunca daha sınırlı olmakla birlikte kendini yenileyebilir, erişkin dokularda öncü ve özelleşmiş hücrelere farklılaşabilirler. Daha çok elde edildikleri dokuya dönüşme potansiyelleri vardır ve multipotent kök hücrelerdir. Bu hücrelerin, vücut dışında embriyonik kök hücreler kadar uzun süre özelliklerini koruyarak çoğalma yetenekleri yoktur. Hücresel fenotipik özellikleri yüzey belirteçleri ile ayırt edilebilmektedir (8-10) .
2.1.2 Hematopoetik Kök Hücreler (HKH) ve HKH Mikroçevresi
HKH yaşam boyu hematopoezin sağlanması için gereklidir. Ayrıca non-hematopoetik doku hasarlarının tamirinde rol oynarlar. HKH’lerin yaşam boyu fonksiyonları devam ettirebilmeri, kemik iliğinde “Niş” adı verilen özellikli mikroçevrede yerleşmeleri ve zararlı etkilerden kaçmaları ile mümkün olmaktadır. Bu ortamda HKH’ler, istirahet halinde (G0) kök hücre havuzunda hücre sayısını sabit tutmaya çalışırlar. Ayrıca belirli arlıklarla hücre siklusuna girerek homeostaz için gerekli hematopoetik hücre ihtiyaçlarını karşılarlar. Streste ise artan ihtiyacı karşılamak üzere devamlı siklusta kalırlar.
HKH nişi osteoblastlar, endotelyal hücreler, makrofajlar, nöral hücreler, nestin+ mezenkimal kök hücreler (nestin+MKH), CXC kemokin ligand 12 (CXCL12)’den zengin retiküler hücreler (CARs)’den oluşur. Osteoblastlar endosteal nişin ana hücresidir (11). Bu hücreler HKH’lerin devamı, istirahati ve fonksiyon görebilmesi için gerekli olan osteopontin (OPN), N-cadherin, anjiopoietin-1 (Ang-1), trombopoietin (TPO), Jagged1 (Notch ligand), CXCL12, diğer adı ile SDF1 (stroma kaynaklı faktör), gibi çok sayıda faktör salgılarlar (12). Osteblastlar aynı zamanda HKH farklılaşmasına ve çoğalmasına neden olan G-CSF, GM-CSF ve IL-6 gibi faktörler salgılar (13).
Kemik iliğindeki stromal hücreler HKH’lerin yüzeyindeki reseptörlere bağlanacak çok sayıda sitokin ve adezyon molekülü sentezler. Bu moleküler etkileşimler:
1. Kemik iliği stromal hücrelerin (çoğunlukla CARs) ürettiği CXCL12 HKH yüzeyinde ifadelenen CXCR4
2. VCAM-VLA-4
3. SCF-c-kit (HKH üzerinde)
4. Kemik iliği stromal hücreleri tarafından üretilen TPO (aynı zamanda karaciğerde de üretilir) - HKH üzerindeki reseptör MPL
5. Kemik iliği stromal hücrelerdeki Ang-1 - HKH’lerde ifadelenen Tie-2 Reseptörleri
Bu etkileşimler HKH’leri istirahat halinde tutar ve toksik streslerden korur.CXCL12’nin reseptörü olan CXCL4’e bağlanması, HKH’lerin kemik iliğine yerleşmesini ve kemik iliğinin tekrar yapılanmasını sağlar, HKH’leri istirahate (G0) sevk eder. CXCR4’ün yok edilmesi HKH’lerin G0’dan çıkmalarına ve hücre siklusuna girmelerine neden olur. CXCR12/CXCL4 ve VCAM1/VLA4 yolakları, istirahat ya da istirahatin bölünmesi ve hücre döngüsünde önemli belirleyicilerdir (11). Tie1, MPL VE C-Kit ve ligandlarının etkileşimi uzun dönemde çoğalabilen HKH’lerin istirahate ya da kendi kendini yenileme yolağına girmesinde önemli bir rol oynar (14-16).
HKH’lerin kaderi, kemik iliği nişinde karşılıklı sinyaller tarafından regule edilmektedir. Bu sinyaller hücrelerin sessiz kalmasını, kendini yenilemesini ya da “niş”ten çıkarak farklanmasını belirler. Kemik iliği mikroçevresi, HKH’ler yanında mezenkimal kök hücre, endotel projenitör hücre, farklı dokulara ait kök hücrelere de ev sahipliği yapmakta, patolojik durumlarda regenereatif amaçlı kök hücre trafiğini düzenleyerek kritik görev üstlenmekteir.
Kemik iliğinde N-Cadherin pozitif özellikli osteoblastlar endosteal nişin ana komponentini oluşturmaktadır. Kalsiyumdan zengin ve hipoksik bu mikroçevre uzun süreli HKH’ler için uygun ortam oluşturmaktadır. Sinuzoidlerden zengin vaskuler bölgesi ise projenitör hücrelerin çoğalması ve olgun hematopoetik hücrelere farklanmaları için uygundur. Kök hücrlerin niş alanlarındakı trafiği veya kemik iliğinden çıkıp farklı dokulara migasyonu başta kemokinler olmak üzere farklı solubl moleküller, hücre- matriks ilişkileriyle belirlenmektedir.
Kemik iliği mkroçevresi ile HKH ilişkisinin iyi anlaşılması, hastalıkların önlenmesi, tedavisi ve izlenmesinde önemli katkılar sağlayabilecektir. Hematolojik malignitelerde lösemik hücre davranışlarının belirlenmesinde nişin kritik önemine değinilmektedir. Fankoni Aplastik anemi ve diğer konstitusyenel kemik iliği yetmezliklerinde kemik defektleri ve lösemiye yatkınlık olması bu hastalıklarda da hematopoetik niş bozukluğunu akla getirmektedir. Yaşlılıkta, bazı enfeksiyonlar ve metabolik bozukluklarda da hematopoetik mikroçevrede oluşan değişikliklerin hematolojik bozukluklara yol açtığı düşünülmektedir. Son zamanlarda kanser nişi üzerinde çok yoğun araştırmalar yapılmaktadır. İnsanlarda kemik iliği niş özelliklerinin detaylarıyla ortaya konulmasının primer hematolojik hastalıklar
yanında sistemik hastalıklar ve yaşlılıkta görülen hematolojik bozuklukların yönetimine olumlu katkı sağlaması bilinmektedir. Hastalıklarda niş özelliklerinin ortaya konması mikroçevreye yönelik hedeflenmiş ve kişiselleştirilmiş tedavilerin önünü açacaktır (17).
Şekil 2. Stabil koşullarda HKH ve kemik iliği arasındaki etkileşimler.
HKH nişinde nestin+ MKH’ler ve CXCL12’den zengin retiküler hücreler (CARs) CXCL12 sentezleyen 2 önemli hücredir. Vasküler birimler, endosteal kompartmandan çok perivasküler kompartmanda daha yaygın bulunur ve nestin+ MKH’ler, kemik iliği sinuzoidleri ve nöral hücrelerden oluşur. Bu birimler CXCL12/CXCR4, S1P1/S1P1 reseptör, VCAM1/VLA4 ve diğer sekrete edilen faktörler ve yüzey reseptörlerinin etkileşimi aracılığıyla HKH’leri çeker ve burada tutar. Vasküler birimlerin osteoblastlar ve osteoklastlar ile ilişkili olduğu endosteumda ekstrasellüler CXCL12 ve S1P1 konsantrasyonları daha yüksektir. CARs hücreleri bu birimlere perivasküler kompartmanda katılır. Kemik iliği
makrofajları HKH nişinin görevini sürdürmesinde önemli rol oynarlar. Çünkü nestin+MKH’lerin CXCL üretimini regüle eden proteinler salgılarlar (2,11).
2.1.3 HKH Kaynakları
HKH, kemik iliği, periferik kan ve kordon kanından elde edilmektedir.
2.1.3.1 Kemik İliği
İlk HKH kaynağı olarak kemik iliği kullanılmıştır. Lokal veya genel anestezi altında, özel iğneler vasıtasyla crista iliaka’dan aspirasyonla alınmaktadır. Her delme sırasında 5-10ml ilik alınarak, alıcı vücut ağırlığının toplam kilogram başına 10-15ml alınmaktadır (700- 1500ml). Ulusal Kemik İliği Verici Programı (NMDP) limit olarak 20ml /kg olarak belirlemiştir. Genelde çekirdekli hücre sayısı 2x 10^8 /kg olan kemik iliği yeterli kabul edilmektedir. Kemik iliği ürünlerinin antikoagüle edilmesi için heparin veya asit – sitrat –dekstran- A kullanılabilir. Ürün kriopresipite edilecekse, dondurulmadan önce kırmızı kan hücrelerinden arındırılmalıdır (18).
2.1.3.2 Çevre Kanı
Hematopoetik kök hücreler periferik kanda oldukça düşük miktarda bulunmaktadır. Hematopoetik büyüme faktörü (G-CSF, GM-CSF, plerixafor ile CXCR4 inhibisyonu) uygulanarak kök hücre ve pregenitör hücre sayısında 1000 kat artış sağlana bilinmektedir. AHKN için verici hematopoetik kök hücrelerinin çoğunluğunu periferik kan pregenitör hücre (PKPH) ürünleri oluşturmaktadır (19).
Pek çok allojenik donör için PKPH’leri yalnız G-CSF ile mobilize edilebilinmektedir. Genel yaklaşım hematopoietik kök hücre mobilizasyonu için günde 10 ila 16 mcg / kg dozunda donöre G-CSF verilmesidir. Mobilizasyon genellikle dört ile altı gün arasında gerçekleşir. Çoğu donörden tek seans aferez ile toplanabilir, ancak vücut ağırlığının kg'ı başına en az 2 x 106 CD34 + hücrenin arzulanan dozunun elde edilmesi için bazen çok sayıda aferez sayısına ihtiyaç duyulabilir. G-CSF sıklıkla günde iki doz şeklinde verilmektedir. Randomize bir çalışmada AKİT donörlerinde G-CSF günde tek 10mcg /kg ve günde iki kez 5mcg/kg karşılaştırılmış. İkinci grupta CD34+ hücrelerin daha çok verimine ulaşılmış ve toksisite veya maliyet artışı olmadan daha az aferez seansı gerektirmiştir (20).
2.1.3.3 Umblikal Kord Kanı
Umblikal kord kanında (UKK) nispeten daha yüksek sayıda hematopoetik kök hücreler bulunur. UKK alınarak işlendikten sonra bankalarda dondurularak rezerve edilmektedir. HLA – uyumlu bir alıcı için kordon kanı üniteleri gecikmeden nakil merkezine nakledilerek verilmektedir.
HKH kaynağı olarak UKK kemik iliği ve periferik kandan birçok pratik yönden avantajlı sayılmaktadır. Bu farklı özelliklerin en önemlisi kordon kanındaki hematopoietik kök hücrelerin erişkin kemik iliğindeki kök hücrelerden kalitatif olarak bazı farklılıklar göstermesidir; kordon kanı, kök hücrelerin daha immatür olan altgrubu (in vivo long-term repopulating stem cells) açısından erişkin kemik iliğine göre daha zengindir. Bu özellikteki kordon kanı kök hücreleri in vitro olarak daha büyük hematopoietik koloniler oluştururlar, büyüme faktörü gereksinimleri daha farklıdır, in vitro kültürlerde daha fazla ekspanse olabilirler ve daha uzun telomeraza sahiptirler. Kordon kanı kök hücrelerinin in vitro olarak bu özelliklere sahip olması teorik olarak kemik iliğine göre daha az sayıdaki kök hücre miktarı ile hematopoietik engraftmanın gerçekleşebilirliğini desteklemektedir (21).
Yeni doğan bebeklerin immün sistemi erişkinler ile karşılaştırıldığında fonksiyonel olaral daha immatürdür ve bunun nedeni ile de yeni doğan döneminde enfeksiyon riski daha fazladır. Kordon kanı lenfositleri naif ve immatürdür; çifte (double)-negatif CD3+ hücreler açısından daha zengindirler ve daha az sitokin üretirler. Kordon kanı lenfositleri interferon-γ, interlökin-4 (IL-4), ve IL-10 için yeterli fakat IL-2 için çok az mRNA transkriptleri eksprese ederler. Ancak poliklonal T-hücre repertuvarı tam olarak gelişmiştir ve düşük seviyede CD95 nedeniyle de apoptozisten korunabilirler. Sonuç olarak, erken NK ve T-hücre sitotoksitesi yetersizdir fakat sekonder aktivasyon olabilir. Bu preklinik çalışmalar sonucu, teorik olarak kordon kanı transplantasyonu sonrası daha fazla aktive T-lenfosit içeren kemik iliği transplantasyonuna oranla daha az akut ve kronik GVHH gelişmesi fakat GVL etkisinin de korunması beklenebilir. Bu teorik avantaj, tam uygun olmayan bireylerin kordon kanının kemik iliğine göre daha az komplikasyonla kullanılabilirliğini düşündürmektedir (21).
2.2 Hematopoetik Kök Hücre Nakli (HKHN)
2.2.1 Tanım
HKHN, kemik ilğinde hematopoezi yeniden yapılandırmak için her hangi kaynaktan (kemik iliği, periferik kan ve kordon kanı) veya vericiden alınan hematopoetik progenitör hücrelerin alıcıya nakledilmesini ifade eder. Hastanın kemoterapi veya Radiyoterapi (RT) ile hazırlık rejimi adı altında tedavi edildiği ve ardından hematopoetik kök hücrelerin infuzyonu ile bir sıra çeşitli prosedurları kapsayan terimdir.
Otolog (OKİT) ve allojenik KHN (AKİT) hematolojik neoplazilerin, kemik iliği bozukluklarının ve doğuştan gelen birçok metabolik hastalıkların tedavisinde kullanılmaktadır. Dunya genelinde her yıl 40.000’den fazla HKN yapılmakta ve bu rakam giderek artmaktadır.
2.2.2 HKHN Çeşitleri
Singeneik KHN, Alıcının ve vericinin tüm genetik özellikleri ve HLA antijenleri aynıdır. Tek yumurta ikizleri arasındaki KHN buna örnektir. Alıcı - verici arasında genetik farklılık olmadığından graft versus host hastalığı (GVHD ) veya graft versus tümör etkisi beklenmez (22).
Otolog kök hücre nakli (OKHN), hastanın kendi kök hücrelerinin verilmesidir. KH kemik iliği veya kandan toplandıktan sonra dondurulur. Daha sonra kök hücreler yoğun radiyoterapi (RT) ve /veya Kemoterapi (KT) gördükten sonra hastaya verilir. OKHN ‘nin birinci amacı, hastaya yüksek dozda KT ve RT’nin verilmesine izin vermektir. Aksi halde kemik iliği ciddi hasar göreceğinden tolere etmek çok zordur.
Allojenik KHN, HLA uyumlu vericiden alıcıya kök hücrelerin transfer edilmesidir. Uyumda en önemli gen çiftleri HLA-A, HLA-B, HLA-C ve HLA-DR içeren lokuslardır. Allojeneik KHN yapılırken tam uyumlu kardeş, akraba ya da akraba-dışı verici aranır. Ancak tam uyumlu verici bulunmaması durumunda kısmen uyumlu akraba verici, diğer özellikler de göz önünde bulundurularak seçilebilir (Haploidentik AKIT) (23).
AKHN’den önce ve/veya sonra hastaya hazırlık rejimi ve immun supresif tedavi uygulanır. Bu kemoterapötik ve immun supresif ilaç kombinasyonları graftın reddini, graft versus host hastalığını önlemeyi ve primer hastalığa da etkili olmayı hedefler (2). Hazırlık rejimleri yoğunluk açısından çeşitlilik göstermekte ve sitopeni
süresine göre kategorize edilmektedir. Üç seviye yoğunluk rejimi bulunmaktadır: Non-miyeloablatif (NMAH), düşük yoğunluklu hazırlık (DYH) ve miyeloablatif hazırlık (MAH).
Myeloablatif rejim: Kemik iliğindeki hematopoetik hücreleri yok etmek için veriliyor. Tek bir ajan veya kombine şekilde verilmektedir. Uygulandığında 1-3 hafta içinde derin pansitopeni oluşturmaktadır. Ortaya çıkan pansitopeni uzun sürelidir. Hematopoetik kök hücre infüzyonu sağlanmadığı sürece geri dönüşümsüzdür ve fetal seyretmektedir. Tek seferde verilen ˃ 5Gy tum vücut ışınlaması veya ˃ 8mg/kg’lık Busulfan buna örnektir (24) .
Non- myeloablatif rejim: Minimal sitopeniye (ancak belirgin lenfopeni) neden olmaktadır. Kök hücre infüzyonu gerektirmemektedir. Fludarabin artı siklofosfamid veya Anti-timosit globülin (ATG) veya bir pürin analogu ile ≤ 2Gy total vücut ışınlaması buna örnektir. Bununla birlikte bu rejim uyglanan hastalarda genellikle myeloablasyon gelişir. Çünki engraftmanla ortaya çıkan donör T lenfositler alıcının hematopoetik hücrelerini ortadan kaldırır. Sonuçta donör hücrlerin yerleşmesine izin vermiş oluyor (24).
Azaltlmış yoğunluklu rejimler: Myeloablatif ve non-myeloablatif rejim sınıfına girmeyen bir gruptur. Bu tür rejimler, uzamış ve belirgin morbidite ve mortaliteye neden olabilmektedir. Hematopoietik kök hücre desteğine ihtiyaç duyan sitopeniye neden olmaktadır. Azaltılmış yoğunluklu olarak kabul edilen rejimler, genellikle ≤8 mg / kg busulfan veya ≤ 140 mg/ m2 melfalan içermektedir (24).
2.3 Allojenik Kök Hücre Nakli (AKHN)
AKHN sağlıklı gönüllü vericiden hastaya HKH transferidir. AKHN uzun soluklu bir süreç olup hastanın bilgilendirilmesi ve onayı alındıktan sonra hastanın AKHN için uygunluğunun değerlendirilmesi, uygun verici seçimi, kök hücre kaynağının seçilmesi, kök hücre ürününün elde edilmesi, ürünün infüzyonu veya saklamaya hazırlanması, hastaya hazırlık rejiminin ve immun supresif tedavinin verilmesi, kök hücre infüzyonu yapılması, engraftman ve iyileşmenin kaydedilmesi, erken ve geç AKHN komplikasyonlarının izlemi ve tedavisini içerir (2).
Verici yönünden allojenik kök hücre naklinin temel iki aşaması vardır: 1- Uygun vericinin seçimi
2.3.1 Uygun Kök Hücre Vericisinin Seçimi
Genellikle araştırılan verici özellikleri, yaş, cinsiyet, parite, ırk, CMV serolojisi, ABO kan grubu ve HLA uyumudur (2).
Hasta ve verici adayları insan lökosit antijenleri (HLA) açısından mutlaka karşılaştırılmalıdır. Bu konuda en önemli gen çiftleri 6. kromozomun kısa kolunda olan ve haplotip şeklinde kalıtım gösteren HLA-A, HLA-B, HLA-C ve DR lokuslarıdır. HLA uyumlu olma şansı 4 kardeşte birdir (2). Hematopoietik kök hücre nakillerinin başarılı bir engrafman ve posttransplantasyon immun yapılanma ile sonuçlanabilmesi için HLA uyumu olmazsa olmaz koşuldur. Tiplendirme akraba
olmayan vericilerin seçimi için mutlaka gereklidir. Bu durumlarda -A, -B, -C, -DRB1, -DQB1 lokuslarında 9/10 veya 10/10 alel düzeyi uyum koşulu öncelikle;
ancak bu mümkün olmazsa bir antijen uyumsuz ama 9/10 alel uyum sağlayan vericiler nakil için seçilir. Hangi lokusun uyumsuzluğu kabul edilebilir olduğu konusu tartışmalıdır. Ancak HLA-DRB1 ve -C kaçınılması gereken uyumsuzluk durumlarıdır. Bu nitelikte vericiler bulunamadığında akraba olmayan kordon kanı da önemli bir seçenektir. Son yıllarda çift kord kanı uygulaması yaygınlaşarak başka türlü verici bulunamayan erişkin hastaların gereksinimini karşılamayı başarmıştır. Buna bir alternatif de haploidentik nakillerdir ancak her iki uygulamanın avantaj ve desavantajları bulunmaktadır. Kordon kanı seçiminde HLA uyumu en yüksek (-A, -B ve -DRB1 düzeyinde 6/6 uyumda TNC sayısı > 1.5 x107/kg, 5/6 uyumda >2.5 x107/kg, 4/6 uyumda ise >5 x107/kg olması önerilmektedir. Kordon kanı seçiminde henüz HLA-C uyumu koşulu aranmamaktadır. Buna karşılık KIR ligand uyumu ve alıcının anti-HLA antikorlara sahip olmaması da kalıcı engrafman ile hastalıksız yaşam sürelerine etkiyen parametrelerdir.
İdeale en yakın özelliklerdeki vericiler bulunduğunda nakil sonrası immunsupresiflerin güçlendirilmesi ile graft versus host reaksiyonunun (GVHR) kısmen veya tamamen önlenmesi mümkündür. Ancak bu yaklaşım da primer hastalığın nüksü, tekrarlayan fırsatçı enfeksiyonlar gibi sorunları beraberinde getirmektedir. Kardeşler arası HLA tam uygun nakilleri takiben bile % 40 akut ve % 60 kronik GVH hastalığı gözlenmesinin nedenleri olarak HLA dışı faktörler olarak minor HLA, sitokin veya hormon reseptör polimorfizmleri ile Killer İnhibitory Like İmmunologlobulin Reseptör (KIR) reseptör-ligand uyumsuzlukları sorumlu tutulmaktadır (25).
Verici değerlendirme süreci, intravenöz (İV) ilaç kullanımı taraması, kan transfüzyonu öyküsü, gebelikler, kürtajlar, dövmeler, aşılar ve seyahat geçmişi gibi fiziksel muayene ve kapsamlı sağlık değerlendirmesini içerir (26).
2.3.1.1 Eneksiyon Hastalıklar Açısından Değerlendirilmesi
Bulaşıcı hastalık belirteçlerinin standart bir paneli HIV, HTLV-1 ve HTLV-II, Batı Nil virüsü, hepatit A ve B serolojilerini, ayrıca hepatit B ve C viral yükü içerir. Normal kan vericileri için FDA gerekliliklerini yansıtacak şekilde, Chagas hastalığı, sifilis ve CMV serolojisi gereklidir. Hepatit B veya C’ye karşı antikor taşıyan donörler bağış yapmaya uygundur. PCR testi viremi gösteriyorsa, alıcıların seroloji ve etkili antiviral tedavi uygunluğuna bağlı olarak bağışçılar aile üyelerinin bağışı için kabul edilebilir. Viremik bağışçılar, akrabadışı alıcılar için kabul edilebilir bağışçılar değildir (27).
Tablo 1: Hematopoietik hücre nakli donörleri ve alıcıların enfeksiyon riski açısından
pretransplant değerlendirilmesi (28, 29, 30).
Testler ve değerlendirme Donör adayı Alıcı adayı (allojenik veya otolog) Öykü, sistemlerin gözden geçirilmesi, fizik
muayene + +
Diş değerlendirme - +
AC grafisi - +
CMV IgG + +
HBV (HBsAg,a-HBs,a-HBc) +/- viral yük + +
HCV (İgM, İgG) + +
HCV viral yük + -
VZV İgG + +
HSV İgG - +
EBV (VCA IgG) + +
HIV -1 ,- 2 antikor + +
HIV -1 viral yük + -
HTLV -1, -2 antikor + +
RPR veya VDRL veya T.Pallidum antikor + +
Batı Nil virüs antikor +/- -
Asp. galaktomannan Ag - +/-
Toxoplazma Gondi IgG + +/- (özellikle T hucresi
tükenmiş allojeniklerde)
TBC tarama - +
St. Aureus nasal culture - +
VRE (rectal sürüntü kültürü) - +
Endemik bölgede yaşayan ve ya seyahet edenler
Strongyloides stercoralis serolojisi + +
Coccidoides spp serolojisi - +/- (allojenik ve T hücre düşük olanlarda)
Histoplasma capsulatum - +/- (allojenik ve T hücre
düşük olanlarda)
Tripanosoma cruzi + +/-
Malarya yayma veya rapid test ve /veya PCR + +
Eğer donör, HIV ile ilişkili yüksek riskli davranışlara sahipse, HHV8 testi yapılmalıdır. Teyit edilen HIV'li bağışçılar bağış yapamıyor (27).
2.3.2 Diğer Bulaşıcı Hastalıklar Açısından Değerlendirilmesi
Bir sıra otoimmun (multipl skleroz ve ülseratif kolit gibi) ve genetik hastalıklar potensial olarak alıcıya geçe bilmektedir (2, 27, 31).
Otoimmun hastalıkları olan vericiler hematopoetik kök hücre vermek için uygun değildir, çünkü hastalığın semptomları G-CSF uygulanması ile artabilir (34-36).
Hemoglobinopatili (örn. Talasemi veya orak hücre anemisi) akrabası olan, ya da şüphesi olan potensial donörlerde hemoglobin elektroforezi yapılmalıdır. Orak hücre taşıyıcı ve talasemi minör alıcı için bir risk taşımamamktadr (27, 32).
2.3.3 Diğer Sistemlerin Değerlendirilmesi
Değerlendirme gerektiren temel problemler varsa, örneğin koroner arter hastalığı, aritmiler veya ağır sigara öyküsü varsa, göğüs radyografisi, idrar tahlili veya elektrokardiyogram (EKG) görülmelidir. Serum gebelik testi, vericinin postmenopozal olmadığı veya cerrahi olarak infertil olmadığı sürece 55 yaşın altındaki tüm kadın donörler için gereklidir. İkinci trimesterdeki ilik bağışının güvenli olduğu düşünülmektedir. Bununla birlik te nakilin acil olduğu durumlarda sadece bağış yapılması ile sınırlıdır. Gebe donör olanlar filgrastim alamamaktadır, çünki fetüs için risk belirlenmemiştir. Gebe bağışçılar doğumdan sonraya kadar akraba dışı donör olamazlar (27).
Tüm bağışçılar, bağışın riskleri ve yararları konusunda tam olarak bilgilendirilmelidir. Uygun mutabakat formlarını imzalamalı ve riskleri anlamış olduklarını ve alternatif prosedürlerden haberdar olduklarını belirtmelidir. Transplantasyon klinisyenleri ya periferik kan öncü hücreleri ya da kemik iliği istemektedir. Bağış yapan kişi, bu işlemlerden birini veya her ikisini birden reddede bileceğinin farkında olmalıdır (27).
Vericilerin psikolojik durumu donasyondan önce değerlendirilmelidir. Kök hücre nakli için gerçekten gönüllü verici olduklarını anlamak önemlidir. Kemik iliği nakli için baskı altında olmamalıdır. Vericilerden aydınlatılmış onam alınmalıdır. Çocuk vericiler yalnızca akrabaları için verici olabilir ve aydınlatılmış onam ailelerinden alınır (2, 33).
2.3.4 Verici Açısından Donasyonun Değerlendirilmesi
Tüm vericiler önceki sağlık sorunları, aldığı tedaviler, alerjiler ve aile öyküsü açısından değerlendirilmelidir. Kemik iliği vericileri daha önce geçirilen ameliyatlar ve yapılan anestezinin tipi açısından sorgulanmalıdır. Solunum, kardiyovasküler, iskelet ve santral sinir sisteminin ayrıntılı değerlendirilmesi verici açısından önemlidir. Kemik iliği vericilerinde havayolu ve iliak kemik girişimi sorgulanmalıdır. Çevre kanı kök hücre vericilerinde ise kardiyovasküler ve nörolojik sistemi de içerecek şekilde tüm sistemler değerlendirilmelidir. Vasküler giriş yollarını ve dalak muayenesini de içerecek şekilde ayrıntılı fizik muayene yapılmalıdır. Daha önceki kan bağışı, aferez öyküsü, venöz giriş yollarında karşılaşılan problemler, otoimmun hastalıklar, dalak ile ilgili hastalıklar ve hemoglobinopatiler hakkında da vericiler sorgulanmalıdır (2, 33).
2.3.5 Kök Hücre Kaynağının Seçimi
Allojenik kök hücre kaynağı hastaya veya vericiye ait özelliklere göre seçilir. Çevre kanından ya da kemik iliğinden kök hücre toplanmasının kararı hastanın primer hastalığı, vericinin yaşı ve ek hastalıklarına bağlı olarak değişir. Örneğin, orak hücre anemi ve talasemi taşıyıcıları hem çevre kanı hem de kemik iliğinden kök hücre vericisi olabilirken, karmaşık hemoglobinopatisi olan vericiler dalak komplikasyonları nedeniyle G-CSF alamaz ve çevre kanı kök hücre vericisi olamazlar (37). Aynı şekilde otoimmun hastalıkları olan vericilerin hastalıkları G CSF uygulaması ile alevlenebileceği için çevre kanından kök hücre vericisi olmaya uygun değildirler (34-36).
Yapılan çalışmalarda sitokinle mobilizasyon sonucu elde edilen çevre kanı ürününde kemik iliği ürününe kıyasla daha fazla miktarda CD34+ ve CD3+ hücre elde edilmiş, nakiller daha hızlı engraftman, azalmış nüks ve benzer sağ kalım ile sonuçlanmıştır (38,39). Çevre kanı KHN, daha erken hematopoetik iyileşme sağladığı için ileri evre ve enfeksiyon riski yüksek hastalarda özellikle tercih edilmektedir (40).
Kemik iliğinden ürün elde edilmesi bir işlemle yapılabilirken G-CSF ile çevre kanından ürün elde edilmesi için 4-6 gün beklenir ve aferez ile ürün toplanması işlemi 1-3 gün sürer. Kemik iliğinden ürün elde edilmesi genel ya da epidural anestezi altında yapılır. Genel anestezinin mevcut riskleri ilerleyen yaş ve eşlik eden başka hastalıklarla artar. Diğer yandan çevre kanı mobilizasyonu 1 yaşından 80’li
yaşlara kadar yapılabilir. Bu işlemde venöz bir yola ihtiyaç duyulması ana kısıtlayıcı faktördür (41). Kemik iliğinden ve çevre kanından kök hücre toplanmasının olumlu ve olumsuz yönleri Tablo 2’de gösterilmiştir.
Tablo 2. Hematopoetik kök hücre toplama yöntemlerinin olumlu ve olumsuz yönleri (2).
Kök hücre
kaynağı Kemik iliği Çevre kanı
Olumlu yönleri Bir günlük toplama Santral kateter yerleştirilmez G-CSF kullanımına gereksinim yok Genel anestezi uygulanmaz Hastaneye yatışı gerektirmez Daha hızlı nötrofil ve plateler engraftmanı kaydedilir Olumsuz Yönleri
Genel anestezi gerektirir Anesteziye ait
komplikasyonlar İşleme bağlı ağrı ve
kanama riski
Sıklıkla hastaneye yatış gerektirir
Daha yavaş nötrofil ve platelet engraftmanı G-CSF uygulamasına ait komlikasyonlar Afereze ait komplikasyonlar Santral kateler takılması gerekebilir Katetere ait kanama,
emboli ve enfeksiyon gibi komplikasyonlar Toplama işlemi birkaç
gün sürebilir
2.3.6 Sağlıklı Vericide Çevre Kanı Kök Hücresi Toplanması
Kemik iliğinden çevre kanına HKH’lerin çıkarılması işlemine çevre kanı kök hücre mobilizasyonu denir (42). Aferez işlemi ile bu kök hücrelerin vericiden alınması işlemine de donasyon denir (2).
Periferik kan lökositlerinin %0,05’inden daha azının kararlı durum şartları altında CD34+ hücrelerdir ve takipte önemli bir parametredir. Transplantasyon için yeterli CD34+ hücre toplamak için CD34+ hücrelerinin kemik iliğinden periferik kana mobilize edilmesi gerekir. Büyüme faktörleri döneminden önce, 5-15 katlık bir PKKH (periferik kan kök hücresi) artışına yol açan çoklu kemoterapi
kullanılmaktaydı (43). Allojeneik ortamda, sadece granülosit-koloni uyarıcı faktörün (G-CSF) kullanılması, yeterli hücre sayısının elde edilmesine olanak tanır (41, 44, 45). Allojeneik donörlerde, genç erkek hastalar ile daha yüksek CD34+ hücre verimi elde edilmiştir (47, 48). PKKH mobilizasyonunda, glikozile olan ve glikozile olmayan G-CSF arasında karşılaştırma yapan çapraz tedavi çalışmalarında farlılıklar gözlemlenmiştir (48, 49). Tek dozluk bir G-CSF’den ziyade bölünmüş dozda uygulamalar, sağlıklı donörlerde ve ayrıca hastalarda daha yüksek PKKH toplanmasını sağlamıştır (50, 51). Büyüme faktörü uygulama bölgelerine göre yapılan bir karşılaştırmada (karın vs ekstremiteler) otolog kök hücre etkinliğinde bir farklılık saptanmamıştır (52). Farklı kök hücresi mobilizasyon stratejileri vardır. Bunlar, myeloablatif olmayan fakat myelosupresif kemoterapileri, hematopoietik büyüme faktörleri (G-CSF) kullanımnı, granülosit-makrofaj-koloni uyarıcı faktörü (GM-CSF), interlökin (IL)-7, IL-12, kök hücre faktörü (SCF) ve Flt3 ligandı veya bunların kombinasyonunu, kemoterapi ve hematopoietik büyüme faktörlerinin birlikte kullanımını ve AMD3100 gibi yeni ajanların kullanımı ve kök hücre nişi manipülasyonlarını içerir (53).
1993’te Weaver ve ark. sinjenik nakilde çevre kanı kök hücre mobilizasyonunda G-CSF kullanımının başarılı olduğunu göstermiştir (46). Sağlıklı vericilerde kök hücreleri mobilize etmek için 10 yılı aşkın G-CSF kullanılmaktadır. G-CSF 4-6 gün boyunca günde 1 kez 10-16 mcg/kg subkutan enjeksiyon şeklinde uygulanmaktadır. Günlük tek ya da ikiye bölünmüş dozda kullanılabilir. Çevre kanı HKH’leri G-CSF uygulanmasının 4-5. gününde sürekli akım hücre ayraçları kullanılarak toplanır. AKHN için optimal CD34+ miktarı 2- 8x106/alıcının ağırlığı (kg) olmakla birlikte genellikle en az 4x106 CD 34+ hücre/kg tercih edilir (2).
2.3.7 Aferez İşlemi
Kök hücreler çevre kanından aferez ile toplanmaktadır. Aferez cihazlarında hedef, mononükleer hücreleri toplamaktır. Bu cihazlar, antikoagülanlı kanın santrifüj yöntemi kullanılarak bileşenlerine ayrılması prensibi ile çalışmaktadır. Vasküler giriş yolu olarak periferik venöz sistem veya santral venöz kateter kullanılır. Hasta veya vericiden alınan tam kan, antikoagüle edilir ve cihazın santrifüj sistemine gönderilir. Santrifügasyon ile tam kan, plazma, trombosit, lenfosit-monosit-granülosit ve eritrosit tabakası olarak, özgül ağırlıklarına göre, farklı katmanlara ayrılır. Kök hücreler trombosit ile granülositlerin arasındaki tabakada toplanır (2, 105).
Toplanan ürünün hematokrit düzeyi (Hct) %2-3 arasında olacak şekilde ayarlanır. Burada amaç, dondurularak saklanan ve daha sonra eritilen ürünlerin infüzyonu sırasında hemolizini ve hemolize bağlı gelişen böbrek fonksiyon bozukluğunu önlemektir. Ayrıca Hct yükseldikçe ürünün granülosit içeriği de artmakta ve lenfosit içeriği azalmaktadır. Bu da, aferez tekniğiyle elde edilen ürünün CD34+ hücre miktarında düşüşe neden olmaktadır. Üründe trombosit içeriği de düşük tutulmalıdır. Böylece, vericinin trombositopeniye girmesi ve üründe agregasyon/pıhtılaşma olasılığı engellenmiş olmaktadır (2, 105).
Donör aferezi (94). 1) Lökaferez
- Periferik kök hücre aferezi - Granülositaferez
- Lenfositaferez 2) Trombositaferez 3) Plazmaferez (bağış)
2.3.7.1 Geniş Hacimli Lökoferez (GHL) İle Toplama
Geniş hacimde kanı hızlı kan akım oranlarında işleyebilme kapasitesindeki lökoferez ekipmanlarının gelişmesiyle, daha fazla hacimde kanın bir seferde işlenmesi olanaklı hale getirilmiştir. GHL, tek bir aferez sırasında (ortalama 5 saatten fazla süre boyunca) en az 3 misli kan hacminin (genellikle 15-35L) işlenmesini gerektirir. Bazı yazarlar, PKKH verimini arttırmak için GHL’yi destekler (54-60). Hatta bazı yazarlar 35L’ye varan kan hacmi işlemiştir (52, 61). PKKH toplanmasının arttırılması aferez sırasında Kİ’den kök hücrelerin mobilize edilmesiyle, açıklanmıştır (52).
Artışın ve dolayısıyla zamana bağımlı PKKH artışının GHL tarafından indüklenip indüklenmediği hala tartışmalıdır. PKKH artışı hakkındaki tartışmalı veriler, GHL sırasındaki farklı tedavi ve çalışma rejimleriyle açıklanabilir. Aferez işleme hacimleri, genellikle hastaların kan hacimlerine uyarlanmamıştır ve bu nedenle, farklı yetişkin ve pediatrik hastalardan edinilen sonuçlar, karşılaştırılabilir nitelikte olmayabilir. Ayrıca, büyüme faktörleri veya kemoterapi ve miyeloid
büyüme faktörleri kombinasyonları ile birlikte PKKH mobilizasyon kinetikleri, bu tedavilerin her birisi için bireysel faktörler içermektedir. (41, 62, 63). Mobilizasyon sonrası düşük CD34+ hücresine sahip hastalar, GHL’den daha fazla faydalanabilirler (64-66).
2.3.8 G-CSF Etki Mekanizması ve Yeni Ajanlar
Uzun ömürlü G-CSF türevleri (pegfilgrastim, Amgen) ile eritropoietin (darbopoietin, Amgen) halen rutin olarak klinik kullanımdadır ve mobilize eden ajanlar olarak klinik kullanımda yer almaktadır. Yarılanma ömürlerinin çok uzun olması ve hastaların kullanım kolaylığı en önemli avantajlarıdır (53) .
Aralık 2008’de FDA stromal kaynaklı faktör 1 SDF-1 (SDF-1)’in reseptörü CXCR4’ün geri dönüşümlü antagonisti plerixaforu (AMD3100) hodgkin dışı lenfoma (NHL) ve MM hastalarının otolog çevre kanı HKH mobilizasyonu için onaylamıştır (11). AMD3100, CD34+ hücreleri periferik kana mobilize eden reversibl bir CXCR4/SDF1a bağlama inhibitörüdür. SDF-1 ile CXCR4 arasındaki etkileşimler, kök hücrelerin kemik iliğine göçünü veya periferik kana mobilizasyonunu önemli bir şekilde düzenler (67). CXCR4, CD34+ hematopoietik progenitör hücrelerde, CD34+ oval hücrelerde (karaciğer kök hücreleri), CD34+ solid organ dokusuna dönüşen progenitör hücreler ve T hücreler üzerinde eksprese olur. AMD3100 (5. gün) G-CSF uyarımlı CD34+ hücre mobilizasyonunu ve CD34+ hücre aferezini önemli derece arttırır. Aferez ile CD34+ hücre toplanması etkiniliği tek doz AMD3100 (240 μg/kg) veya 5 günlük G-CSF kullanımı ile benzerdir. AMD3100’e ilişkin önemli bir toksisiteyle karşılaşılmamış ve transplant sonrası graft yetmezlikleri gözlemlenmemiştir. Otolog hematopoietik progenitör hücre mobilizasyonu için AMD3100 ile birlikte G-CSF kullanımı, tek başına G-CSF’den daha üstündür (68).
AMD3100’in mobilize ettiği otolog ve allojeneik kan mononükleer hücrelerinin engaftman yetmezliğine neden olmadığı daha önce köpek transplantasyon modelinde gösterilmiştir (69). Yeni bir G-CSF türevi niteliğindeki pegile filgrastim (Neulasta™), filgastrim ile monometoksipolietilen glikole eşdeğer bir konjugattır. Peg-filgrastime karşı filgrastimin plazma yarılanma ömrü, ~33 saate karşı 3-4 saattir (70). Kök hücre mobilizasyonu için pegfilgrastim kullanımının sınırlı yanı ise, iyi mobilize olmayan hastalarda/donörlerde dozun iyi bir şekilde ayarlanamaması ve ilaca ilişkin majör toksisite halinde müdahale edilememesidir.
Ayrıca, kök hücre mobilizasyonu için FDA tarafından da henüz onaylanmamıştır. Yeni CXCR4 agonist molekülleri halen incelenmektedir. Bunlardan birisi, polimorfonükleer nötrofilleri ve hematopoietik progenitör hücreleri periferik kana doğru hızla mobilize eden ve granülosit-koloni uyarıcı faktörle sinerji oluşturan CTCE-0021’dir (71).
CXCR4 ve VLA4 antagonistleri gibi kemokin reseptörlerini ve adezyon faktörlerini doğrudan hedef alan ajanlar, uygulandıktan sonra saatler içinde HKH’leri çevre kanına doğru hareketlendirirler. Buna karşın G-CSF ya da siklofosfamid kemik iliği mikro çevresinde değişiklik yaparak tepe mobilizasyon etkisine ulaşmak için günlere ihtiyaç duyar (11). Bunlar aynı zamanda mobilizasyon öncesi HKH’lerin proliferasyonunu da uyarır (72). G-CSF ve siklofosfamid verilmesi kemik iliğinde yüksek proteolitik ortam yaratır (11). Özellikle kemik iliği myeloid hücreleri matrix metalloproteinaz-9 (MMP-9), cathepsin- G ve nötrofil elastaz gibi çok sayıda proteaz salgılar. Bu proteazlar kit-L, VCAM1, CXCL12 gibi kök hücre destekleyici çok sayıda molekülün yıkımında rol oynar. HKH’lerin stromal hücrelerle adezyon sağlayan bu reseptörlerin yıkımı HKH’lerin çevre kana mobilizasyonu ile sonuçlanır (73, 74).
Allojenik vericide çevre kanı HKH mobilizasyonu için tek başına G-CSF kullanılır (53). Vericilerde G-CSF’in en sık kullanılan dozu 10mcg/kg/gündür ve 5.günde afereze başlanır. Yeterli CD34+ hücre toplayıncaya kadar aferezle birlikte G-CSF uygulanır. G-CSF’ in daha yüksek dozlarının kök hücre ürününe etkisi yoktur (11). Hashimato ve ark. 5 gün boyunca 8 ya da 16 mcg/kg G-CSF uygulanması ile CD34+ hücre miktarında anlamlı bir fark olmadığını göstermiştir (75). G-CSF’in günde 2 kez uygulanması daha fazla CD34+ hücreyi mobilize etmesine karşın (76, 77), günde tek doz hem uygulama kolaylığı hem de sağlıklı vericilerin %95’inde yeterli kök hücre ürünü elde edilebilmesi nedeniyle daha sık tercih edilmektedir (78). Yapılan çalışmalarda G-CSF’nin HKH’leri nişde tutan mekanizmaları baskıladığını ve HKH’leri istirahatte tutan genlerde down regulasyona neden olduğu gösterilmiştir. G-CSF tedavisi makrofaj/monositlerde, nestin+ MKH’lerde ve olgun osteoblastlarda baskılanmaya, CXCL12 ve diğer adezyon moleküllerinin ifadelenmesinde ve salınmasında azalmaya neden olur (79-81).
Osteoblastlar HKH proliferasyon ve farklılaşmasını uyaran G-CSF salgılarlar. Bununla birlikte yüksek konsantrasyonda ekzojen G-CSF verilerek HKH’lerin çevre kanına mobilizasyonu uyarılabilir. G-CSF’nin olası etki mekanizmaları:
1) Myeloid hücrelerden proteazların salgılanmasını uyarır ve HKH’leri kemik iliği stromal hücrelere bağlayan adezyon moleküllerini yıkar.
2) Endosteumdaki osteoblastları baskılar.
3) Makrofajların MKH’leri uyarmasını inhibe eder, bu da CXCL12 üretim ve ifadelenmesinde azalma ile sonuçlanır.
4) Kemik iliği mikroçevresinde sempatik uyarıları artırır.
5) S1P ve CXCL12 gibi kemotaktik faktörlerin gradientlerini değiştirir.
CXCR4 ve VLA4 antagonistleri gibi diğer mobilize edici ajanlar doğrudan HKH - stromal hücre etkileşimlerini hedef alarak bozar (11).
2.3.9 Mobilizasyon Dönemi İle İlişkili Komplikasyonlar
Büyüme faktörü (G-CSF, 6-24 μg/kg/gün) uygulamalarında en sık (%81-98) izlenen yan etki kemik ağrısıdır. Giderek azalan sıklıkta olmak üzere baş ağrısı, grip benzeri bulgular, uykusuzluk, ateş, bulantı ve kusma izlenebilmektedir. Uygulanan büyüme faktörü dozu ile izlenen yan etkilerin şiddeti arasında ilişki saptanmıştır (82).
G-CSF uygulaması sırasında dalak boyutunda büyüme (ortalama 1-1.5 cm) tanımlanmış ve nadiren dalak rüptürü bildirilmiştir (83-86). Büyüme faktörü uygulaması sırasında ve sonrasındaki 2–3 haftalık dönemde vericilerin fiziki aktivitelerine özen göstermeleri ve özellikle temas gerektiren sporlardan kaçınmaları önerilmektedir (87).
G-CSF uygulaması ile ilgili olarak genelde ciddi ancak az sayıda çeşitli yan etkiler (myokard infarktüsü, derin ven trombozu ve pulmoner emboli, kapiller sızma sendromu, hipertansiyon, hipertiroidi, trombositopeni, serebrovasküler malformasyona bağlı kafaiçi kanama, akut akciğer hasarlanması, şiddetli trombositopeni) bildirilmiştir (87).
Laboratuvar çalışmalarında, G-CSF uygulaması ile lenfositlerde genetik ve epigenetik değişiklikler, mono-nükleer hücrelerin gen sunumlarında farklılıklar ve DNA yapısında istikrarsızlaşma bildirilmiştir (87). Ek olarak meme kanserli hastalarda ve kötücül olmayan hastalıklarda G-CSF uygulamasının lösemi ve miyelodisplastik sendrom gelişme riskini arttırabileceği yayınlanmıştır (87-89). Büyüme faktörü uygulanan vericilerde genelde lösemi riskinde artış bildirilmemesine karşın yakın zamanda yayınlanan bir çalışmada, lenograstim ile mobilize edilmiş akraba dışı vericilerde sadece Hodgkin Lenfoma izlenme sıklığının yaş ile uyumlu
gruba göre anlamlı olarak arttığı saptanmıştır (90). Bu alanda ileri dönük, çok sayıda vaka içeren ve uzun süreli takip ile gerçekleştirilmiş çalışmalara ihtiyaç vardır.
Tek doz peg-filgrastim (12-18 mg) uygulanan gerek akraba gerekse akraba dışı vericilerde ağrı (%76 kemik ve %44 baş), uygulama yerinde reaksiyon (%28) ve daha az sıklıkta izlenen (uykusuzluk, terleme ve hipotansiyon) yan etkiler bildirilmiştir (91). Az sayıda vaka içeren çalışmada plerixafor (240 μg/kg) uygulaması ile vericilerde sadece derece 1 düzeyinde olmak üzere bulantı, şişkinlik ve gaz (%36), uygulama yerinde rahatsızlık (%28), ağız çevresi uyuşma, sulu dışkılama, terleme (%20) ve baş ağrısı (%16) bildirilmiştir (92). Gerek peg-filgrastim gerekse plerixafor’un vericilerde uygulamaları ile ilgili olarak daha çok vericiden oluşan, ileri dönük olarak planlanmış çalışmalara ve uzun dönemli sonuçlarının ortaya konmasına gereksinim vardır (93).
2.3.9.1 Aferez İşlemi İle İlgili Komplikasyonlar
Son yıllarda kan bağışçısı havuzunun giderek daralması sonucu kan bağışçılarından en yüksek verimi elde etmek amacıyla otomatize kan bağış sistemlerinin kullanımı artmıştır. Bu sistemler ile kan bağışı tam kan bağışı ile temelde aynı komplikasyonları içerse de aferez ile kan bileşeni bağışının kendine özgü komplikasyonları görülmektedir (94). Aferez ile kan bağışçılarında işlemler nedeniyle görülen komplikasyon sıklığı McLeod ve arkadaşları tarafından çok merkezli çalışmada %2.18 olarak saptanmıştır. Bu sıklık tam kan bağışçılarında görülenlerden oldukça azdır. Reaksiyon oranları trombosit vericilerinde (%12) plazma (%5.9) ve granülosit (%9.4) vericilerinden daha fazla bulunmuştur. Tüm bağış- çılarda ilk kez bağışçı olanlarda bu sıklık daha fazladır. Donörün yakın takibi gelişen reaksiyonların erken fark edilmesini kolaylaştırır.
Yan etkilerin hemen tamamı sitrat toksisitesidir ve kan dönüş hızı ile sitrat infüzyonun azaltılması ile düzeltilebilmektedir. Donör aferezi sırasında gelişebilecek komplikasyonların listesi aşağıda verilmiştir.
Donör aferezi komplikasyonları (94). 1) Hipovolemi
a) Senkop
b) Diaforez (aşırı terleme) c) Bulantı-kusma
d) Hipotansiyon 2) Vazovagal Etkiler a) Senkop b) Bradikardi c) Diaforez d) Solukluk 3) Venöz Giriş Yeri
a) Hematom b) Sinir hasarı c) Lokal enfeksiyon d) Tromboflebit 4) Sitrat Toksisitesi 5) Allerjik Reaksiyonlar 6) Mekanik Hemoliz 7) Hava Embolisi
8) Trombosit sayısında azalma 9) Lenfosit sayısında azalma
Vazovagal etkiler ve hipovolemi; Hipovolemi ve vazovagal reaksiyonun ana sonucu hipotansiyondur. Her iki durumda da hastayı Trendelenburg pozisyonuna getirmek, kan basıncını yükseltmeye yeterli olabilir. Bradikardi genellikle vazovagal reaksiyonun bir işaretidir. Kardiyovasküler şok ve hipovolemide daha sıklıkla kan basıncı düşerken kalp hızının artması vazovagal etkiler ile hipovoleminin ayrımında bradikardinin önemli bir yer tutmasını sağlar. Azalmış intravasküler hacime kompansatuvar cevap olarak, kardiyak debiyi arttırmak ve doku perfüzyonunun devam etmesini sağlamak için otonomik sempatik aktivite ile kalp hızı arttırılır.
Hipovalemi aktif kan kaybına bağlı gelişebilir. Bu durum cihaza kan sızıntısı, hemotoraks, santral kateter takılırken oluşabilecek arteriyel laserasyonda veya aşırı ekstrakorporeal hacimde gözlenebilir (total kan hacminin %15’inden fazla). Dolaşan kan hacminin azalması intravasküler kompartmandan çevre dokuya sıvı geçişi nedeniyle de gelişebilir. Replasman sıvıları kristalloid veya hipotonik ise sıvı geçişi gözlenebilir. Hipovolemi nedeniyle gelişen hipotansiyon normal serum fizyolojik gibi kristalloid solüsyonlar veya %0.9 NaCl içinde %5 albumin gibi kolloid sıvı
infüzyonu ile giderilebilir. Aferez cihazındaki ekstrakorporeal hacimin geri infüze edilmesi de dolaşan kan hacminin yerine konmasına yardımcı olur.
Vazovagal reaksiyon emosyonel stres, iğne veya kan korkusu, idrar yapamama-mesane doluluğu sonucu gözlenebilir. Bunlar parasempatik cevabı tetikleyerek kalp hızını ve kan basıncını azaltır. Aferez işlemi sırasında gelişen reaksiyonlara ait en sık görülen belirtiler halsizlik, ciltte soğukluk, diaforez ve solukluktur. Yorgunluk hikayesi vazovagal reaksiyon için hazırlayıcı bir faktördür. Bu belirtilerden daha ciddi olan ancak yine de hafif sayılabilecek yan etkiler arasında baş dönmesi, hipertansiyon, hipotansiyon ve/veya bradikardi bulunmaktadır. Vazovagal sendromun daha ciddi formlarında şuur kaybı, konvülzyonlar, istemsiz defekasyon ve diürez görülebilmektedir.
Venöz giriş yeri ile ilişkili komplikasyonlar; Venoz katater giriş yerinde ve aferez için kullanılan iğneler yerinden çıkarsa gelişebilen bir komplikasyondur. Kan donöre aktif pompalama ile geri döndüğü için iğne eğer yerinden oynar ve aferez işlemi devam ederse, kan basınç ile antekubital fossa’ya dolmaya devam eder ve çok hızlı bir şekilde hematom gelişebilir. Eğer hematom geliştiği gözlenirse, aferez işlemi sonlandırılmalı, hematom gelişen yerin üzerine basınç uygulanmalı, eğer bu şekilde hematom gelişimi önlenemez ve antekubital fossa’da damar ve sinirlere baskı olduğu tespit edilirse kalıcı ve ciddi hasarlar oluşmaması için drenaj uygulanması gerekmektedir. Lokal enfeksiyon ve tromboflebit sterilizasyona önem verilmeyen durumlarda görülebilir.
Sitrat toksisitesi; Plazmasitaferez işlemi sırasında kullanılan antikoagülan sitrattır. Hipokalsemik reaksiyon (sitrat toksisitesi) aferez işleminin en sık rastlanan yan etkisidir. Sitrat dağılımı ve infüzyon hızının hesaplanması bize donörün ne kadar sitrat alacağını tahmin ettirir fakat donörün sitratı nasıl tolere edeceğini göstermez. Asidoz iyonize kalsiyum seviyesini arttırırken alkaloz azaltır. Sitrat infüzyonu kan pH’sını arttırarak metabolik alkaloza neden olabilir. Sitrat karaciğer, böbrek ve kaslarda metabolize olur ve bunun sonucunda bikarbonat oluşur. Hiperventilasyonu olan donörlerde respiratuvar alkaloz gelişebilir ki, bu da sitrat toksisitesi olasılığını arttırır. Kese kağıdına solumak kan karbondioksit miktarını arttırarak respiratuvar alkalozu düzeltebilir. Hiperventilasyon, hipertermi, hipomagnezemi ve hipoalbuminemi sitrat toksisitesini arttıran durumlardır. Sitratın kalsiyumu bağlaması ve bunun sonucu oluşabilecek kardiyak toksisite ciddi bir problem olabilmektedir. Sitrat reaksiyonu ve hipokalsemi ile ilişkili belirtiler Tablo 5’te gösterilmiştir. Kanda
bulunan sitrat miktarındaki artışlar parestezi, kas krampları, tetani ve kardiyak aritmi oluşturabilir. Nöromüsküler irritabilitenin ve latent tetaninin belirtileri olarak Chvostek ve Trousseau belirtileri gözlemlenebilir. Plazmasitaferez sırasında donörün 4-6 litre kanı, 1-3 saat süren bir işlem boyunca aferez cihazının içerisinden geçirilir, sitrata maruz bırakılır ve donöre geri verilir. Bu işlem sırasında kullanılacak uygun sitrat dozunun tespiti açısından yapılmış bir çalışmada, 65 mg/kg/saat’ten daha yavaş yapılan sitrat infüzyonunun donörlerde herhangi bir yan etki ve elektrokardiyografik değişiklikler oluşturmadığı gösterilmiştir. Ayrıca aynı seviyede hipokalsemisi bulunan donörlerin çok çeşitli ve birbirinden farklı belirtiler gösterdiği bilinmektedir. Bir başka çalışmada lökaferez ve trombositaferez donörlerinde bradikardi, supraventriküler ve ventriküler erken atılar, sağ dal bloğu, ST segment elevasyonu veya depresyonu, uzamış QT intervali ve sivri, düzleşmiş ya da tersleşmiş T dalgalarını içeren çok çeşitli elektrokardiyografik değişikliklerin bulunduğu belirtilmiştir. Bazı donörlerde bulantı-kusma, hipotansiyon, bayılma ve konvülzyonlar gözlemlenmiştir (94-104).
Tablo 3. Sitrat toksisitesi ve hipokalsemi belirtileri (94).
Hafif
Ağız çevresi parestezisi-ağız çevresi ve yüzde uyuşuklukHapşırmak
Dudakları çiğnemek
Orta
Eller, ayaklar ve/veya göğüse ilerleyen paresteziKan ısıtıcısı kullanılmasına rağmen titreme Bulantı-kusma, abdominal kramp
Baş dönmesi ve hafif hipotansiyon Huzursuzluk
Ağır
Kas krampları, şiddetli abdominal kramp TremorMesane inkontinansı Ölüm korkusu
Bulanık veya çift görme Bilinç kaybı
Hipokalsemik sitrat reaksiyonundan korunmak ve tedavi için sitrat infüzyon hızının monitörize edilmesi, kalsiyum seviyelerinin ölçülmesi, işlem boyunca donörün yakın takibi ve yine işlem boyunca donöre oral/parenteral kalsiyum desteği verilmesi önemlidir. Donörün sitrat toksisitesi ile ilişkili yakınması olursa sıklıkla kalsiyum içeren anti-asit tabletler veya diğer oral kalsiyum preparatları kullanılmaktadır. IV Ca glukonat (1 gramında 94 mg iyonize kalsiyum içerir) 10 dakikada 1 gr gidecek şekilde IV olarak infüze edilebilir. Ca glukonat serum fizyolojik ile dilüe edilip pompa veya manuel titrasyon ile verilebileceği gibi %5 albumin veya kristaloid replasman sıvıları ile beraber de verilebilir. Sitrat reaksiyonundan korumak için Ca glukonatı replasman sıvısında litrede 1 gr olacak şekilde verilmesi önerilmektedir. Eğer hipokalsemik semptomlar ortadan kaldırılamaz ise işlem sonlandırılmalı ve işleme tekrar başlanmadan önce donör bir doktor tarafından muayene edilmelidir. Trombosit kaybı ve kümelenmesi görülebilse de sitrat toksisitesinden korunmak için antikoagülasyon amaçlı heparin veya sitrat ile heparin kombinasyonu kullanılmalıdır (94-104)
Allerjik reaksiyonlar; Allerjik reaksiyonlar vasoaktif maddelerin mast hücreleri ve bazofillerden IgE anntikorları ile antijenin bağlanmasıyla salınımı sonucu oluşur. Bu reaksiyonlar ürtikerden anafilaksiye kadar değişen derecelerde görülebilir. Genellikle aferez setlerinin sterilizasyonunda kullanılan etilen okside karşı gelişen allerji ile oluşur. Granülosit vericilerinde ise genellikle HES (Hydroxyethyl Starch) solüsyonuna karşı allerji olabilmektedir. Her türlü alerjik reaksiyonda işlem durdurulur derecesine göre antihistaminik veya epinefrin verilebilir. Bu tip reaksiyon görülen vericiler kalıcı red olarak kaydedilir (94-104).
Mekanik hemoliz; Aferez işlemi sırasında kanın çeşitli mekanizmalar içinden akması ve santrifüj edilmesi eritrositlerin travmaya uğramasını ve hemolizi teorik bir komplikasyon olarak akla getirmektedir. Eğer dönüş iğnesi 18 G’den daha ince ise yüksek dönüş hızı eritrositler üzerindeki stresi arttırır ve hemolize neden olur. Hemoliz aynı zamanda tüplerdeki bükülme, yıkama için normal serum fizyolojik dışında bir solüsyon kullanılması nedeniyle de oluşabilir. Plazma toplama torbasındaki plazmanın pembe renkli olması hemolizin göstergesidir. Seyrek bir komplikasyon olmakla beraber mekanik hemoliz bir çalışmada %0.07 sıklıkta, yani yaklaşık 1,500 aferez işleminde bir görülmüştür (94-104).
Hava embolisi; Donörün venlerine kan aktif olarak pompalandığı için eğer aferez sistemine hava kaçarsa, donöre hava verilme olasılığı bulunmaktadır. Modern
otomatik hücre ayrıcılarında güvenlik mekanizması olarak hava algılayıcıları bulunmaktadır ve nadir görülen bir komplikasyon olan hava embolisinin görülme sıklığını azaltmaktadır. Hava embolisi belirtileri akut solunum yetmezliği, göğüs ağrısı, diaforez, konfüzyon, şok veya senkop’tur. Hava embolisinden korunmak için donöre bağlanmadan önce tüp sistemlerinin kontrol edilmesi ve işlem boyunca sıvı seviyeleri ile tüplerdeki hava kabarcıklarının varlığının izlenmesi son derece önemlidir.
Trombosit sayısında azalma; Trombositaferez donörün vücudunda kalan trombositlerinde herhangi bir zarara sebep olmaz ve işlem sonrasında donörün trombositleri fonksiyon açısından tamamen normaldir. Aferez işleminin hemen sonrasında trombosit sayıları yaklaşık %30 oranında azalmakta ve 4-6 gün sonra normal seviyesine gelmektedir. Aferez işleminden 8-11 gün sonra başlangıç trombosit değerinin hafifçe üstünde değerlerle de karşılaşılabilmektedir.
Eritrosit kaybı; Sitaferez yöntemi ile trombosit, granülosit, lenfosit veya kök hücre toplanması sırasında çok az miktarda eritrosit kaybı olmaktadır. Bu yüzden eritrosit toplanması normal gelişen bir aferez işleminin olası bir komplikasyonu değildir. Aferez işlemi sırasında her an donörün kanının yaklaşık %15’i ekstrakorporeal olduğu için eritrosit kaybı, işlem sırasında kullanılan malzemeler ile ilgili bir sorun olur ve donörün kanı aferez cihazında kalır ise yaşanabilir.
Kan hacim değişiklikleri; Aferez işlemi süresince donörün kanının yaklaşık %15’i aferez cihazı içinde bulunduğundan çok ciddi bir hacim kaybı oluşmamaktadır. Buna ek olarak aferez boyunca, uygulanan sitrat ve %0.9 NaCl infüzyonu bu hacim kaybının bir miktar da olsa yerine koyulmasına yardımcı olur. Sonuçta hacim kaybına bağlı hipotansiyon gelişmesi çok sık görülen bir komplikasyon değildir. Lökaferez sırasında kullanılan HES aynı zamanda hacim tamamlayıcı olarak da kullanılır. Bu nedenle aferez sırasında HES uygulanması kan hacminde bir artışa bu da bazı donörlerde hipertansiyona ve akut kalp yetersizliği bulgularının gelişmesine neden olabilmektedir. Lökaferez sırasında uygulanan HES miktarı 200-400 ml arasında değişmekte olup, donörlerden aferez işlemi sonunda 50-200 ml granülosit konsantresi toplandığından sonuç olarak donör kan hacminde bir artış genellikle gözlenmez.
Lenfosit sayısında azalma; İlk aferez cihazlarının kullanıldığı dönemlerde bu cihazların trombositaferez sırasında donörden topladıkları lenfosit sayısının günümüzdeki cihazlara göre çok fazla olması nedeniyle, sık trombositaferez donörü
olan kişilerde lenfosit sayılarında düşme ve immun yanıtta azalma olabileceği düşünülmüştür. Bir çalışmada 1 yıllık sürede 9 kez trombositaferez donörü olan kişilerin, aynı süre boyunca 1-4 kez tam kan bağışlayan kişilerle kıyaslandıklarında toplam lenfosit sayılarında %23, T hücrelerinde %25 ve B hücrelerinde %47 düşme olduğu gösterilmiştir. Bir diğer çalışmada ise sık trombositaferez donörü olanların toplam lenfosit sayılarında %20 azalma görüldüğü belirtilmiştir. Bir kişide klinik immun yetersizlik tablosunun oluşabilmesi için kişiden kısa bir süre içerisinde en az 1011 lenfosit alınması ve/veya kişinin mutlak lenfosit sayısının 500/mm3’ten daha düşük olması gerektiği öngörülmektedir (94-104).
2.4 Sağlıklı HKH Vericisinin Ürüne Etkisi
Çalışmalarda yaş, cinsiyet, vücut ağırlığı, vücut kitle indeksi, kan sayımları ve G-CSF öncesi çevre kanı kan CD34+ hücre sayısı araştırılan parametrelerdir (2, 78, 47, 84, 107, 108). Kök hücre nakillerinde vericinin genç olması daha yüksek engraftman oranı, daha uzun hastalıksız sağ kalım ile daha az akut ve kronik GVHH’na yol açmaktadır (2, 109, 106, 25,110).
Verici yaşı HLA uyumundan sonra alıcının sağ kalımını etkileyen vericiye ait en önemli özelliktir (2, 109). Buna karşın HKH vericisi yaşının çevre kanı kök hücre ürünü miktarı ile ilişkisi konusunda çelişkili sonuçlar yer almaktadır. Kimi çalışmada yaşın etkisinin olmadığı (111-113) gösterilmekle birlikte bazı çalışmalarda genç yaşın mobilizasyon üzerinde pozitif etkisi olduğu (2, 114, 47, 84) saptanmıştır. Ayrıca ileri yaşın mobilizasyon üzerine negatif bir etkisi olduğu ileri sürülmekle birlikte ileri yaş sınırının ne olduğu belirsizdir (2, 47, 84, 115).
Üründe HKH miktarına etkili olduğu düşünülen temel özelliklerden biri vericinin cinsiyetidir. Genel olarak doku bankalarına kayıtlı verici adaylarının yarısından fazlası kadın olmasına karşın, oran nakil yapılan vericilerde erkek lehine dönmektedir (106). Bunda rol oynayan etkenlerin başında kadından yapılan nakillerde daha yüksek GVHH olması ve var ise erkek vericilerin tercih edilmesidir (2, 109, 116, 117). Kadın verici dezavantajı, gebelikte kazanılan farklı antijenik özelliklerden kaynaklanır. Dezavantaj vericinin gebelik sayısı arttıkça artar. Kadın vericilerdeki etki gebelik öyküsü olan kadın vericilerle sınırlı olmakla birlikte kronik GVHH gelişme olasılığı daha fazla görülmüştür (2, 109). Erkek vericilerin daha yüksek vücut ağırlığına sahip olup iyi bir CD 34+ hücre miktarı sağlayabilme potansiyelleri olduğu düşünülmektedir (106). NMDP’nin verilerine göre erkek