T.C.
SELÇUK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
YÜKSEK LİSANS TEZİ
HÜMİK ASİTLERİN METAL TUTMA ve LİGAND DEĞİŞTİRME ÖZELLİKLERİNİN İNCELENMESİ
MELİHA KUTLUCA
KİMYA ANABİLİM DALI KONYA, 2007
T.C.
SELÇUK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
HÜMİK ASİTLERİN METAL TUTMA ve LİGAND DEĞİŞTİRME ÖZELLİKLERİNİN İNCELENMESİ
Meliha KUTLUCA
YÜKSEK LİSANS TEZİ KİMYA ANABİLİM DALI
Bu tez, 22.01.2007 tarihinde aşağıdaki jüri tarafından oybirliği / oyçokluğu ile kabul edilmiştir.
Doç. Dr. Hüseyin KARA (Danışman)
Prof. Dr. Erol PEHLİVAN Prof. Dr. Bedrettin MERCİMEK (Üye) (Üye)
ÖZET
YÜKSEK LİSANS TEZİ
HÜMİK ASİTLERİN METAL TUTMA ve LİGAND DEĞİŞTİRME ÖZELLİKLERİNİN İNCELENMESİ
Meliha KUTLUCA Selçuk Üniversitesi
Fen Bilimleri Enstitüsü, Kimya Anabilim Dalı
Danışman: Doç. Dr. Hüseyin KARA 2007, Sayfa: 103
Jüri:
Doç. Dr. Hüseyin KARA (Danışman) Prof. Dr. Erol PEHLİVAN (Üye) Prof. Dr. Bedrettin MERCİMEK (Üye)
Sunulan bu çalışmada; sulu ortamda pH 3’ten itibaren çözünmeye başlayan ve pH 7’de tamamen çözünmüş halde bulunan hümik asit, çözünürsüzleştirme ve aminopropilsilika üzerine immobilizasyon işlemi ile sulu ortamda geniş bir pH aralığında (pH 10’a kadar) çözünmeyen bir şekle dönüştürülmüştür. Elde edilen çözünürsüzleştirilmiş hümik asit (IHA) ve immobilize hümik asit (HAimm) kesikli sistemlerde ve sürekli sistemlerde katı faz olarak kullanılmıştır.
Kesikli sistemlerde; Cu(II) ve Ni(II) ile çalışılmış ve Cu(II) tutulmasına farklı Cu(II) bileşiklerinin etkisi, HAimm ve IHA’ in etkisi, ortamda bulunan farklı metalin etkisi incelenmiştir. Sürekli sistemlerde ise Co(II) ile çalışılmış ve metal tutulmasına
pH etkisi, konsantrasyonun etkisi, sıcaklığın etkisi ve besleme akış hızının etkisi incelenmiştir. Yapılan deneyler sonucunda optimum şartlar belirlenmiş ve sabit faz olan HAimm üzerine, Co(II) yüklemesi gerçekleştirilerek yeni bir sabit faz elde edilmiştir. Hazırlanan bu sabit fazla ligand değişimini incelemek için adenozin yüklemesi ve sıyırması deneyleri gerçekleştirilmiştir. Elde edilen veriler ışığında ligand değiştirme özellikleri incelenmiştir.
Sürekli sistemle yapılan deneylerde elde edilen sonuçlarla, adsorbsiyon izotermleri çıkarılmıştır. Langmuir izotermine uyum göstermesi ve freundlich izoterminde doğrusallıktan azda olsa sapmanın gözlenmesi Co(II)’ nin, katı faz olan HAimm üzerine tek tabakalı olarak tutulduğunu göstermektedir. Scatchard Eğri analizi de bu sonuçları desteklemektedir. D-R izoterminde elde edilen sonucun 50 kJ/mol olması tutulmalarda metal ile katı faz arasında kimyasal etkileşmelerin
gerçekleştiğini ortaya koymaktadır.
Her iki sistemde de elde edilen sonuçlarla hümik asitin metalleri seçici adsorbladığını ve adsorban/ iyon değiştirici madde olarak kullanılabileceği sonucuna varılmıştır. Ayrıca HAimm’ in; adenozin ile yapılan çalışmalar sonucunda hümik asit üzerine kompleks oluşumuyla ligand değişiminin gerçekleştiği görülmüştür.
Sonuç olarak hümik asitler, hem adsorban/iyon değiştirici madde olarak metallerin giderilmesi ve geri kazanılmasında kullanılabileceği gibi hem de uygun işlemler sonucunda ligand değiştirici madde olarak da kullanılabileceği noktasında incelenmeye değer olduğu görülmüştür.
Anahtar Kelimeler: Çözünürsüzleştirilmiş hümik asit, İmmobilize hümik asit, Cu(II), Ni(II), Co(II), Kompleksleşme, Ligand Değişimi, HPLC, Kesikli Sistem, Langmuir Adorpsiyon İzotermi, Freundlich Adorpsiyon İzotermi, Dubinin-Radushkevich (D-R) Adorpsiyon İzotermi, Scatchard Eğri Analizi, Katı Faz Ekstraksiyonu.
ABSTRACT
M. Sc. Thesis
INVESTİGATION OF METAL SORPTION AND LIGAND EXCHANGE PROPERTIES OF HUMIC ACIDS
Meliha KUTLUCA Selçuk University
Graduate School of Natural and Applied Science Department of Chemistry
Supervisor: Assoc. Prof. Dr. Hüseyin KARA 2007, Pages: 103
Jury:
Assoc. Prof. Dr. Hüseyin KARA (Supervisor) Prof. Dr. Erol PEHLİVAN (Member) Prof. Dr. Bedrettin MERCİMEK (Member)
In the present study, humic acid that starts to disolve from pH=3 and dissolve completely ligher than pH=7 was converted into their insoluble derivative, not soluble at wide pH range (to pH=10), by insolubilization and immobilization on aminopropylsilica. The unsoluble humic acid (IHA) and immobilized humic acid (HAimm) was used in discontinuous and continuous systems as a solid phase.
In discontinuous systems, Cu(II) and Ni(II) ions were used and effects of type of Cu(II) ion, IHA and HAimm, and different metal ion existed in the media on sorbtion of Cu(II) ion were investigated. In continuous systems, Co(II) ion was used and effects of pH, concentration, temperature and feed flow rate on metal retain were investigated. As a result, optimum conditions were determined and a novel stationary phase was obtained by loading Co(II) on HAimm, solid phase. Experiments of loading
and stripping adenosine to the obtained stationary phase were performed. The sorption and ligand Exchange properties of Co-HAimm as a solid phase was investigated.
The absorption isotherms were obtained from the results obtained from the experiments with continuous systems. The results accord with Langmuir isotherms and deviate from linearity in the Freundlich isotherm. Therefore, these results showed that Co(II) ion was retained onto solid phase, HAimm, as a mono layer. The results of Scatchard curve analysis support these findings. That the result of D-R isotherm is 50 kJ/mol shows that chemical interactions are main interaction between metal ion and solid phase.
According to the results obtained from both systems, it was determined that humic acid selectively adsorbs metal ions and can be used as adsorbent/ion exchanger. In consequence of studies performed with HAimm and adenosine, it was seen that ligand exchange was realized by complex formation onto Co-HAimm.
Consequently, it was seen that the present study is worth investigating for that humic acid can be used as both adsorbent/ion exchanger material in the metal removing and recovery, and as a ligand exchanger in consequence of the appropriate processes.
Keywords: Insolubilazed humic acid, immobilized humic acid, Cu(II), Ni(II), Co(II), complexation, ligand exchange, HPLC, discontinuous system, Langmuir adsorption isotherm, Freundlich adsorption isotherm, Dubinin-Radushkevich (D-R) adsorption isotherm, Scatchard curve analysis, Solid phase extraction.
ÖNSÖZ
Bu çalışma, Selçuk Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü Öğretim Üyelerinden Doç. Dr. Hüseyin KARA yönetiminde hazırlanarak, Selçuk Üniversitesi Fen Bilimleri Enstitüsüne, Yüksek Lisans Tezi olarak sunulmuştur.
Yüksek lisans tezimi yöneten ve çalışmalarım esnasında yakın ilgi ve yardımlarını gördüğüm, her zaman destek olan sayın hocam Doç. Dr. Hüseyin KARA’ ya sonsuz saygı ve şükranlarımı sunarım.
Çalışmalarım esnasında sürekli yardım ve desteklerini gördüğüm başta Yrd. Doç. Dr. Semahat KÜÇÜKKOLBAŞI olmak üzere analitik kimya araştırma laboratuarında bulunan tüm arkadaşlarıma, Arş. Grv. İmren HATAY, Arş. Grv. Önder ALICI, Arş. Grv. Sait MALKONDU ve manevi destekleriyle her an yanımda olan değerli yüksek lisans öğrencisi arkadaşlarıma sonsuz teşekkürlerimi sunarım.
Ayrıca tahsil hayatım boyunca her türlü fedakarlığı gösteren, bugünlere gelmem için maddi ve manevi desteklerini esirgemeyen, sahip olduğum manevi ve ahlaki değerlerimin temeli olan ailem; sevgili kardeşlerim ve annem Beyhan KUTLUCA ile babam Mustafa KUTLUCA’ ya sonsuz saygı ve şükranlarımı sunarım.
Meliha KUTLUCA Konya-2007
İÇİNDEKİLER ÖZET --- İİİ ABSTRACT ---V ÖNSÖZ --- Vİİİİ İÇİNDEKİLER ---Vİİİİİ ŞEKİLLER LİSTESİ--- Xİİİİ TABLOLAR LİSTESİ --- XİV KISALTMA VE SEMBOLLER--- XV 1. GİRİŞ --- 1 1.1.HÜMİK MADDELER--- 2
1.1.1. HÜMİK VE FULVİK ASİTLERDEKİ FONKSİYONEL GRUPLAR--- 5
1.1.2. HÜMİK ASİTİN YAPISI VE ELDE EDİLMESİ--- 6
1.2.HÜMİK ASİTİN KİMYASAL ÖZELLİKLERİ---11
1.3.HÜMİK ASİTİN FİZİKOKİMYASAL ÖZELLİKLERİ---13
1.3.1. MADDELERLE ETKİLEŞME MEKANİZMALARI---13
1.3.2. SULU ORTAMDA ÇÖZÜNEBİLME ÖZELLİKLERİ---14
1.3.2.1. Hümik asitin çözünürsüzleştirilmesi ---15
1.3.2.2. Hümik asitin immobilizasyonu ---16
1.4.HÜMİK ASİTLERİN ELEKTROKİMYASAL ÖZELLİKLERİ---17
1.5.İYON VE LİGAND DEĞİŞİMİ---18
1.5.1. İYON DEĞİŞTİRİCİ MADDELER VE ÖZELLİKLERİ---18
İNORGANİK İYON DEĞİŞTİRİCİLER---18
ORGANİK İYON DEĞİŞTİRİCİLER---18
1.5.2.1. Ligand değiştiriciler ---20
1.5.2.2. Ligand değiştiricilerde şelatlaşma ---22
1.6.ADSORPSİYON---23 1.6.1. ADSORPSİYON İZOTERMLERİ---26 1.6.1.1. Freundlich izotermi ---26 1.6.1.2. Langmuir izotermi ---27 1.6.1.3. Dubinin-Radushkevich (D-R) izotermi ---29 1.6.2. SCATCHARD ANALİZİ---30
1.6.3.ÇÖZÜNMÜŞ MADDELERİN KATILAR TARAFINDAN ADSORPSİYONU---31
1.6.3.1. Yüzey gerilimdeki değişiklikten ileri gelen adsorpsiyon---31
1.6.3.2. Elektrostatik kuvvetlerden ileri gelen adsorpsiyon---32
1.6.4. ADSORPSİYONUN ÖZELLİKLERİ---32
1.6.5. ADSORPSİYON TÜRLERİ---33
1.6.5.1. Fiziksel adsorpsiyon ---33
1.6.5.2. Kimyasal adsorpsiyon ---33
1.7.EKSTRAKSİYONLA AYIRMA TEKNİKLERİ---34
1.7.1. SIVI–SIVI EKTRAKSİYONU---35
1.7.2. KATI FAZ EKSTRAKSİYONU (SPE)---35
1.7.2.1. Kesikli yöntem ---35
1.7.2.2. Sürekli Yöntem---35
1.7.3. SPE’ nin üstünlükleri ---36
1.7.4. SPE VE HPLC ---36
1.7.5. GENEL OLARAK SPE İŞLEMLERİNİN BASAMAKLARI---37
1.7.5.1. Katı fazın şartlandırılması ---37
1.7.5.2. Analitin katı fazda tutulması (Besleme) ---39
1.7.5.3. Katı fazda tutulmayan türlerin giderilmesi (Yıkama)---40
1.7.5.4. Analitin katı fazdan sıyırılması (Sıyırma) ---40
1.7.6. BREAKTHROUGH EĞRİLERİ---41
1.7.6.1. Besleme basamağındaki breakthrough eğrisi ---41
1.7.6.2. Yıkama basamağındaki breakthrough eğrisi ---47
2. KAYNAK ARAŞTIRMASI ---50
3. MATERYAL VE METOD ---60
3.1.KULLANILAN KİMYASAL MADDELER ---60
3.2.KULLANILAN CİHAZLAR---60
3.3.METOT---61
4. DENEYSEL KISIM ---62
4.1.ÇÖZÜNÜRSÜZLEŞTİRİLMİŞ HÜMİK ASİTİN (IHA)ELDE EDİLMESİ---62
4.2. ÇÖZÜNÜRSÜZLEŞTİRİLMİŞ HÜMİK ASİTİN SODYUM TUZU (NAA) İÇİN ÇÖZÜNÜRLÜK TESTİ---62
4.3.HÜMİK ASİTİN İMMOBİLİZE EDİLMESİ (HAİMM) ---62
4.3.1. HÜMİK ASİTİN SAFLAŞTIRILMASI---63
4.3.2.HÜMİK ASİTİN İMMOBİLİZASYONU---63
4.4.İMMOBİLİZE HÜMİK ASİTİN (HAİMM)ÇÖZÜNÜRLÜK TESTİ ---63
4.5.ÇÖZELTİLERİN HAZIRLANMASI ---63
4.6.KESİKLİ SİSTEMLE YAPILAN DENEYLER---64
4.6.1. FARKLI CU(II) BİLEŞİKLERİNİN ETKİSİ---64
4.6.2.METAL TUTULMASINA HAİMM VE IHA’ İN ETKİSİ---65
4.6.3. METAL TUTULMASINA ORTAMDA BULUNAN FARKLI METALİN ETKİSİ---65
4.7.SÜREKLİ SİSTEMLE YAPILAN DENEYLER---65
4.7.1. CO(II) TUTULMASINA PH ETKİSİ---68
4.7.2. CO(II) TUTULMASINA KONSANTRASYONUN ETKİSİ---68
4.7.3. CO(II) TUTULMASINA SICAKLIĞIN ETKİSİ---69
4.7.4. CO(II) TUTULMASINA BESLEME AKIŞ HIZININ ETKİSİ---69
4.8.HAİMM ÜZERİNE CO(II)İYONLARININ YÜKLENMESİ ---69
5. DENEY SONUÇLARI VE DEĞERLENDİRİLMESİ ---71
5.1.HÜMİK ASİDİN SPEKTROSKOPİK ÖZELLİKLERİ---71
5.2.KESİKLİ SİSTEMLE ELDE EDİLEN SONUÇLAR---72
5.2.1. FARKLI CU(II) BİLEŞİKLERİNİN ETKİSİ---72
5.2.2. METAL TUTULMASINA HAİMM VE IHA’ İN ETKİSİ---74
5.2.3. METAL TUTULMASINA ORTAMDA BULUNAN FARKLI METALİN ETKİSİ---76
5.3.SÜREKLİ SİSTEMLE ELDE EDİLEN SONUÇLAR---78
5.3.1. CO(II) TUTULMASINA PH ETKİSİ---80
5.3.2. CO(II) TUTULMASINA KONSANTRASYONUN ETKİSİ---82
5.3.3. CO(II) TUTULMASINA SICAKLIĞIN ETKİSİ---83
5.3.4. CO(II) TUTULMASINA BESLEME AKIŞ HIZININ ETKİSİ---84
5.4.HAİMM ÜZERİNE CO(II)YÜKLENMESİ---86
5.5.HAİMM-CO(II)ÜZERİNE ADENOZİNİN YÜKLENMESİ VE SIYIRILMASI---87
5.6.ADSORBSİYON İZOTERMLERİ---89
5.6.1. LANGMUİR ADSORBSİYON İZOTERMİ---90
5.6.2. FREUNDLİCH ADSORBSİYON İZOTERMİ---91
5.6.3. D-R (Dubinin-Radushkevich) Adsorbsiyon İzotermi ---92
5.6.4.SCATCHARD EĞRİSİ---93
6. SONUÇ VE TARTIŞMA ---95
7. KAYNAKLAR ---99
ŞEKİLLER LİSTESİ
Şekil 1.1. Hümik madde türlerinin kabul görmüş karşılaştırmalı özellikleri _______ 4 Şekil 1.2. Fulvik asitin moleküler yapısı ___________________________________ 5 Şekil 1.3. Hümik ve Fulvik Asitlerdeki Fonksiyonel Gruplar ___________________ 5 Şekil 1.4. Hümik asitin 35.000 defa büyütülmüş görüntüsü ____________________ 7 Şekil 1.5. Hümik Asit İçin Önerilen Moleküler Yapı__________________________ 9 Şekil 1.6. Hümik Asitin IR-Spektrumu____________________________________ 10 Şekil 1.7. Metallerin Hümik Asit İle Kompleks Oluşturma Şekilleri_____________ 14 Şekil 1.8. Hümik Asitin Çözünme Özelliği ________________________________ 15 Şekil 1.9. Çözünürsüzleştirilmiş hümik asitin sulu ortamda pH’ya bağlı olarak çözünme özelliği ____________________________________________________ 16 Şekil 1.10. Freundlich sabitlerinin elde edildiği grafik ______________________ 27 Şekil 1.11. Langmuir sabitlerinin elde edildiği grafik _______________________ 28 Şekil 1.12. Scatchard eğrisi____________________________________________ 31 Şekil 1.13 Fiziksel ve Kimyasal adsorpsiyon ______________________________ 33 Şekil 1.14 Su molekülleri ile etkileşmemiş oktilsilan sabit fazının görünümü _____ 38 Şekil 1.15. Su molekülleri ile etkileşmiş oktilsilan sabit fazının görünümü _______ 38 Şekil 1.16 Ortama metanol ilave edildiğinde oktilsilan sabit fazının görünümü ___ 39 Şekil 1.17Besleme basamağında detektörden gözlenen eğrinin genel profili______ 42 Şekil 1.18. Besleme eğrisinde analitik amaçlar için kullanılan terimler _________ 42 Şekil 1.19. Alıkonma zamanından teorik tabaka sayısının hesaplanması için kullanılan yöntem ___________________________________________________ 44 Şekil 1.20. Teorik tabaka yüksekliği ile numunenin kolona beslenme hızı arasındaki ilişki ______________________________________________________________ 46 Şekil 1.21. Yıkama basamağında gözlenen breakthrough eğrisinin genel profili___ 47 Şekil 1.22. Sıyırma basamağında gözlenen breakthrough eğrisinin genel profili ve simetrisi___________________________________________________________ 48 Şekil 1.23. Sıyırma basamağında elde edilen piklerin verimliliği ve simetrisi _____ 49 Şekil 4.1. SPE basamaklarının yürütüldüğü sürekli SPE sisteminin şematik olarak gösterimi __________________________________________________________ 66 Şekil 5.1. Hümik asit için IR Spektrumu __________________________________ 71
Şekil 5.2. Cu(II) tutulmasına farklı Cu(II) bileşiklerinin etkisi deneylerinin elde edilen sonuçları ____________________________________________________ 73 Şekil 5.3. Cu(II) Tutulmasına HAimm ve IHA’ in etkisi_______________________ 74
Şekil 5.4. Ni(II) Tutulmasına HAimm ve IHA’ in etkisi________________________ 75
Şekil 5.5. HPLC’ den elde edilen örnek eğri_______________________________ 78 Şekil 5.6. HPLC’ den elde edilen besleme basamağı için örnek bir eğri _________ 79 Şekil 5.7. HPLC’ den elde edilen sıyırma basamağı için örnek bir eğri _________ 80 Şekil 5.8. Co(II) Tutulmasına pH’ ın Etkisi Deneylerine Ait Sıyırma Eğrileri _____ 81 Şekil 5.9. Co(II) Tutulmasına pH’ ın Etkisi Deneylerine Ait Sıyırma Eğrileri _____ 82 Şekil 5.10. Sıcaklığın Co(II) Tutulmasına Etkisi Deneylerine Ait Sıyırma Eğrileri _ 84 Şekil 5.11. Co(II) tutulmasına Besleme hızının Etkisi ile ilgili Besleme Eğrisi ____ 85 Şekil5.12. Co(II) tutulmasına Besleme hızının Etkisi ile ilgili Sıyırma Eğrisi _____ 86 Şekil 5.13. Co(II) Yüklemesine Ait Eğri __________________________________ 87 Şekil 5.14. HAimm-Co(II) Üzerine Adenozin Yüklemesine ve Sıyırılmasına Ait Eğri 88
Şekil 5.15. HAimm-Co(II) Üzerine Adenozin Yüklemesine Ait Eğri ______________ 89
Şekil 5.16. Co(II) için Langmuir İzotermi_________________________________ 90 Şekil 5.17. Co(II) için Freundlich izotermi ________________________________ 91 Şekil 5.18. Co(II) için D-R izotermi _____________________________________ 92 Şekil 5.19. Co(II) için Scatchart Grafiği__________________________________ 93
TABLOLAR LİSTESİ
Tablo 1.1. Hümik Maddelerdeki Fonksiyonel Gruplar--- 6
Tablo 1.2. Hümik ve Fulvik Asitler İçin Yaklaşık Elementel İçerikler --- 6
Tablo 1.3. Ayırmada kullanılan bazı teknikler ve uygulamaları ---34
Tablo 5.1. Cu(II) tutulmasına farklı Cu(II) bileşiklerinin etkisi deneylerinin elde edilen sonuçları---72
Tablo 5.2. Cu(II) Tutulmasına HAimm ve IHA’ in etkisi ---74
Tablo 5.3. Ni(II) Tutulmasına HAimm ve IHA’ in etkisi ---75
Tablo 5.4. Cu(II) ve Ni(II) Tutulmalarına Farklı Metalin Etki---77
Tablo 5.5. Co(II) için Langmuir Sabitleri ---90
Tablo 5.6. Co(II) için Freundlich sabitleri---91
Tablo 5.7. Co(II) için D-R İzoterminden Hesaplanan Değerler ---92
KISALTMA ve SEMBOLLER
HAimm : İmmobilize hümik asit
IHA : Çözünürsüzleştirilmiş hümik asit
NaA : Çözünürsüzleştirilmiş hümik asidin sodyum tuzu SPE : Katı faz ekstraksiyonu
C : Konsantrasyon (mol/L)
q : 1 g katının tuttuğu iyon miktarı (mmol İyon/gKatı) k : Freundlich sabiti
n : Freundlich sabiti
qm : Maksimum kapasite (mmolİyon/gKatı)
Kd : Ayrışma sabiti (L/mmol)
1. GİRİŞ
Çevre; canlıların biyolojik, kimyasal, ekonomik ve kültürel aktivitelerini meydana getirdikleri ortamların tümüdür. Yani; çevrede meydana gelebilecek tahribatlar, canlıları direk veya dolaylı olarak etkileyecektir. Nitekim; onlarca canlının neslinin tükenmiş ve tükenmekte olduğu bir gerçek olup, bunun altında yatan temel neden de hiç kuşkusuz; bu canlıların yaşadığı ortamların tahribata uğramasıdır.
Toprak ve sudaki ağır metaller, belirli konsantrasyon seviyelerinden sonra canlılar üzerinde olumsuz etkiler bırakır. Bu nedenle, özellikle son yıllarda sivil toplum örgütlerinin de etkisiyle, çevre ile ilgili kanunlarda bir dizi düzenleme yapılmıştır. Bunların içinde son yıllarda en çok başvurulan yöntemlerden biri olarak ağır metal iyonlarının sudan uzaklaştırılması için biyopolimerlerin iyon değiştirici madde olarak kullanımı yaygınlaşmıştır.
İyon değiştirici özelliğe sahip doğal biyopolimerik maddeler olan hümik asitlerin iyon değiştirici ve adsorban madde olarak kullanıldığı birçok çalışma yapılmıştır. Fakat, bu çalışmalar için en büyük kısıtlamalardan biri, hümik asitin bir adsorban/iyon değiştirici katıda bulunması gereken en önemli özelliklerden biri olan, “sulu ortamda çözünmeme” şartını sağlayamamasıdır. Çünkü hümik asit, sulu ortamda pH 3’te çözünmeye başlar ve pH 7’de tamamen çözünmüş halde bulunur. Bu kısıtlamayı gidermek için hümik asitin çözünürsüzleştirilmesi (insolubilizasyon) veya katı bir destek maddesine immobilize edilmesi tekniklerinden yararlanılabilir. Bu sayede, pH 10’ da dahi çözünmeyen hümik asitler elde edilebilir ve adsorban/iyon değiştirici madde olarak kullanılabilirler.
1.1. Hümik Maddeler
Bitki ve hayvan kalıntılarının ayrışmasıyla meydana gelen hümik maddeler proteinler, polisakkaritler ve polinükleotitler gibi bileşiklere dönüşmeyen polikondanse biyopolimerlerdir. Yerkürede toprağın veya suyun organik maddelerle beraber bulunduğu tüm yerlerde hümik maddeler de bulunur. Hümik maddelerin meydana gelişleri sırasındaki biyokimyasal ve kimyasal etaplar tam olarak aydınlatılamamış olmasına rağmen yapılarında çok sayıda aromatik, alisiklik ve heterosiklik halkalar bulunduğu bilinmektedir. Hümik maddeler; aromatik, hidroaromatik, alisiklik ve heterosiklik yapıların birbirlerine alifatik ve eterik bağlarla bağlandığı, karboksil, fenolik hidroksil gibi çok sayıda hidrofilik grup içeren molekül ağırlığı yüksek polikondanse yapılardır.
Doğal sularda sıkça gözlenen kahverengi renk tonları, koyu toprakların koyulukları ve linyitlerin koyu kahverengi renkleri, hümik maddelerden kaynaklanmaktadır. Hümik maddeler, yerküre yüzeyinde en geniş alana dağılmış biyosentez ürünleridir. Toprağın yanı sıra; nehirlerde, göllerde, okyanuslarda, çürümüş kalıntılarda, sedimentlerde, turba bataklıkları ve yumuşak kömür gibi birçok farklı kaynakta, çeşitli konsantrasyonlarda bulunabilirler (Mayhew, L., 2004).
Hümik maddeler; kolloidal yapıdaki heterojen makromoleküller olup, topraktaki organik maddelerin % 60-70’lik bir oranını temsil etmektedir. Ayrıca; topraktaki yüzey organik maddelerin de % 30-50’lik bir kısmını işgal eden hümik maddeler, belki de yer kürede en çok bulunan doğal olarak oluşmuş makromoleküllerdir. Sarıdan siyaha değişebilen renk tonlarındaki bir görünüme sahip olan hümik maddelerin, bitki ve hayvan kalıntılarından toprakta, sedimentlerde ve doğal sularda meydana gelen ve mikrobiyal bozunmaları kapsayan hümifikasyon işleminin sonucunda oluştuklarına inanılmaktadır (Tochiyama, O., 2000).
Hümik maddelerin çevresel kirleticiler üzerine etkileri; maddelerin fizikokimyasal reaksiyonlarını (sorpsiyon, koagülasyon, asit-baz etkileşimleri ve kompleksleşme reaksiyonları gibi) ve kimyasal değişimlerini (yükseltgenme, indirgenme, hidroliz ve fotokimyasal reaksiyonlar gibi) içerir. Sulu sistemlerde organik veya inorganik kirleticilerin hümik maddelere bağlanması, kirleticilerin hareketliliğini ve biyolojik kullanılabilirliğini değiştirebilir. Birçok durumda humik
maddeler ile birleşmiş toksik metaller daha düşük bir toksik etkiye sahiptir. Ayrıca hümik asitlerin yararlarını aşağıdaki gibi sıralayabiliriz:
• Topraktaki minerallerin bitkiler tarafından alımını düzenler. • Toprağın su tutma kapasitesini artırır.
• Kuraklığı önlemeye yardımcıdır. • Erozyonu azaltır.
• Pestisitlerin zararlı etkilerini azaltır.
• Toprağın ve doğal suların pH’ sını düzenler. • Bitkinin vitamin değerini artırır.
• Bitkiler için yaralı minerallerin oluşumuna yardımcı olur.
Yukarıdaki yararlarıyla gübre olarak yaygın şekilde kullanılan hümik asitlerin bu faydalarının yanında inşaat sektöründe yüksek su tutma kapasiteleri sebebiyle kullanılır. Ayrıca özellikle hayvanlar için ilaç endüstrisinde kullanılmaktadır.
Hümik maddeleri incelemek oldukça zordur. Çünkü hümik maddeler; bileşenlerinin sıra dışı kompleksleşmesinden oluşur. Kimyacılar ve biyokimyacılar tarafından geliştirilen neredeyse tüm ayırma teknikleri hümik maddelere de uygulanmıştır. Ayırma amaçlı bu girişimlerin çoğu, numunenin heterojenlik derecesini azaltmıştır, ancak “saf hümik madde” olarak tanımlanabilecek bir materyal izole edilememiştir. Bununla birlikte hümik maddeleri 3 alt grupta kategorize etmek mümkündür.
Fulvik Asit.
Hümik maddelerin herhangi bir pH değerinde suda çözünebilen fraksiyonudur. Ortalama molekül ağırlıkları 1500’den küçük olup, hümik asitlerden daha polar karakterdedirler.
Hümik Asit
Hümik maddelerin suda yüksek pH değerlerinde çözünen, fakat düşük pH değerlerinde (pH<2.0) çözünmeyen fraksiyonudur. Ortalama molekül ağırlıkları genellikle 2000’den büyük olup, 5000 civarındadır. Elde edildiği kaynağa göre molekül ağırlığı birkaç yüz bin kadar olabilir.
Hümin
Hümik maddelerin bütün pH değerlerinde suda çözünmeyen fraksiyonudur. Ortalama molekül ağırlıkları hümik asitlerden oldukça yüksektir.
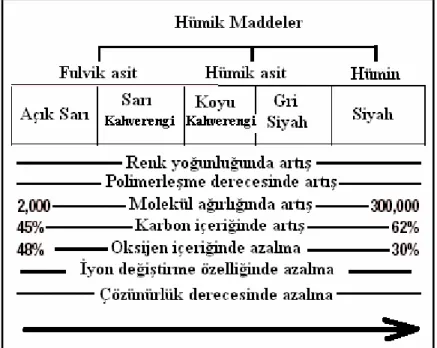
Hümik asit, fulvik asit ve hümin birer hümik madde fraksiyonu olmasıyla beraber, fiziksel ve kimyasal özellikleri farklılık göstermektedir. Bu farklılıklardan bazıları aşağıda şematik olarak verilmiştir.
Şekil 1.1. Hümik madde türlerinin kabul görmüş karşılaştırmalı özellikleri (Stevenson, F. J., 1982)
Hümik maddeleri bu üç türden başka tanninler, ligninler ve ulmik asitler gibi birçok alt birimde inceleyebiliriz. Şekil 2.1’ de görüldüğü gibi fulvik asitten hümine doğru gidildikçe molekül ağırlığında ve karbon içeriğinde artış gözlenmektedir.
Hümik ve fulvik asitlerin yapısı hakkında kesin bir bilgi yoktur. Ancak yapılarında bulunan fonksiyonel gruplara bağlı olarak hümik ve fulvik asit için moleküler yapılar sunulmuştur. Fulvik asit için öngörülen moleküler yapı aşağıdaki gibidir. Hümik asitin moleküler yapısı ise daha sonra sunulacaktır.
Şekil 1.2. Fulvik asitin moleküler yapısı (Stevenson, F. J., 1982) 1.1.1. Hümik ve Fulvik Asitlerdeki Fonksiyonel Gruplar
Benzer fonksiyonel gruplar içeren fulvik ve hümik asitlerin genel fonksiyonel gruplarını aşağıdaki gibi karşılaştırmak mümkündür.
Şekil 1.3. Hümik ve Fulvik Asitlerdeki Fonksiyonel Gruplar
Burada da görüldüğü gibi karbon miktarı azaldıkça ve oksijen miktarı arttıkça hümik maddenin fulvik asit olma ihtimalide artmaktadır. Dikkat çekici önemli bir nokta fulvik asitteki –COOH ve –OCH3 gruplarının hümik asitteki miktarından fazla olduğudur. Buna karşılık hümik asitte de eter gruplarının miktarı artmaktadır. Burada
fulvik asitteki –COOH ve –OCH3 grupları parçalanarak hümik asitte eter gruplarına dönüşmüştür şeklinde bir teori sunulabilir.
Hümik maddelerdeki fonksionel grupları incelediğimizde hümin, hümik asit ve fulvik asit sırasında toplam asidite miktarlarında artış görülmektedir.
Tablo 1.1. Hümik Maddelerdeki Fonksiyonel Gruplar (mmol/kg) Toplam Asidite Karboksil Fenolik Hidroksil Alkolik Hidroksil Karbonil Hümin 5100±200 2000±200 3100±200 3600±300 2600±200 Hümik Asit 7200±400 3100±200 4200±300 1300±300 1300±100 Fulvik Asit 8600±400 4000±200 4600±200 800±200 4300±100 1994’ te Tan, hümik maddelerin toplam asitliğinin karboksilik ve fenolik hidroksil içeriklerinin toplamıyla ilgili olduğunu bildirmiş ve hümik maddelerin katyon değiştirme ve kompleksleşme kapasitelerini göstermiştir. Yüksek bir toplam asitlik değeri, hem katyon değiştirme kapasitesinin ve hem de kompleksleşme gücünün yüksek olduğunun göstergesidir (Tan, K. H., 1994).
Tablo 1.2. Hümik ve Fulvik Asitler İçin Yaklaşık Elementel İçerikler
% Hümik Asit Fulvik Asit
Karbon 53,8-58,7 40,7-50,6
Hidrojen 3,2-6,2 3,8-7,0
Oksijen 32,8-38,3 39,7-49,8
Azot 0,8-4,3 0,9-3,3
Kükürt 0,1-1,5 0,1-3,6
1.1.2. Hümik Asitin Yapısı ve Elde Edilmesi
Hümik maddelerin toprağın her zerresinde ve suyun her damlasında bulunuyor olmalarına karşın, son 200 sene zarfında yapıları hiç kimse tarafından tam olarak tanımlanamamıştır. Hümik maddeler, bulundukları ortamın şartlarına göre moleküler yapılarını yeniden düzenleyebilme özelliğine sahiptir (Mayhew, L., 2004).
Hümik asitleri, doğada bulundukları kaynaklara göre iki alt sınıfta incelemek mümkündür:
1) Toprak kaynaklı hümik asitler 2) Su kaynaklı hümik asitler
Toprak kaynaklı hümik asitler, yapı itibariyle oldukça aromatik bir yapıya sahiptir. Yani; benzen ve fenole benzeyen bir çok bileşen birbirlerine karmaşık olarak kondanse olmuştur. Su kaynaklı hümik asitlerde ise, aromatik yapılar bulunmakla birlikte, toprak kaynaklı hümik asitlerdeki kadar fazla değildir. Su kaynaklı hümik asitlerin yapılarında alifatik gruplar oldukça fazladır.
Hümik asitler çeşitli doğal kaynaklardan elde edilebilirse de, “linyit” ve “leonardite” en yaygın hümik asit kaynakları olarak bilinir. Bu kaynaklardan hümik asitlerin ekstrakte edilmesi, esas olarak iki basamaklı bir işlemdir. Hümik asit kaynağı bazik bir çözeltiyle etkileştirilerek hümik asit önce alkali tuzuna dönüştürülür, sonra bazik ortamda çözünmüş halde bulunan hümik asit çözeltisi asitlendirilerek siyah yumaklar halinde hümik asit elde edilir.
Şekil 1.4. Hümik asitin 35.000 defa büyütülmüş görüntüsü
Alifatik ve aromatik birimlere bağlı fonksiyonel gruplar üniform bir dağılım sergilemediklerinden, molekül ağırlıklarını daha detaylı bir şekilde belirtmenin mümkün olmadığı hümik asitler, molekül ağırlıkları 2000 ile 5000 Dalton arasında
değişebilen hümik maddelerdir. Hümik asitteki karbon, oksijen, hidrojen ve azot gibi elementler; çok sayıda alifatik ve aromatik halkadan meydana gelen yapıda bir arada bulunurlar. Şekil 1.5’de görüldüğü gibi söz konusu alifatik ve aromatik halkalar birbirlerine karbonil, alkolik ve fenolik hidroksiller, karboksilatlar, aminler, amidler ve diğer fonksiyonel gruplarla bağlanmıştır. Bütün bu fonksiyonel gruplar, hümik asidi hem hidrofilik ve hem de hidrofobik bölgelere sahip bir molekül haline getirir (Chopin, G., 1999), (Chopin, R., 1997). Hümik asitlerin yapısında, kaynağına bağlı olarak; Ca, Mg, Cu ve Zn gibi metal iyonları da bulunabilmektedir. Bu iyonlar, doğal ortamda hümik asit ile şelatlaşmış olarak bulunurlar.
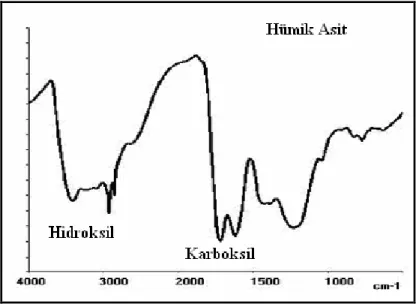
Hümik asitlerdeki fonksiyonel gruplar, maddenin reaktifliği hakkında önemli bilgiler verir. Bu gruplar; ağırlıklı olarak oksijen içeren karboksil ve fenolik hidroksil gibi gruplar olup, IR spektroskopisiyle kolayca tayin edilebilirler. Aşağıda hümik asit için örnek bir IR spektroskopisi görülmektedir.
Şekil 1.6. Hümik Asitin IR-Spektrumu
Son zamanlarda “leonardite” (linyit kömürünün yükseltgenmiş bir formu) nin özelliklerini anlamak için yapılan çalışmalar sonucunda, bu maddenin büyük oranda hümik asit tuzlarının bir karışımı olduğu tespit edilmiştir.
Hümik moleküldeki katyon değiştirici gruplar büyük oranda hidrojenler tarafından doldurulduğundan, molekül asit gibi davranır ve buna göre isimlendirilir. Katyon değiştirici gruplar büyük oranda protondan farklı bir katyon tarafından işgal edilmişse madde, hümat olarak isimlendirilir. Tek yüklü alkali metallerinin hümatları
suda çözünür, fakat çok değerlikli metallerin hümatları genellikle çözünmez (Senn, T. L.).
1.2. Hümik Asitin Kimyasal Özellikleri
Hümik asitlerin kimyasal özellikleriyle ilgili sınırlamalara rağmen, bu maddelerin bileşimi hakkında pek çok şey bilinmektedir. Hümik maddelerin bileşimi; elde edildiği kaynağa, ekstraksiyon metoduna ve diğer parametrelere bağlı olarak değişiklik gösterir. Bununla birlikte; farklı hümik maddeler arasındaki benzerlikler, genelde farklılıklarından daha fazladır (Cafe, M. C., 1982).
Hümik asitin yapısında bulunan en önemli fonksiyonel gruplar, hiç şüphesiz –COOH gruplarıdır. Bu gruplar moleküle, metal iyonları ile şelatlaşabilme özelliği kazandırır. Hümik asitin şelatlaşabilme özelliği, canlılar için son derece önemlidir. Çünkü; şelatlaşma ile;
a) Metal iyonlarının çökelmesi önlenmiş olur.
b) Metal iyonlarının canlılar tarafından biyolojik kullanımı kolaylaşır. c) Ağır metallerin zehirleyici etkileri azaltılmış veya bertaraf edilmiş olur . Bütün bu etkilerinin yanı sıra hümik asitler, ultraviyole ve görünür bölge ışınlarının iletiminde de rol almaktadır. Bu da; canlılar için son derece önemlidir (Filella, M., 1990).
Hümik asitler içme suyuna tat ve koku verebildiği için, genellikle içme sularından uzaklaştırılır. Bu amaçla; ters osmoz ve ultrafiltrasyon işlemleri kullanılmaktadır. Bununla birlikte; hümik asitlerdeki hidrofilik ve hidrofobik gruplar hem organik hem de inorganik maddeler ile etkileşebildiğinden, bu maddeler suyun saflaştırılmasında kullanılabilir (Meng, J., 1998).
Hümik asit/hümat sistemi aynı zamanda doğal tampon sistemleridir. Doğadaki pH değerlerinde meydana gelen küçük sapmaların bile canlılar için son derece önemli sonuçlar doğurabildiği düşünülürse, hümik asitlerin önemi daha iyi anlaşılabilir.
Reaktivitelerinden dolayı hümik maddelerin su ve toprak üzerine önemli etkileri bulunmaktadır. Suffet ve MacCarthy akuatik (su kaynaklı) hümik maddelerin kirleticiler üzerine etkisini gözden geçirmiş ve hümik maddelerin organohalidler, polisiklik aromatik hidrokarbonlar, ağır metal iyonları, indirgenebilen metal iyonları, çözünebilen yükseltgenler, demir bileşikleri, alüminyum bileşikleri, kuvvetli asitler ve bazlar ile etkileşebildiğini tespit etmişlerdir. Lobartini, Chiou ve Garbarini hümik asitin inorganik ve organik
maddelerle etkileşme şeklinin büyük oranda hümik asitin kimyasal yapısına bağlı olduğunu bildirmiştir. Bu nedenle; hümik asitlerin yapıları hakkında daha doğru bilgi elde etmek son derece önemlidir. Bununla birlikte; hümik asitlerin polifonksiyonel yapıda olması ve tekrarlanan yapı birimlerinin olmaması, proteinler ve karbonhidratlar gibi biyomoleküllerin tayin edildiği birçok yaygın fraksiyonlama ve yapı karakterizasyon tekniklerinin kullanılırlığını azaltmaktadır (Meng, J., 1998).
Metal iyonlarının hümik asit ile kompleks oluşturması, zararlı metal iyonlarının topraktaki ve sudaki tutulmasını ve hareketliliğini etkilediği için son derece önemlidir. Şelatlaşma kapasitesinin çok yüksek olmasından dolayı hümik
asitler, metal kirliliklerine maruz kalmış göllerin ıslahında kullanılabilir (Tan, K. H., 1994).
Hümik maddelerin dünya çapındaki kullanımı oldukça yaygındır ve toprak için önemi kanıtlanmıştır. Bütün ekosistemlerin önemli bir parçası olup, besleyici madde ve karbon döngüsünde önemli roller üstlenir. Topraktaki humus azalmasını giderebilecek organik maddeler için zengin ve ekonomik bir kaynak teşkil eder. Hümik maddelerin toprağa (örneğin kalkerli topraklara) ilavesiyle bitki gelişimi,
mineral besleyicilerin tek başına sağladığından daha ileriye çıkar (Mayhew, L., 2004).
Hümik maddeler kaya ve minerallerin ayrışmasına aktif olarak katılır. Bazı minerallerin hümik asit çözeltisi ile ayrışmaları birçok araştırmacı tarafından kanıtlanmıştır. Bu davranışın karakteri mineralin dayanıklılığına olduğu kadar, hümik asitin özelliğine de bağlıdır.
Hümik maddelerin, tohumun çimlenme hızını ve bitkinin vitamin içeriğini arttırdığı kanıtlanmıştır. Lieske, hümik asit ve türevlerinin bitki membranlarının geçirgenliğini arttırarak besleyici maddelerin bitki tarafından alımını kolaylaştırdığını bildirmiştir.
Khristeva, hümik asitlerin bitki gelişiminin ilk evrelerinde bitkiye nüfûz ederek solunumda katalizör olarak davrandıkları bilinen polifenoller için ek bir kaynak olarak davrandığını ileri sürmüştür. Bu da; enzim sistemlerinin güçlenmesi, hücre bölünmesinin hızlanması, kök sistemlerinin daha fazla gelişmesi ve son olarak kuru madde veriminin artmasıyla sonuçlanarak bitkinin yaşam aktivitesini arttırır (Senn, T. L.).
1.3. Hümik Asitin Fizikokimyasal Özellikleri
Hümik asitlerin fizikokimyasal özellikleri iki başlık altında incelenebilir: 1) Maddelerle Etkileşme Mekanizmaları
2) Sulu Ortamda Çözünme Özellikleri 1.3.1. Maddelerle Etkileşme Mekanizmaları
Hümik asitlerin yapılarında çok sayıda fonksiyonel grup bulunmaktadır. Bu grupların sayesinde maddelerle etkileşebilme olanağına sahiplerdir. Yapılarındaki bu gruplarla hümik asitler; maddelerle aşağıdaki şekillerde etkileşebilirler:
1) İyon Değişimi -COOH ve kısmen –OH grupları
2) Kompleks Oluşumu -COOH, -OH, -NR2, -SH, heterosiklik yapılar 3) Adsorpsiyon Polar ve apolar yapılar
4) Redoks Tepkimeleri Kinon ve hidrokinon yapıları
İyon değişiminde maddelerle hümik asitlerin etkileşiminde, metal iyonu polielektrolitteki aynı yüklü iyonla yer değiştirir. Bu işlemdeki başlıca yürütücü güç; elektorstatik etkileşmeler ve metal iyonlarının dehidrasyonudur. Hümik asitlerdeki asidik karboksil grupları, metal iyonlarının elektrostatik olarak bağlanabileceği bölgelerdir. Karboksil grupları, hümik asit molekülünde zayıf, orta kuvvette ve kuvvetli katyon iyon değiştirici bölgeleri teşkil eder.
Metallerin hümik asitlere tutunabileceği bir diğer yol ise kompleks oluşumudur. Metaller hümik asitin yapısında bulunan gruplarla ο-fitalat da olduğu gibi iki -COOH grubu arasına ya da salisilatta olduğu gibi bir –COOH ve bir –OH grupları arasına bağlanabilirler. Metal iyonları bu bölgelere koordine kovalent bağlarla bağlanırlar. Yine metaller hümik asitlere karboksil ve fenolik hidroksil grupları arasında metal iyonunun şelatlaşması, bir karboksil grubuyla metal iyonunun kompleksleşmesi veya fenolik hidroksil ve fenolik eter grupları ile metal iyonunun kompleksleşmesi şeklinde de bağlanabilirler (Pandey, A., 1999), (Sahu, S., 1996).
C O O Me C O O C O O O Me o-fitalat salisilat
Şekil 1.7. Metallerin Hümik Asit İle Kompleks Oluşturma Şekilleri
Metal-hümat kompleksinin dayanıklılığını sorgulamak için, durum kararlılık sabitleri hesaplanır. Bunun için de, toplam ligand konsantrasyonunun bilinmesi gereklidir. Fakat; hümik asitin heterojenliği nedeniyle bu değerin deneysel olarak tespit edilmesi oldukça zordur. İlk yaklaşım olarak; standart metotlara göre - COOH, fenolik ve enolik – OH gruplarından elde edilmiş toplam asitlik değerini kullanmak mümkündür (Stevenson, F. J., 1982), (Senkyr, J., 1999). Toplam asitlik değeri uygulanan metoda bağlıdır.
1.3.2. Sulu Ortamda Çözünebilme Özellikleri
Sulu çözelti ortamında metal iyonlarını tutabilmeleri, tutulan iyonları düşük pH’ larda bırakabilmesi, rejenere edilebilme özellikleri hümik asitleri önemli kılmaktadır. Fakat bütün hümik madde kaynaklarından alkali ekstraksiyonu yoluyla elde edilen hümik ve fulvik asitler, pH>3 olan bütün sulu çözeltilerde az veya çok çözünürler ve bu özelliklerinden dolayı doğrudan adsorban madde olarak kullanılmaları mümkün değildir. Bu nedenle; sulu ortamda hümik asitin adsorban/iyon değiştirici katı madde olarak kullanılması zordur. Sulu ortamdan, özellikle metal iyonlarının geri kazanılması, giderilmesi, ön-deriştirilme gibi işlemlerde hümik asitin özelliklerinden faydalanabilmek için uygun bir işleme tabi tutularak çözünürlüğünün azaltılması gerekir. Bunun için uygulanan başlıca iki yöntem aşağıdaki gibidir.
1) Hümik asitin çözünürsüzleştirilmesi.
1.3.2.1. Hümik asitin çözünürsüzleştirilmesi
Çözünürsüzleştirme; hümik asitte bulunan ve hümik asitin sulu ortamda çözünmesine önemli oranda katkıda bulunan fonksiyonel gruplardan bir kısmının yapıdan uzaklaştırılmasıdır. Bunun için; Seki ve Suzuki tarafından denenen teknik kullanılabilir. Bu yöntemde (Seki, H., 1995), hümik asit 330 oC’ta 1 saat ısıtılarak hümik asitteki karboksil ve fenolik hidroksil grupları arasında bir kondenzasyon reaksiyonu meydana getirilir ve sonuçta hümik asit, sulu ortamda pH 10’a kadar çözünmeyen bir şekle dönüştürülmüş olur. Isıtma işlemi sırasında hümik asitten su molekülleri ayrılır. Bununla birlikte hümik asit molekülündeki karboksil gruplarının bozunarak CO2 gazının açığa çıktığı “dekarboksilasyon” işleminin meydana gelmesi de olasıdır. Bu dönüşüm sonucunda elde edilen hümik asit üzerine uygun işlemler yapıldıktan sonra hümik asit geniş bir pH aralığında kullanılabilecek bir forma dönüştürülmüştür. Çözünürsüzleştirme işlemi sonucunda hümik asitte bulunan ve metallerin bağlanmasına olanak sağlayan aktif – COOH gruplarının sayısı azalmıştır. HA ve IHA’nın 0,1 F HNO3 ve 0,1 F NaOH ile yapılan titrasyon eğrilerinden, HA ve IHA üzerindeki toplam asidik grup sayısının sırasıyla 3,40.10-3 ve 2,60.10-3 olduğu tayin edilmiş ve kondenzasyon reaksiyonundan yani çözünürsüzleştirme işleminden sonra HA üzerindeki asidik grupların %25’inin kaybolduğu belirtilmiştir (Seki, H., 1995).
Şekil 1.9. Çözünürsüzleştirilmiş hümik asitin sulu ortamda pH’ya bağlı olarak çözünme özelliği
Yukarıdaki iki şekilde görüleceği gibi; pH 3’ün üstünde çözünmeye başlayan hümik asitler çözünürsüzleştirme işlemiyle pH 10’ da dahi çözünmeyen bir forma dönüştürülmüştür. Çözünürsüzleştirme işleminin bir avantajıda; hümik asitin çözünme özelliğini azaltan diğer işlemler gibi zaman alıcı ve zor kimyasal etaplar içermemesidir.
1.3.2.2. Hümik asitin immobilizasyonu
İmmobilizasyon; istenen fizikokimyasal işlemi gerçekleştirebilmeye elverişli fonksiyonel gruplara sahip bir maddenin, bazı fiziksel özellikler açısından kendisinden daha üstün katı bir destek maddesine, uygun bir yöntem ile tutturulmasıdır. İmmobilizasyon işlemi 2 şekilde gerçekleştirilir:
1- Fiziksel adsorpsiyon ile 2- Kimyasal reaksiyonlar ile
Fiziksel Adsorpsiyon ile İmmobilizasyon
Bu yöntemle hümik asit katı destek maddesinin yüzeyine zayıf Van der Walls etkileşmeleri ile bağlanır. Zayıf etkileşmeler nedeniyle, hümik asitin çözünürlüğü kısmen azaltılabilir. Fiziksel adsorpsiyon ile immobilizasyon sonucunda elde edilen hümik asitin çözünürsüzlüğü, kimyasal reaksiyon ile immobilizasyon sonucunda elde edilen hümik asitin çözünürsüzlüğü kadar iyi değildir.
Kimyasal Reaksiyonlar ile İmmobilizasyon
Hümik asitteki fonksiyonel gruplar ile katı destek maddesindeki fonksiyonel gruplar arasında kimyasal bir reaksiyon gerçekleştirilir ve sonuçta katı destek
pH
0 10 14
Çözünmeye başlar Çözünmez
maddesi ile hümik asit arasında kimyasal bir bağ oluşur. Etkileşmelerin kuvvetli olması nedeni ile, hümik asitin çözünürlüğü önemli oranda düşürülebilir.
O O Si O CH3 CH2CH2CH2NH3 C O O O OH silika HA
1.4. Hümik Asitlerin Elektrokimyasal Özellikleri
Hümik maddeler, sudaki geçiş metallerini de kapsayacak şekilde metal iyonlarına karşı bir şelatlaştırma aracı olarak davranmaktadır. Hümik maddelerin metal iyonları üzerine olan önemli bir etkisi de, başlıca iki yolla meydana gelen indirgenme-yükseltgenme reaksiyonlarıdır. Hümik asit için E0 değeri 0,70 V olarak hesaplanmıştır ve genellikle indirgeyen madde olarak davranır. Ayrıca hümik maddeler, şelatlama ile indirgenmiş katyonları kararlı hale getirebilir. Örneğin; şelatlaşmamış bir oksoanyon olan Cr2O72- hümik asit tarafından şelatlaşabilen katyonik Cr3+ türüne indirgenir. Cr2O72- türünün Cr3+ türüne indirgenmesine ilişkin yarı-reaksiyon, hümik maddenin varlığında sağa doğru meyillidir. Hümik maddeler aynı zamanda çözünebilen VO3– ve MnO42- türlerini de indirgeyebilir. Böylece bu
türler, çözünebilen formdan şelatlaşabilen katyonik forma dönüşürler (Meng, J., 1998).
1.5. İyon ve Ligand Değişimi
1.5.1. İyon değiştirici maddeler ve özellikleri
İyon değiştirme bir katı maddenin yapısında bulunan iyonların temasta bulunduğu çözelti içindeki aynı cinsten yüklü başka iyonlarla bir dengeye göre değişmesi temeline dayanır. Bu amaçla kullanılan katı maddeler, çözelti ortamında hiç çözünmeyen büyük moleküllü doğal veya yapay maddelerdir. Bunlar inorganik ve organik diye ikiye ayrılırlar (Skoog, D. A., 1999).
İyon-değiştirme; katı ve sıvı faz arasındaki iyonların tersinir bir şekilde yer değiştirmesi olarak tanımlanır. Bir iyon değiştirici reçinenin çalışma prensibi; hareketli faz olan zıt iyonlar taşıyan faz ile, sabit yüklü gruplar ihtiva eden çözünmeyen maddeler arasındaki elektrik yüklerinin dengelenmesi şeklindedir.
İyon değiştiricinin iyonları tutma gücü, birçok değişken parametrenin fonksiyonudur. Bunlar pH, iyon yükü, iyon yarıçapı, reçinenin gözenekliliği, çözücü ve sıcaklıktır.
Kimyasal özelliklerine göre iyon değiştiriciler 2 grupta incelenir: İnorganik İyon Değiştiriciler
İnorganik iyon değiştiricilerden en çok bilinenler zeolitlerdir. Genel olarak Na2Al2SiO2, formülünde gösterilirler. Zeolitler yapılarında bulunan sodyum iyonlarını Fe+2 , Mg+2 gibi iyonlarla değiştirme özelliğine sahip olan maddelerdir. Organik İyon Değiştiriciler
Organik iyon değiştiriciler (reçineler) suda ve birçok organik çözücüde hiç çözünmeyen, yapılarında sayılamayacak kadar çok anyon ve katyon taşıyan büyük moleküllü polimer maddelerdir. Bunlar hem anyon, hem de katyon değiştirmede ve hatta selektif iyon değiştirmede kullanılırlar.
1.5.2. Ligand Değiştirme
‘Ligand değiştirme’ terminolojisi ilk olarak 1961 yılında F. G. Helfferich (Helfferich, 1961) tarafından, Walton ve Stokes’un ( Walton and Stokes, 1954) 1954 yılındaki araştırmalarından faydalanarak ortaya atılmıştır. Helfferich, bakır (II) yüklü karboksilik katyon değiştirici kolonları kullanarak sulu çözeltilerde diaminin tutulmasını sağlamış ve kolonu amonyak çözeltisi ile rejenere etmiştir (Helfferich, 1962). Ligand değişitirici reçinelerin diğer uygulamalarına alifatik aminlerin, diaminlerin ve hidrazinlerin ayrılmalarıyla devam etmiştir.
Ligand değiştirme kromatografisinde sulu ortamda bulunan aminler, amino asitler ve bunlara benzer ligandlar katı gövdeye tutturulan geçiş metalleri ile kompleksleşme yaptırılarak çok iyi ayırmalar gerçekleştirilmiştir (Helfferich, 1961).
Organik çözeltilerdeki bileşenlerin ayrılması ve saflaştırılması için ligand değiştirme kromatografisi son yılların popüler konusu olmuş ve bu konudaki çalışmalar artmaya başlamıştır. Yaklaşık 20 yıldan beri ligand değiştirme kromatografisi, saflaştırma konusunda ortaya çıkan birçok problemin çözümünü kolaylaştırmıştır. Ligand değiştirme kromatografisi karışımların ayrılması için güçlü ve güvenilir bir metot olmuştur.
Nadir toprak elementlerini ayırmada ortaya çıkan en büyük zorluk; dış elektron kabuklarındaki benzer yapıdan dolayı, kimyasal ve fiziksel özelliklerindeki benzerliklerdir. Bir elementten diğer bir elemente değişen ayırıcı özellikleri atomik çap ve bu elementlerin şelat yapıcılarla olabilecek kompleksleridir. Bu özellik iyon değiştiricilerde şelat yapıcılar kullanma fikrini geliştirmiştir. Şelatlaşma yanında kullanılacak elüsyon çözeltilerinin önemi artmış ve şelat reçinelerinde hangi çeşit elüent kullanılması gerektiği üzerindeki çalışmalar yoğunluk kazanmıştır. Elüent seçimindeki gelişmeler ayırma piklerinde istenilen piklerin elde edilmesini sağlamıştır.
Ligand değiştiriciler, değişik fonksiyonel gruplarla kompleks teşkil eden metal iyonlarını taşıyan maddelerdir. Bugün, ligand değiştirme, standart bir teknik haline gelmiş olup, aminlerin, amino asitlerin vb. ayrılmasında kullanılmaktadır. Şelat reçineler ve ligand değiştirme olayı iyon değiştirmenin kimyasal reaksiyonlarla kompleks oluşturmasını amaçlayan genel bir düşüncenin ürünü olmuştur.
Ligand değiştirme sistemlerindeki metal iyonunun sabit faza yerleştirilmesine veya metal iyonunun değişken faz tarafından hareket ettirilmesine bağlı olarak ikiye ayrılır. Birinci durumda metal iyonu kompleks, koordinasyon veya başka bağlar vasıtasıyla sabit faz tarafından tutulur. Eğer bu metal iyonunun koordinasyon küresi doyurulmazsa hareketli fazda bulunan farklı ligandları tersinir olarak adsorblar.
Ligand değiştirme heterojen bir reaksiyondur. Sıvı fazdaki ligandlar, katı fazdaki ligandlar ile yer değiştirir. Amonyak, alifatik aminler, polihidrik alkoller, karboksilik anyonlar ve amino asitler potansiyel ligand olarak sayılabilirler. Çözeltiden tutulan ligandlar, metal iyonuna bağlı çözücü molekülleri ile veya daha önce komplekse bağlanmış diğer ligandlar ile yer değiştirir.
Ligand değiştirme, ligand gibi hareket edebilen, çözünen ve kompleks
oluşturan katyonlar arasındaki kararsız komplekslerin oluşumuyla ilgilidir (Ayar, 1997). Cu(II), Co(II), Ni(II) ve Ag(I) gibi kompleksleşmiş katyonlar
içeren iyon değiştiriciler, ligand olarak davranabilen moleküller ve anyonlar için yüksek seçici sorbentler olarak kullanılabilirler.
Ligand seçiciliği, metal iyonunun kompleksleri güçlü olduğu zaman yüksektir. Ligandların reçinedeki metal iyonu tarafından yeteri kadar çekilmesi
nedeniyle adsorbsiyon için yeteri kadar büyük bir yürütücü kuvvet vardır ( Uçan, 2002).
1.5.2.1. Ligand değiştiriciler
Ligand değiştiricilere kompleks yapan iyon değiştiriciler adı verilir. Fonksiyonel grup taşıyan bu reçineler iyon taneciklerine karşı özel bir davranış göstermektedir. Şelatlaşmış gruplar kararlı kompleksler yaptığı için bu reçinelerin önemi büyüktür. Kompleks yapan bu reçinelerin fonksiyonel grupları iyonlarla veya fonksiyonel gruba sahip bileşiklerle şelat yaparlar. Şelat yapan maddelerde, şelat maddesi uygun kararlılığa sahip olmalıdır, şelat maddesi, şelat halkası oluşturabilme özelliğine sahip olmalıdır (Uçan, 2002).
Koordinasyon yapan kopolimerler, metallerle kordinasyon yapabilen ve içerisinde dönor atomu taşıyan fonksiyonel gruplarla kovalent bağlar yaparak polimere bağlanırlar( Boef, 1983). Kopolimerler özel ve seçici ligand değiştirciler olarak kullanılırlar.
Fonksiyonel gruplar içerisinde elektron verici olarak görev yapan elementler, oksijen, azot, kükürt, fosfor ve arseniktir. Bazı fonksiyonel gruplar aşığıda gösterilmiştir: - NHCH2COOH -CH2N(CH2COOH)2 - P(OH)2 - PO(OH)2 - OPO(OH)2
Şelat reçinelerini diğer reçinelerden ayıran özellikleri şöyle sıralayabiliriz: • Metal iyonlarının şelat iyonlarına karşı ilgisi şelat grubunun yapısına
bağlıdır. İyon büyüklüğü, yükü ve diğer fiziksel özellikleri ikinci derecede önemlidir.
• Alışılan iyon değiştiricilerde bağlanma kuvveti 8-12 kJ/mol iken şelat reçinelerde 60-100kJ/mol’ dür.
• Şelat reçinelerde değiştirme işlemi iyon değiştiricilerden daha yavaştır (Benli, 1997).
Ligand değiştirici reçinelerin seçiciliği ligand gruplarının diş sayısı ile ilgilidir. Seçici ligand değiştiricilerde olması istenen özellikler ise aşağıdaki gibidir.
• Çapraz bağın olmaması veya az olması, • Çok sayıda aktif fonksiyonel grupların olması,
• Aktif fonksiyonel gruplar üzerinde dönor atom sayısının çok olması, • Metalin liganda ilgisinin fazla olması.
Bugün ligand değiştirme, standart bir kromatografik teknik haline gelmiştir. Oluşan komplekslerin yüksek kararlılığı sebebiyle sorbentler çözelti içinde tuzlar ve elektrolit olmayan maddeler olmasına rağmen hareketli fazdaki ligandları seçici bir şekilde tutablirler. Bu yolla, ligand tutma dönor grupları bulunmayan her tür maddeden kompleks oluşturabilen bileşenlerin ayrılması için ve sulu ligand çözeltilerin konsantre edilebilmesi için kullanılabilirler (Uçan, 2002).
1.5.2.2. Ligand değiştiricilerde şelatlaşma
Koordinasyon bileşiklerinde bir merkez atomu vardır. Merkez atomu büyük çoğunlukla artı yüklü metal iyonudur. Elektron çifti aldığı varsayılarak merkez atomuna Lewis Asidi denir. Merkezin çevresinde ligandlar vardır. Ligandlar eksi yüklü iyonlar, nötr moleküller veya atomlardır. Merkez atomuna elektron çifti verdiği varsayılarak ligandlara Lewis Bazı denir.
Ligandların çoğu bir katyon ile koordinasyon bağı oluştururlar. Bunlardan bir koordinasyon bağı oluşturan ligandlara tek dişli ligandlar denir. Bazı durumlarda ise her bir ligand molekülü merkez metal katyonuna birden fazla dişle bağlanırlar, bu tip ligandlara çok dişli ligandlar denir. Bazı ligandlar ise merkez atomuna altı dişle bağlanırlar. Liganlarla katyonlar arsında oluşan bu komplekslere ise şelat kompleksleri denir. Çoğunlukla tek dişli ligandlar çok dişli ligandlar kadar güçlü değildirler.
Bazı ligandlar ise (etilen diamin tetra asetat gibi) merkezi iyona altı dişle yani çok dişli olarak bağlanırlar. Çok dişli ligandlar ve katyonlar arasında oluşan bu kompleks iyonlara “şelat kompleksleri” denir. Bu tür komplekslerde ligandlar, metal iyonu üzerine kıskaç gibi tutunurlar. Genelde çok dişli ligandlar tek dişli ligandlardan daha güçlüdür.
Metal iyonlarını tutan katı desteğin ve şelatların seçimi çok önemlidir. İki dişli ligandlar metal iyonlarını bağlama yönünden zayıftır. Üç dişli ligandlar ise metal iyonlarını bağlama yönünden uygundur. İki dişli ligandların tutmuş oldukları metaller elüent ile sökülebildikleri halde üç dişli ligandlar için böyle bir durum söz konusu değildir. Bu durum göz önüne alınarak fonksiyonel gruplar seçilirken üç dişli ligandlar veya çok dişli ligandlar tercih edilmelidir.
1.6. Adsorpsiyon
Adsorpsiyon bir katının ya da bir sıvının sınır yüzeyindeki konsantrasyon değişmesi olarak tarif edilebilir. Konsantrasyonun artışı halinde buna pozitif adsorpsiyon, azalması halinde de negatif adsorpsiyon denir. Adsorpsiyon olayı maddenin sınır yüzeyinde moleküller arası kuvvetlerin denkleşmemiş olmasından ileri gelir. Adsorpsiyon, atom, iyon ya da moleküllerin bir katı yüzeyinde tutunması şeklinde de ifade edilebilir.
Sabit sıcaklık ve basınçta kendiliğinden olduğundan dolayı adsorpsiyon sırasındaki serbest entalpi değişimi yani adsorpsiyon serbest entalpisi ∆G daima eksi işaretlidir. Diğer taraftan, gaz ya da sıvı ortamda daha düzensiz olan tanecikler katı yüzeyinde tutunarak daha düzenli hale geldiği için adsorpsiyon sırasındaki entropi değişimi yani adsorpsiyon entropisi ∆S de daima eksi işaretlidir. Adsorpsiyon serbest enerjisi ve adsorpsiyon entropisinin daima eksi işaretli olması,
∆H = ∆G + T∆S
eşitliği uyarınca adsorpsiyon sırasındaki entalpi değişiminin yani adsorpsiyon entalpisinin (∆H) daima eksi işaretli olmasını gerektirmektedir. Adsorpsiyon ısısı da denilen adsorpsiyon entalpisinin eksi işaretli olması, adsorpsiyon olayının daima ısı salan yani ekzotermik olduğunu göstermektedir. Adsorpsiyon ısısı, katı yüzeyindeki doymamış kuvvetlerle adsorplanan tanecikler arasındaki etkileşmelerden doğmaktadır. Adsorpsiyon ısısı –20 kJmol-1 civarında olan etkileşmeler sonundaki tutunmalara fiziksel adsorpsiyon, –200 kJmol-1 civarında olan etkileşmeler sonundaki tutunmalara ise kimyasal adsorpsiyon denir. Fiziksel adsorpsiyon sırasında adsorplanan tanecikler ile katı yüzeyi arasında zayıf Van der Walls çekim kuvvetleri etkindir. Kimyasal adsorpsiyon sırasında ise tanecikler ile yüzey arasında bir kimyasal bağ ve genellikle de kovalent bağ oluşmaktadır. Tüm fiziksel adsorpsiyonlar ve çoğu kimyasal adsorpsiyonlar ekzotermik olduğu halde, hidrojen gazının cam üzerinde tutunması gibi bazı kimyasal adsorpsiyonlar endotermik olabilmektedir. Kimyasal adsorpsiyon yalnızca bir tabakalı yani monomoleküler olabildiği halde, fiziksel adsorpsiyon bir tabakalı ya da çok tabakalı yani multimoleküler olabilir. Diğer taraftan çoğu fiziksel adsorpsiyonlar tersinir olarak yürütülebildiği halde kimyasal adsorpsiyonlar tersinmezdir.
Bir molekülün potansiyel enerjisi; molekülün adsorblayıcı madde yüzeyine olan uzaklığı ile değişir. Molekül adsorblayıcı yüzeyine çekilirken önce önce fiziksel adsorpsiyonun meydana geldiği bir ara hal oluşmaktadır. Bu ara halin oluşması sırasında açığa çıkan ısı fiziksel adsorbsiyon ısısına eşittir. Fiziksel olarak adsorblanmış moleküller yüzeye daha da yaklaştığında kimyasal adsorbsiyon meydana gelmektedir. Bu sırada potansiyel enerji de büyük oranda düşmektedir. Adsorpsiyon sırasında molekül parçalanarak; molekül ile adsorblayıcı yüzey arsında kimyasal reaksiyon meydana gelmektedir.
Moleküllerin katı yüzeyine tutunması değişik bağlarla olur. Adsorplanan maddenin tanecikleri ile adsorban yüzeyindeki tanecikler arasında sadece Van der Walls çekim kuvvetlerine dayanan bir bağlanma oluyorsa bu tip adsorpsiyon fiziksel adsorpsiyon olarak adlandırılır. Fiziksel adsorpsiyonda adsorplanan moleküller yüzeye son derece zayıf olarak bağlanmıştır. Adsorpsiyon ısıları çok düşük olup en çok birkaç kilokalori civarındadır. Adsorpsiyon ısısı adsorplanan maddenin buharlaşma ısısı ile kıyaslanabilir bir değerdedir. Adsorpsiyon sıcaklıkla ters orantılıdır yani sıcaklığın artması adsorpsiyon miktarını önemli derecede azaltır.
Adsorplanan madde adsorbanın üzerinde tek moleküllü bir tabaka oluşturacak şekilde tutunmuş ise buna tek moleküllü adsorpsiyon veya tek tabaka adsorpsiyonu, madde çok moleküllü tabaka oluşturacak şekilde tutunmuş ise buna çok moleküllü adsorpsiyon veya çok tabaka adsorpsiyonu adı verilir.
Eğer adsorplanan moleküller yüzeyle kimyasal reaksiyona giriyorsa yani kimyasal bağlar oluşturuyorsa bu tür adsorpsiyon kimyasal adsorpsiyon olarak adlandırılır. Kimyasal adsorpsiyonda bazı kimyasal bağlar kopar ve bazı yeni bağlar oluşur. Bu nedenle adsorpsiyon ısısı kimyasal reaksiyonlarınki ile kıyaslanabilir büyüklüktedir ve genelde bir kaç kilokaloriden 100 kilokaloriye kadar olabilir. Kimyasal adsorpsiyon, katı yüzeyinde tek tabakalı adsorpsiyon şeklinde meydana gelir. Kimyasal adsorpsiyon hızı sıcaklıkla artar. Bu halde adsorplanmış tabaka mono moleküler bir tabakadır. Ayrıca; birçok durumda, kimyasal adsorpsiyon katının bütün yüzeyinde değil aktif merkez denilen bazı merkezlerde meydana gelir.
Genellikle herhangi bir adsorpsiyon, sıcaklık yükselirken azalmalıdır. Yüksek sıcaklıkta olan adsorpsiyon düşük sıcaklıkta olan adsorpsiyondan farklıdır. Yüksek sıcaklık adsorpsiyonu aktive edilmiş kimyasal adsorpsiyondur. Düşük sıcaklık
adsorpsiyonu ise Van der Walls adsorpsiyonudur. Fiziksel kuvvetler yapıya özel olmadığından Van der Walls adsorpsiyonu bütün hallerde meydana gelir. Kimyasal adsorpsiyon ise ancak karşılıklı kimyasal etkileşme olduğu zaman meydana gelir.
Bazı sistemler düşük sıcaklıklarda fiziksel, yüksek sıcaklıklarda ise kimyasal adsorpsiyon gösterirler. Hidrojenin nikel üzerinde adsorpsiyonunda durum böyledir. Genellikle kimyasal adsorpsiyon fiziksel adsorpsiyona göre daha spesifiktir ve gaz ile katı arasında bir reaksiyon eğilimi bulunduğu hallerde kendini gösterir. Van der Walls kuvvetleri tabiatı gereği spesifik olmadığından, kuvvetli kimyasal adsorpsiyonlarda maskelenmiş olsa bile, bütün hallerde kendini gösterebilir.
Adsorplanan maddeler adsorbanın türüne göre farklı şiddetlerde adsorplanırlar. Bazen bir katı, bir madde için çok iyi bir adsorban olduğu halde bir başka madde için iyi bir adsorban olmayabilir. Bu da bazı katı maddelerin seçimli adsorpsiyon özelliği olduğunu gösterir. Adsorpsiyonun seçimli olması, birçok konuda uygulama alanı bulmuştur. Örnek olarak; kimyada önemli analiz yöntemlerinden biri olan adsorpsiyon kromatografisi seçimli adsorpsiyon özelliğine dayanır ve birçok organik ve inorganik maddenin birbirinden ayrılması ve saflaştırılmasında kullanılır. İkinci bir kullanım alanı da genellikle polar moleküllerden oluşan zehirli gazların, adsorban olarak aktif kömürün kullanıldığı gaz maskeleri ile tutulmasıdır. Aktif kömür zehirli gazları havaya göre seçimli olarak adsorbe eder. Gaz maskelerinde kullanılma sebebi budur.
Metaller ve plastikler de dahil olmak üzere bir kristal yapıya sahip olsun ya da olmasın tüm katılar az veya çok adsorplama gücüne sahiptirler. Adsorplama gücü yüksek olan bazı doğal katıları kömürler, killer, zeolitler ve çeşitli metal filizleri şeklinde; yapay katıları ise aktif kömürler, yapay zeolitler, silika jeljeller, metal oksitleri, katalizörler ve bazı özel seramikler şeklinde sıralayabiliriz.
Adsorplama gücü yüksek olan katılar, deniz süngerini andıran gözenekli bir yapıya sahiptir. Katıların içinde ve görünen yüzeyinde bulunan boşluk, oyuk, kanal ve çatlaklara genellikle gözenek adı verilir. Genişliği 2 nm den küçük olanlara mikro-gözenek, 2 nm ile 50 nm arasında olanlara mezo-gözenek, 50 nm den büyük olanlara ise makro-gözenek adı verilmiştir. Katının bir gramında bulunan gözeneklerin toplam hacmine özgül gözenek hacmi, bu gözeneklerin sahip olduğu duvarların toplam yüzeyine ise özgül yüzey alanı denir. Gözeneklerin büyüklük dağılımına adsorplayıcının gözenek boyut dağılımı denir. Bir katının adsorplama gücü, o katının doğası yanında özgül yüzey alanı, özgül gözenek hacmi ve gözenek boyut dağılımına bağlı olarak değişmektedir.
1.6.1. Adsorpsiyon izotermleri
İzoterm; sabit bir sıcaklık ve basınçta adsorplanan maddenin denge konsantrasyonuna karşı adsorbanın kütle birimi başına adsorplanan madde miktarının karakteristik bir eğrisidir.
1.6.1.1. Freundlich izotermi
Deneysel sonuçlara dayanarak Freundlich kendi adıyla bilinen aşağıdaki bağıntıyı önermiştir.
Burada q, 1g katının adsorbe ettiği madde miktarı; C, adsorban ile dengede bulunan çözelti konsantrasyonu; k ve n de ampirik parametreleri göstermektedir. Yukarıdaki bağıntı;
şeklinde gösterilebilir ve ln q ile ln C arasında bir grafik çizilirse, şekilde görülen doğru elde edilir. Bu doğrunun y eksenini kestiği noktadan ln k (dolaylı olarak k), doğrunun eğiminden de n sabiti bulunabilir (Pekin, B., 1996).
Şekil 1.10. Freundlich sabitlerinin elde edildiği grafik 1.6.1.2. Langmuir izotermi
Yüzey kimyası alanındaki çalışmalarından dolayı 1932 yılında Nobel Ödülü alan Amerikalı bilim adamı Irving Langmuir (1881 – 1957) tarafından 1916 yılında kimyasal adsorpsiyon için çok basit bir izoterm denklemi türetmiştir.
Langmuir, teorik düşüncelerinden hareket ederek ve • Adsorpsiyon tek moleküllüdür,
• Adsorpsiyon dengesi bir dinamik dengedir,
• Adsorpsiyon hızı madde konsantrasyonu ve adsorbanın örtülmemiş yüzeyi ile orantılıdır,
kabullerine dayanarak adsorpsiyon için kendi adı ile bilinen bağıntıyı önermiştir (Berkem, A. R., 1984).
C/q = 1/(Kd.qm) + C/qm
Yukarıdaki bağıntıya göre; C/q ile C arasında çizilecek grafiğin eğimi 1/qm değerine, y-eksenini kestiği nokta ise 1/(Kd.qm) değerine eşit olacaktır. Burada; C: denge konsantrasyonunu (mol/L)
q: 1 g adsorban madde tarafından tutulan madde miktarını (mmolM+n/gİyon değiştirici)
qm: maksimum kapasiteyi (mmolM+n/gİyon değiştirici) Kd: denge bağlanma sabitini (L/mmol) göstermektedir.
Şekil 1.11. Langmuir sabitlerinin elde edildiği grafik Langmuir’in teorik yaklaşımı aşağıdaki kabullere dayandırılmıştır:
• Katı yüzeyi belli sayıda adsorpsiyon yüzeyi içerir. Denge durumunda herhangi bir sıcaklık ve basınçta dengede bu adsorpsiyon bölgelerinin θ gibi bir kesri adsorplanan moleküller tarafından işgal edilmiştir, 1-θ gibi bir kesri ise işgal edilmemiş durumdadır. Buna göre yüzeyin örtülü kesri θ ve örtülü olmayan kesri 1-θ olarak gösterilebilir.
• Her bir adsorpsiyon merkezine bir molekül tutunabilir.
• Adsorpsiyon ısısı bütün adsorpsiyon merkezleri için aynıdır ve yüzeyin örtülü kesrine (θ) bağlı değildir.
• Farklı merkezler üzerine bağlanmış moleküller arasında hiçbir etkileşme yoktur. Bir molekülün işgal edilmemiş bir merkeze bağlanması, veya işgal ettiği bir noktayı terk etme şansı komşu adsorpsiyon merkezlerinin dolu olup olmamasına bağlı değildir (Yıldız, S., 2000).
1.6.1.3. Dubinin-Radushkevich (D-R) izotermi
Radushkevich (1949) ve Dubinin (1965) karakteristik sorpsiyon eğrisinin adsorbanın gözenekli yapısıyla ilişkili olduğunu bildirmiştir (Ho, Y. S., 2002).
Langmuir izoterminden elde edilen sabitler, sorpsiyonun fiziksel ve kimyasal özellikleri hakkında herhangi bir bilgi vermez. Fakat, D-R izoterminden hesaplanan ortalama adsorpsiyon 1/bqm enerjisi (E), sorpsiyonun fiziksel ve kimyasal özellikleri hakkında bilgi verir. D-R izotermi, homojen bir yüzey ve sabit bir sorpsiyon potansiyeli temelinden hareket etmediğinden, Langmuir izoterminden daha kapsamlı bir yaklaşım sergiler (Ceyhan, Ö., 2001).
D-R izotermi, aynı tip gözenekli yapılarla gerçekleşen adsorpsiyon işlemlerini açıklar. Bu yönüyle, Langmuir izotermi ile benzeşi gösterir. D-R izotermi;
lnq = lnqm - kεεεε2
denklemi ile tanımlanır. Bu denklemde; ε : polanyi potansiyeli : RTln(1+1/C)
q:adsorbanın birim ağırlığınca tutulan metal iyonu miktarı (molİyon/gAdsorban)
qm: adsorbanın maksimum kapasitesi (molİyon/gAdsorban) C: metal iyonunun denge konsantrasyonu (mol/L)
k: D-R izotermi sabiti
R: Evrensel gaz sabiti (8,314.10-3 kJ/(mol.K) T: sıcaklık (K)
lnq-ε2 grafiğinin eğiminden k ve qm değerleri hesaplanabilir. D-R izoterminden elde edilen “k” değerleri kullanılarak ortalama adsorpsiyon enerjisi (E),
E = (2k)-1/2
formülünden hesaplanabilir. E değerinin 8-16 kJ/mol değerleri arasında yer alması, sorpsiyonun ağırlıklı olarak iyon değişimi mekanizması üzerinden gerçekleştiği anlamına gelir. E değerinin 8 kJ/mol’den daha düşük olması durumunda, tutulmanın mekanizması fiziksel etkileşmeler ile açıklanabilir. E değerinin 16 kJ/mol’den daha