T.C
EGE ÜNĠVERSĠTESĠ TIP FAKÜLTESĠ
ĠÇ HASTALIKLARI ANABĠLĠM DALI
MAMMALIAN TARGET OF RAPAMYCIN (MTOR) ĠNHĠBĠTÖRÜ KULLANAN RENAL TRANSPLANTLI HASTALARIN KLĠNĠK VE LABORATUVAR
VERĠLERĠNĠN RETROSPEKTĠF OLARAK DEĞERLENDĠRĠLMESĠ
UZMANLIK TEZĠ Dr. Feyza ARSLAN TAN
TEZ DANIġMANI Doç. Dr. Mümtaz YILMAZ
ĠZMĠR Ekim 2018
I TEġEKKÜR
Uzmanlık eğitimim boyunca beraber çalışma şansına eriştiğim ve feyzaldığım, İç Hastalıkları Anabilim Dalı Başkanı Sayın Prof. Dr. Selahattin Fehmi Akçiçek başta
olmak üzere hepsi kendi alanlarının önde gelen klinisyenlerinden olan tüm öğretim üyelerine,
İşine olan saygısını, çalışkanlığını, hastalarına gösterdiği ilgiyi ve hayata dair duruşunu örnek aldığım Sayın Doç. Dr. Mümtaz Yılmaz‘a,
Tezimin ortaya çıkmasında büyük katkıları olan ve Organ Nakli Polikliniği‘nin imkanlarından yararlanmamı sağlayan Sayın Prof. Dr. Hüseyin Töz‘e,
Varlığının ilk anlarından itibaren tezimin her aşamasında bana eşlik eden oğlum Tuna Ceday Tan‘a,
Uzmanlık eğitimimin her evresinde elimi sımsıkı tutan eşim Yaşar Çağatay Tan‘a,
Ege İç Hastalıkları Kliniği‘nde edindiğim dostluklardan Tuğba Çelebi, Fatma Erol ve Alper Uysal‘a,
Özellikle son bir senedir verdikleri büyük desteklerden dolayı Çağın Tan Eşrefoğlu, Erhan Eşrefoğlu ve Erçin Bülent Tan‘a,
Eğitim hayatım boyunca yoluma ışık tutan anneme ve babama,
ve
Elini her daim üzerimde hissettiğim ikinci annem rahmetli Nuray Tan‘a,
Teşekkürlerimle
II ĠÇĠNDEKĠLER
TEŞEKKÜR ... I İÇİNDEKİLER... II TABLO LİSTESİ ... III KISALTMALAR ... IV ÖZET ... V ABSTRACT ... VI
1. GİRİŞ VE AMAÇ ... 1
2. GENEL BİLGİLER... 2
2.1. Kronik böbrek yetmezliği ... 2
2.1.1. Son dönem böbrek yetmezliği tedavisi ... 5
2.1.2. Hemodiyaliz... 5
2.1.3. Periton diyalizi ... 5
2.1.4. Renal transplantasyon ... 6
2.1.5. Renal transplantasyonun prensipleri ... 7
2.1.6. İmmünspresif tedaviler ve yan etkileri ... 7
2.2. mTOR ve mTOR inhibitörleri... 9
2.2.1. mTOR sinyal yolağı... 9
2.2.2. Sirolimus ve Everolimus ... 10
2.2.3. mTOR inhibitörlerinin yan etkileri ... 10
2.2.4. mTOR inhibitörlerinin renal transplantasyonda kullanımı ... 14
3. GEREÇ VE YÖNTEMLER ... 15
4. BULGULAR ... 16
5. TARTIŞMA ... 23
6. SONUÇLAR ... 28
III TABLO LĠSTESĠ
Tablo 1. KDIGO kılavuzuna göre kronik böbrek hastalığı kriterleri………..2
Tablo 2. KDIGO kılavuzuna göre kronik böbrek hastalığında GFH kategorileri………2
Tablo 3. KDIGO kılavuzuna göre kronik böbrek hastalığında albüminüri kategorileri………..3
Tablo 4. 2016 yılı sonu itibarıyla prevalan hemodiyaliz hastalarının etiyolojik nedenlere göre
dağılımı (73 merkezden elde edilen verilere
göre)………….………...4
Tablo 5. 2016 yılı sonu itibariyle prevalan periton diyalizi hastalarının etiyolojik nedenlere
göre dağılımı (27 merkezden elde edilen verilere
göre)………...4
Tablo 6. De novo olarak mTOR inhibitörü başlanan hastaların kronik böbrek yetmezliği etiyolojileri………....16 Tablo 7: De novo olarak mTOR inhibitörü başlanan hastaların aldıkları indüksiyon tedaviler……… ....17 Tablo 8: De novo olarak mTOR inhibitörü alan hastaların mTOR inhibitörü kullanım süresi……….17 Tablo 9. De novo olarak mTOR inhibitörü başlanan hastalarda mTOR inhibitörü ile ilişkili
olabilecek yan
etkiler……….18
Tablo 10. De novo olarak mTOR inhibitörü başlanan hastaların izlemlerine ait veriler……..19
Tablo 11. Dönüşüm sonrası mTOR inhibitörü kullanan hastalarının ve vericilerinin
demografik özellikleri ve indüksiyon
protokolleri………20
Tablo 12. mTOR inhibitörü başlanıp kesilen hastalarda, mTOR inhibitörü kesilme nedenleri………....21 Tablo 13. Dönüşüm sonrası mTOR inhibitörü kullanan hastalarının izlemlerine ait veriler…..22
IV KISALTMALAR DĠZĠNĠ
Kronik böbrek yetmezliği: KBY Glomerül filtrasyon hızı: GFH Son dönem böbrek yetmezliği: SDBY Kalsinörin inhibitörleri: KNİ
Mammalian target of rapamycin: mTOR Renal replasman tedavi: RRT
Hemodiyaliz: HD
Mikofenolat mofetil: MMF Mikofenolat sodyum: MPA Fosfotidilinozitol 3-kinaz: PI3K
Tuberoskleroz kompleksi 1 ve 2: TSC1 ve TSC2 Sitomegalovirüs: CMV
Anjiyotensin dönüĢtürücü enzim inhibitörü: ADEi Anjiyotensin reseptör blokeri: ARB
GecikmiĢ greft fonskiyonu: (GGF)
V ÖZET
Mammalian target of rapamycin (mTOR) inhibitörü kullanan renal transplantlı hastaların klinik ve laboratuvar verilerinin retrospektif olarak değerlendirilmesi
Kronik böbrek yetmezliği (KBY), çeşitli hastalıklar sebebiyle böbrek fonksiyonunda ve yapısında aylar veya seneler içerisinde kalıcı değişiklik meydana gelmesidir. Glomerül filtrasyon hızı (GFH) 15 mL/dk/1·73 m²‘nin altına indiğinde son dönem böbrek yetmezliği (SDBY) söz konusudur. SDBY olan hastalarda tedavi seçenekleri renal replasman (diyaliz veya renal trasnplantasyon) veya konservatif yaklaşımdır. Renal transplantasyon ile böbreğin tüm fonksiyonlarının işler hale geldiği için SDBY‘nin ideal tedavisidir. Renal transplantlı hastalar greft işlevselliğini sürdürdüğü müddetçe immünsüpresif tedavi almalıdır. İmmünsüpresif tedaviler çoğunlukla ilaç kombinasyonları şeklinde kullanılır. Bu kombinasyonlarda, kortikosteroidler, kalsinörin inhibitörleri (KNİ), antimetabolitler ve ―Mammalian target of rapamycin (mTOR)‖ proteini inhibitörleri kullanılır. Renal transplantlı hastalarda en sık kullanılan immünsüpresyon tedavi protokolü antimetabolit ajanlar ve kalsinörin inhibitörlerinin (KNİ) kombine olarak kullanılması şeklindedir. KNİ kullanımı ile uzun dönemde KNİ nefrotoksisitesi, kronik allograft nefropatisi ve greft kaybı görülebilmektedir. mTOR proteini, hücre içinde yer alan serin treonin kinazdır. Hücre büyümesi, metabolizması ve proliferasyonun temel düzenleyicilerinden birisi olarak tanımlanmıştır. mTOR inhibitörleri T hücre sinyal yolağını ve dolayısıyla antijen aracılı T hücre proliferasyonunu bloke ederek immünsüpresif etki gösterir. mTOR inhibitörleri özellikle nefrotoksik yan etkilerinin az olması nedeniyle, renal transplantlı hastalarda uzun dönem immünsüpresyonun sağlanması için kalsinörin inhibitörlerine alternatif olarak kullanılmaktadır. Bununla birlikte mTOR inhibitörlerinin kesildiği durumlar da azımsanmayacak düzeydedir ve bu yüzden renal transplantasyonda kullanımı yaygınlaşmamıştır. İlacın kesilme sebepleri arasında öncelikle olarak yan etkiler bulunmaktadır. Bu yan etkiler arasında kemik iliği baskılanması, mukozit, akne, proteinüri ve periferik ödem olarak sayılabilir. Bu çalışmada merkezimizde, izlemde kullanımına ara verilen veya tamamen kesilenler da dahil mTOR inhibitörü kullanan renal transplantlı hastaların klinik ve laboratuvar verileri değerlendirilmiştir.
VI ABSTRACT
Retrospective evaluation of clinical and laboratory data of renal transplant recipients using mammalian target of rapamycin (mTOR) therapy
Chronic kidney disease (CKD) is defined as irreversible alternations of function and structure of the kidney over months or years due to many diseases. A glomerular filtration rate (GFR) of less than 15 mL/min per 1·73m² is referred as end stage kidney disease (ESKD). Treatment options for patients with ESKD are kidney replacement therapy (dialysis or kidney transplantation) or conservative care. Kidney transplantation is the preferred treatment for ESKD because it is the closest thing to having normal kidneys. Patients with renal transplantation should receive immunosuppressive therapy as long as the graft function is maintained. Immunosupression is almost always includes a combination of drugs. In this combination, corticosteroids, calcineurin inhibitors (CNI), antimetabolites and mammalian target of rapamycin (mTOR) inhibitors are used. The most common immunosuppressive treatment protocol among renal transplant patients is the combination of antimetabolite agents and CNIs. Nephrotoxicity, chronic allograft nephropathy and graft loss may be seen with the long term use of CNI. Mammalian target of rapamycin (mTOR) is a protein serine/threonine kinase that plays a central role in the regulation of cell growth, metabolism and proliferation. mTOR inhibitors act as immunospressant by blocking the signaling pathway of T cell growth factors and thus inhibit the proliferation of antigen-activated T cells. mTOR inhibitors are used as an alternative to calcineurin inhibitors for long-term immunosuppression in renal transplant patients, especially because of their relative lack of nephrotoxicity. However, relatively high drug discontinuation rates have limited the more broad introduction of mTOR inhibitors in kidney transplantation. The primary reason for drop outs were side effects, such as bone marrow suppression, mucositis, acne, proteinurea and peripheral edema. In this study, we evaluated the clinical and laboratory data of renal transplant patients receiving mTOR inhibitors (including interruption and withdrawn) in our center.
1 1. GĠRĠġ VE AMAÇ
Kronik böbrek yetmezliği tanısı yapısal böbrek hasarının ve böbrek fonksiyonlarındaki azalmanın gösterilmesi ile konur. Glomerüler filtrasyon hızı 15 mL/dk/1·73 m²‘nin altına indiğinde son dönem böbrek yetmezliği (SDBY) söz konusudur. SDBY dünya çapında mortalite ve morbiditenin önde gelen sebeplerinden biridir. Hasta SDBY tanısı aldığında renal replasman tedaviler açısından bilgilendirilmeli ve uygun olan hastalar transplantasyon merkezlerine yönlendirilmelidir.
―Mammalian target of rapamycin (mTOR)‖ proteini hücre büyümesi, proliferasyon, hücresel metabolizma, otofaji ve anjiyogenez süreçleri için ana şalter olarak tanımlanmıştır. mTOR inhibitörlerinin antiproliferatif ve immünsüpresif etkinliğe sahip olması transplantasyon sonrası uzun dönem tedavide önem teşkil etmektedir.
Transplantasyon sonrası erken dönemde immünsüpresyon en üst seviyede tutulurken uzun dönem tedavide azaltılır. Renal transplantasyon sonrası idame immünsüpresyon tedavide çoğunlukla farklı mekanizmalarla etki eden ilaçların kombinasyonları kullanılır ve çeşitli tedavi protokolleri mevcuttur. Renal transplantlı hastalarda en sık kullanılan idame immünsüpresyon tedavi protokolü antiproliferatif ajanlar ve kalsinörin inhibitörlerinin (KNİ) kombinasyonudur. Başlangıç idame tedavide mTOR inhibitörleri rutin olarak kullanılmamaktadır (1). mTOR inhibitörleri 1990‘ların sonunda renal transplantasyonda kullanılmaya başlanmış olmakla beraber bu süre içerisinde kullanım oranları yaygınlaşmamıştır. Halen tüm dünyada kullanım oranı %10-15 civarı seyretmektedir (2). Kalsinörin inhibitörüne bağlı toksisite gelişmesi, izlemde malignite saptanması veya hastanın mevcut tedaviye uyumsuzluğu gibi durumlarda mTOR inhibitörü ilaçlar immünsüpresif tedavi kombinasyonuna eklenmektedir (3).
Ege Üniversitesi Nefroloji Organ Nakli Polikliniği‘nde yaklaşık 1200 renal transplantlı hasta takip edilmektedir. Çalışmamızda Ocak 1990 ile Aralık 2017 tarihleri arasında böbrek nakli yapılan ve Nefroloji Organ Nakli Polikliniği‘nde takiplerine devam edilen hastaların dosyaları geriye dönük olarak taranmış ve mTOR inhibitörü kullanan hastaların verileri incelenmiştir. .Bu çalışmanın amacı merkezimizde, izlemde kullanımına ara verilen veya tamamen kesilenler da dahil mTOR inhibitörü kullanan renal transplantlı hastaların laboratuvar ve klinik verilerini inceleyerek mTOR inhibitörü ve diğer ilaçların kombinasyonlarını, mTOR inhibitörü kullanım sıklığını, mTOR inhibitörü kullanımına bağlı yan etkileri, bu süreçte gerçekleşen rejeksiyon oranlarını belirlemektir.
2 2.GENEL BĠLGĠLER
2.1 Kronik böbrek yetmezliği
Kronik böbrek yetmezliği (KBY), çeşitli hastalıklar sebebiyle böbrek fonksiyonunda ve yapısında aylar veya seneler içerisinde kalıcı değişiklik meydana gelmesidir. KBY tanısı yapısal böbrek hasarının ve böbrek fonksiyonlarındaki azalmanın gösterilmesi ile konur. Böbrek fonksiyonunun ölçümünde glomerüler filtrasyon hızı (GFH) kullanılmaktadır, GFH ile nefronlardan birim zamanda filtre edilen sıvının miktarı ölçülmektedir.
KBY tanımı ve sınıflandırması seneler içerisinde değişmiştir. Güncel kılavuzlarda KBY tanımı, altta yatan sebep ne olursa olsun en az 3 aylık bir süre zarfında GFH‘nin 60 mL/dk/1·73 m²‘nin altında seyretmesi veya böbrek hasarına dair belirteçlerin olması veya her iki durumun birlikte görülmesidir. Kidney Disease Improving Global Outcomes (KDIGO) kılavuzuna göre KBY kriterleri, KBY‘de GFH ve albüminüri kategorileri sırasıyla Tablo 1, Tablo 2 ve Tablo 3‘te sunulmuştur (4).
Tablo 1. KDIGO kılavuzuna göre kronik böbrek hastalığı kriterleri. Böbrek hasarı
belirteçleri
Albüminüri (>30 mg/24 saat; Albümin/kreatinin >30 mg/g [>3 mg/mmol])
Üriner sediment anormallikleri
Tübüler hasara bağlı elektrolit imbalansı ve diğer bozukluklar Histolojik olarak tespit edilen anomaliler
Görüntüleme yöntemleri ile tespit edilen yapısal anomalileri Böbrek transplantasyonu öyküsü
GFH <60 mL/dk/1·73 m²
Tablo 2. KDIGO kılavuzuna göre kronik böbrek hastalığında GFH kategorileri. GFR kategorisi GFR (mL/dk/1·73 m²) Tanım
G1 >90 Normal
G2 60-89 Hafifçe azalmış
G3a 45-59 Hafif-orta derecede azalmış
G3b 30-44 Orta-ağır derecede azalmış
G4 15-29 Ağır derecede azalmış
3 Tablo 3. KDIGO kılavuzuna göre kronik böbrek hastalığında albüminüri kategorileri Kategori Albümin ekskresyon hızı (mg/24
saat) Albümin/kreatinin(mg/gr) Tanım A1 <30 <30 Normal A2 30-300 30-300 Orta derecede Artmış A3 >300 >300 Ağır derecede Artmış
KBY‘nin sınıflandırılması prognozun, komplikasyon olasılığının belirlenmesi ve hasta yönetimi açısından önem teşkil etmektedir. Bu sebeple her hastada GFH hesaplanmalı ve GFH‘deki düşüş hızı yakından takip edilmelidir. KBY hastalarında anemi, asidoz, kemik ve mineral hastalıkları, ilaç toksisitesi, kardiyovasküler hastalıklara yatkınlığın artması gibi komplikasyonların görülme sıklığı artmıştır ve bunlar her evrede görülebilir.
GFH‘deki düşüşte hızlanma görüldüğünde yeni eklenen hipopotasemi, hiperkalsemi gibi elektrolit imbalansları, nefrotoksik ajan maruziyeti, eşlik eden konjestif kalp yetmezliği, renal arter stenozu, üriner sistem enfeksiyonu gibi hastalıkları ve kontrolsüz hipertansiyon gibi faktörler araştırılmalıdır.
KBY tanısı konulan hastalarda altta yatan hastalığın teşhisi ve tedavisi, progresyonun hızının yavaşlatılması açısından önemlidir. Bununla birlikte hastaların bir kısmı üremik tablo ile hastaneye başvurmakta ve etiyoloji saptanamamaktadır.
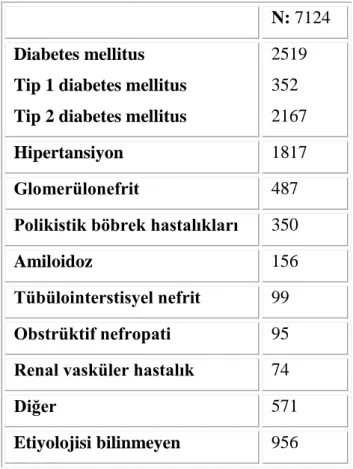
KBY‘ye yol açan hastalıkların dağılımı ülkeden ülkeye farklılık göstermektedir. Diyabet ve hipertansiyon yüksek gelirli ve orta gelirli ülkelerde ve birçok düşük gelirli ülkede KBY etiyolojisinde en sık neden olarak yer almaktadır. Asya, Hindistan ve Sahra-altı Afrika‘da altta yatan hastalığın bulunamaması sık görülen bir durumdur, bunun yanı sıra glomerulnefrit de önemli bir sebep olarak yer almaktadır. Bitkisel ürünler Asya ve Afrika‘da kırsal kesimde yaygındır, yüksek gelirli ülkelerde de kullanıma girmiştir. Bu sebeple bitkisel ürünlerin nefrotoksisiteye yol açma sıklığı artmaktadır. Hepatit B, Hepatit C, HIV enfeksiyonu da KBY nedenleri arasında yer almaktadır (5). Türk Nefroloji Derneği‘nin 2016 tarihli raporunda hemodiyaliz ve periton diyaliz programında olan hastaların verileri incelendiğinde diyabet, hipertansiyon, glomerulonefrit ve polikistik böbrek hastalıkları ilk sıralarda yer almaktadır (6). Bu veriler Tablo 4 ve Tablo 5‘te sunulmuştur.
4 Tablo 4. 2016 yılı sonu itibarıyla prevalan hemodiyaliz hastalarının etiyolojik nedenlere göre dağılımı (73 merkezden elde edilen verilere göre).
N: 7124 Diabetes mellitus
Tip 1 diabetes mellitus Tip 2 diabetes mellitus
2519 352 2167
Hipertansiyon 1817
Glomerülonefrit 487
Polikistik böbrek hastalıkları 350
Amiloidoz 156
Tübülointerstisyel nefrit 99
Obstrüktif nefropati 95
Renal vasküler hastalık 74
Diğer 571
Etiyolojisi bilinmeyen 956
Tablo 5: 2016 yılı sonu itibariyle prevalan periton diyalizi hastalarının etiyolojik nedenlere göre dağılımı (27 merkezden elde edilen verilere göre).
N: 919
Hipertansiyon 319
Diabetes mellitus Tip 1 diabetes mellitus Tip 2 diabetes mellitus
200 70 130
Glomerülonefrit 110
Polikistik böbrek hastalıkları 53 Tübülointerstisyel nefrit 17
Amiloidoz 20
Obstrüktif nefropati 19 Renal vasküler hastalık 10
5
Diğer 71
Etiyolojisi bilinmeyen 100
GFH 30 mL/dk/1·73 m² olduğunda hasta nefroloji uzmanına yönlendirilmelidir. Bu şekilde hastaya uygun renal replasman tedavisi planlanması için zaman kazanılır.
2.1.1 Son dönem böbrek yetmezliği tedavisi
GFH 15 mL/dk/1·73 m²‘nin altına indiğinde son dönem böbrek yetmezliği (SDBY) söz konusudur. SDBY dünya çapında mortalite ve morbiditenin önde gelen sebeplerinden biridir. Tedavi seçenekleri renal replasman veya konservatif yaklaşımdır. Tedaviye dirençli hiperkalemi ve asidoz gibi sıvı elektrolit bozuklukları veya üremik semptomlar mevcutsa renal replasman tedavi (RRT) başlanmalıdır. Ayrıca GFR 10 mL/dk/1·73 m²‘nin altında ise RRT gereksinimi vardır. RRT, hemodiyaliz (HD), periton diyalizi ve renal transplantasyondan oluşmaktadır. Hastanın renal replasmanı kabul etmemesi de bir seçenektir ve bu durumda semptomların tedavi edildiği ve palyatif bakımın sunulduğu konservatif yaklaşım devreye girer.
2.1.2. Hemodiyaliz
Hastadan alınan kanın ekstrakorporal dolaşıma alınması ve yarı geçirgen bir membranda dengeli bir sıvı ile karşılaştırılmasıyla yürütülen diffüzyon ve ultrafiltrasyon prensiplerine dayanan bir renal replasman tedavisidir. Tipik bir hemodiyaliz programı olarak haftada 3 gün diyaliz merkezinde 3 ila 4 saat şeklindedir. Haftada altı gün diyaliz merkezinde veya evde gece saatlerinde gerçekleştirilen hemodiyaliz programı da uygulanmaktadır. Sık gerçekleştirilen hemodiyaliz ile kan basıncı regülasynunda, sol ventrikül hipertrofisinin gerilemesinde iyi sonuçlar alınmış ve hastaların hayat kalitelerinde iyileşme olduğu görülmüştür fakat mortalitede azalma saptanmamıştır (7; 8).
Volüm fazlasının ve küçük molekül ağırlıklı toksinlerin uzaklaştırılmasında hemodiyaliz daha etkilidir. Hemodiyaliz esnasında görülebilecek komplikasyonlar hipotansiyon, bulantı kusma, kas krampları, filtre pıhtılaşması, kanama, enfeksiyon, hava embolisi ve metabolik sorunlardır.
2.1.3. Periton diyalizi
Periton kateteri ile periton boşluğuna verilen 1,5 ila 3 litre diyaliz solüsyonunun dengeleme süresinden sonra yenisi ile değiştirilmesi işlemidir. Diffüzyon, ultrafiltrasyon ve
6 absorbsiyon prensiplerine dayanır. Filtre olarak periton membranı kullanılır. Kapillerlerdeki kan ve diyalizat arasındaki konsantrasyon farkı ile diffüzyon meydana gelir. Hipertonik solüsyonlar periton boşluğuna ultrafiltrasyona yol açar. Lenfatik sisteme su ve solüt transportu ile absorbsiyon gerçekleşir. Hastanın ev ortamında kendisinin diyalizi uygulayabilmesi, antikoagulasyonun kullanılmaması, ultrafiltrasyonun yavaş olması ve buna bağlı olarak hipotansiyonun daha az görülmesi nedeniyle uygun hastalarda tercih edilebilir. Özellikle eşlik eden kalp kapak hastalığı, kalp yetmezliği varlığında, arteriovenöz füstül açılamaması gibi vasküler sorun yaşanan ve hemodiyaliz merkezine erişimde sorun yaşayan hastalar periton diyalizi açısından değerlendirilmelidir. Periton diyalizinin dezavantajları enfeksiyon riskinde artış olması, diyafram hareketlerinin kısıtlanması nedeniyle akciğer ve kalp fonksiyonlarında bozulma ve solüt yükünün yeterli temizlenememesidir.
2.1.4. Renal trasnplantasyon
Böbreğin tüm fonksiyonlarının işler hale geldiği için SDBY‘nin ideal tedavisidir. SDBY hastalarının hepsi renal transplantasyon ile ilgili bilgilendirilmeli, hastalar transplantasyon merkezlerine yönlendirilmeli ve varsa canlı vericiler belirlenmelidir.
Dünya üzerinde renal replasman tedavisi alan hasta sayısının 2030‘da 5439 milyona ulaşması beklenmektedir. SDBY prevalansında artış beklenmesi nedeniyle son dönem böbrek yetmezliğine gidişatın önlenmesi yönünde çalışılmalı ve erken teşhis yöntemleri geliştirilmelidir (9). Diyaliz tekniklerden birinin seçimi için hastanın diyalize girme endikasyonu (solüt yükün/volüm yükünün veya her ikisinin de uzaklaştırılması), hemodinamik durumu, hastanın seçimi ve becerisi (Evde diyaliz için) gibi birçok faktör gözden geçirilmelidir. KBY‘de renal replasman tedavisine başlanması açısından net bir zaman bulunmamaktadır. Hemodiyalize erken başlama ile renal trasnplantasyonun erken dönemde yapılması sağ kalım açısından avantaj teşkil etmemektedir (10).
SDBY evresine gelen hastaların çoğu hemodiyaliz veya periton diyalizi ile izlenmektedir. Ülkemizde 2016 yılı sonu itibarıyla kronik hemodiyaliz/periton diyalizi programında olan veya fonksiyonel greftle izlenmekte olan tüm hastaların (çocuk hastalar dahil) RRT tipine göre dağılımı; hemodiyaliz 56.687 (%76.12), periton diyalizi 3.508 (%4.72), transplantasyon 14.280 (%19.17) şeklindedir (6). Yeterli diyaliz ile üremik semptomlar önlenir ve hastanın hayat kalitesinin mümkün mertebe iyi olması sağlanır fakat diyaliz ile böbrek fonksiyonlarının tamamı sağlanamamaktadır. Ayrıca kronik diyaliz programında olan hastaların mortalite ve morbidite oranları toplum geneline göre artmıştır (11). Diyalize alınan hastalar ile renal transplantasyon yapılan hastaların karşılaştırıldığı 100
7 kohort çalışmayı içeren bir derlemede renal trasnplantlı hastalarda mortalite ve kardiyovasküler olayların azaldığı, yaşam kalitelerinde artış olduğu saptanmıştır (12).
2.1.5. Renal transplantasyon prensipleri
SDBY hastalarında çoğu zaman komorbid hastalıklar mevcuttur. Postoperatif dönemi ve sağ kalımı etkileyeceği için bu açıdan dikkatli bir şekilde değerlendirilme yapılmalıdır.
Transplantasyon adaylarını değerlendirmek için birçok merkez tarafından yayınlanmış çeşitli kılavuzlar mevcuttur (13; 14; 15). Hastalar mutlak ve göreceli kontrendikasyonlar açısından değerlendirilmelidir. Mutlak kontrendikasyonlar, hastada aktif malignite, aktif enfeksiyon, madde bağımlılığı olması, tedavi ile kontrol altına alınamayan psikiyatrik tanısı olması, transplantasyon sonrası yaşam süresi beklentisinin az olması (Bu süre merkezden merkeze değişmektedir), böbrek hastalığının geri dönüşümlü olması ve hastanın transplantasyon sonrasında tedaviye uyum sağlayamayacak olmasıdır. Göreceli kontrendikasyon olarak ise kardiyovasküler, gastrointestinal, serebrovasküler, periferik vasküler hastalıklar gibi komborbiditeler sayılabilir, bu durumların varlığında hastalar iyi değerlendirilmeli ve yakından gözlenmelidir. Transplantasyon için kontrendikasyon saptanmayan hastalar GFH 30 mL/dk/1·73 m²^nin altına indiğinde transplantasyon programına yönlendirilmelidir.
Transplantasyonun hangi aşamada yapılacağına dair kesin bir zaman dilimi belirlenmemiştir. Cerrahi tekniklerin ilerlemesi ve immünsüpresif tedavilerin daha etkin hale gelmesiyle renal transplantasyon başarısı seneler içerisinde artmıştır.
2.1.6. Ġmmünsüpresif tedaviler ve yan etkileri
Renal trasnplantlı hastalar, greft işlevselliğini sürdürdüğü müddetçe immünsüpresif tedavi almalıdır. Transplantasyon sonrası erken dönemde immünsüpresyon en üst seviyede tutulurken uzun dönem tedavide azaltılır. Renal transplantasyonun ilk gerçekleştirildiği 1950‘li yıllarda immünsüpresyon tüm vücut radyasyonu ile yapılmaktayken, özellikle son 20 yılda immünsüpresyon tedavisine yeni ajanların katılmasıyla oldukça yol kat edilmiştir. 1980‘li yıllarda siklosporinin tedaviye eklenmesiyle akut rejeksiyon oranları düşürülmüş, 1990‘lı yıllarda yeni ajanların eklenmesiyle ve tedavi protokollerinin yenilenmesiyle akut rejeksiyon görülme sıklığı daha da azalmıştır.
İmmünsüpresif ilaçlar immün sistemin farklı bölümlerini hedef alır. İmmünsüpresyon aşamaları indüksiyon, idame ve anti-rejeksiyon tedavilerden oluşur
8 Ġndüksiyon tedavisi: Amaç ilk haftalarda ve sonraki aylarda gelişebilecek akut rejeksiyonu önlemektir. Transplantasyon sonrası ilk hafta içerisinde uygulanır. Akut rejeksiyon riski indüksiyon fazında en fazladır, idame tedaviye geçtikten sonra bu risk git gide azalır.
Poliklonal antikorlar: Anti-timosit globülin, anti-lenfosit globülin. İnfüzyon reaksiyonu, lökopeni, trombositopeni görülebilir.
Monoklonal antikorlar: Basiliksimab (anti-CD25), daklizumab (anti-CD25), alemtuzumab (anti-CD52), muromonab (OKT3). Nadiren infüzyon reaksiyonu görülebilir.
Kortikosteroidler: Metilprednizolon, prednizon. Hipertansiyon, hiperlipidemi, osteoporoz, diyabetes mellitus, aseptik nekroz gibi yan etkileri mevcuttur.
Ġdame tedavi: Allograft işlev göstermeye devam ettiği müddetçe her gün düzenli kullanılması gereken ilaçlardır.
Kalsinörin inhibitörleri: Takrolimus, siklosporin. Nefrotoksisite, diyabetes mellitus, hipertansiyon, kıllanma, gingival hipertrofi, hiperlipidemi, hepatotoksisite görülebilir.
mTOR inhibitrleri: Sirolimus, everolimus. Proteinüri, hiperlipidemi, lökopeni, trombositopeni, diyare görülebilir.
Anti-proliferatif ilaçlar: Mkofenolik asit türevleri (Mikofenolat mofetil; MMF, mikofenolat sodyum; MPA), azatiyoprin. Mikofenolik asidin en sık görülen yan etkileri anemi, lökopeni, trombositopeni ve diyaredir. Azatiyoprine bağlı olarak da anemi, lökopeni, trombositopeni görülebilir.
Kortikosteroidler: Metilprednizolon, prednizon.
Anti-rejeksiyon tedavisi: Akut hücresel rejeksiyonda CD8 ve CD4 hücreler görev alır. Tedavisinde yüksek doz intravenöz metilprednizolon ve poliklonal antikorlar kullanılır. Akut humoral rejeksiyon antikor aracılı gerçekleşir. Tedavisinde plazmaferez, intravenöz immünglobulin, rituksimab (anti-CD20 monoklonal antikor), ekulizumab (anti-CD5 monoklonal antikor), bortezonib (proteazom inhibitörü) kullanılır.
İdame immünsüpresyon tedavide çoğunlukla farklı mekanizmalarla etki eden ilaçların kombinasyonları, bu kombinasyonlarda kortikosteroidler, kalsinörin inhibitörleri (KNİ), antimetabolitler ve mTOR inhibitörleri kullanılır. Renal transplantlı hastalarda en sık kullanılan idame immünsüpresyon tedavi protokolü antiproliferatif ajanlar ve kalsinörin inhibitörlerinin (KNİ) kombinasyonudur. Başlangıç idame tedavide mTOR inhibitörleri rutin olarak kullanılmamaktadır (1). Kalsinörin inhibitörüne bağlı toksisite gelişmesi, malignite
9 saptanması veya hastanın mevcut tedaviye uyumsuzluğu gibi durumlarda mTOR inhibitörü ilaçlar kombinasyona eklenmektedir (16).
2.2 mTOR inhibitörleri 2.2.1. mTOR sinyal yolağı
mTOR, hücre bölünmesinde görevli fosfotidilinozitol 3-kinaz (PI3K) ailesinde yer almaktadır. Hücre içinde yer alan, treonin ve serin rezidülerini fosforilleyen bir protein kinazdır, Gen transkripsiyonu ve protein sentezinde görev alan mTOR, hücresel anabolik ve katabolik süreçlerin ana şalteri olarak tanımlanmıştır. Büyüme faktörleri, hücrenin enerji düzeyi, hücresel stres, aminoa asitler gibi çeşitli nütrisyonel ve çevresel faktörler ile etkileşim içindedir Ortamdaki mitojen, enerji ve nütrisyon düzeylerini algılar ve hücre büyümesi, metabolizması ve proliferasyonunu düzenler. On yılı aşkın süredir yapılan çalışmalarda mTOR yolağının tümör oluşumu, anjiyogenez, insülin direnci, adipogenez ve T lenfosit aktivasyonu gibi birçok hücresel olayda aktive olduğu, kanser ve tip 2 diyabetes mellitus gibi hastalıklarda ise regülasyonunun bozulduğu gösterilmiştir (17).
mTOR iki farklı multi protein kompleksinin katalitik alt ünitesidir; mTOR kompleks 1 ve mTOR kompleks 2 (18). mTOR kompleks 1 P13K/AKT yolağının major komponentidir. (19). Büyüme faktörleri gibi çeşitli reseptör kinazlar, sitokinler ve diğer kostimulatör sinyaller ile aktive olan P13K, Akt‘yi fosforilleyerek aktive eder. Akt, PTEN tarafından defosforile edilerek inaktive olur. Aktif Akt, tuberoskleroz kompleksini (TSC1/TSC2) inhibe eder. TSC1/TSC2 ras homoloğu Rheb‘i inhibe etmektedir. Dolayısıyla TSC1/TSC2‘nin inhibitör etkisi ortadan kalktığında sinyal yolağı Rheb‘in mTOR‘u aktive etmesi yönünde ilerler. Stres ve hipoksi varlığında da TSC1/TSC2 stimulasyonu sonucu mTOR yolağı inhibe olur. Nütrisyonlar sinyal yolağını Rheb üzerinden aktive eder. Aktifleşen mTOR kompleks 1 birçok biyolojik olaya aracılık eder. Örneğin p70-S6 kinazı ve ökaryotik başlatıcı faktör 4E bağlayıcı proteini fosforilleyerek mRNA translasyonu, ribozom biyogenezi, transkripsiyonun aktivasyonu ve lipit sentezi gibi süreçleri indükler. Atg13 ve ULK1 üzerinden otofajiyi baskılayarak katabolik süreçleri kısıtlar (20).
mTOR kompleks 2 de PI3/AKT yolağında görev alır fakat mTOR kompleks 1‘den bağımsız olarak işlev görmektedir. mTOR kompleks 2, Akt akitvasyonunu stimüle eder. Hücre sağ kalımında ve aktin hücre iskeletini düzenlemede görev alır (21).
mTOR kompleks 1 rapamisin ve analogları tarafından tamamen inhibe olurken, mTOR kompleks 2‘nin inhibisyonu daha uzun bir süre gerektirir (22).
10 2.2.2. Sirolimus ve Everolimus
Sirolimus (Rapamisin, SRL) ilk olarak Rapa Nuia adasında Streptomyces hygroscopicus türü bir bakteriden izole edilmiştir. Lipofilik mikrosiklik bir laktondur. FK bağlayıcı protein 12‘ye bağlanır. Oluşan SRL-FKBP-12 kompleksi mTOR‘u hedef alır ve mTOR ilişkili sinyal yolaklarını inhibe eder. Sitokinler ve mitojenlere cevaben gelişen DNA ve protein sentezini inhibe eder. Lenfositlerin progresyonunu G1 fazından S fazına geçişte durdurur. Böylece IL-2 başta olmak üzere sitokin aracılı gelişen T lenfosit proliferasyonunu inhibe ederek allograft rejeksiyonu engeller (23). Bunun yanı sıra büyüme faktörleriyle ilişkili yanıtı inhibe ettiği için fibroblast, endotelyal hücre, hepatosit ve düz kas hücre proliferasyonunu da bozar (24). Vasküler düz kas hücrelerinin proliferasyonunu ve neointmial hiperplaziyi inhibe ederek kronik allogreft disfonksiyon gelişimini engellediği düşünülmektedir (25).
Everolimus, sirolimusun ikinci jenerasyon türevidir. Sirolimus ile karşılaştırıldığında oral biyoyararlanımı daha fazladır ve metabolik olarak daha stabildir (26). Everolimusun bir diğer özelliği yarılanma ömrünün siroliumus ile karşılaştırıldığında daha kısa olmasıdır. Sirolimus ile benzer şekilde FKBP-12 ile kompleks oluşturur, büyüme faktörleri ile ilişkili hücre proliferasyonunu inhibe eder. Ayrıca in vitro ve in vivo olarak posttransplantasyon lenfoprolifetarif hastalığın önlenmesi ve tedavisinde etkili olduğu gösterilmiştir (27). Affinitesi sirolimusa göre daha düşüktür. Everolimus renal transplantasyonda sirolimustan daha yaygın olarak kullanılmaktadır. Her iki ilaç da karaciğerde CYP3A4, CYP3A5 ve CYP2C8 ile metabolize olur ve barsak lümeninden p-glikoprotein ile taşınır.
Sonuç olarak mTOR inhibitörleri antijen ile aktive olan T hücrelerinin sinyal yolağını bloke eder. Ayrıca vasküler düz kas ve kanser hücrelerinin proliferasyonunu da inhibe eder. mTOR inhibitörlerinin arteriyel damar yapılarında gösterdiği antiproliferatif etkinlik ile aterojenik remodelling ve neointima oluşumunu da inhibe ettiği preklinik çalışmalarda gösterilmiştir (28; 29). Malign tümörlerin oluşumunu bloke eden sinyal yolaklarında rol aldıkları, antianjiyogenik oldukları ve apoptozisi destekledikleri için antineoplasitk özellikleri bulunmaktadır (30; 31). mTOR inhibitörlerinin antiproliferatif ve immünsüpresif dual bir etkinliğe sahip olması transplantasyon sonrası uzun dönem tedavide önem teşkil etmektedir.
11 mTOR inhibitörlerinin transplantasyon ve diğer endikasyonlar ile kullanımı arttıkça çeşitli yan etkiler bildirilmiştir. Bu yan etkilerin çoğu doz bağımlı olup ilaç düzeyinin yakın olarak takip edilmesini gerektirirken bazı yan etkiler ortaya çıktığında ise ilacın kesilmesi gerekmektedir.
Dermatolojik yan etkiler
Stomatit: mTOR inhibitörünün doğrudan toksik etkisi nedeniyle gelişen stomatit çevresi eritematöz sınırlı, belirgin, ovoid şekilli yüzeyel ülserdir (32). Genellikle mTOR inhibitörü başlanmasının ardından ortalama 1 haftalık süre zarfında ortaya çıkmaktadır ve doz ile ilişkilidir (33). mTOR inhibitörü de novo olarak başlandığında ülser görülme oranı daha azdır. Bunun sebebi olarak da öncesinde KNİ ve kortikosteroid tedavisi verildiği durumlarda bu ilaçlara bağlı olarak mukozal frajilitenin artması gösterilmektedir (33).
Diğer kutanöz yan etkiler: Kaşıntı, raş, tırnak değişiklikleri, akne görülebilir (34). Hematolojik yan etkiler
Anemi: mTOR inhibitörü kullanımına bağlı gelişen anemi, mikrositer ve orta düzeydedir. Doz bağımlıdır ve tedaviye başlandığı ilk bir ay gibi erken evrede görülmektedir (35). Genellikle ilacı kesme nedeni olmamaktadır. Hastada anemi saptandığında mutlaka diğer sebepler de tetkik edilmelidir.
Trombositopeni ve lökopeni: mTOR inhibitörü kullanımına bağlı trombostiopeni ve lökopeninin özellikle mTOR inhibitörünün mikofenolik asit ile beraber kullanımında görüldüğü belirtilmiştir (36). KNİ ile karşılaştırıldığında mTOR inhibitörlerinin lökopeni ve trombositopeni yapma sıklığı daha fazladır (37). Bu tablo genellikle kendiliğinden gerilemektedir.
Metabolik yan etkiler
Hiperglisemi: Transplantasyon sonrasında görülen yeni başlangıçlı diyabetes mellitus kardiyovasküler olayları artıran önemli bir risk faktörüdür. Diyabetes mellitus gelişimi ile mTOR inhibitörü kullanımı arasındaki ilişki net olarak belirlenememiştir. Renal trasnplantlı hastalar ile yapılan bir çalışmada sirolimus kullanımının diyabetes mellitus gelişimi için bağımsız bir risk faktörü olduğu gösterilmiştir (38). Düşük doz siklosporin ve everolimus kombinasyonun kullanıldığı bir çalışmada ise diyabet insidansı düşük olarak saptanmıştır (39). Özellikle diyabet açısından başka risk faktörü de olan hastalar mTOR inhibitörü kullanırken yakından gözlenmelidir.
12 Hiperlipidemi: Dislipidemi renal transplantasyon sonrası görülebilen bir komplikasyon olup mTOR inhibitörü kullanımı eklendiğinde görülme sıklığı artabilmektedir. mTOR inhibitörleri lipoprotein lipaz aktivitesini inhibe etmekte ve apolipoprotein B-100 katabolizmasını azaltmaktadır. Bunlara bağlı olarak dislipidemi görülebilmekte ve mTOR inhibitörü kullanan hastalarda hiperlipidemi prevalansı %75‘i bulabilmektedir (40). Renal transplantasyonlu hastalarda bir sene içinde kardiyovasküler olay geçirme riski normal popülasyona göre 50 kat fazla olduğu için, kardiyovasküler riski artıran dislipidemi durumunun kontrolü önemlidir (41).
Renal yan etkiler
Proteinüri: mTOR inhibitörlerinin glomerüler geçirgenliği inhibe etme mekanizması net olarak bilinmemektedir. Renal transplantasyon sonrası idame tedavide sirolimus başlanan hastalarda proteinüri görülebilmektedir (42). KNİ kesilip sirolimus tedavisine geçilen hastalarda da proteinüri saptanmıştır. Tedavi değişimi sonrası masif proteinüri gelişmesi durumunda mTOR inhibitörü kesilip KNİ tekrar başlandığında proteinürinin düzeldiği ve hastaların çoğunda kalıcı renal hasar olmadığı gösterilmiştir (43).
Greft fonksiyounda gecikme: Renal trasnplantasyon sonrası ilk bir hafta içerisinde hemodiyaliz ihtiyacının olmasıdır. Kadaverik transplantasyon sonrası sık görülür. Yapılan birkaç çalışmada greft fonksiyonunda gecikmenin diğer immünsüpresif tedavi protokolleri ile karşılaştırıldığında sirolimus kullanımı ile daha sık görüldüğü saptanmıştır (44; 45). Yapılan bir çalışmada ise gecikmiş greft fonksiyonu açısından riskli bir grup hastada, transplantasyon sonrasında başlanan veya sonradan tedaviye eklenen everolimus ile renal fonksiyonların iyi seyrettiği gözlenmiştir (46; 47). Hastalar renal trasnplantasyon öncesinde greft fonksiyonunda gecikme riski açısından değerlendirmeye alınmalıdır. İmmünolojik uyumsuzluk, ileri yaş, kilo, diyaliz öyküsü, hipotansiyon varlığı göz önünde bulundurularak yüksek riskli hastalarda erken dönemde sirolimus kullanımı ertelenebilir (48; 49).
Pulmoner yan etkiler
Pnömoni: Pnömoni ve interstisyel akciğer hastalığı mTOR inhibitörlerinin önemli komplikasyonlarından biri olmakla beraber onkolojik hasta grubunda daha sık görülmektedir. Solid organ transplantasyonu yapılan hastalarda pulmoner toksisite nadir olarak vaka raporu şeklinde bildirilmiştir (50; 51; 52). mTOR inhibitörü başlandıktan 2 ila 6 ay sonra görülebilmektedir (52). mTOR inhibitörü kullanımı ile ilişkili pnömoniden şüphelenildiğinde aynı tabloya yol açabilecek enfeksiyöz, otoimmün hastalıklar ve diğer akciğer hastalıkları dışlanmalıdır. Pulmoner yan etkilerin mekanizması net olarak bilinmemektedir, yan etkiler
13 doz bağımlıdır. Genellikle ilaç tamamen kesilmekle ve bunun sonucu tablo gerilemektedir (53). Bunun yanı sıra ilaç dozunun azaltıldığı hastalar ile yapılan bir çalışmada pulmoner yan etkilerin tamamen ortadan kalktığı görülmüştür (54).
Hipertansiyon
Hipertansiyonun saptanması, immünsüpresif tedavide ve renal fonksiyonlarda düşüş ile ilişkilidir. Bunun dışında antikor aracılı rejeksyon, renal arter stenozu, proteinüri, verici ve alıcının yaşı, cinsiyeti, greftin durumu, eşlik eden diyabet tanısı olması, transplantasyon öncesinde de hipertansiyon tanısının olması ve primer böbrek hastalığı da hipertansiyon görülme sıklığını etkilemektedir (55). KNİ sempatik sistem aktivasyonu yapması ve oksidatif stresi artırması nedeniyle hipertansiyona yol açabilmektedir. mTOR inhibitörleri ise lipid profili ve serotonin düzeyi üzerine etki ederek hipertansiyona yol açabilmektedir (56).
Yara iyileĢmesinde gecikme ve lenfödem
İnfeksiyon, yara yerinde açılma, lenfosel gibi cerrahi komplikasyonlar yara yeri iyileşmesini geciktirmektedir. mTOR inhibitörleri endotelyal hücreler ve fibroblastlar için gerekli olan sinyal yolaklarını bloke eder ve bu şekilde fibrozisi sınırlandırır (57). Ayrıca anjiyogenezin mediatörleri olan vasküler endotelyal büyüme faktörü ve nitrik oksidi inhibe eder (58). Lenfanjiyogenezi bozmak suretiyle lenfosel oluşumuna ve daha nadir olarak da lenfödeme yol açabilir (48). mTOR inhibitörlerinin diğer immünsüpresif ajanlarla karşılaştırıldığı çalışmalarda yükleme dozu ile verilen mTOR inhibitörü kullanımı ile lenfosel ve insizyonel herni sıklığının daha fazla olduğu saptanmıştır. mTOR inhibitörünün yükleme dozu olmadan verildiği tedavi protokolünün incelendiği bir derlemede ise diğer immünsüpresif ajanlar ve mTOR inhibitörleri arasında yara iyileşme komplikasyonları açısından fark saptanmamıştır (48; 57). mTOR inhibitörlerinin kullanımının transplantasyon sonrası yedi güne kadar ertelenmesi ve yükleme dozundan kaçınılması durumunda özellikle risk faktörü daha fazla olan obez ve diyabetik hastalarda yara yeri komplikasyonu ve lenfosel riskinin azaldığı gösterilmiştir (58).
Reprodüktif endokrin sistem üzerine etkileri
mTOR inhibitörü kullanımına bağlı olarak erkeklerde fertilitede azalma, seksüel hormon disfonksiyonu, ejeksiyon volümünde azalma, sperm sayısında azalma ve azospermi görülebildiği bildirilmiştir (59). Kadınlarda sirolimus kullanımı ile menstrüel siklus bozuklukları, sirolimus ve everolimus kullanımı ile over kisti görülebildiği bildirilmiştir (60; 61).
14 Enfeksiyon
Ciddi enfeksiyonlar mTOR inhibitörlerinin kesilmesine ve de ölüme yol açan en önemli sebeplerdendir (62). İntrasellüler bakterilerden korunmada önemli rolü olan sitokin inhibisyonunun enfeksiyon sürecine katkıda bulunduğu düşünülmektedir (63).
Literatürde mTOR inhibitörü kullanan hastalarda sitomegalovirüs (CMV) enfeksiyonu görülme sıklığının diğer immünsüpresif tedavi protokollerine göre daha düşük olduğu gösterilmiştir. Bunun sebebi mTOR inhibitörlerinin CMV replikasyonunu engellemesi olabilir (64).
Diğer yan etkiler
Diğer komplikasyonlar arasında diyare, kusma, anoreksi gibi gastrointestinal yan etkiler, halsizlik, tat almada bozulma, asteni sayılabilir. Bu semptomlar genelde ilaç dozunun düzenlenmesi ile gerilemektedir.
2.2.4. mTOR inhibitörlerinin renal transplantasyonda kullanımı
İmmünsüpresif tedavi seçeneklerinde seneler içerisinde görülen gelişmeler sayesinde renal trasnplantasyon sonrası kısa dönemde iyi sonuçlar alınmaktadır. Transplantasyon sonrası ilk yıl içerisinde görülen akut rejeksiyon oranları eski senelere kıyasla düşmüştür, hasta ve greft sağ kalım oranlarında artış izlenmiştir. En sık kullanılan kombinasyon olan KNİ ve MMF/MPA alan hastalarda ilk sene içerisindeki akut rejeksiyon görülme oranları %12‘ye kadar düşürülmüştür (65). Bununla birlikte uzun dönem sonuçlarında aynı derecede iyileşme görülmemiştir. Bunun en büyük sebeplerinden birisi KNİ kullanımına bağlı görülen nefrotoksisite ile ilişkili kronik allograft nefropatisidir. Transplantasyon sonrası KNİ kullanımını sınırlayan faktörlerden birisi de terapötik indekslerinin dar olmasıdır. Bu sebeple sinerjistik etki gösteren ilaçların kombinasyonu yapılmakta ve bu şekilde doz ve dolayısıyla toksisite riski azaltılabilmektedir.
Ayrıca transplantasyon sonrası izlemde kardiyovasküler olay, posttransplant malignite ve viral enfeksiyon insidansında artış gözlenmektedir. Bu etkilerin çoğu KNİ kullanımı veya KNİ ile MMF/MPA kombinasyonu ile ilişkilendirilmektedir.
mTOR inhibitörleri renal transplantasyonlu hastalarda ilk olarak sinerjistik etki nedeniyle siklosporin ve kortikosteroidler ile sadece kombinasyon halinde kullanılmıştır (66). KNİ dozunun azaltılarak yanına mTOR inhibitörü eklenmesi protokolü çok sayıda çalışmada uygulanmış olup etkin ve güvenli bir seçenek olarak görülmektedir. mTOR inhibitörlerinin
15 kullanımı ile kortikosteroid tedavinin erken kesilmesi ve bu şekilde kortikosteroid ilaçların yan etkilerinin azaltılması da mümkün olabilmektedir.
mTOR inhibitörlerinin kullanımı arttıkça yan etkileri ve bu yan etkilere bağlı olarak ilacın kesilme oranları artmıştır (67). Hematolojik yan etkiler, yara iyileşmesinde gecikme ve lenfosel daha sık görülebilmektedir.
KNİ kullanımı ile görülebilen nefrotoksisite malignite, hipertansiyon göz önünde bulundurulduğunda ardışık immünsüpresyon fikri ortaya konmuştur. Özellikle erken dönemde nefrotoksisite yan etkisinin az olması sebebiyle mTOR inhibitörleri KNİ yanına eklenmekte ve bu şekilde KNİ dozu daha düşük tutulabilmektedir Başlangıçta KNİ kullanılan ve sonrasında kesilerek mTOR inhibitörü içeren tedavi protokolüne geçilen tedavi yaklaşımı da uygulanmakta olup henüz uzun dönem etkileri saptanmamıştır. Transplantasyon sonrası dönemde KNİ kullanılmayan ve mTOR inhibitörlerinin yer aldığı tedavi protokolleri de son bir kaç yıldır kullanıma girmiştir. mTOR inhibitörlerinin solid organ transplantasyonunda kullanılmaya başlanmasının üzerinden yaklaşık 15 yıl geçmiş olup bu süreçte birçok tek merkezli, çok merkezli, uluslararası, retrospektif, randomize, kontrollü çalışmalar yapılmıştır. Bu çalışmalarda mTOR inhibitörlerinin etkinliklerine dair kanıtlar bulunsa da, mTOR inhibitörlerinin solid organ transplantasyonunda kullanım yerine dair bir fikir birliği bulunmamaktadır. mTOR inhibitörü kullanımı hasta bazında bireysel olarak değerlendirilmekte ve tedavi protokolündeki yeri klinisyenin seçimine göre şekillenmektedir (68).
3. GEREÇ VE YÖNTEM
Çalışmamızda Ocak 1990 ile Aralık 2017 tarihleri arasında böbrek nakli yapılan ve Nefroloji Organ Nakli Polikliniği‘nde takiplerine devam edilen hastaların dosyaları geriye dönük olarak taranmıştır. Renal transplantasyon yapılan hasta sayısı 2500‘ün üzerindedir. Bu hastalardan yaklaşık 1200 tanesi halen Nefroloji Organ Nakli Polikliniği‘nde takip edilmektedir. Tedavi protokollerine göre mTOR inhibitörü kullanan hastaların yaşı, cinsiyeti, transplantasyon tarihi, primer böbrek hastalığı, vericinin yaşı, cinsiyeti, renal transplantasyonun canlı vericiden veya kadaverik olduğu, soğuk iskemi süresi, mismatch sayısı, haploid uyumu, panel reaktif antijen düzeyi, nakil sonrası verilen indüksiyon tedavisi, immünsüpresif tedavi protokolü, de novo olarak mTOR inhibitörü kullanan hastaların nakil sonrası 1. ve 12. aylardaki ve son başvurusuna ait (takipte mTOR inhibitörü başlanan grup için dönüşüm öncesinde ve dönüşüm sonrası 12. ay ve son başvurusuna ait) hemogram, kreatinin, potasyum, lipit düzeyleri, vizit esnasında ölçülen tansiyon arteriyel değeri,
16 immünsüpresif ilaçlara bağlı gelişen yan etkiler, anjiyotensin dönüştürücü enzim inhibitörü veya anjiyotensin reseptör blokeri kullanıp kullanmadıkları, statin grubu ilaç kullanıp kullanmadıkları, akut ve kronik rejeksiyon sıklığı ve sağ kalım verileri incelenmiştir.
4. BULGULAR
mTOR inhibitörü kullanan hastalar, de novo olarak mTOR inhibitörü alan hasta grubu ve daha öncesinde KNİ alıp KNİ kesilerek mTOR inhibitörüne geçilen veya KNİ doz azaltılıp yanına mTOR inhibitörü eklenen olmak üzere iki grupta incelenmiştir.
De novo olarak mTOR inhibitörü alan 31 hastaya ait ortalama 67 aylık izlem sonuçları değerlendirilmiştir. 31 hastanın 11‘i kadın 20‘si erkekti, yaş ortalaması 49,5 (33-65), kilo ortalaması 68,6±12,4 kg (44-85), boy ortalaması 164,7±8,7 cm (149-180) olarak hesaplandı. 14 hastaya canlı vericiden renal transplantasyon yapılırken, kadaverik transplantasyon sayısı 17 idi. Renal transplantasyon esnasında soğuk iskemi süresi ortalama 17 saat olarak hesaplandı. Renal transplant vericilerinin 13‘ü kadın, 18‘i erkekti. Vericilerin yaş ortalaması 53,8 (24-74), boy ortalaması 164 cm (145-175), kilo ortalaması 68,8 kg (53-75) olarak hesaplandı.
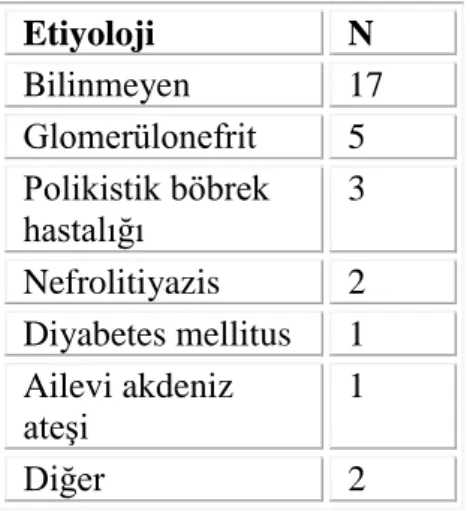
De novo olarak mTOR inhibitörü alan hastaların böbrek yetmezliği etiyolojilerine ait veriler tablo 6‘da verilmiştir.
Tablo 6. De novo olarak mTOR inhibitörü başlanan hastaların kronik böbrek yetmezliği etiyolojileri. Etiyoloji N Bilinmeyen 17 Glomerülonefrit 5 Polikistik böbrek hastalığı 3 Nefrolitiyazis 2 Diyabetes mellitus 1 Ailevi akdeniz ateşi 1 Diğer 2
Hastalara de novo olarak mTOR inhibitörü başlanma sebeplerine bakıldığında 11 hastada protokol gereği mTOR inhibitörü başlandığı görülürken, 11 hastada sıfırıncı saatte yapılan biyopside verici değişiklikleri izlenmesi, iki hastada vericide malignite olması, üç hastada alıcıda malignite olması, dört hastada diğer sebepler (Yaşlı verici, yavaş greft fonksiyonu) söz
17 konusuydu. De novo olarak mTOR inhibitörü alan hastaların transplantasyon sonrasında indüksiyon tedavileri ve gecikmiş greft fonksiyonu (GGF) sayıları tablo 7‘de verilmiştir.
Tablo 7: De novo olarak mTOR inhibitörü başlanan hastaların aldıkları indüksiyon tedaviler.
Ġndüksiyon ATG ATG doz
Basiliximab Daklizumab Ġndüksiyon yok GGF Varlığı Canlı (14) 6 700 7 - 1 - Kadavra (17) 14 1100 3 - - 17
De novo olarak mTOR inhibitörü alan hastalardan altı hastada ilk 12 aylık izlemde mTOR inhibitörü kesilmiştir. 67. Ay sonunda ise mTOR inhibitörü almaya devam eden hasta sayısı 18 olarak saptanmıştır. İlk 12 ayda mTOR inhibitörü kesilen hastalar değerlendirildiğinde bir kişi ani ölüm ile kaybedilmiştir. Bir hastada renal transplant sonrası 9. Ayda akut Budd-Chiari gelişmesi nedeniyle mTOR inhibitörü kesilmiştir. Transplantasyon sonrası 6.ayında bir hastada tedaviye dirençli lenfosel nedeniyle mTOR inhibitörü kesilmiş ve hasta opere edilmiştir. Bir hastada takibinin 100. Ayında kreatinin ve proteinüri progresyonu ile greft kaybı gelişmiş ve immünsüpresyonu kesilerek diyaliz tedavisine başlanmıştır. Bir hasta transplantasyon sonrası beşinci ayda ileus tablosu ile acil opere edilmiş ve takibinde mTOR inhibitörü kesilmiştir. Bir hastada transplantasyon sonrası beşinci yılında greft kaybı gelişmiş ve hemodiyaliz programına alınarak immünsüpresyon tedavisi kesilmiştir (Tablo 8). Tablo 8: De novo olarak mTOR inhibitörü alan hastaların mTOR inhibitörü kullanım süresi.
N 12. ayda mTOR inhibitörü almaya eden hasta sayısı 25 Son kontrolünde mTOR inhibitörü almaya devam
eden hasta sayısı
18 12. aydan önce mTOR inhibitörü kesilme sebepleri
Ani ölüm Lenfosel Budd-Chiari İleus Pulmoner emboli 1 2 1 1 1
Ortalama beş yılın üzerinde izlenmiş olan 31 hastada toplam 15 klinik ve subklinik akut rejeksiyon izlenmiştir. Tüm hastalara pulse metilprednizolon tedavisi uygulanmıştır. İki
18 hastada takipte tekrar akut rejeksiyon saptanması üzerine plazmeferez uygulanmış ve intravenöz immünglobülin tedavisi verilmiştir.
Takipte hastaların ortalama proteinüri düzeyinde istatistiksel olarak anlamlı olmasa da artış gözlenmiştir (p>0,05). 1. ayda ortalama proteinüri değeri 0.48 g/g Krea iken takip sonu 0.61 g/g Krea olarak saptanmıştır. Tansiyon arteriyel değerleri istatistiksel olarak anlamlı olmasa da artmıştır. Başlangıçta üç hasta anjiyotensin dönüştürücü enzim inhibitörü (ADEi) veya anjiyotensin reseptör blokeri (ARB) kullanırken izlem sürecinde gelişen proteinüri nedeniyle ADEi/ARB kullanan hasta sayısı dokuza çıkmıştır. Benzer şekilde total kolesterol, trigliserid, LDL düzeylerinde başlangıç değerlerinde göre anlamlı derecede artış gözlenmese de başlangıçta statin veya fenofibrat kullanan hasta sayısı üç iken bu sayı sekiz kişiye ulaşmıştır. Bu hastalarda statin/fibrat kullanımı ile hiperlipidemi tedavisi sağlanmış olup mTOR inhibitörü kesilmemiştir.
İzlemde dört hastada post transplantasyon diyabetes mellitus gelişmiş, bu hastaların ikisine bazal-bolus insülin tedavisi, ikisine oral antidiyabetik ilaç başlanmıştır. Bu hastalarda tedavi ile kan şekeri kontrolü sağlanmış olup mTOR inhibitörü kesilmemiştir.
Bir hastada akut koroner sendrom gelişmiş ve tedavi edilmiştir. mTOR inhibitörü kesilmemiştir.
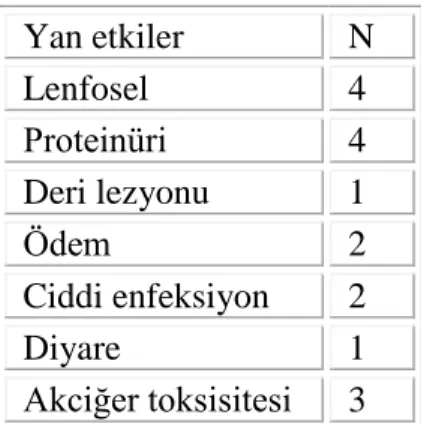
Takip süresince iki hastada malignite saptanmıştır. Bir hastada endometrium kanseri gelişmiştir. Bu hastada immünsüpresif dozu azaltılmıştır ancak mTOR inhibitörüne devam edilmiştir. Diğer hastada malign melanom saptanmış ve immünsüpresif tedavisine düşük doz kortikosteroid ve mTOR inihibitörü kombinasyonu ile devam edilmiştir. Bu hastalarda greft kaybı gelişmemiştir. mTOR inhibitörü kullanımına ilişkin diğer yan etkiler tablo 9‘da verilmiştir.
Tablo 9. De novo olarak mTOR inhibitörü başlanan hastalarda mTOR inhibitörü ile ilişkili olabilecek yan etkiler.
Yan etkiler N Lenfosel 4 Proteinüri 4 Deri lezyonu 1 Ödem 2 Ciddi enfeksiyon 2 Diyare 1 Akciğer toksisitesi 3
19 Hiperlipidemi 8
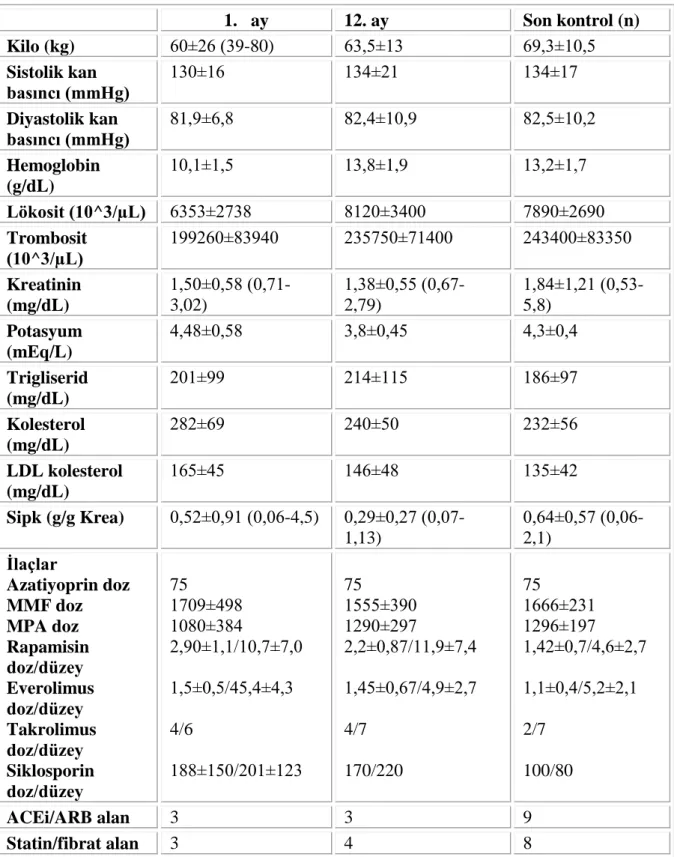
De novo olarak mTOR inhibitörü alan hastaların 67 aylık izlem verileri tablo 10‘da özetlenmiştir.
Tablo 10. De novo olarak mTOR inhibitörü başlanan hastaların izlemlerine ait veriler.
1. ay 12. ay Son kontrol (n) Kilo (kg) 60±26 (39-80) 63,5±13 69,3±10,5 Sistolik kan basıncı (mmHg) 130±16 134±21 134±17 Diyastolik kan basıncı (mmHg) 81,9±6,8 82,4±10,9 82,5±10,2 Hemoglobin (g/dL) 10,1±1,5 13,8±1,9 13,2±1,7 Lökosit (10^3/µL) 6353±2738 8120±3400 7890±2690 Trombosit (10^3/µL) 199260±83940 235750±71400 243400±83350 Kreatinin (mg/dL) 1,50±0,58 (0,71-3,02) 1,38±0,55 (0,67-2,79) 1,84±1,21 (0,53-5,8) Potasyum (mEq/L) 4,48±0,58 3,8±0,45 4,3±0,4 Trigliserid (mg/dL) 201±99 214±115 186±97 Kolesterol (mg/dL) 282±69 240±50 232±56 LDL kolesterol (mg/dL) 165±45 146±48 135±42 Sipk (g/g Krea) 0,52±0,91 (0,06-4,5) 0,29±0,27 (0,07-1,13) 0,64±0,57 (0,06-2,1) Ġlaçlar Azatiyoprin doz MMF doz MPA doz Rapamisin doz/düzey Everolimus doz/düzey Takrolimus doz/düzey Siklosporin doz/düzey 75 1709±498 1080±384 2,90±1,1/10,7±7,0 1,5±0,5/45,4±4,3 4/6 188±150/201±123 75 1555±390 1290±297 2,2±0,87/11,9±7,4 1,45±0,67/4,9±2,7 4/7 170/220 75 1666±231 1296±197 1,42±0,7/4,6±2,7 1,1±0,4/5,2±2,1 2/7 100/80 ACEi/ARB alan 3 3 9 Statin/fibrat alan 3 4 8
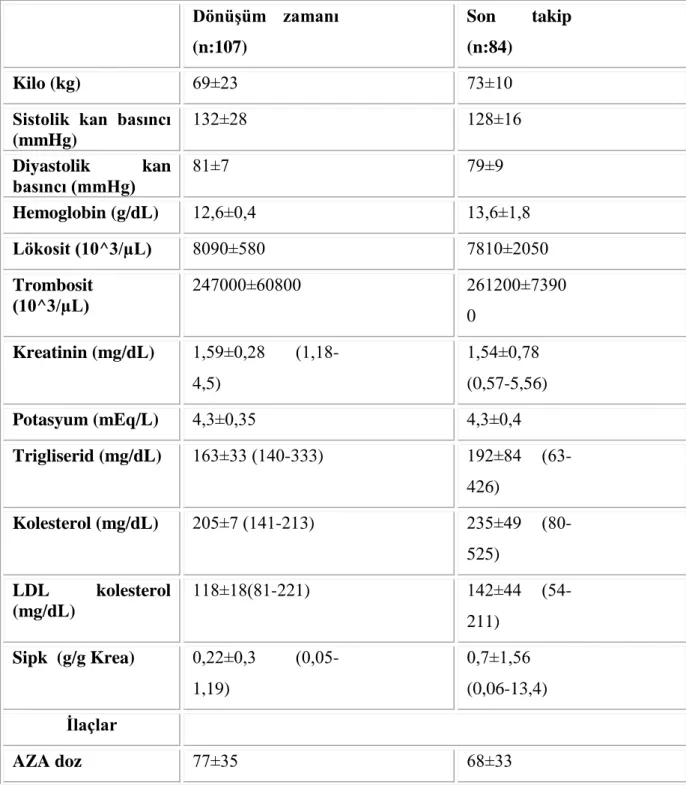
20 Başlangıçta mTOR inhibitörü almayan ancak sonra takipte immünsüpresif tedavisi mTOR inhibitörü olarak değiştirilen 107 hastanın verisi değerlendirilmiştir. Hastalarda nakilden sonra ortalama 117. ayda mTOR inhibitörüne dönüşüm yapılmıştır. Dönüşüm zamanı nakilden sonra 14 ay ve 11 yıl arasında değişmektedir. Bu hastalar dönüşümden sonra ortalama 68 ay (2-155) izlenmişlerdir. Dönüşüm yapılan 107 hastanın son kontrollerinde toplam 84 hasta halen mTOR inhibitörü almaya devam etmekte idi. Dönüşüm yapılan hastaların dönüşüm anındaki verileri aşağıdaki tablo 11‘de verilmiştir.
Tablo 11. Dönüşüm sonrası mTOR inhibitörü kullanan hastalarının ve vericilerinin demografik özellikleri ve indüksiyon protokolleri.
N YaĢ (Yıl) 41.6±7 Kilo (kg) 66,7±13 Boy (cm) 169±9 Canlı/kadavra 67/40 Verici yaĢ 65,5±13 (3-87) Verici kilo (kg) 75±14 Verici boy (cm) 170±11 Mismatch 2,9±1,3 Haplotip 0 1 2 63 36 8
PRA (n:53) Negatif Pozitif
Sınıf 1 48 5 (%44)
Sınıf 2 47 7 (42)
Ġndüksiyon
Yok 19
21 Dönüşüm yapılmadan önce hastalar kortikosteroid, antimetabolit (azatiyoprin, MMF/MPA) ve üçüncü ilaç olarak kalsinörin inhibitörü (siklosporin ya da takrolimus) almakta idiler. Dönüşüm nedenleri değerlendirildiğinde; yedi hastada verici değişiklikleri, 13 hastada protokol nedenli biyopsilerde intertisyel fibrozis ve tübüler atrofi bulgularının saptanması, 11 hastada kalsinörin toksisitesi ya da ilacı tolere edememe (kreatinin yüksekliği, potasyum yüksekliği, hipertansiyon, ellerde titreme gözlenmesi ya da biyopsi bulguları ile kalsinörin toksisitesi saptanması), 27 hastada malignite gelişimi (14 hastada deride skuamöz ve bazal hücreli kanser, üç hastada lenfoma, üç hastada meme kanseri, iki hastada over kanseri ve iki hastada prostat kanseri, üç hastada diğer kanserler), 13 hastada hirsutizm ve/veya gingival hiperplazi, iki hastada kontrolsüz diyabet gelişimi, dokuz hastada BK nefropati sonrası, 25 hastada ise verrü, viral hepatit, kondilom, trombotik mikroanjiopati gibi diğer nedenler saptanmıştır.
68 aylık takip sonunda 107 hastanın 84 tanesi mTOR inhibitörü almaya devam etmekte idi (11 hasta mTOR inhibitörü-KNݱsteroid, 73 hasta ise antimetabolit-mTOR inhibitörü± kortikosteroid). mTOR inhibitörü başlanıp tekrar kesilen 23 hastanın mTOR inhibitörü kesilme nedenleri aşağıdaki Tablo 12‘de verilmiştir.
Tablo 12. mTOR inhibitörü başlanıp kesilen hastalarda, mTOR inhibitörü kesilme nedenle ri. ATG dozu (616±41) Basiliksimab 16 Parametre N:23 Tromboz 2 Proteinüri ve ödem 10
Tedaviye dirençli yara ve tekrarlayan sellülit 2
Akciğer toksisitesi 1
Hiperlipidemi 4
22 mTOR inhibitörüne dönüşüm yapılmış olan hastaların 10 tanesinde dönüşüm öncesinde akut rejeksiyon atağı saptanmıştır. Bu hastalardan iki tanesinde mTOR inhibitörüne geçildikten sonra akut rejeksiyon atağı tekrarlamıştır. Daha öncesinde akut rejeksiyon atağı olmayıp mTOR inhibitörüne geçildikten sonra akut rejeksiyon atağı geçiren hasta sayısı ikidir.
Dönüşüm hastalarının dönüşüm zamanı ve 68 aylık ortalama izlem sonuçları tablo 13‘de özetlenmiştir.
Tablo 13. Dönüşüm sonrası mTOR inhibitörü kullanan hastalarının izlemlerine ait veriler. DönüĢüm zamanı
(n:107)
Son takip (n:84)
Kilo (kg) 69±23 73±10
Sistolik kan basıncı (mmHg) 132±28 128±16 Diyastolik kan basıncı (mmHg) 81±7 79±9 Hemoglobin (g/dL) 12,6±0,4 13,6±1,8 Lökosit (10^3/µL) 8090±580 7810±2050 Trombosit (10^3/µL) 247000±60800 261200±7390 0 Kreatinin (mg/dL) 1,59±0,28 (1,18-4,5) 1,54±0,78 (0,57-5,56) Potasyum (mEq/L) 4,3±0,35 4,3±0,4 Trigliserid (mg/dL) 163±33 (140-333) 192±84 (63-426) Kolesterol (mg/dL) 205±7 (141-213) 235±49 (80-525) LDL kolesterol (mg/dL) 118±18(81-221) 142±44 (54-211) Sipk (g/g Krea) 0,22±0,3 (0,05-1,19) 0,7±1,56 (0,06-13,4) Ġlaçlar AZA doz 77±35 68±33
23 MMF doz 1677±443 1500±470 MPA doz 1153±330 1100±354 Sirolimus doz/düzey - 1±0,3/6,8±3,2 Everolimus doz/düzey - 1,2±0,43/3,8± 1,9 Takrolimus doz/düzey 2,3±1,03/6,3±3,3 2,3±1/5,2±2,3 Siklosporin doz/düzey 193±65/203±77 110±51/52/38 ADEi/ARB alan 14 35 Statin/fibrat alan 13 24 5. TARTIġMA
Bu çalışmada renal transplantlı hastalarda de novo olarak ya da öncesinde başka bir immünsüpresif tedavi alıyorken tedavisi mTOR inhibitörü ile değiştirilen hastaların laboratuvar ve klinik özellikleri değerlendirilmiştir. Ocak 1990 ile Aralık 2017 tarihleri arasında renal transplantasyon yapılan ve mTOR inhibitörü kullanan hastaların verileri retrospektif olarak incelenmiştir.
Yapılan randomize çalışmalarda kısa dönem takip sonuçlarında, ister de novo kullanım olsun ister takip eden dönemde başlanmış olsun, beraberinde KNİ kullanımı olsun veya olmasın, mTOR inhibitörlerinin kullanımı ile rejeksiyon, hiperlipidemi, proteinüri ve yara iyileşmesinde gecikme olduğu gösterilmiştir. KNİ ile kıyaslandığında mTOR inhibitörü kullanımı ile CMV ve BK virüs sıklığının azaldığı rapor edilmiştir. mTOR inhibitörü kullanımı ile malign melanom dışı deri kanserleri ile deri dışı kanserlerin de azaldığı rapor edilmiştir (37; 69; 70). Ancak bir çalışmada sirolimus kullanımı ile takrolimus kıyaslandığında ölüm ve greft kaybının daha çok olduğu rapor edilmiştir (71). Ayrıca mTOR inhibitörü kullanım sıklığı tüm dünyada %5-10 arasında rapor edilmektedir. Ancak bazı merkezlerde ve bölgelerde kullanım sıklığı artmaktadır (2). Deri karsinomu sıklığının yüksek olması nedeniyle Avusturya‘da mTOR inhibitörü kullanım sıklığı dünya ortalamasının üzerine saptanmıştır (72).
mTOR inhibitörlerinin KNİ ve antimetabolitlere kıyasla daha az potent olduğu bu nedenle akut rejeksiyon ve buna bağlı greft kaybının daha sık olduğu düşüncesi nedeniyle teorik olarak daha az riskli olan, daha kısa hemodiyalize girmiş, vericisi ile akraba, genç
24 hastalarda ve PRA negatif olan hastalarda kullanılması mTOR inhibitörlerinin kullanımını sınırlamaktadır.
Bu çalışmada de novo olarak mTOR inhibitörü alan hastaların yaklaşık yarısı kadaverik nakil olup soğuk iskemi süresi ortalama 17 saattir. Kadaverik transplantasyon yapılan hastaların tümünde gecikmiş greft fonksiyonu nedeniyle transplantasyon sonrası hemodiyaliz ihtiyacı olmuştur. Mismatch ortalaması 3,5 olup hastaların 1/3‘ten azında 1 haplotip veya daha fazla uyum mevcuttu. PRA verilerine ulaşılabilen hastaların %75‘inden fazlasında PRA negatif saptanmıştır. Bu veriler değerlendirildiğinde bu hastaların rejeksiyon ve greft kaybı açısından çok riskli grupta olmadıkları görülmektedir. Dönüşüm yapılan hastaların da ortalama soğuk iskemi süreleri benzer olup ortalama mismatch sayıları 2,9‘dur. PRA pozitifliği de %25 civarındadır.
Son yıllarda mTOR inhibitörü içeren rejimler arasında KNİ, mTOR inhibitörü ve kortikosteroid kombinasyonu popüler iken, antimetabolit ve mTOR inhibitörü kombinasyonu da kullanılabilir. Bu idame protokollerin seçimi genellikle nakil yapılmış olan döneme, immünsüpresif tedavi seçeneklerine eklenen yeni ilaçların ülkemizde tanınmaya başlandığı 2000‘li yılların başı ile bu ilaçların kullanımının yaygınlaştığı 2010‘lu yıllarda yapılmış olmasına göre değişmektedir. Bizim takipli hastalarımızda ise de novo olarak mTOR inhibitörü alan hastalarda protokol gereği mTOR inhibitör ve antimetabolit kombinasyonu daha sık kullanılmıştır. Yapılan çalışmalarda de novo mTOR inhibitörü başlanan hastalarda ilacın kesilme oranı %13.5 ila %53 arası değişmektedir (65; 73). Bizim çalışmamızda ilacın kesilme oranı %38 olarak saptanmıştır. Dirençli hiperlipidemi, potasyum metabolizması bozuklukları ve buna bağlı ciddi aritmi, lenfosel, proteinüri, ödem, deri bulguları, yara iyileşmesinde gecikme en sık ilacı kesme nedenleri olarak rapor edilmiştir. Ayrıca ölümcül olabilecek akciğer komplikasyonları da bildirilmiştir (74).
Bu araştırmada de novo mTOR inhibitörü başlanan hastalardan bir hastada ani ölüm meydana gelmiştir. Greft fonksiyon bozukluğu olmayan bu hastada pulmoner emboli düşünülmüştür ancak tanı konulamamıştır.
De novo olarak mTOR inhibitörü kullanan diğer bir hastada greft fonksiyonları stabil seyrederken akut Budd-Chiari tablosu gelişmiştir. Kalıcı kateteri olan bu hasta trombofili açısından tetkik edilmiş ancak tromboza yatkınlık saptanmamıştır. Dönüşüm hastalarından ise birinde derin ven trombozu ve bir tanesinde pulmoner emboli saptanmıştır. Yapılan çalışmalarda rapamisinin TGF reseptörünü, ligandı TGFβ‘dan bağımsız olarak aktive ettiği, PAI-1 ekspresyonunu artırdığı ve tromboza yatkınlık yaratabileceği gösterilmiştir (75). Ayrıca
25 Musetti ve arkadaşlarının yaptığı çalışmada renal transplantlı hastalarda mTOR inhibitörü kullanımının trombotik olay yatkınlığını iki kat artırdığı gösterilmiştir (76).
Nakil hastaların cerrahi komplikasyonlar sık olarak görülebilir. Bunlardan sık karşılaşılan iki tanesi lenfosel oluşumu ve yara iyileşmesinde gecikmedir. Bu iki durum %15-32 sıklıkta rapor edilmektedir. Hastanın ek yandaş hastalıkları ve operasyonu yapan cerrahın tecrübesi de bu komplikasyon sıklığını etkilemekle beraber mikofenolat mofetil kullanımının da yara iyileşmesi, yara yerinin kapanmaması ve insizyonel herni sıklığının arttığı gösterilmiştir. Ancak mTOR inhibitörlerinin kullanımının başlaması ile bu komplikasyonlar artmıştır (77; 78). Kullanılan immünsüpresyon protokol kombinasyonlarının da lenfosel ve yara iyileşmesi üzerine olumsuz etkileri olabileceği rapor edilmiştir. ORION çalışmasında mTOR inhibitörü ve MPA kombinasyonu kullanılan kolunda, mTOR inhibitörü ve takrolimus kombinasyonu kullanılan koluna kıyasla daha fazla lenfosel ve yara iyileşmesinde gecikme rapor edilmiştir. Ancak bu fark istatistiksel olarak anlamlı saptanmamıştır (79). Pengel ve arkadaşları 2011 yılında yapmış oldukları bir meta analizde ise mTOR inhibitörü ve MPA alan hastalarda, mTOR inhibitörü ve takrolimus alan hastalara oranla anlamlı düzeyde daha sık yara iyileşme gecikmesi komplikasyonu olduğunu rapor etmişlerdir (57; 80).
Bizim araştırmamızda de novo olarak mTOR inhibitörü alanlardan dört hastada lenfosel ve bir hastada yara yerinde iyileşmede gecikme saptanmıştır. Lenfosel olan hastalara fenestrasyon uygulanmış ve lenfosel üç hastada gerilemiştir. Bir hastada ise rekürrens olunca tekrar drenaj yapılmış ancak dirençli olunca mTOR inhibitörü kesilmiştir. Bu hastalardan üç tanesi MPA/MMF ve mTOR inhibitörü protokolünde iken bir tanesi KNI ve mTOR inhibitörü almaktadır. Lenfosel genel olarak postoperatif erken dönemde görülmektedir. Bu çalışmada dönüşüm zamanı nakil operasyonundan ortalama 117 ay sonra olmuştur. Dönüşüm hastalarından hiçbirinde lenfosel gelişimi saptanmamıştır. Bu da operasyondan sonra geçen sürenin uzun olması ile açıklanabilir. De novo olarak mTOR inhibitörü başlanan hastalarda hasta sayısı ve lenfosel gelişim sayısı az olduğu için anlamlı bir fark saptanmamıştır.
mTOR inhibitörleri ile göz kapağı ödemi, bacaklarda ödem, lenfödem, plevral effüzyon ve anjioödem sıklığını rapor eden yayınlar mevcuttur. Göz kapağı ödemi ilaç başladıktan sonra genelde 1-5 ayda gelişmektedir. Çoğu hastada düşük doz furosemid ile gerilerken doz azaltmaya gerek kalmamaktadır. Çok az bir hastada ise ilaç kesilmesine rağmen aylar sonra ödemin devam ettiği rapor edilmiştir. Bu ödemin oluşum mekanizması bilinmemektedir (81; 82).