Elif YILDIZ Yüksek Lisans Tezi Biyomühendislik Anabilim Dalı Dr. Öğr. Üyesi Abdullah Tahir BAYRAÇ
T.C
KARAMANOĞLU MEHMETBEY ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
BALDA HİDROKSİMETİL FURFURAL TAYİNİ
YÜKSEK LİSANS TEZİ Elif YILDIZ
Biyomühendislik Anabilim Dalı
Tez Danışmanı: Dr. Öğr. Üyesi Abdullah Tahir BAYRAÇ
TEZ BİLDİRİMİ
Yazım kurallarına uygun olarak hazırlanan bu tezin yazılmasında bilimsel ahlak kurallarına uyulduğunu, başkalarının eserlerinden yararlanılması durumunda bilimsel normlara uygun olarak atıfta bulunulduğunu, tezin içerdiği yenilik ve sonuçların başka bir yerden alınmadığını, kullanılan verilerde herhangi bir tahrifat yapılmadığını, tezin herhangi bir kısmının bu üniversite veya başka bir üniversitedeki başka bir tez çalışması olarak sunulmadığını beyan ederim.
(İmza) Elif YILDIZ
i ÖZET
Yüksek Lisans
BALDA HİDROKSİMETİL FURFURAL TAYİNİ Elif YILDIZ
Karamanoğlu Mehmetbey Üniversitesi Fen Bilimleri Enstitüsü
Biyomühendislik Anabilim Dalı
Danışman: Dr. Öğr. Üyesi Abdullah Tahir BAYRAÇ
Ocak, 2019, 128 sayfa
Hidroksimetil furfural (HMF) balın kalitesinin bozulduğunu gösteren kimyasal bir indekstir. Balın uygun olmayan koşullarda depo edilmesi ve bala uygulanan ısıl işlemler balda HMF oluşumunu arttırmaktadır. Bu çalışmada, spektral, Seliwanoff, HPLC ve Winkler yöntemi kullanarak balda HMF miktarını tespit edecek yöntemler optimize edildi. Ayrıca, dışarıdan HMF eklenen bal örneklerinin ve çeşitli sıcaklık sürelerde ısıl işlem uygulanan bal örneklerinin içerisinde oluşan HMF miktarı bu dört yöntem ile analiz edildi. Bu dört yöntem için gerçeklik, kesinlik, özgünlük, tespit limiti (LOD), tayin limiti (LOQ), geri kazanım ve doğrusallık gibi performans parametreleri ve ölçüm belirsizliği hesaplandı. Sonuç olarak sırasıyla spektral, Seliwanoff, HPLC ve Winkler metotlarına ait geri kazanım değerleri %98,2, %100,2, %102,5 ve %103,3 olarak LOD değereleri ise 0,0011mg HMF/0,1g bal, 0,0007 mg HMF/0,1g bal, 0,0004 mg HMF/0,1g bal ve 0,0012 mg HMF/0,1g bal olarak belirlendi. Buna ek olarak, Seliwanoff yöntemiyle HMF miktarını daha kolay ve hızlı bir şekilde tespit etmek için kolorimetrik renk tabanlı kâğıt tipi bir sensörün ilk aşaması tamamlandı. Son yıllarda her alanda yaygın olarak kullanılan kolorimetrik biyosensör ile HMF tayininin kolay, hızlı ve düşük maliyette yapılması hedeflendi.
ii ABSTRACT
MSc. Thesis
DETERMINATION of HYDROXYMETHYL FURFURAL in HONEY Elif YILDIZ
Karamanoğlu Mehmetbey University Graduate School of Natural and Applied Sciences
Department of Bioengineering
Supervisor: Assist. Prof. Dr. Abdullah Tahir BAYRAÇ
January, 2019, 128 pages
Hydroxymethyl furfural (HMF) is a chemical index showing the deterioration of honey quality. The storage of honey in unsuitable conditions and the heat treatment applied to the honey increases the formation of HMF in honey. In this study, spectral, Seliwanoff, HPLC and Winkler methods were used to determine the amount of HMF in honey. Furthermore, the amount of HMF that spiked into honey samples and formed by heat treatment were analyzed by these four methods. Trueness, precision, specificity, limit of detection (LOD), limit of quantification (LOQ), recovery, linearity and measurement uncertainty were calculated. Recovery was determined as 98.2%, 100.2%, 102.5%, 103.3% and LOD was determined as 0.0011mg HMF/0,1g honey, 0.0007 mg HMF/0,1g honey, 0.0004 mg HMF/0.1g honey, 0.0012 mg HMF/0,1g honey for spectral, Seliwanoff, HPLC and Winkler methods respectively. In addition, the first phase of a colorimetric color-based paper-type sensor was completed to more easily and quickly detect the amount of HMF by the Seliwanoff method. In recent years, it has been aimed to make HMF determination easy, fast and low cost with colorimetric biosensor which is widely used in all areas.
iii ÖNSÖZ
Tez dönemim boyunca yardımlarını esirgemeyen, tecrübesi ve bilgisiyle çalışmama yön veren, ileride başarılı bir akademisyen olmak için bahanelerin arkasına sığınmadan çok çalışmayı öğreten tez danışmanım Dr. Öğr. Üyesi Abdullah Tahir BAYRAÇ' a sonsuz teşekkür ederim. Yüksek lisans eğitimim boyunca ve tezimin çeşitli aşamalarındaki yardımlarından dolayı, her zorlandığım anda rahatlıkla danışabildiğim, bilgisine ve sorunları çözebilme yeteneğine hayran olduğum Dr. Öğr. Üyesi Ceren BAYRAÇ' a çok teşekkür ederim.
''Verilen hiç bir emek zayi olmaz'' diyerek her zorluğun altından kalkmamı sağlayan babama, başaracağıma inanan ve beni destekleyen anneme, her zaman yanımda olduklarını hissettiğim dostlarıma sonsuz teşekkürlerimi sunarım.
Bugünlere gelmemi sağlayan ve bana en iyi eğitim imkanlarını sunan kudretli Türkiye Cumhuriyeti Devletine, yurdumda barış ve refah içinde yaşarken 'Ayyıldızlı Bayrak' için can veren şehitlerimize sonsuz minnetlerimi sunarım.
Bu çalışma sırasında gerekli olan analizleri gerçekleştirmeme olanak sağlayan Karamanoğlu Mehmetbey Üniversitesi Biyomühendislik Bölümüne ve Karamanoğlu Mehmetbey Üniversitesi Bilimsel ve Teknolojik Araştırmalar Uygulama ve Araştırma Merkezine ve bu merkezde görev alan Öğr. Gör. Hacer Sibel KARAPINAR' a HPLC analizlerimdeki yardımlarından dolayı teşekkür ederim. Yüksek lisans eğitimim boyunca maddi desteğinden dolayı TÜBİTAK' a teşekkür ederim.
Elif YILDIZ OCAK/2019
iv İÇİNDEKİLER Sayfa ÖZET ... i ABSTRACT ... ii ÇİZELGE DİZİNİ ... vii ŞEKİLLER DİZİNİ ... viii 1. GİRİŞ ... 1
2. KURUMSAL TEMELLER VE KAYNAK ARAŞTIRMASI ... 3
2.1. Biyosensörler ... 3
2.1.1. Biyosensörün Tanımı ... 3
2.1.2. Biyosensör Çeşitleri ... 4
2.1.2.1. Biyoalgılama Materyallerine Göre Biyosensör Çeşitleri ... 5
2.1.2.1.1. Enzim Bazlı Sensörler ... 5
2.1.2.1.2. Hücre ve Doku Bazlı Sensörler ... 5
2.1.2.1.3. Biyoafinite Sensörleri ... 6
2.1.2.2. Tiplerine Göre Biyosensör Çeşitleri ... 7
2.1.2.2.1. Elektrokimyasal Biyosensör ... 7
2.1.2.2.2. Kalorimetrik Biyosensör ... 7
2.1.2.2.3. Piezoelektrik Biyosensör ... 8
2.1.2.2.4. Optik Biyosensör ... 8
2.1.2.2.5. Kolorimetrik Biyosensör ... 8
2.2. Biyosensörlerin Uygulama Alanları ... 10
2.2.1. Biyosensörlerin Tıptaki Uygulamaları ... 10
2.2.2. Biyosensörün Çevre Kontrolünde Kullanımı ... 11
2.2.3. Biyosensörün Askeri Alanda Kullanımı ... 13
2.2.4. Biyosensörlerin Gıda Alanında Kullanımı ... 13
2.3 . Bal...15
2.4. Bal Çeşitleri.. ... 16
2.5. Balın Fiziksel Özellikleri ... 17
2.5.1. Renk ... 17
2.5.2. Viskozite... 18
2.5.3. Kristalizasyon ... 19
2.6. Balın Kimyasal Özellikleri ... 20
2.6.1. Balda Briks Değeri ... 21
v
2.6.3. Balın Şeker Profili ... 22
2.6.4. Hidroksimetil furfural (HMF) ... 24
2.7. Gıdalarda HMF’nin Önemi ... 28
2.8. Balda HMF Oluşumu ve Önemi ... 29
2.9. HMF'nin Tayin Yöntemleri ... 32
2.9.1. Winkler Metot ... 33
2.9.2. HPLC ... 33
2.9.3. White Metotu ... 33
2.9.4. Seliwanoff Testi ... 33
2.10. Türkiye’de Bal Üretimi ... 34
2.11. Bala İlişkin Yasal Düzenlemeler ... 35
3. MATERYAL VE METOT ... 38
3.1. Materyal ve Cihazlar ... 38
3.2. HMF Tayin Yöntemleri... 38
3.2.1. Solüsyonların Hazırlanması ... 38
3.2.2. HMF'nin Spektral Analizi ... 39
3.2.3. Fruktoz Dehidrasyonuna ait Koşulların Belirlenmesi ... 39
3.2.4. Seliwanoff Testi ile HMF Tayini ... 39
3.2.4.2. Renk Analizi ... 40
3.2.5. HPLC Yöntemi ile HMF Tayini ... 40
3.2.5.1. HPLC Cihazında HMF Kalibrasyon Eğrisi ... 40
3.2.6. Winkler Testi ile HMF Tayini ... 41
3.2.6.1. Standartların Hazırlanması ve Kalibrasyon Eğrisi ... 41
3.2.6.2. Renk Analizi ... 41
3.3. Metotların Gerçek Örneklerle Test Edilmesi ... 41
3.3.1. Bal Numunesinin Hazırlanması ... 41
3.3.2. Seliwanoff Testi ile Bal Analizi ... 42
3.3.3. HPLC ile Bal Analizi ... 42
3.3.4. Winkler Testi ile Bal Analizi ... 42
3.3.5. Bal Numunelerinin Isıl İşleme Maruz Bırakılması ... 42
3.4. Metot Validasyonu ... 42
3.4.1. Spesifite ... 43
3.4.2. Doğrusallık ... 43
3.4.3. Tespit Limiti (LOD) ve Tayin Limiti (LOQ)... 43
3.4.4. Doğruluk ... 43
vi
3.6. Kâğıt Deneyleri ... 44
4. BULGULAR VE TARTIŞMA ... 45
4.1. HMF’nin spektral analizi ... 45
4.2. Fruktoz dehidrasyonu ile HMF elde edilmesi ... 47
4.2. Seliwanoff Testi ... 52
4.2.1. Rezorsinol Miktarı ve Isıl İşlem Süresi Optimizasyonu ... 52
4.2.2. Seliwanoff Testi ile HMF Tayini ... 65
4.2.3. Seliwanoff Testinin özgünlüğünün değerlendirilmesi ... 67
4.3. HPLC ile HMF tayini ... 68
4.4. Winkler Testi ... 71
4.4.1. Winkler Testi ile HMF Tayini ... 71
4.4.2 Winkler Testinin özgünlüğünün değerlendirilmesi ... 76
4.5. Bal Analizi.... ... 77
4.5.1. Bala Uygulanan Isıl İşlem ... 80
4.6. Metot Validasyonu ve Ölçüm Belirsizliği ... 86
4.8. Kâğıt Deneyleri ... 89
5. SONUÇ ... 95
6. KAYNAKÇA ... 98
vii
ÇİZELGE DİZİNİ
Çizelge Sayfa
Çizelge 2-1 Biyosensörlerin çeşitli transdüserleri ve onların çalışma yöntemleri ... 7
Çizelge 2-2 Bal çeşitlerinin fizikokimyasal özellikleri ... 17
Çizelge 2-3 Bal çeşitlerinin kimyasal özellikleri ... 17
Çizelge 2-4 Balın bileşimi ... 21
Çizelge 2-5 Kanada bal numunesinin bileşimi ve değerleri aralığı ... 24
Çizelge 2-6 Balın özellikleri ... 31
Çizelge 2-7 Yıllara göre bal üretimi metrik ton (MT) ve piyasa değeri (TL/kg) .... 34
Çizelge 2-8 Codex Alimentarius'un CL 1998/12-S taslağına ve AB Taslak 96/0114 (CNS) taslağına göre bal kalitesi standardı ... 37
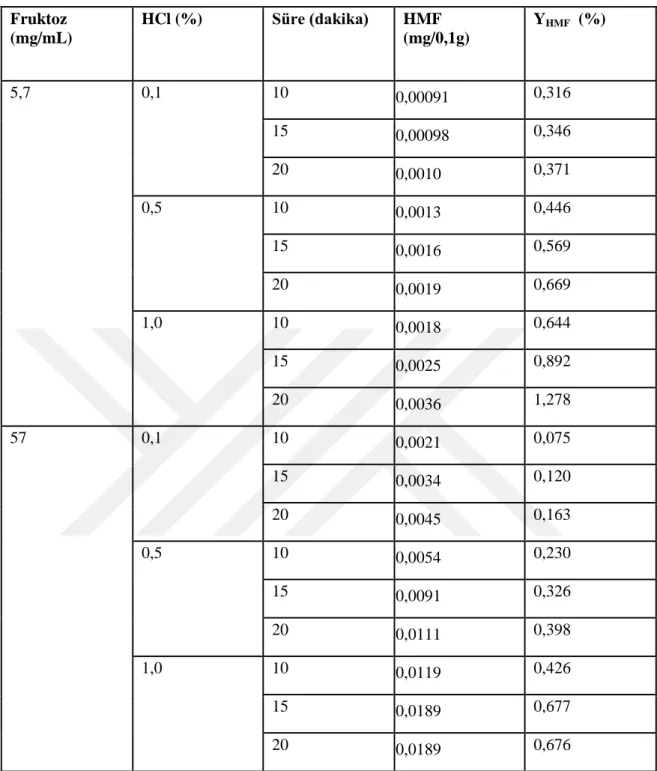
Çizelge 4-1 Standart HMF grafiğinden hesaplanan HMF (mg/mL) miktarları ... 46
Çizelge 4-2 Farklı reaksiyon koşulları altında fruktoz dehidrasyonunun sonuçları 49 Çizelge 4-3 80°C'de farklı ısıl işlem sürelerinde 57 mg/mL fruktozdan HMF oluşumu ... 50
Çizelge 4-4 Fruktozun dehidrasyonu sonucu oluşan HMF grafiğinden hesaplanan HMF (mg/mL) miktarları ... 51
Çizelge 4-5 5 dakikalık ısıl işlem ile fruktoz dehidrasyonundan elde edilen HMF’yle yapılan seliwanoff testine göre hesaplanan HMF değerleri ... 64
Çizelge 4-6 Fruktozdan elde edilen HMF solüsyonlarına karşılık hesaplanan HMF değerleri ... 71
Çizelge 4-7 Fruktozdan elde edilen HMF solüsyonlarına karşılık hesaplanan HMF değerleri ... 75
Çizelge 4-8 Metotların gerçek örnekle analizi sonucu elde edilen HMF miktarları ve geri kazanım değerleri ... 78
Çizelge 4-9 Seliwanoff testi, winkler metodu ve spektral analize ait düzeltme faktörü değerleri ... 79
Çizelge 4-10 Spektral analiz, seliwanoff testi ve winkler metoduna göre ısıl işlem görmüş bal analizlerden elde edilen HMF (mg/0,1g) miktarları ... 83
Çizelge 4-11 Metot validasyon çalışmalarının sayısal değerleri ... 87
Çizelge 4-12 Spektral analiz, Seliwanoff testi, HPLC ve Winkler testine ait belirsizlik bütçe çizelgesi ... 88
viii
ŞEKİLLER DİZİNİ
Şekil Sayfa
Şekil 2-1 Biyosensörün şematik gösterimi ... 3
Şekil 2-2 Biyosensörlerin biyoreseptör ve dönüştürücü çeşitliliği ... 5
Şekil 2-3 İmmünosensör cihazının şematik diyagramı ... 6
Şekil 2-4 Alkalen fosfataz test kiti analiz sonuçları ... 9
Şekil 2-5 Glikoz oksidaz elektrodu ... 10
Şekil 2-6 Hidroksimetil furfuralın yapısı ... 24
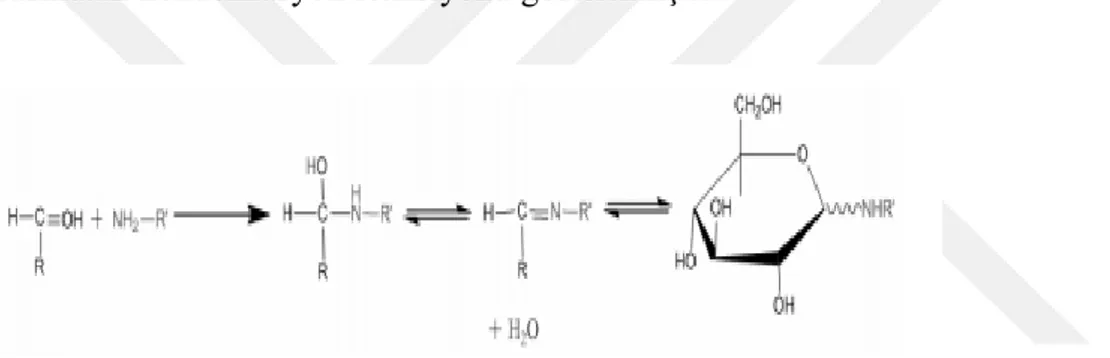
Şekil 2-7 Serbest amino grubu ve karbonil grubu arasındaki kondenzasyon reaksiyonu... 25
Şekil 2-8 Hidroksimetil furfuralın oluşumu ... 26
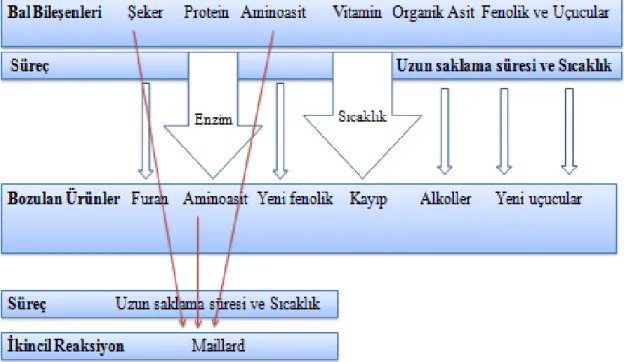
Şekil 2-9 Balda bulunan bileşikler, balın stabilitesini etkileyen süreçler, bozulma ürünleri ve ortaya çıkabilecek ikincil reaksiyonlar ... 27
Şekil 2-10 HMF ve türevleri... 29
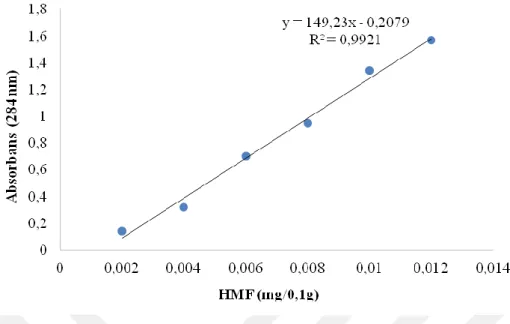
Şekil 4-1 Standart HMF ile oluşturulan standart HMF grafiği... 45
Şekil 4-2 Fruktozdan HMF üretilme reaksiyonu ... 47
Şekil 4-3 Fruktozdan elde edilmiş HMF ile oluşturulan standart HMF grafiği ... 51
Şekil 4-4 Seliwanoff reaksiyonu ... 52
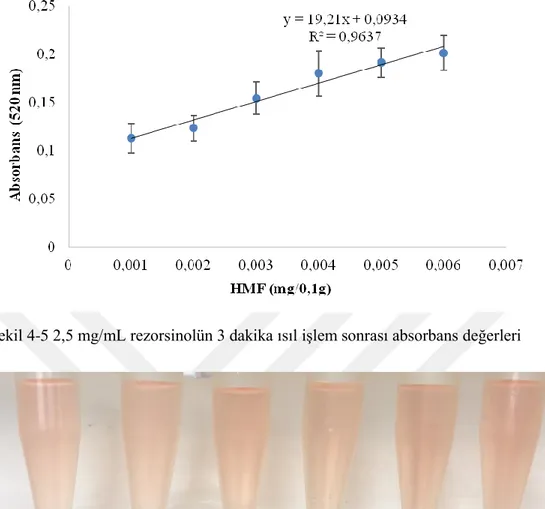
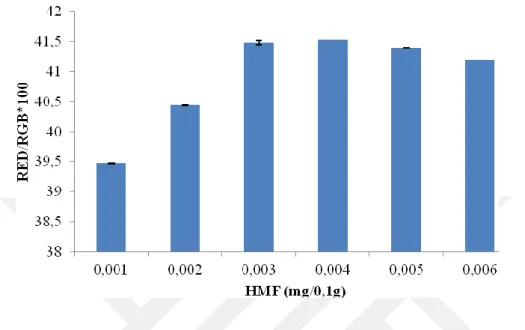
Şekil 4-5 2,5 mg/mL rezorsinolün 3 dakika ısıl işlem sonrası absorbans değerleri 53 Şekil 4-6 2,5 mg/mL rezorsinol ile HMF solüsyonlarının 3 dakika ısıl işlem uygulandıktan sonraki renk değişimleri (mg HMF/0,1g) ... 53
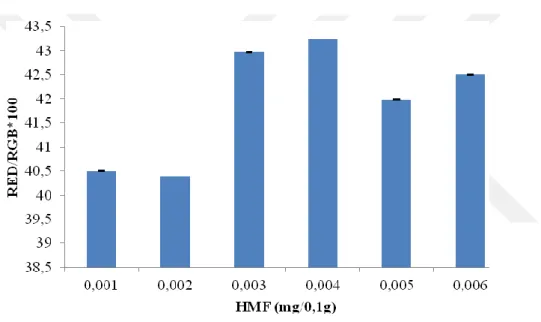
Şekil 4-7 2,5 mg/mL rezorsinol ile HMF solüsyonlarının 3 dakika ısıl işlem uygulandıktan sonraki renk analizi ... 54
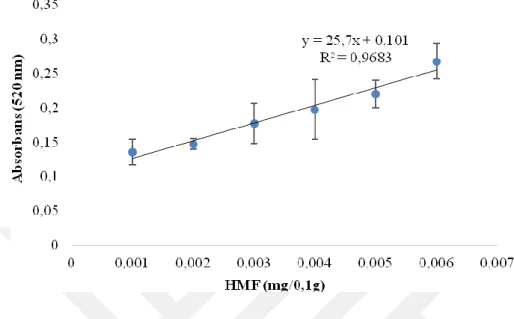
Şekil 4-8 3,75 mg/mL rezorsinolün HMF solüsyonlarının 3 dakika ısıl işlem sonrası absorbans değerleri ... 54
Şekil 4-9 3,75 mg/mL rezorsinol ile HMF solüsyonlarının 3 dakika ısıl işlem uygulandıktan sonraki renk değişimleri (mg HMF/0,1g) ... 55
Şekil 4-10 3,75 mg/mL rezorsinol ile HMF solüsyonlarının 3 dakika ısıl işlem uygulandıktan sonraki renk analizi ... 55
Şekil 4-11 5 mg/mL rezorsinolün 3 dakika ısıl işlem sonrası absorbans değerleri . 56 Şekil 4-12 5 mg/mL rezorsinol ile HMF solüsyonlarının 3 dakika ısıl işlem uygulandıktan sonraki renk değişimleri (mg HMF/0,1g) ... 56
ix
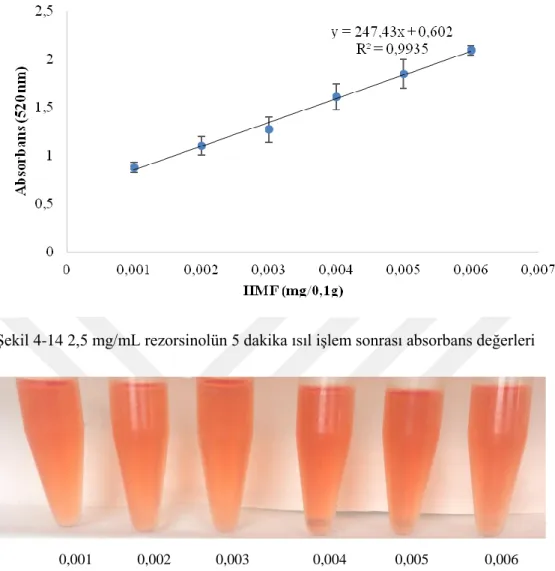
Şekil 4-13 5 mg/mL rezorsinol ile HMF solüsyonlarının 3 dakika ısıl işlem uygulandıktan sonraki renk analizi ... 57 Şekil 4-14 2,5 mg/mL rezorsinolün 5 dakika ısıl işlem sonrası absorbans değerleri ... 58 Şekil 4-15 2,5 mg/mL rezorsinol ile HMF solüsyonlarının 5 dakika ısıl işlem uygulandıktan sonraki renk değişimleri (mg HMF/0,1g) ... 58 Şekil 4-16 2,5 mg/mL rezorsinol ile HMF solüsyonlarının 5 dakika ısıl işlem uygulandıktan sonraki renk analizi ... 58 Şekil 4-17 3,75 mg/mL rezorsinolün 5 dakika ısıl işlem sonrası absorbans değerleri ... 59 Şekil 4-18 3,75 mg/mL rezorsinol ile HMF solüsyonlarının 5 dakika ısıl işlem uygulandıktan sonraki renk değişimleri (mg HMF/0,1g) ... 59 Şekil 4-19 3,75 mg/mL rezorsinol ile HMF solüsyonlarının 5 dakika ısıl işlem uygulandıktan sonraki renk analizi ... 60 Şekil 4-20 5 mg/mL rezorsinolün 5 dakika ısıl işlem sonrası absorbans değerleri . 61 Şekil 4-21 5 mg/mL rezorsinol ile HMF solüsyonlarının 5 dakika ısıl işlem uygulandıktan sonraki renk değişimleri (mg HMF/0,1g) ... 61 Şekil 4-22 3,75 mg/mL rezorsinol ile HMF solüsyonlarının 5 dakika ısıl işlem uygulandıktan sonraki renk analizi ... 61 Şekil 4-24 Farklı rezorsinol konsantrasyonlarının 5 dakika ısıl işlem sonrası birlikte gösterimi ... 63 Şekil 4-25 5 dakikalık ısıl işlem ile fruktoz dehidrasyonundan elde edilen HMF’yle yapılan seliwanoff testine göre hesaplanan HMF değerlerinin grafiği ... 65 Şekil 4-26 Rezorsinol solüsyonu ile standart HMF'nin konsantrasyon absorbans grafiği ... 65 Şekil 4-27 Rezorsinol ve standart HMF konsantrasyonlarına uygulanan ısıl işlem sonrası oluşan renk (mg HMF/0,1g) ... 66 Şekil 4-29 Rezorsinol ve standart HMF konsantrasyonlarına uygulanan ısıl işlem sonrası oluşan renk analizi ... 66 Şekil 4-30 HMF solüsyonunun Seliwanoff testine özgünlük değerlendirmesi ... 68 Şekil 4-31 HMF solüsyonunun Seliwanoff testine özgünlük değerlendirmesinde renk değişimi (mg HMF/0,1g) ... 68 Şekil 4-32 Farklı konsantrasyonlarda standart HMF'nin kromatogram görüntüsü 69
x
Şekil 4-33 Standart HMF çözeltilerine ait HPLC kalibrasyon grafiği ... 69
Şekil 4-34 Fruktozdan elde edilen HMF çözeltilerine ait HPLC kalibrasyon grafiği ... 70
Şekil 4-35 Fruktozdan elde edilen HMF solüsyonlarına karşılık hesaplanan HMF değerlerinin grafiği ... 71
Şekil 4-36 Standart HMF solüsyonu kullanılarak winkler metoduyla oluşturulan standart eğri ... 72
Şekil 4-37 Winkler metodu sonucunda standart HMF konsantrasyonlarındaki renk değişimi (mg HMF/0,1g) ... 72
Şekil 4-38 Winkler metodu sonucunda standart HMF konsantrasyonlarının renk analizi ... 73
Şekil 4-39 Fruktozdan elde edilen HMF ile oluşturulan standart HMF absorbans grafiği ... 74
Şekil 4-40 Winkler metodu sonucunda HMF konsantrasyonlarında oluşan renk değişimi (mg HMF/0,1g) ... 74
Şekil 4-41 Winkler metodu ile fruktozdan elde edilen HMF'lerin renk analizi ... 75
Şekil 4-42 Fruktozdan elde edilen HMF solüsyonlarına karşılık hesaplanan HMF değerlerinin grafiği ... 76
Şekil 4-43 HMF solüsyonunun Winkler metoduna ait özgünlük değerlendirmesi . 76 Şekil 4-44 HMF solüsyonun winkler metoduna ait özgünlük değerlendirmesi (mg HMF/0,1g) ... 77
Şekil 4-46 Isıl işlem görmüş balda oluşan HMF (mg/0,1g) miktarlarının spektral analizle tespit edilmesi ... 81
Şekil 4-47 Isıl işlem görmüş balda oluşan HMF (mg/0,1g) miktarlarının Seliwanoff testiyle tespit edilmesi ... 82
Şekil 4-48 Isıl işlem görmüş balda oluşan HMF (mg/0,1g) miktarlarının Winkler testiyle tespit edilmesi ... 83
Şekil 4-49 0,005 mg/mL rezorsinol ile yapılan kağıt deneyi ... 90
Şekil 4-50 0,01 mg/mL rezorsinol ile yapılan kağıt deneyi ... 90
Şekil 4-51 0,02 mg/mL rezorsinol ile yapılan kağıt deneyi ... 91
Şekil 4-52 Rezorsinol (0,25 mg/mL) üzerine HMF damlatıldıktan 5 dk sonra renk değişimi (solda), HMF damlatıldıktan 1 gün sonra oluşan renk değişimi (sağda) .. 91
xi
Şekil 4-53 Rezorsinol (0,75 mg/mL) üzerine HMF damlatıldıktan 5 dk sonra renk değişimi (solda), HMF damlatıldıktan bir gün sonra oluşan renk değişimi (sağda) 92 Şekil 4-54 Etüvde 60°C’de 15 dk (solda) ve 20 dk (sağda) kurutulan kağıtların renk değişimi ... 93 Şekil 4-55 Etüvde 40℃’de 17, 19, 21, 23, 25, 27, 29, 31, 33 dakika boyunca kurutulan kağıtların renk değişimi ... 93 Şekil 4-56 Etüvde 40℃’de 17, 19, 21, 23, 25, 27, 29, 31, 33 dakika boyunca kurutulan kağıtların renk analizi ... 94
xii SİMGELER ve KISALTMALAR DİZİNİ Simgeler Açıklama °C Santigrat derece C Karbon gr Gram H Hidrojen mg Miligram mL Mililitre O Oksijen μL Mikrolitre Kısaltmalar Açıklama AB Avrupa Birliği
AChE Asetil kolinesteraz
ATP Adenozin trifosfat
BChE Butirilkolinesterazın
BOD Biyokimyasal oksijen ihtiyacı
DNA Deoksiribonükleik asit
ELISA Enzime dayalı immunosorbent assay
ESHF Son evre kalp yetmezliği
FRET Floresan rezonans enerji transferi
FTIR Fourier dönüşümlü kızılötesi spektroskopisi
GFP Yeşil floresan protein
HCl Hidroklorik asit
HMF Hidroksimetil furfural
HPLC Yüksek basınçlı sıvı kromotografisi IHC Uluslararası Bal Komisyonu
IUPAC Uluslararası temel ve uygulamalı kimya birliği
xiii
LOQ Tayin limiti
MECK Micellar elektro kinetik kromatografi
MFC Mikrobiyal yakıt hücresi NIR Yakın kızılötesi spektroskopisi
PAH Polisiklik aromatik hidrokarbonlar
PCB Poliklorlu bifeniller
PCR Polimeraz zincir reaksiyonu
QCM R2
Kuartz kristali mikrobalans Korelasyon katsayısı
RGB Kırmızı, yeşil, mavi
RSD RSDr
Rölatif standart sapma
Rölatif tekrar edilebilirlik standart sapma
SAW SD SELEX
Yüzey akustik dalga Standart sapma
Ligandların üstel zenginleştirme ile sistematik evrimi
TGK Türk gıda kodeksi
TSE Türk Standartları Enstitüsü
UTI Üriner sistem enfeksiyonu
1 1. GİRİŞ
Bal, her yaş grubundaki insanın tüketebildiği yüksek besin değerine sahip bir gıda maddesidir. Balın içeriğinde 180’den fazla farklı madde bulunmaktadır. Fruktoz ve glikoz gibi karbonhidratlar bal içeriğinin %85'ini oluşturmaktadır. Bunun yanı sıra içinde, protein, aminoasit, enzim, vitamin ve hormonlar da bulunmaktadır (Karimov ve ark., 2014). Balın içeriği daha ucuz tatlandırıcılar eklenerek veya arıların şekerlerle beslenmesiyle değiştirilebilir ve bu işlemler balın doğal yapısını bozarak insan sağlığı için tehdit oluşturmaktadır. Bu nedenle, balın kalitesini tespit etmek ve ölçmek için yöntemler gerekmektedir. Balın kalitesi fiziksel, kimyasal ve biyokimyasal parametreler kullanılarak değerlendirilmektedir (Pita Calvo ve ark., 2007). Hidroksimetil furfural (HMF) bal kalitesinin bozulmasının bir göstergesi olarak kullanılır. Isıl işlem uygulaması veya yetersiz depolama koşulları balda HMF oluşumuna sebep olmaktadır. Ayrıca HMF oluşumu; meyve suları, süt, bal, tahıl ürünleri, reçel gibi birçok ürünün uygun koşullarda depolanıp depolanmadığını, uygun ısıl işlemin yapılıp yapılmadığını anlamak için de kimyasal indeks olarak kullanılmaktadır (Nassberger, 1990). Taze ballarda HMF içeriği düşüktür. Bununla birlikte, yüksek HMF konsantrasyonu eski ballarda mevcut olup, bu durum, balın ısıtılmış veya invert şeker veya şurup ilave edildiğini göstermektedir (Nozal ve ark., 2001).
HMF aromatik alkol, aromatik aldehit ve furan halkasından oluşur. Maillard reaksiyonu esnasında bir ara ürün olarak ortaya çıkmaktadır (Chichester, 1986). Gıdalarda HMF tayiniyle ilgili yapılan çalışmalar HMF’nin toksisitesi sebebiyle oldukça önemlidir. Gıda ürünlerinde yüksek oranda oluşan HMF, üst solunum yollarını, göz, deri ve mukozayı tahriş etmektedir. HMF ve türevlerinin genotoksik, sitotoksik, mutajenik ve kanserojen etkileri olduğu bildirilmiştir (Makawi ve ark., 2009).
HMF tayini için kolorimetrik, spektrofotometrik, kromatografik, spektroskopik çalışmalarda dâhil olmak üzere çok çeşitli yöntemler kullanılmaktadır (White, 1979). Uluslararası Bal Komisyonu (The International Honey Commission, IHC), HMF'nin belirlenmesi için üç temel yöntem önermektedir: ikisi spektrofotometrik yöntem olan, White ve Winkler yöntemi diğeri ise HPLC yöntemidir (Zappala, 2005).
2
Sensörler, herhangi bir fiziksel özelliği algılayıp sonucu sayısal veri olarak kayıt eder. Biyosensör, analiti biyoreseptör yardımıyla analiz etmek için fizikokimyasal dedöktör ile birleştiren cihazlardır. Biyosensörler, biyoreseptörlerin ve dönüştürücülerin çeşidine göre sınıflandırılırlar (Bulut, 2011). Kolorimetrik biyosensörler, renk oluşturmak için kromojenik bir maddenin kullanıldığı basit ve hızlı sistemlerdir (Kavruk, 2010). Bu tez çalışmasında, seliwanoff, HPLC ve winkler yöntemini kullanarak balda hidroksimetil furfural bileşiğinin miktar tespit yöntemi optimize edilmiştir. Bununla birlikte Seliwanoff yöntemi temelli HMF miktarını daha kolay ve hızlı bir şekilde tespit edebilen kolorimetrik renk tabanlı bir kâğıt tipi bir sensörün öncül çalışmaları tamamlanmıştır. Son yıllarda birçok alanda kullanılan kolorimetrik biyosensör ile HMF tayini kolay, hızlı ve düşük maliyette yapılacağı düşünülmektedir.
3
2. KURUMSAL TEMELLER VE KAYNAK ARAŞTIRMASI
2.1. Biyosensörler
2.1.1. Biyosensörün Tanımı
"Biyosensör" terimi Cammann (1977) tarafından oluşturulmuştur ve tanımı Uluslararası Temel ve Uygulamalı Kimya Birliği (IUPAC) tarafından yapılmıştır (Thevenot ve ark., 2001). Biyosensörler analiz edilecek maddeyi biyoreseptör yardımıyla algılayıp, sonucu fizikokimyasal dedektör yoluyla sayısal verilere dönüştürebilen cihazlardır (Belkin, 2003; Wilson ve Gifford, 2005; Rustagi ve Kumar, 2013). Başka bir ifadeyle biyosensörler biyolojik bir değişimi elektriksel sinyale dönüştürürler. Şekil 2-1'de biyosensörün şematik gösterimi yapılmıştır.
Şekil 2-1 Biyosensörün şematik gösterimi (Sharma ve Mutharasan, 2013)
Biyosensörler analit, biyoreseptör ve transdüser olmak üzere üç kısımdan oluşmaktadır (Sharma ve Mutharasan, 2013). Analit; analiz edilecek maddeyi ifade eder. Biyoreseptör, analiti algılayabilen biyomoleküllerdir. Transdüser ise, biyoreseptörün analiti farkettiği esnada ürettiği fiziksel veya kimyasal sinyali elektrik sinyaline dönüştüren yapılardır (Byfield ve Abuknesha, 1994).
Biyosensörler birçok parametreye göre nitelendirilebilirler (Bulut, 2011). Bunların başında duyarlılık gelmektedir. Duyarlılık, madde miktarı değişimine göre cihazın hassas bir şekilde tepki vermesidir. Seçicilik ise, cihazın sadece analiz edilecek maddedeki özgünlüğünü göstermesidir. Böylece cihaz, başka bir reaktifi ölçmemekte ve
hatalı sonuç vermemektedir. Biyosensörlerin ölçüm yapabildiği analit
konsantrasyonunun aralığı ise ölçüm aralığıdır ve aranan bir diğer parametredir (Nice ve Analit
Biyoreseptör
4
Catimel, 1999). Ölçüm süresi ise cihazın ölçüm hızını göstermektedir. Cihazın sonuçlarındaki tutarlık ise aranan bir diğer parametredir. Tespit sınırı, cihazın ölçebileceği en düşük konsantrasyonu ifade etmektedir (Turner, 1994). Cihazın kullanılma süresi, cihazın, performansında bir değişme veya azalma olmadan verdiği hizmet süresidir. Son parametre olan kararlılık ise, analiz süresi içerisinde cihazın duyarlılığındaki değişimleri dikkate alan bir kalite ölçüm değeridir (Mulchandani ve Bassi, 1995).
Başarılı bir biyosensör oluşturmak için bazı şartların yerine getirilmesi gerekmektedir. Öncelikle biyoreseptör, incelenen analit için oldukça özgün olmalıdır. Ayrıca, insan numunelerinden alınan analitlerin hızlı ölçümleri için, biyosensör gerçek zamanlı analiz
sağlayabilmelidir. Biyosensör, depolama koşullarına maruz kaldığında kararsız
olmamalıdır ve birden fazla sayıda analizde kararlılık göstermelidir (Murugaiyan ve ark., 2014). Biyosensörde gerçekleşen reaksiyon çeşitli fiziksel parametrelerden (pH, sıcaklık) bağımsız sonuç verebilmelidir. Seyreltme işlemine başvurmak zorunda kalmadan doğru, kesin ve doğrusal sonuçlar elde edilmelidir. Biyosensörün ucuz, küçük ve taşınabilir olması da biyosensörlerde aranan özelliklerdir (Grieshaber ve ark., 2008).
2.1.2. Biyosensör Çeşitleri
Biyosensörlerle ilgili çalışmalar 1960'larda Clark ve Lyons tarafından başlatılmıştır. Kullanılan çeşitli biyosensörler, enzim bazlı, doku bazlı, DNA bazlı, termal ve piezoelektrik biyosensörlerdir. Birçok farklı madde çeşitli biyoreseptörler yardımıyla analiz edilebilmektedir (Mehrotra, 2016). Şekil 2-2' de biyosensörü oluşturan kısımlar ve bu kısımların çeşitleri gösterilmiştir.
5
Şekil 2-2 Biyosensörlerin biyoreseptör ve dönüştürücü çeşitliliği (Abasıyanık ve ark., 2011) 2.1.2.1. Biyoalgılama Materyallerine Göre Biyosensör Çeşitleri
2.1.2.1.1. Enzim Bazlı Sensörler
Enzim tabanlı sensörler ilk defa Updike ve Hick tarafından 1967'de rapor edilmiştir (Updike ve Hick, 1967). Enzim biyosensörlerinde özellikle immobilizasyon yöntemleri üzerinde çalışmalar yapılmıştır. Örneğin, enzimlerin Van der Waals kuvvetleri, iyonik bağlama veya kovalent bağlanma yoluyla adsorpsiyonu üzerinde enzim tabanlı biyosensörler geliştirilmiştir. Bu amaçla yaygın olarak oksidoredükazlar, polifenol oksidazlar, peroksidazlar ve aminooksidazlar kullanılmıştır (Venugopal, 2002; Wang, 2008; Akyilmaz ve ark., 2010).
2.1.2.1.2. Hücre ve Doku Bazlı Sensörler
İlk mikroorganizma temelli ve hücreye dayalı sensör Diviès tarafından 1975 yılında gerçekleştirilmiştir. Çalışmada Acetobacter xylinum ve oksijen elektrodu kullanılmıştır. Bu çalışma, biyoteknoloji ve çevresel izleme programları için mikrobiyal biyosensörlerin geliştirilmesine adanmış araştırmaların temeli olmuştur (Turner, 1997). Rechnitz, amino asit arginin tayini için ilk doku tabanlı sensörü geliştirmiştir (Rechnitz,1978). Bu çalışma membranlar, kloroplastlar, mitokondri ve mikrozomlar gibi organelle temellendirilmiş sensörler kullanılarak yapılmıştır. Bu tip biyosensörlerde kararlılığın yüksek olmasına rağmen analiz süresinin uzadığı anlaşılmıştır. Analiz süresinin uzaması ise analiz edilecek maddenin özgünlüğünü azaltmıştır (Wijesuriya ve Rechnitz, 1993). Doku esaslı sensörler için dokular, bitki ve hayvansal kaynaklardan elde edilmiştir. Newman ve Setford (2006) tarafından doku esaslı biyosensörlerle ilgili
6
yapılan çalışma, Japonya ve diğer ülkelerdeki biyosensörlerin biyoteknolojik ve çevresel uygulamalarına yönelik büyük bir araştırma çabasının başlangıcı olarak kabul edilmiştir.
2.1.2.1.3. Biyoafinite Sensörleri
DNA biyosensörleri ve immunosensörler biyoaffinite sensörleri olarak kullanılmaktadır. DNA biyosensörleri, tek sarmallı nükleik asit molekülünün, tamamlayıcı zinciri tanıyıp bağlanabilme kapasitesi üzerine kurulmuştur. Bu etkileşim, iki nükleik asit zinciri arasında kararlı hidrojen bağlarının oluşumundan kaynaklanmaktadır (Wang, 1998). İmmunosensörler, antikorların ilgili antijenlere karşı yüksek afiniteye sahip olması üzerine, diğer bir ifadeyle antikorların patojenlere veya toksinlere spesifik olarak bağlanması veya konakçının bağışıklık sisteminin bileşenleriyle etkileşime girmesi üzerine kurulmuştur (Mehrotra, 2016). Şekil 2-3'de immünosensör cihazının işleyiş mekanizması gösterilmiştir.
Şekil 2-3 İmmünosensör cihazının şematik diyagramı (Kumar, 2000)
Aptamerler, hedef molekülüne spesifik ve yüksek afiniteyle bağlanabilen oligonükleik asit veya peptid moleküllerdir. Aptamerler, geniş bir oligonükleotid kütüphanesinden SELEX (ligandların üstel zenginleştirme ile sistematik evrimi) adı verilen bir yöntem ile seçilir (Ellington ve Szostak, 1990) ve küçük organikler, peptitler, proteinler ve hatta virüsler veya hücreler gibi supramoleküler kompleksler de dahil olmak üzere çok çeşitli hedef moleküllerine bağlanabilirler (Wilson ve Szostak, 1999). Bu özelliklerinden dolayı aptamer sensörler, enzim veya antikor biyosensörlere göre daha çok avantaja
Kayıt Cihazı Transdüser
Antikor reseptörleri Antijen
7
sahiptir. Nükleik asit bazlı aptamerler ile ilk olarak 1990 yılında çalışılmıştır (Cho ve ark., 2009; Marrazza, 2017). Zelada-Guillen ve ark, (2009) Salmonella Typhi bakterisini tespit etmek için biyoreseptör olarak aptameri iletken madde olarak ise tek duvarlı karbon nanotüpleri kullanmışlardır. Bu biyosensöer sayesinde araştırmacılar bakteriyi yüksek seçicilik ile 5 ml'lik sıvı içerisinde kolayca tespit etmişlerdir.
2.1.2.2. Tiplerine Göre Biyosensör Çeşitleri 2.1.2.2.1. Elektrokimyasal Biyosensör
Elektrokimyasal biyosensörler, biyolojik bir olayın elektronik sinyale doğrudan dönüşümü sayesinde biyolojik bir numunenin içeriğini kolaylıkla analiz etmektedir. Elektrokimyasal yaklaşımlar mikrobiyal biyosensörlerin geliştirilmesinde yaygın olarak kullanılmaktadır. Tespit prensibine göre elektrokimyasal teknikler, amperometrik, potansiyometrik ve kondüktometrik olarak sınıflandırılmaktadır (Hasan ve ark., 2014). Çizelge 2-1' de biyosensörlerin transdüserleri ve onların çalışma alanları gösterilmiştir.
Transdüser Biyosensörin Ölçüm
Yöntemi
Uygulamalar
İyon seçici elektrot Potensiyometrik Biyolojik ortamda iyonlar, Enzim elektrotları
Gaz algılama elektrodu Potensiyometrik
Gazlar, oraganeller ve enzimler Hücre veya doku elektrotları Optoelektronik ve fiber optik
cihazlar Optik İmmünolojik analitler
Termistörler Kalorimetrik Enzim, vitamin ve organaller Enzim elektrot Amperometrik Enzim ve immunolojik sistemler Çizelge 2-1 Biyosensörlerin çeşitli transdüserleri ve onların çalışma yöntemleri (Murugaiyan ve ark., 2014)
2.1.2.2.2. Kalorimetrik Biyosensör
Termal biyosensörler diğer bir ifadeyle kalorimetrik biyosensörler, analiz edilecek maddenin termometre, termopil veya termistör gibi fiziksel bir transdüsürle birleştirilerek çalıştırma prensibine dayanmaktadır (Kroger ve Danielsson, 1997).
8
2.1.2.2.3. Piezoelektrik Biyosensör
Piezoelektrik biyosensörler analiz edilecek maddenin kütle değişimini ölçen gravimetrik cihazlardır. Piezoelektrik biyosensörleri iki çeşittir: kuartz kristali mikrobalans (QCM) ve yüzey akustik dalga (SAW) cihazı. Çalışma prensipleri kristal yapısındaki kütle değişikliklerine bağlı olarak piezoelektrik kristalin rezonans frekansındaki değişikliklere dayanır (Mehrotra, 2016).
2.1.2.2.4. Optik Biyosensör
Optik biyosensörler genellikle optik kırınımlara dayanarak yapılır (Watts ve ark., 1994). Optik biyosensörler, bir ışık kaynağının yanı sıra belirli özelliklere sahip bir ışık demeti üretmek ve bu ışığı modüle edici bir ajana, bir fotodetektör ile birlikte modifiye edilmiş bir algılama başına çekmek için tasarlanmış optik bileşenlerden oluşur (Leatherbarrow ve Edwards, 1999). Optik biyosensörler moleküler etkileşimlerin analizini hızlı ve kullanışlı hale getirmektedir. Optik, mikrobiyal biyosensörlerde yaygın olarak kullanılan bir tekniktir. Optik saptama genellikle, mikroorganizmaların analitlerle etkileşimi ile üretilen floresan, kolorimetrik veya diğer optik sinyallerin ölçümüne dayanır ve gözlemlenen optik sinyali hedef bileşiklerin konsantrasyonu ile ilişkilendirir (Murugaiyan ve ark., 2014).
2.1.2.2.5. Kolorimetrik Biyosensör
Kolorimetrik biyosensörler, renk oluşturmak için kromojenik bir maddenin kullanıldığı basit ve hızlı sistemlerdir. Optik tanımlama çoğunlukla mekanik transdüser yerine çıplak gözle yapılır. Tek kullanımlık ve taşınabilir sensörlerdir ve geleneksel zaman alıcı ve laboratuvar tabanlı yöntemlere alternatif uygulamalardır (Kavruk, 2010). Kolorimetrik sensörlerin diğer sensör çeşitlerine göre birçok avantajı vardır. Örneğin, analiz kısa sürede gerçekleştirilir, analiz yaparken herhangi bir ek teçhizata veya solüsyona ihtiyaç duyulmaz, deneyimli ya da deneyimsiz personel sensörü kullanabilir ve düşük maliyette çözüm sunar. Kâğıt şerit üzerinde bulunan test bölgelerinde meydana gelen rengin değişimine göre nitel sonuç verir (Özgen, 2010).
9
Şekil 2-4 Alkalen fosfataz test kiti analiz sonuçları (SENSObiz®, 2012)
Şekil 2-4’te kolorimetrik bir biyosensörün analiz sonucu yer almaktadır. Kolorimetreik sensörlere örnek olaak verebileceğimiz bu alkalen fosfataz enzimi test kiti, sütün pastörize olup olmadığını veya pastörize olmuş süte çiğ sütün karışıp karışmadığını analiz eden ve birçok süt firması tarafından kullanılan bir yerli üretim bir test kitidir.
Mikrobiyal biyosensörlerdeki kolorimetrik algılama tekniği, bir kromojen substratın, mikrobiyal duyu elemanının metabolik aktivitesi ile renkli bir bileşiğe dönüştürülmesini içerir (Azevedo ve ark., 2005). Renkli ürün çıplak göz veya bir spektrofotometre ile ayırt edilebilir. Basit ve ucuz ölçüm kurulumu sayesinde, kolorimetrik teknik, mikrobiyal biyosensörlerin üretiminde yaygın olarak uygulanmaktadır.
Çevresel sudaki antibiyotiklerin varlığı ve antibiyotiğe karşı dirençli bakterilerin ortaya çıkmasından dolayı, çevre suyunun taranması için uygun bir tespit yönteminin geliştirilmesi gerekmektedir. Duyen ve ark, (2017) çalışmasında, aminoglikozidler, tetrasiklin, kloramfenikol ve makrolidler dâhil olmak üzere bakteriyel protein sentezini inhibe eden antibiyotiklerin saptanması için yeni bir prensibe dayanan basit bir yöntem olan kolorimetrik kâğıt bazlı biyosensör geliştirmişlerdir. Bu biyosensör, β-galaktosidaz tarafından tetiklenen bir renk değişikliğinin saptanmasına dayanmaktadır. Kâğıt disklere antibiyotiksiz bir su numunesi uygulandığında, β-galaktosidaz sentezlenir ve kolorimetrik bir substratı hidrolize ederek sarıdan mor renge dönüşür. Aksine, antibiyotiklerin varlığında, β-galaktosidaz sentezinin inhibisyonuna bağlı olarak renk değişimi engellenir.
Kolorimetrik sensörlerde genellikle kâğıt tabanlı biyosensörler kullanılmaktadır. Kağıt tabanlı biyosensörler sentetik biyoloji için kararlı, steril ve abiyotik bir ortam sağlamaktadır. Ayrıca, hücre tabanlı araştırma ve gen devre tasarımı için hızlı
prototipleme sağlar ve laboratuvar yeteneklerini laboratuvardan sahaya
10 2.2. Biyosensörlerin Uygulama Alanları
Biyosensörler, gıda endüstrisi, tıbbi alan, denizcilik sektörü, askeri alan gibi birçok farkla alanlarda uygulanmaktadır ve geleneksel yöntemlere kıyasla analizlerde daha çok kararlılık ve hassaslık sağlamaktadır (Kissinger, 2005; Amine ve ark., 2006).
2.2.1. Biyosensörlerin Tıptaki Uygulamaları
Tıp alanında biyosensör uygulamaları hızla artmaktadır. Glikoz biyosensörleri, kan şekeri seviyeleri üzerinde kesin kontrol gerektiren diabetes mellitus tanısı için klinik uygulamalarda yaygın olarak kullanılmaktadır (Scognamiglio ve ark., 2010). Şeker hastalarının evlerde sıklıkla kullandığı glikoz biyosensörleri, dünya pazarının % 85'ini oluşturmaktadır (Rea ve ark., 2009). Şekil 2-5'te glikoz oksidaz elektrodu gösterilmiştir.
Şekil 2-5 Glikoz oksidaz elektrodu (Ötleş, 2000)
Bulaşıcı hastalıkları teşhis etmek için biyolojik sensörler tıp alanında yaygın olarak kullanılmaktadır. Patojen tanımlaması ve anti-mikrobiyal duyarlılık ile birlikte üriner sistem enfeksiyonu (UTI) tanısı için biyosensör teknolojisi umut vadetmektedir.
Tıp alanında kullanılan bir diğer biyosensör uygulaması olan Interleukin-10'un (IL-10) ölçümü, son evre kalp yetmezliği (ESHF) hastalarını tanımlamak için önemli bir araç haline gelmiştir (Lee ve ark., 2012).
Sağlık alanında immünoaffinite sütun analizi, florometrik ve enzime dayalı immunosorbent assay (ELISA) gibi kardiyovasküler hastalıklarla ilgili biyolojik
11
belirteçlerin saptanması için yaygın olarak kullanılan çeşitli yöntemler geliştirilmiştir. Bununla birlikte, bu laboratuvar teknikleri nitelikli personel gerektiren gelişmiş cihazlara dayanmaktadır, numune hazırlama ve analizleri de zaman almaktadır. Bu nedenle, erken safhalarda enflamatuar durumun ciddiyetinin belirlenmesini ve böylece erken terapötik müdahalenin yapılmasını mümkün kılan, yüksek duyarlılık ve seçiciliği olan biyosensörler tıp alanında uygulanmaktadır.
Ayrıca enzimler ve antikorlar tıp ve biyomedikal alanda yaygın olarak kullanılan biyoreseptör çeşitleridir. Enzim bazlı amperometrik biyosensör, diyabet hastalığının teşhisi ve tedavisi için kullanılmaktadır (Weltin ve ark., 2016).
Floresan biyosensörler diğer bir ifadeyle görüntüleme ajanları, kanser ve ilaç keşfinde yaygın olarak kullanılmaktadır. Floresan biyosensörler hücresel düzeyde enzimlerin rol ve düzenlenmesine ilişkin bilgiler sağlamıştır (Morris, 2010). Yeşil floresan protein (GFP) tabanlı ve genetik olarak kodlanmış floresan rezonans enerji transferi (FRET) biyosensörleri kanser ve ilaç keşfinde hayati bir rol oynamaktadır. Ayrıca bu sensörler, gen aktarımı, protein lokalizasyonu ve sinyal transdüksiyonu, transkripsiyon, hücre döngüsü ve apoptoz gibi alanlarda kullanılmaktadır. Bunlara ek olarak, artrit, inflamatuar hastalıklar, kardiyovasküler ve nörodejeneratif hastalıklar, viral enfeksiyon, kanser ve metastaz belirtileri bu sensörler yardımıyla belirlenbilmektedir (Wang ve ark., 2009a).
2.2.2. Biyosensörün Çevre Kontrolünde Kullanımı
Çevresel ölçüm ve kontroller insan sağlığını ve ekosistemin dengesini korumak için yapılmaktadır. Laboratuvar ölçümlü sistemler zaman alıcı ve pahalı kontrol sistemleridir. Daha hızlı ve ekonomik çözüm sağlaması sebebiyle kirlilik ölçümlerinde kullanılmak üzere çeşitli biyosensörler üretilmiştir. Örneğin, organik sularda atık kirliliğin ölçüsü olan biyokimyasal oksijen ihtiyacı (BOD) sensörleri, atmosfer kirliliğini ölçmek için gaz sensörleri ve toksisite analizinde kullanılan enzim inhibisyon derecesi tayinine dayalı sensörler geliştirilmiştir (Ötleş, 2000).
Biyosensörler, çevresel izleme için gerçek zamanlı sonuçlar sunabilen, kullanımı kolay, taşınabilir, uygun maliyetli ve faydalı analitik araçlardır. Belirli kimyasal veya toksisite biyosensörleri ve endokrin etki biyosensörleri gibi biyolojik etkilerinin ölçülmesi için
12
biyosensörler tasarlanmıştır (Rodriguez-Mozaz ve ark., 2005). Çevrede zararlı kirleticilerin sayısının artması, kapsamlı izleme programlarında kullanılmak üzere hızlı ve uygun maliyetli analitik teknikler gerektirmektedir. Kromatografik gibi geleneksel yöntemler zaman alıcı, yüksek maliyetli olduğundan çevre kirliliğini takip etmede engel teşkil etmektedir. Bu bağlamda, biyosensörler uygun alternatif veya tamamlayıcı analitik araçlar olarak görülmektedir.
Teknolojik gelişmenin bir sonucu olarak, endüstriyel kimyasallar ve yan ürünler çevre kirliliğinin artmasına sebep olmuştur. Pestisitler, ağır metaller veya poliklorlu bifeniller (PCB)'ler çevrenin kalitesini etkilediği bilinen zararlı kirleticilerdir. Organofosfor ve karbamat pestisitler için, kolin oksidazın aktivitesine dayanan ve asetil kolinesteraz (AChE) ve butirilkolinesterazın (BChE) inhibisyonu üzerine çeşitli enzimatik biyosensörler geliştirilmiştir (Andres ve Narayanaswamy, 1997; Ivanov ve ark., 2000; Choi ve ark., 2001; Andreou ve Clonis, 2002).
Biyosensörler, yalnızca metal iyonlarının tehlikeli fraksiyonlarıyla reaksiyona girme yetenekleri sayesinde, genel toksisite ve spesifik toksik metalleri algılamak için de kullanılmaktadır (Amaro ve ark., 2011). Ağır metallerin belirlenmesi için, Ivask ve arkadaşları tarafından kullanılan rekombinant lüminesan bakteriyel sensör gibi, sadece metal iyonlarının mevcut fraksiyonuna tepki verebilen tam hücreli biyosensörler de geliştirilmiştir (Ramanathan ve ark., 1997; Ivask ve ark., 2002). Diğer bilinen kirleticiler PCB'ler ve dioksinler (Shimomura ve ark., 2001) fenoller ; (Parellada ve ark., 1998), yüzey aktif maddeler (Nomura ve ark., 1998) ve polisiklik aromatik hidrokarbonlar (PAH), günümüzde biyosensörler tarafından tespit edilebilmektedir (Alarie ve ark., 1990; Pathirana ve ark., 2000; Koubova ve ark., 2001). Belirli kimyasal analizlere ek olarak, biyokimyasal oksijen ihtiyacı (BOD) gibi genel kalite parametrelerinin hızlı belirlenmesi ve patojenik organizmalar tarafından biyolojik kontaminasyonun değerlendirilmesi, biyosensör bazlı yöntemler ile mümkündür. BOD ve atık su için ticari biyosensörler Liu ve Mattiasson (2002) çalışmasında rapor edilmiştir.
13
2.2.3. Biyosensörün Askeri Alanda Kullanımı
Son yıllarda teknolojinin hızla gelişmesiyle hayatımızın birçok alanında değişimler yaşanmıştır. Askeri alanda yaşanan değişim ve gelişmeler ise insan hayatını yakından ilgilendirmektedir. Savaşlar mızrağın keşfi ile başlayıp, biyolojik ve kimyasal lazer silahlarının keşfi ile son noktaya gelmiştir. Askeri teçhizat ve silah yapısındaki değişimler ve teknoloji geliştikçe değişmeye devam edecektir. Savaşların yıkımı biyolojik ve kimyasal silahların kullanılmasıyla birlikte daha da artmıştır (Astan, 2015). Biyosensörler, biyolojik saldırılara karşı önem almak için askeriyede kullanılmaktadır. Bu tür biyosensörlerin amacı, biyomüfer ajanlar (BWA), yani bakteriler, toksinler ve virüsler olarak adlandırılan gerçek zamanlı olarak tehdit oluşturan organizmaları hassas ve seçici bir şekilde tanımlamaktır.
2.2.4. Biyosensörlerin Gıda Alanında Kullanımı
Günümüzde, gıda kalitesini ve güvenliğini sağlayan kontrol sistemlerinin geliştirilmesine yönelik çeşitli araştırmalar yapılmaktadır. Son 30 yılda önemli bir küresel nüfus artışına işaret eden tahminlere bağlı olarak gıda kontrolündeki farkındalık artmıştır (Anonim, 2004).
Gıda endüstrisinde ürünlerin bakımı ve işlenmesi gıda ürünlerinin kalite ve güvenliğini önemli ölçüde etkilemektedir. Geleneksel teknikler olarak bilenen spektroskopi ve kimyasal deneyler, insan gücüne dayalı olduğu için birçok dezavantaja sahiptir. Ayrıca bu teknikler, pahalı ve zaman alıcıdır. Gıda endüstrisi için gıdaların doğru ve tarafsız bir şekilde ölçülebilmesi için alternatif tekniklerin uygun maliyetli olması tercih edilmektedir. Basit, gerçek zamanlı, seçici ve ucuz tekniklere olan talebe karşılık cevaben biyosensörler geliştirilmiştir (Scognamiglio ve ark., 2014).
Gıda kalitesi terimi; görünüm, tat, koku, besin değeri içeriği, fonksiyonel bileşenler, tazelik, lezzet, doku ve kimyasallarla ilgilidir. Gıda bileşiminin analizi, gıdaları karakterize etmemizi ve doğal bileşenler (şekerler, amino asitler ve alkoller) ve katkı maddeleri (vitaminler ve mineraller) dahil olmak üzere istenen tüm bileşenleri içerdiğini kanıtlamamızı sağlamaktadır.
14
Ayrıca, gıda bileşiminin değerlendirilmesi, ürünlerin tazeliği hakkında kapsamlı bir tahminde bulunulmasını sağlar ve hasar sonucu oluşan mikroorganizmaların ve toksinlerin varlığını veya konsantrasyonunu açığa çıkarmaktadır. Gıda güvenliği kavramı, tüketiciye risk teşkil etmeyen gıdaların üretimi ve ticarileştirilmesini gerektirdiğinden, alerjenlerden, böcek ilaçlarından, gübrelerden, ağır metallerden, organik bileşiklerden, patojenlerden ve toksinlerden arındırılmış olmalıdır. Bu kirletici maddeler, insan sağlığı ve refahını ciddi şekilde etkilemektedir. Güvenli olmayan veya kalitesiz ürünlere neden olan tehditleri en aza indirgemek için prosedürler, denetimler ve kontrol sistemlerini belirlemek ve kurmak gerekmektedir (Mehrotra, 2016).
Gıda analizine yönelik geleneksel metodolojiler, yüksek güvenilirlik ve çok düşük tespit limitleri (LOD) sağlar. Bunların arasında kromatografi, spektrofotometri, elektroforez, immünolojik testler, polimeraz zincir reaksiyonu (PCR) testleri ve adenozin trifosfat (ATP) saptama yöntemleri 24 saat içinde sonuç verir, ancak bunlar pahalı ve zaman alıcıdır ve laboratuvarlara gönderilmesi gereken numunelere ihtiyaç duyar. Ayrıca, bu testlerin çoğu eğitimli personele ihtiyaç duymaktadır. Bu nedenlerle, gerçek zamanlı izleme için güçlü, hızlı, uygun maliyetli alternatif teknolojilere olan talep artmaktadır (Sezgintürk ve ark., 2012). Bu sebeple, gıda bileşenlerinin ve su ürünlerindeki kimyasal türlerin saptanması için çeşitli biyosensörler tasarlanmış ve gerçekleştirilmiştir (Arduini ve ark., 2010).
Ghasemi-Varnamkhasti ve ark. (2012), kobalt ftalosiyanine dayanan, enzimatik biyosensörler kullanarak bira yaşlanmasının izlenmesinde çalışmışlardır. Bu biyosensörler depolama sırasında biranın yaşlanmasını izlemek için kullanılacak iyi bir çalışma olmuştur.
Gıdalardaki patojenlerin tespiti için de biyosensörler kullanılmaktadır (Arora ve ark., 2011). Escherichia coli'nin sebzelerde bulunması gıdalarda fekal kirlenmenin yani dışkı kaynaklı kirlenmenin bir biyoindikatörüdür. E.coli, potansiyometrik dönüşümlü biyoalgılama sistemleri kullanılarak amonyağın neden olduğu pH değerinin saptanmasıyla ölçülmüştür (Ercole ve ark., 2003; Torun ve ark., 2012).
Süt bebekler ve gençler için önemli bir besin maddesidir (Padilla ve ark., 2004; Zhang ve ark., 2005). Pestisit ile kirlenmiş süt insan sağlığı için ciddi endişeler oluşturmaktadır. Süt gibi gıda maddelerinde nörotoksik pestisitlerin hızla taranması için
15
oldukça hassas tekniklere ihtiyaç duyulmaktadır. Mishra ve ark. (2012) bu ihtiyacı karşılamak için süt endüstrisinde enzimatik biyosensörler kullanarak bir çalışma gerçekleştirmiştir. Ekran baskılı karbon elektrota dayalı biyosensör, bir akış hücresine entegre edilip ve enzimler bir foto çapraz bağlanabilir polimerde immobilize edilerek elektrotlar üzerinde sabitlenmektedir. Otomatik akış bazlı biyosensör ile sütte üç organofosfat pestisiti ölçülmektedir.
Tatlandırıcılar, günlük yaşamımızda genellikle gıda katkı maddeleri olarak kullanılmaktadır. Günümüzde yaygın olarak kullanılan popüler gıda katkı maddeleri olan tatlandırıcılar, diş çürüğü, kardiyovasküler hastalıklar, obezite ve tip-2 diyabet gibi istenmeyen hastalıklara neden olmaktadır. Bu nedenle, tatlandırıcıların tespiti ve ölçümü gıda güvenliği için ciddi öneme sahiptir. Zhang ve ark. (2014) çalışmasında, hem doğal hem de yapay tatlandırıcılar içeren farklı tatlandırıcıları ölçmek ve analiz etmek için bir tat biyosensörü kullanılmıştır. Çok kanallı biyosensörler tarafından tat epitelinden elektrofizyolojik aktiviteler tespit edilmiş ve spatiotemporal yöntemlerle tatlandırıcılar analiz edilmiştir.
2.3. Bal
Bal, bitkilerden sızan sıvıların oluşturduğu ve bitki emici böceklerden arındırılmış bitki nektarlarının bal arıları (Apis mellifera) tarafından toplanmasıyla oluşur. İçerisinde ağırlıklı olarak karbonhidrat, su, organik asit, enzim, amino asit, pigment, polen ve balmumu bulunduran karmaşık doğal tatlı gıda maddesidir. Bal, ana sakkaritler olarak fruktoz ve glikoz içeren aşırı doygun bir şeker çözeltisidir ve aynı zamanda tatlandırıcı olarak da tüketilir (Karimov ve ark., 2014; de Oliveira Neto ve ark., 2017).
Bal, doğal bir gıda ürünü olduğu için ve yapısında bulundurduğu şeker, enzim, amino asitler, organik asitler, karotenoidler, vitaminler ve mineraller gibi maddelerden dolayı son yıllarda tüketimi artmıştır. Önemli bir antioksidan etkiye sahip olduğundan dolayı birçok içecek ve gıda maddesinde gıda katkı maddesi olarak kullanılır (Pasias ve ark., 2017).
Bal, çeşitli biyolojik etkilere sahip olan ve doğal antioksidanlar gibi davranan flavonoidler ve fenolik asitler bakımından zengindir. Balın bileşimi, rengi, aroması ve lezzeti ağırlıklı olarak çiçekler, coğrafi bölgeler, iklim ve bal arısı türleri ve ayrıca hava
16
koşulları, işleme, paketleme ve depolama süresinden etkilenir (da Silva ve ark., 2016). Ayrıca, bal kalitesini artırmak için arıcılık tekniklerinin, imalat prosedürlerinin ve muhafaza işlemlerinin standardizasyonu ve rasyonalizasyonu için gerekli tedbirlerin alınması oldukça önemlidir (Kahraman ve ark., 2010).
2.4. Bal Çeşitleri
Bal arıları (Apis mellifera) tarafından oluşturulan bal, arıların kullandığı kaynağa göre ikiye ayrılır. Bal arıları bitki çiçeklerinden topladıkları nektarlarla balı oluşturuyorsa bu bala çiçek balı denir ıhlamur balı, yonca balı, pamuk balı, kekik balı, akasya balı ve funda balı çiçek balına örnek ballardır. Salgı balı ise bitkilerin canlı bölümlerinden yararlanarak bazı böceklerin salgıladığı salgıları bal arılarının kullanmasıyla oluşan bal türüdür. Salgı balına örnek ballar ise, çam balı, meşe balı ve köknar balıdır (Anonim, 2002).
Ballar kaynağına göre sınıflandırıldığı gibi hammaddesine ve piyasaya sunulmasına göre de sınıflandırılmaktadır. Kaynağına göre çiçek ve salgı balı olarak sınıflandırılır. Salgı balları mineral bakımından diğer ballara oranla daha zengindir ve tedavi amaçlı olarak da kullanılabilirler. Ayrıca kristalize olmamaları da bir diğer özelliğidir. Süzme bal, petek balı ve pres balda piyasaya sunulma şekline göre sınıflandırılan ballar arasında yer almaktadır (Anonim, 2002).
Bal ülkemizde doğrudan tüketildiği gibi çeşitli gıdaların üretiminde bir bileşen olarak da kullanılmaktadır. Bu yüzden gıda endüstrisinde geniş uygulama alanına sahiptir (Güler, 2005).
Bal türleri birbirinden farklı fiziksel ve kimyasal özelliklere sahiptir. Singh ve Bath (1997)'ın yaptığı çalışmada Hindistan'da üretilen en popüler türdeki balların kimyasal bileşimi, akış davranış indeksleri ve balların genel olarak kabul edilebilirliği araştırılmıştır. Trifolium balı, özgül ağırlık, diyastaz sayısı, toplam asitlik, serbest yağ asitleri içeriği ve tutarlılık katsayısı gibi kabul edilebilirlik parametrelerine en yüksek oranda uyumluluk göstermiştir. Bununla birlikte, Eucalyptus lanceolatus balı, lakton ve iletkenlik için kabul edilebilir en yakın sayısal değerleri vermiştir. Ayrıca hidroksimetil furfural (HMF) oluşum hızı da bal çeşitlerine göre farklılık göstermiştir. Trifolium balında HMF oluşum hızının en hızlı olduğu, bu sırayı Eucalyptus lanceolatus ve
17
Brassica juncea balının izlediği görülmüştür. Çizelge 2-2 ve Çizelge 2-3’te üç farklı bal
örneğine ait fiziksel ve kimyasal özellikler verilmiştir. Bal Çeşitleri Yoğunluk
(g/cm3)
Diyastaz Nem(%) Renk (O.D) Briks
(mg/100g)
Trifolium 1,49 32,5 18,7 2,0 100
E. lanceolatus 1,45 23,3 19,4 1,65 200
B. juncea 1,35 8,5 21,8 0,82 400
Çizelge 2-2 Bal çeşitlerinin fizikokimyasal özellikleri (Sing ve Bath., 1997)
Bal Çeşitleri Serbest Asitlik (meq
/kg)
Lakton Toplam asitlik (meq / kg) pH İletkenlik (ohm) Trifolium 26,5 15,0 41,5 4,1 0,82 E. lanceolatus 9,5 21,5 31,0 4,76 1,04 B. juncea 14,5 15,0 29,5 4,25 0,24
Çizelge 2-3 Bal çeşitlerinin kimyasal özellikleri (Sing ve Bath., 1997) 2.5. Balın Fiziksel Özellikleri
Balın kalitesini belirlemek için çeşitli parametreler kullanılır. Bunlardan balın rengi, viskozitesi ve kristalleşmesi balın kalite düzeyini belirlemek için kullanılan önemli fiziksel karakterlerdir (Aparna ve Rajalakshmi, 1999).
Bala uygulanan işlemler sırasında balın fiziksel özelliklerinde değişimler meydana gelir. Balın fiziksel özellikleri balın depolanma süresinden, depolanma koşullarından, üretilme esnasında ve sonrasında uygulanan ısıl işlemden etkilenir (Aparna ve Rajalakshmi, 1999).
2.5.1. Renk
Renk, balın ilk çekici özniteliğidir ve bu nedenle balın ticarileştirilmesi için çok önemlidir. Tüketiciler tarafından balın kabulü ve tercihinde önemli bir parametredir (Gámbaro ve ark., 2007).
Bal arılarının kullandığı hammadde kaynağına göre veya balın oluşma şekline göre balın rengi değişkenlik gösterir; balın rengi su beyazından koyu kahverengi rengine kadar çeşitli renklerde oluşabilir (Anonim, 2002). En yaygın bal rengi parlak sarı,
18
kırmızımsı veya yeşilimsi renktedir. Ayrıca, balın doğal rengi, bitki kökenli, mineral bileşimi, iklim, kovan sıcaklığı, depolama koşulları vb. gibi çeşitli faktörlerden etkilenir. Yüksek mineral içeriği olan doğal ballar daha koyu renktedir (Gámbaro ve ark., 2007). Birçok ülkede bal fiyatı balın rengiyle ilgilidir. Açık renkli ballar genelde daha yüksek fiyata sahiptir, ancak bazı bölgelerde koyu renkli ballar da tercih edilmektedir (Tuberoso ve ark., 2014). Bu durum, tüketicilerin tercihlerinin balların renklerine göre değişebileceğini gösterir.
Balın doğal renkte oluşabilmesi için, üreticiler sağlıklı arı kovanları kullanılmalı ve balın içerisinde bulunan doğal organik ve inorganik maddelere zarar verici herhangi bir yabancı madde karıştırmamalıdır (Anonim, 2002).
Boussaid ve ark. (2014)'ın yaptığı çalışmada Tunus'un farklı bölgelerinden alınan altı bal örneğini değerlendirilmiş ve 36,64 ile 51,37 arasında açıklık değerleri (L*
) bulunmuştur. Analiz edilen ballar arasında turuncu, sarı ve yeşil renkler bulunmuştur. En yüksek açıklık değerleri çok koyu renkte olan nane balında bulunmuştur. Ayrıca, bu çalışmada Tunus ballarının renginin soluk sarıdan koyu kahverengiye kadar çok değişken olduğu gösterilmiştir.
2.5.2. Viskozite
Reoloji, yani akış bilimi, katı maddelerin deformasyonunu sıvı maddelerin ise akış özelliklerini belirlemek için kullanılan terimdir. Maddelerin reolojik davranışının belirlenmesi, maddelerin taşınması, pompalanması ve depolanması için önemlidir. Reoloji uygulaması, örneğin metalürjide (Zhou ve ark., 2001), polimer endüstrisinde (Barker ve Wilson, 2008), inşaat endüstrisinde (Tregger ve ark., 2010), jeoloji-madencilik endüstrisi (Burov, 2011) ve ilaç endüstrisinde (Çelebi, 2009) oldukça sık kullanılır. Reolojik özelliklerin araştırılması, reolojinin kalite kontrol özelliklerle ilişkili olduğu gıda endüstrisinde de özellikle bal içeren gıdalarda önemli bir rol oynamaktadır (Popek, 2002). Gıda maddelerinin reolojik özellikleri, işleme ve depolama süreçlerinde çok faydalıdır, çünkü viskozite diğer fizikokimyasal ve duyusal özelliklerle ilişkili önemli bir fiziksel özelliktir (Gómez-Díaz ve ark., 2009).
Viskozite sıvıların akışkanlığa gösterdiği direnç olarak tanımlanır. Sıvıların viskozitesi sıcaklığa ve içerdiği su oranına bağlı olarak değişir (Trávníček ve ark., 2012). Sıcaklık
19
artışı birçok sıvı maddenin viskozitesini düşürür, maddenin daha akışkan hale gelmesini sağlar.
Gómez-Díaz ve ark. (2009)'nın çalışmasında kullanılan 11 farklı bal numunesi İspanyol yerel pazarından elde edilmiştir ve bu balların viskozitesi, 7-55°C arasında değişen sıcaklıklar dikkate alarak belirlenmiştir. Viskozite üzerinde incelenen aralıktaki sıcaklıktan kaynaklanan etki, düşük sıcaklık aralığında daha önemliyken, yüksek sıcaklıkta viskozitede daha az değişiklik göstermiştir. Özellikle, çalışma sıcaklığı 25°C'nin altında olduğunda bu değişken dikkate alınmalıdır; çünkü bu değerin altında sıcaklıktaki küçük bir değişim viskozite değerinde yüksek değişimlere sebep olmaktadır.
Aparna ve Rajalakshmi (1999) tarafından yapılan çalışmada, Rheomat 15T cihazı kullanılarak belirlenen balların viskozitesinin 100-500 poise arasında değiştiği bulunmuştur. Balın reopektik özelliği esas olarak kristalize karbonhidratların ya da asılı katıların varlığına bağlıdır, oysa balın tiksotropik özelliği içerdiği proteinlerin varlığına bağlıdır.
2.5.3. Kristalizasyon
Bal, aşırı doymamış glikoz çözeltisidir ve oda sıcaklığında glikoz mono hidrat formunda kendiliğinden kristalleşme eğilimindedir. Balda bulunan glikoz, fruktoz oranına ve su miktarına bağlı olarak balın kristalleşme hızı değişir. Genellikle baldaki fruktoz miktarı glikozdan fazladır. Glikoz miktarı fruktoz miktarına yaklaştıkça balın kristalleşme hızı artar, glikoz ve fruktoz arasındaki fark arttıkça bal geç kristalleşir. Olgunlaşmamış ballarda sakaroz miktarı fazla glikoz miktarı daha düşük olduğu için kristalleşme yavaş olur olgunlaşmış ballarda ise daha düşük miktarda sakaroz bulunmaktadır (Önür ve ark., 2018).
Balda kristalleşme, "yapışkanlık" ve daha yüksek viskozite nedeniyle makinelerde işleme zorluklarına neden olduğu için birçok endüstriyel süreç için problemdir (Deora ve ark, 2013). Buna ek olarak, tüketiciler de tüketim için sıvı bal tercih ederler. Kristalleri eritmek veya sıvılaştırmak için ve kullanım sırasında kristalleşmeyi geciktirmek için ortak bir yaklaşım olarak üreticiler balı yüksek sıcaklıklarda ısıl işleme tabi tutarlar (Grabowski ve Klein, 2017).
20
Genellikle granülasyon olarak adlandırılan balın kristalleştirilmesi, sıvı balda istenmeyen bir işlemdir, çünkü bu durum balın dokusal özelliklerini etkiler, bu da balı tüketiciye daha az çekici hale getirir. Ayrıca glikoz granülasyonundan kaynaklanan en büyük problem, bu işlemle birlikte balda sıvı fazın oluşmasına ve nem artışı ile birlikte maya hücrelerinin çoğalmasına sebep olur ve sonuç olarak, balın fermantasyonuna neden olur (Doner, 1977). Bu işlemin gerçekleşme oranı, çeşitli bileşim parametrelerine (glikoz, fruktoz, nem ve su aktivitesi) ve işleme yöntemlerine bağlıdır. Bu sorunları çözmek için; ince tohum kristalleri kontrollü bir kristalleştirme işlemi altında büyümek için çekirdek gibi davranan sıvı bala eklenir. Bu uygulama indüktif granülasyon olarak bilinir (Doner, 1977).
2.6. Balın Kimyasal Özellikleri
Bal, bulundurduğu kimyasal bileşenlere göre analiz edilip tanımlanmaktadır. Bu bileşenlerin birçoğu, balın kalitesini, kristalleşmesini, lezzetini, besin ve tıbbi kalitesini etkilediğinden bal endüstrisi için büyük önem taşır. Bu nedenle, IHC balın bazı bileşenlerini kalite kriterleri olarak önermiştir ve bu kriterler için sınırlandırmalar yapılmıştır (Bogdanov ve ark., 1999). Bunlar arasında nem içeriği, elektrik iletkenliği, bireysel şekerler, indirgeyici şekerler, fruktoz ve glikoz miktarı, sakkaroz içeriği, mineraller, serbest asitlik, diyastaz, HMF, invertaz ve prolin gibi parametreler bulunmaktadır (Joshi ve ark., 2000).
Balın içeriği üretildiği iklim koşullarına coğrafik bölgeye, arıların cinsine ve arıların kullandığı çiçeklerin türüne göre değişir. Balların oluşturulduğu bölgeye ve değişen diğer özelliklere göre balların farklı kimyasal özellikleri vardır (Abu Tarboush ve ark., 1993). Balı oluşturan bileşenler ve değerleri Çizelge 2-4'te gösterilmiştir.
21
Balın Bileşenleri Çiçek Balı Salgı balı
Ortalama Değer Min-Max Değer Ortalama Değer Min-Max Değer
Su 17,2 15-20 16,3 15-20 Monosakkaritler Fruktoz 38,2 30-45 31,8 28-40 Glikoz 31,3 24-40 26,1 19-32 Sakkaroz 0,7 0,1-4,8 0,5 0,1-4,7 Diğer şekerler 5,0 2-8 4,0 1-6 Trisakkaritler Melezitoz <0,1 0,5-6 4,0 0,3-22,0 Erloz 0,8 0,5-1 1,0 0,1-6 Diğerleri 0,5 3,0 0,1-6 Tanımlanmayan oligosakkaritler 3,1 10,1 Mineraller 0,2 0,1-0,5 0,9 0,6-2,0 Aminoasitler 0,3 0,2-0,4 0,6 0,4-0,7 Asitler 0,5 0,2-0,8 1,1 0,8-1,5 pH değeri 3,9 3,5-4,5 5,2 4,5-6,5
Çizelge 2-4 Balın bileşimi (Bogdanov ve ark., 2008)
Balın kalite analizinde kullanılan en önemli kimyasal özellikler; briks değeri, diyastaz sayısı, nem oranı, pH değeri/asitlik, şeker miktarları ve HMF miktarıdır.
2.6.1. Balda Briks Değeri
Bir maddenin briks değeri suda çözünen kuru madde miktarını gösterir. Batu ve ark. (2013)’ya göre çiçek ballarında yapılan araştırmada bal örnekleri analiz edildiğinde briks için minimum değer % 84,24 olarak ölçülmüştür, maksimum değer % 81,24 iken ortalama değer ise % 82,99 ’dur.
Ayvaz (2017)’ın çalışmasında Türkiye'nin çeşitli bölgelerinden 59 farklı bal numunesi toplanarak briks analizi yapılmıştır. Yapılan bu çalışmada fourier dönüşümlü kızılötesi spektroskopisi (FTIR) ve yakın kızılötesi spektroskopisi (NIR) kullanıldı. Yakın kızılötesi spektroskopisi (NIR) sistemi ile yapılan briks analizleri kabul edilebilir değere yakınlık açısından daha iyi performans göstermiştir.
22 2.6.2. Balın Enzim Aktivitesi
Balı oluşturan en önemli yapılardan biri enzimlerdir. İşleme ve depolama sırasında balın ısıya maruz kalmasının bir ölçüsü olarak enzim aktivitesi kullanılır (Anklam, 1988). Doğal ve ısıl işlem görmemiş ballarda enzim miktarı yüksektir ve enzim değerinin yüksek olması balın kalitesini gösterir ve bu ballar insan sağlığı açısından değerlidir. Balın ısıtılma oranıyla enzim değerindeki azalma doğru orantılıdır. Bir bal ne kadar ısıtılırsa içerisindeki enzim oranı da o oranda azalır (Fuente ve ark., 2011).
Diyastaz, genellikle nektarda bulunur ve aynı zamanda bal arısı tarafından nektarın toplanması ve olgunlaşması sırasında eklenir. Bu nedenle, bal kalitesi için önemli bir parametre olan diyastaz sayısı, 1 saat içinde 1g bal içerisinde enzim tarafından hidrolize edilen % 1 nişasta ml'si olarak ifade edilen α-amilaz aktivitesidir (Küçük ve ark., 2007).
Balda diyastaz enziminin etkisi, eklenen nişastanın hidrolizine yol açar ve bu eylem, deneysel olarak enzim aktivitesini ölçmek için kullanılır. Nişasta hidrolizinden sonra nişasta içeriği, hekzos dehidrasyonu ve Maillard reaksiyonuyla (Bulut ve Kilic, 2009) iyot çözeltisi içerisinde (Küçük ve ark., 2007) mavi renkli kompleks verir. Balın işleme ve saklama esnasındaki yetersiz koşullar (sıcaklık, pH ve şeker içeriği), indirgeyici şekerlerin parçalanması ile renk değişimlerinin oluşturduğu farklı furfural türevlerinin konsantrasyonunu da arttırır. Örneğin, yüksek konsantrasyonda HMF balda koyu renge neden olur ve bal kalitesinin azaldığını gösterir (Bulut ve Kilic, 2009; Biluca ve ark., 2014).
Türk Gıda Kodeksi 2012/58 sayılı Bal Tebliği’ne göre diyastaz sayısı en az 8 olmalıdır. Yapısında doğal olarak az miktarda enzim bulunan ballarda bu sayı 3 olarak belirtilmiştir. Ayvaz (2017)’ın çalışmasında Türkiye'deki değişik bölgelerden toplanan 59 farklı bal numunesi için diyastaz sayısı 8,30-17,9 ve 13,09 aralığında tespit edilmiştir.
2.6.3. Balın Şeker Profili
Karbonhidratlar, karbon (C), oksijen (O) ve hidrojen (H) atomunun birleşmesiyle oluşur. Monosakkartiler, disakkaritler ve oligosakkaritler basit şekerler olarak sınıflandırılırken, polisakkaritler kompleks şekerlerdir. Üç çeşit monosakkarit şeker türü