T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ PATOLOJİ ANABİLİM DALI
BRCA-1 VE BRCA-2’DE SIK GÖRÜLEN NOKTA
MUTASYONLARININ BÖLGEMİZDE GÖRÜLME
SIKLIĞI
Dr. ARİF HAMİDİ TIPTA UZMANLIK TEZİ
T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ PATOLOJİ ANABİLİM DALI
BRCA-1 VE BRCA-2’DE SIK GÖRÜLEN NOKTA
MUTASYONLARININ BÖLGEMİZDE GÖRÜLME
SIKLIĞI
Dr. ARİF HAMİDİ TIPTA UZMANLIK TEZİ
TEZ YÖNETİCİSİ
Prof. Dr. HÜSEYİN BÜYÜKBAYRAM
ÖNSÖZ
Asistanlık eğitimim süresince yardım ve desteklerini esirgemeyen, bilimsel ve mesleki deneyimleri başta olmak üzere her konuda yol gösterici olan başta tez danışman hocam Prof. Dr. Hüseyin BÜYÜKBAYRAM’a, diğer hocalarım Doç. Dr. Uğur FIRAT, Doç. Dr. Selver ÖZŞENER ÖZEKİNCİ, Yrd. Doç. Dr. Ayşenur KELEŞ, Yrd. Doç. Dr. Gül TÜRKCÜ, Yrd. Doç. Dr. Ulaş ALABALIK, Yrd. Doç. Dr. İbrahim İBİLOĞLU, Yrd. Doç. Dr. Gülay AYDOĞDU, Yrd. Doç. Dr. Engin Deniz YILMAZ’a,
İstatistiksel değerlendirmede yardımcı olan Yrd. Doç. Dr.İsmail YILDIZ’a, Beraber çalışmaktan ve tanışmaktan mutluluk duyduğum arkadaşlarım Uz. Dr. Gülseren ÖZEL, Uz. Dr.Songül YERLİKAYA KAVAK, Uz. Dr. Yılmaz YILDIZ, Uz. Dr. Yahya AVCI, Uz. Dr. Şeyhmus KAYA, Arş. Gör. Dr. Berat SOYLU, Dr. Mansur ALA, Arş. Gör. Dr. Fatma Şule KUTLAR DURSUN, Arş. Gör. Dr. Nursel COŞKUNSEL, Arş, Gör. Dr. Mustafa NACİR’e
Çalışmamın DNA izolasyon aşamasına yardımcı olan arkadaşlarım teknisyen Neval TANIŞ ÖZDEMİR ve Biyolog Osman AKAMAN olmak üzere bölümümüzde çalışan tüm arkadaşlarıma,
Genetik konularda yardımlarını esirgemeyen Yrd. Doç. Dr. Sevgi İRTEGÜN, M.Ali TEKİN ve Irmak İÇEN’e
Bu tezin hazırlanmasında maddi destek sağlayan “Dicle Üniversitesi Bilimsel Araştırma Proje Koordinatörlüğü (DÜBAP)’ne (TIP.15.017 no lu proje),
Son olarak her dönemde manevi desteğini hissedeceğim bugünlere gelmemde büyük katkıları olan başta annem, rahmetli babam ve canım kardeşlerim olmak üzere tüm aileme teşekkürlerimi sunuyorum.
ÖZET
Dünya sağlık örgütünün verilerine göre meme kanseri dünyada kadınlar arasında en sık görülen malign tümör olup, tüm kadın kanserlerinin yaklaşık %25’ini oluşturmaktadır. Meme kanseri kadınlarda %14.7 ile ölüme en sık neden olan kanser tipidir. Her yaş grubunda görülebilmesine karşın genç yaşta ailesel olguların dışında nadir olarak görülmektedir. BRCA 1, 2 mutasyonları, nokta mutasyonlarından dolayı oluşan meme kanserlerinin çoğunluğunu ve genel meme kanserlerinin %3’ünden sorumlu tutulmaktadır. BRCA 1 ve BRCA 2 genlerinde kodlama bölgeleri boyunca dağılan yüzlerce farklı mutasyon bildirilmiştir. Bu mutasyonların belirlenmesinde bir çok metod kullanılmaktadır. Bunlardan biri de Real-time PCR yöntemidir.
Araştırmamızda Diyarbakır Dicle Üniversitesi Tıp fakültesi Patoloji Anabilim Dalında genç yaş (42 yaş altı) grubu kadınlarda meme kanseri tanısı almış 96 adet hasta değerlendirildi. Bu hastalara ait yaş, tümör lokalizasyonu, grade, ER, PR, HER-2 reseptör durumu ve rezeksiyon materyallerinde tümör çapı gibi parametreler değerlendirildi. Bu hastaların biyopsi ve rezeksiyon dokularına ait materyallerden elde edilen tümör dokularında, meme kanserinde sık olarak tespit edilen BRCA 1 (rs80357713, rs80357906, rs28897672) ve BRCA 2 (rs80359550) genlerine ait nokta mutasyonlarının bölgemizdeki sıklığını PCR özgül belirleme grubundan Hibridizasyon Prob Yöntemiyle “LightCycler” PCR cihazı kullanılarak belirlemeyi amaçladık.
Çalışmamızda elde ettiğimiz verilere göre 96 olgumuzdan sadece bir tanesinde BRCA 1 genine ait rs80357906 [5382insC] nokta mutasyonu saptadık. Bu sayı istatistiksel analizler için oldukça yetersiz bulunmuştur. Çalışmamızdaki olgu sayısı 96’dır. Literatürde yapılan çalışmalarla karşılaştırıldığında olgu sayımız oldukça azdır. Çalışmada heterojen bir hasta grubumuz vardı. Belirli bir histolojik tip veya moleküler alt tip ve spesifik gruplar belirlenip buna uygun olgu seçimi yapılarak çalışmanın tekrarlanması durumunda daha farklı sonuçlara ulaşılabileceği kanısındayız.
ABSTRACT
According to the World Health Organization, breast cancer is the most common malignant tumor among women in the world, accounts for approximately 25% of all female cancers. A breast cancer is a cancer type which is the most common cause of death in women with accounting for 14.7%. Its incidence increases with age. Even though breast cancer can be seen in all age groups, yet the familial cases usually seen at an early age. The etiology of breast cancer is multifactorial due to biological and clinical heterogeneity. BRCA 1,2 mutations account for the majority of the breast cancers caused by the point mutations, and for 3% of the general breast cancers. Hundreds of different mutations distributed throughout the coding regions in BRCA 1 and BRCA 2 genes have been reported. Many methods are used to identify these mutations. One of them is the real-time PCR.
In our study, we aimed to detect common mutations identified in women with breast cancer at young age (below 42 years old) who evaluated parameters such as ER, PR, HER 2, age, tumor localization, tunor diamater and grade presented to Diyarbakir Dicle University Department of Pathology and using "LightCycler" PCR machine by Roche with Hybdidization Probe Method from PCR SPecific determination group in order to identify common mutations including BRCA 1 (rs80357713, rs80357906, rs28897672) ve BRCA 2 (rs80359550).
According to our data, out of 96 cases we detected only one rs80357906 [5382insc] point mutations related to BRCA 1 gene family. This number has been quite insufficient for statistical analysis. The number of patients in this study was 96. Compared with studies in the literature, the number of our cases is quite small. We had a heterogeneous group of patients in the study. We beleive would have been possible to achieve to different results with repetition of study by choosing a particular histological type or molecular subtypes or specific groups of patients.
Simgeler ve Kısaltmalar Dizini
ATM: Ataxia Telangiectasia Mutated AR: Androgen reseptörBARD1: BRCA1 associated RING domain 1
BASC: BRCA1-associated genome surveillance complex
BRCA 1: Breast cancer 1, early onset (Erken başlangıçlı meme kanseri 1) BRCA 2: Breast cancer 2, early onset (Erken başlangıçlı meme kanseri 2) CHEK2: Checkpointkinase2
CDH1: Cadherin1 ER: Östrojen reseptörü
EGFR: Epidermal growth factor receptor FISH: Fluorescence in situ hybridization HER 2: Human epidermal growth factor NGS: Next generation sequencing
PALB2: Partner and Localizer of BRCA2 PCR: Polymerase chain reaction
PR: Progesteron reseptörü
İÇİNDEKİLER Sayfalar
Önsöz……….i
Özet ……….ii
İngilizce Özet (Abstract) ………...iv
Simgeler ve Kısaltmalar Dizini ... vi
1. Giriş ve Amaç ……….……...1
2. Genel Bilgiler ……….………...3
2.1. Memenin embriyolojik gelişimi………..……….………..3
2.2. Meme Anatomisi .………..………...4 2.3. Meme Histolojisi ..………..…………..,...5 2.4. Meme Kanseri .…..…………..,...9 2.4.1 İnsidans……...9 2.4.2 Epidemiyoloji...9 2.4.3 Etyoloji ve Patogenez..……….…………...13
2.4.4 Sporadik meme kanseri……...13
2.4.5 Herediter meme kanseri ………...13
2.4.6. Meme kanserinde rol oynayan genler…...14
2.4.6.1 Meme kanserinde rol oynayan onkogenler……..……14
2.4.6.2 Meme kanserinde rol oynayan tümör supresör genler………..….15
2.4.7. BRCA 1 ve BRCA 2 geni……….………18
2.4.8. Meme Tümörlerinde Prognostik Faktörler………...………20
2.4.9. Meme Tümörlerinin Sınıflandırılması……….…….21
2.5. Meme Tümörlerinde Prognostik Faktörler………...29
3.Gereç ve Yöntem……….36
3.1. Parafine Gömülü Dokulardan Genomik DNA İzolasyonu………..36
3.2 DNA Saflığının Belirlenmesi ve Konsantrasyon Hesaplanması.………..38
3.3. BRCA 1 ve BRCA 2 Gen Mutasyonlarının Real-Time PCR ile Belirlenmesi………38
3.4. İstatistiksel Yöntem..………....41
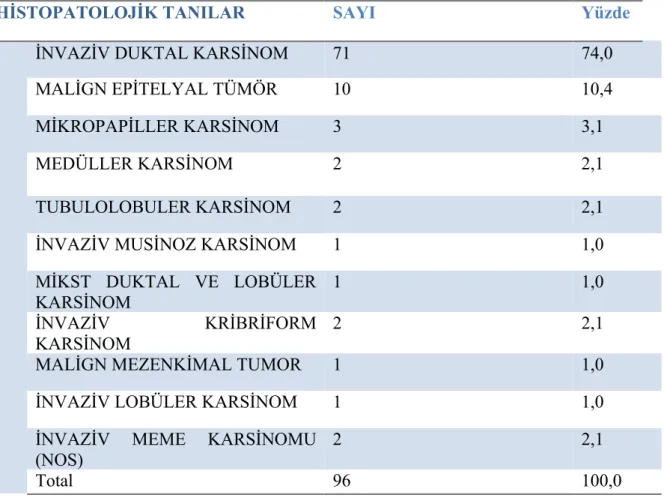
4.Bulgular………45
5.Tartışma ve Sonuç………53
1.GİRİŞ VE AMAÇ
Meme kanseri dünyada kadınlarda en sık görülen malign tümördür. Kadınlarda görülen tüm kanserlerin yaklaşık %23’ ünü meme kanserleri oluşturmaktadır. Meme kanserinin dünyada ortalama insidansı yüz binde 38-40 iken, Avrupa’da bu oran yüz binde 66-67, ülkemizde ise ortalama yüzbinde 40 civarındadır . İnvaziv duktal karsinom en sık görülen meme kanseri olup meme kanserlerinin %70-80’ini oluşturmaktadır. Meme kanseri 30 yaştan önce nadir görülür, ancak reprodüktif dönemde hızlı bir artış gösterir, menopoz sonrasında daha düşük bir ivmeyle artış devam eder . Dünya’da en çok tanı konulan kanserler akciğer (%13,0), meme (%11,9) ve kolon (%9,7) iken kanserden ölümlerin ise en çok akciğer (%19,4), karaciğer (%9,1) ve mideden (%8,8) gerçekleştiği belirtilmiştir . Uluslararası Kanser Ajansı özellikle meme kanserindeki artışa dikkat çekmiştir. Kadınlarda meme kanser insidansının bir önceki tahminlere göre %20, meme kanserinden ölümlerin ise %14 arttığını belirtmiştir. Meme kanseri kadın kanserleri içinde en fazla görülen ve en fazla ölüme neden olan kanserdir. Dünyada kanser olan her 4 kadından biri meme kanseridir. Meme kanseri insidansı gelişmiş ülkelerde gelişmekte olan ülkelere göre daha yüksek, meme kanserinden ölüm ise gelişmiş ülkelerde gelişmekte olan ülkelere göre daha düşüktür . Meme karsinomu tanısındaki bu keskin artışın, tarama programlarının hayata geçirilmesi, özellikle mamografinin geniş kullanım alanı bulmasına bağlı olduğu düşünülmektedir. Artık bir çok vaka 2 cm’den küçük ve/veya in situ formda yakalanabilmektedir. Tanı ve tedavideki ilerleme ile beraber meme kanserinden korunma stratejileri ve kanser gelişiminde artmış riskin belirleyicilerini belirlemeye yönelik olan çalışmalar artış göstermiştir .
Meme kanserinin histolojik subtipleri çok geniş bir yelpazede ele alınmış, heterojen bir hastalık grubudur. Klinik ve prognoz hastalar arasında farklılıklar arz eder. Tümörün büyüklüğü, histolojik derecesi ve aksiller lenf nodu metastazı gibi kriterlerin prognozu belirlemede yol gösterici olduğu belirlenmiştir .
Meme kanseri için major risk faktörleri yaş, cinsiyet, geçirilmiş meme hastalığı, ailede meme kanseri öyküsü ve genetik yatkınlık olarak belirlenmiştir. Meme kanseri oluşumunda bir çok tümör supresör genler, onkogenler ve DNA tamir genleri rol oynar. EGFR, HER-2/neu, Ras, c-Myc, Siklinler, siklin bağımlı kinazlar ve
inhibitörleri kanserde etkili onkogenlerdendir. Tümör supresör genlerden p53, ATM, PTEN, BRCA1 ve BRCA2 genlerinin meme kanserine yol açtığı belirlenmiştir. Meme kanserlerinin büyük çoğunluğu sporadik vakalar olarak görülürken, tüm olguların % 5–10’unu kalıtsal nedenli ailesel meme kanseri oluşturur. BRCA geninin keşfedilmesinden sonra yapılan çalışmalar sonucu BRCA1 ve BRCA2 genlerinin mutasyonunun tüm ailesel kanserlerin %40-50’sinden sorumlu olduğu ortaya konmuştur .
1990 yılında uluslararası destekli çalışmalarda, BRCA1 kromozom 17q ile bağlantılı bulundu ve 1994 yılında klonlandı . BRCA1 geni; enbüyük ekzon bölgesi 11 olan 24 ekzonluk büyük bir gendir. Mutasyonlar genelde genin kodlama sekansı boyunca bulunan ve kırılmış proteinlerle sonuçlanan çerçeve kayması şeklinde bulunur. Yüzden fazla spesifik patolojik BRCA 1 mutasyonu tanımlanmasına rağmen belirli topluluklardaki mutasyonlar ortaktır. Mesela aşkenazi yahudilerinde, c.68_69delAG ve c.5266dupC (daha önce 185delAG/5382insC) nüfusun yaklaşık %1,2’ sinde ortaya çıkmıştır. c.5266dupC mutasyonu ayrıca diğer Doğu Avrupa popülasyonlarında özellikle Polonya’da sık görülmüştür .
Çalışmamızda 2010-2015 yılları arasında Dicle Üniversitesi Tıp Fakültesi Patoloji Anabilim Dalında tanı almış, 45 yaş altı meme kanserinin çeşitli histolojik alt tipleriyle tanılı 96 vakaya BRCA1 ve BRCA2’ de bazı popülasyonlarda arttığı gözlenen toplam 4 adet nokta mutasyonun varlığını araştırmayı amaçladık.
2.GENEL BİLGİLER
2.1. Memenin embriyolojik gelişimi
Meme bezleri gebeliğin beşinci haftasında, primitif süt çizgisi olarak, epidermisin bant benzeri kalınlaşmayla kendini gösterir. Yedi haftalık embriyoda bu çizgi, aksilladan inguinal bölgeye kadar uzanır. Daha sonra bu bandın büyük kısmı regrese olur ve torakopektoral bölgede meme kabartısı şeklinde küçük bir bölüm olarak kalır. Ektopik meme dokusu Süt çizgisinin artıklarından aksilla ve vulva başta olmak üzere gelişebilir. Glandüler yapılar 7-8. haftada farklılaşmaya başlayıp daha sonra göğüs duvarı mezenkimine invajinasyon (disk evresi), üç boyutlu büyüme (küre evresi) ve 10-14. haftalarda koni evresi oluşur. 12-16. haftada göğüs duvarındaki mezenkimal hücrelerin diferansiasyonu ile meme başı ve areolanın düz kası meydana gelir. 16. haftada epitelyal tomurcuk ve gelecekteki sekretuar alveolü oluşturacak epitelin 16-24 filizin dallanması ortaya çıkar. Memenin bu gelişiminin hormonlardan bağımsız olarak gerçekleşildiği düşünülmektedir. Üçüncü trimesterde fetal dolaşıma giren plasental steroid hormonlar dallanmış epitelyal dokunun kanalizasyonunu ortaya çıkartır. Parankimal diferansiyasyon 32-40. haftalar arasında oluşur. Termdeki fetusta 16-24 meme duktusu meydana gelmiştir. Doğumda, ana duktus, dallanan duktuslar ve az sayıda lobüler ünite görülebilir . Terme yakın dönemde fetal meme dokusu maternal ve plasental steroidlerden ve prolaktinden etkilenir ve kolostrum sekresyonu oluşur. Doğumda maternal seks steroidleri ve prolaktinin çekilmesi ile ve bu sekretuar aktivite hayatın 1. ayı veya 2. ayında sona erer. İnfantın cinsiyeti bu gelişim evresini etkilemez. Maternal steroidler ve prolaktin eksikliğinin devam etmesi ile glandlar basit duktular organizasyonlarına dönerler. Bundan sonra meme dokusunun gelişimi ve diferansiasyonu, steroid ve peptit hormonlara ve büyüme faktörlerine bağlıdır . Memenin esas gelişimini sağlayan, pubertede testosteronun relatif yokluğudur. Meme dokusu tam olarak geliştikten sonra menopoza kadar menstrual siklus sırasında ve gebelikte döneminde çeşitli değişiklikler gösterir. Menopozda ise parankimal lobuloalveoler yapıların regresyonu ile karakterli involüsyonel değişiklikler meydana gelir .
2.2. Meme Anatomisi
Meme pektoralis majör kasının önünde ön göğüs duvarında yer almaktadır ve tipik olarak vertikal aksta ikinci kottan altıncı kota ve horizontal aksta sternum kenarından orta aksiller çizgiye uzanım göstermektedir. Spence kuyruğu olarak meme dokusu aksillaya da uzanım gösterebilir. Meme lateralde serratus anterior kası ve inferiorda eksternal oblik kas ve superior rektus kası kılıfı üzerinde seyreder. Yoğun fibröz doku demetleri olan, Cooper asıcı ligamanları deriden pektoral fasyaya uzanır ve memeye destek yapı oluşturur. Memenin anatomik olarak iyi tanımlanmış sınırı pektoral fasyayla birleştiği derin yüzüdür, mikroskobik bez dokusu pektoral fasyaya girebilir hatta aşabilir. Bu durum total mastektomi olgularında tüm meme dokusunun çıkarılmasıyla son bulmamasını açıklamaktadır . Meme, tubuloalveolar tipte bezlerin oluşturduğu ortalama 15-20 lobdan meydana gelen, modifiye aksesuar bir ter bezidir. Santralinde 6. interkostal aralık hizasında meme başı ve bunun çevresinde pigmente bir alan olan areola yapısı mevcuttur .
Her bir meme; üst dış kadran, alt dış kadran, üst iç kadran, alt iç kadran ve areola olmak üzere bölümlere ayrılarak değerlendirilmektedir. Meme dokusunun ana kitlesi genellikle üst yarıda ve daha çok dış kadranda yer alır. Bu nedenle, meme kanseri ve başlıca benign lezyonlar daha çok bu kadranda tespit edilmektedir .
Meme; internal mammarian (torasik); interkostal, aksiller ve torakoakromial arterin pektoral dallarından beslenir. Bu damarlanmalar değişik varyasyonlar gösterir ve her iki memede simetrik değildir. Venleri de değişik varyasyonlar göstermekle beraber interkostal, aksiller, internal mammarian (torasik) venlerden oluşmaktadır. Meme dokusu innervasyonları 2-6. interkostal sinirlerin dallar ile sağlanır, üst bölümünün az bir alanındaki deri ise supraklaviküler sinir dallarından innerve olur. Memenin lenf drenajı yaklaşık %75-95’i aksiller lenf düğümlerine, %5-25’i internal mammarian lenf düğümlerine, çok az bir kısmı ise kostavertebral ekleme yakın
alandaki posterior interkostal lenf düğümlerine drene olur. Lenfatik sistem anatomik olarak üç bölgeye ayrılır .
Level 1: Pektoralis minörün lateral kenarının yanında, alt kenarının altında, aksiler ven boyunca uzanan lenf düğümleridir. Mammaria eksterna, aksiller ven ve skapuler lenf düğümü gruplarını içermektedir.
Level 2: Pektoralis minör kasının arkasında, medial ve lateral sınırları arasında uzanmakta olup, santral bölge lenf düğümlerini içerir.
Level 3: Pektoralis minör kasının medial sınırının medialinde ve superiorunda sıralanıp, subklaviküler, intraklaviküler, apikal lenf düğümlerini içerir.
Rotter lenf düğümleri: Pektoralis major ve minör arasında bulunur.
İnternal mammarian lenf düğümleri: İntertorasik lenf nodları olarak da adlandırılan bu düğümcükler parasternal bölgede, interkostal aralıkta, internal mammar damarların medialinde uzanıp, lenfatik akımın %25 ‘ini sağlar .
2.3.Meme Histolojisi
Erişkin kadın memesi duktus ve asinus yapılardan oluşur. Asinuslar bir araya gelerek lobulleri oluşturur. Meme başında duktuslar laktiferöz sinüsleri oluşturmak üzere genişleyip buraya açılırlar. Bu sinüsler meme başının altında koni şeklinde genişleyerek son bulur. Duktus ve lobülüsler değişen oranda fibröz doku ve yağ dokudan oluşan stroma içerisinde yer alır. Laktasyonda olmayan erişkin memesinin çoğunluğunu stroma oluşturur, fibröz doku ve yağ doku oranı yaş ve bireye göre değişebilmektedir .
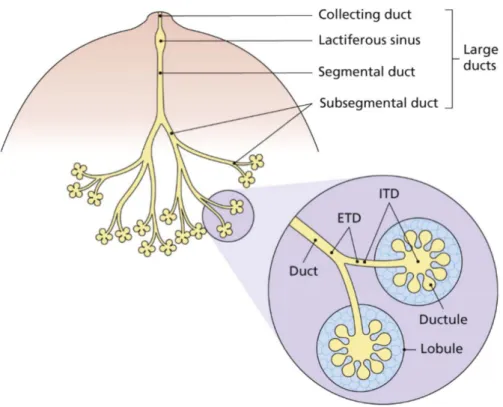
Duktal sistem: Meme ucundan sırası ile ana laktiferöz duktus, laktiferöz sinus, laktiferöz segmental duktus, subsegmental duktus, terminal duktus ve onun lobül içi dallarından meydana gelir. Ana laktiferöz duktuslar, meme başının deri yüzeyine açılır. Duktus orifisi ve duktusun küçük bir bölümü çok katlı yassı epitel ile döşeli olup, daha sonraki bölümü, laktiferöz sinus iki tabakalı küboidal epitel ile devam eder. Laktiferöz sinusdan sonraki duktusları ise içte tek sıralı epitel döşemekte olup, bu epitel silindirik ya da küboidal yapıdadır (Şekil 1,2) .
Meme lobülleri: Meme lobülü, her bir terminal duktusun küçük bir bölümü ve onun tomurcuklanması ile oluşan asinuslardan (duktüller) oluşur ve patolojik lezyonların çoğunun geliştiği bölge terminal düktüler lobüler ünit (TDLU) adını alır. Meme lobüllerinin boyutu ve lobül içindeki asinusların sayısı oldukça değişkendir. Asinuslar gebelik ve laktasyon dışında afonksiyoneldir. Asinuslar içte tek sıralı küboidal, dışta miyoepiteliyal hücreler ile döşelidir ve en dışta bazal membran mevcuttur .
Endometriumda olduğu gibi, her menstrüel siklusda memede az da olsa bazı morfolojik değişiklikler görülür. Folliküler fazda, lobüller rölatif olarak sakindir. Ovulasyondan sonra, progesteron düzeyindeki artışa bağlı olarak hücre proliferasyonu ve her bir lobüldeki asinus sayısı artmakla birlikte sitoplazmada vakuolizasyon gelişir. Lobül stromasında ödem belirginleşir, lenfosit sayısı artar, genelde memede premenstrüel dönemde hissedilir büyümeye neden olur. Menstrüasyonda, östrojen ve progesteron düzeyinin düşmesini epitel hücre ölümü (apoptoz) izler, stromal ödem, lenfositik infiltrasyon kaybolur, lobülün boyutu küçülür .
Gebelikte, hem morfolojik hem de fonksiyonel aktivite birliktedir. İlk 20 haftasında proliferatif aktivite, ikinci yarısında ise sekretuar ve laktasyonel değişiklikler artar, hücrelerde lipid ve sekretuar materyal belirir, miyoepiteliyal hücreler azalır. Gebeliğin sonunda, meme dokusunun hemen hemen tümü, ince bağ dokusu stroma ile birbirinden ayrılmış lobüllerden oluşur .
Doğumdan hemen sonra, prolaktin hormon etkisi ile süt sekresyonu başlar. Asinusların epiteli içinde ve lümende sekresyon birikir. Laktasyonun bitiminden sonra, meme lobüllerinde geri dönüş (involusyon) başlar, lobüller atrofiye olur, bu değişik sürede ve memede farklılıklar göstererek sürer. Lobül stromasında fibröz dokuda artış, hyalinizasyon, epitelde düzleşme, intralobüler stromada yağ ve bağ dokusu, lenfosit ve makrofajlarda artış görülür. Bazen tam regresyon olmayabilir, lobüllerde sayısal artış ve büyüklük kalabilir .
Meme dokusunda üçüncü dekattan sonra başlayan, menopozdan sonra daha da artan atrofi olur, lobüldeki asinusların epitel ve myoepitel hücreleri azalır, lümen daralır, bazal membran kalınlaşır, çevresinde kalın sklerotik, hiyalinize bağ dokusu bulunur, daha sonra lobül içi stroma hiyalinize nodüle dönüşür, memede yağ dokusu artar. Bazen meme dokusunda birkaç duktusda hafif, orta düzeyde kistik yapı gelişir ve ‘‘kistik atrofi’’ olarak isimlendirilir. Birçok yaşlı meme dokusunda, miyoepitelial hücrelerde belirginleşme meydana gelir, ayrıca hipertrofi ve hiperplazi görülür . Meme stroması: Memenin interlobüler geniş alanlarında, yağ dokusu ve yoğun kompakt fibrokonnektif doku bulunmaktadır. Lobül içi bağ dokusu ise daha gevşek, daha hücreseldir, bu stromanın özelleşmiş ve meme stromasının hormona duyarlı bölümü olduğu düşünülür, ince bir bant biçiminde duktusların çevresinde de devam eder .
Meme başı ve areola: Çok katlı yassı epitel ile örtülüdür. Epidermisde saydam hücreler bulunur, bu hücreler ‘Paget hücreleri’ ile karıştırılmamalıdır. Areolada çok sayıda sebase bezler (Montgomery bezleri) mevcuttur ve bunlar laktiferöz duktuslar ile ilişkili olup, gebelikte daha belirgin olmaya baslarlar. Montgomery tüberkülleri adı verilen kabartılar yapar ve meme başının yağlı olmasını sağlar. Meme başında ayrıca duktuslar çevresinde düz kaslar, sinir uçları, Meissner korpüskülleri, bazen meme asinusları da izlenmektedir .
Şekil 1 : Terminal düktüler lobuler unitin şematik görünümü
ETD: Ekstralobuler terminal dukt, ITD: İntralobuler terminal dukt.
2.4. Meme Kanseri 2.4.1. İnsidans :
Dünya sağlık örgütünün verilerine göre meme kanseri dünyada kadınlar arasında en sık görülen malign tümör olup, tüm kadın kanserlerinin yaklaşık %25’ini oluşturur. Dünyada her yıl 1.500.000’dan fazla kadın meme kanseri tanısı almaktadır. Kadınlarda %14.7 ile ölüme en sık neden olan kanser tipidir . Meme karsinomu tanısında özellikle 1980 yılından sonra belirgin bir artış gözlenmektedir. Bunun, mamografinin geniş kullanım alanı bulması ve yeni görüntüleme yöntemlerinin kullanılmasına bağlı olduğu düşünülmektedir . Böylece çoğu vaka daha 2 cm’den küçük ve/veya in situ formda iken tespit edilebilmektedir .
2.4.2. Epidemiyoloji:
Meme kanseri insidansı, bir çok epitelyal tümör gibi, yaşla birlikte paralel bir artış gösterir, her yaşta görülebilmesine karşın genç yaşta ailesel olguların dışında nadir olarak görülür. Dördüncü dekatta 1/231 iken yedinci dekatta 1/29’dur . İnsidans oranları dünyanın farklı bölgelerine göre neredeyse 4 kat değişkenlik göstermektedir.
Orta Afrika ve Doğu Asya'da 100.000 kişide 27 arasında değişkenlik gösterirken bu oran Kuzey Amerika'da 100.000 kişide 92’ye çıkmaktadır. Meme kanseri genel olarak kanserden dolayı ölümlerde 5.sırada yer alıyor (522.000 ölüm). Az gelişmiş yerlerde ise kansere bağlı ölümlerde 1.sıradadır (324.000 ölüm) (Toplam% 14.3). Şimdi ise daha gelişmiş bölgelerde kansere bağlı ölümlerde akciğerden sonra 2. sırada gelmektedir. (198.000 ölüm, % 15.4). Dünya bölgeleri arasında mortalite oranlarındaki dağılım, insidans oranlarındaki dağılımdan daha azdır. Bunun sebebi gelişmiş bölgelerdeki meme kanseri tedavisinin daha iyi sonuçlar vermesinden dolayıdır, ki bu oranlar Doğu Asya’da 100.000’de 6 iken Batı Afrika’da 100.000’de 20’dir. Hastalığa yakalanma riski hem gelişmekte olan hem de gelişmiş ülkelerde artmaya devam etmektedir .
Risk faktörleri:
Cinsiyet: En önemli risk faktörüdür. Erkeklerde meme kanseri görülme sıklığı yaklaşık olarak %1’dir .
Yaş: Meme kanseri 25 yaşın altında nadir olup, bu yaştan sonra risk menapoza kadar devamlı artar. Sonraki dönemde bunu yavaş bir yükselme izler. 75-80 yaş en yüksek risk düzeyi yaşıdır .
Menarş yaşı: Menarş yaşı 11 yaşından daha önce olanlarda, 14 yaşından sonra olanlara göre %20 oranında meme kanseri riski artmıştır. Geç menapoz da riski arttıran bir diğer faktördür .
İlk doğum yaşı: 20 yaşından önce ilk doğumu yapanlar, nullipar veya 35 yaşından sonra ilk doğum yapanlarla karşılaştırıldığında yarı yarıya daha az risk altındadırlar. Bu, Afro-Amerikan kadınlar için güçlü bir risk faktörü değildir .
Birinci derecede akrabalarda meme kanseri hikayesi: Kanserden etkilenmiş birinci derecede akraba (anne, kız kardeş veya kız) sayısı, özellikle genç hastalarda riski arttırır. Ancak çoğu kadında aile öyküsü yoktur. Meme kanseri olan hastaların sadece %13’ünde bir tane birinci derece akraba öyküsü mevcut olup, birden fazla
birinci derece akraba öyküsü oranı ise %1’dir. Buna karşılık, bir aile öyküsü olan kadınların %87’ inde meme kanserine yakalanma olmaz .
Atipik Hiperplazi: Önceki meme biyopsisinde atipik hiperplazi tanısı almış hatalarda risk artmıştır. Diğer proliferatif fakat atipi içermeyen lezyonlarda ise risk çok azdır .
Fibrokistik değişiklikler ve proliferatif hastalıklar: Fibrokistik değişikliklerde gözlenen epitel proliferasyonu geniş bir aralık göstermektedir. College of American Pathologists fibrokistik değişikliği olan vakaları gösterdikleri epitelyal proliferasyona göre dört gruba ayırmış olup gruplardaki kanser gelişme riski belirtilmiştir;
Grup 1: Hafif veya hiç hiperplazi göstermeyenlerde (Adenozis, duktal ektazi, fibroadenom, fibrozis, mastitis, atipisiz hiperplazi, kistler, basit apokrin metaplazi, skuamöz metaplazi) invaziv karsinom riski artmamaktadır.
Grup 2: Orta derecede hiperplazi gösterenlerde (kompleks fibroadenom, atipik orta-şiddetli hiperplazi, sklerozan adenozis, soliter papillom) risk 1,5-2 kat artmaktadır. Grup 3: Atipik duktal veya lobüler hiperplazi gösterenlerde risk 4-5 kat artmaktadır. Grup 4: Duktal veya lobüler karsinoma insitu olanlarda risk 8-10 kat artmaktadır . Proliferatif meme hastalığı artan risk ile birliktedir. Özellikle atipik hiperplazi önemli bir risk faktörü olarak karşımıza çıkar. Meme kanseri öyküsü olmayan kadınlarda riski 5 kat arttırır. Familyal öykü varlığında risk 11 kat artma eğilimi gösterir .
Irk: Amerika verilerine göre hispanik olmayan beyaz kadınlar en yüksek riske sahiptir. Önümüzdeki 20 yıl içinde 50 yaşında meme kanseri gelişme riski, bu grup için 1/15 iken Afro Amerikanlar için 1/20, Asya/ Pasifik adaları için 1/26, Hispanikler için 1/27 olarak öngörülmektedir. P53 mutasyonu Afro Amerikan kadınlarda genelde sıktır. Hispanik olmayan beyaz kadınlarla karşılaştırıldığında hispanik kadınlarda daha az görülür. Bu farklılıklarla, etnik gruplar arasındaki genetik varyasyonun meme kanserinden en azından kısmen sorumlu olduğu tahmin edilmektedir. Bir bilinen örnek de BRCA-1 ve BRCA-2 mutasyonlarının insidansının farklı etnik gruplarda farklı frekanslarda ortaya çıkmasıdır .
Ekzojen östrojen: Postmenapozal hormon replasman tedavisi, meme kanseri riskini 1,2 ila 1,7 kat arttırmaktadır. Oral kontraseptiflerin endometrium ve over kanseri riskini azalttığı kanıtlanmasına karşın meme kanseri gelişiminde riski arttırdığına yönelik ikna edici bir çalışma gösterilmemiştir .
Meme yoğunluğu: Direk grafide yüksek radiodansitite meme kanseri için güçlü bir faktördür. Dens memelerde direk grafide kanser tespiti zordur, bu tür hastalarda MR(Manyetik rezonans) yararlı bir yöntem olabilir .
Radyasyona maruz kalma: Radyasyon, DNA hasarına yol açarak karsinogenezisin erken evrelerinde etkili olur. Radyasyona maruz kalma sonucu ortaya çıkan meme kanserlerinde 10-15 yıl gibi uzun bir latent süre vardır . Memenin radyasyona maruz kalması; tedavi nedeniyle, atom bombası veya nükleer kazalar sebebiyle, meme kanseri riskini arttırır. Bu risk, 20-25 yaşından küçük genç hastalarda ve yüksek radyasyon dozuyla %30 oranında artar. 25 yaş üstü kadınlarda bu oran daha da düşüktür .
Karşı Meme ya da Endometrium Karsinomu varlığı: Karşı meme ya da endometrium karsinomunun varlığı meme kanseri riskini artırır. İnvaziv meme kanseri olan hastalarda diğer memede karsinom görülme riski genel popülasyona oranla 5 kat daha fazladır. Özellikle ailesel öyküsü olanlarda risk daha da yüksektir . Lobüler karsinomlu vakalarda bu risk %25-%50’ye yükselmektedir .
Coğrafyanın Etkileri: Meme kanserinin görülme oranı ülkeler arasında sayısız farklar gösterir. Asya ve diğer ülkelere kıyasla kanserin en yüksek görülme oranına sahip ABD ve Avrupa ülkelerinde, meme kanseri insidansı 4-7 kat daha fazladır . Diyet alışkanlığı: Büyük çalışmalar, meme kanser gelişme riski ile herhangi bir yiyeceğin korelasyonu arasındaki ilişki bulma konusunda başarısız olmuştur. Kafeinin meme kanser riskini azalttığı, orta veya ağır derecede alkol tüketiminin ise riski arttırdığı belirtilmiştir. Yüksek östrojen düzeyleri ve daha düşük folat düzeyleri bu ilişkiye sebep olabilir .
Obezite: Anovulatuar sikluslu ve siklusun geç döneminde düşük PR seviyelerine sahip 40 yaş altı şişman kadınlarda risk düşüktür. Postmenapozal şişman kadınlarda
ise risk artmıştır. Bu durumdan yağ depolarındaki östrojen sentezi sorumlu tutulmaktadır .
Egzersiz: Premenapozal kadınlarda, obez olmayan kadınlarda ve miadında gebelik geçirenlerde riski mükemmel bir biçimde azaltır .
Emzirme: Ne kadar uzun süreli olursa risk o ölçüde azalır. Laktasyon ovulasyonu baskılar .
Çevresel toksinler: Organoklorin pestisit gibi bazı çevresel kontaminasyonların östrojenik etki nedeniyle riski arttırdığı söylense de henüz kanıtlanmış bir çalışma yoktur .
Tütün: Sigaranın meme kanseri ile ilişkisi tam olarak saptanmamakla beraber periduktal mastit ile ilişkisi vardır .
2.4.3. Etiyoloji ve Patogenez
Biyolojik ve klinik heterojen özelliğe sahip olan meme kanserinin etyolojisi multifaktöriyeldir. Meme kanserinde oluşan denetimsiz hücre çoğalması genellikle genomik instabilite belirtileri ve belirli epitelyal özelliklerin ortadan kalkması gibi değişiklikler sergileyebilmektedir. Bu yüzden kanser gelişimine neden olan moleküler mekanizmaların ve her hastanın tümörünün özelliklerinin belirlenmesi ve buna en uygun tedavi yönteminin uygulanması büyük önem taşımaktadır. Risk faktörlerinin tamamı meme kanser etyolojisinde yer almakla beraber deney hayvanlarında ve in vitro meme tümörleri üzerinde yapılan çalışmalar, meme kanseri gelişiminde belli başlı üç etkenin; genetik, hormonal ve çevre olmak üzere önemli rol oynayabileceğini ortaya koymuştur .
Meme kanseri gelişiminde rol oynayan majör risk faktörleri hormon ve genetik yapıdır. Meme karsinomlarını bu yüzden, muhtemel hormonal maruziyet sonucu sporadik ve germline mutasyonla ilişkili herediter olarak ikiye ayırabiliriz .
Sporadik meme kanserinde temel risk faktörleri hormon maruziyeti ile ilişkili olmakla beraber cinsiyet, menarş ve menopoz yaşı, reproduktif öykü, emzirme ve ekzojen östrojenler diğer risk faktörleridir. Çoğu postmenopozal kadınlarda gelişir ve östrojen reseptörlerini daha fazla eksprese ederler. Östrojen, hem metabolitleri ile hem de DNA hasarı yapan serbest radikaller oluşturarak meme kanseri gelişiminde rol oynarlar. Ancak sporadik meme kanseri gelişiminde hormone maruziyet dışında başka mekanizmalar da rol oynamaktadır. Çünkü belli sayıda meme karsinomunda östrojen reseptörü negatiftir. Ayrıca yüksek östrojen maruziyeti olmayan kadınlarda da sporadik meme karsinomu gelişebilir .
2.4.5. Herediter Meme Kanseri:
Primer meme kanserlerinin yaklaşık olarak % 12’sini ailesel meme kanserinden sorumlu genler oluşturmaktadır. Etkilenen birinci derecede akraba sayısı birden fazla ise, kişiler menapozdan önce etkilenmişse ve/veya çok sayıda kanserleri varsa veya aile bireylerinde bu gen için başka spesifik kanserler varsa genlerdeki mutasyon nedeniyle oluşan meme kanseri olasılığı artar. Yüksek riskli meme kanser genindeki tekli mutasyonlar bazı ailelerde artmış riskin sonucudur. BRCA 1,2 mutasyonları, nokta mutasyonlarından dolayı oluşan meme kanserlerinin çoğunluğunu ve genel meme kanserlerinin %3’ünden sorumlu tutulmaktadır. BRCA 1 ve BRCA 2 taşıyıcısı olan kadınlarda hayat boyu meme kanseri olma riski % 30-90 arasında değişmektedir. BRCA 1 mutasyonu ayrıca over karsinomu gelişme riskini de % 20-40 gibi yüksek oranda artırır. BRCA 2 mutasyonu over karsinomu için daha az risk taşır (%10-20), fakat erkek meme kanseri ile daha sık ilişki gösterir. BRCA 1 ve BRCA 2 gen mutasyonu taşıyıcıları ayrıca prostat ve pankreas ve diğer epitelyal kanserler için de yüksek risk eğilimindedir. Diğer genlere bağlı yatkınlık BRCA 1 ve BRCA 2 genine göre daha nadirdir ve herediter meme kanserlerinin %10’unu oluşturmaktadır .
2.4.6. Meme Kanserinde rol oynayan genler:
Meme kanserinde rol oynayan genleri onkojen ve tümör supresor genler diye ikiye ayırabiliriz.
2.4.6.1. Meme kanserinde rol oynayan onkogenler:
1. Epidermal Büyüme Faktör Reseptörü (EGFR) ve ERBB2:
EGFR geni kromozom 7‘de yerleşmiş olup ERBB2 geni daha çok bilinen ismiyle Her-2/neu, (v-erb-b2 avian eritroblastik lösemi viral onkogen homolog 2) kromozom 17’nin uzun kolunda lokalizedir . Bunlar epidermal büyüme faktör reseptör ailesinin üyeleridir. Batı dünyasında yapılan çalışmalarda meme kanserli hastalarının yaklaşık %7-36’sında EGFR protein ekspresyonunun var olduğu vurgulandı. Ama gen amplifikasyonu meme kanserli hastaların sadece yaklaşık %6’sında tespit edilmiştir . Diğer taraftan Suudi Arabistan’da yapılan çalışmalarda EGFR proteinin meme kanseri ile ilişkisi %1,3 gibi düşük bir oran çıkmıştır. Bu, EGFR ile ilişkili meme kanseri vakalarının bir etnik yatkınlığa bağlı olduğunu düşündürmüştür . Meme kanseri vakalarının yaklaşık olarak % 25-30’unda ERBB2 geni amplifiyedir . Bu gen hücre yüzeyinde yer alan ERBB2 büyüme faktör reseptör proteinin sentezi için gerekli bilgiyi sağlar. ERBB2 hücre adezyonu, hücre özelleşmesi ve hücre mobilitesinde çok önemli bir role sahiptir . Bu genin ekstra kopyası, hücre yüzeyindeki ERBB2 reseptör proteinin aşırı ekspresyonu ile ilişkilidir. ERBB2 reseptör proteinin aşırı uyarılması, kanserli tümör hücrelerine sürekli sinyal sağlayarak bülünmesine ve hızla çoğalmasına zemin hazırlar. ERBB2 geninin aşırı ekspresyonu metastaz yapmış meme kanseri riskinde artış ile ilişkili bulunmuştur . 2. RAS Geni: RAS gen süper ailesinin 3 tane üyesi vardır. Bunlar; H-RAS, K-RAS, N-RAS genleridir ve farklı kromozomlarda lokalizedir. RAS proteinlerinin hücre büyümesi, farklılaşması, hücrenin yaşamını devam etmesi ve hücre dışı sinyal iletimi gibi görevleri vardır .
3. c-Myc (Myelomatosis viral onkogen homolog): Nükleus düzenleyici protein kodlayan bir onkogendir. Bu gendeki mutasyonlar malign transformasyona yol açarlar. Bu genin amplifikasyonunda meme kanseri görülme olasılığı artmıştır . 4. Cyclin D1 ve Cylin D2 Geni: Cyclin bağımlı kinazlar hücre döngüsünü kontrol eden proteinlerdir. G1/S fazı kontrol noktasında görevlidirler. Bu proteini kodlayan
CCND 1 ve CCNE 1 mutasyonlarında lenfoma (daha çok mantle cell lenfoma) ile bir çok kanser ve meme kanseri riski artar .
2.4.6.2. Meme kanserinde rol oynayan tümör supresör genler:
1. P53 geni: Orta yaşlı kadınlarda meme kanserine neden olan ve BRCA 1 mutasyonuna bağlı meme kanserli hastaların sayısına neredeyse eşit olan p53, tümör supresor proteinidir. Bu gen, 17. kromozomun kısa kolunda (17p13) yer almaktadır. . TP53 ayrıca Li-Fraumeni Sendromu gibi aralarında meme de bulunan bir çok kanserin erken yaşta ortaya çıkmasıyla karakterizedir. TP53 geni hücre döngüsü, hücre onarımı ve apoptozis dahil çeşitli faktörlerden ileri derecede sorumludur . TP53 mutasyonlarının meme kanserlerinin % 20-40’ının gelişmesinde büyük bir rol oynadığı bildirilmiştir. Meme kanseri stromal ya da epitelyal olabilir. TP53 mutasyonları meme kanserinin özellikle stromal tip karsinogeneziste etkilidir. p53 mutasyonları sporadik meme kanserine de bağlı olabilir ve dolayısıyla onların tanısında yararlı olabilir .
2. ATM geni: Otozomal resesif geçişli, bir çok sistemin etkilendiği bir bozukluktur. Gen, 11q23.1’de lokalizedir. İlerleyici nörolojik bozukluklar (ataksi telenjiektazi) ve özellikle malign lenfoproliferatif hastalıklar ve meme kanser riskinde artmaya yol açan immünolojik problemler birlikte seyreder .
3. Androjen Reseptör Gen (AR): Bu gen, Xq11.2q12’de lokalizedir. Erkek meme kanseri risk faktörleri arasında yer alır. Androjen üretiminde görev alan bir proteini kodladığı için vakaların bir bölümünde androjen sensitivitesi ya da yetmezliği görülür .
3. PTEN: PTEN geninin germline mutasyonunun meme kanserinde yüksek riske sahip Cowden sendromuna yol açtığı biliniyor. Cowden sendromu ailelerin yaklaşık %80’ninde PTEN germline mutasyonu mevcuttur. Ayrıca kadın cowden sendromlu hastaların ömür boyu meme kanserine yakalanma riski %25-50’dir .
4. CDH geni: Selüler adezyon molekülü olan E-cadherin CDH-1 geni tarafından kodlanmaktadır ve bu gen 16q krozomunda lokalizedir . Ayrıca kromozom 16’nın
uzun kolunda heterozigozite kaybının meme kanserine yol açtığı bilinmektedir. Bu kaybın lobüler meme kanserindeki E-cadherin alelleri için önemli bir mutasyona yol açtığı düşünülmektedir . Ancak duktal karsinomlarda E-cadherin mutasyonu şu ana kadar kaydedilmemesine rağmen bu karsinomlarda da E-cadherin protein ekspresyonu belirgin bir şekilde azalmıştır .
5. Checkpointkinase2 (CHEK2) Geni: Sitogenetik olarak 22. Kromozomun uzun kolunda yer alır (22q12.1) . Bu CHEK2 geni, protein kontrol noktası kinaz olarak adlandırılan bir protein üreten tümör süpresör gendir. Bu protein DNA hasarlandığı zaman aktive olur. DNA hasarına yanıt olarak, TP53 dahil olmak üzere birçok başka protein ile birlikte çalışır ve hücre bölünmesini durdurur . Kalıtsal ve sporadik meme kanseriyle ilişkili bulunmuştur .
6. Serine/threonine kinase 11 (STK11) Geni: STK11 / LBK1 mutasyonları östrojen reseptörü pozitif ilişkili meme kanserinde duyarlı kişilerde tespit edilmiştir. Ayrıca Peutz-Jeghers Sendromu ile ilgili mutasyonlarla meme kanserinin güçlü bir ilişkisi saptanmıştır. STK11 / LBK1 mutasyonu olan Peutz-Jeghers Sendromu hastalarda meme, over ve akciğer kanseri gibi bir çok risk faktörü bildirilmiştir. Bunların dışında meme kanseri orta yaşlı kadınlarda önemli bir yere sahiptir .
7. RAD 50 ve RAD 51: RAD 50 geni 5. Kromozomun uzun kolunda lokalizedir (5q31). RAD 51 geni ise 15. Kromozomun uzun kolunda yerleşmiştir.(15q15.1) RAD 50 geninde mutasyon olduğu zaman RAD 50 proteinin küçük ve işlevsel olmayan bir proteini ortaya çıkar. RAD 51 proteini, DNA zararlarını onarmak için BRCA 1, BRCA 2 ve PALB2 gibi bir çok başka protein ile etkileşime girer. BRCA 2 proteini nükleustaki DNA’ nın hasarlı bölgelerini RAD 51 proteinine transport eder. RAD 51 geni meme kanseri ile birlikte pek çok kanser ile ilişkilendirilmiştir .
8. Partner and localizer of BRCA2 (PALB2) Geni: PALB2 geni, BRCA 2’nin partneri ve yerleştiricisi diye adlandırılan proteinin sentezi için talimat verir. 16. Kromozomun kısa kolunda lokalizedir (16p12.2). Defektif PALB2 proteini, hasarlı DNA'yı onarmak için BRCA2 protein ile etkin bir şekilde çalışamaz .
9. BRCA1 associated RING domain 1 (BARD1) Geni: BRCA1 associated RING domain 1 (BARD1) geni 2. Kromozomun uzun kolunda yerleşmiştir (2q34-2q35) . Bu gen, hücre büyümesi ve bölünmesi için gerekli proteinin sentezi için talimat verir. BARD 1 ve BRCA 1 proteinleri hasarlı DNA’yı onarmak için beraber çalışırlar. Araştırma sonuçları BARD 1 proteininin BRCA 1 proteinine bağlandığını göstermiştir. BARD 1 BRCA 1 proteinini stabilize eder ve BRCA 1 direkt DNA hasarlı bölgelere müdahale eder .
10. BRCA1 Interacting Protein C- terminal Helicase (BRIP1) Geni: BRIP 1 geni 17. Kromozomun uzun kolunda lokalizedir (17q22.2) . Normalde BRIP 1 hasarlı DNA tamirinde yardımcı olur. Çekirdek içinde BRIP 1 BRCA 1 ile etkileşime girer ve beraber DNA kırıklarını onarır böylece zararlı mutasyonların birikimini önler. BRIP 1 geni helikaz gibi DNA’nın belirli bölgelerine takılarak ve geçici olarak çift ipliğin ayrılmasında görev alır. DNA’nın hasarlı bölgelerindeki çift ipliği söker ve BRCA 1’in hasarlı bölgeye ulaşmasına ve tamir etmesine izin verir .
2.4.7. BRCA 1 ve BRCA 2 geni:
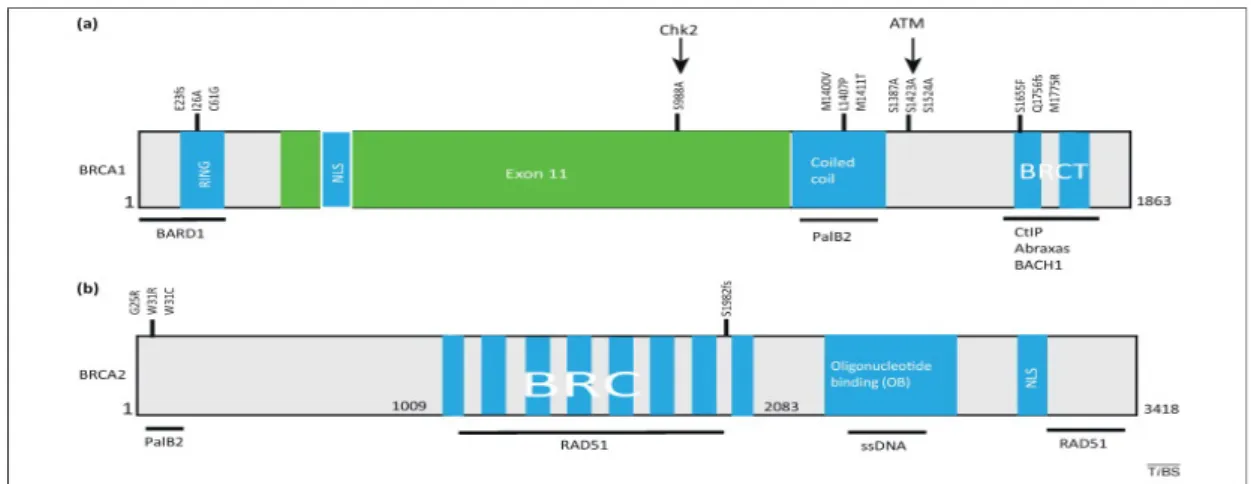
BRCA 1 ve BRCA 2 her ikisinin de uzunluğu 80 kb üzerinde olan büyük genlerdir. Kodlama bölgeleri boyunca dağılan yüzlerce farklı mutasyon bildirilmiştir. Meme kanseri riskini arttıran mutasyonların sıklığı genel popülasyonda sadece % 0.1-0.2’dir ve önemsiz polimorfizmler yaygındır. Sonuç olarak, genetik test zordur ve genellikle güçlü bir aile öyküsü olan bireyler veya belli etnik gruplara mensup olanlar ile anlamlı sonuçlar doğurur. Örnek olarak Askenazi Yahudileri soyundan olan insanların %2-3’ünde ikisi BRCA 1 biri BRCA 2 olmak üzere üç spesifik mutasyon taşıyıcılığı tanımlanmıştır. Klinik açıdan mutasyon taşıyıcılarını tanımlamak proflaktik mastektomi ve/veya ooferektomi ile mortaliteyi azaltmak için önemlidir. BRCA1 ilişkili meme kanserleri genellikle kötü diferansiye, "medüller özellikler" gösteren (itici tarzda sinsityal büyüme paterni ve lenfositik yanıtı olan) ve "triple negatif" fenotip olarak tanımlanan hormon reseptörleri, HER2 / neu negatif
olgularla ilişkilidir. BRCA 1 genleri ayrıca sık sık inaktive X kromozomun kaybı veya aktive X kromozomun reduplikasyonu sonucu Barr cisminin yokluğuyla ilişkilidir. BRCA 2 ile ilişkili meme kanserleri de nispeten kötü diferansiye olma eğilimindedir ancak BRCA 1 kanserlerine göre daha sık ER pozitifliği gözlenir . BRCA-1: BRCA 1 geni kalıtsal geçişli meme kanseri gelişiminde büyük önem taşımaktadır. Meme kanseri ile ilişkisi, büyük bir soyağacı grubunda çalışılan erken başlangıçlı meme kanseri ailelerin çalışması bitince kuruldu . BRCA 1 geni 17q12-q21’de lokalizedir. 22 tane kodlanan büyük ekzon bölgesi içerir. En büyüğü ekzon 10 bölgesidir. Bu 1863 aminoasitten oluşan çok büyük bir protein molekülünü kodlar . BRCA1 geni, caretaker (bakıcı) tümör süpresör gen grubuna aittir . İnsanlarda BRCA 1 geni dört ana bölgeye sahiptir. Proteinin N-ucunda bir RING çinko parmak bölgesi ve C-ucunda iki ‘BRCT’ tekrar bölgesi ve bir de serin bölgesi bulunmaktadır. Proteinin amino terminal bölgesinde RING çinko parmak bölgesi BARD 1 proteinin RING çinko parmak bölgesiyle bağlantı halindedir. BRCA 1/BARD 1 kompleksi ubikitinasyondan sorumlu olan E3 ligaz aktivitesi taşır . Karboksil terminalde iki tane BRCT tekrarı vardır. BRCT bölgesi, RNA polimeraz II, p53, RB gibi proteinlerle etkileşerek başta transkripsiyonel aktivasyon ve kromatin düzenlenmesi olmak üzere, birçok hücresel işlevde özellikle DNA tamirinde görev aldığı düşünülmektedir . BRCA1 geninin kodladığı protein, diğer tümör baskılayıcılar, DNA hasar sensörleri, sinyal dönüştürücülerle birlikte BASC (BRCA1 associated genom survelliance compleks) BRCA1 ile ilişkili genom denetim birimi denilen yapıyı oluşturur. DNA hasarı oluştuğunda BASC kompleksi BRCT bölgesine bağlanır ve DNA tamir edici diğer protein ve enzimler için etkileşim bölgesi oluşturur. Bu bölge tamir işlemi bittikten sonra ayrılır .
Şekil 4: Brca1 ve Brca 2 proteinlerinin yapısal özellikleri ve diğer proteinlerle ilişkisi
BRCA 2 geni: BRCA 2 geni kromozom 13q üzerinde bulunan 26 kodlu ekzon bölgesi içeren 3418 aminoasitlik büyük bir proteini kodlayan gendir . 30-80 aminoasitten oluşan 8 adet tekrar eden protein bölgesi vardır. Bu alan sıradışı uzun
11. Ekzon tarafından kodlanır. Bu tekrar dizisi BRCA 2’nin en karakteristik özelliğidir ve BRCA 2 proteininin merkezindeki üçte birlik kısmında mevcuttur. Bu etki alanı BRC olarak adlandırılır . Bu BRC etki alanı Rad51 için bir bağlanma alanı görevi görür . BRCA 2 karboksil terminal bölgesinde bulunan TR 2 olarak adlandırılan başka bir bölge RAD 51’e bağlanma görevini yürütür . Proteinin bu bölgesinin rekombinant tamir mekanizmasında önemli rol oynadığına inanılmaktadır . Öte yandan PALB2, BRCA 2 amino terminali ile etkileşime girer ve nükleer yapılarda BRCA 2 stabilitesinin artışına neden olur .
2.4.8. Meme Kanser Progresyonunda Hücresel Değişiklikler
Bir karsinogenez modelinde normal hücrenin malign olması için bir kaç yeni yetenek kazanması gerektiği vurgulanmıştır . İlk belirlenen değişikliklerden biri, hücre sayısının normal regülasyonunun kaybı ve sonuç olarak meme dokusunda epitelyal hiperplazi ya da sklerozan adenozis meydana gelmesidir. Daha sonra bunu hücrelerin klonal popülasyonunda ortaya çıkan genetik instabilite sonucu atipik hiperplazi oluşumu izler. Karsinomun progresyonundan sonra, çok sayıda sellüler değişiklikler ortaya çıkabilir ve bu selüler değişiklikler içerisinde onkogen ekspresyonunda artma (örneğin cerbB2 [Her2/neu], INT2, c-ras, c-myc), tümör süpresör genlerinin fonksiyonları ya da ekspresyonunda kayıp (örneğin NM23, p53, RB), hücre yapısındaki değişiklikler (örneğin vimentin ekspresyonunda artma, fodrin ekspresyonunda azalma), hücre adezyon kaybı (örneğin lobüler karsinomlarda izlenen E-kaderin kaybı, az diferansiye karsinomlarda görülen integrinlerdeki kayıp), hücre siklus proteinlerinin ekspresyonundaki artma (örneğin siklinler, Ki-67, proliferasyon sağlayan hücre nükleer antijeni), anjiyogenetik faktörlerin ekspresyonunda artma (örneğin vasküler endotelial büyüme faktörü, fibroblast büyüme faktörü) ve proteaz ekspresyonunda artma (örneğin katepsin D, stromelisinler) vardır. Tüm meme kanserlerinde olmasa da bazılarında ortaya çıkan, malign fenotipin multiple değişikliklerinin bir birikimine bağlı olduğunu düşündürmektir .
Meme tümörleri için Dünya Sağlık Örgütü (WHO) 2012’de yeni bir histolojik sınıflandırma yayınlamıştır .
Epitelyal tümörler
Mikroinvaziv karsinom İnvaziv meme karsinomu
İnvaziv karsinom NST (spesifik tip olmayan) Pleomorfik karsinom
Osteoklastik dev hücreli karsinom
Koryokarsinomatöz özellikleri olan karsinom Melanositik özellikleri olan karsinom
İnvaziv lobüler karsinom Klasik lobuler karsinom Solid lobuler karsinom Alveoler lobuler karsinom Pleomorfik lobuler karsinom Tubulolobuler karsinom Mikst lobuler karsinom Tübüler karsinom Kribriform karsinom Müsinöz karsinom
Medüller Karsinom Atipik medüller karsinom
Medüller özellikli Non-spesifiye tip invaziv karsinom (NST) Apokrin diferansiyasyonlu karsinom
Taşlı yüzük diferansiyasyonlu karsinom İnvaziv mikropapiller karsinom
Non-spesifik tip metaplastik karsinoma Düşük grade adenoskuamöz karsinom Fibromatozis benzeri metaplastik karsinom Skuamöz hücreli karsinom
İğsi hücreli karsinom
Mezenkimal diferansiyasyonlu metaplastik karsinom o Kondroid diferansiasyonlu
o Osseöz diferansiasyonlu
o Mezenkimal diferansiasyonlu diğer tip Mikst metaplastik Karsinom
Myoepitalyal Karsinom Nadir tipler
Nöroendokrin Özellikli Karsinom Sekretuar Karsinom
İnvaziv papiller Karsinom Asiner hücreli Karsinom Mukoepidermoid Karsinom Polimorf Karsinom
Onkositik Karsinom Lipidden Zengin Karsinom
Glikojenden Zengin Şeffaf Hücreli Karsinom Sebasöz Karsinom
Tükürük bezi / deri eki tip tümörler Epitelyal-myoepitelyal tümörler
Pleomorfik adenom Adenomyoepitelyoma Adenoid kistik karsinom Prekürsör lezyonlar
Duktal karsinoma in situ Lobüler neoplazi
Lobüler karsinoma in situ Atipik lobüler hiperplazi İntraduktal proliferatif lezyonlar
Flat Epitelyal Atipi içeren Kolumnar Hücreli Lezyonlar Atipik Duktal Hiperplazi
Papiller lezyon
Intraduktal papillom
Atipik hiperplazili intraduktal papillom
Duktal karsinoma in situlu intraduktal papillom Lobüler karsinoma in situlu intraduktal papillom Intraduktal papiller karsinom
Enkapsüle papiller karsinom
Enkapsüle invazyon gösteren papiller karsinom Solid papiller karsinom
In situ Invaziv
Benign epitelyal proliferasyonlar Sklerozan adenozis
Apokrin adenozis
Mikroglanduler adenozis
Radial skar/kompleks sklerozan lezyon Adenomlar
Laktasyon adenomu Apokrin adenom Duktal adenom Mezenkimal Tümörler Noduler fasiit Myofibroblastom Desmoid-tip fibromatozis
Inflamatuar myofibroblastik tumor Benign vaskuler lezyonlar
Hemanjiom Anjiomatozis
Atipik vasküler lezyonlar
Psödoanjiomatöz stromal hiperplazi Granuler hücresel tümör
Benign periferik sinir kılıfı tümörleri Nörofibrom
Schwannom Lipom Anjiolipom Liposarkom
Anjiosarkom Rabdomyosarkoma Osteosarkom Leiomyoma Leiomyosarkom Fibroepitelyal Tümörler Fibroadenom Filloides tümör Benign Borderline Malign
Periduktal stromal tümör, düşük grade Hamartom
Meme başı tümörleri Nipple adenom
Siringomatöz adenom
Meme başının Paget hastalığı Malign lenfoma
Diffüz büyük B hücreli lenfoma Burkitt lenfoma
T hücreli lenfoma
ALK negatif Anaplastik büyük hücreli lenfoma
Ekstranodal marjinal-zon B hücreli lenfoma MALT tip Folliküler lenfoma
Metastatik tümörler Erkek meme tümörleri
Jinekomasti Karsinom Invaziv karsinom o In situ karsinom Klinik Paternler Inflamatuar karsinom Bilateral meme karsinom
2.4.6. Meme Tümörlerinde TNM Sınıflaması . T-Primer tümör
TX Primer tümör değerlendirilemez durumda T0 Primer tümör yok
Tis İn situ karsinom: DCIS
Meme başının Paget hastalığı, tümör eşlik etmiyorsa (Paget tümöre eşlik ediyorsa tümör boyutuna göre değerlendirilir)
T1 Tümör boyutu 2 cm veya daha küçük T1mic Mikroinvazyon 0,1cm veya daha küçük T1a 0,1-0,5 cm arası
T1b 0,5-1 cm arası T1c 1-2 cm
T2 2-5 cm arası T3 5 cm den büyük
T4 Tümör ne boyutta olursa olsun göğüs duvarı ya da meme derisine yayılım(pektoral kas tutulumu hariç)
T4a Göğüs duvarına yayılım
T4b Meme derisinde ülser ya da ödem, meme derisinde satellit nodüller T4c T4a+T4b
T4d İnflamatuar karsinom
N-Bölgesel Lenf Nodu (Patolojik)
NX Bölgesel lenf nodu değerlendirilemiyor N0 Lenf nodu metastazı yok
N1 İpsilateral aksiller 1-3 adet lenf nodunda tümör metastazı
N2 İpsilateral aksiller 4-9 adet lenf nodunda tümör metastazı ya da internal mamarien lenf nodu metastazı
N2b İpsilateral internal mamarien lenf nodunda tümör metastazı
N3 İpsilateral infraklavikuler lenf nodu metastazı beraberinde 10’dan fazla aksiller ya dainternal mammarien lenf nodu tutulumu
N3a Sadece infraklavikuler lenf noduna metastaz
N3b İnternal mammarien lenf nodu ve aksiller lenf nodu metastazı N3c Supraklavikuler lenf nodu metastazı
M-Metastaz
MX Uzak metastaz değerlendirilemiyor M0 Uzak metastaz yok
M1 Uzak metastaz varlığı
2.5. Meme Tümörlerinde Prognostik Faktörler
Dünyada her 8 kadından birinde hayatlarının herhangi bir döneminde meme kanser gelişimi söz konusu olmaktadır. İnvaziv meme karsinomlarını tedavi etmek için çok çeşitli ve agresiv tedavi rejimlerinin kullanılması prognozu doğru bir şekilde belirlemeyi önemli kılmaktadır. Çünkü böylesi tedavilerin çok yaygın toksik etkileri vardır. Bir çok prognostik faktör aşağıda belli gruplar altında belirtilmiştir .
Yaş: Tanı esnasında 50 yaştan küçük olanlarda prognoz iyi seyirli olamakla beraber 50 yaşından sonraki kadınlarda sağ kalım oranı düşük bulunmuştur. Bununla birlikte bazı çalışmalarda çok genç yaştaki kadınlarda (<35 yaş) prognozun yaşlı kadınlarla aynı olduğu, bunların nüks ve uzak metastaz açısından yüksek riske sahip ve daha agresif oldukları tespit edilmiştir .
Irk: Siyah kadınlarda meme kanserlerinde her stage için daha düşük bir sağ kalım oranı mevcut olmakla birlikte ayrıca bu kadınlarda kanser daha genç yaşta ortaya çıkmakta ve daha kötü diferansiye olma eğilimi göstermektedir .
Vücut Ağırlığı (Kilo): Son veriler bize, tedavi süresince ağırlık artışının meme kanserinin rekürrens riskini artırdığını ve surviyi azalttığı yönündedir. Ayrıca vücut yağ dağılımı ve obezitenin, meme ve endometrial kanser riskini artırdığı gösterilmiştir .
Yerleşim yeri: Mevcut birçok çalışmada prognoz ile tümörün kadranlara göre yerleşimi arasında bir ilişki tespit edilememiştir. Ancak son zamanlarda yayımlanan bir çalışmada medial yerleşimli tümörler, lateral yerleşimlilerle karşılaştırıldığında %50 daha fazla nüks ve ölüm riski bulunmuştur .
Gebelik ve oral kontraseptifler: Gebelik ve laktasyon sırasında ortaya çıkan meme karsinomları, düşük hormon reseptörü ekspresyonu ve yüksek Cerb-B2 ekspresyonu ile birliktelik gösterir. Bu nedenle agresiv bir tümör olduğuna dair yaygın bir kanı mevcuttur . 45 yaş altındaki genç kadınlarda uzun süreli oral kontraseptif kullanımının meme kanseri riskinde artışa sebep olduğu gösterilmiş ve oral kontraseptif kullanılan her yıl için meme kanseri riskinin % 3,1 arttığı tespit edilmiştir .
Tümör Boyutu ve Büyüme Şekli: Meme kanserinde tümör boyutu en önemli prognostik faktörlerden biridir; lenf nodu tutulumu ve metastaz ile birlikte evrelemede kullanılmaktadır. Artan tümör hacmi ile aksiller lenf nodu tutulumu arasında bir ilişki mevcuttur. Tümör çapının 2 cm ya da daha küçük olduğu olgularda prognoz belirgin olarak daha iyidir. Artan tümör hacmiyle birlikte lenf nodunun tutulma oranı artmakta ve 5 yıllık sağ kalım oranı düşmektedir . Saigo ve Rosen’ın negatif lenf nodlu, ≤1 cm çaplı invaziv karsinomlu ve modifiye radikal mastektomili 111 hastanın en az 10 yıllık takip oranlarını belirttikleri çalışmalarında: hastaların %75’i hiçbir hastalık belirtisi vermeden yaşamış, %4’ü rekürren karsinomu olup yaşamış, %6’sı hastalıktan ve %15’i de diğer sebeplerden kaybedilmiştir . Atıcı ve arkadaşları yaptıkları bir çalışmada meme kanserlerinde tümör büyüklüğü ile hastalıksız yaşam ve sağ kalım arasında anlamlı bir ilişki bulmuşlardır. Buna göre 2 cm' den küçük, 2-5 cm arası ve 5 cm' den büyük tümörlü hastalar için 3 yıllık takipler sonucu sırası ile % 100, % 77, % 83 hastalıksız yaşam ve %100, % 84, % 93 sağ kalım oranları belirlemişlerdir . Genelde rekürrens riski tümör boyutunun artışı ile koreledir ve kanserin boyutu 1 cm' den büyük olduğunda adjuvan sistemik tedavi için
potansiyel bir adaydır . Multisentrik gelişen tümörlerde nüks daha sıktır. Prognoz da daha kötüdür. Yapılan çalışmalarda multisentrik olmayan tümörlerde 5 yıllık mortalite % 25, multisentrik olanlarda ise % 15 olarak gösterilmiştir . Düzgün sınırlı tümörler infiltran sınırlı tümörlerden daha iyi prognoza sahiptir . Bazı çalışmalarda bilateral tutulumlu karsinomlarda, unilateral tutulumlulara oranla yaşam süresinin kısaldığı gösterilmiştir .
Tümörün Histopatolojik Tipi: Meme karsinomunun tubuler, papiller, müsinöz, adenoid kistik karsinom, medüller karsinom gibi belirli tipleri esas olarak düşük dereceli kanserlerdir. Aksiller lenf nodu metastazı göstermediklerinden ya da düşük sıklığı nedeniyle genel olarak iyi prognoz ve düşük rekürrens oranları gösterirler. Bunlarda hastalıksız yaşam oranları % 100' dür. Duktal ve lobuler karsinomlarda ise bu oran % 92 civarındadır . Taşlı yüzük hücreli karsinom, inflamatuar karsinom ve karsinosarkom kötü diferansiye agresiv neoplazmlardır. En agresiv tümörlerden biri olan inflamatuar karsinom için 5 yıllık sağ kalım oranı % 11'dir. Medüller karsinomda 10 yıllık survi % 51, İDK’da % 46, infiltratif lobuler karsinomda % 53 olarak belirlenmiştir .
Tümörün Histolojik Derecesi (Grade): Yaşam süresi üzerine olan etkisi en iyi araştırılmış olan parametre tümörün histolojik grade'idir. Bloom ve Richardson 1957'de 1544 vakalık bir seride yine daha önceki grade' lendirme sistemlerindeki kullanılan özellikleri ele alan bir puanlama sistemi ile grade' lendirme önermiştir. Bu sistem WHO tarafından da benimsenmiş, bazı ufak değişikliklerle günümüzde de geçerliliğini korumaktadır . Günümüzde en çok kabul gören sistem, Elston tarafından modifiye edilmiş Bloom-Richardson sistemidir. Bu sistemde tümörde tubul yapısı, nükleer özellikler ve mitoz sayısı ayrı ayrı değerlendirilerek skorlanır ve elde edilen sonuca göre tümörün histolojik diferansiasyonu I, II, III olarak değerlendirilir. Medüller karsinomlar hariç tüm invaziv meme karsinomlarında derecelendirme yapılabilir . Tablo 1’e göre toplam puan 3–5 ise derece 1(iyi diferansiye), toplam puan 6–7 ise derece 2 (orta diferansiye), toplam puan 8–9 ise derece 3 (az diferansiye) olarak değerlendirilir. Yapılan bir çalışmada 5 yıllık yaşam oranları Grade I, II ve III tümörler için sırası ile % 81,9, % 63,4, % 49,5 olarak belirlenmiştir . Bu ve ilişkili gradeleme sistemlerinin faydasının inandıcılığı ve
tekrarlanabilir güvenilirliği sayesinde bu sistemin rutin patoloji raporlarına eklenmesine yönelik bir yaklaşım vardır .
Tablo 1: Meme tümörlerinde histolojik differansiasyon kriterleri
Özellik Puan
Tubul yapısı
Tubul yapıları tümörün %75’inden fazla 1
Tubul yapıları tümörün %75-10’u 2
Tubul yapıları tümörün %10’nundan az 3
Nükleer pleomorfizm
Küçük, düzenli, uniform 1
Şekil ve boyutta orta derecede fark 2
Şekil ve boyutta belirgin fark 3
Mitoz sayısı (10 BBA)
0-9 1
10-19 2
20’den fazla 3
Aksiller Lenf Nodu Tutulumu: En önemli prognostik faktörlerden biridir . ALN metastazı olan ve olmayan olguların sağkalım oranları arasında belirgin bir fark olmasının yanı sıra, ALN tutulumunun düzeyi, sayısı, metastatik odaktaki tümörün boyutu, lenf nodundan kapsül dışına yayılım da sağ kalım oranını olumsuz yönde etkilediği bildirilmiştir . Metastatik lenf nodu sayısı arttıkça prognoz kötüleşir. Metastatik lenf nodu yoksa prognoz en iyi, 1-3 lenf nodu pozitifse orta, 4 ve daha fazla lenf nodu metastazı varsa prognoz kötüdür .
Lenfovasküler invazyon: İnvaziv karsinomlar etrafında vasküler invazyonun gösterilmesi erken lokal nüks ve uzak metastazlar açısından önemlidir. Aksiller lenf
nodu (+) olan 33 hastanın % 69'undave aksiller lenf nodu (-) olan 30 hastanın sadece % 26' sında vasküler invazyon görülmüştür. Başka bir çalışmada lenfatik invazyon gösteren hastaların % 32' sinde, aynı invazyonu göstermeyen hastaların da % 10,3' ünde nüks görülmüştür . Lenfatik vasküler invazyon gösteren meme kanserli hastalarda hastalıksız yaşam % 83, lenfatik vasküler invazyon göstermeyen hastalarda ise % 98' dir .
Cerrahi Sınırlar: Bazıları cerrahi sınır ile tümör arasındaki 5 mm' lik bazıları da birkaç yağ hücresi ya da ince fibröz bağ dokusunun bulunmasını negatif kabul etmektedir. Cerrahi sınırda tümörün (+) bulunması, tedaviye etkileri ve lokal nüks açısından önemlidir .
Deri Tutulumu: Meme karsinomlarında deri invazyonunun varlığı azalmış sağ kalım oranları ile birliktedir. Özellikle inflamatuar karsinom olarak tanımlanan dermal lenf damarlarının tümöral invazyonu özellikle kötü bir prognostik işarettir. Ayrıca meme başı tutulumu da aksiller metastazlarının yüksek insidansı ile ilişkilidir. Meme başı ve areola tutulumu; tümör büyüklüğü, tümör areola uzaklığı ve histolojik türle ilişkili bulunmuştur .
Aksiller Lenf Nodu Değişiklikleri: Lenfosit hakimiyeti, sitimülasyon yokluğu ve sinüs histiositozis düşük rekürrens oranı ile birliktedir (% 9). Buna karşın lenfosit azlığı, germinal merkez belirginliği ve mikrometastazların varlığı orta derecede (% 23) ve makrometastazların varlığı yüksek bir rekürrens oranı ile ilişkilidir (%58) . Tümör Nekrozu: Tümör nekrozunun varlığı lenf nodu metastazı oranında artış ve yaşam süresinde azalmayla ilişkilidir . Nekroz, tümör boyutu ve derecesi ile ilişkilidir. Ayrıca tümör nekrozu kötü prognozla birliktedir . Nekroz yokluğu yıllık survi oranlarında %10'luk bir farkla önemli ölçüde daha iyi prognoz sağlar .
Evre: Tümörün evresi tek başına sağ kalımın önemli bir belirleyicisidir. Evre ile survi arasında anlamlı ilişki bulunmuştur. Amerika Birleşik Komitesi klinik evrelemede aşağıdaki şemayı uygulamaktadır :
Evre 0 : Duktal karsinoma in situ ya da lobüler karsinoma in situ (beş yıllık sağ kalım oranı %92).
Evre I : Nodal tutulumsuz ya da uzak metastazsız 2 cm ya da daha küçük çaptaki invaziv karsinomlarda ( mikroinvazyonlu karsinoma in sitular dahil ) ( beş yıllık sağ kalım oranı %87).
Evre II : 5 cm ya da daha küçük hacimli hareketli, tutulmuş lenf nodülü ve uzak metastaz göstermeyen veya nodal tutulum ya da uzak metastazsız 5 cm’ den büyük bir tümör (beş yıllık sağ kalım oranı % 75 )
Evre III : 5 cm’ den büyük çapta nodal tutulumlu meme kanseri; ya da fikse aksiler nodüllü herhangi bir meme kanseri; aynı taraf internal meme lenf nodülü tutulumu ile birlikte olan herhangi bir meme kanseri; deri tutulumu, pektoral ve göğüs duvarı fiksasyonlu, ödemli ya da uzak metastazsız klinik iltihabi meme kanseri ( beş yıllık sağ kalım oranı % 46 )
Evre IV : Uzak metastazlı herhangi bir meme kanseri ( aynı taraf supraklavikuler lenf nodülleri dahil ) (beş yıllık sağ kalım oranı % 13 )
Proliferasyon hızı ve anöploidi: Elston tarafından oluşturulan kombine gradeleme tablosuna katılmıştır. Aslında o sistemin en önemli komponentidir. İmmünhistokimyasal olarak saptanabilen bazı belirleyiciler (Ki–67) yanı sıra akım sitometri yöntemiyle DNA değerlerine bakılarak bir tümörün proliferasyon hızına ilişkin bilgiler elde edilebilmektedir. Tümör hücrelerinde DNA miktarının artması ya da yüksek Ki–67 proliferasyon indeksi kötü prognoz göstergesi olarak kabul edilmektedir . Ki–67, G0 hariç tüm hücre siklusunda nükleusta mevcut bir nükleer antijene karşı gelişen monoklonal antikordur. DNA içeriğine bakmaksızın herhangi bir siklus fazında bulunan tüm hücreler G0 fazına girebildiği için, Ki–67 fraksiyon tayinlerinin bir tümörün prolifere hücre komponenti ile ilgili en anlamlı bilgileri verebileceği söylenebilir. Lenf nodu metastazı izlenmeyen meme kanserleri ortalama %13 Ki–67 büyüme fraksiyonuna sahipken, dörtten az lenf nodu metastazı izlenen tümörlerde bu fraksiyon %20’dir .
Hormon reseptörleri: İnvaziv kanserlerde %37-80 oranında ER, %45-69 oranında PR pozitifliği bildirilmiştir. ER pozitif hücrelerin oranı, tümörün diferansiasyon derecesi ve hormonal tedaviye vereceği yanıt ile ilişkilidir. Tedaviye en yüksek
cevap oranı hem ER, hem PR pozitif tümörlerdedir . Bir tümörde ER ve PR’nin her ikisinin varlığı sadece ER (+) olan tümörlü hastalarda izlenen ortalama %52’lik hormonal tedavi yanıtı %75-80’e kadar çıkarır . Meme kanserlerinde androjen reseptör ekspresyonu % 20-85 arasındadır. AR primer ve metastatik meme kanserlerinde en sık eksprese edilen steroid hormon reseptörüdür. Genel olarak ER ve PR ile belirgin korelasyon gösterir .
Tümör baskılayıcı genler ve onkogenler: Malign transformasyondan direkt olarak yapısal değişikliğe uğramış onkogenler veya protoonkogenlerin artmış ekspresyonu sorumludur. Yapısal değişiklikler, nokta mutasyonu, translokasyon, inversiyon, kromozomal yeniden düzenlenmeler ve gen amplifikasyonu şeklinde olabilir . Klinik olarak önemi olan bazı onkogenler şunlardır:
a) BRCA1 geni: 17q 12-q21’ de lokalizedir. 70 yaş civarında BRCA1’ e bağlı meme kanseri gelişim riski %85’ dir. BRCA1 ile ilgili meme kanserleri daha erken evrede ve daha genç yaş gruplarında görülmektedir. Bu tümörler yüksek proliferasyon oranlarına sahiptir ve yüksek derecelidirler .
b) BRCA2 geni: 13q 12-q13’ de lokalizedir. Herediter kanserlerin % 35-40’ından sorumludur .
c) c-myc: Meme kanserlerinde % 17-32 oranında saptanır. Değişmiş c-myc, tümör derecesi, aksiller lenf nodu durumu, yaş ve hormon reseptör düzeyleri ile belirgin bir ilişki göstermez .
d) p53 geni: Hücre siklusunda G1 fazından S fazına ilerlemeyi inhibe eden tümör baskılayıcı gendir. Bu gende mutasyon ve delesyonlar sonucu olan değişiklikler malign transformasyona neden olur. Agresif biyolojik davranış, büyük tümör boyutu, sık aksiler lenf nodu metastazı ile ilişkilidir .
e) cerb-B2: Meme kanserlerinde cerb-B2' nin prognostik ve prediktif önemi bulunmaktadır. Meme kanserli hastalarda % 25-30 oranında cerb-B2 amplifikasyon ve overekspresyonu bildirilmiştir. Birçok çalışmada özellikle lenf nodu pozitif olan hastalarda cerb-B2 amplifikasyon/overekspresyonunun hastalıksız yaşam ve sağ kalım süresi üzerine negatif etkisi olduğu bildirilmiştir. Yani cerb-B2 pozitifliği


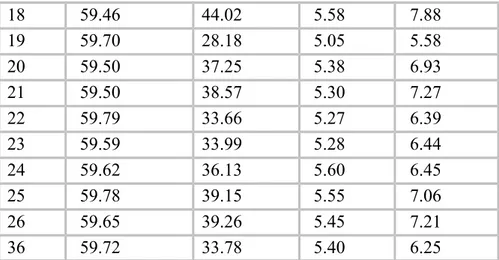
![Tablo 7 BRCA 1 rs80357906 [5382insC] çalışılan hastaların örnek pik değerleri ( 90 nolu hastada mutasyon gözlendi)](https://thumb-eu.123doks.com/thumbv2/9libnet/3287088.9407/56.892.169.766.206.1008/tablo-çalışılan-hastaların-örnek-değerleri-hastada-mutasyon-gözlendi.webp)
![Şekil 6 BRCA 1 rs80357906 [5382insC] mutasyon pozitif ve wild tip hastaların karşılatırılması](https://thumb-eu.123doks.com/thumbv2/9libnet/3287088.9407/57.892.172.823.128.681/şekil-brca-insc-mutasyon-pozitif-wild-hastaların-karşılatırılması.webp)