1. GİRİŞ ve AMAÇ 1.i. GİRİŞ
Beyin, nörovasküler yapıların karmaşıklığından dolayı her zaman gizemini koruyan bir doku olmuştur(1). Endoskopi son 20 yılda hem nöroşirurji hem de tıbbın diğer alanlarında kullanımı ile önemli ölçüde değişiklik yaratmış bir cihazdır. Özellikle beynin ulaşılması zor ve riskli alanlarına getirdiği ulaşım ve görüş açısı avantajları ile hem kraniyal hem de omurilik ve periferik sinir cerrahisinde vazgeçilemez teknikler arasında yerini almıştır(5). İlk kez 1910 yılında L'Espinasse'in hidrosefalide koroid pleksus koterizasyonu için endoskop kullanmasından itibaren modern nöroşirurjide tanı ve tedavi amaçlı çeşitli nöroendoskopi metotları geliştirilmiştir (2). Nöroşirurjide, mikroskopun yanı sıra kraniotomi sahasında, subaraknoid boşluk veya kistik yapılarda endoskopun da kullanılması ile uygulanan endoskop yardımlı cerrahi ise ilk kez 1977 de Appuzo tarafından tanımlanmıştır (3). Bu yöntemin geliştirilmesi ile ana çalışma alanı ventriküler sistem olan nöroendoskopi, mikrocerrahide yardımcı araç olarak kullanılmaya başlanmıştır. Nöroşirürji için halen yeni bir teknik sayılan nöroendoskopinin bilimsel kanıtlara temellendirilebilmesi için, büyük ölçekli, randomize- kontrollü ve meta-analiz çalışmalarına gereksinim vardır. Henüz endikasyonlarının geçerliliği ve gerekliliği ya da avantajları konusunda kanıt olacak vaka serileri olması gereken düzeyde değildir(26).
Beyin cerrahisi için yeni tanı ve tedavi yöntemlerinde kullanılan endoskopinin kullanım ve cerrahi yaklaşım tekniklerinde güvenli girişime ait küresel standartlar sağlayabilmek için şu an literatürde var olan vaka örneklerinin daha fazla sayıda paylaşılması gerekliliği ve bu hastaların klinik durum ve sonuçları hakkında daha fazla bilgiye ihtiyaç olduğu da görülmektedir.
1.ii. AMAÇ
Yukarıda belirtilen bilgi ve açıklamalardan yola çıkılarak planlanan, geriye dönük ve tanımlayıcı olan çalışmamızda, 1 Ocak 2005- 15 Haziran 2016 yılları arasında E.Ü.T.F.H. Nöroşirürji AD’da “İntraventriküler Endoskopik Yolla Biyopsi” örnekleri alınan hastalarının sosyo-demografik özellikleri (yaş, cinsiyet), kitle yerleşim yeri, girişim yılı, patoloji sonucu, başlangıçta ve girişim sonrasında hidrosfali varlığı, E3V endikasyonu, postop komplikasyon varlığı ve mortalite değişkenleri incelenerek, elde edilen bulgularla, bu konuda kısıtlı olan literatür bilgilerine az da olsa vaka serisiyle katkıda bulunmayı; asıl olarak nöroendoskopik biyopsinin güvenliği ve tanısal etkinliği konusunda uygulanabilir standartlar oluşmasına destek olabilmeyi amaçladık.
2. GENEL BİLGİLER
2.1. ENDOSKOPİK CERRAHİNİN TARİHÇESİ
Tüpler medeniyetin erken dönemlerinden itibaren tıp tarihinde kullanılmıştır. Önceleri tüpler değişik uygarlıklar tarafından enemalar için lavman olarak, daha sonra ise hastaların beslenmesi amacıyla kullanılmıştır. Bu kullanımlar tüplerin sadece doğal kullanım yolları olup daha sonraları ise hekimler tarafından hastalıklar hakkında bilgilerini geliştirmek için hastaların vücudunu intralüminal ve ekstralüminal olarak incelemeye teşebbüs etmişlerdir. Mısırlılar, Yunanlar, Romalılar ve Araplar gibi birçok medeniyet insan vücut boşluklarını görebilmek için spatulalar ve spekulumlar gibi değişik enstrümanlar denemişlerdir (6,7,8). Medeniyetlerin ilk çağlarında kullanılan aletler 1805’e kadar tamamen ortam ışığının vasıtası ile yapılan incelemelerden ileriye gidememiştir. 1805 yılında Phillip Bozzini tarafından ilk endoskop icat edilmiştir. Bu alet ile mum alevini konkav bir ayna vasıtası ile tüp içinden yansıtarak mesane ve rektumu incelemiştir. 18. yüzyılda başlayan endoskopik incelemeler zaman içinde gelişerek 1901 yılında George Kelling’in bir tüp yardımıyla bir köpeğin abdominal kavitesine ulaşması ile laporoskopiye geçiş sağlanmıştır. Zaman içinde laparoskopi gelişmiş ve popüler olmuştur. Endoskopinin gelişimi fiber optik ışık kaynağının ve rot-lens sisteminin icadı ile daha rahat kulanım alanı bulmuş ve terapötik endoskopi oluşmaya başlamıştır. Böylece ilk çağlarda kullanılan tüplerin gelişimi ile ortaya çıkan laparoskopi ve endoskopi modern tıpta hastaların tanı ve tedavisinde yerini almıştır. Bu ortak başlangıç ve gelişim 2005 yılında tekrar bir noktada buluşmuş ve doğal yollardan cerrahiyi mümkün kılmıştır(8).
İlk endoskopi 1805’de Alman bir ürolog olan Phillipe Bozzini tarafından kendisinin “Lichtleiter” adını verdiği aletin kullanılması ile başlamıştır (8,9). O dönemde bu buluş benimsenmemiş ve pratik kullanıma alınmamıştır. Fransız bir cerrah olan Antoine Jean
yakarak kullanılan karosen lambayı, bir baca vasıtasıyla alevi artırmış ve daha parlak bir nokta elde etmek amacıyla lensi kullanarak ışığı dar bir alanda yoğunlaştıran çok amaçlı bir endoskop oluşturmuştur(8, 10). Bu alet yardımıyla mesane, uterus ve serviksi incelemiş ancak mideyi incelemesine ışığın gücü yeterli olmamıştır. Desormeaux’un bu icadını 1855’te Paris’te, Academy of Medicine’de sunmuş ve 1865 Paris’te, 1867 İngiltere’de yayınlanmasından sonra yayılmıştır(8,10,11).
Endoskopi Yunanca bir kelime olup “Endo” iç, “Skopein” görmek anlamındadır ve tam olarak rijit veya fleksibl tüplere ekli küçük kameralar vasıtası ile vücudun içerisine bakabilmektir (12). Medikal olarak tanılama, görüntüleme ve izlem, birçok hastalıkta cerrahi tedaviye yardımcı olmak amacıyla geniş bir kullanım alanına sahip olan Desormeaux’un icadı birçok gelişme ve yeniliğin de öncüsü olmuştur(8,12). Bu dönemi Bevan’ın özefagoskopi, Pantaleoni’nin histeroskopi icatları izlemiştir. 1874’de Stein’ın “Photoendoscope” adını verdiği buluşuyla mesane patolojilerinin görüntülerini kayıt edebilmiştir (13,14,15). Açık tüp sistemi, içine bir teleskop sisteminin yerleştirilmesi ile devrim niteliğinde değişime uğramıştır. Alman ürolog Maximilian Carl-Friedrich Nitze 1877’de sistoskopu icat etmiştir. 1880’de Jan Mikulicz-Radecki Nitze’nin sistoskopuna benzer bir sistemle ilk gastroskopu yapmıştır(16). 1879’da Edison’un filament ampulü keşfinden sonra Johann Mikulicz bu teknolojiyi ilk olarak kullanarak 1881’de gastroskopiye uygulamıştır(8). Mikulicz endoskopik olarak mide kanserini tarif etmiş ve müdahaleye imkân sağlayan ilk endoskopik prosedürü icat etmiştir (16-17). Ayrı bir müdahale kanalının da eklenmesi ile günümüzdeki modern endoskopi ve endoskopik cerrahi uygulamaları oluşmaya başlamıştır. Mikulicz’den sonra 1930 yılına kadar Lamm’ın fiber optiği endoskopiye adapte etme düşüncesine kadar geçen 70 yılda anlamlı bir gelişme olmamıştır. Bu düşünce ile modern endoskopi çağının ilk adımları atılmaya başlamıştır(8).
Henrich Lamm’ın fiber optiği endoskopiye adapte etme düşüncesinden 25 yıl sonra İngiltere’den Harold Hopkins bir rod-lens sistemi geliştirmiş ve daha net daha keskin bir görüntü elde etmiştir. 1960’larda fiber optik ışık kaynağının ve rod-lens sisteminin gelişimi ile modern endoskopi çağı başlamıştır. Basil Hirschowitz bu teknolojiyi klinik uygulamaya koyan ilk kişidir(8). İlk fiberoskop Ekim 1960’da American Cystoscope Makers Şirketi tarafından yapılmıştır(18). Üst gastrointestinal sistem için fleksible fiberoskopların gelişimi kolonun endoskopik olarak incelenmesinin önünü açmıştır. 1963’de aynı firma tarafından ilk fleksible fiber optik kolonoskop yapılmıştır(19,20). 1973 Richter, Littman ve Levowitz tarafından ilk kez peroperatuar endoskopi, lezyonun bulunması için tarif edilmiş ve böylelikle endoskopi tanıya yardımcı araç olarak kullanılmıştır(21). 1969 da Texas Medical Branch üniversitesinden cerrah Youmans ve ark. endoskopik olarak gastrik kanamayı durdurmasıyla (22) başlayan endoskopinin terapötik araç olarak kullanımı, 1984’te Tada ve ekibi mide kanserinde ‘‘strip-off’’ soyma biopsisini, 1990’larin başında ise Japon endoskopistler erken evre özefagus kanserinde ilk endoskopik mukozal rezeksiyonu gelişmeye devam etmiştir(20). Endoskopi, doktorların ilk çağlarda tüpler ile hastaların beslenme ve lavman için kullanılmasından bu yana hastaların vücudunu keşfetmek için ve şu an ise bu aletler ile tedavi ettikleri birer araç halini almıştır(8). Endoskopi kulak-burun-boğaz hastalıklarından jinekolojiye, nöroşirürjiden ürolojiye; insan bedeninin tepesinden topuğuna kadar her ilgi alanına dağılmış sayısız işlem aracılığı ile cerrahlar arasında ortak bir anlayış, ortak bir dil oluşmasında anlamlı ve yok sayılamaz bir katalizör işlevi de görmektedir (23).
2.2. ENDOSKOPİK GÖRÜNTÜLEME SİSTEMLERİ
Endoskopik görüntüleme sistemleri vücut içi görüntülemeyi amaçlar. Endoskopi ismi genel bir ifadedir. Modern endoskopi, 1959 yılında Harold H.Hopkins’in (1918–1994) çubuk şeklinde optik sistemi bulması ve 1960 yılında da Karl Storz’un (1911–1996) fiber optik ışık sistemini eklemesiyle başlayan bir süreç içerisinde önemli ilerlemeler kat ederek günümüze kadar gelmiştir. Endoskopi yöntemi ile vücuda giriş ve vücut içinden görüntüleme işlemi yapılır. Endoskop ile vücut içinin görüntülenebilmesi için teleskop, görüntüyü alacak kamera sistemi, bu sistemin içeriyi görmesi için soğuk ışık kaynağı, vücut içi boşluk oluşturmak için insüflatör, irigasyon /aspirasyon cihazı, elde edilen görüntünün izlenmesi için monitör, kaydedilebilmesi için de bir kayıt cihazına ihtiyaç vardır. Vücut içine gaz verilerek kavite (boşluk) oluşturan cihazlara insüflatör, vücut içine sıvı verilerek kavite oluşturan cihazlara irigasyon /aspirasyon cihazı denir.
Vücut içinde hem görüntü alan hem de müdahale yapılmasına olanak sağlayan cihazlara teleskop denir( Resim 1&2). Teleskopların üzerine kamera ve soğuk ışık kaynağı bağlanabilir.
Resim 1:Endoskopik Görüntüleme Sistemleri
http://www.megep.meb.gov.tr
Resim 2:Fleksible & Rijit Teleskop
2.2.1. Endoskopik Sistemlerde Kullanılan Temel Cihazlar
1. Kamera ve Monitörler, CCD Kameraları
(Charge Coupled Device) Tüplü kameraların yerini almışlardır. Avantajları, yüksek ışık duyarlılıkları, düşük ağırlıkta olmaları ve gelişmiş elektronik stabiliteleridir. Kameraya gelen ışınlar filtre ile renklere ayrılır. Her renk için ayrı bir sinyal çıkışı vardır. Monochip kameraların çözünürlükleri 400 satır civarındadır. Monochip kameralardan daha güçlü olarak 3-chip kameralar mevcuttur.
2. Video Kayıt Sistemi
Araştırmalar ve eğitim için gereklidir. Operasyon görüntüsünün kaydedilmesini sağlar.
3. High Definition(HD) Video ve Televizyon Sistemleri Elektrik sinyalinin görüntüye dönüştürülmesi için gereklidir.
4. Işık Kaynağı
Endoskop veya laparoskopun ucunda yer alan ampullerle aydınlatma, ısı travmasına neden olduğundan bugün fiber optik cam liflerinin kullanılması ile soğuk ışık kavramı doğmuştur.
5. Teleskop-Optik-Endoskop
Teleskop-optik-endoskop, endoskopi işleminin temel parçasıdır. Dışarıda kalan okülerinden gözle bakılarak ya da bir endokamera ile görüntü ekrana yansıtılarak kullanılır. Genel olarak 5-10 mm çapında ve farklı açılara sahiptir. Kullanıldığı alana göre değişik isimler alır.
6. Insuflatör Cihazı
7. Irigasyon/Aspirasyon Cihazı
Irigasyon/aspirasyon cihazı kadın–doğum, üroloji vb. alanlarda, vücutta boşluk oluşturmak veya saf yıkama amacıyla kullanılır. İzotonik su, salin solüsyon (iletken) ya da yalıtkan sıvı kullanılabilir.
8. Tıraşlama, Koter, Lazer Cihazları
Tıraşlama, koter, lazer cihazları ihtiyaca göre sıyırma, kesme, yakma işlemlerinin endoskopi yoluyla yapılması gerektiğinde sisteme dâhil olan cihazlardır.
9. Enstrumanlar(Cerrahi Aletleri)
Endoskopi işlemi sırasında kesme, dikme, tutma, açma gibi işlemleri yapan malzemelerden oluşur.
10. Needloscop
1.7 mm, 2 mm ve 3 mm çapında teleskoplar olup micro-invasive cerrahide sadece gözlem amacıyla kullanılır.
2.2.2. Endoskopik Sistemlerde İsimlendirme
Endoskopik görüntüleme cihazları, vücut içinde kullanılan bölgelere göre isimlendirilir (24,25).
Tablo 1. Branşlara Göre Endoskopi Sistemlerinin İsimlendirilmesine Örnekler
BRANŞ YAPILAN İŞLEM KULLANILAN CİHAZ
Genel cerrahi Laparoskopi Laparoskop
Üroloji Sistoskopi Sisteskop
Ortopedi Artroskopi Artroskop
Beyin cerrahi Nöroendoskopi Nöroendoskop
KBB Bronkoskopi Bronkoskop
Dermatoloji Dermaskopi Dermaskop
2.2.3. (Yeni Gelişmeler) Kapsül Endoskop Resim 3: Kapsül Endoskop
Mikro elektromekanik teknolojisi ile küçük bir kapsül içerisine yerleştirilmiş elektronik devre ve kamera, gastroskopi ve kolonoskopi işlemlerinde kullanılır. Kapsül endoskoplar hap gibi yutulabilir özelliktedir. Endoskop ile alınan görüntü, vücut dışına yerleştirilmiş elektrotlar ile algılanmakta ve bir kaydedici cihaza aktarılmaktadır (24).
2.2.4. EndoWrist Teknolojisi Resim 4: EndoWrist Teknolojisi
Yeni gelişen sistemlerde, doktorun kontrolündeki endoskopi anlayışının yerine uzaktan kontrollü robotik kolların yaptığı endoskopik yöntemler kullanılmaktadır. Doktor kumanda odasında iken hasta ameliyat masasındadır.
www.drahmetdobrucali.com
2.3. NÖROŞİRÜRJİDE ENDOSKOPİ
İlk kez 1910 yılında L'Espinasse'in hidrosefalide koroid pleksus koterizasyonu için endoskop kullanmasından itibaren modern nöroşirurjide tanı ve tedavi amaçlı çeşitli nöroendoskopi metotları geliştirilmiştir (2). Nöroşirurjide, mikroskopun yansıra kraniotomi sahasında, subaraknoid boşluk veya kistik yapılarda endoskopun da kullanılması ile uygulanan endoskop yardımlı cerrahi ise ilk kez 1977 de Appuzo tarafından tanımlanmıştır (3). Bu yöntemin geliştirilmesi ile ana çalışma alanı ventriküler sistem olan nöroendoskopi, mikrocerrahide yardımcı araç olarak kullanılmaya başlanmıştır. Günümüzde bu yöntem, giderek taraftar bulan “minimal invazif nöroşirürji” prensibinin değerli bir parçası olmayı başarmıştır(27). Pernecsky, endoskop kullanılarak yapılan operasyonları tanımlamak için terminolojide bir sınıflama geliştirmiştir (4). Buna göre;
-Endoskopik Nöroşirürji: Endoskop içinden çalışarak yapılan manipülasyonları,
-Endoskop Yardımlı Mikronöroşirürji: Mikroşirürji ve endoskopik nöroşirurjinin bağımsız olarak uygulandığı manipülasyonlar,
-Endoskop kontrollu Mikronöroşirürji: Mikroskop kullanılmadan endoskopik kontrol altında yapılan mikroşirürji,
-Endoskopik Gözlem: Endoskopun sadece gözlem amaçlı kullanılması olarak tanımlanmıştır.
Mikroskop ve endoskopun kombinasyonu, daha az invaziv ve daha etkili mikrocerrahi uygulamalara olanak sağlamıştır (4).
2.3.1. NÖROENDOSKOPİDE KULLANILAN GEREÇ VE DONANIMLAR
Endoskopların evrimi, gelişen teknolojik ilerlemeler ile paralellik göstermektedir. Endoskoplar rijid ve bükülebilir olmak üzere iki kategoride sınıflandırılmaktadır. Rijid endoskopların baş kısımları sabit olup herhangi bir yönde hareket ettirilemez, teleskop benzeri lens ile görüntünün büyütülerek, göz veya videoya gönderilmesi sağlanır. Yüksek çözünürlük ve görüntü kalitesi, kullanım kolaylığı, hızlı sterilize edilebilmesi ve stereotaksik sistemlere kolay adapte edilebilmesi bu tip endoskopların önemli avantajlarındandır. En önemli dezavantajı cerrahi sahadaki hareket kısıtlılığıdır. Bükülebilir endoskoplarda ise görüntü göz ya da videoya endoskop içi fiber optik kablolar vasıtasıyla ulaşır. Optik lens yerine fiber optik kabloların kullanımı sayesinde endoskop ucu, görüntü kalitesinde çok belirgin bir kayıp olmaksızın eğilip bükülebilmektedir. Fiber optik endoskopların temel avantajları esneklik ve yönlendirmedeki kolaylık olup, bu sayede cerrahi sahanın çevresi nöral ve vasküler yapılara zarar vermeden görüntülenebilir ve daha dar anatomik alanlarda güvenli şekilde çalışılabilir. Rijid endoskoplara göre görüntü kalitesinin daha düşük oluşu ise bükülebilir endoskopların temel dezavantajlarıdır.
Her iki tip endoskop çeşidi için çeşitli cerrahi enstrümanlar geliştirilmiştir. Çalışma kanalı içerisinden kullanılan biyopsi ve kavrayıcı forsepsler, monopolar ve bipolar koagülasyon probları, mikromakaslar ve aspirasyon iğnelerinin yanısıra son senelerde endoskop çalışma kanalından kullanılabilen cerrahi ultrasonik aspiratör (CUSA) sistemleri geliştirilmektedir(27).
2.3.2 NÖROENDOSKOPİ KULLANIM ALANLARI
Nöroşirürjide kraniyal nöroendoskobun kullanım alanları “tanı amaçlı” ve “tedavi amaçlı” olmak üzere iki ana grupta sınıflandırılabilir:
Tanı Amaçlı Endoskopik İşlemler: 1. Ventriküloskopi, sisternoskopi
2. İntraventriküler, intrasisternal bölgelerdeki patolojilerden ve kistik oluşumlardan biyopsi
Tedavi Amaçlı Endoskopik İşlemler:
1. Ventrikülo-peritoneal şant ventriküler ucunun yerleştirilmesi ve revizyonu
2. Üçüncü ventrikülostomi (nonkommünikan hidrosefali, kommünikan hidrosefali, slit ventrikül sendromu, Dandy Walker malformasyonu)
3. Akuaduktoplasti ve akuaduktal stent yerleştirilmesi (izole dördüncü ventrikül, Dandy Walker malformasyonu, kısa segment akuadukt stenozu, akuadukt ağzı membranöz tıkanıklığı)
4. İzole lateral ventrikülde septostomi
5. Multiloküle hidrosefalide septasyonların ve septum pellusidumun fenesterasyonu 6. Koroid pleksus koagülasyonu, pleksektomi
7. Kolloid kist eksizyonu
8. Araknoid kistlerin fenesterasyonu ve eksizyonu (suprasellar, kuadrigeminal sisterna, intraventriküler ve Sylvian araknoid kistler)
9. İntraventriküler tümör ve pineal bölge tümör/kist eksizyonu
10. Endonazal transsfenoidal yaklaşımla hipofizer tümör ve kraniofaringeoma rezeksiyonu 11. Endoskop yardımlı intraserebral tümör rezeksiyonu
12. İntraventriküler hematom irrigasyonu-aspirasyonu
2.3.3 NÖROENDOSKOPİK YAKLAŞIMLAR
Sınırlı beyin cerrahisinde endoskopun kullanımıyla ameliyat mikroskopu tarafından görülemeyen yapıların görselleşmesi artmıştır ( Endoskop Yardımlı Teknik) ; alternatif olarak da tüm bu prosedürler esnasında tek görüntüleme aracı olarak da kullanılabilir ( Endoskop Kontrollü Teknik)(30,31,32,33). 1980’lerden beri KBB (Kulak-Burun-Boğaz) cerrahisi, fonksiyonel endoskopik sinüs cerrahisine öncülük ederek sellaya endoskopik endonazal yaklaşımı cesaretlendirmişlerdir(34,35,36). Jho ve Carrau tarafından geliştirilen bu tekniğin cerrahi beklentilere yönelik yeni görüntüleme araçlarının eklenip geliştirilmesiyle birlikte kafatası tabanı, pontoserebeller açıları, ventriküler ve para-ventriküler alanları etkileyen lezyonlara endoskopik yaklaşımlar tanımlanmaya başlanmıştır(37,38,39).
Günümüzde kraniyal tümörlerin tedavisinde hipofiz adenomlarına endonazal trans-sphenoidal endoskopik yaklaşım, kafa tabanı ve pontoserebellar açılara genişletilmiş endonazal yaklaşım, endoskopik supra-orbital yaklaşım ve ventriküler endoskopik yaklaşım teknikleri giderek artan sayıda çalışmalarla endoskopik tekniklerinin kuramsal yapılarını oluşturmaya destek olmaktadır(30).
İpsilateral yaklaşım, endoskopun kraniotomi sahası içerisinde kullanılması yöntemidir. Bu yöntemde, çalışılan cerrahi alan içerisine endoskopla girilerek, mikroskopun görme alanı dışında kalan yerlerin düz veya açılı endoskoplarla yakından ve endoskopun ışığı ile daha da aydınlatılmış olarak ve ek doku retraksiyonuna gerek duymadan görüntülenmesi sağlanır. Bir şekilde bu amaçla kullanılan dişçi mikro aynalarının fonksiyonunu görmektedir. Ancak bu aynalar kolay buğulanma, yetersiz aydınlanma gibi dezavantajlarının yanında indirekt ve kısıtlı görüşe yol açmaktadır.
Kontralateral yaklaşım ise daha çok orta hattı geçen lezyonlarda kullanılır. Kraniotomi bölgesinin karşıtı bölgeden anahtar deliği şeklinde açılan geniş bir burr deliğinden
endoskopun yerleştirilmesi yöntemidir. Farklı bakış açısı sağlaması ve lezyonun arka tarafının görülmesine olanak vermesi açısından önemlidir.
Transventriküler yaklaşım, ventrikül ile komşu veya ilişkili lezyonlarda kullanılır. Kontralateral kullanımdaki gibi farklı bakış açısı sağlar. Aynı zamanda BOS drenajı ile beyin relaksasyonu olanağı sağlar.
Transnazal yaklaşım, transnazal transmaksiller yaklaşımlarda ve daha çok transsfenoidal cerrahide kullanılır (40).
İntrakistik yaklaşım, kistik glial tümörler, kistik kraniofarinjiomlar, kolloid kist ve disembriyogenetik tümörler gibi kistik lezyonlarda mikroşirürjikal rezeksiyon öncesi nidusun belirlenerek biopsi alınması, kist duvarı ile normal ve patolojik doku arasındaki farkın intraoperatif tanınması, görsel kontrol altında kist sıvısının boşaltılarak intrakranial basıncın düşürülmesi amacı ile uygulanır (40,41)
2.3.4 ENDOSKOPİK BİYOPSİ
Endoskopik intraventriküler tümör biyopsisi operasyonunu ilk tarif edenlerden birisi 1978 yılında Fukushima olmuştur (42,45). Daha sonra yapılan birçok çalışmada tümör biyopsisi ile beraber E3V veya akuaduktoplasti yapılması gibi yöntemlerin etkinliği incelenmiştir (42,44). Yapılan yayınlarda endoskopik biyopsinin tanı koydurma başarısı %57-100 arasında bildirilmiştir.
Endoskopik biyopsinin güvenliği ve tanısal etkinliği konusunda tek merkezli küçük seriler yayınlanmıştır. Son olarak 9 ülkeden 13 merkezin katıldığı bir çalışmada 293 hastanın biyopsi verileri yayınlanmıştır (42,46). En sık biyopsi alınan bölgeler pineal (%33,1), talamik (16.7%), tektal (%13), ve hipotalamik (%4,4) olarak bildirilmiştir. Lezyonların %50’den fazlası >2 cm, %36’sı 10-20 mm arasında, %14’ü ise 10 mm’den küçüktür. Kanama %75 hafif, %13 orta ve %6 şiddetli kanama olarak bildirilmiştir. 1 hasta ölmüş (%0,3), 8 hastada (%3) ise enfeksiyon gelişmiştir. 265 hastada (%90,4)biyopsi tanı hakkında bilgi verici olmuştur. 78 hasta (%26,6) biyopsi sonrası açık ameliyata alınmıştır. Açık ameliyatta alınan patoloji örneğine konulan tanı ile endoskopik biyopsi arasında karşılaştırma yapılmış ve 14 hastada (%17,9) farklı tanı konduğu görülmüştür. Bu 14 olguda endoskopik biyopside yanlış olarak düşük gradeli astrositom ya da pilositik astrositom tanısı konmuş ancak daha sonra açık ameliyatta alınan örneklemelerde bunların 4 tanesinin yüksek gradeli astrositom, diğerlerinin ise menenjiyom, kavernom, primitive nöroektodermal tümor, nörosistiserkozis, ve pineositom oldukları görülmüştür. Sonuç olarak endoskopik biyopsi düşük mortalite ve morbiditesi ile beraber tanı, özellikle, eğer düşük gradeli glial tümör geldiyse, patolojik tanının örnekleme hatasına bağlı olarak yanlış olabileceği göz önünde tutulmalıdır.
Endoskopik biyopsinin sonuçlarıyla ilgili bir başka analiz Japonya’dan yayınlanmıştır (42,47). Bu çalışmada, Japonya genelinde 714 hastaya yapılan endoskopik biyopsi sonuçları incelenmiş, sadece 18 hastada açık ameliyatla alınan son tanı ile endoskopik biyopsi arasında
farklılık bulunmuştur. Bunlar 7 astrositik tümör, 4 pineal tümör, 6 germ hücreli pineal tümör ve 4 diğer lezyonlar olarak bildirilmiştir. Biyopsiler lateral ventrikül (91 hasta) üçüncü ventrikül (339 hasta), dördüncü ventrikül (18 hasta), suprasellar bölge (75 hasta), ve diğer paraventriküler alanlardan (191 hasta) yapılmıştır. Ateş, progressif hidrosefali, BOS kaçağına bağlı infeksiyon, ventrikül içi tümöral kanama şeklinde komplikasyonlar 81 hastada (%11,3) görülmüştür. Hastaların ameliyat öncesi median Karnofski performans skalaları 80, ameliyat sonrası 90 olarak bildirilmiştir. 15 hastada ise (%2,1) post-operatif komplikasyonlara bağlı olarak günlük yaşam kalitesinde düşme bildirilmiştir. Bu çalışmada, ayrıca operasyona bağlı tümöral disseminasyon hakkında da bilgi verilmiştir. Buna göre tümöral disseminasyon %6,8 olarak bildirilmiştir (42,47).
3. MATERYAL-METOD
Bu çalışmanın örneklemini, 1 Ocak 2005- 15 Haziran 2016 yılları arasında E.Ü.T.F.H. Nöroşirürji AD’da “intraventriküler endoskopik yolla biyopsi” örnekleri alınan tüm hastalar oluşturmaktadır. Çalışma verileri tanımlayıcı araştırma türünde olup, hasta epikrizlerinin elektronik ortamda geriye dönük olarak taranması ile elde edilmiştir. On bir yıllık geriye dönük veri taramasında toplam 60 hastanın epikrizine ulaşılmış ve veri tabanını oluşturmuştur.
Çalışmaya dahil edilen hastaların epikriz bilgilerinden elde edilen sosyo demografik özellikleri(yaş, cinsiyet), kitle yerleşim yeri, girişim yılı, patoloji sonucu, başlangıçta ve girişim sonrasında hidrosfali varlığı, E3V endikasyonu, postop komplikasyon varlığı ve mortalite, çalışmanın incelenen değişkenlerini oluşturmuştur.
Çalışmaya dâhil edilen hastaların postoperatif komplikasyon değerlendirmesinde girişimin yapıldığı tarihten taburculuğuna kadar olan süre temel alınmıştır.
Veriler SPSS 23.0 İstatistik Analiz programında, sosyo-demografik özellikler ve araştırma değişkenleri tanımlayıcı sayı, yüzde ve sıklık olarak incelenmiştir.
4. BULGULAR
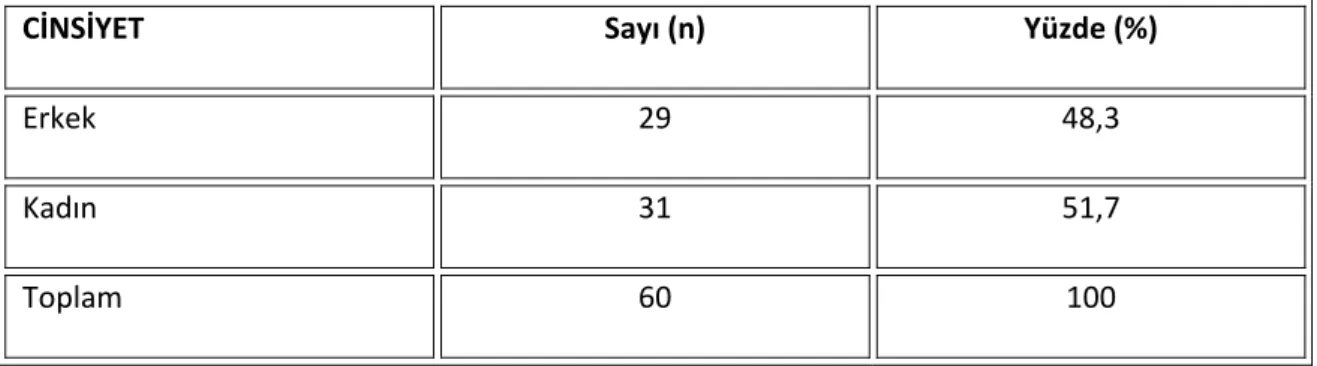
Tablo 2: Endoskopik Biyopsi Alınan Hastaların Cinsiyetlerine Göre Dağılımı
Çalışmaya alınan 60 hastanın % 51,7’si kadın, % 48,3’ü erkekti.
CİNSİYET Sayı (n) Yüzde (%)
Erkek 29 48,3
Kadın 31 51,7
Tablo 3: Endoskopik Biyopsi Alınan Hastaların Yaş Ortalamalarına Göre Dağılımı
Minimum Maximum X Sd
Yaş (ay) 1,00 840,00 237,95 238,63
Çalışmaya dâhil edilen hastalarda en düşük yaş 1 aylık, en büyük yaş 70 yıl ve yaş ortalaması ay olarak; x=237,95 ± 238,63 ay olarak bulunmuştur (Tablo 3).
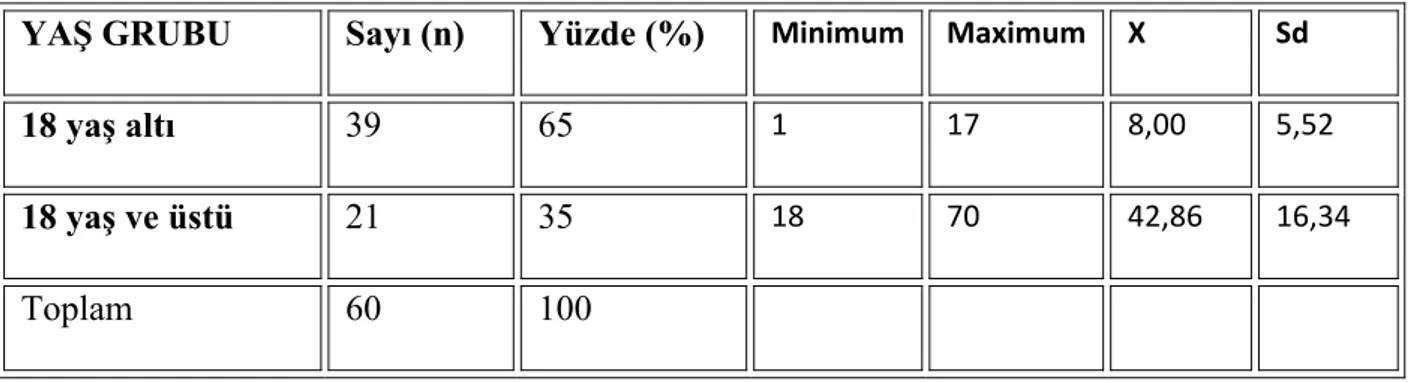
Tablo 4: Endoskopik Biyopsi Alınan Hastaların Yaş Gruplarına &Yaş Ortalamalarına Göre Dağılımı
YAŞ GRUBU Sayı (n) Yüzde (%) Minimum Maximum X Sd
18 yaş altı 39 65 1 17 8,00 5,52
18 yaş ve üstü 21 35 18 70 42,86 16,34
Toplam 60 100
Çalışmaya alınan hastaların %65’i 18 yaş altında çocuk hasta, %35’inin yetişkin hasta olduğu görülmüştür. 18 yaş altı hastaların yaş ortalaması X=8±5.52; yetişkin hastaların yaş ortalamaları X=42,86±16,34 olarak bulunmuştur.
Tablo 5: Endoskopik Biyopsi Alınan Hastaların Kitle Yerleşim Yerine Göre Dağılımı
Kitle Yerleşim Yeri Sayı (n) Yüzde (%)
Pineal 21 35,0 3. Ventrikül Tavanı 10 16,7 Suprasellar 9 15,0 Tektal 5 8,3 Hipotalamik 4 6,7 Lateral Ventrikül Duvarı 5 8,3 Talamik 2 3,3 Atrium Duvarı 1 1,7 Beyin Sapı 1 1,7 Foremen Monro 1 1,7 Multipl Yerleşim 1 1,7 TOPLAM 60 100
Çalışmaya alınan hastaların kitle yerleşim yerine göre dağılımı incelendiğinde; örnek alınan tümörlerin en fazla pineal alanda yerleşmiş olduğu (%35) görüldü. Bu oranın 3. Ventrikül Tavanı’nda %16,7; Suprasellar alanda %15; Tektal alanda %8,3; Hipotalamik ve Lateral Ventrikül Duvarın’da %8,3; Talamik bölgede %3,3 olduğu bulunmuştur.
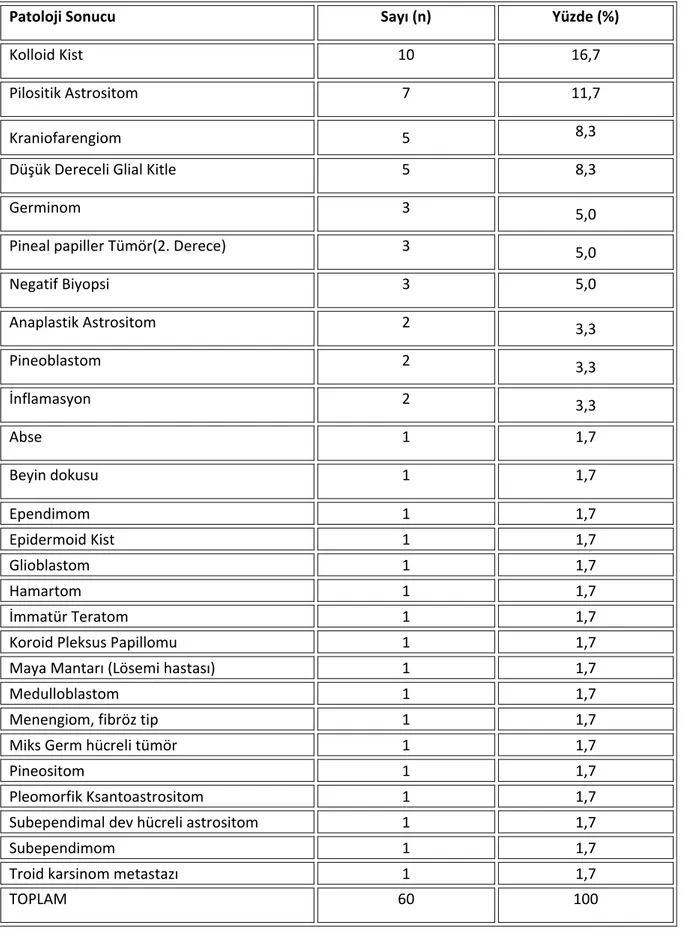
Tablo 6: Endoskopik Biyopsi Alınan Hastaların Patoloji Sonuçlarına Göre Dağılımı
Patoloji Sonucu Sayı (n) Yüzde (%)
Kolloid Kist 10 16,7 Pilositik Astrositom 7 11,7 Kraniofarengiom 5 8,3 Düşük Dereceli Glial Kitle 5 8,3 Germinom 3 5,0 Pineal papiller Tümör(2. Derece) 3 5,0 Negatif Biyopsi 3 5,0 Anaplastik Astrositom 2 3,3 Pineoblastom 2 3,3 İnflamasyon 2 3,3 Abse 1 1,7 Beyin dokusu 1 1,7 Ependimom 1 1,7 Epidermoid Kist 1 1,7 Glioblastom 1 1,7 Hamartom 1 1,7 İmmatür Teratom 1 1,7 Koroid Pleksus Papillomu 1 1,7 Maya Mantarı (Lösemi hastası) 1 1,7 Medulloblastom 1 1,7 Menengiom, fibröz tip 1 1,7 Miks Germ hücreli tümör 1 1,7 Pineositom 1 1,7 Pleomorfik Ksantoastrositom 1 1,7 Subependimal dev hücreli astrositom 1 1,7 Subependimom 1 1,7 Troid karsinom metastazı 1 1,7 TOPLAM 60 100
Biyopsi ile alınan örneklerin patoloji sonuçlarında en fazla Kolloid Kist (%16,7); Pilositik Astrositom %(11,7); Kraniofarengiom ve Düşük Dereceli Glial Kitle (%8,3 ) olduğu görülmüştür. Germinom ve pineal papiller tümör (2.derece) oranı %5, anaplastik astrositom ve pineoblastom oranı%3,3; ependimom, epidermoid kist, glioblastom, hamartom, immatür teratom, koroid pleksus papillomu, maya mantarı(bilinen ALL), medulloblastom, menengiom (fibröz tip), miks germ hücreli tümör, pineositom, pleomorfik ksantoastrositom, subependimal dev hücreli astrositom, subependimom, troid karsinom metastazı oranı %1,7 bulunmuştur. %3,3 hastada patoloji sonucu inflamasyon, %1,7 hastada beyin dokusu ve abse, %5 hastada ise negatif biyopsi olarak belirtilmiştir.
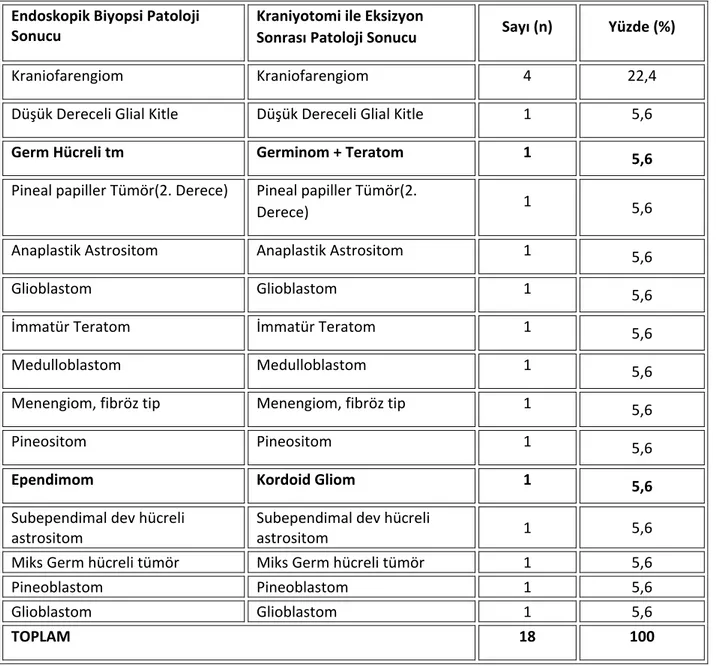
Tablo 6.a: Açık Cerrahi Uygulanan Hastaların Endoskopik Biyopsi Patoloji Sonucu ile Kraniyotomi Sonrası Patoloji Sonuçlarına Göre Dağılımı
Endoskopik Biyopsi Patoloji Sonucu
Kraniyotomi ile Eksizyon
Sonrası Patoloji Sonucu Sayı (n) Yüzde (%)
Kraniofarengiom Kraniofarengiom 4 22,4 Düşük Dereceli Glial Kitle Düşük Dereceli Glial Kitle 1 5,6 Germ Hücreli tm Germinom + Teratom 1 5,6 Pineal papiller Tümör(2. Derece) Pineal papiller Tümör(2. Derece) 1 5,6 Anaplastik Astrositom Anaplastik Astrositom 1 5,6 Glioblastom Glioblastom 1 5,6 İmmatür Teratom İmmatür Teratom 1 5,6 Medulloblastom Medulloblastom 1 5,6 Menengiom, fibröz tip Menengiom, fibröz tip 1 5,6 Pineositom Pineositom 1 5,6 Ependimom Kordoid Gliom 1 5,6 Subependimal dev hücreli astrositom Subependimal dev hücreli astrositom 1 5,6 Miks Germ hücreli tümör Miks Germ hücreli tümör 1 5,6 Pineoblastom Pineoblastom 1 5,6 Glioblastom Glioblastom 1 5,6 TOPLAM 18 100
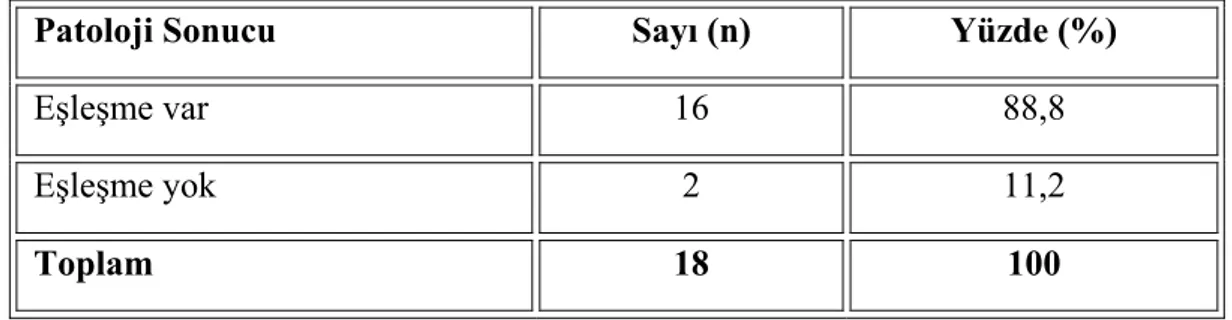
Tablo 6.b: Endoskopik Biyopsi ile Kraniyotomi Sonrası Patoloji Sonuçlarının Eşleşmesine Göre Dağılımı
Patoloji Sonucu Sayı (n) Yüzde (%)
Eşleşme var 16 88,8
Eşleşme yok 2 11,2
Tablo 7: Endoskopik Biyopsi Alınan Hastaların Biyopsi Öncesi Hidrosefali Görülme Sıklığına Göre Dağılımı
Hidrosefali
Varlığı Var Yok
Toplam
Sayı (n) Yüzde (%) Sayı (n) Yüzde (%) Sayı (n) Yüzde (%) Girişim Öncesi
Hidrosefali 50 83,3 10 16,7 60 100
Tablo 7.a: Endoskopik Biyopsi Alınan Hastaların Biyopsi Sonrasında Hidrosefali Görülme Sıklığına Göre Dağılımı
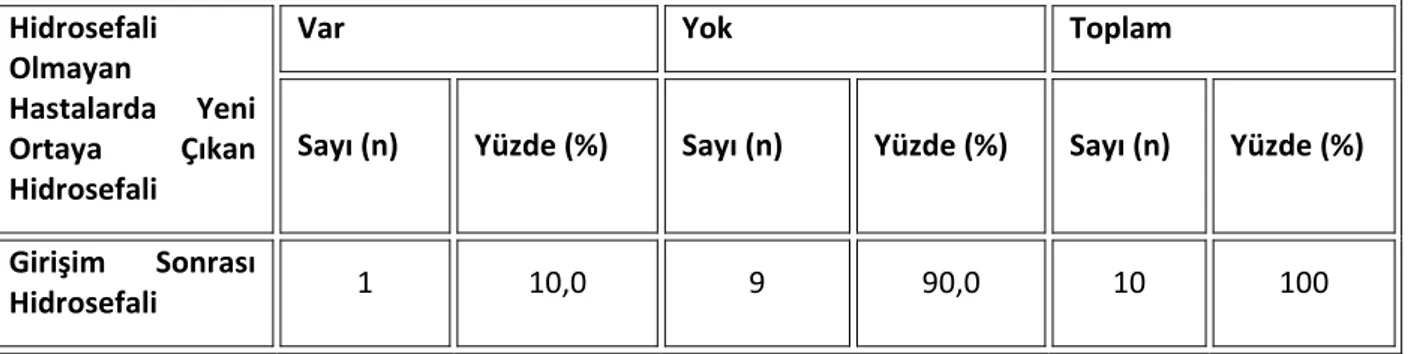
Hastaların %83,3’ü biyopsi öncesi hidrosefali tanısı almıştır(Tablo 7). Endoskopik biyopsi sonrası ise bu hastaların dışında öncesinde hidrosefalisi olmayan 10 hastadan sadece 1 tanesinde hidrosefali gelişmiştir (Tablo 7.a).
Hidrosefali Olmayan
Hastalarda Yeni Ortaya Çıkan Hidrosefali
Var Yok Toplam
Sayı (n) Yüzde (%) Sayı (n) Yüzde (%) Sayı (n) Yüzde (%)
Girişim Sonrası
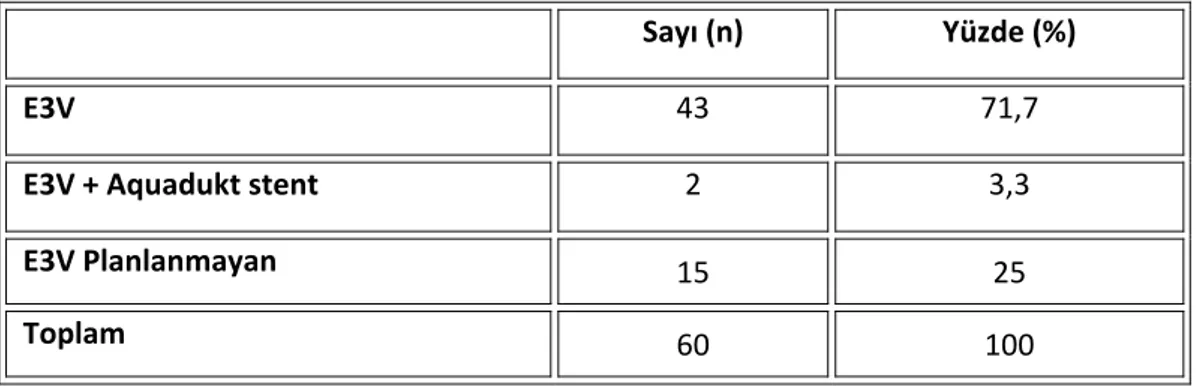
Tablo 8: Hidrosefalisi Olan Hastaların E3V & Aquadukt Stent Kararı Verilmesine Göre Dağılımı
Hidrosefalisi olan 45 hastanın 43’ünde E3V, 2’sinde E3V + Aquadukt stent cerrahi tedavisi uygulanmıştır. Sayı (n) Yüzde (%) E3V 43 71,7 E3V + Aquadukt stent 2 3,3 E3V Planlanmayan 15 25 Toplam 60 100
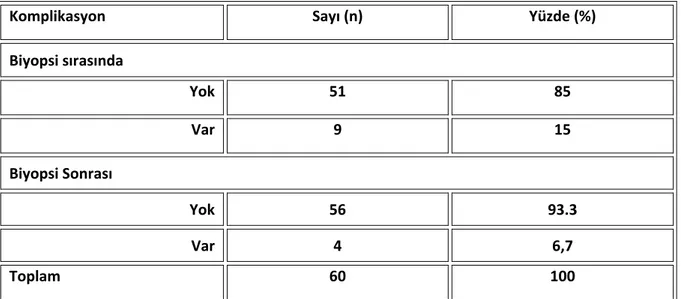
Tablo 9: Endoskopik Biyopsi Alınan Hastaların Komplikasyon Görülme Sıklığına Göre Dağılımı
Komplikasyon Sayı (n) Yüzde (%)
Biyopsi sırasında Yok 51 85 Var 9 15 Biyopsi Sonrası Yok 56 93.3 Var 4 6,7 Toplam 60 100
Endoskopik biyopsi sırasında hastaların %85’inde komplikasyon görülmez iken, % 15’inde komplikasyon oluştuğu saptanmıştır.
Tablo 10: Hastaların Endoskopik Biyopsi Sonrası Oluşan Komplikasyon Türüne Göre Dağılımı
Biyopsi sırasında en fazla komplikasyonun %11,7 oranıyla ventrikül içi kanama olduğu görülmüştür. Biyopsi sonrası ise 4 hastada yara yeri enfeksiyonu gelişmiştir.
Komplikasyon Sayı (n) Yüzde (%)
Biyopsi sırasında Yok 51 85 Ventrikül İçi Hemoraji 7 11,7 Hipotalamik Etkilenme 1 1,7 Ventrikül İçi Hemoraji+Sağ Hemiparezi 1 1,7 Biyopsi sonrası Yok 56 93.3 Yara yeri enfeksiyonu 4 6,7 Toplam 60 100
Tablo 11: Endoskopik Biyopsi Alınan Hastaların Mortalite Durumu Göre Dağılımı
Endoskopik biyopsi ilişkili mortalite durumu incelenmiş ve hastaların %96,7’sinde sağ kalım devam etmiş olup, hipotalamik etkilenme ve ventrikül içi hemorajisi olan 2 hasta exitus olmuştur.
Mortalite Sayı (n) Yüzde (%)
Yaşayan 58 96,7
Exitus 2 3,3
5. TARTIŞMA
Nöroendoskopi, cerrahi teknik ve optik teknolojisindeki gelişmelerle birlikte, nöroşirürjinin vazgeçilemez bir girişim tekniği olarak yerini almaya başlamıştır (47). Her geçen gün endikasyon çeşitliliği artan bu girişim artık günümüzde intra ve paraventriküler tümörler, kistik lezyonlar, pineal tümörler ve idiyopatik hidrosefali olgularında etkinlik ve avantajları konusunda yapılan vaka serileriyle standartları oluşturulmaya çalışılan bir yöntem olarak kabul edilmektedir. Hatta endoskopik biyopsilerden elde edilen sonuçlarla, bu vakalarda bir sonraki tedavi ve izlem yaklaşımları tartışılmaktadır(48). Literatürdeki son çalışmalara bakıldığında; çocuk ve yetişkin hastalarda tekniğin kullanımına ilişkin farklılıklar, cerrahi yaklaşımlar, komplikasyonlar ve tedavi protokolleri üzerine elde edilen bulgularla konuya ilişkin paylaşımların gözle görülür bir oranda artmaya başladığı dikkat çekmektedir(48,49,50,51,52).
Retrospektif olarak yapılan bu çalışmada, intraventrikül endoskopik yolla biyopsi örnekleri alınan 60 hastadan elde ettiğimiz 11 yıllık verileri literatür bilgileri ile karşılaştırdık. Örnekleme alınan hasta sayısının evrene genelleme yapılamayacak bir düzeyde olması çalışmanın kısıtlılığı olarak ele alınsa da, literatür taramalarında, nöroendoskopi kullanımına dair çalışmalar daha ön planda olmasına karşın, nöroendoskopik biyopsiye ilişkin araştırma ve örneklem sayılarının az oluşu dikkat çekici bir nokta olarak göze çarpmaktadır. Constantini ve ark. 2013 yılında yayınladıkları çalışmalarında, literatür eksikliğine dikkat çekerek, nöroendoskopik biyopsinin rutinde uygulanmasına karşın, yöntemin doğruluğu ve güvenilirliği konusunda çok az çalışmanın bulunduğunu belirtmektedirler (46). Oertel ve ark.’nın 2009 yılında 126 hasta ile yaptıkları çalışmada, sadece 12 hastada biyopsi yapıldığı belirtilmektedir (53). Mohanty ve ark. İse 10 yıllık geriye dönük vaka serilerinde 87 hasta ile çalışmışlardır (54). Bu nedenle, nöroendoskopik biyopsi çalışmalarının tek merkezli araştırmalarında örneklem sayısı bildirimlerine göre bizim çalışmamızdaki vaka sayısının
küçümsenmeyecek bir oranda olduğunu söyleyebiliriz. Literatür incelemelerinde, örneklem sayısı 100’ün üstünde olan çalışmaların çoklu merkezlerden elde edilen veriler olduğu [Constantini ve ark.nın 9 ülkeden 13 merkezin katıldığı bir çalışmada 293 hastanın biyopsi verileri (46) ve Hayashi ve ark.nın Japonya genelinde 123 merkezden 714 hastaya yapılan endoskopik biyopsi sonuçları(47)] görülmektedir. Bu çeşitlilik ise çalışmaların standardizasyonu ile ilgili ciddi soru işaretleri yaratmaktadır.
Çalışmamızda sosyo- demografik veri olarak değerlendirilen cinsiyetlerine göre analiz bulgularında hastalarımızın % 51,7’sinin kadın, %48,3’ünün erkek olduğu görülmüştür. Nöroendoskopik biyopsi çalışmaları incelendiğinde, girişim ve cinsiyetle arasında bir ilişki bulgusunun yer almadığı görülmüştür. Aksine literatürde yer alan birçok çalışmada cinsiyetin bu bulgu olarak gösterilmediği, cinsiyetin belirtildiği çalışmaların ise; bizim çalışmamıza benzer şekilde bu bulgunun sosyo -demografik veri olarak ele alındığı tanımlayıcı vaka serilerinden oluştuğu görülmektedir( 47,54,56).
Çalışmaya dahil ettiğimiz hastalarda yaş aralığı 1 aylıktan 70 yaşa kadar bir dağılım göstermekteydi. Hastaların yaş ortalamaları ise X=237,95 ± 238,63 ay olarak bulunmuştur ( Tablo 3). Literatür çalışmalarındaki vakaların, pediatrik grup, yetişkin grup, tümörün lokalizasyonuna özel gruplar veya bizim çalışmamıza benzer tüm biyopsi yapılan hastalar gibi çok çeşitlilik göstermesi nedeniyle çalışmamızdan elde ettiğimiz yaş ortalamasının diğer çalışmalarla karşılaştırılması, benzer ya da farklı bulgu yorumlarına gidilmesinin uygun olmadığı düşünülmüştür. Bu bulgu çalışmanın tanımlayıcı bir verisi olarak sunulmuştur. Mohanty ve ark.nın 2011 yılındaki çalışmalarında da vakaların 1 ay dan 55 yaş üstü gibi geniş bir yaş aralığında dağılım göstermesi nedeniyle, çalışmada sadece yaş grupları olarak sınıflandırılmış, ortalama değerleri verilmemiştir (54).
şekilde 87 hastanın 30’u, Constantini ve ark.nın 293 hasta ile yaptıkları çalışmada ise hastaların % 33,1’i pineal alan tümörü olan hastaların olduğu belirtilmiştir. Song ve ark. nın 49 pediatrik hastayla yaptıkları çalışmada, 28 hastanın pineal alanda tümörü olan hastalar olduğu belirtilmiştir (46,54,59). Pineal alan tümörleri nadir görülmekle birlikte tüm pediatrik tümörlerin %11’ini oluşturmaktadır (57). Pineal alan tümörlerinin de yaklaşık %60 ‘ı germ hücresinden köken alan tümörlerdir (58). Pineal alanın vaskülaritesi nedeniyle geleneksel yaklaşım yöntemlerinin (mikrocerrahi ya da stereotaktik biyopsi) yüksek morbidite oranı nedeniyle günümüzde nöroendoskopik biyopsi hem direkt görüş açısı hem de eşzamanlı hidrosefali tedavisi sağlaması gibi avantajları ile birlikte tanısal duyarlılığı ve minimal invaziv olması nedeniyle yaygın olarak tercih edilmeye başlanmıştır(59,60,61). 1997 yılından beri, hidrosefali ile birlikte görülen pineal alan tümörlerinin erken tedavisinde önemli bir prosedür haline gelen bu yöntem fazladan girişimi azalttığı için de hasta yararına olmaktadır(61,62). Goumnerova çalışmasında pineal alan lezyonlarında tanısal biyopsi başarısını % 87,5 gibi yüksek bir oranda olduğunu ifade etmiştir (63). Benzer şekilde Pople ve ark.nın çalışmasında, endoskopik biyopsinin tanısal başarısı %94 olarak bulunmuştur(64).
Çalışmamızda endoskopik biyopsi yapılan diğer tümörlerin yerleşim yerleri ve sıklıkları, 3. Ventrikül tavanı’nda % 16,7, suprasellar alanda % 15, tektal alanında % 8,3, hipotalamik ve lateral ventrikül duvarında % 8,3; talamik bölgede ise % 3,3 olarak tespit edilmiştir. Atrium duvarı, beyin sapı, foremen monro ile multipl yerleşimde olanların oranları ise %1,7dir (Tablo 5). Goumnerova’nın çalışmasında belirttiği tümör lokalizasyonu ile biyopsinin tanısal etkinliği arasındaki ilişkide lateral ventrikül için %100, Talamik lezyonlarda %57, tektal lezyonlarda% 25’dir (63). Constantini ve ark.nın çalışmasında stereotaktik biopsi ile nöroendoskopik biyopsinin avantajları konusunda yaptıkları açıklamalarda, özellikle ventriküler duvarında yerleşim gösteren tümörlerde nöroendoskopik girişimin tercih edilmesine vurgu yapılmaktadır(46). Bu tercihte cerrahın daha açık görüş
açısı nedeniyle spesifik bir noktayı seçebilme ve biyopsi alanının kanama yönünden de inceleyebilme olanağından tercih sebebi olduğu belirtilmektedir.
Çalışmamızda tümör yerleşim yerleri açısından endoskopik biyopsi tercihinin yukarıda belirtilen birçok literatür bilgisi ışığında doğru bir seçim olduğunu ifade etmek gerekmektedir (46,54,57,59,60,61).
Çalışmamızda biyopsi ile alınan örneklerin patoloji sonuçlarında en fazla kolloid kist (%16,7); pilositik astrositom %(11,7); kraniofarengiom ve düşük dereceli glial kitle (%8,3 ) olduğu görülmüştür (Tablo 6). Literatürde yer alan çalışmaların nöroendoskopik biyopsinin kullanım alanlarını ve etkinliği tanımlayan olması nedeniyle elde edilen patoloji sonuçlarının oranları hemen hemen her çalışmada değişiklik göstermektedir. Dolayısıyla nöroendoskopide elde edilen patoloji sonuçlarını benzerlik / farklılık açısından tartışmak çok anlamlı bulunmamaktadır. Patoloji sonuçlarından elde ettiğimiz diğer bir bulgu ise 4 hastanın biyopsisinde patolojik sonucun tanı koydurucu olmayan, diğer bir ifadeyle başarısız biyopsi olarak değerlendirilmesidir. Literatürdeki çalışmalarla karşılaştırıldığında; Gianetti ve ark. ı 43 hastanın 2’sinde, Mohanty ve ark. ı 87 hastanın 8’inde, Souweidane ise 26 hastanın 1’inde biyopsi sonucunu başarısız, tanı koydurucu olmayan biyopsi olarak belirtmişlerdir ( 54, 65,66). Oranlara bakıldığında başarısız biyopsi açısından çalışmamızla büyük farklılıkların olmadığı görülmektedir. Çalışmaya aldığımız hastaların %1,7’inde ise biyopsi sonucu abse tanısı konarak etken tespit edilmiş ve sonrasında spesifik antibiyoterapi uygulanmıştır. Gianetti ve ark.nın çalışmasında bu oran benzer şekilde %9 olarak gösterilmiştir(66).
Çalışmada biyopsi sonrası kraniyotomi yapılan 18 hastanın biyopsi ve açık cerrahi ile alınan patoloji sonuçları karşılaştırılmıştır (Tablo 6.a & Tablo 6.b). Biyopsi sonrası 18 hastada kraniyotomi uygulanmış ve bu hastaların 16’sında endoskopik biyopsi ile elde edilen patoloji sonucu açık cerrahide eksizyon ile elde edilen patoloji sonucuyla bire bir uyumlu iken, sadece
biyopsi örneğinde “Germ Hücreli tm. “ olarak yorumlanan patoloji sonucu, açık cerrahi sonrası “Germinom + Teratom “ olarak değişmiş; diğer hastanın endoskopik biyopsi örneğinde “Ependimom” yorumlanan patoloji sonucu açık cerrahi sonrası “Kordoid Gliom “ olarak değişiklik göstermiştir (Tablo 6.a).
Çalışmamıza benzer olarak, literatürdeki 7 çalışmada biyopsi sonuçları ile cerrahiden elde edilen sonuçlar karşılaştırılmış ve eşleşme oranları hasta sayısı ile birlikte belirtilmiştir ( Tablo 12) ( 46,54,55,66,67,68,69).
Tablo 12: Biyopsi Ve Açık Cerrahi İle Alınan Patoloji Sonuçlarının Karşılaştırıldığı Literatür Çalışmaları Ve Sonuçları
Literatür Hasta sayısı (n) Eşleşen Sayı (%) Benzer Sayı (%) Eşleşmeyen Sayı (%) O’Brien ve ark, 2006 5 4 (80.0) 0 (0) 1 (20.0) Kumar ve ark., 2007 6 6 (100) 0 (0) 0 (0) Depreitere ve ark., 2007 6 5 (83,3) 0 (0) 1 (16,7) Ahn ve Goumnerova, 2010 2 2 (100) 0 (0) 0 (0) Mohanty et al., 2011 16 12 (75) 4 (25) 0 (0) Constantini ve ark., 2013 78 64 (82,1) 5 (6,4) 9 ( 11,5) Giannetti ve ark.,2015 12 10 (83,3) 0 (0) 2 (16,7) Bizim çalışmamız, 2016 18 16 (88,8) 0 (0) 2 (11,2)
Constantini ve ark.nın çalışmasında biyopsi sonuçları ile açık cerrahiden elde edilen patoloji sonuçlarının eşleştirilmesi yapılmış olup, biyopsinin tanısal doğruluğu üzerinde yorum yapıldığı görülmüştür (46). Bu çalışmada düşük dereceli glial tümörlerde biyopsi sonucunun yanıltıcı olabileceği belirtilmiştir.
Çalışmada biyopsi öncesi hastaların %83,3’ü hidrosefali tanısı almıştır. Endoskopik biyopsi sonrası ise bu hastaların dışında öncesinde hidrosefalisi olmayan 10 hastadan sadece 1
tanesinde hidrosefali gelişmiştir (Tablo 7 & Tablo 7.a). Nöroşirürjide endoskopik biyopsi kullanım alanlarına bakıldığında, tedavi amaçlı kullanımda özellikle non -komünike hidrosefali için tercih edilen bir yöntem olarak karşımıza çıkmaktadır (28,29). Tanısal amaçlı biyopsilerde ise aynı anda tedaviye de olanak vermesi yöntemin üstünlüğü olarak kabul edilmektedir. Özellikle pineal alan tümörlerinin erken tedavisinde girişim prosedürleri oluşturulmakta ve geliştirilmektedir(59,60,61,62).
Endoskopik biyopsi yapılan 60 hastada, biyopsi öncesi hidrosefali tanısı alan 50 hastanın, girişim sırasında 45 ‘inde E3V yapılmış ve bu hastaların 2’sine aynı zamanda aquadukt stent uygulanmıştır. Oertel ve ark.nın pediatrik nöroendoskopik çalışmasında benzer şekilde özellikle beyin tümörüne bağlı hidrosefalisi olan çocuklarda tanı ve tedavi olanağı sağlamasından dolayı endoskopik girişimin tercih edilmesi gerekliliği ve yararlılığına değinilmiştir(53). Oppido ve ark.nın 60 hasta ile yaptıkları çalışmada endoskopi öncesi hidrosefalisi olan 32 (%53) hastada E3V uygulanmıştır(70).
Endoskopik biyopsi yapılan hastalarımızın, biyopsi sırasında %85’inde komplikasyon görülmez iken, % 15’inde komplikasyon oluştuğu ve en yüksek komplikasyonun %11,7 oranıyla ventrikül içi kanama olduğu görülmüştür (Tablo 9). Literatür taramalarında benzer şekilde kanamanın en fazla görülen komplikasyon ve bunun özellikle E3V uygulama prosedürü ile ilişkili olduğu belirtilmektedir. Literatür incelemelerinde hemoraji oranları %0 ile %9,7 arasında değişiklik göstermekte olup bizim çalışmamızda bu oran biraz daha yüksek bulunmuştur(46,54,65,66,69,70). Ancak bildirilen kanama oranlarında kanamanın komplikasyon olarak ele alınmasındaki kriterler değişiklik gösterebilmektedir. Bazı çalışmalarda kanama ciddi, hafif olarak sınıflandırılmıştır(46,54,65,70).
Endoskopik biyopsi sonrasında komplikasyon ise hastalarımızın %6,7’sinde yara yeri enfeksiyonu olarak görülmüştür (Tablo 10). Constantini ve ark.nın çalışmasında bu oran %3(8
Endoskopik biyopsi yapılan hastalarda mortalite ve morbidite oranı oldukça düşüktür (66). Mortalite oranı incelenen literatürlere bağlı olarak %0 ile %6.3 arasında değişiklik göstermektedir(46,54,65,66,69,70,71). Endoskopik biyopsi ilişkili mortalite sonucuna göre; hastalarımızın %96,7’sinde sağ kalım devam etmiş olup, hipotalamik etkilenme ve ventrikül içi hemorajisi olan 2 hasta exitus olmuştur. Elde ettiğimiz %3,3 oran ile mortalite oranımız literatür bilgilerine de uyumlu olarak görülmektedir.
6. SONUÇ
Endoskopik biyopsi günümüzde, intra ve paraventriküler tümörler, kistik lezyonlar, pineal tümörler ve idiyopatik hidrosefali olgularında etkinlik ve avantajları konusunda yapılan vaka serileriyle standartları oluşturulmaya çalışılan bir yöntem olarak kabul edilmektedir. Hatta endoskopik biyopsilerden elde edilen sonuçlarla, bu vakalarda bir sonraki tedavi ve izlem yaklaşımları tartışılmaktadır(48). Tümör tipi, yerleşimi ve özelliği bakımından birbirinden farklı çok geniş bir dağılım gösteren birçok hasta için anlamlı, doğru ve güvenilir bir patalojik veri sağlamada düşük mortalite ve morbidite oranıyla endoskopik biyopsi uygulaması vazgeçilemez bir teknik olarak kabul edilmektedir. Aynı zamanda tanısal doğruluğu ile birlikte E3V gibi tedaviyi sağlayabilmeye yönelik avantajları da bu yöntemin üstünlüğüdür (46,54). 60 hasta ile yaptığımız bu çalışma literatür bilgilerine olan uyumlu sonuçları ile endoskopik biyopsinin doğru ve güvenilir bir yöntem olabileceğine destek sağlamıştır.
7. KAYNAKLAR
1. Cerrahi Nöroanatomi. Türk Nöroşirürji Derneği Cerrahi Nöroanatomi Öğretim ve Eğitim Grubu Bülteni / Aralık 2008 / Sayı: 2
2. Fries C, Perneczky A. Intracranial endoscopy. Adv Tech Stand Neurosurg 25: 21-60, 1999
3. Apuzzo MLJ, Heifetz MD, Weiss MH, Kurze T. Neurosurgical endoscopy using the side-viewing telescope: Technical note. Neurosurgery 46: 398-400,1977
4. Hopf NI, Perneczky A. Endoscopic neurosurgery and endoscope-assisted microneurosurgery for the treatment of intracranial cysts. Neurosurgery 43 (6): 1330-6; tartışma 1336-7, 1998
5. Cappabianca P, Jane Jr. J A, Souweidane M. Endoscopy in neurosurgery. Neurosurg Focus 30 (4):Introduction, 2011
6. Rosin D. History. In: Rosin D, editor. Minimal Access Medicine and Surgery– Principles and Technicques. 1st ed. Oxford: Radcliffe Medical Pres; 1993. s. 1-9. 7. Gorden A. The history and development of endoscopic surgery. In: Sutton C,
Drummond PM, editors. 1st ed. Endoscopic Surgery for Gynaecologists. London: Saunders; 1993. s. 3–7.
8. Cengiz F, İlhan E,Yakan S, Zengel B. Değişmeyen Cerrahi - Değişen Teknikler; Laparoskopik ve Endoskopik Cerrahinin Dünü Bugünü Geleceği. J Clin Anal Med 2013;4(1): 72-5.
9. Bozzini PH. Lichtleiter, eine Erfindung zur Anschauung innerer Teile und Krankheiten. J. Prak. Heilk 1806;24:107-11
10. Desormeaux AJ. The endoscope and its application to the diagnosis and treatment of affections of the genitourinary passages. Chicago Med J 1867;24:177–194.
11. Desormeaux AJ. De l’Endoscope et de Ses Applications au Diagnostic et au Traitement des Affections de l’Urèthre et de la Vessie. Paris: Balliere; 1865
12. History of Endoscopy. http://www.eng.ucy.ac.cy Erişim Tarihi: 01/07/2016
13. Dameword MD. History of the development of gynecologic endoscopic surgery. In: Azziz R, Murply AA, editors. Practical Manual of Operative Laparoscopy and Hysteroscopy. 1st ed. New York: Springer- Verlag; 1992. s. 7–14.
14. Stein S. Das Photo-endoshop. Berl. Klin. Wochenschr 1874;3.
15. Shan J. Endoscopy through the ages. BJU International 2002; 89: 645–52
16. Berci G, Forde KA. History of endoscopy: what lessons have we learned from the past?. Surg Endosc 2000;14(1):5–15
17. Troidl H. Surgical endoscopy and sonography: surgery at the crossroads. Surg Endosc 1990;4(1):41–6.
18. Lau WY, Leow CK, Li AK. History of endoscopic and laparoscopic surgery. World J Surg 1997;21(4):444-53.
19. Radojcic B, Jokic R, Grebeldinger S, Meljnikov I, Radojic N. [History of minimally invasive surgery]. Med Pregl 2009;62(11-12):597-602.
20. Morgenthal CB, Richards WO, Dunkin BJ, Forde KA, Vitale G, Lin E; SAGES Flexible Endoscopy Committee. The role of the surgeon in the evolution of flexible endoscopy. Surg Endosc 2007;21(6):838-53.
21. Richter RM, Littman L, Levowitz BS. Intraoperative fiberoptic colonoscopy. Localization of nonpalpable colonic lesions. Arch Surg 1973;106(2):228.
22. Youmans CR Jr, Patterson M, McDonald DF, Derrick JR. Cystoscopic control of gastric hemorrhage. Arch Surg 1970;100(6):721-3
23. Menteş A. Interventıonal Endoscopy İn Gastroıntestınal Dısease. SSK Tepecik Hastanesi 1991 (1); ss:4-9
24. Biyomedikal Cihaz Teknolojileri. Endoskopik Görüntüleyiciler. T.C. Millî Eğitim Bakanlığı, Ankara, 2012.
25. Endoscopic Imaging. http://www.eng.ucy.ac.cy Erişim tarihi: 01/07/2016
26. Hellwig D, Tirakotai W, Riegel T, Heinze S, Bertalanffy H. Endoscopy in Neurosurgery. Revıew Artıcle. Dtsch Arztebl 2007; 104(4): A 185–91
27. Etuş V, Karabağlı H. Endoscopic Treatment of Hydrocephalus. Türk Nöroşirürji Dergisi 2013, Cilt: 23, Sayı: 2, 216-219
28. Harris LW: Endoscopic techniques in neurosurgery. Microsurgery 15: 541-546, 1994 29. Hellwig D, Grotenhuis JA, Tirakotai W, Riegel T, Schulte DM, Bauer BL, Bertalanffy
H: Endoscopic third ventriculostomy for obstructive hydrocephalus. Neurosurg Rev 28: 1–34, 2005
30. Cappabianca P, Esposito I, Cavallo L M, Barakat M, Jalalod’din H. Endoscopic Tumour Surgery – Current Limits and Future Possibilities. Imaging Neurosurgery, Touch Brıefıngs 2008;p: 77-80
31. Messerklinger W, Acta Otorhinolaryngol Belg, 1980;34:170–76. 32. Kennedy DW, Arch Otolaryngol, 1985;111:643–9.
33. Stammberger H, Otolaryngol Head Neck Surg, 1986;94:147–56. 34. Jho HD, Carrau RL, Acta Neurochir (Wien), 1996;138:1416–25.
35. Cappabianca P, Alfieri A, de Divitiis E, Minim Invasive Neurosurg, 1998;41:66–73. 36. Cappabianca P, Alfieri A, Thermes S, et al., Neurosurgery, 1999;45:392–5, discussion
395–6.
37. Asthagiri AR, Laws ER Jr, Jane JA Jr, Front Horm Res, 2006;34:46–63.
38. Gardner PA, Kassam AB, Rothfus WE, et al., Otolaryngol Clin North Am, 2008;41:215–30, vii.
39. Divitiis E, Cappabianca P, Cavallo LM, Neurosurgery, 2002;51:699–705, discussion 705–697
40. Evliyaoğlu Ç, İlbay K, Ceylan S. Endoskop Yardımlı Tümör Cerrahisi. Türk Nöroşirurji Dergisi 13: 47 - 52, 2003
41. Bauer BL, Heiiwig D. Minimaiiy invasive endoscopic neurosurgery-a survey. Acta Neurochir 61: 1-12, 1994
42. Düz B. İntraventriküler Lezyonlarda Nöroendoskopik Yaklaşım. Türk Nöroşir Derg 2014, Cilt: 24, Ek Sayı: 2, 42-49
43. Fukushima T: Endoscopic biopsy of intraventricular tumors with the use of a ventriculofiberscope. Neurosurgery 2(2): 110-113,1978
44. Yurtseven T, Ersahin Y, Demirtas E, Mutluer S: Neuroendoscopic biopsy for intraventricular tumors. Minim Invasive Neurosurg 46(5):293-299, 2003
45. Fukushima T: Endoscopic biopsy of intraventricular tumors with the use of a ventriculofiberscope. Neurosurgery 2(2): 110-113,1978
46. Constantini S, Mohanty A, Zymberg S, Cavalheiro S, Mallucci C, Hellwig D, Ersahin Y, Mori H, Mascari C, Val JA, et al: Safety and diagnostic accuracy of neuroendoscopic biopsies:An international multicenter study. J Neurosurg Pediatr11(6):704-709,2013
47. Hayashi N, Murai H, Ishihara S, Kitamura T, Miki T, Miwa T, Miyajima M, Nishiyama K, Ohira T, Ono S, et al: Nationwide investigation of the current status of therapeutic neuroendoscopy for ventricular and paraventricular tumors in Japan. J Neurosurg 115(6):1147-1157, 2011
48. Gaab MR: A universal neuroendoscope: development, clinical experience, and perspectives. Childs Nerv Syst 10:481, 1994 (Abstract)
49. Gaab MR, Schroeder HWS, Oertel JMK: Neuroendoscopic approach to intraventricular tumors, in Schmidek HH, Roberts DW (eds): Schmidek & Sweet Operative Neurosurgical Techniques. Indications, Methods, Results, ed 5. Philadelphia: WB Saunders,2005, pp 739– 52
50. Gangemi M, Donati P, Maiuri F, Longatti P, Godano U, Mascari C: Endoscopic third ventriculostomy for hydrocephalus. Minim Invasive Neurosurg 42:128–132, 1999 51. Gangemi M, Maiuri F, Buonamassa S, Colella G, de Divitiis E: Endoscopic third
ventriculostomy in idiopathic normal pressure hydrocephalus. Neurosurgery 55:129– 134, 2004
52. Gangemi M, Maiuri F, Cappabianca P, Alataci C, de Divitiis O, Tomasello F, et al: Endoscopic fenestration of symptomatic septum pellucidum cysts: three case report with discussion on the approaches and technique. Minim Invasive Neurosurg 45:105– 108, 2002
53. Oertel J. M .K, Baldauf J, Schroeder H.W.S, Gaab M. Endoscopic options in children: experience with 134 procedures. Neurosurg Pediatrics 3:000–000, 2009
54. Mohanty A, Santosh V, Devi I, Satish S, Biswas A. Efficacy of simultaneous single-trajectory endoscopic tumor biopsy and endoscopic cerebrospinal fluid diversion procedures in intra- and paraventricular tumors. Neurosurg Focus 30 (4):E4, 2011 55. Ahn E S, Goumnerova L. Endoscopic biopsy of brain tumors in children: diagnostic
success and utility in guiding treatment strategies. Journal of Neurosurgery: Pediatrics, March 2010 / Vol. 5 / No. 3 : Pages 255-262
56. Ishikawa E, Yamamoto T, Matsuda M, Akutsu H, Zaboronok A, Kohzuki H, Miki S, Takano S, Matsumura A. Intraparenchymal brain lesion biopsy guided by a rigid endoscope and navigation system. Surgical Neurology International 2015, 6:149
57. Drummond KJ, Rosenfeld JV: Pineal region tumours in childhood. A 30-year experience. Childs Nerv Syst 15:119–127,1999
58. Weiner HL, Finlay JL: Surgery in the management of primary intracranial germ cell tumors. Childs Nerv Syst 15:770–773,1999
59. Song JH, Kong DS, Shin HJ: Feasibility of neuroendoscopic biopsy of pediatric brain tumors. Childs Nerv Syst 26:1593– 1598, 2010
60. Yamini B, Refai D, Rubin CM, Frim DM: Initial endoscopic management of pineal region tumors and associated hydrocephalus: clinical series and literature review. J Neurosurg 100 (5 Suppl Pediatrics):437–441, 2004
61. Morgenstern P F, Osbun N, Schwartz T H, Greenfield J, Tsiouris A J, Souweidane M M. Pineal region tumors: an optimal approach for simultaneous endoscopic third ventriculostomy and biopsy. Neurosurg Focus 30 (4):E3, 2011
62. Robinson S, Cohen AR: The role of neuroendoscopy in the treatment of pineal region tumors. Surg Neurol 48:360–367, 1997
63. Goumnerova L, Ahn ES. Endoscopic biopsy of brain tumors in children: diagnostic success and utility in guiding treatment strategies. Clinical article. J Neurosurg Pediatr 5:255–262, 2010
64. Pople IK, Athanasiou TC, Sandeman DR, Coakham HB. The role of endoscopic biopsy and third ventriculostomy in the management of pineal region tumours. Br J Neurosurg 15:305–311, 2001
65. Souweıdane M M. Endoscopic management of pediatric brain tumors. Neurosurg Focus 18 (6a):E1, 2005
66. Giannetti AV, Alvarenga AYH, Lemos de Lima TO, Pedrosa HAR, Souweidane MM. Neuroendoscopic biopsy of brain lesions: accuracy and complications. J Neurosurg 122:34–39, 2015
67. Kumar SVR, Mohanty A, Santosh V, Satish S, Devi BI, Praharaj SS. Endoscopic options in management of posteriorthird ventricular tumors. Childs Nerv Syst 23:1135–1145,2007
68. O’Brien DF, Hayhurst C, Pizer B, Mallucci CL: Outcomes in patients undergoing single-trajectory endoscopic third ventriculostomy and endoscopic biopsy for midline tumors presenting with obstructive hydrocephalus. J Neurosurg (3 Suppl) 105:219– 226, 2006
69. Depreitere B, Dasi N, Rutka J, Dirks P, Drake J: Endoscopic biopsy for intraventricular tumors in children. J Neurosurg (5 Suppl) 106:340–346, 2007
70. Oppido PA, Fiorindi A, Benvenuti L, Cattani F, Cipri S, Gangemi M, et al: Neuroendoscopic biopsy of ventricular tumors: a multicentric experience. Neurosurg Focus 30(4):E2, 2011
71. Domínguez-Páez M, Puch-Ramírez M, Rodríguez-Barceló S, Medina-Imbroda JM, Romero-Moreno L, Ibáñez-Botella G, et al: [Neuroendoscopic biopsy. Experience in 31 patients and literature review.] Neurocirurgia (Astur) 22:419–428, 2011