T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
KADIN HASTALIKLARI VE DOĞUM ANABİLİM DALI BAŞKAN: Prof. Dr. İsmail Mete İtil
OKSİTOSİNİN
POLİKİSTİK
OVER
SENDROMU
MODELİ
GELİŞTİRİLEN
SIÇANLARDA
OLASI
TEDAVİ
EDİCİ
ETKİSİNİN
BİYOKİMYASAL
VE
HİSTOLOJİK
OLARAK
GÖSTERİLMESİ
UZMANLIK
TEZİ
Dr. Gül ÖZPINAR
ÖZTÜRK
DANIŞMAN
Prof. Dr. Murat ULUKUŞ
ii
ÖNSÖZ
Uzmanlık eğitimim boyunca bilgi ve tecrübelerinden faydalandığım, yetişmemizde büyük katkıları olan Anabilim Dalı Başkanımız Sayın Prof. Dr. İsmail Mete İtil’e teşekkür ederim.
Tez çalışmam sırasında her konuda yol gösterici olan, bilgi ve deneyimlerini benimle paylaşan tez danışmanım Sayın Prof. Dr. Murat Ulukuş'a teşekkürlerimi bir borç bilirim.
Kadın Hastalıkları ve Doğum Anabilim Dalı'nda uzmanlık eğitimim boyunca bilgi, deneyim ve yardımlarıyla bu alanda yetişmemde katkısı olan başta tüm değerli hocalarıma ve ayrıca birlikte çalışmaktan mutluluk duyduğum tüm araştırma görevlisi arkadaşlarıma, hemşire ve personeline teşekkür ederim.
Çalışmanın yürütülmesi sırasındaki katkılarından dolayı Tıbbi Fizyoloji Anabilim Dalı'ndan Sayın Prof. Dr. Dilek Taşkıran'a ve Yrd. Doç. Dr.Oytun Erbaş'a teşekkür ederi.
Beni yetiştiren ve bugünlere ulaşmamı sağlayan aileme ve benden desteğini esirgemeyen eşim Engin Öztürk'e sonsuz teşekkür ederim.
iii
İ
ÇİNDEKİLER
TABLOLAR VE ŞEKİLLER LİSTESİ ... iv
KISALTMALAR ... v GİRİŞ ... 1 1. GENEL BİLGİLER ... 1 1.1 TANIM ... 1 1.2 TARIHCE ... 1 1.3 ETYOPATOGENEZ ... 5 1.4 KLİNİK BULGULAR ... 9 1.5 LABORATUVAR BULGULARI ... 15
1.6 PKOS VE UZUN DÖNEM ETKİLERİ ... 17
1.7 PKOS’UN TANISI ... 22 1.8 PKOS’ UN TEDAVİSİ ... 24 1.9 OKSİTOSİN ... 27 2. AMAÇ VE YÖNTEM ... 31 3. MATERYAL VE METOD ... 35 4. BULGULAR ... 39 5. TARTIŞMA ... 42 6. SONUÇ ... 46 7. KAYNAKLAR ... 47
iv
TABLOLAR
Tablo 1: Polikistik over sendromu tanı kriterleri... 2
Tablo 2: 2006 Androgen Excess Society tanı kriterleri ... 3
Tablo 3: PKOS ile ayırıcı tanıya giren hastalıklar ... 4
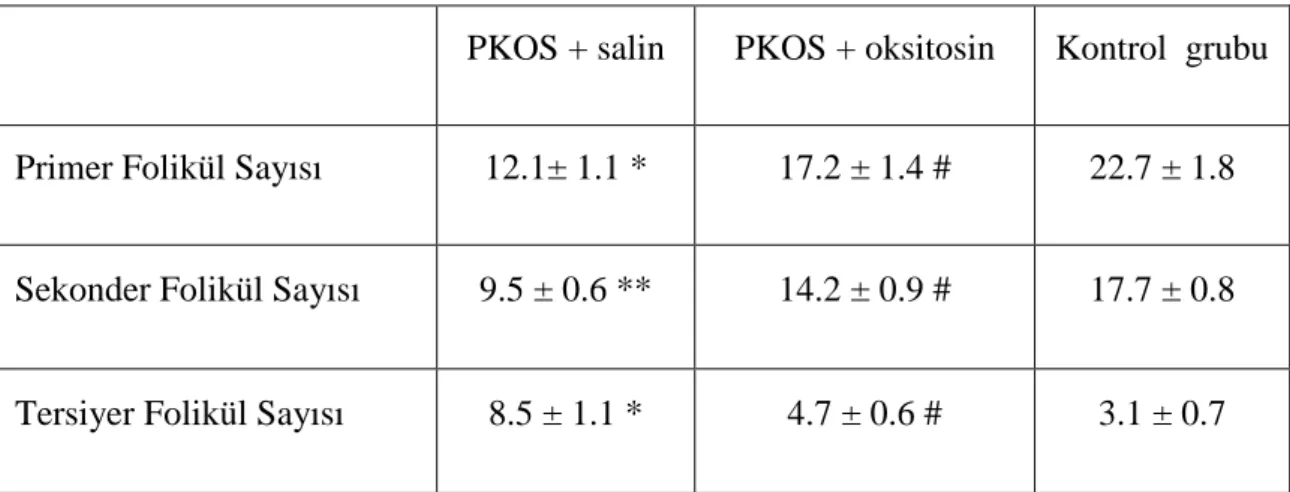
Tablo 4: Primer, sekonder, tersiyer folikül sayısının karşılaştırılması ... 40
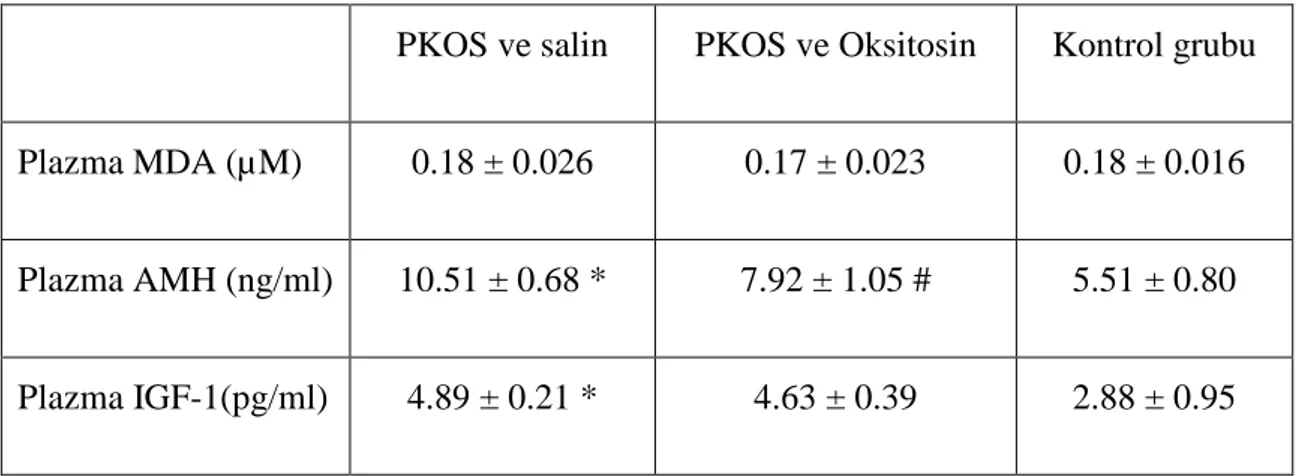
Tablo 5: Plazma AMH, IGF, MDA düzeyleri ... 41
Ş
EKİLLER
Şekil 1: Polikistik over ultrasound görüntüsü... 3Şekil 2: PKO’da insülin/IGF1-2 etkisi ... 8
Şekil 3:Ferriman-Gallwey skorlama skalası ... 11
v
KISALTMALAR
A : Androstenedion
ACTH : Adrenokortikotropin hormon ADA : Amerikan Diyabet Enstitüsü AMH : Anti müllerian hormon
AF : Antral folikül
BGT : Bozulmuş glukoz toleransı DHEA : Dehidroepiandrosteron DHEAS : Dehidroepiandrosteron sülfat DHT : Dihidrotestosteron
DM : Diabetes mellitus
E2 : Östradiol
FGIR : Açlık glukoz / insülin oranı FGS : Ferriman-Gallwey skorlaması FSH : Follikül stimulan hormon GDM : Gestasyonel Diabetes Mellitus GnRH : Gonadotropin releasing hormon HOMA : Homeostasis model assessment HDL : Yüksek dansiteli lipoprotein IGF : İnsulin benzeri büyüme faktörü IL-6 : İnterlökin-6
İD : İnsülin direnci
İP : İntraperitoneal
LDL : Düşük dansiteli lipoprotein
vi MDA : Malondialdehit
OGTT : Oral glukoz tolerans testi
PAI-1 : Plazminojen aktivatör inhibitör-1 PON1 : Paroksanaz 1
PKO : Polikistik over
PKOS : Polikistik over sendromu
PPAR-γ : Peroksizom proliferatör aktive edici reseptör gama
PRL : Prolaktin
RAS : Renin-anjiotensin sistemi
SHBG : Seks hormonu bağlayan globulin SOR : Serbest oksijen radikalleri SOD : Superoksid dismutaz sT : Serbest testosteron
T : Testosteron
TSH : Tiroid stimülan hormon SAi : Serbest androjen indeksi TZD : Tiazolidinedion
VKİ : Vücut kitle indeksi
VLDL : Çok düsük dansiteli lipoprotein WHR : Bel/kalça oranı
1
GİRİŞ
1.
GENEL BİLGİLER
1.1 TANIM
Polikistik over sendromu (PKOS), değişik derecelerde adet düzensizliği (oligomenore, amenore), hirsutizm, akne ve obezite ile seyreden, ilk belirtileri erken ergenlik çağında ortaya çıkan bir sendrom’dur. Polikistik over sendromu kısaca santral sinir sistemi, hipofiz, overler, adrenal bezler ve ekstraglanduler dokular arasındaki ilişkinin bozulmasıyla; üreme çağının herhangi bir döneminde ortaya çıkan, kronik seyirli ve yaşam kalitesini olumsuz etkileyebilen kompleks bir hastalık olarak tanımlanabilir (1).
1.2 TARİHÇE
PKOS; üreme çağındaki kadınlarda en sık görülen endokrin bozukluktur. Prevalansı baz alınan tanı kriterlerine göre değişir fakat, genel olarak %6-8 civarındadır. Bu hastaların %50- 65'inde obezite, %35-45'inde insülin direnci ve %7-10'unda insülinden bağımsız diabetes mellitus saptanır.
İlk kez 1935 te Irving F. Stein ve Michael Leventhal kadınlarda anovulasyon ile ilişkili bir sendrom olarak tanımlamışlardır. Bu sendrom; dördü obez, amenoreik, hirsutik ve büyük polikistik görünümde overleri olan yedi kadın üzerinde tanımlanmıştır. Hastalarda overler normalden büyük ve tunika tabakasının daha kalın olduğu gözlemlenmiş ve bu tablo Stein-Leventhal Sendromu adlandırılmıştır. Over dokularının ½ - ¾’ü kadarlık kısmına kama rezeksiyon yapıldıktan sonra, tümünde menstruel siklusun normale döndüğünü ve hastaların ikisinde de gebelik sağlandığını belirtmişlerdir (2). 1958’de McArthur, Ingersoll ve Worchester bu tanımlanan hasta grubunda idrar LH düzeyinin normalden yüksek olduğunu saptamışlar. Yen; 1980’de polikistik over (PKO) olan hastalarda serum LH/FSH oranının LH lehine bozulması ilk
2
kez 1980’li yıllarda tanıda yer almıştır. USG’de ‘polikistik over görünümü’ ilk kez 1981’de Saurberi ve Cooperberg tarafından tariflenmiştir.(3). Günümüzde Ultrasonografide (USG) polikistik over görünümünün olması tanı koymak için yeterli değildir. Bugün PKOS’un iki tanımı genel kabul görmektedir. Polikistik over sendromu tanı kriterleri Tablo 1’de verilmiştir.
Tablo 1: Polikistik over sendromu tanı kriterleri
1990 NIH tanı kriterleri:
1.Kronik anovulasyon
2.Klinik ve/veya biyokimyasal hiperandrojenizm bulguları ve diğer etyolojik nedenlerin ekarte edilmesi
2003 Rotterdam yeniden gözden geçirilmiş tanı kriterleri:
1.Oligo-anovulasyon
2. .Klinik ve/veya biyokimyasal hiperandrojenizm bulguları
3.USG’de polikistik over varlığı ve diğer etyolojik nedenlerin ekarte edilmesi
Tanı için üç kriterden ikisinin bulunması gerekmektedir.
İlki 1990 yılında U.S National Institues of Health (NIH)’e bağlı National Institues of Child Health Human Disease (NICHD) konsensusunda kararlaştırılmıştır. Diğer tanım ise 2003 yılında Roterdam kentinde toplanan Europan Society for Human Reproduction and Embryology (ESHRE) ve American Society for Reproductive Medicine (ASRM) tarafından yapılmıştır. 2003 Rotterdam yeniden gözden geçirilmiş tanı kriterleri Tablo 1’de gösterilmiştir.(4)
3
Son olarak 2006 yılında Androgen Excess Society tarafından yeni bir düzenleme önerilmiş ve hiperandrojenizm olmadan polikistik over görünümünün olması ile oligo-amenore varlığı tanısal olarak kabul edilmemiştir.(Tablo-2)
Tablo 2: 2006 Androgen Excess Society tanı kriterleri
Androgen Excess Society tanı kriterleri
1. Hiperandrojenizm (hirsutizm ve/veya hiperandrojenemi)
2. Over disfonksiyonu (oligo-anovulasyon ve/veya polikistik over)
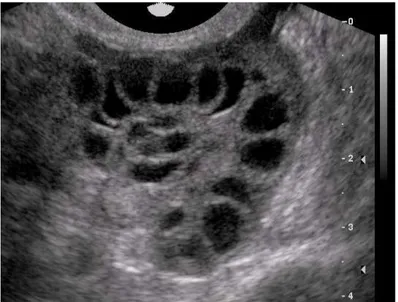
USG ile stroma dokusunun artması nedeniyle büyümüş overler ve inci kolye tarzında periferik yerlesimli 2-8 mm boyutlarında 10’un üzerinde folikül görünümünü PKO olarak ifade edilmektedir (4). Polikistik overlerin ultrasonografi görüntüsü Şekil 1’de gösterilmiştir.
4
PKOS'nda USG bulguları ile birlikte bazı klinik (Oligomenore/amenore, obezite, hiperandrojenizm, akne, hirsutizm, alopesi) ve biyokimyasal belirteçlerde (Serum total testosteron veya serbest testosteron, LH, insülin düzeylerinin artması gibi) de bulunur (4).
Anovulatuar kadınlarda PKO sıklığı %75’tir. Normal kadınların da %8-25’inde USG’de PKO görüntüsüne rastlanabilmektedir (6).
PKOS tanısı koyabilmek için benzer kliniğe neden olabilecek hastalıkların ekarte edilmesi gerekir. Tablo 3'de PKOS ile ayırıcı tanıya giren hastalıklar gösterilmiştir.
Tablo 3: PKOS ile ayırıcı tanıya giren hastalıklar
-Androjen salgılayan tümörler -Ekzojen androjen alımı -Cushing Sendromu
-Nonklasik konjenital adrenal hiperplazi -Akromegali
-Primer hipotalamik amenore -Primer ovaryen yetmezlik -Tiroid patolojileri
-Hiperprolaktinemi durumları -Hipertekozis
Polikistik over sendrom ayırıcı tanısı yapılırken; androjen yüksekliği ve anovulasyon ile birlikte olan klinik durumlar, androjen salgılayan tümörler, Cushing sendromu, konjenital adrenal hiperplazi, hiperprolaktinemi mutlaka göz önünde bulundurulmalıdır.
Dehidroepiandrostenodion sülfat(DHEA) ve dehidroepiandrostenodion (DHEA) düzeyleri androjen salgılayan tümörlerde yükselmektedir. Konjenital adrenal hiperplazi
5
ile ayırıcı tanı periferik kanda 17- hidroksi progesteron (17-OHP) düzeylerinin yüksekliğinin gösterilmesiyle yapılabilir.
Hiperprolaktinemi, GnRH pulsasyonlarını değiştirerek gonadotropin salınımını etkiler. Östrojenin LH üzerine olan pozitif "feedback" etkisini engeller, adrenal kaynaklı androjenlerin salınmasını tetikler. PKOS ile ayırıcı tanıda PRL düzeyleri de önemlidir. PKOS’da %3-12 oranında orta düzeyde PRL yüksekliği görülür. Cushing sendromu, devamlı olarak kortizol sekresyonu fazlalığıdır. Tanıda bazal şartlarda en faydalı ölçümler 24 saatlik idrarda kortizol miktarı (10-90 µg/24 saat) ve gece plazma kortizol düzeyidir (< 15 µg/dL) (7)
1.3 ETYOPATOGENEZ
Menstrüasyondan hemen önce ve menstrüasyon sırasında östrojen, progesteron ve inhibin’in negatif "feedback" etkisi ortadan kalkar ve böylece hipofizden FSH sekresyonu artar. Bu artış folliküler gelişim ve steroidogenez için gereklidir. Follikülün gelişmesi ile follikül içerisinde oluşan otokrin-parakrin faktörler FSH’ya olan folliküler duyarlılığı devam ettirir. Bu da folliküler mikroçevredeki androjenik üstünlüğün östrojenik üstünlüğe dönüştürülmesini sağlar. FSH ve aktivinin birlikte etki göstermesi, ovulasyon ve luteinizasyon için gerekli olan, granuloza hücreleri üzerinde LH reseptörlerinin ortaya çıkmasını sağlar. Dolaşımdaki östradiol (E2) seviyesinin ani artışı ovulasyonu tetikler. Hipofiz ön lobu ve muhtemelen de hipotalamus üzerinde oluşturulan bir pozitif "feedback" etki ile de, siklus ortasında LH salınımı, yumurtanın ekspulsiyonu ve korpus luteumun oluşması sağlanır. Ovulasyonla birlikte E2 düzeylerinde ikinci bir artış ve progesteron artışı ile beraber düşük LH ve FSH düzeyleri ile karakterize olan 14 günlük luteal faz oluşturulur. Korpus luteumun fonksiyonunu kaybetmesi ile hormon düzeyleri düşer, FSH yükselmeye başlar ve yeni bir siklus oluşur (7).
PKOS’ta etyoloji kesin olarak bilinmemekle birlikte sendrom genetik ve çevresel faktörlerin etkileşimiyle ortaya çıkmış sık görülen ve kompleks bir problem olarak değerlendirilebilir. Sendromun fizyopatalojisinde gonadotropin dinamiğinde
6
değişiklikler, steroidogenez defektleri, insülin salınım ve etki bozuklukları beraberinde genetik faktörler ön plana çıkmaktadır.
a. Gonadotropin sekresyon defektleri: PKOS’ta hipotalamus-hipofiz-over aksının fonksiyonunda bozukluklar tanımlanmıştır. Gonadotropin Releasing Hormon(GnRH) puls sıklığının artışı, GnRH’ya yanıt artışı ve yüksek östrojen düzeylerinin neden olduğu serum LH konsantrasyonu artışı izlenmektedir (8). LH’nın aksine hipofizer FSH sekresyonu erken foliküler fazda belirgin düşük olarak tesbit edilmektedir (9).Düşük FSH düzeyinin nedeni tam olarak anlaşılamamakla beraber kronik karşılanmamış östrojenin negatif geri-denetim etkisi ile, artmış GnRH pulsatilitesinin LH β gen ekspresyonunu FSH β gen ekspresyonuna göre daha fazla arttırması patogenezde rol aldığı düşünülen iki mekanizmadır (10).
b. Steroidogenez değisiklikleri: Yükselmiş LH düzeyi overlerde siklik adenozin monofosfat (cAMP) artışı ile steroidogenezi androjenlerin üretimi yönünde etkiler ki bu da folikül gelişiminde duraklama ile sonuçlanmaktadır (11). Artmış LH düzeylerine cevap olarak androjen salgısı hızlanmaktadır. Yükselmiş androjen düzeyleri, ekstraglandüler olarak androjen-östrojen dönüşümünü arttırırken, seks hormon bağlayıcı globulin (SHBG) sentezini baskılamakta, sonuçta östrojen düzeylerinde yükselmeye neden olmaktadır. Buna ilaveten SHBG’deki azalma, serbest testosteron miktarında iki katlık bir artışa neden olmaktadır.
Artmış androjenler, over içerisinde normal follikül gelişmesinin engellenmesine katkıda bulunmakta ve prematür atreziyi uyarmaktadır. Lokal androjen bloğu, sürekli anovulasyonun devam etmesinin ana nedenlerinden biridir. Overdeki androjen konsantrasyonları yüksek olduğunda bunlar, aromataz aktivitesini ve östrojen sentezini inhibe eden 5-alfa metabolitlerine dönüşmektedir.
Normalde oluşan, bir siklusun bitmesinden sonra yeni bir siklusun başlayamaması sonucunda sabit bir hormonal durum ortaya çıkmakta, bu da artmış androjen sentezine bağlanabilecek sürekli bir anovulasyona neden olmaktadır (7).
7
c. Genetik faktörler: PKOS hastalarında genetik özellikler de araştırılmıştır (24). PKOS’lu kızların annelerinde ve kız kardeslerinde hiperandrojenizm ve menstrüel disfonksiyonun artmakla birlikte, baba ve erkek kardeşlerde de serum androjen düzeyleri artmış gibi görünmektedir (25). Bu hastaların birinci derece yakınlarda insülin direnci (İD) ve değişik derecelerde glukoz hemostaz bozukluklarının görülme riski, yaş ve vücut kitle indeksi (VKİ) artmıştır (25). PKOS gelişiminde rol oynayabilecek olası genetik defektlerin incelendiği değişik çalışmalar sendromun kompleks, poligenik bir bozukluk olduğunu göstermektedir.
d. İnsülin salınım bozuklukları: İnsülin anabolik etkili bir hormon olup başlıca etkileri
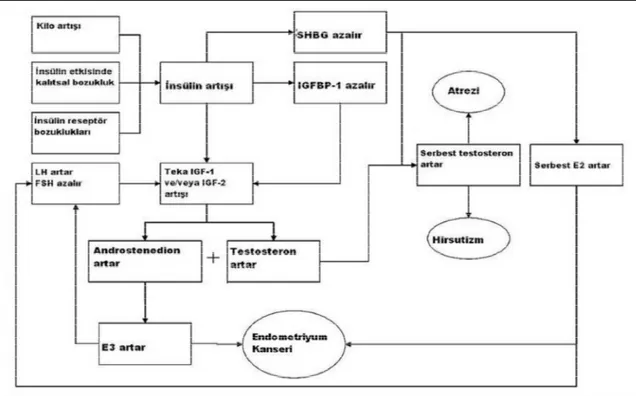
hücreye glukoz ve aminoasit girişini, lipojenez ve mitojenezi arttırmaktır. İnsülin etkilerini insülin reseptörleri aracılığıyla yapar. İnsülin benzeri büyüme faktörü (IGF-1) büyüme hormonu etkilerinde bir ara madde olarak keşfedilmiştir. Bugün için büyüme hormonunun birçok dokuda etkilerini IGF-1 aracılığı ile yaptığı kabul edilmektedir. IGF-1 karaciğerde üretilen ve 12. kromozom tarafından kodlanan 70 aminoasitli bir polipeptiddir. Kanda insülin benzeri büyüme faktörü bağlayan protein-1 (IGFBP-1) ile taşınır. IGF-1 ve IGF-2’nin reseptörleri farklıdır. IGF-1 resptörleri insülin reseptörleri ile benzerlik gösterir. Pek çok hücrede DNA sentezini arttırarak mitojenik etki yapar. IGF-2 ise embriyonik ve fetal gelişim üzerine etkilidir (15,16) Erken folliküler dönem gonadotropinlerden bağımsızdır ve bu dönemde lokal büyüme faktörleri gereklidir. Özellikle IGF-1’in bu dönemde etkili olduğuna dair pek çok çalışma vardır. IGF-1’in inaktivasyonu ile follikül gelişiminin preantral dönemde durduğu gösterilmiştir (17). PKOS’ da birçok alanda IGF-1 artmıştır. Bu artış LH ve FSH’ya over cevabını arttırır. Buna bağlı olarakta gelişen follikül sayısı artar, fakat bunu atrezi izler.
PKOS’da IGFBP-1’in azalması da IGF-1’in etkilerini arttırır. IGF-1 ve insülin birlikte androjen üretimini arttırırlar.IGF-1’in insülin ile benzer etkisi granüloza hücrelerinde aromataz aktivitesini arttırır (18). Şekil 2’de PKOS’da insülin/IGF1-2 etkisi gösterilmiştir.
8
Şekil 2: PKOS’da insülin/IGF1-2 etkisi
İnsülin direnci (İD), belli bir glukoz düzeyi için gereken insülin yanıtının olmamasıdır. PKOS’lu vakaların yaklaşık %10’unda ID saptanmıştır. Bu hastalarda ID’nin patofizyolojisi henüz tam olarak bilinmemektedir (19).
Hem zayıf hem de obez PKOS hastalarında İnsülin direnci ve kompanzatuar hiperinsülinemi sık görülen bir bulgudur (20). İlk kez 1980 yılında Burghen ve ark. (21) tarafından obez PKOS’lu hastalarda hiperandrojenizm ve hiperinsülineminin pozitif lineer korelasyonu bulunmuştur. Sendromda insülin etki anormalliklerinin mekanizması net olarak bilinmemektedir. Ne obezite ne de tek basına androjen fazlalığı PKOS’ da görülen insülin etki bozukluğunu açıklamamaktadır (22).İD ölçümü PKOS tanı kriteleri arasında yer almaz (23).
Sonuç olarak patofizyolojiyi anlamamızı kolaylaştıran bu alt gruplar aslında birbiriyle iç içedir. Bazı olgularda ailesel bir yatkınlık genetik bağlantıyı düsündürmekle beraber aday genler hala bulunamamıştır.
9 1.4 KLİNİK BULGULAR
PKOS ile ilgili pek çok farklı görüş vardır. Klinisyenlerin çoğu PKOS’u gördüklerinde kesin olarak tanımlayabildikleri konusunda hemfikirdirler. Semptomlar menarşla başlamaktadır, ancak hastalığın klinik gidişi birçok farklı faktörlerden etkilenmektedir. Erken yaşlarda daha çok mestrüel düzensizlikler görülmekte iken, daha ileri yaşlarda ise hirsutizm ve infertilite ön plana çıkmaktadır.
Orta ve ileri derecede PKO’leri olan bazı vakalarda ovaryan disfonksiyona sebep olacak kadar adipoz doku birikinceye kadar semptom görülmeyebilir (26). PKOS’lu olguların %20’de adetlerin düzenli olabileceği de bildirilmiştir (27). Kronik oligo-amenore kriteri olarak menslerin arasında 45 günden daha uzun bir süre olması veya yılda sekiz veya daha az mens görme, hiperandrojenizm kriteri olarak ise klinik hirsutizm varlığı (akne, hirsutizm, androjenik alopesi, akanthosis nigricans) veya laboratuvar bulgusu olarak androjenlerin yüksekliği (serum total ve serbest testosteron düzeylerinde artış) kullanılmaktadır (28).
PKOS’de anahtar bulgu, anovulasyon olup, olguların % 50’sinde amenore , % 30’unda ise düzensiz şiddetli kanama seklinde kendini göstermektedir. Anovulatuar hastaların %70’inde hirsutizm mevcuttur. Gerçek virilizasyon nadir görülür. Olgularda obezite varlığı çok değişkenlik gösterir ve tanısal değeri bulunamamıştır. Bununla birlikte vücut kitle indeksi (VKİ) arttıkça, T düzeyi de arttığından aşırı kilolu anovulatuar kadınlarda hirsutizm daha sıktır. Alopesi ve akneye de hiperandrojenizm neden olmaktadır.
1.4.1. Kronik Anovulasyon
Kronik anovulasyonun klinik görüntüsü, irregüler menstrüel siklus, oligomenore ve ya amenore şeklindedir. PKOS’da menstrual disfonksiyon genellikle menarş ile baslar. Şiddetli oligomenore durumlarında endometrial hiperplazi ve ardından gelişebilecek neoplastik değişiklik riski mevcuttur. Ultrasonografi ile endometrial kalınlık ölçülerek takip edilebilse de bu yöntemin malign değişim için risk altındaki kadınların belirlenmesinde hassas olup olmadığı tartışmalıdır. PKOS’lu ve şiddetli oligomenoresi
10
olan kadınlarda, düzenli bir çekilme kanaması sağlamak gerekir. Kronik anovulasyonlu PKOS’da anormal follikülogenezis söz konusudur. Bu hastalarda infertilite şikâyeti de mevcuttur. Nadiren, spontan gebelik ve ovulasyon olabilmektedir. Ancak oluşan gebeliklerde spontan abortus, gestasyonel DM ve gebelikte hipertansif durumlara yatkınlık artmış olarak bulunmuştur (7, 29).
Kronik anovulasyonun klinik sonuçları olarak infertilite, amenoreden disfonksiyonel kanamaya kadar değişen menstrüel kanama problemleri, hirsutizm, akne, endometrial kanser ve muhtemelen meme kanseri riskinde artış, kardiovasküler sistem hastalıklarında artış şeklinde olabilmektedir.
1.4.2. Hiperandrojenizm ve hirsutizm
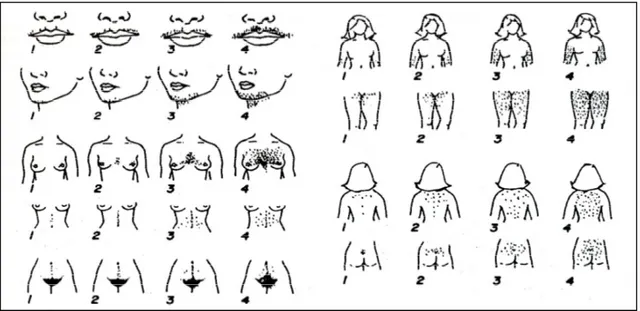
PKOS, androjen fazlalığının ve hirsutizmin en sık rastlanan nedenidir. Hirsutizmli hastaların %65-85i PKOS’lu olgulardır (30,31). Hiperandrojenemi hastaların yaklaşık yarısında mevcuttur.LH; overin teka hücrelerinden androjen sentezini uyarır, SHBG’nin azalması da serbest androjen formlarını arttırır. Dolaşımdaki major androjen testosteron olmakla birlikte, DHT; kıl follikülleri ve derideki pilosebase birim gibi, birçok duyarlı dokuda major androjendir. Hirsutizmde, total ve serbest testosteron yüksekliği, ovaryan hiperandrojenemi bulgusudur. Androstenedion düzeyleri de genelde artar ve ovaryan orjinlidir. DHEA ve DHEAS adrenal kökenlidir, yükselebilir. Periferde testosteron ve DHT’a dönüsür. Androjenler periferde östrona (E3) dönüşür. LH/FSH yüksekliği %75 olguda saptanır. Hirsutizmin esas nedeni; anovulasyon ve overlerden aşırı androjen üretimidir (32). Hirsutizm; kadınlarda kıllanmanın normalde hiç olmadığı veya çok hafif olduğu androjene duyarlı alanlarda, tipik koyu ve kalın telli kılların fazlalığı olarak tanımlanır. Hastaların %70’i hirsutizm sergilerken, daha azı ise aknelidir. Kıl büyümesindeki artışın derecesinin belirlenmesinde Ferriman-Gallwey yöntemi kullanılır (33). Burada vücudun 9 farklı bölgesi objektif olarak değerlendirilir.
Bu bölgeler yüz (özellikle bıyık ve sakal bölgesi), göğüs, meme areolası, sırtın üst kısımları, sırtın asağı kısımları, linea alba, kalçalar, uyluk iç kısımları ve dış genital
11
bölgelerdir. Her bölge için 1 ile 4 arasında puan verilir. Toplam 8’in üzerindeki değerler hirsutizm olarak değerlendirilir. Hirsutizm hafif, orta, siddetli olarak 3 gruba ayrılır. Hafif hirsut kadınlarda tek alan skoru 0-2 olup tipik olarak, yüzde, göğüs ve alt abdomende, ince, renkli kıllar bulunur. Orta derecede hirsutizmde, tek alanda 1-3 skorlarına rastlanır. Bu grupta kol-bacakta, yüzde göğüste, abdomende ve perinede kaba, renkli, uzayabilen kıllar vardır. Şiddetli hirsutizmde ise skor 3-4 ve üstü olup tüm çene altı sakal bölgesinde ve geri kalan androjene duyarlı alanlarda kalın ve renkli kıllar mevcuttur (Şekil 3).
Şekil 3: Ferriman-Gallwey skorlama skalası
1.4.3. Obezite
Obezite; PKOS’lu kadınlarda sık görülür ve genetik faktörler, fiziksel aktivite ve diyetle bağlantılı olabilir. Obezite, normal ovulasyonu bozan üç değişiklik yapmakta olup, zayıflama ile bu değisiklikler düzelebilmektedir. Bu değişiklikler şunlardır: periferde androjenlerin östrojenlere aromatizasyonu, serbest E2 ve testosteron düzeylerinin artmasına neden olan SHBG düzeylerinde azalma ve overin stroma dokusunda androjen sentezini uyaran insülin düzeyinde artış. PKOS olan kadınlarda
12
vücut kütle indeksi normal kabul edilen sınırın genelde üzerindedir. Şişmanlık genelde santral obezite şeklindedir. Santral obezitede bel/kalça oranı fazladır (>0.85). VKİ obezitenin en yaygın kullanılan indeksidir. VKİ; ağırlığın boyun karesine bölünmesiyle hesaplanır (kg/m2). VKİ aralıkları genellikle şu sekilde tanımlanmıstır; normal ağırlıkta (19.1-24.9 kg/m2), yüksek kilolu (25-29.9kg/m2) ve obez (>30kg/m2). Bel ölçüsü olarak göğüs kafesi ile krista iliakalar arasındaki en küçük çevre ölçülürken, kalça ölçüsü olarak bel ve uyluklar arasındaki en geniş çevre ölçülmektedir. Kadınlarda 0.85 ve altındaki değerler normal kabul edilir. WHR 0.85’ten fazla olduğunda, android tipte yağ dağılımı söz konusudur. Obez ve santral yağ dağılımlı kadınlar daha yüksek LH, androstenedion, E3, insülin, trigliserid, LDL, apolipoprotein-B seviyelerine sahiptir. HDL ise düşüktür (36). Yüksek bel/kalça oranının, daha fazla menstrual anormallik ve daha yüksek infertilite prevalansıyla birlikte olduğu gösterilmiştir. Obezite ve PKOS’u olan hastaların, sıkı kalori kısıtlaması sonucu %5 veya daha fazla kilo kaybı durumunda insülin, IGF-1, SHBG ve menstrüasyonda olumlu değişiklikler gözlemlenmiştir. Menstrüel düzen sağlanmış, hirsutizm düzelmiştir. Bazı spontan gebelikler de görülmüştür (34).
PKOS gibi hiperandrojenik obezitede, androjenlerin artmış üretimi menstrüel düzensizlikle birliktedir. Estrona çevrilen androstenedion miktarı total vücud ağırlığına bağlı olarak değisiklik gösterir (34). Obezite ve aşırı kilonun menstrüel disfonksiyona anlamlı bir katkıda bulunduğu görülmektedir. Yayınlarda; VKİ ve infertilite’nin artmış insidansı arasında bir ilişki olduğu görülmektedir (35). Kilo fazlalığı, artmış abortus riski ile de birliktedir. Genel olarak PKOS‘lu kadınların, PKOS olmayanlara göre daha yüksek oranda abortus riskine sahip olduğu gösterilmistir. Bu sonuç kısmende olsa, PKOS’daki yüksek LH konsatrasyonu sonucunda bozulmus oosit ve embriyo kalitesi ile ilişkilendirilir. Artmış VKİ ile DM arasındaki ilişki konusunda çok miktarda yayın vardır. PKOS olan olgularda önemli bir glukoz intoleransı riski vardır. Yapılan bir çalışmada VKİ’i 30 kg/m2’nin üzerindeki 20-30 yaş arasındaki tüm kadınların %18’inde glukoz metabolizmasında bozukluk saptanmıştır. PKOS’u olan kadınların %15’inde başlangıç çalışmasında glukoz toleransı normalken, 5-7 yıl sonra bozulmuş glukoz toleransına veya aşikar diabete dönüş görülmektedir (37). Bu değişimin hemen hepsinin artan obezite ile bağlantılı olabileceği ve kilo alımının önlenmesinin anormal glukoz toleransının azaltılmasında yararlı olabileceği düşünülmektedir. PKOS’lu
13
kadınlar gebeyken gestasyonel diabet olmaya daha eğilimlidir ve gebelikte glukoz intoleransı olan pek çok kadın PKOS özelliklerine sahiptir. Obezite ve PKOS’u olan hastaların kalori kısıtlaması sonucu %5 veya daha fazla kilo kaybı durumunda insülin, IGF-1,SHBG düzeylerinde değisiklikler gözlemlenmiştir. Menstrüel düzen sağlanmış, hirsutizm düzelmiştir. Bazı hastalarda spontan gebelikler de görülmüştür (38).
1.4.4. İnfertilite
PKOS’da infertilitenin primer sebebi anovulasyondur. Anovulasyon’a neden olan LH hipersekresyonu ile infertilite arasındaki ilişki sanıldığından daha komplekstir. LH ayrıca bilinmeyen bir mekanizma ile fertilizasyon ve erken gebelik kayıpları ile de ilişkili olabilir (34,39). Ovulasyon indüksiyonundaki ve yardımcı üreme tekniklerindeki gelişmelere rağmen PKOS’lu infertil hastalarda anlamlı bir başarıya ulaşılamamaktadır. Kilo vermeye direnç gösteren hastalarda ovulasyon indüksiyonu esnasında hiperinsülinemiyi azaltıcı akut bir diyet kısıtlaması tedavinin etkinliğini artıracaktır (39, 40).
1.4.5. Hiperinsülinemi ve İnsülin Direnci
İlk kez 1980 yılında PKOS ile hiperinsülineminin ilişkili olduğunu tesbit edilmiştir.Daha sonra 1980’li yılların ortalarında ise PKOS’lu hastalara oral glukoz tolerans testi (OGTT) bir tarama testi olarak önerilmiştir (41). Günümüzde PKOS ile insülin direnci arasındaki ilişki artık daha iyi bilinmektedir.
PKOS endokrin ve metabolik bir hastalıktır. İD; endojen ve eksojen insüline normal biyolojik cevabın verilememesi diye tanımlanır. PKOS’lu vakaların %43-76’sında İD tespit edilmistir. Bu vakalarda Tip 2 DM gelişme ihtimalinin normal popülasyonuna nazaran daha fazla olduğu yapılan birçok çalışmada bildirilmektedir (42, 43, 44). Çoğu çalışma, obez ve nonobez PKOS’lu kadınların, aynı yaş ve kilolu normal kadınlara göre daha fazla İD ve hiperinsülinemi gösterdiğini ortaya koymuştur. Azalmış insülin sensitivitesinin yanısıra, PKOS’lu obez kadınlarda rölatif olarak insülin sekresyon defekti mevcuttur. PKOS’lu kadınların kilo vermesi insülin rezistansını önemli derecede
14
iyilestirmesine rağmen, beta hücre defektini düzeltememektedir. Bu durum beta hücre defektinin PKOS’da primer anormallik olabileceğini göstermektedir (21, 22).
PKOS’lu kadınlardaki çalışmalar, insülin reseptörlerinin normal olduğunu göstermiştir. İnsülin stimülasyonuna cevap olarak, adipozitlerde insülin bağlanması da normaldir. Glukoz tasıyıcı proteinlerin aktivasyonu ve glukozun hücre içine alınması gibi gelişen olaylarda azalma saptanması defektin postreseptör seviyede olduğunu göstermektedir (21,22,45). PKOS’lu obez kadınların yaklaşık yarısında insülin reseptörü otofosforilasyonunda defekt olduğu görülmüştür. Bu kadınlarda uyarılmamış insülin reseptöründe zaten önemli derecede fosforilasyon vardır.
Son yıllarda serin fosforilizasyonunun androjen yapımında anahtar rol oynayan P450c17alfa enzim kompleksinin çalışmasını düzenlediği saptanmış olup PKOS’lu hastalarda tek bir bozukluğun hem insülin direnci hem de hiperandrojenemiye neden olabileceği düşünülse de PKOS’lu vakaların yarısında tirozin otofosforilasyonunun normal olması bu kadınlarda insülin direncinin mekanizmasının multifaktoriyel olabileceğini düşündürmektedir (48). Hiperinsülineminin oranı ve hiperandrojenizm arasında anlamlı bir korelasyon bulunmaktadır. Hiperinsülineminin hiperandrojenemiye yol açışını açıklayan iki mekanizma daha mevcuttur.
1. Hepatik seks hormonu bağlayıcı globulin (SHBG) sentezinin inhibisyonu.
2. IGFBP-1 sentezinin inhibisyonu.
İnsülinin IGFBP-1’in intrafolliküler seviyesini azaltarak indirekt etki ile serbest IGF- 1’in intrafolliküler konsatrasyonunu arttırdığı ileri sürülmüstür. IGF-1 ovaryan intertsisyel hücrelerince LH’ın indüklediği androjen sentezinin potent stimulatörüdür. (49).
1.4.6. Hiperprolaktinemi
Prolaktin gen ekspresyonu ön hipofiz laktotrop hücrelerinde, desidualize endometriyumda ve myometriyumda meydana gelir. İnsanlarda ana fonksiyonu laktasyonu başlatmak ve devam ettirmektir. 1985’den bugüne, PKO’li hastalarda hiperprolaktinemi sıklığı %3,2 ile %12,5 arasında değişiklik göstermiştir. PKO olan ve
15
olmayan kadınlarda, intravenöz dopamin uygulanması ile her iki grupta da serum LH ve prolaktin seviyelerinde düşme görülür, bu da gösteriyor ki; PKOS’lu tüm olgularda anormal LH sekresyonu ile ilişkili hipotalamik dopamin varlığında sonuç hiperprolaktinemidir. Gerçekte, PKOS’lu tüm hastalarda LH puls sıklığı ve amplitüdünde artış görülür, fakat sadece birkaç hastada prolaktin artışı görülmektedir.
1.5 LABORATUVAR BULGULARI
Androjenler:
Laboratuar bulgularında özellikle androjen düzeylerinin tanıda önemi vardır. Normal bir kadında günde 0.2-0.3 mg Testosteron üretilir ki, bunun da %50’si Androstenedionun periferik dönüşümünden, geri kalanı eşit miktarlarda (% 25) over ve adrenalden salgılanır. DHEAS’ın neredeyse tamamı, DHEA’ın ise % 90’ı adrenal kaynaklıdır. Dolaşımdaki testosteronun % 80’i beta globulin olan SHBG, % 19’u albumine bağlı , % 1’i ise serbest durumdadır. Androjen etkisi bu serbest kısım ve bir miktarda albumine bağlı kısıma bağlıdır. DHEA, DHEAS ve Androstenedion ise belirgin sekilde proteine bağlı değildir ve rutin immunassay testler biyolojik aktif düzeylerini yansıtır. Testosteron için durum farklıdır, rutin testler bağlı olan ve olmayan total testosteron düzeyini ölçer. SHBG düzeyleri, artmış androjen ve hiperinsulinemi varlığında düşer. Östrojen ve tiroid hormonu ise SHBG düzeylerini arttırır. Hirsutizmi olan kadınlarda artmış testosteron ve androstenedionun kaynağının over olduğu gösterilmiştir.
Hiperandrojenemiyi değerlendiren en sensitif ölçümler serum serbest testosteron düzeyi ve serbest androjen indeksidir (SAi = total testosteron mol / L) / SHBG (nmol / L )x100). PKOS’lu kadınların yaklaşık % 60-80’ inde artmış androjen düzeyleri ölçülür. Genelde serbest testosteron düzeyleri yükselmiştir. Total testosteron ölçümünün katkısı azdır.Androstenedion ölçümü hiperandrojenemik olarak tanımlananların sayısını %10 kadar arttırır. DHEAS, PKOS’lu kadınların %25’inde normal değerlerin üzerinde ölçülür (13). DHEA ölçümünün tanı değeri kısıtlıdır. Androgen Excess Society 2006 raporunda (13) serbest testosteron dahil androjenlerin kan seviyelerinin
16
hiperandrojenemi tanısı için sadece yardımcı olduğunu, tanı için tek kriter olmadığını ve klinik değerlendirmenin yerini tutmadığını belirtmiştir. Total testosteron düzeylerinin 200 ng/dL nin üzerinde olması over ve adrenal tümör araştırılmasını, DHEAS düzeylerinin normalin iki katından yüksek olması adrenal tümör araştırılmasını gerektirir.
Progesteron:
Luteal fazın ortasında ölçülen progesteron düzeyleri ile ovulasyon objektif olarak gösterilebilir. Bazal foliküler faz 17-(OH)-P ölçümü ise PKOS’un geç başlangıçlı konjenital adrenal hiperplaziden ayırımı için gereklidir. Geç baslangıçlı konjenital adrenal hiperplazide 17-(OH)-P düzeyinin erken foliküler fazda < 3ng/ ml olması ile ekarte edilebilmektedir. Bu değerin üzerindeki olgularda ACTH uyarısı ile ölçülen 17(OH)Progesteron seviyesinin > 10 ng/ml olması 21-hidroksilaz eksikliğinin tanısını koydurur. Cushing Sendromunu düşündüren klinik bulguların varlığında, Deksametazon supresyon testi ve 24 saatlik idrarda serbest kortizol düzeyinin ölçülmesi tarama için kullanılabilir.
Prolaktin:
Prolaktin (PRL) ile ilgili bozukluklar ve tiroid hastalıkları da ayırıcı tanıda düsünülmesi gereken durumlardır. PKOS’ da %30 ‘a varan oranlarda hafif-orta düzeylerde PRL yüksekliği görülebilir.
Tiroid hastalıklarında menstürel düzensizlikler görülebilir ancak çoğu zaman hastalıkla ilişkili diğer semptom ve bulgular tanıya olanak sağlar.
AMH:
PKOS’lu hastalarda serum anti-müllerian hormon (AMH) seviyeleri, normal overleri olanlara göre 2-3 kat artmıştır.AMH seviyeleri PKOS özellikleriyle koreledir (50). AMH; TGF-b ailesinden bir glikoproteindir. Sadece gonadal dokudan üretilir. Erkekte sertoli hücrelerinden üretilir. Müllerien kanal regresyonunu sağlar.Kadınlarda sadece gelişmekte olan ovaryan granüloza hücre foliküllleri (preantral ve küçük antral)
17
tarafından üretilir. Bu büyüklükteki fonksiyone foliküllerin yansıması olarak kabul edilir. Ovaryan rezerv markerı olarak kullanılır.AMH’nın normal overdeki fonksiyonu inisiyal ve siklik recruitmentı engelleyerek over rezervinin korumak, FSH’ya folikül duyarlılığını azaltarak FSH tarafından aşırı folikül gelişimini baskılamaktır.Böylece folikülogenezde kritik rol oynar.
AMH insan overlerinde dişi fetüste 36. gestasyon haftasından menopoza kadar granüloza hücrelerinden üretilir. Primordial moleküllerden AMH salınımı yoktur.Sentez primer folikülde başlar. En fazla salınım granüloza hücrelerinden 4 mm’ye kadar olan preantral ve küçük antral foliküllerden olmaktadır. AMH konsantrasyonları artan folikül çapıyla giderek azalır. Büyük antral folikülde (>8 mm) AMH salınımı ölçülemeyecek düzeydedir. Atreziye uğrayan folikülde ve korpus luteumda AMH ekspresyonu izlenmez. AMH sadece ovaryan orijinlidir. Fetüste algılanamayan düzeydedir. Başlangıçta doğumdan sonra haftalar içinde hafif bir artış olur. Daha sonra seviyeleri artar. Geç pubertede pik seviyeye erişir. Reprodüktif yaşam boyunca progresif kademeli azalır. Menopozdan sonra tespit edilemeyecek seviyeye iner (51). Serum AMH konsantrasyonları menstruel siklus boyunca önemli oranda değişiklik göstermez. Seviyesi siklusun herhangi bir günü ölçülebilir (52). PKOS’taki AMH üretimindeki artışın sebebi bilinmemektedir. Androjen, insülin veya bilinmeyen bir faktör buna yol açabilmektedir. AMH ölçümünün PKOS tanısında kullanılmasının spesifitesi %92, sensitivitesi %67 bulunmuştur (53). AMH ile insülin direnci arasında direkt korelasyon olduğu gözlenmiştir (54).
1.6 PKOS VE UZUN DÖNEM ETKİLERİ
Kadın sağlığıyla ilişkili bu metabolik ve endokrin bozukluğun uzun dönem etkilerinin ortaya çıkması ve sağlığı tehdit edici boyutlara ulaşması nedeniyle PKOS’lu hastaların uzun süreli takipleri çok önem kazanmıstır.
1.6.1. Abdominal Obezite Ve Dislipidemi
PKOS’da ortaya çıkan obezitenin nedeni hala bilinmemekle beraber farklı serilerde %10 ile %75 arasında değişebilen oranlarda obezite varlığı bildirilmektedir.
18
Obez olan hastaların daha düşük LH, SHBG, DHEAS, dihidrotestosteron, IGF-1 ve yüksek dansiteli lipoprotein (HDL) düzeylerine, buna karşılık daha yüksek LDL (düşük dansiteli lipoprotein) düzeylerine sahip oldukları gösterilmiştir.(55)
PKOS’lu kadınların obeziteye vücut yağının abdominal depolanmasına ve insülin rezistansına eğilimi olduklarından, sendrom X olarak adlandırılan durumun diğer metabolik özelliklerinede sahip olabilecekleri öne sürülmektedir.
PKOS’lu kadınların karakteristik bir dislipidemiye sahip olup olmadıkları tartışmalı bir konu olmakla beraber, yapılan çalışmalarda genellikle bu grup kadınların düşük HDL kolesterol ve yüksek trigliserid düzeylerine sahip oldukları bildirilmektedir (56). Kardiyometabolik sendromda ortaya çıkan yüksek TG ve düşük HDL düzeyleri, insülinin kolesterol ester transfer proteini üzerindeki etkileri sonucu ortaya çıkmaktadır. Bu protein kolesterolün HDL’den VLDL’ye transferini ortaya çıkarmakta ve sonuçta Apolipoprotein A katabolizması gelişmektedir (58, 59).
1.6.2. Kemik Metabolizması
Hipotalamik orjinli amenorelerde osteopeni sık bir bulgudur. PKOS’lu kadınlarda normal yada supernormal iskelet mineralizasyonu ve androjen seviyeleri arasında pozitif bir ilişki olduğu gösterilmistir. PKOS’lu kadınlarda düsük öströdiol seviyelerine rağmen hiperandrojenemi ve ilgili metabolik prosesler kemik kütlesini korur. PKOS’lu kadınlarda kilo fazlalığı eğilimi vardır ve vücut ağırlığı kemik kütlesinin güçlü bir belirtecidir.
En yüksek kemik dansitesi PKOS ve hirsutizmi olan normal adet gören kadınlarda gözlenmistir. Yeterli östrojen varlığında androjenler kemik üzerine pozitif bir etki yaparlar. Östrojen seviyelerinin düsük olduğu bazı oligomenoreik ve amenoreik PKOS’lu kadınlar osteopeni riski altında olabilir. Hiperandrojenik kadınlarda görülen yüksek kemik dansitesi androjenlerin bir sonucudur demek için henüz erkendir.
19 1.6.3. Kanser Riskleri
Çalışmaların birçoğunun kontrollü çalışma olmaması ve sendromu tanımlamak için kullanılan tanı kriterlerinin farklılıklar içermesi nedeni ile şuana kadar PKOS ile kanser ilişkisini destekleyen güçlü kanıtlara rastlanmamıştır. Ancak mevcut veriler ışığında özellikle basta endometrial kanser olmak üzere PKOS ile jinekolojik kanserlerin ilişkisini göz ardı etmek mümkün değildir.
Obezite, uzun süreli anovulasyon nedeni ile karşılanmamış östrojen maruziyeti, nulliparite, infertilite endometrium kanseri riskini arttıran faktörlerden bazılarıdır. DM ve HT hastalarında endometrium kanseri daha fazla görülmektedir. Bu yüzden amenoresi olan hastalara en az üç ayda bir endometrial dökülmenin sağlanması önerilmiştir (62).
PKOS’lu kadınlarda artmış endometrium kanseri riskinden sorumlu olduğu düşünülen mekanizma uzamış anovulasyon ve takibinde progestron ile karşılanmayan, devam eden östrojen sekresyonudur. Karşılanmamıs östrojene maruziyet endometrial hücrelerde mitotik aktivitenin artmasına, DNA replikasyon hatalarının artmasına ve sonucunda malign fenotip ortaya çıkmasına neden olmaktadır (62).
PKOS’un bir özelliği olan LH hipersekresyonunun endometrium kanseri gelişiminde etkili olabileceği bildirilmiştir. Endometrium adenokarsinomlarında LH ve hCG reseptörleri aşırı eksprese edilirler (63).Konishi ve arkadaşlarının yaptığı çalışmada LH ve hCG reseptörlerinin aşırı ekspresyonunun genç anovulator kadınlarda gelisen endometrial hiperplazi ve kanser ile ilişkili olduğu sonucuna varmışlardır (64).
PKOS ile over kanserleri arasındaki doğrudan ilişkiyi ortaya koymaya yönelik çok az sayıda çalışma vardır. Over kanseri gelismis 31 kadın, yas ve menopozal durum olarak eşlestirilmiş 62 kontrol vakası ile karşılastırıldığında tanı öncesi androstenodion ve dehidroepiandrosteron seviyelerinin belirgin olarak yüksek saptanması androjenlerin ovaryan karsinogenezde rol oynadığını desteklemektedir (67). Obezite ve epitelyal over kanseri arasındaki ilişkiyi açıklamaya çalışan çalışmaların sonucu çelişkili olup bazı çalışmalarda pozitif bir korelasyon saptanmışken diğer bazı çalışmalarda saptanmamıştır.
20
1.6.4. Kardiyovasküler Hastalık Ve Metabolik Sendrom
PKOS, insulin direnci, obezite, aterojenik dislipidemi ve hipertansiyon ile karakterizedir. Metabolik sendrom, artmış kardiyovasküler hastalık (KVH) ve tip 2 DM riski ile ilişkilidir (69). Metabolik sendrom prevelansı, PKOS olan kadınlarda %45, yaş olarak eşleştirilmiş kontrol grubundaki kadınlarda ise %4 olarak bildirilmiştir (70). PKOS’lu kadınlarda artmış KVH sıklığı için kesin kanıtlar olmasa da, PKOS metabolik sendrom için çeşitli endokrin özellikleri paylaşır (71, 72). Ancak, Dahlgen ve arkadaşları (1992) PKOS olan kadınlardan oluşan küçük bir grupta, myokard infarktüsü için relatif riski 7.4 saptamışlardır (73). Başka bir 10 yıllık izlem çalışması, aşırı kilolu PKOS olan beyaz ırkta kadınlarda KVH için relatif riski 5,91 olarak göstermişlerdir (74).
Kadınlarda metabolik sendromun tanı kriterleri: Bel çevresi >88 cm
Trigliserid düzeyi > 150 mg/dl
HDL kolesterol < 50 mg/dl
Açlık glukoz düzeyi : 110-126 mg/dl
HT > 130/85 mmHg
Metabolik sendrom parametrelerine ek olarak, diğer bazı subklinik hastalık belirteçleri de PKOS ve KVH arasında bağlantının olduğunu gösterir. PKOS’lu kadınların sol ventrikül diyastolik disfonksiyonu için artmış sıklığa ve artmış internal ve eksternal karotid arter sertliğine sahip oldukları tespit edilmiştir (78). Ayrıca birçok çalışma ateroskleroz gelişiminde erken olay olarak tanımlanan endotel disfonksiyonun, etkilenmiş kadınlarda daha fazla olduğunu göstermiştir (79, 80).
PKOS ‘lu kadınlarda yapılan çalışmalar bu kadınlarda makrovasküler hastalık ve Tromboza daha fazla yatkınlık olduğu gösterilmiştir (81). Bu hastalarda yüksek Plazminojen aktivatör inhibitör tip 1 (PAI-1) düzeyleri bildirilmiştir (82)
21
PKOS’ da aterosklerozun ilk bulgularından olan endotel hasarın gelisiminde İD anahtar rol oynar. Bunun sonucu olarak PKOS’ lu kadınlar ileri yaşlarda hipertansiyon, artmış kardiyovasküler risklerle PKOS’ lu olmayan kadınlara göre daha sık karşı karşıyadırlar (83).
1.6.5. PKOS’da Kardiyovasküler risk ve hiperinsülinizmi değerlendirmek için biyolojik markerlar
a. Açlık hiperinsülinemisi
b. OGTT esnasında artmış insülinemi
c. Düsük glukoz/insülin oranı
d. Azalmıs serum HDL –kolesterol seviyesi ve lipid profili, artmış TG
e. Serum SHBG seviyesinde azalma
1.6.6. PKOS’ta oksidatif stres artışı
Artmış oksidatif stresin PKOS’lu kadınlarda kardiyovasküler hastalık riskini artırabileceği bildirilmiştir. Oksidatif stresin doku hasarına yol açma mekanizmalarından biri de lipid peroksidasyonudur.Lipid peroksidasyonunu yansıtan malondialdehid (MDA) hücrenin yapı ve fonksiyonunu bozabilir.
Serbest oksijen radikalleri (SOR) lipid peroksidasyonuna neden olur ve sonucunda biyolojik hasar meydana gelir. Bu olay serbest radikal reaksiyonlarından en iyi bilinen reaksiyondur ve hedefi membran fosfolipidlerinin yağ asit yan zinciridir. Reaksiyon sonucunda lipid hidroksiperoksitleri oluşur (84). Lipid hidroperoksitleri arasında başlıca pentan, aldehid ve etan bulunur. Bunlardan en iyi bilinen ve en toksik olanı aldehidlerdir. Üç yada daha fazla çift bağı olan yağ asitlerinin peroksidasyonu sonucunda MDA oluşur ve membran serbest amino gruplarında çapraz bağlanmalara neden olarak membran rijiditesini arttırır (85). Hemen tüm biyolojik membranlar peroksidasyona duyarlıdır. Membran doymamış yağ asitlerinin peroksidasyonu, bir
22
yandan çift katmanlı hücre membranının yapısal bütünlüğünü de bozar. Lipid yapı değiştiği için transmembran iyonik gradiyent de bozulur. Bu olaylar zincirini hücre membran düzeyindeki enzim ve reseptörlerin fonksiyon kayıpları izler (85). Membran lipidlerinin yanısıra başlıca LDL olmak üzere plazma lipoproteinleri de peroksidasyona uğrayabilir. Okside olan lipoproteinler hücre fonksiyon bozukluğunun gelişmesine aracılık edebildiği gibi, makrofajlar tarafından fagosite edilerek, aterom plağının gelişmesine zemin hazırlayabilir (86).
1.7 PKOS’UN TANISI 1.7.1. Görüntüleme Yöntemleri
PKO; ultrasonografi ile stroma dokusunun artması nedeniyle büyümüş overler ve inci kolye tarzında periferik yerleşimli 2-8 mm boyutlarında 10’un üzerinde follikül görümünü olarak tanımlanmıştır. Üreme çağındaki kadınlarda ultrasonografik olarak PKO görünümünün sıklığı ile ilgili bazı çalışmalarda bu oran %17-23 oranında bildirilmiştir. Bu kadınların %10’unda PKOS tanısı koyduracak diğer semptomlar vardır (7). PKO’da oluşan histolojik değişiklikler şunlardır (87):
● Yüzey alanı iki kat artmıştır. ● Over hacmi 2-8 kat artmıştır.
● Aynı sayıda primordial follikül vardır. Ancak büyümekte olan ve atreziye uğramış follikül sayısı normalin yaklaşık 2 katıdır.
● Kortikal stromada 1/3 kat, subkortikal stromada 5 kat artış vardır. ● Over hilus hücre hiperplazisi normalden 4 kat fazladır.
Multifolliküler overler PKO ile karıştırılmamalıdır. PKO, normal overler ve multifolliküler overlerden daha büyük olması, daha fazla follikül içermesi ve hipertrofik stroması ile ayrılmaktadır. Stromal hipertrofi ve hiperekojenite PKO ve multifolliküler overleri ayırmada en güvenilir ultrasonografik belirti olarak kabul edilmektedir (88).
23
Tanıda kullanılan ultrasonografik kriterler eksternal ve internal olmak üzere ikiye ayrılır:
Eksternal morfolojik bulgular: Ovarian alan ve volümün artması, yuvarlak indeks (ovarian genişlik/uzunluk) artışı, uterin genişlik/ovarian uzunluk oranının azalmasıdır.
İnternal morfolojik bulgular ise, çok sayıda periferal dağılımlı mikrokist (<10 mm), ovarian stromanın artmış ekojenitesi ve ovarian stromanın yüzeyinin artmasıdır (26).
Renkli Doppler ultrasonografisi, over stromasındaki vaskularizasyon ağının tespitini sağlamaktadır. Kan akımı, erken folliküler fazda PKOS’lu hastalarda (%88) normal hastalara (%50) göre daha sık olarak görüntülenir ve artmış gibi görünmektedir (90).
1.7.2. Hormon Analizleri
1. Testosteron: Kadınlarda adrenal bez ve overler tarafından eşit olarak üretilir. Bu iki yerdeki üretim dolaşımdaki testosteronun %50’sini oluşturur. Geriye kalan testosteron over ve adrenal bezden salgılanan androstenedionun periferde testosterona dönüşümü ile oluşur. Kadında normal testosteron konsantrasyonu 20 ila 75 ng/dL arasındadır. Testosteron düzeyleri ile hirsutizmin şiddeti arasında yüksek bir bağıntı yoktur. Çünkü hirsutizme neden olan testosteron değil onun daha güçlü bir metaboliti olan DHT’dir. Yüksek serbest testosteron düzeyleri (>80 ng/dL) anovulasyonlu ve hirsutizmli kadınlarda bulunur. Total testosteron düzeyinin >200 ng/dL olduğu olgularda tümör araştırması yapılması önerilmektedir (91).
2. Androstenedion: Adrenal bez ve overler tarafından eşit olarak üretilir. Testosterondan daha az potenttir. Ancak aşırı konsantrasyonlarda androjenlerin biyolojik etkinliğini gösterir.
3. Dehidroepiandrosteron: DHEA ve sülfat formunun hemen tamamı adrenal bez tarafından üretilir. DHEA hızla metabolize olur ve bu nedenle düzeyinin ölçülmesi tam olarak adrenal bez aktivitesini göstermez. DHEA-S ise bunun tersine daha uzun
24
yarılanma ömrüne sahiptir ve adrenal bez aktivitesini gösterir. DHEA’nın normal değerleri 38 ile 338 mg/dL arasındadır.
4.Luteinizan Hormon: PKOS’lu kadınlarda, sıklıkla serum LH düzeyleri yükselmiş, FSH düzeyleri baskılanmıştır. Böylece LH/FSH oranı artar. Geç başlayan konjenital adrenal hiperplazili kadınlar genellikle normal bir LH/FSH oranına sahiptir.
5.Prolaktin: PKOS’lu vakaların %10-30’unda prolaktin (PRL) yükselmiş olabilir (>30ng/mL).
6.Anti müllerian hormon: PKOS’lu hastalarda serum anti-müllerian hormon (AMH) seviyeleri, overleri normal olanlara göre 2-3 kat artmıştır.
1.8 PKOS’ UN TEDAVİSİ
PKOS’ lu hastalarda tedavi amaçları: androjen seviyelerini düşürmek, endometriumu korumak, normal vücut kilosuna erişmeyi sağlamak, uzun dönemde kardiyovasküler riskleri azaltmak, hirsutizm ve insülin direncini düzeltmek, ovulasyonu indüklemektir. Tedaviyi yönlendirmede, fertilite isteğine göre tedavi seçenekleri hastayla birlikte değerlendirilip karar verilmelidir. Bu hedeflere ulaşmak için öncelikle yaşam tarzı modifikasyonunu sağlamak önerilmektedir. Bu hastalarda bilinen en etkin tedavi kilo vermektir. Kilo kaybı ve düzelmiş endokrin profil ile ovulasyon ve sağlıklı bir gebelik ihtimali yükselecektir. Mevcut kilonun %10 kadarı verilmelidir. Kilo kaybı ile periferde androjenlerin östrojene dönüşme oranı azalır, SHBG düzeyleri artar. İnsülin düzeylerinde azalma olur (92).
PKOS tedavisinde aşağıdaki grup ilaçlar kullanılır:
1.8.1. Antiandrojenler
Spiranolakton: Aldesteron antagonisti, potasyum tutucu diüretik olup hirsutizm tedavisinde de kullanılır (94). Androjenlerin periferik androjen reseptörlerine bağlanmalarını bloke eder. En sık görülen yan etkileri: menstruel düzensizlik, hiperkalemi, geçici poliüri, bas dönmesi ve bulantıdır.
25
Siproteran asetat: Testosteron ve DHT’ un etkisini hücre içi reseptörlere bağlanarak bloke eden güçlü bir progesterondur. LH salınımını inhibe ederek, ovaryan testosteron sekresyonunu azaltır, androjenlerin klirensini arttırır, periferal düzeyde androjen etkisini antagonize eder. Akne ve hirsutizm tedavisinde sık kullanılır (94). Yan etkileri: hepatotoksisite, kilo artısı, ödem, kisilik değisiklikleri, açlık insülin ve lipid düzeylerinde hafif artıstır.
Flutamid: Esas olarak prostat hipertrofisi ve prostat kanserinde kullanılan saf antiandrojendir. Testosteron ve DHT’ nin reseptörlere bağlanmasını yarısmalı olarak inhibe eder. En önemli yan etkisi hepatotoksisitedir. Tedavi süresince karaciğer fonksiyon testleri yakın izlenmelidir. Ancak düsük dozlarda bu yan etkinin az olduğu ve hirsutizmde etkili olduğu gösterilmiştir (94).
Bikalutamid: Yapısı testosterona benzeyen antiandrojen bir ilaçtır. Testosteronun reseptör bağlanmasını bloke eder. İlk olarak prostat kanserinde kullanılmıstır. Literatürde yapılan tek çalışmada bikalutamid hirsutism tedavisinde etkili bulunmuştur (95).
Finasterid: Kıl folikülleri üzerine en güçlü androjen aktiviteye sahip olan DHT’ un testosterondan dönüsümünü sağlayan 5α-redüktaz enziminin inhibitörüdür. Hirsutizm ve PKOS’daetkili olduğunu gösteren çalışmalar vardır(96, 97). Yan etkileri; hafif gastointestinal bozukluklar, baş ağrısı, kuru cilt ve libidoda azalma yapmasıdır.
Ketokonazol: 400 mg/gün dozunda 6 hafta içinde hirsutizmde tedavi edici etkiye sahiptir. Adrenal ve gonadal steroidogenezisi bloke eder (26).
1.8.2. İnsülin duyarlılığını arttıran ilaçlar
PKOS’ nun insülin direnci ile ilişkili olması, Tip 2 DM ve kardiyovasküler hastalıklar açısından atmıs riske sahip olması önemli klinik bulgulardır. Bundan dolayı PKOS’ da İD’ nin önemi fark edildikten sonra insülin duyarlılığını arttıaran ilaçların kullanımı da giderek yaygınlaşmaktadır.
Bu amaçla kullanılan ilaçlar metformin ve tiazolidinedionlardır.
Metformin: En eski ve dünyada hala en çok kullanılan insülin hassasalastıcı, biguanidler sınıfından oral antidiyabetik ajandır. Direkt etkisi karaciğerde
26
glukoneogenezi azaltıp, glikojenolizisi artırarak glukoz üretimini azaltmak, kas ve yağ dokusunda glukoz alımını arttırmak, intestinal glukoz emilimini azaltmaktır(98). Hiperandrojenizm üzerine olan etkisini; karaciğer tarafından üretilen SHBG yapımını arttırıp, bunun sonucunda serbest testosteron düzeylerini azaltarak sağlar. PKOS’ da kullanım dozu 1000-2000 mg/gündür. En sık görülen yan etkiler; bulantı, kusma ishal, siskinlik gibi gastrointestinal sistem semptomlarıdır.
Tiazolidinedionlar (TZD): Glitazonlar olarak da adlandırılan bu grup, insülin hassaslastırıcı oral antidiyabetiklerdendir. Bir nükleer reseptör olan, peroksizom proliferatör aktive edici reseptör gamaya (PPAR-γ) bağlanan sentetik ligandlardır. TZD’ların PPAR-γ’ yı aktive etmesi sonucunda özellikle kas ve yağ dokusunda insülin duyarlılığı artar, yağ hücrelerinin diferansiyasyonu stimüle olur (98).Troglitazon bu grubun ilk ilacıdır ancak idiosenkrotik hepatotoksisite nedeniyle Mart 2000’ de piyasadan kaldırılmıstır. Troglitazon ile PKOS’ lu hastalarda serum insülin, LH ve androjen seviyelerinde düsme, ovulasyon oranlarında artıs tesbit edilmiştir (100).
1.8.3. Oral kontraseptifler
Polikistik over sendromunda uzun dönem kontrol için kullanılır. Hirsutizm tedavisinde halen en popüler tedavi aracıdırlar. Oral kontraseptifler dolaşımdaki LH ve FSH düzeyini baskılayarak overde androjen yapımını azaltırlar (106). Henüz tam olarak anlaşılamamış bir mekanizmayla adrenal androjen üretimini de azaltmaktadırlar. Oral kontraseptiflerdeki progesteronlar derideki 5 α redüktaz aktivitesini de inhibe eder.
1.8.4. GnRH agonistleri
Ovaryan androjen sentezi LH etkisi ile olduğundan GnRH agonistleri tedavisi ile hipofiz supresyonu hirsutizmin gerilemesini sağlar. PKOS’lularda 4 hafta süreyle günlük kısa etkili GnRH agonisti kullanan kadınlarda ovaryan steroidogeneziste belirgin baskılanma olur. Ovaryan androjen üretiminin baskılanması, hirsutizmde belirgin düzelmeye yol açar.
27 1.8.5. Cerrahi Tedavi
Cerrahi tedavide ya "wedge" rezeksiyon ya da "drilling" kullanılabilir. "Wedge" rezeksiyonda overin en kalın kısmından yarısını medulla dokusunun oluşturduğu over dokusu çıkarılır. "Drilling" ise over stromasında laser yada koter ile termal hasar oluşturulmasıdır.
Her iki işlem sonrasında normal menstrüel sikluslar, gebelik, hormon değerlerinde düzelme gibi olumlu sonuçlar elde edilebilmektedir (29,107). Laparoskopik ovaryan drilling işlemi ile 3-6 ay arasında gonadotropinler ile ovulasyon indüksiyonu yapılan hastalar karşılaştırıldığında sonuçları benzerdir (107).
1.8.6. İnfertilite Tedavisi
Polikistik over sendromlu hastalarda ovülasyon indüksiyonunda ilk seçenek klomifen sitrattır. Bu ajanla hastaların %80’inde ovülasyon, %40’ında gebelik sağlanır. Klomifen sitrata yanıtsız hastalarda ikinci basamak ekzojen gonadotropinler kullanılabilir.
1.9 OKSİTOSİN
Oksitosin adlı hormon; 1906 yılında Sir Hanry Dale tarafından bulunmuştur. Dale arka hipofiz ekstraktının gebe kedilerde uterus kontraksiyonu sağladığını göstermiştir. Yunancada hızlı doğum anlamına gelen ‘oksitosin’ adını vermiştir.
Oksitosin arka hipofizden salınan 9 aminoasitten oluşan peptid hormondur. Sistein- Tirozin- izolösin- glutamin- asparajin- sistein- prolin- lösin- glisin aminoasit dizilimine sahiptir. 1 internasyonal ünite (IU) oksitosin 2 mikrogram pür peptide eşdeğerdir. Oksitosinin atom ağırlı 1007 daltondur. 1 mol oksitosin 1007.19 gramdır. Buradan hesap edilirse yaklaşık olarak 1 Ü oksitosin, 2 nmol eşdeğeridir.
28
Oksitosin esas olarak hipotalamus supraoptik ve paraventriküler çekirdeklerinde, magnosellüer nörosekretuar hücrelerde yapılıp, arka hipofize, nörofizin aracılıklı aksonal transport ile taşınır. Ayrıca bu bölgeden çıkan aksonlar nukleus akkumbense projekte olurlar (108).
Oksitosinerjik nöronlar beyin ve beyin sapında geniş projeksiyona sahiptirler (109). Oksitosinin, beyin omurilik sıvında (BOS) ölçümlerinden diürnal ritmi olduğu bilinmektedir. Plazmada diürnal ritmi mevcut değildir (110). BOS içinde bulunan oksitosin limbik sistem, beyin ve medulla spinalis orjinlidir.
1.9.1. Oksitosin ve ön hipofiz bezi
Oksitosin erkeklerde doz bağımlı olarak ACTH salımını azaltır (111-112). Oksitosin; hipoglisemi, CRH, ADH gibi ACTH salımını uyaran faktörlerin etkisini bloke eder (113).
Oksitosinin, gonadotropin salınımı üzerine modüle edici etkileri vardır. Preovulatuar dönemde kadınlara oksitosin uygulanması LH pikinde artma oluşturur.
Bu bulgular oksitosinin fizyolojik ovulasyonda ve seksüel davranışta etkisini göstermektedir. (114,115) Bu dönemin dışında oksitosin uygulanmasının LH üzerine bilinen etkisi bulunmamaktadır (116,117). Oksitosin erkeklerde FSH salınmasını arttırmaktadır (118). Kadınlarda TRH ile indüklenen prolaktin salımını attırır. Erkeklerde böyle bir etki mevcut değildir (119).
1.9.2. Oksitosin ve genital sistem
Gebeliğin sonuna doğru uterusta oksitosin reseptörü artar. Oksitosin ile hipotalamik-pituiter-adrenal stres aksı arasında yakın bağlantı bulunmaktadır. CRH ve oksitosin, myometrial kontraksiyonu arttırırlar. Bunda PGF2-alfa sorumlu tutulmaktadır (120). Gebe olmayan kadınlarda uterusta oksitosin reseptörü vardır. Ancak oluşan kontraksiyon gebeliğe göre çok azdır (121).
Ovulasyon sırasında endometrium glandüler epitelinde oksitosin reseptör m-RNA’sı artar. Ayrıca geç luteal fazda ve menstrüel dönemde endometriumda oksitosin
29
reseptör dansitesi artar (122). Oksitosin bu nedenle menstrüel siklusun düzenlenmesinden sorumludur.
İnfertil kadınlarda endometrial oksitosin bağlanma bölgelerinin sayısı azalmış olarak bulunmuş, klomifen ile ovulasyon induksiyonu ile bu normale gelmiştir (123). Östrojen, myometriumda bulunan oksitosin reseptör sayısında artma oluşturur (124). Erbaş ve arkadaşları endometriozis modeli geliştirilen sıçanlarda oksitosin tedavisinin plazma ve periton yıkama sıvılarında VEGF, TNF, MCP-1 azaltıcı etki gösterdiğini ve bu yolla endometriozis odaklarında küçülme oluşturduğunu göstermişlerdir (125).
Erkek genital sistemde ejukulasyonsa görev yapan oksitosin, prostatik üretra, mesane boynunda ve duktus ejukulatoriusta etkilidir. Oksitosin erkek genital sistemdeki etkisini V1a reseptörü üzerinden yapar (126).
1.9.3. Oksitosin ve meme
Yenidoğan döneminde bebeğin anneyi emmesi oksitosin salımı için en kuvvetli uyarıcıdır.Arka hipofizden salınan oksitosin, meme duktusunda bulunan kontraktil özeliği olan myoepitel hücreleri uyararak sütün memeden dışarı çıkmasını sağlar. Laktasyon sırasında pulsatil karakterli salımı mevcuttur. Laktasyon döneminde meme ve uterus kasılma etkileri eşzamanlı oluşur. Oksitosin reseptörü Gq proteine bağlıdır. Bu yolla fosfalipaz C aracılıklı, IP3 artmına sebep olur. Bu yolla endoplazmik retikulumdan salınan kalsiyumu arttırır. Bu yolla düz kas hücresinde kontraksiyona sebep olur (120).
1.9.4. Oksitosin ve over
Over granüloza hücresinde h-CG ile stimule olan oksitosin sekresyonu mevcuttur. (127). Bunun yanında oksitosin granuloza hücresinde FSH bağmlı östrojen sekresyonunu baskılar.
Over ekstrahipotalamik oksitosin sekresyonu yapan bölgelerden biridir (128). Oksitosin hücre içi kalsiyumu arttırarak h-CG bağımlı progesteron salgısını stimüle eder (129).
30
Korpus luteumda da oksitosin bulunmaktadır. Oksitosin burada progesteron sekresyonunu inhibe etmektedir. Ayrıca oksitosin korpus luteumda aynı PGF2-alfa gibi luteolize sebep olur (130).
Yine sıçanlar üzerinde yapılan deneysel bir çalışmada sisplatinin neden olduğu godadotoksisite tedavisinde oksitosin kullanılmış ve sisplatin kaynaklı over hasarını azalttığı ve oksidatif hasarı önleyerek folikül rezervini arttıdığı gösterilmiştir (131).
Başka bir çalışmada oksitosinin over torsiyonu geliştirilen sıçanlarda detorsiyon sonrası iskemik reperfüzyon hasarı üzerindeki etkisini incelenmiştir. Oksitosin verilen grupta foliküler dejenerasyon, ödem, kanama, damar tıkanıklığı ve inflamatuar hücre infiltrasyonu gibi histopatolojik kriterler karşılaştırıldığında önemli ölçüde azalma olduğu tespit edilmiştir. Sonuç olarak, histopatolojik ve biyokimyasal testler ile doğrulanan bu sonuçlar, sıçan yumurtalıklarda iskemi ve iskemik reperfüzyon hasarında oksitosinin olası bir koruyucu rol oynadığını düşündürmektedir (132).
31
2. AMAÇ VE YÖNTEM:
Bütün bu verilerin ışığında oksitosinin antiinflamatuvar ve ovulasyon indükleyici özelliği düşünülerek PKOS’lu hastalarda kullanıldığında etkilerinin önemli olabilecegi düşünülmüş ve çalışmamız bu yönde düzenlenmiştir. PKOS’ta oksitosin tedavisinin etkileri ile ilgili literatürdeki ilk çalışma olma özelliğini taşıyan çalışmamız ileriki yıllarda bu alanda yapılacak çalışmalara ön ayak olma niteliği taşımaktadır.
Çalışmamızda PKOS geliştirilmiş sıçan modellerinde oksitosin tedavisinin AMH, IGF-1 ve oksidatif stres markerı olan MDA düzeyleri üzerine olan etkisileri ve ooferektomi materyallerin histolojik kesitlerinde foliküler yapı (antral folikül sayısı) değişiklikleri incelendi.
PKOS’lu hastalarda serum anti-müllerian hormon (AMH) seviyeleri, normal overleri olanlara göre 2-3 kat artmıştır.AMH seviyeleri PKOS özellikleriyle koreledir (50). AMH; TGF-b ailesinden bir glikoproteindir. Sadece gonadal dokudan üretilir. Erkekte sertoli hücrelerinden üretilir. Müllerien kanal regresyonunu sağlar.Kadınlarda sadece gelişmekte olan ovaryan granüloza hücre foliküllleri (preantral ve küçük antral) tarafından üretilir. Bu büyüklükteki fonksiyone foliküllerin yansıması olarak kabul edilir. Ovaryan rezerv markerı olarak kullanılır. AMH’nın normal overdeki fonksiyonu inisiyal ve siklik recruitmentı engelleyerek over rezervinin korumak, FSH’ya folikül duyarlılığını azaltarak FSH tarafından aşırı folikül gelişimini baskılamaktır.Böylece folikülogenezde kritik rol oynar. AMH konsantrasyonları artan folikül çapıyla giderek azalır. Büyük antral folikülde (>8 mm) AMH salınımı ölçülemeyecek düzeydedir. Atreziye uğrayan folikülde ve korpus luteumda AMH ekspresyonu izlenmez. AMH sadece ovaryan orijinlidir. Fetüste algılanamayan düzeydedir. Başlangıçta doğumdan sonra haftalar içinde hafif bir artış olur. Daha sonra seviyeleri artar. Geç pubertede pik seviyeye erişir. Reprodüktif yaşam boyunca progresif kademeli azalır. Menopozdan sonra tespit edilemeyecek seviyeye iner (51). Serum AMH konsantrasyonları menstruel siklus boyunca önemli oranda değişiklik göstermez. Seviyesi siklusun herhangi bir günü ölçülebilir (52). PKOS’taki AMH üretimindeki artışın sebebi bilinmemektedir. Androjen, insülin veya bilinmeyen bir faktör buna yol açabilmektedir. AMH ölçümünün
32
PKOS tanısında kullanılmasının spesifitesi %92, sensitivitesi %67 bulunmuştur (53). AMH ile insülin direnci arasında direkt korelasyon olduğu gözlenmiştir (54).
PKOS etyopatogenezinde primer olarak artmış İD ve hiperinsülineminin önemli bir yeri bulunmaktadır.İnsülin direnci; dolaşımda yeterli konsantrasyonda insülin bulunmasına rağmen yeterli biyolojik cevabın oluşamamasıdır.İD kısa vadede hiperandrojenizm ve anovulasyon yapmakla birlikte, uzun vadede diabetes mellitus ve kardiyovasküler komplikasyonlara neden olmaktadır.PKOS’lu vakaların %43-76’sında İD tespit edilmistir. Bu vakalarda Tip 2 DM gelişme ihtimalinin normal popülasyonuna nazaran daha fazla olduğu yapılan birçok çalışmada bildirilmektedir (42, 43, 44). Çoğu çalışma, obez ve nonobez PKOS’lu kadınların, aynı yaş ve kilolu normal kadınlara göre daha fazla İD ve hiperinsülinemi gösterdiğini ortaya koymuştur. İnsülin Growth Faktör sistemi (IGF) insülinle yakından iliskilidir ve ovaryen fonksiyonların regulasyonuna katkıda bulunur.Hiperinsülineminin oranı ve hiperandrojenizm arasında anlamlı bir korelasyon bulunmaktadır. Hiperinsülineminin hiperandrojenemiye yol açışını açıklayan iki mekanizma mevcuttur.
1. Hepatik seks hormonu bağlayıcı globulin (SHBG) sentezinin inhibisyonu.
2. IGFBP-1 sentezinin inhibisyonu.
Overlerde hem insülin hem de IGF-1 reseptörleri vardır İnsülinin IGFBP-1’in intrafolliküler seviyesini azaltarak indirekt etki ile serbest IGF- 1’in intrafolliküler konsatrasyonunu arttırdığı ileri sürülmüstür. IGF-1 ovaryan intertsisyel hücrelerince LH’ın indüklediği androjen sentezinin potent stimulatörüdür. (49). Hiperinsülinemi, LH aracılı androjen sentezinin güçlü uyarıcısı olan IGF-1 reseptörlerinde up regulasyon yapar ve karacigerde IGFBP-1 üretimini suprese ederek buna sekonder olarak IGF-1’in biyoyararlılıgını artırmak yoluyla hiperandrojenizme yol açabilir.Ek olarak insülin ACTH’ya adrenal steroidogenez cevabını potansiyelize edebilir ve hepatik SHBG’yi inhibe ederek androjenlerin biyoyararlılıklarını artırmak suretiyle hiperandrojenemiyi artırabilir.
Overler insülinin etkisine dirençli olmasına ragmen hiperinsülinemi halinde IGF-1 reseptörleri ile çapraz reaksiyon olusturur. IGF-1 reseptörlerinin uyarılması ile