Ç.Ü Fen ve Mühendislik Bilimleri Dergisi Yıl:2012 Cilt:28-3
- 37 -
TERMOALKALİFİLİK AMİLAZ VE SELÜLAZ ENZİM (MULTİENZİM) ÜRETİCİSİ BACILLUS sp. İZOLASYONU, ENZİMLERİN KARAKTERİZASYONU VE
BİYOTEKNOLOJİK UYGULANABİLİRLİĞİ*
İsolation of Thermophilic Amylase and Cellulase (Multienzymes) Producing Bacillus Sp. Strains, Enzyme Production,Characterization And İnvestigation of
Biotechnological Applications
Serkan HALİSKARANFİL Burhan ARIKAN Biyoloji Anabilim Dalı Biyoloji Anabilim Dalı ÖZET
Bu çalışmada, doğal ortamdan izole edilen Bacillus sp. SHK-7 suşundan termoalkalifilik amilaz ve selülaz (multienzim) enzimlerinin üretimi ve karakterizasyonu gerçekleştirilmiştir. Bu amaçla, optimum aktivite sıcaklığı, optimum pH, pH stabilitesi ve sıcaklık stabilitesi analizleri gerçekleştirilmiştir.
Amilaz enzimi optimum aktivitesini pH 8.0 ve 80°C’de göstermiştir. Enzim 30-100ºC arasında 60 dakikada aktivitesinin yaklaşık %93’ünü korumuştur. Amilaz enzimi 50ºC’de pH 8.0-13.0 aralığında 24 saat süreyle ortalama %84 stabil kalmıştır. Selülaz enzimi optimum aktivitesini 60°C ve pH 8.0’de göstermiştir. Enzim 30-100°C arasında 60 dakikada aktivitesinin yaklaşık %98 ini korumuştur. Selülaz enzimi 50°C’de pH 9.0-12.0 aralığında 24 saat süreyle ortalama %72 stabil kalmıştır.
Bu sonuçlara göre SHK-7 amilaz ve selülaz enzimleri termofil, alkalifil, termostabil ve alkali-stabil özellik göstermekte olup başta deterjan endüstrisi olmak üzere tekstil, gıda ve içecek endüstrilerinde kullanılabilir özelliktedir.
Anahtar Kelimeler: Bacilllus sp., multienzim, termoalkalifilik, selülaz, amilaz ABSTRACT
In this study, the production and characterization of thermoalkaliphilic amylase and cellulase enzymes (multi enzymes) from Bacillus sp. strain which is isolated from soil samples were carried out. For this purpose, optimum activity temperatures and pH values, temperature and pH stabilities analysis of enzyme was investigated.
Amylase enzyme showed its optimum activity at pH 8.0 and 80°C. The enzyme activity was retained around 93 % of the original activity within 60 minutes between 30-100ºC. Enzyme was also stable about %84 between pH 8.0-13.0 at 50oC for 24 hours. The maximum activity of the cellulase was at 60ºC and pH 8.0 The enzyme activity was retained around 98% of the original activity within 60
*
Ç.Ü Fen ve Mühendislik Bilimleri Dergisi Yıl:2012 Cilt:28-3
- 38 -
minutes between 30-100ºC. Enzyme was also stable well-nigh %72 between pH 9.0-12.0 at 50oC for 24 hours.
According to these results, SHK-7 amylase and cellulase enzymes are thermophile, alkaliphile, thermostable and alkali-stable. Owing to these characteristics, the cellulase and amylase enzymes obtained in this research can be used as additive in detergent, textile, food and drink industries.
Keywords: Bacillus sp., multienzyme, thermoalkaliphilic, celluase, amylase Giriş
Enzimler canlı sistemlerdeki tüm biyokimyasal reaksiyonların neredeyse tamamında görev yapan biyolojik katalizörlerdir. Enzimler kimyasal reaksiyonlarda değişikliğe uğramadan reaksiyon hızını arttıran maddelerdir. Enzimler olmaksızın çoğu reaksiyon biyolojik sistemlerde var olandan daha yüksek sıcaklık ve enerji düzeylerine ihtiyaç duyarlar. Enzimler besin üretimi, gen klonlama ve ileri tedavi tekniklerine kadar birçok alanda (özellikle mikrobiyal endüstri ve genetik) yaygın uygulama alanı bulmuşlardır (Lerner ve Lerner, 2003).
Endüstriyel enzimler dünya pazarında meyve suyu, tekstil, fırıncılık, süthane, biracılık, nişasta ve deterjan gibi farklı alanlarda kullanılmışlardır. Endüstriyel enzimlerin üretiminde kullanılan mikroorganizmaların çoğu ekstrasellüler özelliğe sahiptirler (Vroemen, 1983). Endüstriyel enzimlerin en büyük uygulama alanını deterjan endüstrisi oluşturmaktadır. Fırıncılık ve hayvan yemi endüstrileri son yıllarda hızlı büyüme göstermiştir (Kirk ve ark, 2002). Multienzimler iki veya daha fazla enzim içeren sistemler olarak tanımlanmışlardır (Zhang ve ark, 2004). Fotosentez güneş enerjisinin canlılar tarafından en verimli kullanıldığı yoldur. Fotosentez sonunda bitkiler tarafında yüksek miktarda enerji depolanır. Bu şekilde bitkisel materyal doğada en fazla bulunan yüksek enerjili bir geri dönüşüm kaynağı şekline gelmektedir (Rajoka ve Malik, 1997). Bitkilerdeki en önemli polisakkaritler selüloz ve nişastadır (Pallardy, 2008). Nişasta yüzlerce glikoz biriminin α-1,4 ve α-1,6 glikozidik bağlarıyla bağlanması ile oluşur (Aiyer, 2005). Amilazlar, biracılık ve damıtma, kağıt, fermantasyon, gıda, tekstil ve nişastanın şekerleştirme uygulamalarında (Kumar ve ark, 2010; Asgher ve ark, 2007) yaygın bir kullanım göstermekle birlikte, klinik ve analitik kimya gibi diğer bazı alanlarda da kullanılmaktadırlar.
Selüloz biyolojik parçalanmaya karşı doğal olarak dayanıklı olup sağlam ve çözünmez yapısıyla diğer polisakkaritlerden farklıdır (Yang ve ark, 2010). Yaklaşık 15000 glikoz biriminin β-1,4- glikozidik bağlar ile lineer bir şekilde bağlanması ile oluşur. Selüloz en az üç farklı enzimin sinerjistik çalışması ile glikoza hidrolize olabilir (Kıran ve ark, 2006). Selülazlar; selülozlardaki β-1,4 bağlarını hidroliz ederek son ürün olarak glukoz, sellobiyoz ve sello-oligosakkaritleri meydana getirirler.
Selülaz enzimleri sellobiyohidrolazlar, endo-1,4-glukanaz ve β-glukozidazlar olmak üzere üç farklı şekilde bulunurlar (Sukumaran ve ark, 2005). Endoglukanazlar selülozları rastgele parçalayarak oligosakkaritleri, sellobiyozları ve glukozları oluştururken, ekzoglukanazlar (sellobiyohidrolazlar) selülozdaki
β-1,4-Ç.Ü Fen ve Mühendislik Bilimleri Dergisi Yıl:2012 Cilt:28-3
- 39 -
D-glukozidik bağlarını hidrolizleyerek indirgenmemiş uçlardan sellobiyozların serbest kalmasını sağlarlar. β-glikozidazlar ise sellobiyozları glikoza hidrolize ederler (Haki ve Rakshit, 2003). Selülazlar yem, gıda, tekstil ve deterjan gibi diğer endüstriel alanlarda kullanılmaktadırlar. Fosil yakıt kaynaklarının azalmasıyla, yenilenebilir yeni alternatif yakıt ve enerji kaynaklarının bulunmasına yönelik ihtiyaçlar artmış ve selülazlar ile diğer enzimler birlikte kullanılarak lignoselülozik biyokütlenin hidrolizi gerçekleştirilmiştir (Singhania ve ark, 2010).
Bu çalışmada termoalkalifilik amilaz ve selülaz enzim (multienzim) üreticisi
Bacıllus sp. izolasyonu, enzimlerin karakterizasyonu ve biyoteknolojik
uygulanabilirliğinin araştırılması amaçlanmıştır. Materyal ve Metod
Topraktan Bacillus sp. Suşlarının İzolasyonu
Selülaz ve amilaz pozitif Bacillus sp. suşlarının izolasyonu için farklı bölgelerden alınan toprak örnekleri 1’er g tartılarak pH’sı 9.0 olan 50 mL’lik N1 sıvı besiyerine inoküle edilip, 24 saat 55ºC’de inkübe edilmiştir. Daha sonra 80ºC de 10 dakika ısı şoku gerçekleştirilmiştir (Arikan, 2008). Örnekler 24 saat 55ºC’de inkübasyona bırakılmıştır. İnkübasyon sonunda tek koloni elde etmek amacıyla seri sulandırma yapılarak pH’sı 9.0 olan N1 agar besiyerine yayma şeklinde ekim yapılıp 55ºC’de inkübasyona bırakılmıştır. Tek düşen kolonilerden morfolojik olarak
Bacillus görünümüne sahip olanlar M9-nişastalı ve CMC’li besiyerlerine ekilerek
enzim üretme yetenekleri araştırılmıştır. Çalışmada en iyi amilaz ve selülaz enzim üreticisi suş SHK-7 olarak isimlendirilmiş ve enzim üretimi için kullanılmıştır. Amilaz ve Selülaz Enzim Üretimi ve Kısmi Saflaştırma
Katı besiyerlerinde farklı pH ve sıcaklıklarda en iyi üremeyi ve enzim aktivitesini amilaz için pH 11.0 ve 50°C, selülaz enzimi için pH 9.0 ve 50°C’de gösteren SHK-7 suşu, amilaz üretimi için pH’sı 11.0’e ayarlanmış M9-nişastalı sıvı besiyerinde 72 saat, selülaz üretimi için pH’sı 9.0’a ayarlanmış CMC sıvı besiyerinde ise 24 saat 50°C ve 175 rpm’de çalkalayıcıda inkübe edilmiştir. Sıvı kültürler +4°C ve 7000 rpm’de 20 dakika santrifüj edilerek bakteriler ortamdan uzaklaştırılmıştır. Elde edilen süpernatantlara örnek hacimlerinin %70’i kadar soğuk etanol eklenerek -20°C’de bir gece bekletilmiştir. Karışımlar +4°C ve 10000 rpm’de 20 dakika santrifüj edilerek amilaz ve selülaz enzimleri ayrı ayrı çöktürülmüştür. Ayrı ayrı elde dilen selülaz ve amilaz enzimleri uygun hacimde 0.1M’lık sodyum fosfat tamponlarında sıvılaştırılmıştır (Kobayashi ve ark, 1992). Enzimlerin Optimum Aktivite Gösterdiği pH Değerinin Saptanması
Substrat içeren Na-Fosfat (pH 6.0-8.0), Glisin-NaOH (pH 8.5-10.5) ve Boraks-NaOH (pH 11.0-13.0) tamponları kullanılmıştır. 0.5 ml substrat ve 0.5 ml enzimden oluşan reaksiyon karışımları 50°C’de 60 dakika inkübe edilmiştir. İnkübasyon sonunda DNS yöntemi kullanılarak spektrofotometrede 550 nm dalga boyunda standart aktivite analizi yapılmış ve relatif enzim aktiviteleri belirlenmiştir. En yüksek absorbans değerinin elde edildiği pH değeri 100 kabul edilerek diğer pH
Ç.Ü Fen ve Mühendislik Bilimleri Dergisi Yıl:2012 Cilt:28-3
- 40 -
değerleri buna göre oranlanarak relatif enzim aktiviteleri saptanmıştır (Arikan, 2008).
Enzimlerin Aktivite Gösterdiği Optimum Sıcaklık Değerinin Saptanması Enzimlerin optimum aktivite gösterdikleri sıcaklık değerlerinin belirlenmesi için 30, 40, 50, 60, 70, 80, 90, 100ºC sıcaklıklarda enzimlerin optimum aktivite gösterdikleri pH değerlerinde hazırlanmış substratlar ile 60 dakika inkübe edilmişlerdir. İnkübasyon işleminden sonra standart aktivite analizi uygulanmıştır. En yüksek absorbans değerlerinin elde edildiği sıcaklık 100 olarak kabul edilmişlerdir. Diğer sıcaklık derecelerinden elde edilen absorbans değerleri optimum absorbans değerleriyle oranlanarak relatif enzim aktiviteleri bulunmuştur (Burhan ve ark, 2003).
Enzimlerin Sıcaklık Stabilitelerinin Saptanması
Selülaz ve amilaz enzimlerinin sıcaklık stabilitelerinin belirlenmesi için 30- 100ºC arasındaki farklı sıcaklıklarda enzimlere 60 dakika boyunca ön inkübasyon işlemi yapılmıştır. Ön inkübasyon işleminden sonra enzimlerden 0.5 mL ve optimum aktivitenin gerçekleştiği pH’da hazırlanmış substrat örneklerinden 0.5 mL karıştırılarak optimum aktivitenin görüldüğü sıcaklıkta 60 dakika inkübasyon gerçekleştirilmiştir. İnkübasyon sonunda standart aktivite tayini yapılmıştır. Kontrol testi için, ön işlemden geçmemiş enzim ve substrat kullanılarak standart aktivite analizi yapılmıştır. Kontrolden elde edilen sonuç 100 kabul edilmiş, farklı sıcaklıklardan elde edilen değerlerle kıyaslanarak relatif enzim aktivitesi belirlenmiştir (Burhan ve ark, 2003, Arikan, 2008).
Enzimlerin pH Stabilitelerinin Saptanması
Çöktürülmüş enzim örneğinden 2’şer mL alınarak eppendorf tüplerine konulmuş ve 10000 dev/dak 15 dakika santrifüj edilmiştir. Üst faz atılıp enzim çökeltisi üzerine 2 mL farklı pH’ larda (pH’sı 7.0-13.0 olan yeni hazırlanmış) hazırlanmış tampon çözeltileri eklenmiştir. Tampon ve enzim karışımı 50ºC’de 24 saat ön inkübasyona bırakılmıştır. İnkübasyon süresi sonunda standart aktivite tayini yapılmıştır. Kontrol testi için, ön işlemden geçmemiş enzim ve substratlar kullanılarak standart aktivite tayini yapılmıştır. Kontrolden elde edilen sonuç 100 kabul edilmiş, farklı pH’lardan elde edilen değerlerle kıyaslanarak relatif enzim aktivitesi belirlenmiştir (Burhan ve ark, 2003; Arikan, 2008).
Araştırma Bulguları ve Tartışma
Amilaz ve selülaz üreticisi toplam 264 suş izole edilmiş olup, bunlardan 38 suş selülaz ve amilaz üretme yeteneğine sahiptirler (%14.4). Bunlar arasında en iyi amilaz ve selülaz üreten SHK-7 suşu enzim üretimi ve karakterizasyonu için kullanılmıştır.
Ç.Ü Fen ve Mühendislik Bilimleri Dergisi Yıl:2012 Cilt:28-3
- 41 -
Amilaz Enziminin Optimum Aktivite Gösterdiği pH Değeri
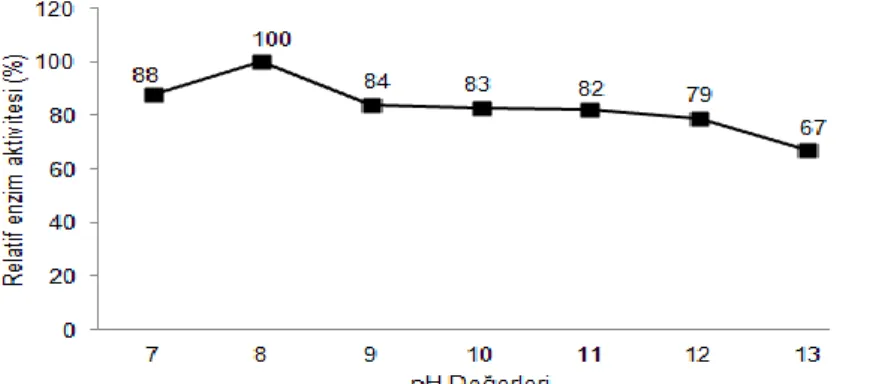
Bacillus sp. SHK-7 suşuna ait amilaz enzimi optimum aktiviteini pH 8.0’de
göstermiştir. Enzimin pH 9.0’da %84, pH 10.0’da %83, pH 11.0’de %82, pH 12.0’de %79, pH 13.0’te %67 gibi yüksek aktivite değerlerine sahip olduğu bulunmuştur (Şekil 1). Bano ve ark (2011), Bacillus subtilis KIBGE HAS‘dan izole ettikleri alfa amilazın pH 7.5’ta optimum aktivite gösterdiğini belirlemişlerdir. Shanmughapriya ve ark (2009), Halobacterium salinarum MMD047’den saflaştırdıkları amilaz enziminin aktivitesini pH 6.0-10.0 aralığında, ancak optimum aktivitesini ise pH 9.0’da gösterdiğini bildirmişlerdir.
Şekil 1. Bacillus sp. SHK-7 amilaz enziminin optimum aktivite gösterdiği pH değeri ve aralığı
Selülaz Enziminin Optimum Aktivite Gösterdiği pH Değeri
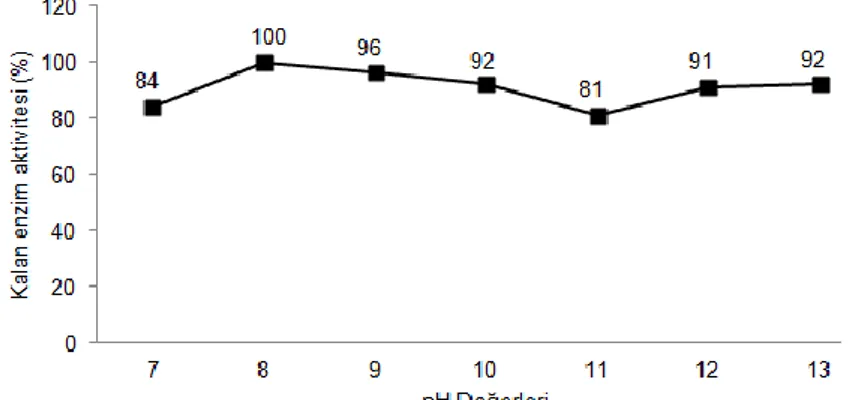
Selülaz enzimi optimum aktivitesini pH 8.0’de göstermiştir. Bu sonuç SHK-7 selülaz enziminin alkali özellikte olduğunu göstermektedir. Enzimin pH 8.0-13.0 aralığında ortalama %91 aktiviteye sahip olduğu görülmektedir. Huang ve Monk (2004), Caldibacillus cellulovorans’tan izole ettikleri selülaz enziminin optimum aktivitesini pH 6.5-7.0 arasında gösterdiğini saptamışlardır. Enzim pH 8.3’te ise %50 aktiviteye sahiptir. SHK-7 selülaz enziminin optimum aktivite gösterdiği pH değeri ve aralığına ait sonuçlar şekil-2 de gösterilmiştir.
Ç.Ü Fen ve Mühendislik Bilimleri Dergisi Yıl:2012 Cilt:28-3
- 42 -
Şekil 2. Bacillus sp. SHK-7 selülaz enziminin optimum aktivite gösterdiği pH değeri ve aralığı
Amilaz Enziminin Sıcaklık Stabilitesi
Bacillus sp. SHK-7 amilaz enziminin farklı sıcaklıklardaki 1 saatlik ön
inkübasyon işleminden sonra 30-100ºC arasında orijinal aktivitesini %93 oranında koruduğu belirlenmiştir. Elde edilen bu sonuçlar Bacillus sp. SHK-7 amilaz enziminin 30-100ºC arasında yüksek düzeyde termostabil olduğunu göstermektedir. Asgher ve ark (2007), izole ettikleri α-amilaz enzimini 1 saat 40-100ºC arasında ön inkübasyona bıraktıklarında enziminin 60-70ºC’de oldukça stabil olduğunu, 80-90ºC’de orijinal aktivitesini sırasıyla %12 ve %48 kaybettiğini, 100ºC’de ise yüksek düzeyde inhibe olduğunu bildirmişlerdir. Elde edilen sonuçlar şekil-3’te gösterilmiştir.
Şekil 3. Bacillus sp. SHK-7 amilaz enziminin termal stabilite sonuçları Selülaz Enzimin Sıcaklık Stabilitesi
Bacillus sp. SHK-7 selülaz enziminin aktivitesi 30-50ºC arasında artış göstermiştir (30ºC’de %101, 40ºC’de %105, 50ºC’de %104). Enzim orijinal aktivitesini 60-100ºC ortalama %95 korumaktadır. Kim ve ark (2005), izole ettikleri
Ç.Ü Fen ve Mühendislik Bilimleri Dergisi Yıl:2012 Cilt:28-3
- 43 -
selülaz enziminin 60ºC’de 1 saatlik ön inkübasyondan sonra enzimin yaklaşık %60 aktivitesini sürdürdüğünü bildirmişlerdir. Peng ve ark (2011), izole ettikleri selülaz enziminin 70ºC’de 1 saatlik ön inkübasyondan sonra %50’den fazla aktivitesinin korunduğunu bildirmişlerdir. Selülaz enziminin sıcaklık stabilitesinin belirlenmesi amacıyla yapılan analiz sonuçları şekil-4’te gösterilmiştir.
Şekil 4. Bacillus sp. SHK-7 selülaz enziminin termal stabilitesi sonuçları Amilaz Enziminin pH Stabilitesi
Bacillus sp. SHK-7 amilaz enzimi analizi yapılan pH 8.0-13.0 değerleri
arasında 24 saatlik ön inkübasyon sonunda enzim aktivitesi ortalama %84 korunmuştur. Enzim aktivitesi pH 7.0, 8.0. 9.0, 10.0, 11.0, 12.0 ve 13.0’te sırasıyla, %96, %99, %98, %71, %71, %70 olarak bulunmuştur. Asgher ve ark (2007), izole ettikleri α-amilaz enziminin 24 saat pH 10.0 ön inkübasyonundan sonra aktivitesinin %54’ünü kaybettiğini açıklamışlardır. pH stabilitesine ait sonuçlar şekil-5’te gösterilmiştir.
Ç.Ü Fen ve Mühendislik Bilimleri Dergisi Yıl:2012 Cilt:28-3
- 44 -
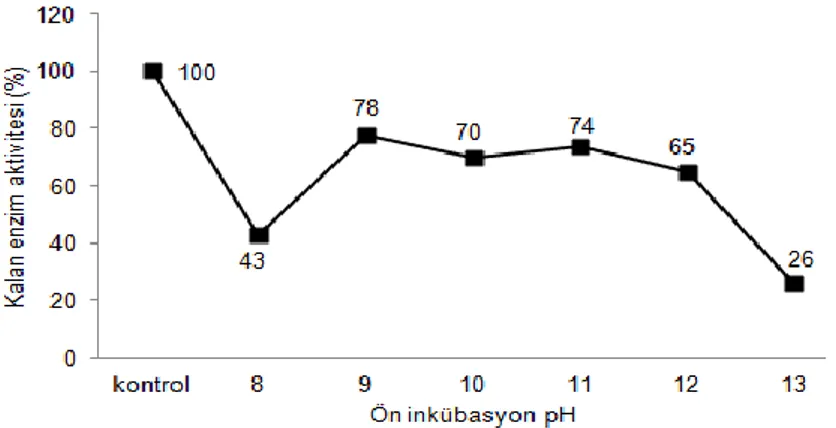
Selülaz Enziminin pH StabilitesiBacillus sp. SHK-7 selülaz enzimi pH 9.0-12.0 aralığındaki farklı tampon
sistemlerinde gerçekleştirilen ön işlemden sonra ortalama %72 kalan aktivite değeri elde edilmiştir. Enzim orijinal aktivitesini pH 8.0’de %43 korurken pH 9.0, 10.0, 11.0, 12.0 ve 13.0 te sırası ile %78, %70, %74, %65 ve % 26 korumuştur. Kim ve ark (2005), optimum aktivitesini pH 10.0’da gösteren selülaz enziminin aktivitesini 5ºC ve pH 12.0 de 24 saatlik ön inkübasyondan sonra yaklaşık %60 koruduğunu bildirmişlerdir. Elde edilen sonuçlar şekil-6 da gösterilmiştir.
Şekil 6. Bacillus sp. SHK-7 selülaz enziminin pH stabilitesine ait sonuçlar Sonuç ve Öneriler
Selülaz ve amilaz enzimleri optimum pH’larını 8.0’de göstermekte olup, her iki enzimde pH 7.0-13.0 aralığında oldukça aktiftir. Bacillus sp. SHK-7 suşundan izole edilen selülaz enzimi optimum aktivitesini 60ºC sıcaklıkta gösterirken, amilaz enzimi ise 80ºC’de göstermektedir. SHK-7 amilaz enzimi 30-100ºC arasında %91, selülaz enzimi ise 30-100ºC arasında %92 aktiviteye sahiptir. Selülaz enzimi sıcaklık stabilitesi deneylerinde 30-50ºC arasında indüklenerek ortalama %103 aktivite göstermiş, 30-100ºC arasında ise %98 aktivite elde edilmiştir. Bunakarşılık amilaz enzimi hiçbir sıcaklıkta indüklenmemiş, 30-100ºC aralığında ortalama %93 aktivite elde edilmiştir.
Amilaz ve selülaz enzim üreticisi Bacillus sp. SHK-7 suşundan izole edilen amilaz ve selülaz enzimlerinin pH 8.0-13.0 arasındaki ortalama stabiliteleri amilaz enzimi için %84, selülaz enzimi için 60’tır. Selülaz enzimi pH 8.0 ve pH 13.0’te %45’in altında aktivite gösterirken, amilaz enzimi ise pH 8.0 ve pH 13.0’te %70’in üzerinde stabilitesini korumaktadır.
Bu özellikleri dikkate alındığında, Bacillus sp. SHK-7 amilaz ve selülaz enzimlerinin gıda ve deterjan endüstrisinde kullanılma potansiyeli oldukça yüksektir. Deterjan formülasyonunda kullanılacak enzimlerde aranan özellikler alkali-stabil ve termostabil olmasıdır. Her iki enziminde termal stabilitelerinin yüksek olması ve alkali stabil olmaları bu enzimleri deterjan endüstrisi için uygun kılmaktadır.
Ç.Ü Fen ve Mühendislik Bilimleri Dergisi Yıl:2012 Cilt:28-3
- 45 -
Kaynaklar
AIYER, P. V., 2005. Amylases and their applications. African Journal of Biotechnology, 4(13):1525-1529.
ASGHER, M., ASAD, M. J., RAHMAN, S.U., and LEGGE, R.L., 2007. A thermostable a-amylase from a moderately thermophilic Bacillus subtilis strain for starch processing. Journal of Food Engineering, 79:950–955. ARIKAN, B., 2008. Highly Thermostable, Thermophilic, Alkaline, SDS and Chelator
Resistant Amylase from a Thermophilic Bacillus sp. Isolate A3-15. Bioresource Technology, 99:3071-3076.
BANO, S., QADER, S. A.U., AMAN, A., SYED, M. N., and AZHAR, A., 2011. Purification and characterization of novel α-amylase from Bacillus subtilis KIBGE HAS. AAPS PhamSci Thec, 12:255-261.
BURHAN, A., NISA, U., GOKHAN, C., OMER, C., ASHABIL, A., and OSMAN, G., 2003. Enzymatic properties of a novel thermostable, thermophilic, alkaline and chelator resistant amylase from an alkaliphilic Bacillus sp. Isolate ANT-6. Process Biochemistry, 38:1397-1403.
HAKI G.D., and RAKSHIT S.K., 2003. Developments in industrially important thermostable enzymes: a review. Bioresource Technology, 89:17–34. HUANG X. P., and MONK C., 2004. Purification and characterization of a cellulase
(CMCase) from a newly isolated thermophilic aerobic bacterium
Caldibacillus cellulovorans gen. nov., sp. nov. World Jaurnal of
Microbiology & Biotechnology, 20:85-92.
KIM, J. Y., HUR S. H., and HONG J. H., 2005. Purification and characterization of an alkaline cellulase from a newlyisolated alkalophilic Bacillus sp. HSH-810. Biotechnology Letters, 27:313–316.
KIRAN, Ö. E., ÇÖMELEKÇİOĞLU, U., ve DOSTBİL, N., 2006. Bazı mikrobiyal enzimler ve endüstrideki kullanım alanları. KSÜ. Fen ve Mühendislik Dergisi. 9(1):12-19.
KIRK, O., BORCHERT T. V., and FUGLSANG C. C., 2002. Industrial enzyme applications. Current opinion in biotechnology, 13:345-351.
KOBAYASHI, T., KANAI, H., HAYASHI, T., AKIBA, T., AKABOSHI, R., and HORIKOSHI, K., 1992. Haloalkaliphilic maltotriose-forming α-amylase from the archaebacterium Natronococcus sp. strain Ah-36. Journal of Bacteriology, 174(11):3439-3444
KUMAR G. S., CHANDRA M. S., MALLAİAH K. V., SREENİVASULU P., and CHOİ Y.L., 2010. Purification and characterization of highly thermostable α-amylase from thermophilic Alicyclobacillus acidocaldarius. Biotechnology and Bioprocess Engineering, 15:435-440.
LERNER, K. L., and LERNER B. W., 2002. World of microbiologhy and immunology. America, 1-359.
RAJOKA, M. I., and MALIK, K. A., 1997. Cellulase production by Cellulomonas
biazotea cultured in media containing different cellulosic substrates.
Ç.Ü Fen ve Mühendislik Bilimleri Dergisi Yıl:2012 Cilt:28-3
- 46 -
SHANMUGHAPRIYA, S., KIRAN, G. S., SELVIN, J., GANDHIMATHI, R., BASKAR, T. B., MANILAL, A., and SUJITH, S., 2009. Optimization, production, and partial characterization of an alkalophilic amylase produced by sponge associated marine bacterium Halobacterium
salinarum MMD047. Biotechnology and Bioprocess Engineering. 14:67-75.
SINGHANIA, R. R., SUKUMARAN, R. K., PATEL, A. K., LAROCCHE, and C., PANDEY, A., 2010. Advancement and comparative profiles in the production technologies using solid-state and submerged fermentation for microbial cellulases. Enzyme and Microbial Technology. 46:541-549. SUKUMARAN R. K., SINGHANIA R. R., and PANDEY A., 2005. Microbial
cellulases Production, applications and challenges. Journal of Scientific And Industrial Research, 64:832-844.
PALLARDY, S. G., 2008. Physiology of woody plants (Third Edition), Pages 199-255.
PENG, J., WANG W., JIANG Y., LIU M., ZHANG H., and SHAO W., 2011. Enhanced soluble expression of a thermostable cellulose from Colstridium
thermocellum in Escherichia coli. Curr Microbiol, 63:523-530.
VROEMEN A. J., 1983. Production of industrial enzymes. Antonie van leeuwenhoek, 49:90-91.
YANG, D., WENG, H., WANG, M., XU, W., LI, Y., and YANG, H., 2010. Cloning and expression of a novel thermostable cellulase from newly isolated
Bacillus subtilis strain I15. Mol Biol Rep. 37:1923-1929.
ZHANG C., XING X. H., and LIU M. S., 2004. Production of multienzymes consisting of alkaline amylase and cellulase by mixed alkalophilic culture and their potential use in the saccharification of sweet potato. Biochemical Engineering Journal 19: 181–187.