ENOİL-AÇİL TAŞIYICI PROTEİN (ACP) REDÜKTAZ
ENZİM İNHİBİTÖRLERİ ÜZERİNDE YAPILAN
DOKİNG ÇALIŞMALARI
DOCKING STUDIES ON ENOYL-ACYL CARRIER PROTEIN (ACP) REDUCTASE
ENZYME INHIBITORS
Uğur ŞENEL, Tuğba ERTAN-BOLELLİ*, Kayhan BOLELLİ, İlkay YILDIZ
Ankara Üniversitesi Eczacılık Fakültesi Farmasötik Kimya A.D. 06100 Tandoğan/ANKARA
ÖZET
Kombine ilaç kullanımıyla mikroorganizmalar ilaçlara direnç kazanmakta ve mevcut terapötikler, oluşan yeni dirençli suşların tedavisinde yetersiz kalmaktadır. Bu nedenle dirençli mikroorganizmalara karşı etkili olabilecek yeni etken maddelerin geliştirilmesine verilen önem gün geçtikçe artmaktadır. Mikroorganizmaların gelişimlerini sürdürebilmeleri için hücre duvarı sentezi gereklidir ve bu işlem için yağ asidi sentezi esansiyeldir. Bakteriyel yağ asidi sentezinde görev alan en önemli enzimlerden birisi enoil-ACP redüktazdır. Tüberküloz tedavisinde önemli bir yere sahip olan izoniazid, bu enzimi inhibe ederek etki göstermektedir. Mycobacterium tuberculosis hücre duvarı mikolik asit yönünden zengin bir yapıdadır ve geçirgenliği son derece azdır. Bu sayede konak hücrenin savunma mekanizmasına ve antibiyotiklere karşı dirençlidir. Enoil-ACP redüktaz enzimi inhibe edilip mikolik asit sentezi durdurularak M. tuberculosis’in gelişimini sürdürebilmesi için gerekli olan hücre duvarının sentezi engellenebilmektedir.
Bu çalışmada, enoil-ACP redüktaz enzimi ve bu enzime karşı etkili olan bileşikler incelenerek enzim üzerinde etkili olabilecek yeni moleküller tasarlanmış ve doking yöntemi kullanılarak enzim üzerindeki etkileri tahmin edilmiştir. Etkiden sorumlu olduğu bilinen Tyr158 ve NAD+ kofaktörü ile hidrojen bağı yapan ve bilinen inhibitörlere göre daha düşük CDocker enerjilerine sahip olan u05, u06 ve u07 kodlu bileşikler ileride yapılacak çalışmalar için aday bileşikler olarak belirlenmiştir. Bundan sonraki süreçte bu bileşiklerin sentezlenmesi ve enzim üzerindeki etkinliklerinin saptanması amaçlanmaktadır.
Anahtar kelimeler: CDocker; doking; enoil-ACP redüktaz; InhA; Mycobacterium tuberculosis
*
Sorumlu Yazar / Corresponding author: Tuğba ERTAN-BOLELLİ
e-mail: tbolelli@ankara.edu.tr
ABSTRACT
Depending on the use of multi-drug in therapy, microorganisms acquire resistance to drugs and existing therapeutics become insufficient. Fatty acid biosynthesis in microorganisms is essential for cell viability. Prokaryotic microorganism’s cells have different fatty acid synthesis mechanism than eukaryotic host cells. So this mechanism is a potential target for developing new antibiotic agents. Enoyl-ACP reductase enzyme is one of the important enzymes in bacterial fatty acid synthesis. Isoniazid shows the effect by inhibiting enoyl-ACP reductase enzyme. Mycolic acid is rich in cell wall of Mycobacterium tuberculosis and cell wall is highly impermeable. That makes microorganism more resistant to antibiotics and host cell defense mechanisms. By inhibiting this enzyme, mycolic acid synthesis, so cell wall synthesis can be stopped.
In this study, inhibitors of enoyl-ACP reductase enzyme were analyzed by molecular docking methods and new molecules were designed. Efficiency of these molecules has been predicted via molecular modeling studies. u05, u06 and u07 make hydrogen bonds with Tyr158 and NAD+ cofactor which are responsible from the activity and they have less CDocker energies than known inhibitors. These three diphenyl ether derivatives were selected as lead compounds for further studies. In future works, synthesizing and determining activity on this enzyme are intended.
Keywords: CDocker; docking; enoyl-ACP reductase; InhA; Mycobacterium tuberculosis
GİRİŞ
Klinikte kullanılan birçok antibiyotiğe bakteriyel direnç gelişimi dünya çapında sorun teşkil etmektedir. Mevcut terapötiklerin etkisiz kalması nedeniyle, özellikle metisiline dirençli
Staphylococcus aureus (MRSA), penisiline dirençli Streptococcus pneumoniae ve çoklu ilaca
dirençli tüberkülozun (MDR-TB) görülme sıklığı artmaktadır. Tüberküloz örneğinde; WHO verilerine göre dünya nüfusunun üçte biri Mycobacterium tuberculosis’in latent formu ile enfekte olmuştur. Yarım milyondan fazla insan ise MDR-TB ile enfekte olmuştur. Tedavi edilebilmesi ve enfekte olan insan sayısının azaltılabilmesi için yeni ilaçların geliştirilmesi gerekmektedir [1].
Patojen mikroorganizmalarda hücre duvarının canlılığını koruyabilmesi için yağ asidi biyosentezi zorunludur. Bu nedenle yağ asidi biyosentezi yolağında görev alan enzimler genetiğe dayalı yeni antibakteriyel ilaç geliştirilmesinde önem kazanmıştır. Yağ asidi biyosentezi, 2 farklı formu olan yağ asidi sentez sistemi (FAS) ile idare edilmektedir. FAS-I, özellikle ökaryotik organizmalarda görülmektedir ve yağ asidi sentezi zincir reaksiyonlarındaki tüm basamakları katalizleyen çok fonksiyonlu enzimler içermektedir. FAS-II ise çoğunlukla bakteri suşlarında ve bitkilerin plastitlerinde görülür. FAS-II sisteminde, yağ asidi sentez zincirindeki her reaksiyon kendine özgü yapıdaki proteinler ile başlatılır ver sürdürülür. FAS-I ve FAS-II sistemleri arasındaki bu yapısal farklılıklar sayesinde, ökaryötik konak hücreye toksik olmayan, prokaryötik yapıdaki patojen hücre üzerine etki eden kemoterapötikler geliştirilebilmektedir [1,2].
Membran lipit biyosentezinin ilk basamağı olan yağ asidi biyosentezi, bakterilerde her biri farklı genler tarafından kodlanan bir dizi küçük, çözünebilir protein tarafından katalizlenmektedir
[3]. NADH’a bağlı enoil-açil taşıyıcı protein redüktaz, yağ asidi sentez zincirinin son basamağında doyurulmamış yağ asitlerinin açil taşıyıcı proteine (ACP) bağlanmasında NADH’a bağlı stereospesifik redüksiyonu katalizleyen önemli bir enzimdir. Enoil-ACP redüktazın (ENR), bakterinin yaşamını sürdürebilmesi için gerekli olması ve ideal seçiciliği nedeniyle, çoklu ilaca dirençli suşlara karşı yeni antibakteriyel ilaçların geliştirilmesi için umut vadeden bir hedeftir [1].
Bilinen ilk ENR enzimi FabI’dır. Streptococcus pneumoniae, Bacillus subtilis ve Pseudomonas
aeruginosa’da triklosana karşı direnç gelişimi gözlenmiştir ve tek başına FabI’nın varlığı bu direnci
açıklamaya yetmemiştir. Bu direnç mekanizmalarının incelenmesiyle, yeni iki ENR enzimi, FabK ve FabL keşfedilmiştir [4,5]. Günümüzde 4 farklı ENR bulunduğu tespit edilmiştir (FabI, FabL, FabK ve FabV). Vibrio cholerae’de bulunan FabV, bu enzim sınıfının en son üyesidir [6].
M. tuberculosis’de bulunan FabI enzimi InhA olarak adlandırılmaktadır. InhA, geçirgenliği az
olan ve bu nedenle direnç mekanizmasında önemli rol oynayan mikolik asit tabakasının sentezinden sorumludur. İzoniazid M. tuberculosis’e karşı antitüberküloz ilaç olarak kullanılan bir ön ilaçtır. İzoniazid (INH)’in etkinlik gösterebilmesi için katalaz-peroksidaz (KatG) ile aktive edilmesi gerekmektedir [3,7]. Aktivasyon için ayrıca ortamda manganez iyonları, NADH ve oksijene ihtiyaç vardır. KatG ile önce hidrazin grubu kopar, daha sonra kalan izonikotinil kısmı NAD+ ile birleşerek
izonikotinil-NAD (IN-NAD) oluşur. IN-NAD kompleksi hücre duvarının oluşumunda gerekli olan mikolik asit sentezini inhibe eder [7-9].
İzoniazid dar spektruma sahip bir antibakteriyel ilaçtır. Tüberküloz enfeksiyonun tedavisinde ve profilaksisinde en yaygın kullanılan ve en eski ilaçtır [10]. İzoniazidin klinik kullanıma başlanmasından kısa bir süre sonra izoniazide karşı direnç gösteren M. tuberculosis suşları gözlemlenmiştir [3]. Bakterinin KatG geninde mutasyonların oluşmasıyla, izoniazidin etkisiz kalması, izoniazide dirençli M. tuberculosis şuşlarının oranındaki artıştan sorumludur [11]. Tüberkülozun dirençli suşlarına karşı etkili olabilecek yeni bileşiklerin geliştirilmesine ihtiyaç duyulmaktadır ve bakteri hücre duvarı sentezinde görevli olan ENR enzimi yeni ilaç etken maddesi geliştirmede potansiyel bir hedeftir.
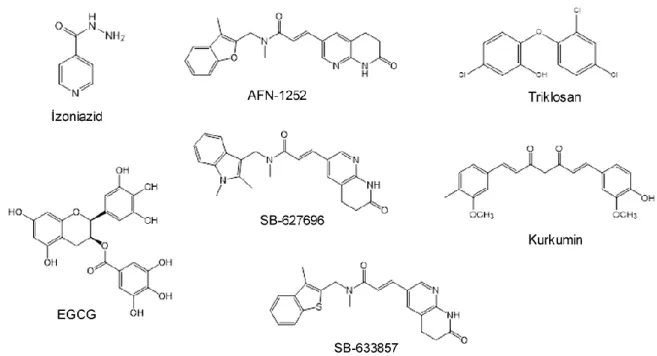
Şekil 1. FabI üzerinden etki gösterdikleri bilinen bazı inhibitörler
AFN-1252, FabI üzerinde in vivo ve in vitro etkinliği kanıtlanmış Faz II aşamasını geçmiş bir bileşiktir. Fareler üzerinde yapılan farmakokinetik çalışmalarda oral yolla aktif olduğu saptanmıştır [12].
Difenileterler grubunun en önemli üyesi triklosandır. Triklosan, yağ asidi biyosentezini enoil-ACP redüktaz (FabI) basamağında inhibe eden, klorlanmış bisfenol halka yapısında geniş spektrumlu bir antibiyotiktir [3,13]. Triklosan FabI proteinine spesifik bir ilaçtır. Yalnızca FabI’i içeren S. aureus triklosana son derece hassastır, ancak B. subtilis (FabI ve FabL) ve S. pneumoniae (FabK) triklosana dirençlidir. Triklosanın FabI enzimin inhibisyon derecesi üzerindeki etkisi zamana bağlı olarak artmaktadır. Triklosan yavaş-sıkı inhibisyon yapmaktadır. FabI - NAD+ - triklosan üçlü kompleksi stabildir ve kompleks 1-2 dakika
içinde oluşur. Triklosanın antimikrobiyal etkisinde bu üçlü kompleks oluşumu son derece önemlidir. Difenileterlerin etki gösterebilmesi için hidroksil grubu gereklidir. Oksijen köprüsü sülfür ile değiştirildiğinde etki büyük oranda kaybolmaktadır. Triklosan, güven aralığının geniş olmasından dolayı hastane düzeyinde kullanılan sabun ve plastiklerin yapısına katılmaktadır [11].
Gallokateşin gallat türevleri yağ asidi biyosentezinde görev alan FabI ve FabG gibi enzimler üzerinde inhibitör etki göstermektedir. En etkili formu epigallokateşin gallat (EGCG)’tır. Etki için galloil grubu gereklidir, fakat galloil grubu tek başına antimikrobiyal etki göstermemektedir. EGCG serbest enzime bağlanarak, enzim-substrat kompleksine bağlanarak veya her ikisine bağlarak etki göstermektedir. FabI enziminde NADPH ile yarışmalı olarak serbest enzime bağlanmaktadır [14].
Kurkumin, doğal kaynaklı FabI inhibitörüdür. Escherichia coli FabI’nın yarışmasız inhibitörüdür. Etki mekanizmaları triklosana benzemektedir. İki bileşiğin de fenol halkaları NAD’ın nikotinamid grubu ile reaksiyona girer [15].
GlaxoSmithCline firmasının geliştirdiği SB-627696 ve SB-633857 kodlu 2-naftiridinon türevi bileşikler triklosana direnç geliştirmiş S. aureus suşları üzerinde triklosanla karşılaştırıldığında başarılı sonuçlar vermektedir [4,16]. Bu bileşikler yalnızca FabI içeren bakteriler karşısında etkiliyken, yalnız FabK veya FabI ve FabK’yı birlikte bulunduran bakteri suşlarında etkisiz kalmaktadır. Bu durum yalnız FabI üzerine etkili olduklarını göstermektedir [17].
Bu çalışmada, enoil-ACP redüktaz enzimi üzerinden etki gösterdikleri bilinen inhibitörlerin enzim ile etkileşimlerini değerlendirmek üzere doking çalışmaları yapılmıştır. Bu çalışmalar için M.
tuberculosis Enoil-ACP Redüktaz enzimi (InhA) kullanılmıştır. Öncelikle bilinen inhibitörler
üzerinden doking çalışmaları yapılmış, daha sonra elde edilen veriler doğrultusunda bu enzim üzerinden etki gösterebilecek yeni ilaç etken maddelerinin tasarımları gerçekleştirilmiştir.
MATERYAL VE YÖNTEM
Doking Çalışmaları (CDocker Yöntemi)
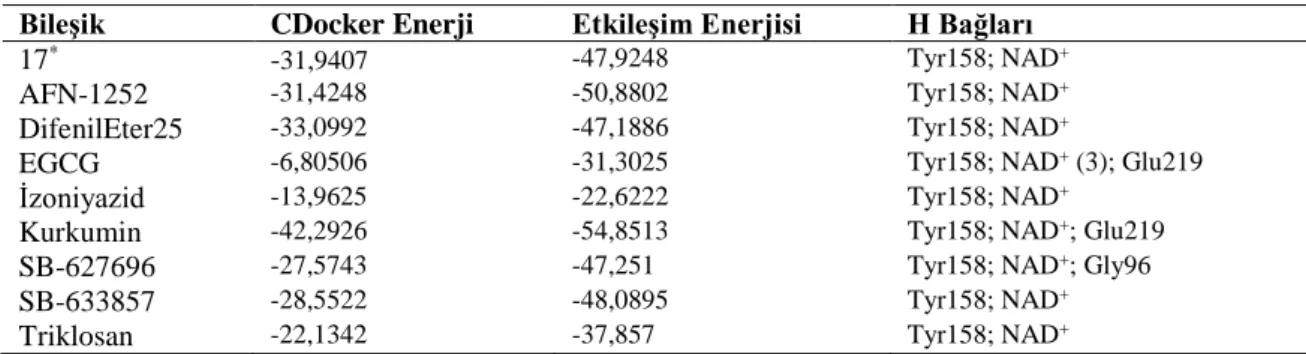
Bu çalışmada, mikobakteriyel enoil-ACP redüktaz enzimi üzerinde yapılan doking çalışması için ön çalışma olarak, Şekil 2’deki triklosan türevi (17 kodlu) molekül kullanılmıştır. Protein Veri Bankası (PDB)’ndan 3FNE kodlu kristal yapı alınmıştır [18]. Discovery Studio 3.5. programı ile CDocker yöntemi kullanılarak yapılan doking çalışması sonucuda bulunan en uygun konformasyon X-ray kristalografisiyle karşılaştırılmıştır [19,20]. Protein ile ligand arasındaki H bağları: Tyr158, NAD+ ve en uygun konformasyonla X ışınları kristalografisi arasındaki farklılığı ifade eden RMSD
değeri: 0,3120 bulunmuştur. Bu şekilde valide edilen CDocker yöntemi kullanılarak bilinen inhibitörler üzerinden doking işlemi gerçekleştirilmiştir.
Doking işleminden önce, InhA enzimi ve doking yapılacak moleküller üzerinden minimizasyon ve moleküler dinamik çalışmaları yapılmıştır. Öncelikle, Protein Veri Bankası (PDB)’ndan alınan 3FNE kodlu kristal yapı içerisinden 17 kodlu ligand ve tüm su molekülleri çıkarılmış ve enzime hidrojen atomları eklenmiştir. Adopted Basis Newton Raphson (ABNR) yöntemi kullanılarak enzim minimize edilmiştir. Doking yapılacak tüm moleküller Discovery Studio 3.5. [19] programı kullanılarak çizilip, ABNR metodu ile minimize edilmiş ve moleküler dinamik yöntemlerinden Heat and Cool (700K-200K) ile moleküllerin farklı konformasyonları elde edilmiş ve doking işlemi uygulanmıştır. Elde edilen sonuçlar Tablo 1’de gösterilmiştir.
Tablo 1. InhA enzimi üzerinde bilinen inhibitörlerle yapılan doking çalışması sonuçları
Bileşik CDocker Enerji Etkileşim Enerjisi H Bağları
17* -31,9407 -47,9248 Tyr158; NAD+
AFN-1252 -31,4248 -50,8802 Tyr158; NAD+
DifenilEter25 -33,0992 -47,1886 Tyr158; NAD+
EGCG -6,80506 -31,3025 Tyr158; NAD+ (3); Glu219
İzoniyazid -13,9625 -22,6222 Tyr158; NAD+
Kurkumin -42,2926 -54,8513 Tyr158; NAD+; Glu219
SB-627696 -27,5743 -47,251 Tyr158; NAD+; Gly96
SB-633857 -28,5522 -48,0895 Tyr158; NAD+
Triklosan -22,1342 -37,857 Tyr158; NAD+
*Literatürdeki 17 kodlu bileşik [18]
Şekil 3. Bilinen FabI inhibitörlerine ait doking sonuçları. [Bileşik 17 (a), triklosan (b), AFN-1252 (c) ve SB-627696 (d)]: hidrojen bağları yeşil noktalı çizgi, inhibitör bileşikler çubuk gösterimi şeklindedir.
SONUÇ VE TARTIŞMA
Bu çalışmada, enoil-ACP redüktaz enzimi üzerinden etki gösteren bileşikler incelenmiş ve bu bilinen inhibitörlerin enzim ile etkileşimlerini değerlendirmek üzere doking çalışmaları yapılmıştır. Bu çalışmalar için M. tuberculosis Enoil-ACP Redüktaz enzimi (InhA) kullanılmıştır. Öncelikle bilinen inhibitörler üzerinden doking çalışmaları yapılmış, daha sonra elde edilen veriler doğrultusunda bu enzim üzerinden etki gösterebilecek yeni ilaç etken maddelerinin tasarımları gerçekleştirilmiştir. CDocker yöntemi kullanılarak yapılan bu doking çalışmalarının sonuçları bilinen inhibitörler için Tablo 1; tasarımı gerçekleştirilen bileşikler için Tablo 2’de gösterilmiştir.
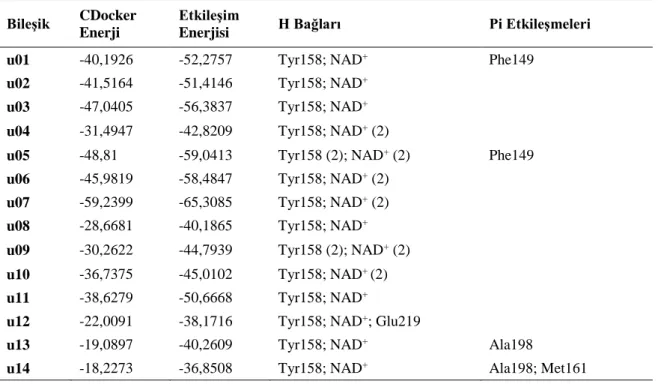
InhA enzimi üzerinden daha yüksek etki gösterebilecek yeni ilaç etken maddesi tasarlamak amacıyla bilinen inhibitörlerin kimyasal yapıları göz önünde bulundurularak birçok bileşik tasarlanmıştır. Doking sonuçları değerlendirilerek en iyi sonuç veren 14 bileşik Tablo 2’de verilmiştir. Tablo 2. InhA enzimine karşı tasarlanan bileşikler ve kimyasal yapıları
Bileşik Molekül Bileşik Molekül
u1 u8 u2 u9 u3 u10 u4 u11 u5 u12 u6 u13 u7 u14
Tablo 3. Tasarlanan bileşiklerin doking sonuçları
Bileşik CDocker Enerji
Etkileşim
Enerjisi H Bağları Pi Etkileşmeleri
u01 -40,1926 -52,2757 Tyr158; NAD+ Phe149
u02 -41,5164 -51,4146 Tyr158; NAD+
u03 -47,0405 -56,3837 Tyr158; NAD+
u04 -31,4947 -42,8209 Tyr158; NAD+ (2)
u05 -48,81 -59,0413 Tyr158 (2); NAD+ (2) Phe149
u06 -45,9819 -58,4847 Tyr158; NAD+ (2)
u07 -59,2399 -65,3085 Tyr158; NAD+ (2)
u08 -28,6681 -40,1865 Tyr158; NAD+
u09 -30,2622 -44,7939 Tyr158 (2); NAD+ (2)
u10 -36,7375 -45,0102 Tyr158; NAD+ (2)
u11 -38,6279 -50,6668 Tyr158; NAD+
u12 -22,0091 -38,1716 Tyr158; NAD+; Glu219
u13 -19,0897 -40,2609 Tyr158; NAD+ Ala198
u14 -18,2273 -36,8508 Tyr158; NAD+ Ala198; Met161
M. tuberculosis H37RV suşu üzerinde üzerinde Tablo 2’deki bileşiklerin etkinliklerini tahmin
edebilmek amacıyla yapılan doking çalışmaları (Tablo 3) incelendiğinde bileşiklerin tamamının, enoil-ACP redüktaz enzimi üzerinde etkili olduğu bilinen bileşiklerdeki gibi Tyr158 ve NAD+
kofaktörü ile hidrojen bağı yaptığı gözlenmiştir. Bunların yanında u12 kodlu bileşiğin aktif bölgede bulunan Glu219 ile H bağı yaptığı gözlenmiştir. u13 kodlu bileşik Ala198 ile pi bağı yaparken, u14 kodlu bileşik hem Ala198 hem de Met161 ile pi bağı yapmıştır. u01 ve u05 kodlu bileşikler Phe149 ile pi bağı yapmıştır. CDocker enerjisi en düşük olan bileşiklerden u07 ve u06 Tyr158 ile bir NAD+
kofaktörü ile 2 H bağı yapmaktadır. CDocker enerjisi düşük olan u05 Tyr158 ve NAD+ kofaktörü ile
ikişer H bağı yaparken, Phe149 ile pi etkileşmesinde bulunmaktadır. CDocker enerjileri düşük olan bileşikler (u03, u05, u06, u07) difenileter yapısına sahiptir. Ayrıca fenil kısımlarının orto konumunda hidroksil grubu, para konumunda ester yapısı taşımaktadırlar. Ester yapısının hidrofobik özelliği arttıkça CDocker enerjisi düşmektedir. Fenile bağlı hidroksillerden bir tanesi –NH2, -OCH3,
-Cl gibi gruplarla değiştirildiğinde CDocker enerjileri önemli oranda artmaktadır. u01, u05, u08 ve u14 kodlu bileşiklerin doking çalışmalarına ait resimler Şekil 3’te verilmiştir.
Şekil 4. Tasarlanan bileşiklere ait doking sonuçları. [u01 (a), u05 (b), u08 (c) ve u14 (d)]: hidrojen bağları yeşil noktalı çizgi, pi etkileşimleri turuncu çizgi, inhibitör bileşikler ise çubuk gösterim şeklindedir.
Bu sonuçlar değerlendirildiğinde, Tablo 2’deki tüm bileşiklerin InhA enzimi üzerinde etkili olabileceği düşünülmektedir. Tüm bileşiklerin aktivitede önemli rol oynadığı bilinen Tyr158 ve NAD+ kofaktörü ile H bağı yaptığı gözlenmiştir. Difenileter yapısı taşıyan u05, u06 ve u07 kodlu
bileşiklerin fenolik hidroksil gruplarının ve ester yapılarının CDocker enerji değerlerini düşürdüğü gözlenmiştir. En düşük CDocker enerjisine sahip olan ve etki için gerekli olan bağları yapan (Tyr158 ve NAD+ ile H bağları) bu bileşikler (u05, u06 ve u07) önder bileşik olarak değerlendirilebilecek
niteliktedir. Bundan sonra yapılacak çalışmalarda öncelikle bu bileşiklerin sentezi ve InhA enzimi üzerindeki etkilerinin tayin edilmesi amaçlanmaktadır.
KAYNAKLAR
1. Lu, X., Huang, K., You, Q. (2011). Enoyl acyl carrier protein reductase ınhibitors: a patent review. Expert Opinion on Therapeutic Patents, 21(7), 1007-1022.
2. Carballeria, N.M. (2008). New advances in fatty acids as antimalarial, antimycobacterial and antifungal agents. Progress in Lipid Research, 47(1), 50-61.
3. Heath, R.J., White, S.W., Rock C.O. (2001). Lipit biosynthesis as a target for antibacterial agents. Progress in Lipid Research, 40, 467-497.
4. Heath, R.J., Rock, O.R. (2004). Fattty acid biosynthesis as a target for novel antibacterials. Current Opinion in Investigational Drugs, 5(2),146-153.
5. Massengo-Tiass, R.P., Cronan, J.E. (2009). Diversity in enoyl-acyl carrier protein reductases. Cellular and Molecular Life Sciences, 66(9), 1507-1517.
6. Lu, H., Tonge, P.J. (2010). Mechanism and inhibition of the FabV enoyl-ACP reductase from
Burkholderia mallei. Biochemistry, 49(6), 1281-1289.
7. Wiseman, B., Carpena, X., Feliz, M., Donald, L.J., Pons, M., Fita, I., Loewe, P.C. (2010). Isonicotinic acid hydrazide conversion to isonicotinyl-NAD by catalase-peroxidases. The Journal of Biological Chemistry, 285(34), 26662- 26673.
8. Vavrikova, E., Mandikova, J., Trejtnar, F., Horvati, K., Bösze, S., Stolarikova, J., Vinsova, J. (2011). Cytotoxicity decreasing effect and antimycobacterial activity of chitosan conjugated with antituberculotic drugs. Carbohydrate Polymers, 83,1901-1907.
9. Deraeve, C., Dorobantu, I.O., Rebbah, F., Queemener, F., Constant, P., Quemard, A., Bernardes-Genisson, V., Bernadou, J., Pratviel, G. (2011). Chemical synthesis, biological evaluation and structure-activity relationship analysis of azaisoindolinones, a novel class of direct enoyl-ACP reductase inhibitors as potential antimycobacterial agents. Bioorganic & Medicinal Chemistry, 19, 6225-6232.
10. Blanchard, J.S. (1996). Molecular mechanisms of drug resistance in Mycobacterium
tuberculosis. Annual Review of Biochemistry, 65, 215-239.
11. Vanelli, T.A., Dykman, A., Montellano, P.R.O. (2002). The antituberculosis drug ethionamide ıs activated by a flavoprotein monooxygenase. The Journal of Biological Chemistry, 277(15), 12824–12829.
12. Kaplan, N., Albert, M., Awrey, D., Bardounıotıs, B.J., Clarke, T., Dorsey, M., Hafkin, B., Ramnauth, J., Romanov, V., Schmid, M.B., Thalakada, R., Yethon, J., Pauls, H.W. (2012). Mode of action, in vitro activity, and in vivo efficacy of AFN-1252, a selective antistaphylococcal FabI inhibitor. Antimicrobial Agents and Chemotherapy, 56(11), 5865-5874.
13. Heath, R.J., Rubin, R.R., Holland, D.B., Zhang, E., Snow, M.E., Rock, C.O. (1999). Mechanism of triclosan ınhibition of bacterial fatty acid synthesis. The Journal of Biological Chemistry, 274(10), 11110-11114.
14. Zhang, Y.M., Rock, C.O. (2004). Evaluation of epigallocatechin gallate and related plant polyphenols as ınhibitors of the FabG and FabI reductases of bacterial type II fatty-acid synthase. The Journal of Biological Chemistry, 279(30), 30994-31001.
15. Yao, J., Zhang, Q., Min, J., He, J., Yu, Z. (2010). Novel enoyl-ACP reductase (FabI) potential inhibitors of Escherichia coli from Chinese medicine monomers. Bioorganic and Medicinal Chemistry Letters, 20, 56-59.
16. Fan, F., Yan, K., Wallis, N.G., Reed, S., Moore, T.D., Rittenhouse, S.F., Dewolf-JR, W.E., Huang, J., Mcdevit, D., Miller, W.H., Seefeld, M.A., Newlander, K.A., Jakas, D.R., Head, M.S., Payne, D.J. (2002). Defining and combating the mechanisms of triclosan resistance in clinical isolates of
Staphylococcus aureus. Antimicrobial Agents and Chemotherapy, 46(11), 3343-3347.
17. Payne, D.J., Miller, W.H., Berry, V., Brosky, J., Burgess, W.J., Chen, E., Dewolf-JR, W.E., Fossberry, A.P., Greenwood, R., Head, M.S., Heerding, D.A., Janson, C.A., Jaworski, D.D., Keller, P.M., Manley, P.J., Moore, T.D., Newlander, K.A., Pearson, S., Polizzi, B.J., Qiu, X., Rittenhouse, S.F., Slater-Radosti, C., Salyer, K.L., Seefeld, M.A., Smyth, M.G., Takata, D.T., Uzinkas, I.N., Vaidya, K., Wallis, N.G., Winram, S.B., Yuan, C.C.K., Huffman, W.F. (2002). Discovery of a novel an potent class of FabI-directed antibacterial agents. Antimicrobial Agents and Chemotherapy, 46(10), 3118-3124.
18. Freundlich, J.S., Wang, F., Vilcheze, C., Gulten, G., Langley, R., Schiehser, G.A., Jacobus, D.P., Jacobs, J.R.W.R., Sacchettini J.C. (2009). Triclosan derivatives: Towards potent inhibitors of drug-sensitive and drug-resistant Mycobacterium tuberculosis. ChemMedChem, 4(2), 241-248. 19. Accelrys Inc. Discovery Studio 3.5
(http://accelrys.com/products/collaborative-science/biovia-discovery-studio/) (2012).
20. Wu, G., Robertson, D.H., Brooks, C.L., Vieth, M. (2003). Detailed analysis of grid-based molecular docking: a case study of CDOCKER – A CHARMm-Based MD docking alogrithm. Journal of Computational Chemistry, 24(13), 1549-1562.
![Şekil 4. Tasarlanan bileşiklere ait doking sonuçları. [u01 (a), u05 (b), u08 (c) ve u14 (d)]: hidrojen bağları yeşil noktalı çizgi, pi etkileşimleri turuncu çizgi, inhibitör bileşikler ise çubuk gösterim şeklindedir](https://thumb-eu.123doks.com/thumbv2/9libnet/3868266.38582/9.892.117.785.150.665/tasarlanan-bileşiklere-sonuçları-etkileşimleri-inhibitör-bileşikler-gösterim-şeklindedir.webp)